Innere Energie
Werbung

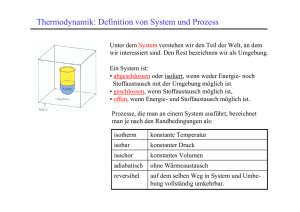
Thermodynamik Wärmelehre Prof. Dr. Sabine Prys Inhalte Grundbegriffe • Thermodynamische Systeme • Arbeit & Energie • Innere Energie • Enthalpie • Entropie • Freie Energie • Thermodynamisches Potenzial • Wärme • Kalorimetrie • Thermodynamik der Gase Ideale Gase • Reale Gase • Gasgesetze • Kreisprozesse • Thermodynamische Maschinen • Hauptsätze der Thermodynamik Chemische Thermodynamik 1 Warum wird der Kaffee kalt ? „ offenes “ System www.brownhen.com/ 2002_09_08_backhen.html Asymmetrie in der Natur • Heiße Körper kühlen sich ab, – Kalte Körper erhitzen sich nicht spontan • Eine Münze fällt aus der Hand auf den Boden, – ein Münze am Boden dagegen bleibt liegen Die Energieumwandlung hat eine Richtung 2 Historisches • Nicolas Leonard Sadi Carnot (1796 – 1832); Theorie der Wärme; Dampfmaschinen. • James Prescott Joule (1818 – 1889); Beziehung zwischen Wärme und Arbeit • William Thomson, Lord Kelvin (1824 – 1907); Grundlagen der klassischen Thermodynamik • Rudolf Gottlieb, Clausius (1822 – 1888); Zusammenhang zwischen Wärme und Materieteilchen • Ludwig Boltzmann (1844 – 1906); Grundlagen der statistischen Thermodynamik Wärmelehre Verbrennung = chemische Reaktion Wärmefreisetzung • Stationäre Verbrennungsprozesse – Strömungsmechanik laminarer Strömung – Chemische Thermodynamik, Wärme durch Stoffumwandlung • Instationäre Verbrennungsprozesse – Strömungsmechanik turbulenter Strömung – Zündung, Löschung Reaktionskinetik 3 1 Grundbegriffe Chemische Reaktion: Stoffgrößen Stoffmasse Molmasse Stoffmenge Stoffdichte Konzentration Molenbruch: A+B C+D Einheit [kg] [kg/mol] [mol] [kg/m3] [mol/m3] m M n=m/M = m/V c xi = ni/ni Energiegrößen [J] Kinetische Energie = 3/2 kT, Innere Energie U, Arbeit W, Enthalpie 1.1 Das SI-System SI = Système International d' Unités IS = International System of Units Basisgröße Basiseinheit Abkürzung Länge Masse Stromstärke Zeit Temperatur Lichtstärke Stoffmenge Ebener Winkel Raumwinkel Meter Kilogramm Ampere Sekunde Kelvin Candela Mol Radiant Steradiant m kg A s K cd mol rad sr http://www.chemie.fu-berlin.de/chemistry/general/si.html 4 1.1.1 Das Mol Die nach Amedeo Avogadro benannte Avogadrozahl oder Avogadro-Konstante ist definiert als die Anzahl der Atome in 12 g des Kohlenstoff-Isotops 12C. Sie ist gleich der Anzahl von Atomen oder Molekülen in einer Stoffmenge von einem Mol und hat nach der CODATA-Empfehlung aus dem Jahr 2002 den Zahlenwert Ein Mol eines Stoffes enthält stets NA = NL = 6,0221415(10) 1023 mol − 1 Molekulargewicht, angegeben in Gramm = 1 Mol 1 Mol He = 4,003 g 1 Mol N2 = 14,007 x 2 = 28,014 g 1 Mol NaCl = 22,990 + 35,453 = 58,443 g http://physics.nist.gov/cuu/Constants/index.html 1.1.1.1 Mol-Definition Loschmidtsche Zahl = 1/Avogadro-Konstante 12 g C 6,0221367 . 1023 C-Atome NL 12 6,022 1023 12u g 1 6,022 1023 g 1 C 1 u http://physics.nist.gov/cuu/Constants/index.html 5 1.1.2 Druck p F A Druck = Kraft / Fläche Pascal: Pa = N/m2 = kg/m s2 1bar = 100 000 Pa ~ atmosphärischer Luftdruck Normaldruck Standarddruck p = 1 atm = 101,325 kPa = 1013,25 mbar p = 1 atm = 101,325 kPa = 1013,25 mbar http://www.ebgymhollabrunn.ac.at/ipin/ph-druck.htm http://cicum92.cup.uni-muenchen.de/puchinger/glossar/glossarB2.html 1.1.3 Teilchenmodell 6 1.1.4 Teilchenbewegung Geordnete Teilchenbewegung – ungeordnete Teilchenbewegung http://www.ifdn.tu-bs.de/physikdidaktik/metzger/preview/index.html 1.1.5 Teilcheneigenschaften Atomare Masseneinheit u u = 1/12 mC-12 12C = 1,66 * 10-27 kg Relative Atommasse A Ar= mA/u mA = Atommasse Relative Molekülmasse M Mr = mM /u mM = Molekülmasse Atomdurchmesser d 10-10 bis 5 * 10-10 m 7 1.1.5.1 Dichte • Unter der Dichte eines Stoffes versteht man das Verhältnis von Masse m zu Volumen V m V 1.2 Thermodynamisches System System: (Materiemenge) makroskopische Eigenschaften von Umgebung abgegrenzt Zustandsvariable (p,T,V) Zustandsgleichungen Umgebung Systemgrenze System Umgebung: (Reservoir) Austausch mit System von extensiven Größen (hier Wärme) ohne Änderung entsprechender intensiver Größe (hier Temperatur) 8 1.2.1 Verschiedene Systeme offene Systeme Energieaustausch Materieaustausch geschlossene Systeme Umgebung Systemgrenze System Energieaustausch kein Materieaustausch abgeschlossene Systeme kein Energieaustausch kein Materieaustausch 1.2.2 Systemzustand Zustandsgrößen sind makroskopisch (beobachtbare) Größen Extensive Zustandsgrößen sind proportional zur Stoffmenge (z.B; Volumen, Energie) Intensive Zustandsgrößen sind unabhängig von der Stoffmenge (z.B. Druck, Temperatur) Thermodynamisches Gleichgewicht 9 1.2.3 Zustandsgrößen Makroskopisch messbare thermodynamische Grundgrößen : Druck p, Temperatur T, Volumen V intensiven Größen (Qualitätsgrößen) unabhängig von der Stoffmenge ! • Druck • Temperatur • chemisches Potential • elektrische Spannung extensive Größen (Quantitätsgrößen) proportional zur Stoffmenge ! • Masse, Teilchenzahl • Gewicht, Volumen • Ladung • Magnetisierung • Energie • Entropie 1.2.4 Differenzen und Summen • Differenz Differenzenquotient Steigung einer Geraden • Differential • Differentialquotient Steigung einer Kurventangenten Unendliche kleine Größe Summe Addition kleiner Größen • • • Endzustand – Ausgangszustand y y2 y1 E E2 E1 S x x2 x1 dE lim E y' E 0 dy dx n x1 x2 x3 ...xn xi i 1 • Integral • Addition unendlich kleiner Größen n n dx lim x i 1 x 0 i 1 i 10 1.3 Arbeit & Energie Arbeit = Kraft x Weg [N.m] = [J] • Wenn man an einem Körper Arbeit verrichtet, vergrößert man seinen Energiegehalt • Energie ist also "gespeicherte Arbeit" • Diese "gespeicherte Arbeit" kann wieder abgegeben werden 1.3.1 Teilchenbewegung Kohärente Teilchenbewegung Arbeit 1. 2. 3. Inkohärente Teilchenbewegung Energie Wärme lässt sich in Arbeit umwandeln Die vollständige Umwandlung gelingt nur am absoluten Nullpunkt Der absolute Nullpunkt ist aber nicht erreichbar 11 1.3.2 Energie Energie ist die Fähigkeit Arbeit zu verrichten Wärme abzugeben Strahlung auszusenden... Energieeinheiten: Wh, J, eV, cal, .... Energieformen: Bewegungsenergie (kinetische Energie) Lageenergie (potenzielle Energie) Wärmeenergie Strahlungsenergie Chemische Energie ... 1.3.3 Energieformen • • • • • • • Deformationsenergie Reibungsenergie Elektrische Energie Potenzielle Energie Kinetische Energie Chemische Energie .... 12 1.3.4 Potenzielle Energie Potenzielle Energie Energie der Lage Epot = m.g.h Epot = Energie der Lage m = Masse des gehobenen Körpers g = Erdbeschleunigung h= Höhe, in der sich der Körper befindet. Energie der Form EForm = ½ .k.x2 EForm = Energie der Form k = Federkonstante x = Längenänderung 1.3.5 Kinetische Energie Kinetische Energie Die kinetische Energie eines Teilchens ist so groß wie die an ihm verrichtete Beschleunigungsarbeit: Ekin = ½ m.v2 Ekin = kinetische Energie m = Masse v = Geschwindigkeit 13 1.3.6 Energieeinheiten Energie J kWh kcal t SKE 1J 1 2,778.10-7 2,388.10-4 34,12.10-12 3,6 .106 1 859,845 12,28.10-5 4186,8 1,163.10-3 1 14,29.10-8 7 . 106 1 Joule 1 kWh Kilowattstunde 1 kcal Kilokalorie 29,31.109 8,141 .103 1 t SKE Steinkohleneinheit 1 t SKE = Brennwert 1 t Steinkohle = 29,3 GJ 1.3.6.1 Definition eV und J • 1 Elektronenvolt ist die Energie, die ein Teilchen mit der Ladung 1 e (Elementarladung) erhält, wenn es die Spannung von 1 V durchläuft • Ein Joule ist gleich der Arbeit, die verrichtet wird, wenn eine Masse von 1 kg über eine Strecke von 1 m mit 1 m/(s²) beschleunigt wird 1 eV = 1,602 176 462(63) · 10-19 J http://de.wikipedia.org/wiki/Hauptseite 14 1.3.6.2 Definition cal • Eine Kalorie ist physikalisch definiert als Wärmemenge, die bei normalen atmosphärischen Druck von 1013 hPa benötigt wird, um 1 Gramm Wasser von 14,5 °C auf 15,5 °C zu erwärmen. Für den Betrag von 1 cal gibt es unterschiedliche Konventionen, beispielsweise die Wärmemenge von 4 °C auf 5 °C oder die durchschnittliche Wärmemenge pro Grad im Bereich von 0 °C bis 100 °C. 1 cal (international) 1 cal (thermochemisch) 1 cal (14.5–15.5°C) = 4,1868 J; 1 J = 0,23885 cal = 4,1840 J; 1 J = 0,23901 cal = 4,1858 J; 1 J = 0,23890 cal http://de.wikipedia.org/wiki/Hauptseite 1.3.6.3 Nährwert“kalorien“ Der Nährwert von Lebensmitteln beträgt in Kilokalorien: 1 Gramm Kohlenhydrate = 4,1 kcal 1 Gramm Eiweiß = 4,1 kcal 1 Gramm Fett = 9,3 kcal http://de.wikipedia.org/wiki/Hauptseite 15 1.3.7 Leistungseinheiten Leistung 1 kW kW kcal / s PS 1 0,238846 1,35962 4,1868 1 5,692 0,735499 0,1757 1 Kilowatt 1 kcal / s Kilokalorie je Sekunde 1 PS Pferdestärke Leistung = Arbeit / Zeit = Energie pro Zeit 1.4 Zustandsgröße „Innere Energie“ U • Als innere Energie U bezeichnet man den in einem Medium gebundenen Energiebetrag – kinetische Energie der Gasmoleküle – potenzielle Energie (Anziehungs-/Abstoßungskräfte) in Festkörpern – jede Energie, die nicht durch Bewegung des Körpers als Ganzes verändert werden kann • Die innere Energie ist eine Zustandsgröße 16 1.4.1 Innere Energie I Gesamtsystem Für Systeme aus einem Stoff "i" in einer Phase gilt: System 1 System 2 Ui ~ ni U: Innere Energie = extensive Zustandsgröße ! U = U1 + U2 n = n1 + n2 V = V1 + V2 U = U(T,V,n) 1.4.2 „Arbeit“ am System Gesamtsystem, abgeschlossen System 1 T1 Q Q U1Endzustand U1Anfangszustand U1 System 2 T2 mmmm Wel • Aufheizen • Energietransport infolge einer Temperaturdifferenz ! U 2 U Q W T2 > T1 W: elektrische Arbeit Wel Volumenarbeit p.V 17 1.4.3 Innere Energie 2 • Die Änderung der inneren Energie hängt nur von der relativen Lage des End- und Anfangszustandes ab, nicht aber vom Weg ! p U Q W dU 0 U2 U1 U1 Q+W V U2 1.4.4 Innere Energie 3 • Thermische Energie des Systems • Ungeordnete Teilchenbewegung – Wärmemenge Q = n.Cm.T – Volumenarbeit W = p.dV dU Q W N Ekin dU n CmV dT p dV – Bei konstantem Volumen gilt: dV 0 dU Q 28 117 31 117 18 1.5 Zustandsgröße Enthalpie H • Bei konstantem Druck entspricht die Enthalpie der Wärmemenge des Systems H U p V dH dU p dV V dp p const dU Q • Bei isobaren chemischen Reaktionen beschreibt die Reaktionsenthalpie den Wärmeumsatz der chemischen Reaktion chemische Thermodynamik 1.6 Zustandsgröße Entropie S „Unordnung“ Zustandsgröße (wegunabhängig) Verursacht durch Brownsche Molekularbewegung & Raumerfüllungsprinzip • Maß für die Irreversibilität eines Vorganges Maßeinheit [J/K] für ein adiabatisches, abgeschlossenes System, (ideales Gas) gilt: • Reversibler Prozess : S = const • Irreversibler Prozess: S > 0 2 S S 2 S1 1 Qrev T dS Qrev T dU p dV T • Wärmezufuhr pro Temperatur = reduzierte Wärme 19 1.6.1 Entropiezunahme Einstellung eines thermischen Gleichgewichts E1,S1 T>0 E1,S2, T = 0 Selbstlaufender (asymmetrischer) Prozess 1.6.3 BOLTZMANNs Gesetz Die Entropie eines Systems ist um so höher, je größer die Wahrscheinlichkeit ist, mit welcher der Zustand des Systems realisiert werden kann: S k ln w S k ln P k P W = Boltzmann Konstante = Wahrscheinlichkeit eines Systemzustandes = Wahrscheinlichkeitsverhältnis zweier Systemzustände 20 1.6.4 Übung: keine Entropieänderung Wie groß ist die adiabatische Änderung (Q = 0) der Entropie wenn eine Volumenarbeit in Form einer Expansion von 1 m3 zu 2 m3 für 1 Mol He bei 20 ° C , p = 1000 Pa geleistet werden soll ? S U pV Q pV pV Q T T T S 0 1000 10001 0 293,15 1.6.5 Übung: Entropiezunahme Wie groß ist die Änderung der Entropie bei konstantem Volumen, aber Zunahme der Wärmemenge für 1 Mol He bei 20 ° C , p = 1000 Pa und Q = 1000 J ? S U pV Q pV pV Q T T T S 1000 J 3,41 293,15 K 21 1.6.6 Energiequalität Brennstoffe der Menschheit Entstehungszeit des Energiespeichers Energiespeicher Lebenszeit eines Menschen Lebensalter der Menschheit Lebensalter des Universums Zeitspanne seit Big Bang Holz Kohle, Erdöl Uran* H Umwandlung von Wärme in Arbeit führt zur Vermehrung der Entropie * Uran ist die schwere Asche verloschener Sterne 1.7 Wärme • Resultiert aus kinetischer und potenzieller Energie der Teilchen Q T S [J ] • Übertragung von Wärme – mit einer Temperaturänderung verbunden – mit Phasenübergang verbunden – von einem System auf ein anderes erfolgt stets in Richtung zur geringeren Temperatur. • Wärme ist keine Zustandsgröße ! 22 1.7.1 Wärmemenge Q = Wärmeenergie Q Ekin 1 3 m v 2 kT 2 2 Gleichverteilungssatz: Die mittlere thermische Energie eines Gases der Temperatur T ist für jede Variable, die quadratisch in die Energie eingeht, 1/2 kT v 2 v x2 v y2 v z2 k 1.380658 10 23 J K Ekin = kinetische Energie, m = (Teilchen)masse v = (Teilchen)geschwindigkeit, k=Boltzmannkonstante 1.7.2 Temperatur [°C] Empirische Temperaturskala • Celsius – Eispunkt von Wasser T=0°C – Kochpunkt T=100°C – 100 Intervalle http://www.astro.uu.se/history/Celsius_eng.html 23 1.7.3 Temperatur [F] Empirische Temperaturskala • Fahrenheit – Temperatur einer Eis/Wasser/Salmiak Mischung Nullpunkt = -17.8 °C – Bluttemperatur eines gesunden Mannes Referenzpunkt = 36.6 °C – 98 Intervalle TF = 9/5TC + 32 [°F] bzw. TC = 5/9 (TF - 32) [°C] www.spacesciencegroup.org/ lessons/default.asp... 1.7.4 Temperatur [K] Thermodynamische Temperaturskala – Stoffunabhängig ! p.V ~ T – T[K] = 273.15 + T[°C] http://www.ptb.de/de/wegweiser/einheiten/si/kelvin.html http://www.chem.gla.ac.uk/~laurence/Chirality.htm 24 1.8 Freie Energie F Als freie Energie F bezeichnet man den Teil der Energie eines Systems, der in Arbeit umsetzbar ist. Nutzarbeit eines thermodynamischen Systems F U T S F U T S = freie Energie = innere Energie = Kelvin Temperatur = Entropie 1.9 Freie Enthalpie G • Die freie Enthalpie G (GIBBS Energie) ist ein Maß für die Triebkraft eines (chemischen) Prozesses G H T S U p V T S G U S V = freie Enthalpie = innere Energie = Entropie = Volumen H T p = Enthalpie = Kelvin Temperatur = Druck • Das (chemische) Gleichgewicht ist erreicht, wenn die freie Enthalpie ihr Minimum erreicht hat 25 1.9.1 Reaktionsrichtung Die freie Enthalpie gibt an, ob Reaktionen spontan ablaufen: endergonische Reaktion G > 0 Reaktion läuft nicht freiwillig ab Gleichgewicht G = 0 Reaktionsstillstand exergonische Reaktion G < 0 Reaktion läuft freiwillig ab 1.10 Spezifische Wärmekapazität "spezifische Wärme„ ist jene Energiemenge, die man benötigt, um 1 kg eines Stoffes um 1° C zu erwärmen Q C T c m T Q C c m T Einheit: C cm Wärmemenge Wärmekapazität [J / K] spezifische Wärmekapazität Masse des Körpers Temperaturdifferenz [c] = 1 J.kg-1.K-1 26 1.10.1 Wärmekapazitäten Stoffe Spezifische Wärmekapazitäten diverser Materialien: Stoff Gold Eisen Sauerstoff Benzol Wasser Wasserdampf Helium Luft c [J/Kkg] 130 450 730 1710 4190 1880 5200 (3230) 1005 (718) 1.10.2 Übung: im Saloon Ein Cowboy schießt mit seiner Pistole eine Bleikugel von 1 g mit einer Geschossgeschwindigkeit von 200 m/s in eine Holzwand. Die Kugel bleibt ohne Verformung dort stecken. Wie warm wird die Kugel, wenn die Wärmekapazität von Blei c = 0,13 J/(g.K) beträgt ? 1 m v 2 c m T 2 1 Q 1 200 2 20 J 2 20 Q T 153,85 K 154 K c m 0,13 1 Q Hängt die Temperaturerhöhung von der Masse der Bleikugel ab ? 27 1.10.3 Übung: Eistee oder TeeEis Zu 3 Liter Tee mit einer Temperatur von 20°C sollen 0,5 kg Eis mit einer Temperatur von -10°C hinzugegeben werden. Welche Temperatur stellt sich ein ? cH2O(l) = cw = 4,18 J/(g.K); cH2O(s) = cE = 2,1 J/(g.K) Schmelzenergie: Es = 333 kJ/kg Tee von 20°C auf 0°C abkühlen: Eis von -10°C auf 0°C erwärmen: Eis zum Schmelzen zu bringen: QE + EE = 177 kJ QT = mw . cw . T = 3000 . 4,18 . 20 = 250,8 kJ QE = mE . cE . T = 500 . 2,1 . 10 = 10,5 kJ EE = mE . EE = 0,5 . 333 = 166,5 kJ Energie für Abkühlung des Tees = Energie zum Aufwärmen + Schmelzen des Eises: 177 kJ + 0,5 .cw . (T-273,15) = 3000 . cw . (295,15 – T) T-273,15 = Tc 177 + 2,09 . Tc = 12,54 (20 - Tc) 250,08 - 177 = (12,54 + 2,09) Tc Tc = 73,8 / 14,63 = 5,04 °C kein Tee-Eis 1.10.4 Molare Wärmekapazität (spezifische Wärmekapazität) Q C T c m T C T Q C T c n M T n Cm T (molare Wärmekapazität) T Q C c Cm m M n Temperaturdifferenz Wärmemenge Wärmekapazität spezifische Wärmekapazität molare Wärmekapazität Masse des Körpers Atomgewicht Molzahl n m M 28 1.10.5 Wärmekapazität Gase 1 • cp • cV Spezifische Wärmekapazität bei konstantem Druck • Cmp Spezifische Wärmekapazität bei konstantem Volumen • CmV Molare Wärmekapazität bei konstantem Druck Adiabatenexponent : Molare Wärmekapazität bei konstantem Volumen c p Cm p cV CmV 1.10.6 Wärmekapazität Gase 2 U Q W Q p V n Cm T p V n Cm T n R T Expansion ! pV = nRT p const. (p 0) ( I ) U n Cm p T n R T V const. (V 0) ( II ) U n CmV T p V n CmV T I II : n Cm p T n R T n CmV T 0 n(Cm p CmV R ) T 0 Cm p CmV R 29 1.10.7 Wärmekapazität Gase 3 1. Für alle Gase gilt: cp Cmp > > cV CmV 2. Die Differenz der molaren Wärmekapazitäten ist für alle Gase gleich. 3. Der Adiabatenexponent ist von der Zahl der Atome im Molekül abhängig. c p Cm p cV CmV 1.10.8 Wärmekapazität Gase 4 Wärmekapazitäten einiger Gase bei Zimmertemperaturen Gas cp [kJ/kg.K] cV [kJ/kg.K] C m p [J/mol.K] C m V [J/mol.K] Cm p-Cm V He Ar O2 CO CO2 5,23 0,52 0,91 1,05 0,85 1,66 1,66 1,40 1,40 1,31 3,15 0,313 0,650 0,750 0,646 20,93 20,93 29,21 29,31 36,93 12,60 12,56 20,86 20,93 28,43 8,33 8,37 8,35 8,38 8,50 N2O 0,84 1,29 0,649 36,84 28,47 8,37 30 1.11 Kalorimetrie Messung von Wärmemengen mittels eines Kalorimeters Historisches Tierkalorimeter zur Messung der Körperwärme von Meerschweinchen von Antoine Lavoisier Bildquelle: Wikipedia 1.11.1 Chem – Lab Experimente Chem - Lab Gas - Lab 31 1.11.1.1 Verzeichnis der Experimente • Experimente zu physikalischen Eigenschaften – – – – – – (P1) Heizleistung einer Wärmeplatte (P2) Verdampfungsenergie von Wasser (P3) Spezifische Wärme von Quecksilber (P4) Verdampfungsenergie von Quecksilber (P5) Temperaturänderung beim Mischen von Flüssigkeiten (P6) Siedepunktbestimmung • Säure-Base-Eigenschaften • Kinetische Experimente • Experimente im Gaslabor – (G1) Gesetz von Boyle (Gaskompression) – (G2) Gesetz von Gay-Lussac (Gasentspannung) – (G3) Ideales Gasgesetz • Zusätzliche Experimente 1.11.2 Erwärmungskurve Becherglas mit 100 ml H2O Chem-Lab (Exp. P3) Erwaermungskurven 410 Temperatur [K] y = 1.01x + 292.42 370 330 290 250 0 10 20 30 40 50 60 70 80 90 Zeit [s] Erwaermung H2O Linear (Erwaermung H2O) 32 1.11.3 Heizleistung Wärmeplatte in Chem-Lab (Exp. P3) s Anfang 100 100 96 96 80 80 Ende T t1 qh c g m T1 t1 0 10 20 30 40 50 60 70 80 ml g ml g K s cg = w Becher + Wasser = Heizleistung = T [°C] (1) T [K] (1) 20 29 39 49 60 70 80 90 100 293.15 302.15 312.15 322.15 333.15 343.15 353.15 363.15 373.15 4.184 418.400 418.400 [J/g.K] [J/K] J/s 1.11.4 Wärmekapazität eines Becherglases Chem-Lab (Exp. P3) T 80 10 t2 c Becher c H 20 c H 20 c Becher t2 t1 cg = w Becher + Wasser = w Becher = 4.184 418.400 52.300 [J/g.K] [J/K] [J/K] w Becher = 59.771 [J/K] t1 c Becher t2 t c H 20 1 1 c Becher t2 c H 20 c Becher t1 t 1 2 33 1.11.5 Abkühlkurven Chem-Lab (Exp. P5) Temperatur [K] Abkuehlkurven 610 570 530 490 450 410 370 330 290 250 y = -6E-06x3 + 0.006x2 - 2.085x + 571.96 y = -2E-06x3 + 0.0018x2 - 0.6048x + 371.33 0 50 100 150 200 250 300 350 400 Zeit [s] Abkuehlkurve Hg Abkuehlkurve H2O Polynomisch (Abkuehlkurve Hg) Polynomisch (Abkuehlkurve H2O) 1.11.6.1 Abkühlung nach 150 s (Hg) Chem-Lab (Exp. P5) 20 ml Dichte exp. Dichte lit. 1 min erhitzen Hg g/ml g/ml T0 [°C] 20 T0 [K] 293.15 T30 [°C] (1) 125 THg T30 [°C] (2) 131 302.373 g 31.655 g 270.719 g 13.536 13.546 T60 [°C] (1) 299 242 194 154 124 101 83 69 59 50 43 38 34 T60 [K] (1) 572.15 515.15 467.15 427.15 397.15 374.15 356.15 342.15 332.15 323.15 316.15 311.15 307.15 Brutto Tara Netto T60 [°C] (2) 298 240 192 154 124 101 83 69 59 50 43 38 34 T60 [K] (2) 571.15 513.15 465.15 427.15 397.15 374.15 356.15 342.15 332.15 323.15 316.15 311.15 307.15 s 0 30 60 90 120 150 180 210 240 270 300 330 360 34 1.11.6.2 Abkühlung nach 150 s (H2O) Chem-Lab (Exp. P5) 20 ml H2O Dichte exp. Dichte lit. g/ml g/ml 1 min erhitzen 20.14 / 25.73 ml T0 [°C] 20 51.655 31.655 20.000 1 T0 [K] 293.15 T30 [°C] (1) 125 15.48 / 19.95 ml TH2O T30 [°C] (2) 131 T100 [°C] (1) 100 79 64 53 45 38 33 30 27 25 24 23 22 T100 [K] (1) 373.15 352.15 337.15 326.15 318.15 311.15 306.15 303.15 300.15 298.15 297.15 296.15 295.15 g g g T100 [°C] (2) 99 81 67 57 49 42 37 33 31 28 26 25 24 Brutto Tara Netto T100 [K] (2) 372.15 354.15 340.15 330.15 322.15 315.15 310.15 306.15 304.15 301.15 299.15 298.15 297.15 s 0 30 60 90 120 150 180 210 240 270 300 330 360 1.11.7 Wärmekapazität von Hg Chem-Lab (Exp. P5) c Hg c H 2O TH 20 THg CH2O = 4.184 [J/ml.K] = 1.574 [J/ml.K] Literaturwert 1.9 35 1.11.8 Fragen zu den Versuchen • Welche Fehlermöglichkeiten konnten Sie bei den Experimenten beobachten ? • Was versteht man unter reproduzierbaren Ergebnissen ? • Was ist der Vorteil der Abkühl- bzw. Erwärmungskurven gegenüber der Messung von Temperaturintervallen ? • Warum wurde bei Versuch 5 die Wärmeplatte zwischendurch nicht ausgeschaltet ? • Warum stimmt der Literaturwert und der Messwert bei der Wärmekapazität von Hg so schlecht überein ? • Was für Arten von Messfehlern kennen Sie ? 1.11.9 Messgenauigkeit • Systematischer Fehler • Statistischer Fehler – Normalverteilung der Messwerte – Mittelwert des Messwertes / Erwartungswert – Streuung der Messwerte / Varianz x F ( x) ( x µ) 2 1 dx exp 2 2 2 36 1.11.10 Die Normalverteilung der Messwerte 1.11.11 Messfehler = 0,674 = 0,954 = 0,997 37 2 Thermodynamik der Gase • Festkörperthermodynamik • Thermodynamik von Flüssigkeiten • Thermodynamik der Gase – ohne chemische Stoffumwandlung – Mit Kräften zwischen den Teilchen • Thermodynamik der idealen Gase – ohne chemische Stoffumwandlung – Ohne Kräften zwischen den Teilchen – Einatomige Gase 2.1 Gesetz von AVOGADRO 1 A.Avogadro (1776-1856): Gleiche Rauminhalte unterschiedlicher Gase enthalten bei gleichem Druck und gleicher Temperatur stets die gleiche Anzahl von Molekülen http://www.anisn.it/scienza/avogadro/avogadro.htm 38 2.2 Gesetz von AVOGADRO 2 Avogadro-Konstante: NA= 6,022 . 1023 Teilchen pro Mol n = Stoffmenge in mol N = Teilchenzahl n = N/NA [mol] Alle Gase haben unter Normalbedingungen dasselbe molare Volumen 3 Vmol = 22,415 m /kmol, allgemein gilt: Vmol = V/n 2.2.1 Teilchengemisch Luft Reine, trockene Luft Zusammensetzung in bodennahen Schichten Gas Volumen-% Stickstoff Sauerstoff Argon Kohlendioxid Wasserstoff Andere Edelgase 78,08 20,95 0,93 0,034 0,00005 0,00245 www.wetter.com 39 2.2.2 Eigenschaften von Luft • Gasgemisch • Hauptbestandteile N2 und O2 – zweiatomige Moleküle haben Bewegungsfreiheitsgrade • Schwingungen • Rotieren um verschiedene Achsen • Wechselwirkungen zwischen den Teilchen • Ursache der Verflüssigung 2.3 Gashaltige Systeme Gas gr. Chaos Gasteilchen • Teilchenbewegungen – Schwingungen – Rotationen – BROWN‘sche Bewegungen z.B. N2, O2 Ein Gas erfüllt stets den gesamten zur Verfügung stehenden Raum http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 40 2.4 BROWNsche Molekularbewegung • BROWN: „Reporter-Teilchen“ in einem Gas führen eine nach Geschwindigkeit und Richtung dauernd wechselnde Bewegung aus • PERRIN: Stöße der Gasmoleküle auf das Teilchen verursachen diese Bewegung, sie ist um so lebhafter je kleiner das Teilchen ist (Translationen, Rotationen) http://www.fh-muenchen.de/home/fb/fb06/labors/lab_didaktik/w-5-2.htm 2.5 Bewegungsfreiheitsgrade • Teilchenbewegungen – Translationen – Rotationen – Schwingungen • räumliches n-atomigen Molekül: – Translationsfreiheitsgrade – Rotationsfreiheitsgrade – Schwingungsfreiheitsgrade 3n 3 3 3n-6 • lineares n-atomiges Molekül – Translationsfreiheitsgrade – Rotationsfreiheitsgrade – Schwingungsfreiheitsgrade 3n-1 3 2 3n-5 Anregung von Freiheitsgraden = Energiespeicherung ! 41 2.6 Teilchenwechselwirkungen • Kurzer Abstand: abstoßende Kräfte • Großer Abstand: anziehende Kräfte • Einfaches Gasmodell: Ideale und reale Gase http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 2.7 Ideale Gase z.B. N2, H2, O2, He, Ne,.... V groß, p klein • • • • • • Das System besteht nur aus einer Teilchensorte Es ist ein System aus sehr, sehr vielen Teilchen Die Teilchen haben kein Eigenvolumen; es sind Punktmassen Zwischen den Teilchen wirken keine Molekularkräfte Die Teilchen befinden sich in ständiger Bewegung Alle Stöße der Teilchen sind elastisch 42 2.7.1 Gaskompression (p.V) Gesetz von Boyle / Mariotte • Geschlossenes System • Wärmebad • Druck wird erhöht • Temperatur wird abgeführt • Isotherme Kompression 1 V p V const. p~ http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 2.7.2 Gasexpansion (-p.V) Gesetz von Gay-Lussac • • Geschlossenes System Wärmebad • • • Wärmebad wird erhitzt System wird erwärmt Volumen nimmt zu • Isobare Erwärmung V ~T V const. T http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 43 2.7.3 Historisches • Mariotte, Edme (1620 - 1684) • Boyle, Robert (1627 – 1691) • Gay-Lussac, Joseph Louis (1778 - 1850) Robert Boyle http://library.mtroyal.ca/subguides/physics.htm http://www.patrimoine.polytechnique.fr/collectionhomme/GayLussac.html 2.7.4 Chem – Lab Experimente Chem - Lab Gas - Lab 44 2.7.4.1 Verzeichnis der Experimente • Experimente zu physikalischen Eigenschaften – – – – – – (P1) Heizleistung einer Wärmeplatte (P2) Verdampfungsenergie von Wasser (P3) Spezifische Wärme von Quecksilber (P4) Verdampfungsenergie von Quecksilber (P5) Temperaturänderung beim Mischen von Flüssigkeiten (P6) Siedepunktbestimmung • Säure-Base-Eigenschaften • Kinetische Experimente • Experimente im Gaslabor – (G1) Gesetz von Boyle (Gaskompression) – (G2) Gesetz von Gay-Lussac (Gasentspannung) – (G3) Ideales Gasgesetz • Zusätzliche Experimente 2.7.4.2 Das Gesetz von BOYLE MARIOTTE O2 T = 273.15 K p [atm] V [L] pV [L*atm] 1.50 3.0185 4.53 2.00 2.2639 4.53 2.50 1.8111 4.53 O2 T = 293.15 K p [atm] V [L] pV [L*atm] 1.50 3.2395 4.86 2.00 2.4297 4.86 2.50 1.9437 4.86 p~ 1 V p V const. 45 2.7.4.3 Das Gesetz von GAYLUSSAC VT Diagramm 2.3000 V [L] y = 5.1421E-03x + 1.0965E-04 1.8000 V ~T 1.3000 V const. T y = 3.8067E-03x + 9.3518E-05 0.8000 200.00 250.00 300.00 350.00 400.00 450.00 T [K] CO2 O2 Linear (CO2) Linear (O2) 2.7.5 Der absolute Nullpunkt T[K] = 273.15 + T[°C] Es muss einen absoluten Nullpunkt geben ! Kelvin-Skala: Basis für eine stofftunabhängige Temperaturdefinition http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 46 2.7.6 Konstante Mengen Gesetz von Gay-Lussac (isobar) Gesetz von Boyle / Mariotte (Isotherm) 1 V p V const. p~ V ~T V const. T p V const. T 2.7.7 „Ideales“ Gasgesetz p V n R T p V n R T = Gasdruck [Pa] = [N/m2] = Volumen [m3] = Molzahl = Gaskonstante = Kelvin Temperatur Allgemeine Gaskonstante: R = 8,3145 J.K-1.mol-1 47 2.7.8 Dimension pV p V n R T J N m 3 mol K 2 mol K m Nm J pV hat die Dimension einer Energie ! Volumenänderung eines Systems entspricht Volumenarbeit W W = pV 2.7.9 Die BOLTZMANN Konstante k 8.314510 R J 1.380658 1023 23 N A 6.0221367 10 K R = allgemeine Gaskonstante NA = Avogadro Konstante Die BOLTZMANN Konstante beschreibt die Energie, die einem Teilchen zugeführt werden muss, damit eine Temperaturerhöhung um 1 K bewirkt wird ! 48 2.7.10 pV Diagramm eines idealen Gases Isothermen 3.10E-05 p [Pa] 2.10E-05 1.10E-05 1.00E-06 1.00E-05 1.00E+09 2.00E+09 3.00E+09 4.00E+09 5.00E+09 V [m3] T= 500 273.16 100 K 2.7.11 Normbedingungen Normalbedingungen: Normaldruck p = 1 atm = 101,325 kPa = 1013,25 mbar Normaltemperatur T = 0°C = 273.15 K Standardbedingungen: Standarddruck p = 1 atm = 101,325 kPa = 1013,25 mbar Standardtemperatur T = 25°C = 298.15 K 49 2.7.12 Übung • Wie groß ist das Volumen von einem Mol eines idealen Gases ? – Unter Normbedingungen nRT p 1 8.314510 273.15 V 0.02241 m3 101325 pV nRT V – Unter Standardbedingungen V 1 8.314510 298.15 0.02447 m3 101325 2.8 Reale Gase Nahe dem Verflüssigungspunkt eines Gases sind Eigenvolumen und Teilchenwechselwirkungen nicht mehr zu vernachlässigen http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 50 2.8.1 „Reales“ Gasgesetz a n2 p 2 V n b n R T V a Binnendruck b Kovolumen a b [l2.kPa/mol2] [l/mol] 422.4200 136.7600 3.4440 141.8000 140.8100 24.7170 0.0370 0.0320 0.0240 0.0390 0.0390 0.0270 Gas Ammoniak Argon Helium Luft Stickstoff Wasserstoff 2.8.2 Isothermen CO2 Isothermen T > 304 K superkritischer Bereich T < 304 K Bereich der Verflüssigung http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 51 2.8.3 Der kritische Bereich http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 2.8.4 Zustandsgleichungen Ek = 3/2.k.T kinetische Energie • Ek mittlere kinetische Energie eines Gasmoleküls. k Boltzmannkonstante (k = 1,38.10-23 J.K-1) T absolute Temperatur kalorische Zustandsgleichung U = 3/2.N.k.T • U Innere Energie N Anzahl der Teilchen k Boltzmannkonstante T absolute Temperatur 52 2.8.5 „Arbeit“ am System 2 System: eingeschlossenes Gas p Druck auf Kolbenfläche K Kraft auf Umgebung dV > 0 (Expansion) • System gibt Arbeit an die Umgebung ab • Negatives Vorzeichen dV < 0 (Kompression) • Zufuhr von Arbeit an das System • Positives Vorzeichen 2.8.6 Volumenarbeit U Q W V 0 W p V Kompression V 0 W p V Expansion 53 2.8.7 Übung: Innere Energie 1. Wie groß ist die innere Energie bei einem Mol He bei 20°C ? U 3 N k T 2 N 6,023 10 23 k 1.380658 10 23 J K T 293,15 K 3 6,023 10 23 1,38110 23 293,15 3657,528 J 2 U 3,7 kJ U 2.8.8 Übung: Änderung der inneren Energie 1. Wie ist die Änderung der inneren Energie, wenn bei einem Mol He bei 20 ° C und Q = 0 das Volumen von einem m3 auf 2 m3 expandiert wird und wenn der Druck 1000 Pa ? Adiabatisch Expansion: Q = 0 W = -p.V U Q W 0 pV V 1 m 3 p 1000 Pa U 1 1000 Nm 1000 J 1 kJ 54 2.8.9 Poissonsche Gleichung Adiabatische Kompression p V const = O2 p [atm] 1.50 2.00 2.50 O2 p [atm] 1.50 2.00 2.50 V [l] 3.0185 2.2639 1.8111 1.4 V 4.70 3.14 2.30 Adiabatenexponent pV [l*atm] 8.28 8.28 8.28 T = 273.15 K V [l] pV [l*atm] 3.0185 4.53 2.2639 4.53 1.8111 4.53 2.8.10 Polytrope Zustandsänderungen • Reale Zustandsänderungen finden zwischen den Extremen Isotherme und Adiabate statt Diagramm • Polytropengleichung: – – – – Isotherme: Adiabate, reversibel: Isobare: Isochore: p V x const x=1 x= x=0 x= 55 2.8.11 Isotherme und Adiabate O2 Adiabaten und Isothermen 3.00 V [l] 2.50 2.00 1.50 pV = const pVκ = const 1.00 1.4000 1.9000 2.4000 2.9000 3.4000 3.9000 4.4000 4.9000 p [atm] Isotherme 273.15 K Adiabate 2.9 Kreisprozesse Maschine: zyklischer Arbeitsprozess, pV-Diagramm Ideale Maschine: keine Reibungsverluste http://www.physik.uni-muenchen.de/didaktik/U_materialien/leifiphysik/web_ph09/umwelt_technik/08dampfm/dampfmasch.htm 56 2.9.1 Isochorer Prozess eines idealen Gases p W12 0 Q12 CmV (T2 T1 ) Wärmezufuhr führt nur zur Erhöhung von U ! 2 1 V Langsame Zustandsänderung, Volumenänderungsarbeit ist Null ! 2.9.2 Isobare Volumenarbeit eines idealen Gases p W12 p (V2 V1 ) Q12 Cm p (T2 T1 ) Wärmezufuhr führt zur Expansionsarbeit und Erhöhung von U ! 1 2 W12 V Langsame Zustandsänderung, Volumenänderungsarbeit entspricht Fläche unter der Kurve ! 57 2.9.3 Isotherme Volumenarbeit eines idealen Gases p V2 W12 p (V ) dV n R T ln V1 V2 V1 dU Q W 0 W12 Q12 Gesammte Kompressionsarbeit kann in Wärme umgewandelt werden ! 2 1 W12 V Langsame Zustandsänderung, Volumenänderungsarbeit entspricht Fläche unter der Kurve ! 2.9.4 Adiabatische Volumenarbeit eines idealen Gases V2 W12 p (V ) dV p V1 W12 n CmV (T2 T1 ) p V const. 2 Volumenänderung bei reversibler adiabatischer Kompression führt nur zur Erhöhung von U ! 1 W12 Reversible Änderung, d.h. keine Reibung V Sehr schnelle Zustandsänderung, Volumenänderungsarbeit entspricht Fläche unter der Kurve ! 58 2.9.5 Der Carnot‘sche Kreisprozess 4 reversible Schritte Isotherme Kompression von A B Adiabatische Kompression von B C Isotherme Expansion von C D Adiabatische Expansion von D A C p Q1 Gewinnung von Arbeit ! W = Q1 - Q2 D B Prinzip der Wärmekraftmaschine ! Umgekehrtes Prinzip der Kältemaschine ! A Q2 V 2.9.6 Nutzarbeit Abgegebene Volumenänderungsarbeit = Gesamtfläche p 1 Nutzarbeit 2 Zugeführte Volumenänderungsarbeit V Rechtsläufiger Prozess • Zustandsänderungen werden im pV-Diagramm im Uhrzeigersinn durchlaufen • Das System gibt mehr Arbeit ab, als zugeführt wurde • Die je Zyklus abgegebene Nutzarbeit stammt aus der Differenz von zu- und abgeführter Wärme Rechtsläufiger Prozess W W p dV dU 0 dQ dW 0 Linksläufiger Prozess • Zustandsänderungen werden im pV-Diagramm gegen Uhrzeigersinn durchlaufen 59 2.9.7 Rechts- und linksläufige Prozesse Rechtsläufig Linksläufig • Kraftmaschinen • Arbeitsmaschinen • • Wärmeaufnahme bei hohen T Wärmeabgabe bei tiefen T • • Wärmeaufnahme bei tiefen T Wärmeabgabe bei hohen T • Differenz von Zu- und Abwärme = mechanische Nutzarbeit • Differenz von Ab- und Zuwärme = zugeführte mechanische Arbeit • Wirkungsgrad: • • Verbrennungsmotor Wärmekraftmaschine th W Qzu . Q Q • Leistungszahl: zu f zu W P • • Kältemaschine Wärmepumpe 2.9.8 Atkin- und Carnot-Prozess p p V • • Nutzlos Keine Nutzarbeit, da isotherme Expansion V • • Nützlich Nutzarbeit gewinnbar durch adiabatische Expansion (mit Temperaturerniedrigung) 60 2.10 Thermodynamische Maschinen Kolbenmaschinen Strömungsmaschinen • • Verbrennungsmotoren – Seiliger-Prozess – Otto-Prozess – Diesel-Prozess Offene Gasturbine – Joule-Prozeß • Geschlossene Gasturbine – Ericson-Prozeß • Heißluftmotoren – Stirling-Prozess • Dampfkraftanlagen – Rankine-Prozeß 2.10.1.1 Verbrennungsmotor 61 2.10.1.2 Verbrennungsmotor 2.10.1.3 Verbrennungsmotor 62 2.10.1.4 Verbrennungsmotor 2.10.2 Dampfmaschine Clausius-Rankine-Prozess p Koexistenzgebiet V 63 2.10.3 Entwicklung des WirkungsgradsWirkungsgrad 2.10.4 Kohlekraftwerk = 0,38 http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-32.html 64 2.10.5 Kernkraftwerk (SWR) = 0,34 http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-32.html 2.10.7 Kältemaschine • Kältemittel: Kompressor Kondensator Verdampfer Q ab Q zu Hochdruck Niederdruck Drosselventil – Flüssigkeiten, die nur durch Druckverminderung zum Sieden gebracht werden können: – Frigen – Ammoniak (NH3) • Joule Thomson-Effekt: – Zur Überwindung zwischenmolarer Anziehungskräfte wird innere Energie verbraucht (Abkühlung bei Drosselung) 65 2.10.7.1 Kältemittel leicht kondensierbare Gase: Kältemittel Symbol Wasser Ammoniak Dichlordifluormethan Chlortrifluormethan Chlordifluormethan H2O NH3 CCl2F2 CClF3 CHClF2 R718 R 717 R 12 R 13 R 22 [ °C ] Schmp 0,0 -77,9 -158,0 -181,0 -160,0 Sdp. Bereich 100,0 -33,3 -30,0 -81,5 -40,8 >0 - 65 ... - 50 ... -100 ... - 70 ... +10 +20 -60 +20 3 Die Hauptsätze der Thermodynamik „Erfahrungssätze“ • Grundprinzipien in der (chemischen) Energetik • Voraussagen von (chemischen) Reaktionen • Unterscheidung zwischen vier Hauptsätzen – – – – 0. Hauptsatz 1. Hauptsatz 2. Hauptsatz 3. Hauptsatz (Gleichgewichtsprinzip) (Energieerhaltungsprinzip) (Entropiezunahmeprinzip) (Unerreichbarkeitsprinzip) 66 3.1 0. Hauptsatz Thermodynamik Gleichgewichtsprinzip • Prinzip von Fowler • Für jedes thermodynamische System existiert eine Zustandsgröße, die Temperatur genannt wird. Ihre Gleichheit ist die notwendige Voraussetzung für das thermische Gleichgewicht zweier Systeme oder zweier Teile des gleichen Systems. Die Temperatur ist eine skalare Größe. Zwei Systeme, die sich im thermischen Gleichgewicht mit einem dritten System befinden, sind auch untereinander im thermischen Gleichgewicht, haben also die gleiche Temperatur. 3.2 1. Hauptsatz der Thermodynamik Energieerhaltungsprinzip • Die Energie eines abgeschlossenen Systems bleibt erhalten. Dies gilt für alle Formen der Energie, seine Wärme kann sich aber ändern ! • U = const. • ∆U = δQ + δW • Es gibt keine periodisch arbeitende Maschine, die Arbeit leistet, ohne andere Energie aufzunehmen es gibt kein Perpetuum Mobile 1. Art * *Alter Erfahrungssatz: bereits 1775 beschloss die französische Akademie der Wissenschaften derartige Vorschläge von Erfindern nicht mehr zu prüfen ! 67 3.2.1 Perpetuum Mobile (1) • PERPETUUM MOBILE. liefert Energie in unbegrenzten Mengen. • Perpetuum Mobile, lat. = dauernd beweglich. • einmal in Gang gesetzt, ganz von selbst weiterlaufen und dabei fortwährend Arbeit verrichten 3.2.2 Perpetuum Mobile (2) • • • • Enzyklopädie Naturwissenschaft und Technik von 1981 : "Perpetuum mobile erster Art. Unter einem Perpetuum mobile erster Art versteht man eine Vorrichtung, deren Teile nicht nur dauernd in Bewegung bleiben, sondern die sogar dauernd Arbeit zu leisten vermag, ohne daß von außen Energie (z.B. in Form von Wärme) zugeführt wird, ohne daß sich aber auch der physikalische oder chemische Zustand der an der Vorrichtung beteiligten Stoffe mit der Zeit ändert. Ein Perpetuum mobile erster Art gibt es nicht. Es würde im Widerspruch zum ersten Hauptsatz der Thermodynamik stehen." (4.Bd. S.3236, re.Sp.) "Perpetuum mobile zweiter Art. Unter einem Perpetuum mobile zweiter Art versteht man eine periodisch arbeitende Maschine, die nichts anderes tut, als Wärme in mechanische (oder eine andere) Arbeit zu verwandeln. Ein Perpetuum Mobile zweiter Art gibt es nicht. Es würde im Widerspruch zum zweiten Hauptsatz der Thermodynamik stehen." (4.Bd. S.3236, re.Sp.) 68 3.3 2. Hauptsatz der Thermodynamik Entropiezunahmeprinzip • Der zweite Hauptsatz der Thermodynamik ist ein Wahrscheinlichkeitssatz: Ein System geht von unwahrscheinlichen zu wahrscheinlichen Zuständen über • In einem abgeschlossenen System nimmt die Entropie bei irreversiblen (realen von selbst ablaufenden) Vorgängen immer zu. • Wärme geht nicht von selbst von einem kalten auf einen warmen Körper über • Es gibt keinen Vorgang der nichts weiter bewirkt als die Abkühlung eines Wärmereservoirs und Erzeugung von äquivalenter mechanischer Arbeit • Ein höherer thermischer Wirkungsgrad als der des Carnot-Prozesses ist nicht möglich • Es gibt kein Perpetuum Mobile 2. Art 3.4 3. Hauptsatz der Thermodynamik Unereichbarkeitsprinzip Nernst Theorem Für alle reinen Stoffe gilt am absoluten Nullpunkt: T 0 S k ln 1 S 0 Für reine Stoffe herrscht am Nullpunkt absolute Ordnung Der absolute Temperaturnullpunkt lässt sich nie erreichen !!! 69 3.5 Übung zu den Hauptsätzen Die Hauptsätze der Thermodynamik beschreiben und regeln die 4 Zustandsgrößen: Innere Energie U Enthalpie H Freie Enthalpie G Entropie S Diskutieren Sie und ordnen Sie diese Grössen den jeweiligen Hauptsätzen zu ! 4 Statistische Thermodynamik • • • • • Newton‘sche Bewegungsgleichungen Druck und Temperatur als Teilchenbewegung Gaußverteilung Maxwellverteilung Bolzmannverteilung 70 5 Chemische Thermodynamik • Thermodynamische Einkomponenten Systeme – Gasvolumina, z.B. ideale Gase • Thermodynamische Mehrkomponenten Systeme – Chemische Reaktionen, z.B. Verbrennungen 5.1 Chemische Reaktionen • Reaktionsenergie – Exotherme Reaktion – Endotherme Reaktion H < 0 H > 0 gibt Wärme ab nimmt Wärme auf G < 0 G > 0 freiwillig unfreiwillig • Reaktionsrichtung – Exergonische Reaktion – Endergonische Reaktion • Umkehrbarkeit von Reaktionen – Reversible Reaktion: A+B z.B. Säure-Base Gleichgewichte – Irreversible Reaktion A+B z.B. Verbrennungsreaktionen C+D C+D 71 5.1.1 Endotherme Reaktion Endotherm Eine Reaktion mit der Enthalpieänderung: H298 >0 e.g. H 298 89kJ C(s) 2S (s) CS2 (l ) E Aktivierungsenergie + H t 5.1.1.1 Reduktion von SiO2 Reduktion = Elektronenaufnahme Herstellung von Rohsilizium Elektrischer Ofen mit Kohleelektroden K SiO2 2 C 2100 Si 2 CO H2100 695kJ 14 kWh / kg Si !!! 72 5.1.2 Exotherme Reaktion Exotherm Eine Reaktion mit der Enthalpieänderung :H298 < 0 e.g. H 298 96,3kJ Fe(s) S (s) FeS(s) E Aktivierungsenergie - H t 5.1.2.1 SiHCl3 Synthese Oxidation = Elektronenabgabe Oxidation Silizium zu SiHCl3 K Si 3 HCl 600 SiHCl3 H2 H298 218kJ 73