v - WWW-Docs for TU
Werbung

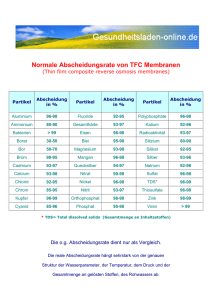
Master Umweltingenieur, 1. Semester, Modul 42439, „Strömungsmechanik“, 420607, VL, Do. 11:30-13:00, R. 3.21 420608, UE, Do. 13:45-15:15, R. 3.17 Materialien WS 2014/15 Dozent: Dr. Andreas Will [email protected] ◦ Thermodynamisches Gleichgewicht und Zustandsgrößen ◦ evaporation/condensation ◦ melting/freezing ◦ sublimation ◦ physical conditions for vapor, liquid and solid state ◦ Internal energy of water ◦ mechanic and kinematic properties of liquid water ◦ Solubility A. Will Physics of Fluids Vorlesung 3: Zustandsgleichung: Zustandsgrößen • Klassische Mechanik: • Massenpunkt: Jedes Massenelement (Partikel) mi wird vollständig durch den Ort ri und die Geschwindigkeit i beschrieben. • Die Bewegung wird durch die Newton‘schen Bewegungsgesetze deterministisch beschrieben wenn die Anfangsbedingung vollständig bekannt ist. • Kinetische Gastheorie beschreibt die mittleren (makroskopischen) Eigenschaften einer großen Zahl (N) von Partikeln in Abhängigkeit von den (mikroskopischen ) Eigenschaften und Bewegungen der einzelnen Partikel. Hierzu werden (makroskopische) Zustandsvariablen wie Temperatur (T), Druck (p) and Dichte ( ) eingeführt: • N ≈ NA≈ 6,022 141 29 *1023 (Avogadro-konstante). • Geschwindigkeit v = 1/NA < i> ist die mittlere Geschwindigkeit der Partikel • Dichte = N mi/V ist Masse m der Partikel im Volumen V. • Druck p=F/A=2/3 N<Ek,i>/V ist die Kraft F die die Partikel auf die Fläche A ausüben. • Die innere Energie E= N <Ei> ist die kinetische Energie der Partikel (Rotations- Osizillations und Translationsbewegungen) im volumen V. • Temperatur T = E/c ist die Zustandsvariable, die proportional ist zur inneren Energie. -> Ein Ensemble von Gaspartikeln ist im theromdynamischen Gleichgewicht, wenn die Temperatur, Druck und Volumen konstant sind. Vorlesung 3: Zustandsgleichung : Die Zustandsgröße Druck Druck p: p =F/A =(m dv/dt) /A = Nr2mi<vi,x > /dt /A # Kraft pro Fläche # Kraft ist die Impulsänderung pro Zeiteinheit # Impulsänderung pro Zeiteinheit ist zwei Mal der Impuls des Partikels mal Zahl Nr der reflektierten Partikel. = Nr2mi<vi ,x> <vi,x > / (LA) # die Zeit pro Reflexion t=L/<vi,x> ist gegeben durch die Weglänge L, die das Partikel mit seiner Geschwindigkeit <vi,x> zurücklegt. Diese Wegstrecke ist gleich der Länge des Volumen V, wenn die Zahl der Partikel konstant ist. = 2Nrmi<vi,x2>/V # Volumen ist Fläche mal dazu orthogonale Längenskala = 2Nrmi<vi2>/(3V) # Annahme von vx= vy= vz = Nami<vi2>/(3V) # Die Hälfte der Partikel bewegt sich in die positive Raumrichtung. Die Gesamtzahl im Volument V ist deshalb 2 Nr = Na =2/3 Na<Ei>/V Die Druckkraft der Partikel auf eine Fläche ist gegeben durch die Impulsänderung der Partikel. Vorlesung 3: Zustandsgleichung Zustandsgröße Temperatur • Thermische Energie: E = N <Ei> = N f/2 <Ei,f> = N f/2 k T = cT c = k f/2 # die innere Energie ist gegeben durch die kinetische Energie aller Partikel. # die kinetische Energie eines Partikels ist gegeben durch die kinetische Energie pro Freiheitsgrad mal Zahl der Freiheitsgrade durch 2. # die kinetische Energie der Partikel ist proportional zur Temperatur. Die Boltzmannkonstante k ist eine Naturkonstante. # die innere Energie E ist proportional zu Ihrer Temperatur. # Die Wärmekapazität c ist eine Materialeigenschaft, da jedes Material eine andere Zahl von Freiheitsgraden hat. f: degrees of freedom (translational, rotational, vibrational) Vorlesung 3: Physical properties of water (at rest): temperature measurements • Temperature measurements: • density (Galileo-thermometer (left),others (center)), • pyrometer (here colour comparison with emitting Wolfram-wire for high temperature range, right), • psychrometer (temperature and humidity (via T2-T1)) Fan Dry temp. humid temp. Temp. Diff. = (t-f) Anal. air Saturated air Humid surface Succed air Vorlesung 3: Zustandsgleichung Ideale Gasgleichung • Gay-Lussac: • Boyle-Mariotte: ρT = const. p/ρ = const. • Ideales Gasgesetz: • NA≈ 6,022 141 29 *1023 • R = 8,314 462 J/mol/K • k = 1,3806488 J/K wenn p=const. wenn T=const. pV = RT = NA k T Avogadrokonstante ideale Gaskonstante Boltzmannkonstante Vorlesung 3: Zustandsgleichung : Aggregatzustände: • Dampfphase • Flüssige Phase • Eisphase • kompressible flüssige Phase • gasartige Phase • superkritische Fluidphase Trennlinien: • Triplepunkt • kritische Temperatur und Druck (Punkt) • Sättigungsdampfdruck Phasendiagram von Wasser Vorlesung 3: Zustandsgleichung : Die typischen Punkte im Phasendiagram: Triplepunkt: Ttp = 273.16 K = 0 °C ptp = 611.73Pa Siedepunkt: Tbp = 373.15 K = 100 °C Pbp = 101.325 kPa = 1atm Kritischer Punkt Tcr = 647.00 K = 273.84 °C Pcr = 22.064 MPa = 217.75 atm Phasendiagram von Wasser Vorlesung 3: Zustandsgleichung: Sättigungsdampfdruck über Wasser A. Will Physics of Fluids Vorlesung 3: Zustandsgleichung: Sättigungsdampfdruck über Wasser Water A. Will Physics of Fluids -10 2.15 40 55.3 0 4.58 60 149.4 5 6.54 80 355.1 10 9.21 95 634 11 9.84 96 658 12 10.52 97 682 13 11.23 98 707 14 11.99 99 733 15 12.79 100 760 20 17.54 101 788 25 23.76 110 1074.6 30 31.8 120 1489 37 47.07 200 11659 Dichte des Quecksilbers Hg: 13,5 g/cm3 Vorlesung 3: Zustandsgleichung: Dichte von Wasser und Eis Das Diagram zeigt die Dichte von Wasser und Eis bei 1013,25 hPa in Abhängigkeit von der Temperatur. Die relative Dichteänderung im Temperaturbereich : 250K-300K : ∆ρ/ρ < 0,01. A. Will Physics of Fluids Water and Ice density Vorlesung 3: Zustansgleichung: Physikalische Eigenschaften von Wasser Die Werte der Konstanten hängen z.T. von Temperatur und Druck ab: Größe Density (maximum) Mol mass Melting Point Boiling Point Triple Point Critical Point Satur. vap. pressure E Specific heat capacity Heat conductivity Evaporation heat Melting heat Viscosity Index of refraction Permittivity Albedo, liquid water ice Solubility of NaCl A. Will Physics of Fluids Symbol = m/V mH2O NA Tmp Tbp (Ttp , ptp ) (Tcr , pcr ) c=dQ/m dT He Hm n=c0/cm α(ϑ) α (ϑ) s Wert = 0,999975 g/cm³ = 18,01528 g/mol = 0 °C = 100 °C = (0 °C , 611,66 Pa) = (373,946 °C , 22,064 Mpa) = 23,3854 hPa = 4.183 kJ/(kg·K) = 0,5984 W/mK = 2.257 MJ/kg = 0.334 MJ/kg = 1,001 mPa s = 1,33251 = 80,35 A s /(V m) 0.05-0.9 0.5-0.7 360,9 g/kg bei (3,98 °C) (1013,25 hPa) (1013,25 hPa) (322 kg/m³ (20 °C) (20 °C, 0,1 MPa) (20 °C, 0,1 MPa) (100°C) (0°C) (20 °C, 1013,25 hPa) (25 °C, visible) / 1,310 (ice) (20 °C und 0 Hz) (20 °C, 1013,25 hPa) Ideales Gas: Volumen V=22,4 l/mol (at 1013,25hPa and 293,15 K) Abgeleitete Größen: v(1013,25mBar, 293,15 K) = 18,01528 g/mol / (22,4 l/mol) = 0,80 kg/m3 Vorlesung 3: Zustandsgleichung: Wasserverfügbarkeit 3% Süßwasser davon 30,1 % Grundwasser 1,2% Oberflächenwasser davon 87% in Seen 2% in Flüssen -------------------0,03*0,012*0,9=0,03% verfügbares Wasser A. Will Physics of Fluids Vorlesung 3: Zustandsgleichung: Übung 1 Nehme an T= 277,15 K 1. 2. 3. 4. Wie groß ist ein Wasserpartikel? Wie groß ist der mittlere Abstand zwischen Wasserpartikeln bei Normaldruck (1013,25 hPa)? Nehme eine Gleichverteilung der thermischen Energie auf die Freiheitsgrade. 1. Wie viele Freiheitsgrade hat eine Wassermolekül? 2. Wie groß ist die mittlere Geschwindigkeit eines Wassermoleküls? 3. Wie ändert sich die mittlere Geschwindigkeit eines Wassermoleküls bei einer Temperaturerhöhung von 1K? Funktionaler Zusammenhang von Druck und Temperatur bei Wasserdampfsättigung 1. Leite p(T) für den Sättigungsdampfdruck aus den Ergebnissen auf Folie 10 und/oder 11 2. Verwende den kritischen, Siede- und Triplepunkt, um die Parameter der Funktion zu berechnen. 3. Berechne den Druck bei 10, 20, 40 und 80 Grad C und vergleiche die Werte mit den gemessenen Werten in Tabelle auf Folie 11 A. Will Physics of Fluids Vorlesung 3: Zustandsgleichung Übung 2 1. Wie funktioniert ein 1. Galilei-Thermometer 2. Psychrometer Geben Sie eine qualitative Beschreibung. 2. Erstellen Sie eine Tabelle der physikalischen Eigenschaften der Atmosphäre. A. Will Physics of Fluids