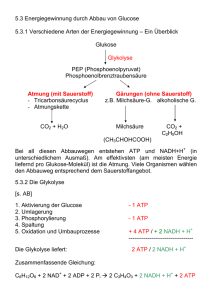
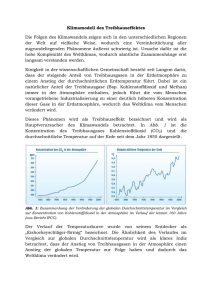
Protokoll ()
Werbung

Philipps-Universität Marburg Fachbereich Chemie Übungen im Experimentalvortrag Leitung: Prof. Dr. Neumüller, Dr. Reiß SS 2010 Experimentalvortrag OC Chemie im Sport am 10.6.2010 in Marburg Verfasst von: Anna-Lena Eicke [email protected] Inhaltsverzeichnis Einleitung.................................................................................................................................... 3 Der Energiestoffwechsel ............................................................................................................ 3 Versuch 1: Verbrennung von Glucose ................................................................................... 4 Demonstration 1: Respiratorische Kompensation einer metabolischen Acidose............... 13 Nährstoffe ................................................................................................................................ 19 Modellversuch 2: Reduzierende Wirkung von Vitamin C..................................................... 20 Demonstration 2: Nachweis von Glutamin in Sportgetränken ............................................ 24 Versuch 3: Nachweis von Kreatin in Sportgetränken ........................................................... 30 Versuch 4: Nachweis von Ephedrin ...................................................................................... 36 Ausblick auf sportartspezifische Versuche am Beispiel des Tauchens ................................... 39 Versuch 5: Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid ................................ 40 Schulrelevanz............................................................................................................................ 44 Literaturverzeichnis, Abbildungsverzeichnis und Versuchsverzeichnis ................................... 45 2 Einleitung Während meines Studiums Chemie und Sport auf Lehramt (L3) stellte sich mir die Frage, wie diese beiden Fächer miteinander verknüpft werden können. Auf Anhieb bieten sich dafür zwei große Themenkomplexe an: zum einen die verschiedenen Stoffwechselvorgänge im Körper, die alle auf chemischen Reaktionen beruhen und zum anderen das Thema der modernen Kunststoffe, die die äußeren Bedingungen der Sportler immer weiter optimieren und diese so immer bessere Leistungen hervor bringen können. Da die Behandlung beider Themen für einen Experimentalvortrag zu viel wäre, werden hier ausschließlich die Stoffwechselvorgänge im Körper betrachtet. Dabei geht es zuerst einmal um den Energiestoffwechsel. Anschließend erfolgt eine Betrachtung der Bedeutung der Nährstoffe für den menschlichen Körper unter besonderer Berücksichtigung des Verbrauchs unter sportlicher Belastung und entsprechenden Nahrungsergänzungsmitteln sowie den Einsatz von Supplementen. Da hier manchmal kaum eine Grenze zwischen Nahrungsergänzung und Doping zu ziehen ist, wird im nächsten Teil kurz auf die Dopinganalytik eingegangen. Dieses Thema alleine würde schon mehrere Experimentalvorträge füllen können. Abschließend wird ein sportartspezifischer Versuch vorgestellt. In diesem geht es um das Tauchen und die Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid. Der Energiestoffwechsel Körperliche Leistung hängt von den motorischen Faktoren Koordination, Schnelligkeit, und Beweglichkeit und von den konditionellen Faktoren Kraft und Ausdauer ab. Die Ausdauerleistungsfähigkeit hängt von folgenden vier Determinanten ab: Lunge: Vitalkapazität, Atemminutenvolumen, Atemgrenzwert, bronchialer Widerstand Herz: Herzfrequenz, Schlagvolumen, Herzminutenvolumen Blut: Erythrozytenanzahl, Hämoglobingehalt, Pufferkapazität, Substrattransport Muskelzelle: Energiebereitstellung (aerob/anaerob) 3 Obwohl Laien in der Regel davon ausgehen, dass für die Ausdauerleistungsfähigkeit vor allem die Lunge und das Herz-Kreislaufsystem verantwortlich sind, ist wissenschaftlich bewiesen worden, dass die oxidative Kapazität der Muskulatur einen größeren Beitrag leistet. „Es wird postuliert, dass die Lunge jedes gesunden Menschen in der Lage wäre, einen Marathonlauf im Hochleistungsbereich zu unterstützen, ähnliches gilt für das HerzKreislaufsystem.“1 Die Unterschiede zwischen einem „normalen“ Menschen und einem Hochleistungssportler bestehen darin, dass der Hochleistungssportler einen größeren Energiespeicher und eine bessere Energiebereitstellung aufzuweisen hat. Solange dem Körper ausreichend Kohlenhydrate zur Verfügung stehen, wird Energie aus diesen bereit gestellt. Diese Tatsache erklärt warum Menschen, die durch Sport abnehmen wollen, mindestens 45 Minuten Sport treiben sollten, denn erst wenn die Kohlenhydratspeicher aufgebraucht sind, greift der Körper auf Fettreserven zurück. Der Energiegehalt der Kohlenhydrate wird durch folgenden Versuch veranschaulicht: Versuch 1: Verbrennung von Glucose 1. Zeitbedarf Vorbereitung: 2 Min. Durchführung: 2 Min. Nachbereitung: 1 Min. 2. Chemikalien Name Gefahrensymbol R-Sätze S-Sätze Smp./Sdp. Kaliumchlorat KClO3 O, N, Xn - 13-16-2761 - 370 °C Glucose 9-20/2251/53 - Einsatz in der Schule S1 146 °C S1 1 Summenformel C6H12O6 Weisser, B., Energiegewinnung im Muskel, Biochemische Grundlagen, S. 16 4 Gefahrensymbole 3. Materialien/Geräte Stativmaterial, Reagenzglas, Spatel, Bunsenbrenner, Tiegelzange 4. Versuchsaufbau 5. Versuchsdurchführung Man gibt so viel Kaliumchlorat in ein an einer Stativklemme befestigtes Reagenzglas, bis dieses zu ca. 1/5 gefüllt ist. Anschließend schmilzt man es vorsichtig mit dem Bunsenbrenner und lässt die Flamme noch ca. fünf Sekunden weiter auf die Schmelze einwirken. Nun gibt man mit einer Tiegelzange ein kleines Stück Glucose (z.B. Traubenzucker) in das Reagenzglas. 6. Beobachtung Das weiße Kaliumchlorat schmilzt innerhalb von 30 Sekunden vollständig. Die Schmelze ist milchig-weiß. Einige Sekunden nach der Schmelze steigen kleine Blasen auf. Gibt man Glucose hinein, so entstehen schlagartig rot-gelbe Flammen im Reagenzglas, die fast aus dem Reagenzglas hinaustreten und sich sehr stark rauf und runter bewegen. Außerdem tritt weißer Rauch aus. Zu hören ist ein Knattern und Brummen. 5 Nach der Reaktion bleiben unten im Reagenzglas schwarze und oben weiße Rückstände zurück. Abb. 1: Glucose in einer Kaliumchlorat-Schmelze 7. Entsorgung Nach dem Abkühlen wird das Reagenzglas in der Feststofftonne entsorgt. 8. Fachliche Analyse Durch das Erhitzen des Kaliumchlorats mit dem Bunsenbrenner disproportioniert dieses zu Kaliumperchlorat und Kaliumchlorid: +5 4 KClO3 (s) +7 -1 3 KClO4 (l) + KCl(l) Das Kaliumperchlorat zerfällt unter weiterer Wärmezufuhr in Sauerstoff und Kaliumchlorid: +7-2 3 KClO4 (l) 0 -1 6 O2 (g) + 3 KCl(l) Der hier gebildete Sauerstoff wirkt nun als Oxidationsmittel und sorgt für die heftige Reaktion, in der die Glucose zu Kohlenstoffdioxid und Wasser verbrennt: 0 -2 0 C6H12O6 (s) + 6 O2 (g) +4 -2 -2 6 CO2 (g) + 6 H2O(g) Bei dieser stark exothermen Reaktion werden 5644 kJ/mol Energie frei, wobei die gasförmigen Produkte ein größeres Volumen einnehmen als die Edukte. Das gasförmige Kohlenstoffdioxid und auch der gasförmige weiße Wasserdampf entweichen nach oben aus dem Reagenzglas und reißen die noch nicht umgesetzte Glucose mit sich. Diese wird ein 6 wenig im Reagenzglas hochgetragen, fällt jedoch schnell wieder herunter und reagiert erneut, wodurch die Flammen sich ständig auf und ab bewegen. Die schwarzen Rückstände am Reagenzglas sind Kohlenstoffreste, die aufgrund einer nicht vollständigen Verbrennung im Reagenzglas zurück bleiben. Der Wasserdampf, der entstehendes Kaliumchlorid mit sich genommen hat, ist für die weißen Rückstände verantwortlich. Dieser Versuch veranschaulicht den hohen Energiegehalt von Glucose. Bei der Verbrennung von einem Mol Glucose (das sind 180 g!) werden 5644 kJ/mol (das sind 1348 kcal) Energie frei. Umgerechnet auf einen Zuckerwürfel, der ungefähr 3 g wiegt und damit 0,017 mol entspricht ist das ein Energiegehalt von 22,5 kcal. Der Tagesbedarf an Energie sollte zu 52 % durch Kohlenhydrate gedeckt werden 2. Der „Durchschnittseuropäer“ nimmt täglich 300 - 400 g Kohlenhydrate zu sich. Dies entspricht 5100 - 6800 kJ bei einem täglichen Grundumsatz von 7100 kJ für einen Mann und 6300 KJ für eine Frau3. Bei körperlicher Tätigkeit oder Belastung steigt der Energieumsatz entsprechend an. Die Werte sind nur ungefähre Angaben. Diese Zahlen zeigen, dass wir zu viele Kohlenhydrate zu uns nehmen. Geht man von einem Mann aus, der 400 g Kohlenhydrate aufnimmt, so deckt dieser seinen Tagesbedarf allein durch diese Naturstoffklasse zu 95 %. Zwar sind die Kohlenhydrate der wichtigste Energielieferant des Menschen, aber auch die anderen Nährstoffe wie Proteine, Lipide, Vitamine und Mineralstoffe sind essentiell für den Menschen. Jede Leistung, jeder Vorgang im menschlichen Körper benötigt Energie in Form von ATP (Adenosintriphosphat). In den Muskeln ist die Konzentration von ATP relativ gering, weshalb bei körperlicher Belastung laufend ATP nachgeliefert werde muss, um weitere Muskelkontraktionen zu ermöglichen. Bei einem Marathonlauf werden beispielsweise 60 kg ATP umgesetzt4, diese Menge verbraucht ein Mensch mit „normaler“ körperlicher 2 Asselborn, W., Jäckel, M., Risch, K. T., Chemie heute – Sekundarbereich II, S. 324 Schmidt, R. F., Lang, F., Thews, G., Physiologie des Menschen mit Pathophysiologie, S. 893 4 Schmidt, R. F., Lang, F., Thews, G., Physiologie des Menschen mit Pathophysiologie, S. 911 3 7 Anstrengung an einem Tag. Die Spaltung des ATP in ADP (Adenosindiphosphat) liefert dem Körper 30,5 kJ/mol Energie (≙ 7,3 kcal/mol). NH2 N N OH N N O O P OH O O P OH O O P OH O ATP OH OH H2O NH2 N N OH N N O O P O OH OH O P OH + HO O P OH + 30,5 kJ/mol O ADP OH OH Um die ATP-Konzentration im Körper auch bei sportlicher Anstrengung aufrecht zu erhalten, arbeiten vier Stoffwechselprozesse an der Herstellung von ATP: die Hydrolyse von Kreatinphosphat: Kreatin überträgt direkt im Zytoplasma der Muskelzelle ein energiereiches Phosphat-Molekül auf das ADP. Dieser Vorgang verbraucht keinen Sauerstoff. Die Kreatinreserven sind relativ gering, so dass sie nur für ca. 20 Sekunden bei maximaler Intensität reichen. Zellatmung mit Glykolyse, Zitronensäurezyklus und Atmungskette als aerobe Energiebereitstellung Glykolyse mit anschließender Gärung als anaerobe Energiebereitstellung (s. unten) Oxidation von Fettsäuren (Lipolyse) als aerobe Energiebereitstellung 8 Der wichtigste Stoffwechselvorgang zu Energiegewinnung ist die Zellatmung. Neben Kohlenhydraten wird hierbei auch Sauerstoff benötigt. Sie besteht aus der Glykolyse (anaerober Abbau von Glucose zu zwei Molekülen Pyruvat), dem Zitronensäurezyklus (Abbau von Pyruvat zu Kohlenstoffdioxid und Wasser) und der Atmungskette (Aufnahme der Elektronen aus den Abbauprodukten der Glykolyse und des Zitronensäurezyklus, Verbindung der Elektronen und Protonen mit molekularem Sauerstoff zu Wasser). Im Folgenden wird lediglich die Glykolyse näher erläutert. Diese besteht aus zehn Schritten, die unter Enzymkatalyse ablaufen. Die ersten fünf Reaktionsschritte benötigen zwar Energie in Form von zwei Molekülen ATP, dafür werden aber in den letzten fünf Schritten insgesamt vier Moleküle ATP freigesetzt. Neben dem ATP, das durch hydrolytische Abspaltung eines Phosphatrestes unter Abgabe von 30 kJ/mol Energie zu ADP wird, hat ebenso das NAD+ (Nicotinamid-Adenin-Dinucleotid) als Oxidationsmittel für die Zellatmung eine wichtige Bedeutung. Es wird zum NADH reduziert und fungiert so als energielieferndes Coenzym. In Abb. 2 ist die Glykolyse schematisch dargestellt. 1 In der Zelle überträgt das Enzym Hexokinase vom ATP eine Phosphatgruppe auf die Glucose. Da die Plasmamembran für Ionen undurchlässig ist, wird der Zucker in der Zelle festgehalten. Die Phosphat-Gruppe erhöht die Reaktivität des Moleküls. 2 Inversion von Glucose-6-phosphat in Fructose-6-phosphat. 3 Das Enzym Phosphorfructokinase überträgt eine zweite Phosphatgruppe auf den Zucker. 4 Das Zuckermolekül wird durch das Enzym Aldolase in Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat gespalten. 5 Reversible Umwandlung des Glycerinaldehyd-3-phosphat in Dihydroxyacetonphosphat und umgekehrt. Da das Glycerinaldehyd-3-phosphat als Substrat entzogen wird, wird das Gleichgewicht auf die Seite des Glycerinaldehyd-3phosphat verschoben. 6 Glycerinaldehyd-3-phosphat wird oxidiert und das Wasserstoffatom auf das Coenzym NAD+ übertragen. Dabei wird eine Phosphatgruppe des Coenzyms auf das Glycerinaldehyd-3-phosphat übertragen, wodurch dieses zum 1,39 Bisphosphoglycerat wird. 7 Die in Schritt 6 übertragene Phosphatgruppe wird auf das ADP übertragen. Da sich durch die Spaltung in Schritt 4 und die Verschiebung des Gleichgewichts in Schritt 5 die Anzahl der Substratmoleküle verdoppelt hat, entstehen pro Molekül Glucose hier zwei Moleküle ATP! Zu diesem Zeitpunkt steht die Energiebilanz der Glykolyse auf Null (zwei Moleküle ATP verbraucht, zwei gewonnen). Aus dem 1,3-Bisphosphoglycerat ist 3-Phosphoglycerat entstanden. Die Carbonylgruppe ist zu einer Carboxylgruppe oxidiert worden, wodurch es sich nicht mehr um einen Zucker, sondern um eine Carbonsäure handelt. 8 Durch ein Enzym wird die Phosphatgruppe verschoben (3-Phosphoglycerat 2-Phosphoglycerat) und das Substrat so auf Schritt 9 vorbereitet. 9 Ein weiteres Enzym spaltet Wasser ab. Es wird eine Doppelbindung ausgebildet und Phosphoenylpyruvat gebildet. Dieses Molekül ist sehr instabil und reagiert sofort weiter. 10 Das Phosphoenylpyruvat überträgt die verbliebene Phosphatgruppe auf ein weiteres Molekül ADP und wird zum Pyruvat. Auch dieser Schritt läuft pro Molekül Glucose zwei Mal ab, wodurch nun eine Energiebilanz von plus zwei Molekülen ATP entsteht. Außerdem wurde in Schritt 6 Energie gespeichert, da hier NAD+ zu NADH reduziert. 10 Abb. 2: Die Glykolyse 11 Steht nach der anaeroben Glykolyse nicht ausreichende Sauerstoff zur Verfügung, so kann der Abbau der Glucose nicht über den aeroben Zitronensäurezyklus oder die aerobe Atmungskette erfolgen. Unter Sauerstoffmangel besteht jedoch noch die Möglichkeit über die alkoholische Gärung, die Essigsäuregärung, die Milchsäuregärung oder die Buttersäuregärung Glucose weiter anaerob abzubauen. Für Sportler ist vor allem die Milchsäuregärung von Bedeutung, da diese unter Sauerstoffmangel in den Muskelzellen stattfindet und Milchsäure („Lactat“) herstellt, welches für die Ermüdung des Muskels bis hin zu Muskelkater verantwortlich ist. Neue Studien machen jedoch weniger das Lactat als vielmehr Mikrotraumata für den Muskelkater verantwortlich. Nachdem die Glucose in der Glykolyse bis zum Pyruvat abgebaut wurde, wird dieses schließlich in der Milchsäuregärung durch NADH zum Lactat reduziert. 2 ADP 2 ATP 2 NADH O +2P C6H12O6 O 2 2 NAD+ 2 NADH + 2 H+ - 2 NAD+ OH +2 H+ O Pyruvat - O 2 O L-(+)-Lactat Glykolyse Während der Erholungsphase wird das Lactat vom Blut abtransportiert und in der Leber wieder zu Pyruvat umgesetzt. Der Vergleich der beiden möglichen Abbauprozesse von Glucose zeigt, dass der anaerobe Weg zwar schnell geht, dafür aber lediglich zwei Moleküle ATP hergestellt werden, hingegen über die Zellatmung 38 Moleküle ATP aus einem Molekül Glucose synthetisiert werden können. Aerober Glucoseabbau über die Zellatmung: Anaerober Glucoseabbau über Glykolyse und Milchsäuregärung: + 2 ATP 12 Schnellkräftige Sportarten, wie z.B. ein 100 m-Sprint, erfordern eine schnelle Energiebereitstellung. Hier wird die Energie anaerob bereit gestellt. Je mehr die Ausdauer eines Sportlers gefragt ist, umso größer ist der Anteil der aeroben Energiebereitstellung. Mit zunehmendem Trainingszustand ist eine deutliche Adaptation zu beobachten, also eine Anpassung an die körperliche Belastung. So bauen Sprinter für die schnellkräftigen Anforderungen in höherem Maße schnell kontrahierende FT-Fasern (Fast-twitch-Fasern) im Muskel auf, die eine höhere anaerobe Kapazität aufweisen, also Energie über die Glykolyse und die Milchsäuregärung zur Verfügung stellen. Langstreckenläufer hingegen haben einen größeren Anteil der ST-Muskelfasern (Slow-twitch-Fasern), in denen durch intensives Training die Anzahl der an der Oxidation beteiligten Zellorganellen (Mitochondrien) und der oxidativen Enzyme ansteigt. Die größte Auswirkung besitzt jedoch die Vergrößerung des Kohlenhydratspeichers durch aerobes Ausdauertraining. Der nächste Versuch veranschaulicht, wie der Körper entstehendes Lactat abfängt. Bei diesem handelt es sich, wie der Name „Milchsäure“ schon sagt, um eine Säure, die ab einer Konzentration von 30 mmol/L den pH-Wert des Blutes so stark absenken kann, dass die Leistung einiger Enzyme herabgesetzt wird. Demonstration 1: Respiratorische Kompensation einer metabolischen Acidose 1. Zeitbedarf Vorbereitung: 5 Min. Durchführung: 30 Min. Nachbereitung: 3 Min. 13 2. Chemikalien Name Summenformel Gefahrensymbol R-Sätze S-Sätze Natriumcarbonat Salzsäure (c = 2 mol/L) L-(+)-Milchsäure (w = 0,01) Wasser Na2CO3 HCl Xi - 36 - 22-26 - Einsatz in der Schule S1 S1 C3H6O3 Xi 36-38 - S1 H2O - - - - Gefahrensymbole 3. Materialien/Geräte Waage, Spatel, Magnetrührer mit Fisch, 250 mL-Becherglas, Pipette, pH-Meter 4. Versuchsaufbau 10.23 pH T on B on 14 5. Versuchsdurchführung Man löst 2 g Natriumcarbonat in 100 mL Wasser. Nachdem man den pH-Wert gemessen hat, gibt man so viel 2 molare Salzsäure hinzu, bis sich der pH-Wert auf 7,4 einstellt. Anschließend gibt man 5 mL einer 1 %igen Milchsäurelösung hinzu und beobachtet den pHWert 60 Min. lang. Um zu veranschaulichen, dass es sich bei dem Puffer um Blut handeln soll, kann die Lösung mit roter Lebensmittelfarbe angefärbt werden. 6. Beobachtung Der pH-Wert des Natriumcarbonats gelöst in Wasser beträgt 9,2. Nach Zugabe von ca. 10 mL Salzsäure stellt sich ein pH-Wert von 7,41 ein. Dieser sinkt nach Zugabe der Milchsäure auf 7,03 ab. Man kann einige Gasblasen im Becherglas aufsteigen sehen. Der pH-Wert steigt schließlich bis auf 7,41 an und nach weiterem Beobachten bis auf 7,49. 7. Entsorgung Die Lösung kann in den Ausguss gegeben werden. 8. Fachliche Analyse Blut verfügt über verschiedene Puffersysteme, die zusammen dafür sorgen, dass der pHWert des Blutes zwischen 7,37 und 7,43 liegt. Sinkt der pH-Wert unter 7,37 ab, so spricht man von einer Azidose, steigt er über 7,43 von einer Alkalose. Ein konstanter pH-Wert ist insofern wichtig, weil viele Zellstrukturen und ihre damit verbundenen Funktionen pHabhängig sind, so z.B. die katalytisch wirkenden Enzyme. Das wichtigste Puffersystem des Blutes ist der Kohlensäure/Hydrogencarbonat-Puffer, der in diesem Versuch nachgestellt wird. Er beruht auf der Löslichkeit von Kohlenstoffdioxid in Wasser zur schwach sauren Kohlensäure5: 5 Zeeck,A., Chemie für Mediziner 15 Das Gleichgewicht dieser Reaktion liegt weit auf der linken Seite. Ein Großteil des Kohlenstoffdioxids liegt physikalisch gelöst vor. Die Kohlensäure dissoziiert in einer zweiten Gleichgewichtsreaktion zu Hydrogencarbonationen und Protonen: Im Blut liegt ein Puffersystem aus Kohlensäure und Natriumhydrogencarbonat vor. Bei 37 °C stabilisiert es den Blut-pH-Wert bei 7 in dem Verhältnis von 20:1: Der Überschuss an Hydrogencarbonationen puffert vor allem -Ionen ab, die sowohl bei der Milchsäuregärung wie auch in vielen anderen Stoffwechselprozessen entstehen. Abb. 3 zeigt die Änderung des pH-Wertes in Abhängigkeit von der Zeit. Zu sehen ist, wie der pHWert nach Zugabe der Milchsäure sehr schnell auf 7,03 abfällt und langsam wieder bis auf den Ausgangswert 7,41 und weiter bis auf 7,49 ansteigt. Dieser weitere Anstieg ist darauf zurück zu führen, dass durch die Milchsäure vermehrt Kohlenstoffdioxid ausgeschieden wird. Im Körper -Ionen entstehen und dadurch würde neuer Sauerstoff zu Kohlenstoffdioxid umgesetzt und der pH-Wert bei 7,41 stehen bleiben. Abb. 3: Änderung des pH-Wertes in Abhängigkeit von der Zeit 16 Da Kohlenstoffdioxid gasförmig ist, hängt seine Löslichkeit vom Partialdruck ab. Im Körper gebildetes Kohlenstoffdioxid wird in der Lunge über die Atmung ausgeschieden. Das heißt, dass der Partialdruck von Kohlenstoffdioxid und damit auch der KohlensäureHydrogencarbonat-Puffer über die Atmung reguliert werden. Durch das Ausatmen von Kohlenstoffdioxid werden die -Ionen neutralisiert: Durch das Abatmen von Kohlenstoffdioxid werden -Ionen neutralisiert. Beim Einatmen von Sauerstoff wird dieser in Stoffwechselprozessen jedoch wieder zu Kohlenstoffdioxid verarbeitet, wobei auch -Ionen entstehen. Das heißt, dass im Blut relativ konstante Konzentrationen von Kohlensäure und Hydrogencarbonationen vorliegen. Durch Hyperventilation verändert sich der Partialdruck von Kohlenstoffdioxid. Welche Folgen dies nach sich ziehen kann, wird in Demonstration 2 erklärt. Bei Profisportlern wird im Training häufig die Lactatkonzentration des Blutes gemessen. Abb. 3 zeigt die Sauerstoff-Aufnahme und den Sauerstoffbedarf eines Sportlers während einer Fahrradergometrie. An der anaeroben Schwelle herrscht gerade noch der LactatSteady-State-Zustand. Dies ist die maximale Leistung, die erreicht werden kann, ohne dass sich die Lactatkonzentration des Blutes um mehr als 1 mmol/L verändert. Bildung und Abbau von Lactat halten sich die Waage. Oberhalb der Schwelle tritt also vermehrt Milchsäuregärung ein, um den Energiebedarf Abb. 4: Sauerstoffaufnahme während einer zu decken. Dadurch reichert sich Lactat in Fahrradergometrie den Muskelzellen an und das Zellmilieu wird sauer, wodurch der Muskel ermüdet und der Sportler seine maximale Leistung nicht mehr abrufen kann. Abb. 4 zeigt die Blutlactatkonzentration in Abhängigkeit von der Laufgeschwindigkeit auf einem Laufband. In Ruhe liegt der Lactatwert zwischen 0,5 - 2,5 mmol/L, maximal können ca. 20 mmol/L erreicht 17 werden6. Die aerobe Schwelle ist der Punkt, bis zu dem der Sportler seinen Energiebedarf durch aerobe Energiebereitstellung decken kann. Abb. 5: Blutlactatwert in Abhängigkeit von der Laufgeschwindigkeit Proband 1: wenig trainiert, Proband 2: gut trainiert, Proband 3: Leistungssportler AS: Anaerobe Schwelle, ANS: Anaerobe Schwelle Diese vermehrte Ausschüttung von Lactat wird von dem Kohlensäure/Hydrogencarbonatpuffer abgepuffert. Im Versuch wird eine relativ große Menge Milchsäure zugesetzt, so dass es hier einige Zeit dauert, bis ein pH-Wert von 7,4 wieder erreicht wird. Da im Körper die Milchsäure zwar schnell, aber nicht schlagartig entsteht und die Menge kleiner ist, kann der Blutpuffer die Säure abfangen. Aus unterschiedlichen Gründen z.B. Einnahme bestimmter Medikamente, oder eben auch durch eine Zunahme der anaeroben Stoffwechselvorgänge durch intensives Sporttreiben, kann es jedoch passieren, dass die Milchsäure nicht abgefangen werden kann und der pH-Wert des Blutes abfällt. In diesem Fall spricht man von einer Laktatazidose. Sie kann zu Schock, bis hin zu Nierenversagen führen. 6 Hoos, O.; Vorlesung Trainingswissenschaften SS 06, Philipps-Universität Marburg, Fachbereich Sport 18 Nährstoffe „Nährstoffe sind die Substrate, die dem Organismus als „Brenn- und Funktionsstoffe“ zum Betrieb der abhängigen Zell- und Gewebe-spezifischen Aufgaben dienen“7. Sofern diese Nährstoffe als Katalysatoren in den Energiestoffwechsel eingebunden sind, steigt der Nährstoffbedarf mit steigendem Energiebedarf an. Die wichtigsten Nährstoffe sind die Kohlenhydrate, Proteine, Lipide, Vitamine, Mineralstoffe und Wasser und müssen durch die Nahrung zugeführt werden, weil sie vom Körper selbst nicht synthetisiert werden können. Die Kohlenhydrate wurden bereits ausführlich besprochen. Proteine sind Makromoleküle, die aus mehr als 100 Aminosäuren bestehen. Sie sind der Grundbaustein aller menschlichen Zellen. Neben ihrer strukturverleihenden Eigenschaft sind sie auch für den Transport verschiedener Substanzen, als Ionenpumpen oder als Katalysatoren tätig. Die vier wichtigsten Proteine sind Aktin, Myosin, Kollagen und Hämoglobin. Aktin und Myosin kommen in den Muskelzellen vor und sind für die Kontraktion dieser verantwortlich. Kollagen findet man vor allem im Binde- und Stützgewebe, dem sie ihre Struktur verleihen. Lipide sind sehr energiereich und dienen sowohl als Energielieferanten aber vor allem auch als Energiereserven. Der Körper wird durch die Fette vor Verletzungen geschützt und außerdem vor zu schneller Auskühlung bewahrt. Da z.B. einige Vitamine (A, D und E) fettaber nicht wasserlöslich sind, sind Fette am Vitaminstoffwechsel beteiligt. Unterschieden werden müssen die gesättigten und ungesättigten Fettsäuren. Während die gesättigten Fettsäuren weniger wichtig sind, sind für den Menschen vor allem die ungesättigten von Bedeutung. So hemmen beispielsweise die Omega-3-Fettsäuren die Blutgerinnung und wirken so Gefäßverschlüssen vor. Vitamine sind lebensnotwendig für den Menschen und häufig als Katalysatoren bei Stoffwechselprozessen im Körper beteiligt. Unterschieden werden die fettlöslichen und die wasserlöslichen Vitamine. Fettlöslich sind z.B. die Vitamine A, D und E, wasserlöslich sind z.B. Vitamin C, B1, B2, B6, und B12. Vitamin C wird im nächsten Versuch näher betrachtet. 7 Schmidt, R. F., Lang, F., Thews, G., Physiologie des Menschen mit Pathophysiologie, S. 826 19 Mineralstoffe werden unterschieden in Mengenelemente und Spurenelemente. Mengenelemente werden in größeren Mengen als 50 mg/kg Körpergewicht am Tag benötigt. Zu ihnen gehören Calcium, Magnesium, Phosphor, Natrium, Kalium, Chlor und Schwefel. Sie haben keine einheitliche physiologische Bedeutung, sind insgesamt aber am Aufbau, der Erhaltung und der Erneuerung von Knochen beteiligt. Ebenso wirken sie bei der Erregungsleitung im Nervensystem, regulieren den Wasserhaushalt und den osmotischen Druck und den pH-Wert des Blutes. Die Spurenelemente wie z.B. Eisen, Iod, Kupfer, Zink oder Aluminium werden in geringeren Mengen als 50 mg/kg Körpergewicht am Tag benötigt. Ihre Aufgaben sind zu einem Großteil noch ungeklärt. Eisen z.B. ist Bestandteil des Hämoglobins und Iod ist am Aufbau des Hormons Tyroxin in der Schilddrüse beteiligt. Die Tatsache, dass der Mensch zu mehr als 60 % aus Wasser besteht, verdeutlicht, wie essentiell Wasser ist. Dieses ist vor allem auch in Muskeln vorhanden. Beim Sporttreiben wird vermehrt Wasser durch den Schweiß ausgeschieden, weshalb der Mensch in diesen Situationen viel trinken sollte. Da durch Schweiß auch Mineralstoffe verloren gehen, müssen auch diese von außen zugeführt bzw. nachgefüllt werden. Aus diesem Grund ist es zu empfehlen, beim Sporttreiben spezielle Sportgetränke zu sich zu nehmen, die dem Körper neben dem Wasser auch Kohlenhydrate, Vitamine und Mineralstoffe nachliefern. Da die Nährstoffe in diesem Vortrag nicht alle behandelt werden können, beschäftigt sich der nächste Versuch nur mit einem Beispiel, dem Vitamin C: Modellversuch 2: Reduzierende Wirkung von Vitamin C 1. Zeitbedarf Vorbereitung: 2 Min. Durchführung: 2 Min. Nachbereitung: 1 Min. 20 2. Chemikalien Name Methylenblau L-Ascorbinsäure Wasser Summenformel C16H18ClN3S C6H8O6 H2O Gefahrensymbol Xn - R-Sätze S-Sätze 22 - 22-24/25 - Einsatz in der Schule S1 S1 S1 Gefahrensymbole 3. Materialien/Geräte Reagenzglasständer, 2 Reagenzgläser, Spatel, Magnetrührer, Becherglas 4. Versuchsaufbau on on 5. Versuchsdurchführung Im ersten Reagenzglas löst man eine Spatelspitze L-Ascorbinsäure in wenig Wasser. In das zweite Reagenzglas gibt man eine Spatelspitze Methylenblau und löst auch dieses in Wasser. Anschließend gibt man die Lösung aus dem ersten in das zweite Reagenzglas und stellt die Lösung in ein Wasserbad. 21 6. Beobachtung Beim Lösen der Ascorbinsäure in Wasser entsteht eine farblose Lösung. Das Methylenblau in Wasser ergibt eine tiefblaue Lösung. Beim Zusammengeben der Lösungen entsteht ebenfalls eine blaue Lösung, die sich im Wasserbad zusehends entfärbt. 7. Entsorgung Stark verdünnt kann die Lösung in den Ausguss gegeben werden. 8. Fachliche Analyse Bei dieser Reaktion handelt es sich um eine Redoxreaktion. Die Ascorbinsäure (Vitamin C) wird unter Abspaltung von zwei Protonen und Freigabe von zwei Elektronen zur Dehydroascorbinsäure oxidiert: - 2 H+ HO O O HO +1 HO HO O - -2e +1 OH Ascorbinsäure O HO +2 +2 O O Dehydroascorbinsäure Das Methylenblau nimmt die beiden Protonen und Elektronen auf und wird dadurch reduziert. Wie diese Reduktion genau aussieht, ist bisher noch nicht bekannt. Jedenfalls geht das Methylenblau in die Leukoform über. Diese besitzt kein durchgehendes πElektronensystem mehr und ist damit farblos. H + 2 H+ N + 2 e- +2 S Cl - Methylenblau Cl N+ N - +1 +1 +2 N N S + N H Leukoform 22 Durch diesen Versuch wird die reduzierende Wirkung der HO Ascorbinsäure veranschaulicht. Die Ascorbinsäure ist wasserlöslich HO * * O O und eine mittelstarke vinyloge Säure mit zwei stereogenen HO Kohlenstoffatomen. Nur die L-Ascorbinsäure zeigt biologische Aktivität. Sie zersetzt sich unter Einwirkung von Sauerstoff, Licht, OH L-Ascorbinsäure Hitze und auch Schwermetallionen wie z.B. Kupfer. Im Körper ist sie vor allem als Radikalfänger oder als Reduktionsmittel tätig. So verhindert sie im Körper bei einigen Reaktionen als Cofaktor die Oxidation von Fe2+ zu Fe3+ im Zentrum des jeweiligen Enzyms. Ein Vitamin C-Mangel führt dazu, dass das Strukturprotein Kollagen nicht mehr hydroxyliert werden kann. Das Enzym Prolyl-Hydroxylase besitzt im Zentrum ein zweiwertiges Eisenatom. Vitamin C wirkt als Reduktionsmittel so, dass dieses Eisenatom zweiwertig bleibt und nicht oxidiert wird. Wenn kein Vitamin C zur Verfügung steht, wird Kollagen synthetisiert, das so gut wie kein Hydroxyprolin enthält. Diese Mangelerscheinung an Vitamin C wird als Skorbut bezeichnet. Symptome sind brüchige Blutgefäße, Zahnfleischbluten bis hin zu Zahnausfall und schlecht heilende Wunden sowie Blutungen der Haut. Erkrankte Menschen leiden an Fieber und Durchfall und können schließlich an Herzmuskelschwäche sterben. Für Sportler ist eine ausreichende Vitamin C-Versorgung zum einen natürlich für die Synthese von Kollagen wichtig. Ein gesundes Binde- und Stützgewebe beugt Verletzungen durch z.B. Umknicken vor. Zum anderen atmen Sportler mehr Sauerstoff ein und damit mehr Sauerstoffradikale. Diese Radikale können in den Zellwänden durch Kettenreaktionen große Schäden anrichten. Da in größeren Höhen vermehrt Radikale zu finden sind, ist es ratsam während eines Höhentrainings besonders auf die Vitamin C-Zufuhr zu achten, damit dieses die Radikale abfängt. Mit zunehmendem Alter nimmt die antioxidative Wirkung der Enzyme im Körper ab, wodurch vermehrt Vitamin C als Antioxidans diesen Mangel kompensieren kann. Kann Vitamin C, so wie alle anderen Nährstoffe auch, nicht in ausreichendem Maß durch die tägliche Nahrung aufgenommen werden, so bieten sich Nahrungsergänzungsmittel an, den Mangel an Nährstoffen auszugleichen. 23 Viele Sportler konsumieren Nahrungsergänzungsmittel und erhoffen sich eine Leistungssteigerung, eine Steigerung der Regeneration und/oder eine verbesserte Immunabwehr. Sie haben aufgrund ihres erhöhten Energiebedarfs einen erhöhten Nährstoffbedarf und versuchen diesen durch bestimmte Präparate auszugleichen. Es ist bewiesen, dass eine leichte Unterversorgung bereits die Leistungsfähigkeit und auch die Gesundheit eines Menschen beeinträchtigen kann. Ein Athlet kann so fleißig trainieren wie er will, wenn sein Nährstoffbedarf nicht gedeckt wird, zeigen sich keine Trainingsfortschritte. Außerdem kann es dazu kommen, dass man für Infekte anfälliger wird. Bisher konnte jedoch nicht eindeutig bewiesen werden, ob bestimmte Nahrungsergänzungsmittel wirklich zu einer Leistungssteigerung führen. Es gibt fast für alle Präparate Studien, die dies behaupten und andere, die dies widerlegen. Unterscheiden kann man Nahrungsmittelsupplementierung. zwischen Während durch Nahrungsmittelsubstitution die Substitution lediglich und die verbrauchten Nährstoffreserven wieder aufgefüllt werden, werden dem Körper durch die Supplementierung Nährstoffe in größeren Mengen zugeführt. Nach dem Europarat ist eine solche übermäßige Einnahme bereits Doping. Da jedoch nicht nachgewiesen werden kann, ob die Menge an Nährstoffen über die Nahrung oder aber über Supplemente aufgenommen worden ist, ist die Einnahme solcher Substanzen legal. Beliebt sind bei Sportlern vor allem Nahrungsergänzungsmittel, die Kreatin oder die Aminosäure Glutamin enthalten. Demonstration 2: Nachweis von Glutamin in Sportgetränken 1. Zeitbedarf Vorbereitung: 10 Min. Durchführung: 60 Min. Nachbereitung: 1 Min. 24 2. Chemikalien Name Summenformel Glutaminhaltiges Sportgetränk Gefahrensymbol - R-Sätze S-Sätze - - Einsatz in der Schule S1 z.B. Power Bar® Performance Sports Drink L-Valin C5H11NO2 - - - S1 L-Leucin C6H13NO2 - - - S1 Wasser n-Butanol H2O C4H9OH Xn CH3COOH C 7/9-13-2637/39-46 23.2-26-45 S1 S1 Essigsäure w=1 Ninhydrin Ethanol Petroleumbenzin 10-22-37/3841-67 35 C9H6O4 C2H5OH - Xn F F, Xn, N 22-36/37/38 11 11-38-48/2051/53-62-6567 26-36 7-16 36/37-6162 S1 S1 S1 S1 Gefahrensymbole 3. Materialien/Geräte Spatel, 4 Bechergläser, DC-Karte, Bleistift, 3 Kapillaren, DC-Kammer, Pipette, Trockenschrank, Zerstäuber 4. Versuchsaufbau 25 5. Versuchsdurchführung Man löst in je einem Becherglas eine Spatelspitze L-Valin und L-Leucin, sowie eine Spatelspitze des Getränkepulvers in Wasser. Anschließend versieht man die DC-Karte ca. einen Zentimeter vom unteren Rand entfernt mit einer waagerechten Startlinie und zeichnet in gleichmäßigen Abständen drei Punkte darauf. Auf den ersten und den dritten gibt man mit Hilfe einer Kapillare je einen Tropfen der beiden Aminosäuren, auf den mittleren gibt man zwei Tropfen des Sportgetränks. Danach wird die DC-Karte in die DC-Kammer gestellt, in der sich ein Gemisch aus 3 mL Butanol, 1 mL Essigsäure und 1 mL Wasser befindet. Wenn das Laufmittel dir Karte zu ca. ¾ hinauf gelaufen ist, nimmt man sie aus der Kammer heraus und trocknet sie. Während des Trocknens setzt man eine Ninhydrin-Lösung an. Diese besteht aus 4 mL Ethanol, 0,5 mL Essigsäure und 100 mL Petroleumbenzin. In dieser Lösung werden 0,5 g Ninhydrin gelöst. Man füllt die Reagenz in einen Zerstäuber und besprüht die trockene DCKarte mit der Lösung. Anschließend legt man die DC-Karte für 10 Min. in den Trockenschrank bei ca. 90 °C. 6. Beobachtung Die Aminosäure-Lösungen sind farblos, während das Sportgetränk orange ist. Nachdem die DC-Karte aus der Kammer herausgenommen und getrocknet wurde, ist auf Höhe des zweiten Startpunktes an der oberen Laufgrenze ein schwach orangefarbener Rückstand zu sehen. Erst nachdem die DC-Karte mit der Ninhydrin-Lösung besprüht und aus dem Trockenschrank genommen wird, sind violette Farbklekse auf der DC-Karte zu sehen. Links auf der Karte ist Valin zu sehen, rechts Leucin. In der Mitte sind die Aminosäuren, die sich in dem Sportgetränk befinden. Dort ist eine Markierung auf Höhe des Valins und eine auf Höhe des Glycins zu sehen. Außerdem ist unterhalb eine Abb. 6: DC von Valin (links), Leucin (rechts) und eines Sportgetränkes (Mitte) Färbung zu erkennen. 26 7. Entsorgung Die Aminosäurelösungen und die Getränkepulvers kann in den Ausguss gegeben werden. Die Lösung aus der DC-Kammer und Reste der Ninhydrin-Lösung werden neutral in den Behälter für organische Lösungsmittel gegeben. 8. Fachliche Analyse In dem Sportgetränk befinden sich die drei Aminosäuren L-Valin, L-Leucin und L-Glutamin. Da die freie Aminosäure Glutamin nicht zu Verfügung stand, erfolgt der Nachweis über eine Dünnschichtchromatographie, in der die beiden anderen Aminosäuren Valin und Leucin direkt nachgewiesen werden und die andere Färbung auf Glutamin schließen lässt. An den Strukturformeln ist zu erkennen, dass die Alkylkette vom Valin zum Leucin länger wird. O O OH NH2 L-Valin O OH NH2 L-Leucin O OH H2N NH2 L-Glutamin Dies führt dazu, dass die elektronenziehende Eigenschaft der Hydroxidgruppe abnimmt und dadurch das Leucin noch unpolarer ist als das Valin. Auf die Chromatographie bezogen bedeutet das, dass das Leucin als unpolareres Molekül weiter mit dem Laufmittel mit wandert, als das Valin. Glutamin ist eine polare Aminosäure und wandert am schlechtesten mit dem unpolaren Laufmittel mit. Auf der DC-Karte sind die Aminosäuren so erst einmal nicht zu erkennen. Aus diesem Grund werden sie mit Ninhydrin versetzt, um schließlich als violetter Ruhemanns-Purpur sichtbar zu werden. Ninhydrin ist Indan-1,2,3-trion-Hydrat und liegt im Gleichgewicht mit dem Indan-1,2,3-trion vor. 27 O O OH + H2O O OH O O Indan-1,2,3-trion-Hydrat Indan-1,2,3-trion (Ninhydrin) Im ersten Schritt greift das freie Elektronenpaar des Stickstoffatoms der Aminosäure das Ninhydrin am Carbonyl-Kohlenstoffatom an. Die Doppelbindung des Sauerstoffatoms bricht auf und dieses bindet ein Wasserstoffatom des Amins. Auch das zweite Wasserstoffatom des Amins geht an die Hydroxidgruppe über, wodurch das Ninhydrin zum Imin kondensiert. H O N O O + O H H OH O H OH R O N O R O - H2O O H O O N R O Nun spaltet sich Kohlenstoffdioxid ab und es folgt eine Hydrolyse. Dabei greift das Sauerstoffatom des Wassers das dem Stickstoff benachbarte Kohlenstoffatom an. Dadurch bricht die Doppelbindung zwischen dem Stickstoffatom und dem Kohlenstoffatom auf und das Stickstoffatom greift sich ein Wasserstoffatom des Wassers. Außerdem greift das Sauerstoffatom des Ketons das Wasserstoffatom des benachbarten Kohlenstoffatoms an, wodurch eine Kohlenstoff-Kohlenstoff-Doppelbindung und eine Hydroxidgruppe entstehen. Durch die Abspaltung der Carbonylgruppe COR entsteht ein Zwischenprodukt. 28 O O H O O H - CO2 N N R R O O + H2O OH O H H R N O O R N + H O H O + H OH NH2 - COR O Dieses Zwischenprodukt kondensiert anschließend mit einem weiteren Molekül Ninhydrin unter Einwirkung von Hitze zum violetten Ruhemanns-Purpur. OH O NH2 + O O O T - H2O OH O N O O Ruhemanns-Purpur Ruhemanns Purpur ist aufgrund der konjugierten Doppelbindungen und den damit verbundenen delokalisierten π-Elektronen blau bis violett gefärbt. Der Name stammt von seinem Entdecker Siegfried Ruhemann, der 1911 erkannte, dass Aminosäuren mit Ninhydrin eine blauviolette Färbung ergeben. 29 Glutamin ist eine proteinogene nicht essentielle Aminosäure, das heißt, sie ist ein Baustein der Proteine und kann vom Körper selber aus α-Ketoglutarat über Glutamat synthetisiert werden. Sie kommt zu einem Großteil ebenso im Blutplasma wie in den Muskelzellen vor. Glutamin fördert die Synthese von neuem Muskelgewebe, indem es die Wassereinlagerung in der Zelle regelt, wodurch die Nukleinsäuren und die Proteine hydratisiert werden und die Synthese dieser beiden Substanzen zunimmt. Nebenbei wird der Abbau der Proteine und damit ein Abbau von Muskeln verhindert. Einige Studien haben gezeigt, dass Glutamin insbesondere für sich schnell vermehrende Zellen, wie z.B. die des Immunsystems, unerlässlich sind. Viele Sportler nehmen Glutamin in Form von Nahrungsergänzungsmitteln zu sich, um den Glutamingehalt im Körper wieder aufzufüllen. Denn nur, wenn der Körper ausreichend mit Glutamin versorgt ist, können Muskeln aufgebaut werden. Nach sportlicher Belastung wirkt es außerdem einem Muskelabbau entgegen, wodurch eine effektivere Regeneration erzielt wird. Versuch 3: Nachweis von Kreatin in Sportgetränken 1. Zeitbedarf Vorbereitung: Durchführung: Nachbereitung: 30 2. Chemikalien Name Kreatinhaltiges Sportgetränk Salzsäure (c = 2 mol/L) PikrinsäureLösung (c = 0,1 mol/L) Natronlauge w = 0,15 Wasser Summenformel - Gefahrensymbol - R-Sätze S-Sätze - - Einsatz in der Schule S1 HCl - - - S1 (NO2)3C6H2OH T 1-423/24/25 28.1-3536/37-45 S1 NaOH C 35 S1 H2O - - 26-37/3945 - S1 Gefahrensymbole 3. Materialien/Geräte Reagenzglasständer, Reagenzglas, Pipette, Magnetrührer, Becherglas 4. Versuchsaufbau on on 31 5. Versuchsdurchführung Man löst eine Spatelspitze Kreatin in einem Reagenzglas in Wasser. Anschließend gibt man 5 Tropfen Salzsäure hinzu und erwärmt die Lösung im Wasserbad bei 70 °C. Zum Schluss gibt man 5 mL Pikrinsäurelösung und so viel Natronlauge hinzu, bis die Lösung alkalisch ist. 6. Beobachtung Das Sportgetränk ist farblos. Durch Zugabe der gelben Pikrinsäurelösung (Abb. rechts) färbt sich auch das Sportgetränk gelb. Beim Zutropfen der Natronlauge erfolgt ein leichter Farbwechsel zu einem dunkleren Gelbton. Nachdem das Reagenzglas noch einmal im Wasserbad erwärmt wurde, ist ein deutlicher Farbwechsel zu sehen. 7. Entsorgung Abb. 7: Nachweis von Kreatin links Kreatinnachweis, rechts Pikrinsäurelösung Die Lösung wird neutral im Behälter für organische Lösungsmittel entsorgt. 8. Fachliche Analyse Durch die Säure wird das Kreatin zum Kreatinin protoniert. Beide Moleküle sind resonanzstabilisiert. Die positive Ladung kann über alle drei Stickstoffatome delokalisiert werden, die negative Ladung über die beiden Sauerstoffatome. Hier ist nur eine mögliche mesomere Grenzformel gezeichnet. H H N O H2N - + H+ O Kreatin + H2N N + H N - H+ O + H2O N Kreatinin 32 Nun spaltet sich das blau eingezeichnete Proton ab. An dem Kreatinin bleibt eine negative Ladung zurück, die im nächsten Schritt in einer nucleophilen aromatischen Substitution die Pikrinsäure angreift. Unter Abspaltung der Hydroxid-Gruppe, welche mit dem Proton zu Wasser reagiert, entsteht der orange Meisenheimer-Komplex. NH H N OH H N NO 2 O 2N + NH N O H O + NaOH N H NO 2 O 2N + H2O H NO 2 NO 2 Meisenheimer-Komplex Kreatin wird zum einen in der Leber und in der Bauchspeicheldrüse aus den Aminosäuren Arginin und Glycin synthetisiert und zum anderen dem Körper über Fleischverzehr zugeführt. Ein erwachsener Mann hat ca. 120 g Kreatin im Körper, wovon sich 95 % im Muskelgewebe befinden8. Bis zu 80 % liegen wiederum in Form des energiehaltigen Kreatinphosphats vor, welches neben dem ATP und dem ADP zu den energiereichsten Phosphaten im Körper zählt. Wenn der ATP-Vorrat aufgrund von sportlicher Belastung und anderen körperlicher Anstrengung aufgebraucht ist, OH O P H N OH O H2N - N + O Kreatinphosphat kommt das Kreatinphosphat zum Einsatz, indem es sich von einem Phosphatrest trennt und so die Synthese von ATP in Gang hält. Sind z.B. durch die Milchsäuregärung vermehrt H+-Ionen in den Muskelzellen vorhanden, so wird das Gleichgewicht weit nach rechts verschoben, das heißt, dass Kreatinphosphat bei anaerober Belastung zur Energiebereitstellung herangezogen wird. Ohne Kreatinphosphat würde der Muskel unter anaeroben Belastungen nur drei bis vier maximale Muskelkontraktionen ausführen, was in etwa einer Aktivität von ein bis zwei Sekunden entspricht. Durch die Energiebereitstellung mit Hilfe des Kreatinphosphats kann diese 8 Holfeld, M., Chemie und Sport, S. 19 33 Spanne auf sechs bis acht Sekunden erweiter werden, was in etwa sechzehn Muskelkontraktionen entspricht. Während der Erholungsphasen wird das Kreatin im Muskelgewebe wieder aufgebaut, wodurch nach relativ kurzen Pausen eine ähnlich kurze maximale Belastung möglich ist. Kreatin erhöht neben der Maximalkraft also auch die Regenerationsfähigkeit. Dadurch kann der Trainingsumfang gesteigert werden. Bei Bodybuildern ist diese Substanz so beliebt, weil sie für eine Einlagerung von Wasser in den Muskelzellen verantwortlich ist und der Muskel sich dadurch um ein bis zwei Prozent vergrößert wodurch eine optische Verbesserung erreicht wird. Die beiden Beispiele Glutamin und Kreatin zeigen, dass die Wirkung einiger sogenannter „Nahrungsergänzungsmittel“ oder gar „Supplemente“ die Grenze zum Doping erreicht, weil diese leistungssteigernd wirken. Leistungssportler sollten bei der Einnahme solcher erlaubter Substanzen auf das Herstellungsland achten. Viele der für die Herstellung benutzten großtechnischen Maschinen werden für mehrere Substanzen verwendet, die die späteren Substanzen verunreinigen können. Dem deutsche Ringer Alexander Leipold beispielsweise wurde bei der Olympiade in Sidney 2000 die Goldmedaille nachträglich aberkannt, weil bei einer Dopinganalyse die verbotene Substanz Nandrolon gefunden wurde. Die Menge war jedoch so gering, dass davon keine Leistungssteigerung zu erwarten war. Das Kölner DopingLabor untersuchte daraufhin alle von Leipold konsumierten Nahrungsergänzungsmittel und fand in einer seiner Kreatin-Tabletten Spuren von Nandrolon. Dopingkontrollen gibt es seit den 60er Jahren. Zu dieser Zeit kam es vermehrt zu Todesfällen von Radrennfahrern. Untersuchungen ergaben, dass sie fast alle Medikamente oder spezielle Nahrungsergänzungsmittel zu sich genommen hatten. Daraufhin stellte der Internationale Radsportbund (UCI) und das Internationale Olympische Komitee (IOC) erste Regeln auf. Die vom IOC aufgestellte Definition von Doping lautet: „Doping ist verboten. Doping ist die Anwendung von verbotenen Wirkstoffen bzw. verbotenen Methoden. Eine Dopingliste führt die verbotenen Wirkstoffgruppen und verbotenen Methoden auf.“9 Diese Dopingliste (s. Tabelle 1) wird jährlich von der Welt-Anti-Dopingagentur (WADA) aufgestellt. Eine Erklärung, warum die Substanzen verboten sind, wird nicht gegeben. 9 Schänzer, W., Thevis, M., Doping-Analytik, S. 3 34 Tabelle 1: Dopingliste der WADA, Stand 1.1.2010 SUBSTANZEN UND METHODEN, DIE ZU ALLEN ZEITEN (IN UND AUSSERHALB VON WETTKÄMPFEN) VERBOTEN SIND S1. ANABOLE SUBSTANZEN anabol-androgene Steroide (AAS) a. Exogene* AAS z.B. Nandrolon b. Endogene** AAS z.B. Testosteron andere anabole Substanzen z.B. Tibolon S2. PEPTIDHORMONE, WACHSTUMSFAKTOREN UND VERWANDTE SUBSTANZEN z.B. Insuline, Wachstumshormone, Blutplättchenpräparate S3. Β-2-AGONISTEN S4. HORMON-ANTAGONISTEN UND –MODULATOREN S5. DIURETIKA UND ANDERE MASKIERUNGSMITTEL z.B. Albumin VERBOTENE METHODEN M1. ERHÖHUNG DES SAUERSTOFFTRANSFERS z.B. Blutdoping M2. CHEMISCHE UND PHYSIKALISCHE MANIPULATION z.B. Austausch von Urin M3. GENDOPING IM WETTKAMPF VERBOTENE SUBSTANZEN UND METHODEN S6. STIMULANZIEN a: Nicht-spezifische Stimulanzien z.B. Amphetamin b: Spezifische Stimulanzien z.B. Ephedrin S7. NARKOTIKA z.B. Morphin S8. CANNABINOIDE z.B. Haschisch S9. GLUCOCORTICOSTEROIDE BEI BESTIMMTEN SPORTARTEN VERBOTENE SUBSTANZEN P1. ALKOHOL z.B. im Motorsport, Schießsport P2. BETABLOCKER z.B. im Motorsport, Schießsport 35 Je nachdem auf welche Substanz ein Athlet überprüft werden soll, wird von diesem eine Urin- oder eine Blutprobe genommen. Amphetamin beispielsweise wird unverändert über den Urin ausgeschieden, Nandrolon wird im Körper verstoffwechselt und ist in den verschiedenen Phasen der Verstoffwechselung durch verschiedene Abbauprodukte im Blut nachzuweisen. Die Identifizierung verbotener Substanzen muss durch anerkannte wissenschaftliche Methoden erfolgen, denn sie muss einer juristischen Überprüfung standhalten. Neben der Gaschromatographie-Massenspektrometrie kommen auch die Flüssigkeitschromatographie in Kombination mit der Massenspektrometrie zum Einsatz. Außerdem gibt es Nachweismethoden, die auf selektiven Antigen-Antigen-Reaktionen beruhen. Leistungssportler müssen genau darauf achten, welche Medikamente oder Nahrungsergänzungsmittel sie zu sich nehmen. Ebenso müssen sie berücksichtigen, dass sie auch z.B. durch Salben verbotene Substanzen in den Körper aufnehmen können. Das Erkältungsmittel Wick®-MediNait beispielsweise enthält das auf der Dopingliste stehende Ephedrin. Im nachfolgenden Versuch wird dieses qualitativ nachgewiesen. Versuch 4: Nachweis von Ephedrin 1. Zeitbedarf Vorbereitung: 2 Min. Durchführung: 2 Min. Nachbereitung: 1 Min. 36 2. Chemikalien Name Erkältungsmittel Wick®-MediNait KupfersulfatLösung w = 0,02 Natronlauge c = 3 mol/L Wasser Summen- Gefahren- R-Sätze S-Sätze Einsatz in formel symbol - - - - S1 CuSO4 Xn, N 22-60-61 S1 NaOH C 22-36/3850/53 34 S1 H2O - - 26-37/3945 - der Schule S1 Gefahrensymbole 3. Materialien/Geräte Reagenzglasständer, Reagenzglas, Pipette 4. Versuchsaufbau 5. Versuchsdurchführung Man gibt in das Reagenzglas nacheinander 2 mL Wick®-MediNait, 5 mL Kupfersulfat-Lösung und 5 mL Natronlauge und schüttelt gut durch. 37 6. Beobachtung Nach der Zugabe der Die Kupfersulfat-Lösung Natronlauge färbt einem grüne sich das gelb- Wick®-MediNait Zugabe führt der zu Farbumschlag nach blau. grün. Abb. 9: Wick®MediNait, Kupfersulfat und Natronlauge Abb. 8: Wick®MediNait und Kupfersulfat 7. Entsorgung Die Lösungen werden neutral in den Behälter für Schwermetalle gegeben. 8. Fachliche Analyse Ephedrin gehört zur Gruppe Stimulanzien. Diese sind strukturell mit den körpereigenen Hormonen Adrenalin und Noradrenalin verwandt. Die Stimulanzien wirken auf das zentrale motorische und Aktivität, OH HO HO HN HO NH2 HO Der bekannteste Vertreter ist Amphetamin. Nervensystem OH der erhöhen die wodurch die Adrenalin Noradrenalin OH HN H2N natürliche Ermüdung unterdrückt wird. Ephedrin Amphetamin 38 Ephedrin kommt in Pflanzen der Gattung Ephedrea vor und wird als Wirkstoff in einigen wenigen Medikamenten, wie z.B. Wick®-MediNait eingesetzt. Es wirkt blutdrucksteigernd, herzstimulierend und bronchienerweiternd, weshalb es gegen Bluthochdruck, chronische Bronchitis, zur Abschwellung der Schleimhäute bei Schnupfen und gegen Asthmaanfälle verabreicht wird. Außerdem wird die Proteinbiosynthese gesteigert bzw. die Proteinabbaurate gesenkt. Dadurch erhöht sich die Körpertemperatur, wodurch mehr Fett verbrannt wird. In dem Versuch wird das Ephedrin nachgewiesen, indem es mit Kupfersulfat und Natronlauge versetzt wird und einen blau-violetten Kupferkomplex bildet. Da das Wick®MediNait eine starke grüne Eigenfarbe aufweist, entsteht hier ein blauer Komplex. N H N N 2- Cu 2 OH O + CuSO4 + 2 NaOH O + Na2SO4 + 2 H2O blau-violetter Kupferkomplex Ausblick auf sportartspezifische Versuche am Beispiel des Tauchens Bisher wurden Versuche behandelt, die allgemeine Bedeutung in den Stoffwechselvorgängen des Menschen haben. Diese finden sowohl in den Körpern von „Nichtsportlern“, als auch in denen von Leistungssportlern statt. Im Folgenden wird am Beispiel der druckabhängigen Löslichkeit von Kohlenstoffdioxid gezeigt, dass es auch Versuche gibt, die sportartspezifisch bedeutende Vorgänge aufzeigen. In Versuch 2, der Kompensation einer metabolischen Azidose wurde bereits über die Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid geschrieben. Diese wird mit folgendem Versuch veranschaulicht: 39 Versuch 5: Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid 1. Zeitbedarf Vorbereitung: 5 Min. Durchführung: 2 Min. Nachbereitung: 2 Min. 2. Materialien/Geräte Stativmaterial, Saugrohr mit Stopfen, Tonscherben, Kolbenprober, PVC-Schlauch, Mineralwasser 3. Versuchsaufbau mL Tonscherben 4. Versuchsdurchführung Man füllt das Saugrohr zu 1/3 mit Tonscherben und gibt anschließend Mineralwasser hinzu, bis die Tonscherben alle von der Flüssigkeit bedeckt sind. Nun verschließt man das Saugrohr mit dem Stopfen. Nachdem man für ca. eine Minute die Tonscherben beobachtet hat, drückt man den Kolbenprobe um ein Volumen von ca. 30 mL hinein. Danach reduziert man langsam wieder den Druck. Während dieser beiden Vorgänge beobachtet man die Tonscherben genau. 40 5. Beobachtung Nachdem das Mineralwasser in das Saugrohr gefüllt wurde ist eine deutliche Gasblasenentwicklung zu beobachten. Die Gasblasen haften an den Tonscherben. Erhöht man den Druck mit dem Kolbenprober lässt die Gasentwicklung nach. Es sind nur noch vereinzelte Blasen an einigen Tonscherben zu beobachten. Sobald der Druck nachlässt steigen wieder Gasblasen auf. 6. Entsorgung Die Lösung kann in den Ausguss gegeben werden. 7. Fachliche Analyse Die Tonscherben habe eine sehr poröse Oberfläche, an der sich die Gasblasen des Mineralwassers im Gegensatz zur sehr glatten Oberfläche des Glases gut ausbilden können. Im Inneren einer Mineralwasserflasche ist Kohlenstoffdioxid in Wasser gelöst. Die Flüssigkeit steht in verschlossenem Zustand unter relativ großem Druck, wodurch der Anteil des im Wasser gelösten Kohlenstoffdioxids groß ist. Das Gleichgewicht liegt weit auf der rechten Seite. Ein kleiner Teil des gelösten Kohlenstoffdioxids reagiert mit dem Wasser zu Kohlensäure. Es ist jedoch nicht ganz richtig zu sagen, dass Mineralwasser Kohlensäure enthält. Das, was der „normale“ Verbraucher als Kohlensäure bezeichnet ist eigentlich Kohlenstoffdioxid, welches von der gelösten in die gasförmige Phase übergeht und im Wasser als Gasblasen aufsteigt. Dieser Versuch veranschaulicht die Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid. Am Anfang herrscht „Normaldruck“ von ca. 1 bar. Das gelöste Kohlenstoffdioxid geht in die gasförmige Form über und steigt in der Flüssigkeit auf. Dieser Vorgang wird mit Hilfe der 41 Tonscherben sichtbar gemacht, an denen sich die Blasen gut ausbilden können. Das Kohlenstoffdioxidgas kann in diesem Fall nicht vollständig entweichen, weil das Saugrohr mit einem Stopfen verschlossen ist. Wird mit Hilfe des Kolbenprobers nun der Druck erhöht gehen die gasförmigen Kohlenstoffdioxidmoleküle wieder in die flüssige Phase über. Das Gleichgewicht der obigen Gleichung wird von links nach rechts verschoben. Außerdem entsteht zu einem Teil durch eine Reaktion des Kohlenstoffdioxids mit dem Wasser die Kohlensäure. In diesem Zustand sind keine Gasblasen mehr zu beobachten. Wird der Druck nun wieder erniedrigt, wird das Gleichgewicht wieder nach links verschoben und das gelöste Kohlenstoffdioxid geht in die gasförmige Form über, wodurch wieder Gasblasen zu beobachten sind. Diese Abhängigkeit der Löslichkeit von Kohlenstoffdioxid spielt eine besondere Rolle beim Tauchen. Der Sauerstoffpartialdruck in den Alveolen (Lungenbläschen) beträgt unter Normalbedingungen ca. 13,3 kPa, der Kohlenstoffdioxidpartialdruck = 5,3 kPa10. Diese Werte sind ungefähre Angaben und hängen von verschiedenen Faktoren wie z.B. der Höhe ab. Diese Partialdrücke sind von der alveolären Ventilation, also dem Atemzugvolumen minus dem Totraumvolumen (das Volumen, das bei maximaler Ausatmung in der Lunge verbleibt), abhängig. Vor dem Tauchen sieht man viele Laien hyperventilieren, das heißt, sie atmen vor dem Tauchen schnell ein und aus. Der Sauerstoffanteil des Blutes kann dadurch jedoch nicht vergrößert werden, weil das Blut in Ruhe schon zu ca. 98 % mit Sauerstoff gesättigt ist. Durch das viele Ausatmen wird jedoch der Kohlenstoffdioxidanteil verringert. Der dabei ab, der sinkt steigt dementsprechend an. Wie bereits beschrieben bildet ein Teil des Kohlenstoffdioxids im Blut Kohlensäure. Den Atemreiz lösen sowohl sauerstoffempfindliche als vor allem auch kohlenstoffdioxidempfindliche und säureempfindliche Chemorezeptoren aus. Die sauerstoffempfindlichen Rezeptoren sind zu vernachlässigen. Der Atemreiz setzt ein, wenn der Kohlenstoffdioxidanteil und damit der Kohlensäureanteil im Blut einen gewissen Schwellenwert überschreiten. Wenn ein Taucher vor dem Tauchen hyperventiliert, verringert er also den Kohlenstoffdioxidanteil und damit auch den Kohlensäureanteil im Blut und verzögert dadurch das Eintreten des Atemreizes. Sein Körper muss erst einen großen Teil Sauerstoff in Kohlenstoffdioxid umwandeln, bis der Atemreiz wieder einsetzt. Die Gefahr 10 Schmidt, R. F., Lang, F., Thews, G., Physiologie des Menschen mit Pathophysiologie, S. 758 42 besteht nun darin, dass der Taucher durch Muskelaktivität so viel Sauerstoff verbraucht hat, dass sein Gehirn nicht mehr ausreichend versorgt werden kann und der Taucher bewusstlos wird, weil der Kohlenstoffdioxidanteil immer noch zu gering ist, um einen Atemreiz auszulösen. Dies wird auch als „Schwimmbad-Blackout“ bezeichnet, denn es hängt nicht mit der Tauchtiefe, sondern lediglich mit Konzentrationen von Sauerstoff und Kohlenstoffdioxid in den Alveolen zusammen. 43 Schulrelevanz Das Thema dieses Vortrages wird das Interesse der Schülerinnen und Schüler wecken, weil es um Stoffwechselprozesse ihres eigenen Körpers geht. Die Versuche behandeln keine Inhalte, die weit außerhalb ihres Lebens liegen, sondern finden in jedem Moment in ihrem Körper statt. Sportinteressierte werden diese Themen insbesondere faszinieren, weil Chemie nicht nur verwendet wird, wenn ein Mensch eine schwere Krankheit hat, sondern auch, um Nahrungsergänzungsmittel oder sogar leistungssteigernde Mittel zu entwickeln bzw. auch nachzuweisen. Tabelle 2 gibt einen Überblick in welche Lehrplanthemen die Versuche einzuordnen sind. Tabelle 2: Einordnung der Versuche in den hessischen Lehrplan G 8 Versuch Jahrgangsstufe Lehrplanthema Verbrennung von Glucose Qualifikationsphase 2 Naturstoffe: Kohlenhydrate Respiratorische Kompensation einer metabolischen Acidose Qualifikationsphase 3 Massenwirkungsgesetz Puffersysteme Reduzierende Wirkung von Vitamin C Qualifikationsphase Naturstoffe Nachweis von Glutamin Qualifikationsphase 2 Naturstoffe: Aminosäuren Nachweis von Kreatin Qualifikationsphase 2 Naturstoffe: Proteine Nachweis von Ephedrin Qualifikationsphase 2 Naturstoffe (Abschluss des Themas Aminosäuren) Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid Klasse 7 Qualitative Zusammensetzung der Luft Alternativ würde sich eine Unterrichtsreihe zum Thema Chemie im Sport anbieten. Hier könnten auch die Fächer Biologie und natürlich Sport einbezogen werden. So könnte man beispielsweise ein Ausdauertraining machen und mittels Teststäbchen die Lactatwerte im Verlauf bestimmen. 44 Literaturverzeichnis, Abbildungsverzeichnis und Versuchsverzeichnis Literaturverzeichnis Asselborn, W., Jäckel, M., Risch, K. T., Chemie heute – Sekundarbereich II, Baden-Württemberg, Bildungshaus Schulbuchverlage Westermann Schroedel Diesterweg, Braunschweig, 2007 Campbell, N. A., Biologie, 2. Korrigierter Nachdruck, Spektrum Akademischer Verlag Heidelberg, 2000, S. 311f Fachinformationszentrum Chemie, http://www.chemgapedia.de (letzter Zugriff: 5.5.2010, 15:09 Uhr) Faller, A., Schünke, M., Der Körper des Menschen, Einführung in Bau und Funktion, 14., aktualisierte und erweiterte Auflage, Georg Thieme Verlag, Stuttgart, 2004 Geuther, A. Barth, H., Luch, S., Übungen zur Didaktik II, Justus-Liebig-Universität Gießen, Institut für Didaktik der Chemie, Internes Arbeitsmaterial, 1998 Hessisches Kultusministerium, Entwürfe der Lehrpläne für die gymnasiale Oberstufe G 8, Aufgabenbeite III, Chemie, http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=9e215f56-8111-221a-eb6df191921321b2 (letzter Zugriff: 18.4.2010, 10:09 Uhr) Hessisches Kultusministerium, Lehrpläne Gymnasium G 8 für die Jahrgangsstufen 5 bis 9, Aufgabengebiet III, Chemie , http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2 (letzter Zugriff: 18.4.2010, 10:11 Uhr) Hoffmann, I., Ralle, B., Atmen unter Extrembedingungen, in: Praxis der Naturwissenschaften-Chemie in der Schule, 1/50, 2001, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Holfeld, M., Chemie und Sport, in: Praxis der Naturwissenschaften-Chemie in der Schule, 5/51, 2002, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Holfeld, M., Chemie und Sport, Didaktische Aufarbeitung chemischer Inhalte aus dem Sport für den fachübergreifenden Chemie-Sport-Unterricht, Inaugural-Dissertation Zur Erlangung des Doktorgrades der Naturwissenschaftlichen Fachbereiche der Justus-Liebig-Universität Gießen, Fachgebiet Chemie, 2005, http://geb.uni-giessen.de/geb/volltexte/2005/2222/pdf/HolfeldMartin-2005-06-06.pdf (letzter Zugriff: 28.5.2010, 12:51 Uhr) Hollemann, A. F., Wiberg, E., Wiberg, N., Lehrbuch der Anorganischen Chemie, 102., stark umgearbeitete und verbesserte Auflage, Walter de Gruyter & Co. Berlin, 2007 Hülsmann, O., Hahn, A., Nahrungsergänzungsmittel im Sport, in: Praxis der Naturwissenschaften-Chemie in der Schule, 2/55, 2006, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Institut für Biochemie der DSHS Köln, Ephedrin und analoge Verbindungen, http://www.dshskoeln.de/biochemie/rubriken/00_home/00_eph.html (letzter Zugriff: 28.5.2010, 14:08 Uhr) Lego, Cristian, Verbrennung eines Gummibärchens in der Kaliumchlorat-Schmelze, Organisch-Chemisches Grundpraktikum für das Lehramt, Philipps- Universität Marburg, Fachbereich Chemie, 2009, http://www.chids.de/dachs/praktikumsprotokolle/PP0211Verbrennung_eines_Gummibaerchens.pdf (letzter Zugriff: 28.5.2010, 13:13 Uhr) 45 Schänzer, W., Thevis, M., Doping-Analytik, in: Praxis der Naturwissenschaften-Chemie in der Schule, 2/55, 2006, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Schmidt, C., Übungen im Experimentalvortag zum Thema Vitamine, Philipps-Universität Marburg, Fachbereich Chemie, 2005, http://www.chids.de/dachs/expvortr/701Vitamine_Schmidt_Ausarbeitung.pdf (letzter Zugriff: 28.5.2010, 12:54 Uhr) Schmidt, R. F., Lang, F., Thews, G., Physiologie des Menschen mit Pathophysiologie, 29., vollständig neu bearbeitet und aktualisierte Auflage, Springer Medizin Verlag, Heidelberg, 2005 Warnecke, A., Puffersysteme, http://www.anjawarnecke.de/cms/component/option,com_docman/task,doc_download/gid,19/Itemid,34/ (letzter Zugriff: 28.5.2010, 13:51 Uhr) Weisser, B., Energiegewinnung im Muskel, Biochemische Grundlagen, in: Praxis der NaturwissenschaftenChemie in der Schule, 2/55, 2006, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 2.5.2010, 17:44 Uhr) Wiskamp, V., Holfeld, M., Ungewollt gedopt? in: Praxis der Naturwissenschaften-Chemie in der Schule, 2/55, 2006, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Zeeck,A., Chemie für Mediziner, 5. völlig überarbeitete Auflage, Urban & Fischer Verlag, München, Jena, 2003 Abbildungs- und Tabellenverzeichnis Alle Abbildungen, die hier nicht genannt werden, sind von mir fotografiert worden. Abb. 2: Abb. 4: Abb. 5: Tabelle 1: Feldmann, H., Abbau von Glucose in der Glykolyse und die Substratketten-Phosphorylierung, http://biochemie.web.med.uni-muenchen.de/biotutor_2004/glykolyse.htm (letzter Zugriff: 28.5.2010, 13:35 Uhr) Schmidt, R. F., Lang, F., Thews, G., Physiologie des Menschen mit Pathophysiologie, 29., vollständig neu bearbeitet und aktualisierte Auflage, Springer Medizin Verlag, Heidelberg, 2005, S. 914 Mesics GmbH, Wissenschaftlicher Hintergrund und Nutzen der Laktatmessung, http://www.mesics.de/ims/_lib/phpproxy/opendocserver.php?imlID=99 (letzter Zugriff: 28.9.2010, 13:41 Uhr) Welt Anti Doping Agentur, DER WELT-ANTI-DOPING-CODE, DIE VERBOTSLISTE 2010, INTERNATIONALER STANDARD, http://www.nada- bonn.de/fileadmin/user_upload/nada/Downloads/Listen/Verbotsliste_2010_NADA.pdf (letzter Zugriff: 28.5.2010, 13:44 Uhr) 46 Versuchsverzeichnis Versuch 1: Verbrennung von Glucose Brandl, H., Ein Gummibärchen im „flammenden Inferno“, in: Praxis der Naturwissenschaften-Chemie in der Schule, 5/44, 1995, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Versuch 2: Respiratorische Kompensation einer metabolischen Acidose Holfeld, M., Chemie und Sport, Didaktische Aufarbeitung chemischer Inhalte aus dem Sport für den fachübergreifenden Chemie-Sport-Unterricht, Inaugural-Dissertation Zur Erlangung des Doktorgrades der Naturwissenschaftlichen Fachbereiche der Justus-Liebig-Universität Gießen, Fachgebiet Chemie, 2005, http://geb.uni-giessen.de/geb/volltexte/2005/2222/pdf/HolfeldMartin-2005-06-06.pdf (letzter Zugriff: 28.5.2010, 12:51 Uhr), S. Versuch 3: Reduzierende Wirkung von Vitamin C Schmidt, C., Übungen im Experimentalvortag zum Thema Vitamine, Philipps-Universität Marburg, Fachbereich Chemie, 2005, http://www.chids.de/dachs/expvortr/701Vitamine_Schmidt_Ausarbeitung.pdf (letzter Zugriff: 28.5.2010, 12:54 Uhr) Demonstration 1: Nachweis von Glutamin Holfeld, M., Chemie und Sport, in: Praxis der Naturwissenschaften-Chemie in der Schule, 5/51, 2002, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Versuch 4: Nachweis von Kreatin Holfeld, M., Chemie und Sport, in: Praxis der Naturwissenschaften-Chemie in der Schule, 5/51, 2002, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Versuch 5: Nachweis von Ephedrin Wiskamp, V., Holfeld, M., Ungewollt gedopt? in: Praxis der Naturwissenschaften-Chemie in der Schule, 2/55, 2006, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig Demonstration 2: Druckabhängigkeit der Löslichkeit von Kohlenstoffdioxid Hoffmann, I., Ralle, B., Atmen unter Extrembedingungen, in: Praxis der Naturwissenschaften-Chemie in der Schule, 1/50, 2001, Aulis Verlag Deubner GmbH & Co KG, Köln/Leipzig 47