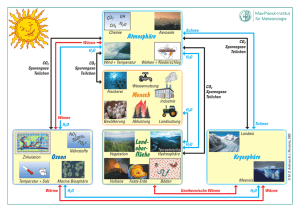
Volltext
Werbung

Neuartige Sulfate der Platin- und Selten-Erd-Metalle Der Fakultät für Mathematik und Naturwissenschaften der Carl von Ossietzky Universität Oldenburg zur Erlangung des Grades und Titels eines Doktors der Naturwissenschaften (Dr. rer. nat.) angenommene Dissertation von Stefan Schwarzer Geboren am 26. September 1981 in Vechta Die Anfertigung der vorliegenden Arbeit erfolgte in der Zeit von Dezember 2007 bis Juni 2010 am Institut für Reine und Angewandte Chemie der Carl von Ossietzky Universität Oldenburg unter der Anleitung von Herrn Prof. Dr. Mathias S. Wickleder. Sie wurde ergänzt durch einem Forschungsaufenthalt an der School of Chemistry der Monash University (Melbourne, Australien) im Zeitraum von September bis Dezember 2009. Erstgutachter: Prof. Dr. M. S. Wickleder Zweitgutachter: Prof. Dr. R. Beckhaus Zweitgutachter: Prof. Dr. R. Beckhaus Tag der Disputation: 25.06.2010 meiner Familie Kurzzusammenfassung Im Rahmen dieser Arbeit wurden Untersuchungen an neuen Verbindungen der Platinmetalle und der Selten-Erd-Elemente vorgenommen. Im Vordergrund standen dabei die Darstellung neuer Sulfate auf verschiedenen Wegen und ihre thermoanalytische Charakterisierung. Als potentielle Edukte für die Synthesen erfolgte der Einsatz neuartiger Chlorometallate der Platinmetalle. Sie wurden durch die Umsetzung von Nitraten, Hydroxiden und Chloriden der Selten-Erd-Elemente mit „Säuren“ der klassischen Edelmetalle Iridium, Osmium, Ruthenium und Rhodium erhalten. In Abhängigkeit vom Selten-Erd-Ionenradius wurde ein unterschiedliches Koordinationsverhalten der Nitrat-, Hydroxid- und Chlorid-Ionen, die als Liganden oder freie Ionen fungieren können, beobachtet. Pulverdiffraktometrische Messungen und thermogravimetrische Untersuchungen lieferten Aufschluss über Zersetzungsprodukte der Verbindungen. Aus Oleum und [Pr(NO3)2(H2O)6][IrCl6]·2H2O konnte bei 350 °C das komplexe Sulfat Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 erhalten werden. In der trimeren, oxid-zentrierten [Ir3O]-Einheit liegen gemischtvalente Iridiumatome (IV, III, III) vor. In Ergänzung zu den wenigen bisher bekannten Verbindungen mit dieser Baueinheit gelang es erstmals ein gemischtes Sulfat-Hydrogensulfat-Schwefelsäure-Addukt des Iridiums in Gegenwart eines Selten-Erd-Elements darzustellen. Ergänzend wurde die Verbindung elektrochemisch mittels Zyklovoltammetrie untersucht und charakterisiert. Durch eine Hochtemperatursyntheseroute konnten die ersten Einkristalle von Rh2(SO4)3(H2O)2 erhalten werden. Das erste binäre Rhodiumsulfat lie sich phasenrein bei einer Temperatur von 465 °C aus konz. Schwefelsäure und elementarem Rhodium kristallisieren und anschließend eingehend charakterisieren. In Zusammenarbeit mit der Arbeitsgruppe von Prof. P. Junk und Prof. G. Deacon (Monash University, Melbourne, Australien) wurden verschiedene Hexachloroplatinate(IV) und ein Platin(III)-Sulfat mit verschiedenen Kronenethern umgesetzt. Die vier erhaltenen Verbindungen [H3O+·18C6]2[PtCl6], [La(NO3)(H2O)2·(18C6)][PtCl6], [Sm(H2O)9·(15C5)3] [PtCl6]Cl·H2O und [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O konnten kristallographisch und thermoanalytisch charakterisiert werden und weisen komplexe Netzwerkstrukturen mit vielfältigen Wasserstoffbrückenbindungen auf. Die Reaktion von Seltenen-Erd-Metallen und -Nitraten in unterschiedlich stark mit Schwefeltrioxid angereicherter Schwefelsäure führte zu einer Reihe neuer Sulfate, die strukturell und thermoanalytisch untersucht wurden. Neben den bisher unbekannten Disulfaten SE2(S2O7)3 (SE = La - Nd), wurden neuartige Disulfat-Hydrogensulfate der Zusammensetzung SE(S2O7)(HSO4) (SE = Sm - Lu, Y) in Oleum bei 300 °C - 400 °C erhalten. Aus verdünnten Schwefelsäure-Lösungen gingen das Sulfat-Hydrogensulfat Dy(SO4)(HSO4) Nd3(SO4)4(HSO4)(H2O)2 bei 300 °C hervor. und das Sulfat-Hydrogensulfat-Hydrat Abstract This thesis deals with syntheses and investigations on compounds of platinum metals and rare-earth elements. The work was focused on preparation of new sulfates and on research of new precursor materials based on chloro compounds of the platinoids with complex oxoanions. Using nitrates, hydroxides and chlorides of rare-earth elements with acids of precious metals like iridium, osmium, ruthenium and rhodium numerous new chlorometallates could be obtained. An overview on structural affinities is given and considering the possible use as starting materials for further reactions in sulfuric acid the compounds were successfully converted. Depending on the rare-earth radius of the respective element, different coordination properties of nitrate, hydroxide and chloride ions were observed. Thermal analysis and powder diffraction measurements were performed to investigate the decomposition residues of the compounds. The reaction of [Pr(NO3)2(H2O)6][IrCl6]·2H2O in conc. sulfuric acid at 350 °C led to the complex sulfate of Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4. In the trimeric oxo-bridged [Ir3O]unit mixed-valence iridium atoms (IV, III, III) are present. In contrast to all known structures of this kind we could obtain a sulfate-hydrogensulfate-sulfuric acid adduct of iridium in the presence of a rare-earth element. Furthermore the structure of the compound was investigated and characterized electrochemically by cyclic voltammetry. By means of a high temperature synthesis of elemental Rhodium in conc. sulfuric acid the first single crystals of Rh2(SO4)3(H2O)2 were isolated. This first binary rhodium sulfate could be synthesized free from phase shift and in the range of hundreds of milligrams at 465 °C and was characterized in detail. In collaboration with the group of Prof. P. Junk und Prof. G. Deacon (Monash University, Melbourne, Australia) several compounds of hexachloroplatinates(IV) and a platinum(III)sulfate were converted with different kinds of crown ethers. The obtained compounds of [H3O+·18C6]2[PtCl6], [La(NO3)(H2O)2·(18C6)][PtCl6], [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O and [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O were characterized crystallographically and thermoanalytically and show a complex network structure and various hydrogen bonds. The reaction of rare-earth oxides in sulfuric acid with different concentrations of sulphur trioxide led to several new sulfates of the respective rare-earth element. A total of 17 new compounds were determined and investigated by DTA/TG-measurements and single crystal analysis. In addition to the so far unknown lanthanide disulfates SE2(S2O7)3 (SE = La - Nd) also novel disulfate-hydrogensulfates of the composition SE(S2O7)(HSO4) (SE = Sm - Lu, Y) were obtained by reactions in oleum at 300 °C - 400 °C. The sulfate-hydrogensulfate Dy(SO4)(HSO4) and a sulfate-hydrogensulfates-hydrate were produced in dilute sulfuric acid solution at 300 °C. A triangle diagram of the disulfates and acid rare-earth sulfates emphasises the key role of the used concentration of sulphur trioxide. Inhaltsverzeichnis I. I Einleitung....................................................................................... 1 II. Allgemeiner Teil............................................................................ 4 1. Apparative Methoden............................................................................... 4 1.1 Stickstoff-Handschuhbox................................................................................... 4 2. Präparative Methoden....... ....................................................................... 5 2.1 Duranglasampullen und Abschmelzapparatur.................................................... 5 2.2 Blockthermostat.................................................................................................. 5 2.3 Chlorierungsapparatur........................................................................................ 6 2.4 Chlorwasserstoffapparatur.................................................................................. 7 2.5 RuO4-Apparatur.................................................................................................. 8 3. Strukturbestimmung................................................................................ 10 3.1 Röntgenbeugung............................................................................................... 10 3.2 Einkristalldiffraktometrie................................................................................. 13 3.3 Kristallstrukturbestimmung.............................................................................. 14 3.4 Pulverdiffraktometrie........................................................................................ 16 3.5 Synchrotron-Strahlung...................................................................................... 17 4. Thermische Analyse............................................................................... 18 5. Infrarot-Spektroskopie............................................................................ 19 6. Verwendete Chemikalien und Geräte..................................................... 22 6.1 Chemikalien...................................................................................................... 22 6.2 Geräte................................................................................................................ 23 7. Verwendete Computerprogramme.......................................................... 24 III. Spezieller Teil.............................................................................. 26 1. Chlorometallate der Selten-Erd-Elemente.............................................. 26 1.1 Allgemeines...................................................................................................... 26 1.2 Übersichtstabelle............................................................................................... 28 1.3 Hexachloroplatinate(IV)……............................................................................... 29 1.3.1 Allgemeines............................................................................................. 29 1.3.2 Synthese................................................................................................... 29 1.3.3 Kristallstrukturen von [SE(NO3)2(H2O)6]2[PtCl6]·2H2O (SE = La, Pr, Nd, Sm)............................................................................. 30 Inhaltsverzeichnis II 1.3.4 Kristallstrukturen von [SE(NO3)(H2O)7][PtCl6] 4H2O (SE = Gd, Dy).......................................................................................... 31 1.3.5 Kristallstrukturen von [SE(H2O)8][PtCl6]NO3 ·4H2O (SE = Er, Y)............................................................................................. 31 1.3.6 Kristallstruktur von [Yb(H2O)8][PtCl6]NO3 ·4H2O................................. 32 1.3.7 Zusammenfasssung.................................................................................. 32 1.4 Hexachloroosmate(IV)…….............................................................................. 34 1.4.1 Allgemeines............................................................................................. 34 1.4.2 Synthese................................................................................................... 34 1.4.3 Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O............................... 37 1.4.3.1 Thermischer Abbau von [Eu(NO3)(H2O)7][OsCl6]∙4H2O.................... 40 1.4.4 Kristallstrukturen von [SE(NO3)2(H2O)6]2[OsCl6]·2H2O (SE = La, Pr)............................................................................................ 42 1.4.5 Zusammenfassung................................................................................... 42 1.5 Hexachloroiridate(III) und Hexachloroiridate(IV)........................................... 44 1.5.1 Allgemeines............................................................................................. 44 1.5.2 Synthese................................................................................................... 44 1.5.3 Kristallstruktur von [Ce(H2O)9][IrCl6]Cl·2H2O...................................... 46 1.5.3.1 Thermischer Abbau von [Ce(H2O)9][IrCl6]Cl·2H2O............................ 49 1.5.4 Kristallstruktur von [Dy(H2O)8][IrCl6]∙6H2O.......................................... 51 1.5.4.1 Thermischer Abbau von [Dy(H2O)8][IrCl6]∙6H2O............................... 54 1.5.5 Kristallstrukturen von [Ce(NO3)2(H2O)6][IrCl6]·2H2O, [Dy(NO3)(H2O)7][IrCl6]∙4H2O und [Lu(H2O)8][IrCl6]NO3∙4H2O......... 56 1.5.6 Zusammenfassung................................................................................... 57 1.6 Chlororuthenate(IV).......................................................................................... 58 1.6.1 Allgemeines............................................................................................. 58 1.6.2 Synthese................................................................................................... 59 1.6.3 Kristallstruktur von [Pr(H2O)9]2[Ru2OCl10]Cl2....................................... 60 1.6.3.1 Thermischer Abbau von [Pr(H2O)9]2[Ru2OCl10]Cl2............................ 63 1.6.4 Zusammenfassung................................................................................... 65 1.7 Hexachlororhodate(III)..................................................................................... 66 1.7.1 Allgemeines............................................................................................. 66 1.7.2 Synthese................................................................................................... 66 1.7.3 Kristallstruktur von [Pr(H2O)9][RhCl6]·2H2O......................................... 68 Inhaltsverzeichnis III 1.7.3.1 Thermischer Abbau von [Pr(H2O)9][RhCl6]·2H2O.............................. 70 1.7.4 Zusammenfassung.................................................................................... 72 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern..............74 2.1 Allgemeines...................................................................................................... 74 2.2 Die Hexachloroplatinsäure [H3O+·18C6]2[PtCl6]............................................. 75 2.2.1 Synthese................................................................................................... 75 2.2.2 Kristallstruktur von [H3O+·18C6]2[PtCl6]............................................... 75 2.2.2.1 Thermischer Abbau von [H3O+·18C6]2[PtCl6]..................................... 80 2.3 Das Lanthan-Hexachloroplatinat(IV) [La(NO3)(H2O)2·(18C6)][PtCl6]........... 83 2.3.1 Synthese................................................................................................... 83 2.3.2 Kristallstruktur von [La(NO3)(H2O)2·(18C6)][PtCl6]............................. 83 2.3.2.1 Thermischer Abbau von [La(NO3)(H2O)2·(18C6)][PtCl6]................... 88 2.4 Das Samarium-Hexachloroplatinat(IV) [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O... 90 2.4.1 Synthese................................................................................................... 90 2.4.2 Kristallstruktur von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O......................... 90 2.4.2.1 Thermischer Abbau von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O............... 94 2.5 Das Platinsulfat [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O......................................... 96 2.5.1 Synthese................................................................................................... 96 2.5.2 Kristallstruktur von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O.......................... 98 2.5.2.1 Thermischer Abbau von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O.............. 102 2.6 Zusammenfassung........................................................................................... 105 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Schwefelsäure……………………………………………………. 107 3.1 Allgemeines..................................................................................................... 107 3.1.1 Synthese................................................................................................. 109 3.1.2 Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4.................109 3.1.2.1 Fourier-Elektronendichtekarten von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4..............................................114 3.1.2.2 Zyklovoltammetrische Untersuchungen....................................... 116 4. Das Rhodiumsulfat Rh2(SO4)3(H2O)2................................................... 119 4.1 Allgemeines..................................................................................................... 119 4.1.1 Synthese................................................................................................. 120 4.1.2 Kristallstruktur von Rh2(SO4)3(H2O)2.................................................... 122 4.1.2.1 IR-Schwingungsspektrum von Rh2(SO4)3(H2O)2............................... 125 Inhaltsverzeichnis IV 4.1.2.2 Thermischer Abbau von Rh2(SO4)3(H2O)2......................................... 127 5. Disulfate und saure Sulfate der Selten-Erd-Elemente........................... 130 5.1 Allgemeines..................................................................................................... 130 5.2 Reaktionsübersicht.......................................................................................... 131 5.3 Die Disulfate SE2(S2O7)3 (SE = La - Nd)....................................................... 132 5.3.1 Synthese................................................................................................. 132 5.3.2 Kristallstrukturen von SE2(S2O7)3 (SE = La - Nd)................................ 133 5.3.2.1 Thermischer Abbau von SE2(S2O7)3 (SE = La, Pr)............................ 136 5.3.2.2 Schwingungsspektrum von La2O2SO4............................................... 139 5.4 Die Disulfat-Hydrogensulfate SE(S2O7)(HSO4) (SE = Sm - Lu, Y)............... 140 5.4.1 Synthese................................................................................................. 140 5.4.2 Kristallstrukturen von SE(S2O7)(HSO4) (SE = Sm - Lu, Y).................................................................................. 140 5.4.2.1 Thermischer Abbau von Dy(S2O7)(HSO4)......................................... 147 5.5 Das Sulfat-Hydrogensulfat Dy(SO4)(HSO4)................................................... 150 5.5.1 Synthese................................................................................................. 150 5.5.2 Kristallstruktur von Dy(SO4)(HSO4)..................................................... 150 5.5.3 Gitterkonstantenverfeinerung von Pr(SO4)(HSO4)................................ 153 5.6 Das Sulfat-Hydrogensulfat-Hydrat Nd3(SO4)4(HSO4)(H2O)2......................... 154 5.6.1 Synthese................................................................................................. 154 5.6.2 Kristallstruktur von Nd3(SO4)4(HSO4)(H2O)2....................................... 154 5.6.2.1 Thermischer Abbau von Nd3(SO4)4(HSO4)(H2O)2..................... 158 5.7 Zusammenfassung........................................................................................... 160 IV. Zusammenfassung und Ausblick............................................... 162 V. Anhang....................................................................................... 176 VI. Literaturverzeichnis................................................................... 179 VII. Danksagung............................................................................... 184 VIII. Erklärung.................................................................................. 186 IX. Lebenslauf.................................................................................. 188 I. Einleitung -1- I. Einleitung Für wenige Elemente des Periodensystems sind bereits so früh Methoden zur Reinstdarstellung entwickelt worden wie für die Platinoide. Heute werden im Edelmetalltrennungsgang Hexachloro-Verbindungen der Platinmetalle im industriellen Maßstab als Amin-Komplexe gefällt und so eine Trennung ermöglicht [1]. Ausgehend hiervon konnten in der Vergangenheit in unserer Arbeitsgruppe für das Element Platin eine Vielzahl an neuen Sulfaten mit und ohne komplexe Oxo-Anionen dargestellt werden [2, 3]. Vernachlässigt wurden hingegen bisher die Platinmetalle Iridium, Osmium, Rhodium und Ruthenium, obwohl die zu erwartenden Verbindungen und thermischen Abbauprodukte nicht minder interessant erscheinen. So werden die leichten und schweren Platinmetalle aufgrund ihrer großen katalytischen Aktivität in Form feinverteilter Metallnanopartikel seit langem vielseitig in der homogenen und heterogenen Katalyse eingesetzt, z. B. als Fahrzeug- und Hydrierungskatalysatoren oder bei der Essigsäuresynthese (Cativa-Prozess) [4]. Die Erforschung von neuen Precursor-Materialien zur Darstellung von katalytischen Metallpartikeln, insbesondere auf Selten-Erd-Oxiden als Trägermaterialien, ist daher von erheblicher Bedeutung [5]. Aus diesen Beweggründen werden im ersten Teil dieser Arbeit eine Vielzahl neuer Verbindungen der Chlorometallate in den Oxidationstufen III bzw. IV mit und in komplexen Anionen vorgestellt und charakterisiert, wobei besonderes Augenmerk auf Untersuchungen des thermischen Verhaltens gelegt wurde. Zum einen stellt dies eine konsequente Fortführung des in der Diplomarbeit begonnenen Arbeitsfeldes dar und zum anderen können in einer vergleichenden Übersicht strukturelle Parallelen zwischen den Platinmetallen mit unterschiedlichen Selten-Erd-Elementen (SE) als Oxo-Anionen gezogen und dieses Themengebiet zu einem Abschluss gebracht werden. Direkt verknüpft damit sind die im Weiteren vorgestellten komplexen Sulfate der Platinoide Iridium und Rhodium. Diese konnten ausgehend von einem Hexachlorometallat, umgesetzt in Oleum, oder dem elementarem Metall, aufgelöst in Schwefelsäure, dargestellt werden. Somit wird gezeigt, dass sich prinzipiell auch weitere Chloroplatinate als Edukte für die Synthese von Metallsulfaten eignen und welchen Einfluss die Wahl der Reaktionsparameter Druck und Temperatur auf Umsetzungen in konzentrierten Mineralsäuren haben können. Geradezu verwunderlich ist die bisherige Unkenntnis einfacher Metallsulfate der Platingruppe. Konnten bereits im Arbeitskreis Wickleder durch die Synthesen von Pt3(SO4)4 [3] und Pt2(HSO4)2(SO4)2 [6] neue Sulfate des Platins dargestellt werden, so wird in dieser Arbeit mit I. Einleitung -2- der ersten strukturellen Beschreibung eines binären Rhodium-Sulfates Pionierarbeit auf diesem Gebiet geleistet. Das die Strukturbestimmung bisher nicht gelang, ist aufgrund der technischen Bedeutung des Sulfats als Ausgangsverbindung für galvanische Beschichtungen von Oberflächen oder als Zwischenprodukt bei der Rhodiumproduktion bemerkenswert. Trotz zahlreicher Bemühungen und unter Anwendung aller gängigen Analysemethoden gelang es bisher nicht, ein reines Rhodiumsulfat eindeutig zu isolieren und strukturell zu charakterisieren [7]. Ursächlich dafür war der röntgenamorphe Charakter untersuchter Proben, der große Unsicherheit über die möglichen Zusammensetzungen nährte [8-10]. Verschiedenartige Platinverbindungen und ihre Reaktion mit diversen KronenetherMolekülen wurden im Rahmen dieser Arbeit ebenfalls untersucht. Dabei richtete sich das Hauptaugenmerk auf Verbindungen, die im Laufe der letzten Jahre in der Arbeitsgruppe dargestellt und umgesetzt Netzwerkstrukturen werden aufweisen. konnten Die und Arbeiten Potenzial zur Ausbildung wurden im Rahmen von eines Forschungsaufenthaltes im Arbeitskreis von Prof. P. Junk und Prof. G. Deacon an der Monash University in Melbourne, Australien, durchgeführt. Eine strukturelle Charakterisierung erhaltener Ergebnisse erfolgte teilweise am Australian Synchrotron, ebenfalls in Melbourne. Im letzten Kapitel werden neue Disulfate und saure Sulfate der Selten-Erd-Elemente vorgestellt. Besonders die Kenntnis von Disulfaten der Lanthanide war bis jetzt stark limitiert und nur Nd(S2O7)(HSO4) bekannt, dass vor einigen Jahren in unserer Arbeitsgruppe dargestellt werden konnte [11]. Durch die Reaktion von Selten-Erd-Oxiden und Selten-ErdNitraten in Oleum konnte nun erstmals ein reines Selten-Erd-Disulfat erhalten werden. Dies ist insbesondere bemerkenswert, da mit Sb2(S2O7)3 nur ein weiterer Vertreter dieser Art mit einem dreiwertigen Metall bekannt ist [12]. Unter gleichen Reaktionsbedingungen erfolgte die Darstellung bisher unbekannter Disulfat/Hydrogensulfate. Daneben lässt sich weiterhin nach sauren Sulfaten der Selten-ErdElemente unterscheiden. Diese Gruppe umschließt Verbindungen mit Oxonium-Ionen, wie (H3O)La(SO4)2·3H2O [13] und die zahlreichen Hydrogensulfate der allgemeinen Formel SE(HSO4) [14]. Temperaturabhängig können neben SE(HSO4) Verbindungen des Typs SE(SO4)(HSO4) entstehen [14]. Neben dem 1998 erstmals beschriebenen Er(SO4)(HSO4) [15], gelang es einen weiteren, nicht isotypen Vertreter dieser Gruppe zu charakterisieren. Unter Variierung der Reaktionsbedingungen konnte mit Nd3(SO4)4(HSO4)(H2O)2 sogar die Darstellung eines beispiellosen wasserhaltigen Sulfat/Hydrogensulfats, durchgeführt werden. In der vorliegenden Arbeit werden drei Hauptbereiche unterschieden. Im ersten, allgemeinen Teil erfolgt eine kurze Einführung in die angewendeten Arbeits- und Analysemethoden und I. Einleitung -3- eine Auflistung der verwendeten Chemikalien und Geräte. Der zweite, spezielle Bereich beschreibt Synthesen und Charakterisierungen aller untersuchten Verbindungen. Dies beinhaltet ausführliche Kristallstrukturbeschreibungen, Erörterungen der thermischen Zersetzungsprozesse und weitere, notwendige Analyseverfahren. Die Arbeit schließt im dritten Teil mit einer Zusammenfassung der Ergebnisse sowie einem Ausblick. Aus Gründen der Handhabbarkeit wurden nicht sämtliche Daten aus den zahlreichen Strukturbestimmungen in der Arbeit tabelliert, sondern in den einschlägigen Strukturdatenbanken hinterlegt. Rein anorganische Strukturdaten können über das Anforderungsformular für deponierte Datensätze des Fachinformationszentrum Karlsruhe bezogen werden [16]. Eine Bereithaltung findet in der Cambridge Structural Database (CSD) statt. Für Kristallstrukturen, die C-H-Bindungen enthalten, erfolgt eine Weitergabe durch das Cambridge Crystallographic Data Centre (CCDC) [17]. II. Allgemeiner Teil -4- II. Allgemeiner Teil 1. Apparative Methoden 1.1 Stickstoff-Handschuhbox Zur Handhabung hydrolyse- und oxidationsempfindlicher Substanzen werden diese unter Stickstoff-Atmosphäre in einer Handschuhbox präpariert. Die Handschuhbox ist ein kastenförmiger Arbeitsraum mit einer Frontscheibe aus Acrylglas, der gegenüber seiner Umgebung hermetisch und gasdicht abgeschlossen ist (Abb. 1). Die Frontscheibe weist mindestens zwei Öffnungen für den Eingriff des Benutzers in den Innenraum auf. Mit zwei oder mehreren Gummihandschuhen, die in den Kasten hineinreichen, wird das Arbeiten ermöglicht. In der Box herrscht ein geringer Überdruck, so dass bei einem eventuellen Leck keine Luft und keine Feuchtigkeit einströmen können. Die Stickstoff-Atmosphäre wird laufend durch eine Umwälz- und Reinigungsanlage von Sauerstoff und Feuchtigkeit befreit. Polarisationsmikroskop und Feinwaage befinden sich je nach Ausstattung in der Handschuhbox. Über ein Schleusensystem werden benötigte Reagenzien und Arbeitsgeräte in die Box oder aus ihr heraus gebracht. Abb. 1: Stickstoff-Handschuhbox II. Allgemeiner Teil -5- 2. Präparative Methoden 2.1 Duranglasampullen und Abschmelzapparatur Zur Darstellung der in dieser Doktorarbeit vorgestellten Verbindungen wurden unter anderem Duranglasampullen (Abb. 2) verwendet, die an einer Abschmelzapparatur (Abb. 3) unter Vakuum oder Normaldruck präpariert wurden. Abb. 2: Normalglasampullen Abb. 3: Abschmelzapparatur Zu diesem Zweck wurden die Glasampullen in ein Quickfit geschraubt, um sie zu evakuieren und anschließend mit einem Schneidbrenner abzuschmelzen. 2.2 Blockthermostat Die Umsetzung der sich in den Glasampullen befindlichen Reaktanden wurde in einem Blockthermostat der Fa. Liebisch (Abb. 4) durchgeführt. Abb. 4: Blockthermostat (links), befüllte Ampullen (rechts) II. Allgemeiner Teil -6- 2.3 Chlorierungsapparatur Die in Abb. 5 gezeigte Apparatur ermöglicht eine Chlorierung bei unterschiedlichen Temperaturen. Werden für die Darstellung von Hexachlorometallaten der Elemente Osmium oder Iridium Reaktionstemperaturen von über 600 °C benötigt, so erfolgte z. B. eine Chlorierung zu Na3[RhCl6] bei maximal 300 °C. Das entsprechende Edukt wurde in ein Quarzglasschiffchen gegeben und dann in ein Quarzrohr eingebracht. Das Rohr wurde anschließend in einen Röhrenofen geschoben, beide Enden mit Absperrhähnen verschlossen und diese mit Schliffklammern gesichert. Zwischen die Chlorgasflasche und den Ofen wurde zur Trocknung des Chlorgases eine Waschflasche mit konz. Schwefelsäure und nachfolgend eine weitere leere Waschflasche als Rückschlagsicherung eingefügt. Nicht abreagiertes Chlorgas konnte durch eine nachgeschaltete Waschflasche mit halbkonzentrierter Natriumhydroxidlösung neutralisiert werden. Eine davor befindliche leere Waschflasche diente wiederum als Rückschlagsicherung. Vor der Chlorierung wurde über einen Dreiwegehahn Stickstoffgas durch die gesamte Apparatur geleitet und so bei ca. bei 200 °C ein Trocknungsvorgang eingeleitet. Die abgeschlossene Trocknung war durch ausbleibendes Kondenswasser am hinteren, kalten Ende des Quarzrohres zu erkennen. Nun wurde von Stickstoff- auf Chlorgas umgestellt und ein kontinuierlicher Gasstrom zugeführt. Der Ofen wurde auf die benötigte Temperatur geregelt und es erfolgte die Chlorierung der Reaktionsmasse für 2-6 Stunden. Nach beendeter Chlorierung wurde die Reaktionsmischung mit der im Rohr verbliebenen Chlorgasatmosphäre über Nacht zum Abkühlen stehen gelassen. Am nächsten Morgen wurde das im Rohr und der Apparatur verbliebene Chlorgas mittels Stickstoffgasspülung ausgetrieben und das Schiffchen entnommen. Abb. 5: Chlorierungsapparatur II. Allgemeiner Teil -7- 2.4 Chlorwasserstoffapparatur Diese Apparatur diente zur Erzeugung von Chlorwasserstoffgas, das zur Aufreinigung der Chlorierungsprodukte, wie z. B. Na2[OsCl6] verwendet wurde. Nicht abreagierte Alkalimetall-Ionen konnten auf diesem Wege als Chlorid-Salz gefällt und dann entfernt werden. Dazu wurde die wässrige Lösung des erhaltenen Produktes aus dem Chlorierungsprozess in eine Gaswaschflasche gefüllt, diese mittels Eisbad gekühlt und für ca. 1 Stunde mit HCl-Gas gesättigt. Der gesamte Apparaturaufbau (Abb. 6) bestand aus sechs hintereinander geschalteten Gaswaschflaschen, wobei die erste, dritte und fünfte Flasche als reine Schutzflaschen fungierten. In der zweiten Flasche befand sich konz. Schwefelsäure zur Trocknung des HCl-Stroms, in der Zweiten das Produkt mit Magnetrührkern und in der sechsten Wasser zum Auffangen überschüssigen HCl-Gases. Dieses wurde in einem 1000-mlDreihalskolben mit Magnetrührkern und aufgesetztem 250-ml-Tropftrichter hergestellt. Der Dreihalskolben war mit war konz. Schwefelsäure und der Tropftrichter mit konz. Salzsäure gefüllt. Durch langsames und kontrolliertes Zutropfen konnte Chlorwasserstoffgas erzeugt und bis zur Sättigung der gekühlten Produktlösung in die Gaswaschflasche eingeleitet werden. Die Sättigung der Produktlösung war abgeschlossen sobald ein Gasfluss durch die Lösung beobachtet werden konnte. Abschließend wurde das ausgefallene Alkalimetallchlorid mittels einer Glasfilternutsche (Porengröße 4) abgesaugt und gegebenfalls der gesamte Vorgang wiederholt. Abb. 6: Chlorwasserstoffapparatur im Abzug (links) und schematisch dargestellt (rechts) II. Allgemeiner Teil -8- 2.5 RuO4-Apparatur [9] RuO4 kann durch Einleiten von Cl2 in Alkaliruthenatlösungen dargestellt werden: 1 g feines Rutheniumpulver wurde mit 4 g KOH und 1 g NaNO3 in einer Silberschale bis zur klaren tiefgrünen Schmelze erhitzt und noch ca. 30 Minuten im Fluss gehalten. Abb. 7: Reaktionsprodukt in Ag-Schale während (links) und nach (rechts) nach dem Erhitzen Nach Erkalten des Reaktionsproduktes war eine Farbänderung ins Rötliche zu beobachten (Abb. 7). Das glasartige Produkt wurde dann aus der Schale herausgeschlagen und in einen 250-ml-Dreihalskolben überführt in dem sich 75 ml dest. Wasser und ein Rührfisch befanden. Der Kolben wurde mit einem Einleitungsrohr für Chlorgas, einer Destillationsbrücke und einem Stopfen für den nicht verwendeten Schliff versehen. Es war unbedingt darauf zu achten, dass alle Verbindungen durch Schliffklammern und PTFE-Schlifffett (PTFE = Polytetrafluorethylen) gasdicht gesichert waren. Das Destillationsrohr endete über 100 ml 2,5 N HCl-Lösung, die sich ebenfalls in einem 250-ml-Dreihalskolben befand. Dieser war über ein Glasrohr mit Schliffen direkt mit zwei sich anschließenden Gaswaschflaschen verbunden. In jeder Flasche befanden sich ca. 75 ml 2,5 N HCl-Lösung, welche zum Lösen von nicht in der ersten Vorlage aufgefangenem RuO4 dienten (Abb. 8). Abb. 8: RuO4-Apparatur zu Beginn der Reaktion (links) und nach Beendigung (rechts) II. Allgemeiner Teil -9- Im nächsten Schritt wurde mit der Einleitung von Chlorgas begonnen, wobei mit einhergehender Erwärmung der Lösung ein Farbumschlag von ornage nach leicht grün beobachtet werden konnte. Ursächlich ist dabei die Oxidation von RuO42- (orange) zu RuO4(grün). Nach wenigen Minuten kondensierten orange Tropfen an RuO4 im Destillationsrohr, die sich dann in der ersten Vorlage mit gelber Farbe lösten und mit weiterem Chlorgas übergetrieben wurden. Etwa eine Stunde später und bei fast abgeschlossener Oxidation, wechselte die Farbe allmählich von gelb zu einem tief orangefarbenen Farbton. Verbliebene Reste an RuO4 in der Destillationsbrücke wurden vorsichtig mit einem Heißluftföhn übergetrieben und die wässrige Vorlage gelinde in einem Ölbad erwärmt. Die wässrige Lösung hatte sich zu diesem Zeitpunkt komplett entfärbt. Es wurde so dann die Apparatur mit Stickstoffgas gespült und die weiteren unterschiedlich eingefärbten Vorlagen vereinigt und auf dem Wasserbad eingeengt. Es sei darauf hingewiesen, dass für den Reaktionsapparaturaufbau nur Glasgeräte benutzt werden dürfen, da z.B. Kunststoffschläuche sofort oxidiert werden. Eine Ausnahme bietet die durch eine Waschflasche gesicherte Verbindung zur Chlorgasflasche. Außerdem wird neben den üblichen Schutzmaßnahmen wie säurebeständigen Schutzhandschuhen und Laborkittel eine Vollgesichts-Atemschutzmaske mit geeignetem Filter empfohlen. II. Allgemeiner Teil -10- 3. Strukturbestimmung 3.1 Röntgenbeugung [18, 19] 1895 stellte Wilhelm Conrad Röntgen seine bahnbrechende Arbeit über Röntgenstrahlung mit dem Titel „Über eine neue Art von Strahlen“ vor. Diese heute in vielen Bereichen genutzte Strahlung erstreckt sich über ein elektromagnetisches Spektrum von 5 pm - 10 nm. Zur Bestimmung von Kristallstrukturen mittels Röntgenstrahlen (Röntgenkristallstrukturanalyse) kommt hingegen nur ein schmaler Wellenlängenbereich von 0,03 nm - 0,5 nm zum Einsatz. Dieser Bereich liegt in der gleichen Größenordnung wie die interatomaren Abstände im Kristall. Röntgenstrahlen entstehen beim Wechselwirken von Elektronen mit einem Anodenmaterial. Die Elektronen werden mittels Glühkathoden in Hochvakuumröhren erzeugt. Treffen diese Röntgenstrahlen nun im Winkel auf die Netzebenen eines Kristalls, die unterschiedlich zahlreich mit Atomen besetzt sind, so findet gemäß ihrer Wellennatur Beugung statt. Dieser Beugungseffekt wurde 1912 von Max von der Laue entdeckt, begründete die moderne Kristallographie und kann als Reflexion an gleichwertigen, parallelen Netzebenen, welche einen konstanten Abstand dhkl zueinander besitzen, beschrieben werden (Abb. 9). Abb. 9: Reflexion von Röntgenwellen an Netzebenen II. Allgemeiner Teil -11- Die Bedingung zum Auftreten eines Reflexes beschreibt mathematisch die Braggsche Gleichung: n mit 2d hkl sin (1) Ordnung der Interferenz n: : dhkl: : Wellenlänge der Röntgenstrahlung Netzebenenabstand Beugungswinkel (Glanz- oder Braggwinkel) In einem Kristall durchdringt der Röntgenstrahl mehrere Millionen Netzebenen, an denen er jeweils zum Teil reflektiert wird, bis er vollständig absorbiert werden kann. Dadurch kommt es unter bestimmten Voraussetzungen zur Auslöschung oder Verstärkung von Wellen, abhängig von der Phasendifferenz. Diese Phasendifferenz wird auch als Gangunterschied ( 2 AN 2d hkl sin ) bezeichnet und besagt, dass es nur zur konstruktiven Interferenz an zwei benachbarten Netzebenen kommt, wenn der Gangunterschied ein ganzzahliges Vielfaches der Wellenlänge λ ist. Durch geometrische Konstruktion hat Ewald eine Methode entwickelt durch die graphisch, ohne weitere Rechnungen, die Braggschen Reflexionsbedingungen im reziproken Raum dargestellt werden können. Dazu wird Gleichung (1) in folgende Form gebracht: sin /2 hkl d hkl 1 / d hkl (2) 2/ Wird nun in einem Kreis mit dem Durchmesser 2 / ein rechtwinkliges Dreieck mit der Hypotenuse durch den Mittelpunkt konstruiert, so ergibt sich für die Gegenkathete des Winkels nach Gleichung (2) eine Länge von 1/ d hkl (Abb. 10). Abb. 10: Ewaldsche Konstruktion II. Allgemeiner Teil -12- Nach Einführung des reziproken Gitters: K / d hkl (3) hkl mit hkl : reziproker Gittervektor erhält man mit K=1 die Braggsche Reflexionsbedingung in der Form: sin hkl 2 hkl (4) Unter Beachtung der Gleichung (4) lässt sich Abb. 10 eine physikalische Bedeutung beimessen (Abb. 11): Abb. 11: Darstellung der Reflexionsbedingungen im reziproken Raum mit A: Eintritt des Röntgenstrahls K: Kristall im Mittelpunkt des Kreises O: Ursprung des reziproken Gitters P: Reziproker Gitterpunkt Sei die Strecke AK in Abb. 11 als Richtung des einfallenden Röntgenstrahls angenommen, so schließt die Strecke AP mit dem eintretenden Strahl den Braggschen Winkel ein. Ferner befinde sich im Mittelpunkt des Kreises ein Kristall (K), so spannt die reflektierende Netzebene mit dem einfallenden Röntgenstrahl ebenfalls den Winkel der Länge hkl auf. Die Strecke OP steht zu dieser Netzebene senkrecht. Damit ist die Länge von hkl bestimmt von der jeweiligen Netzebene und die Strecke KP definiert durch den an der Kristallfläche gebeugten Röntgenstrahl. Abb. 11 wird zur Interpretation von Röntgenaufnahmen auf den dreidimensionalen Raum, wodurch man zur Reflexions- bzw. Ewaldkugel gelangt, erweitert. II. Allgemeiner Teil -13- 3.2 Einkristalldiffraktometrie Die Strukturermittlung der in dieser Arbeit vorgestellten Verbindungen erfolgte an Einkristallen mittels eines Imaging Plate Diffraction Systems (IPDS, Abb. 12). Der zu untersuchende Einkristall wurde vor der Messung unter polarisiertem Licht mikroskopiert und auf eine Glasnadel präpariert. Abb. 12: Imaging-Plate-Diffraktometer System (IPDS) Dieses zu den Einkreisdiffraktometern gehörende Gerät verwendet eine Bildplatte, die mit einer Schicht aus Eu2+ dotiertem BaBrF versehen ist. Der Kristall wird durch fokussierte Mo-Kα-Strahlung belichtet, die Röntgenreflexe werden registriert und anschließend mit Hilfe eines Laserstrahls ausgelesen. Die Strahlungsintensität wird über eine Photozelle detektiert und gibt Auskunft über die Reflexintensität. Die gemessenen Daten werden von einem Computer gespeichert. Abschließend wird die Platte mit einer starken Lichtquelle gelöscht. Der Kristall wird nun um einen bestimmten Betrag (0,5° - 2°) gedreht und der Routineablauf aus Belichten, Auslesen und Löschen wiederholt. Für eine Strukturlösung sind ungefähr 200 - 400 Aufnahmen nötig. II. Allgemeiner Teil -14- 3.3 Kristallstrukturbestimmung [18, 19] Die Strukturbestimmung aus den gemessenen Reflexintensitäten basiert auf der Möglichkeit mit Hilfe geeigneter Rechenprogramme auf die Lage der Atome im Kristallgitter zu schließen. Lösungsansätze sind entweder über die „Patterson-Synthesen“ oder über „direkte Methoden“ zu erhalten. Beide Herangehensweisen ermitteln durch Fouriersynthese aus den Intensitätsdaten eine Elektronendichtefunktion und ermöglichen damit die Struktur des Kristalls zu bestimmen. Die Elekronendichtefunktion lautet: XYZ mit XYZ 1 V Fhkl .e 2 i( hX kY lZ ) (5) hkl : Elektronendichteverteilung V: Volumen Fhkl : Strukturfaktor (Fourierkoeffizienten) Aus den Röntgenmessungen erhält man nur Intensitäten (Strukturamplituden) und nicht die benötigten Strukturfaktoren. Die gemessenen Reflexintensitäten sind dem Quadrat der Strukturfaktoren proportional: I0 ( hkl ) Fhkl ei (6) 2 I0 ( hkl ) ~ Fhkl mit 2 (7) ei : Phase I0 : Elektronendichteverteilung Somit ist der Betrag des Strukturfaktors bekannt, seine Phaseninformation jedoch verloren (Phasenproblem). Zur Lösung dieses Problems lassen sich nun die bereits angesprochene direkte Methode und die Methode nach Patterson, auf die im Weiteren eingegangen wird, heranziehen. Die Patterson-Synthese findet Anwendung bei Strukturen mit wenigen Schweratomen. Zur Berechnung des Teilgitters werden direkt die Fhkl 2 - Werte verwendet. Die Patterson-Funktion lautet: PXYZ 1 V2 Fhkl2 cos 2 ( hX hkl kY lZ ) (8) II. Allgemeiner Teil -15- Als Unterschied zu Fouriersynthesen, die bei der Elektronendichteverteilung XYZ -Maxima für Atome im Kristall aufzeigen, erhält man interatomare Abstandsvektoren. Der Grund liegt in den fehlenden Phaseninformationen der Fhkl 2 - Werte (s. Gleichung 6). Ursprung des Pattersonraums ist der größte Peak. Die so ermittelten Lagen müssen noch einer Normierung unterworfen und mit den zur Raumgruppe gehörenden Symmetrieoperationen verknüpft werden. Die direkten Ansätze gehen von statistischen Methoden aus und sind dann besonders geeignet, wenn die beteiligten Atome untereinander eine ähnliche Ordnungszahl aufweisen. Es werden zwischen den Strukturfaktoren und den Millerschen Indices (hkl) Zusammenhänge ermittelt. So erhaltene Phasen von Strukturfaktoren dienen wiederum zur Bestimmung von Lageparametern mittels Fouriersynthese. Um die Güte von Strukturmodellen und Verfeinerungen mit der Realität vergleichen zu können wurden Zuverlässigkeitsfaktoren eingeführt. Die Residual-Werte (R-Werte) geben die Übereinstimmung zwischen beobachteten Strukturfaktoren Fo mit den berechneten Fc -Werten an. Der konventionelle R-Wert sollte stets mit den zur Berechnung verwendeten Reflexen angeben werden. Es muss bedacht werden, dass bei diesem Wert die Gewichte w, die bei der Strukturverfeinerung einbezogen werden, nicht mit eingehen. Der gewogene R-Wert (wR2) hingegen enthält diese Gewichtungsfaktoren, die die unterschiedliche Genauigkeit der Reflexe eines Datensatzes berücksichtigen. In diesen gehen die bei der Verfeinerung minimalisierten Fehlerquadratsummen ein und ist damit, bei sinnvoller Verwendung von Gewichten, der Wichtigere. Der Index 2 gibt die Berechnung mit Fo2 -Werten an. Fo R Fc hkl Fo (9), hkl mit w: w( Fo2 wR2 Fc2 )2 hkl w( Fo2 )2 (10) hkl 1/ 2 ( Fo2 ) Bei einem entsprechend guten Datensatz sind R-Werte von unter 0,05 und wR2-Werte von unter 0,15 zu erwarten. Ein weiteres Qualitätsmerkmal ist der „Goodness of fit“ oder „Gütefaktor“ S. In ihn geht als Grad der Übereinstimmung die Differenz aus n-p ein. Er sollte bei richtig gelöster Struktur einen Wert um 1 aufweisen. II. Allgemeiner Teil -16- w( Fo2 S mit Fc2 )2 hkl n n: Zahl der Reflexe p: Zahl der Parameter p (11) Weitere Optimierung des Strukturmodells kann dann ausgehend vom ersten Strukturmodell durch Differenz-Fourier-Synthesen vorgenommen werden. Dadurch können weitere Atome aufgefunden und die Strukturlösung verfeinert werden. Des Weiteren stehen Verfahren zur Absorptionskorrektur und der Einführung von anisotropen Temperaturfaktoren zur Verfügung. 3.4 Pulverdiffraktometrie [20] Das Pulverdiffraktometer (Abb. 13) ermöglicht Untersuchungen an feinkristallinen Pulvern. Es wird jedoch keine Aufklärung bezüglich enthaltener Elemente geleistet, vielmehr ist Ziel der Untersuchung, Informationen über die kristallinen Phasen oder Verbindungen zu erhalten. Dabei ist es möglich die gemessenen Daten mit simulierten Pulverdiffraktogrammen aus Datenbanken oder mit erzeugten Diffraktogrammen aus Einkristallstrukturanalysen zu vergleichen. Abb. 13: Pulverdiffraktometer STADI P der Firma STOE, Darmstadt II. Allgemeiner Teil -17- Bei den durchgeführten pulverdiffraktometrischen Untersuchungen wurde monochromatische Cu-Kα-Röntgenstrahlung verwendet. Die Röntgenstrahlen werden an allen Netzebenen gebeugt, die die Braggsche Beziehung (1) erfüllen. Die gebeugten Strahlen können durch einen fotografischen Film oder, wie bei dem verwendeten Diffraktometer, durch eine Zählelektronik (Geigerzähler) nach der Debye-Scherrer-Methode detektiert werden. Durch Rotation der Probe um eine Achse werden mögliche Textureffekte eingeschränkt. Es gibt eine Reihe von Möglichkeiten, Pulveraufnahmen durchzuführen. Zum überwiegenden Teil werden die gemörserten Kristallite auf einer Adhäsivfolie („tesa-Film“) aufgebracht, in einem Flachbettprobenträger fixiert und dann in die Haltevorrichtung des Pulverdiffraktometers gesetzt. Alternativ können hydrolyse- und oxidationsempfindliche Substanzen in Glaskapillaren (Markröhrchen) von 0,1 mm - 0,7 mm unter Schutzgas gehandhabt werden. 3.5 Synchrotron-Strahlung [21, 22] Röntgenographische Untersuchungen mit Synchrotron-Strahlung wurden am Australian Synchrotron in Melbourne (Abb. 14) durchgeführt. Als erster Teilchenbeschleuniger Australiens wurde er im Jahre 2007 in Betrieb genommen. Abb. 14: Australian Synchrotron Frontansicht (links) und Aufsicht (rechts) Auf das grundlegende Konzept eines Synchrotrons soll an dieser Stelle nicht eingegangen, sondern nur kurz die verwendete Beamline „High-throughput Protein Crystallography (PX1)“ (Abb. 15), vorgestellt werden. Momentan stehen acht unterschiedliche Beamlines am Australian Synchrotron zu Verfügung, wovon zwei zur Kristallstrukturaufklärung von Proteinen genutzt werden. Allerdings waren keine Messungen an Schweratomen enthaltenden II. Allgemeiner Teil -18- Proben vorgesehen. Daher erfolgt vor dem Auftreffen der verwendeten Synchrotronstrahlung (Wellenlänge 77,53 pm) eine Abschwächung um ca. 95%. Abb. 15: Schematische Darstellung der High-throughput Protein Crystallography (PX1) Beamline 4. Thermische Analyse [20] Die Thermische Analyse ermöglicht Untersuchungen von thermischen Effekten und stellt in der Festkörperforschung eine wichtige, vielseitig einsetzbare Methode dar. Es können Phasenumwandlungen, Festkörperreaktionen und Zersetzungsreaktionen von Substanzen in Abhängigkeit von der Temperatur gemessen werden. Es gilt dabei zwei Methoden zu unterscheiden. Zum einen die Thermogravimetrie (TG), die nur die Massenänderung als Funktion der Temperatur aufzeichnet und zum anderen die sich auf eine Referenzquelle beziehende Differenzthermoanalyse (DTA). Insbesondere die DTA ist universell einsetzbar, da sie nicht nur Effekte aufzeichnet, die mit Gewichtsänderungen einhergehen, sondern ebenfalls z.B. polymorphe Umwandlungen. Bei der DTA wird die Temperaturdifferenz der Probe zu einem inerten Referenzmaterial untersucht während beide erhitzt werden, und damit die Wärmekapazität der Probe bestimmt wird. Alternativ wird das DTA-Signal aus der Temperaturdifferenz von Ofentemperatur (Soll-Wert) und Probentemperatur (Ist-Wert) bestimmt. Das Messgerät kommt also ohne Referenztiegel aus. Dieses System wird auch als „Single Thermal Analysis“ (STA) bezeichnet. Moderne Geräte ermöglichen eine gleichzeitige TG- und DTA- Messung (Abb. 16). II. Allgemeiner Teil -19- Abb. 16: SDTA/TG-Apparatur Für die Durchführung einer Messung werden in einen Korundtiegel 10 mg - 20 mg Probe eingewogen. Dieser Tiegel wird dann auf eine im Gerät integrierte Feinwaage gestellt, die auch gleichzeitig die Temperatur des Probentiegels ermittelt. Die Messung erfolgt in einem offenen System, damit gasförmige Reaktionsprodukte entweichen können. Der die Probe umgebende Stickstoffstrom soll einer Zersetzung durch Sauerstoff oder Feuchtigkeit vorbeugen. Sinnvoll zur Detektion entweichender Reaktionsprodukte ist die Kopplung eines Massenspektrometers an die SDTA/TG-Apparatur. 5. Infrarot-Spektroskopie [20, 23] Durch Infrarot-Spektroskopie können funktionelle Gruppen in einem Molekül durch Absorption von elektromagnetischer Strahlung geeigneter Frequenz (1012 Hertz - 1013 Hertz) charakterisiert werden. Die große Bedeutung der Schwingungsspektroskopie beruht auf der vergleichsweise schnellen und einfachen Präparation der Probe, der Vielfalt der Möglichkeiten zur Probenmessung und dem hohen Informationsgehalt des Spektrums. Zwei Arten von Infrarotspektroskopie werden unterschieden. Zum einen wird die Intensität der Absorption, man spricht von IR-Spektroskopie und zum anderen die Intensität der Streuung gemessen, die Ramanspektroskopie. Die Intensität der Absorption bzw. der Streuung kann als Funktion der Frequenz oder Wellenzahl erhalten werden. Beide Arten der Spektroskopie sind eng miteinander verwandt, daher finden sich in der Praxis oft kombinierte IR-Raman-Spektrometer realisiert in einem Gerät. II. Allgemeiner Teil -20- Die IR-Aktivität einer Substanz hängt entscheidend von dem Dipolmoment ab, das sich während der Schwingung ändert, und tritt in einem Bereich zwischen den Wellenzahlen 4000 cm-1 und 400 cm-1 auf. Die Intensität der erscheinenden Bande im Spektrum ist dabei proportional dieser Änderung. r mit 0 (12) : reduzierte Masse r: Gleichgewichtabstandsänderung Betrachtet man vereinfachend und unter zur Hilfenahme des Modells des harmonisches Oszillators die Schwingungsfrequenz eines zweiatomigen Moleküls, so ergibt sich: 1 2 osc mit osc k: : k (13) Schwingungsfrequenz des Oszillators Kraftkonstante Es ist ersichtlich, dass die Schwingungsfrequenz umso höher ist, je größer die Kraftkonstante k und damit die Bindungsstärke ist. Damit lässt sich qualitativ die Absorptionsfrequenz des IR-Spektrums interpretieren. Die Anzahl von möglichen Schwingungsmöglichkeiten in komplexen Molekülen gehorcht einer einfachen Beziehung. Ein Molekül aus N Atomen kann Bewegungen in drei Raumrichtungen ausführen und hat damit 3 N Freiheitsgrade. Da noch einige Freiheitsgrade auf Translationsbewegungen und Rotation entfallen ergeben sich für die Schwingungsfreiheitsgrade n: linearer Moleküle n 3N 5 (14) nichtlinearer Moleküle n 3N 6 (15) Die so zu errechnenden Schwingungen eines Moleküls nennt man Grund- oder Normalschwingungen. Im Unterschied zu dem bei der Erzeugung von IR-Spektren genutzten infraroten Licht tritt beim Raman-Effekt eine Wechselwirkung zwischen dem eingestrahlten Licht und der Polarisierbarkeit des Moleküls auf. Raman-Spektren sind Emissions-Spektren und werden seltener zur Strukturlösung herangezogen, sondern dienen ergänzend zur IR-Spektroskopie. Der Raman-Effekt tritt auf, wenn Moleküle mit monochromatischem Licht z.B. einem ArgonLaser bestrahlt werden. Ein geringer Teil des eingestrahlten Lichts (Faktor 10-4) wird mit II. Allgemeiner Teil einer bestimmten -21Frequenzverteilung gestreut. Nach spektraler Zerlegung dieser Streustrahlung und photoelektronischer Detektion zeigen sich neben der Spektrallinie der Lichtquelle weitere Spektrallinien, die Raman-Linien. Auswahlregeln dienen dazu eine Vorhersage bezüglich der Infrarot- bzw. Ramanaktivität zu treffen. Symmetrische Moleküle weisen bei Schwingungen, die symmetrisch zum Symmetriezentrum erfolgen IR-Inaktivität auf, sind aber Raman-aktiv. Umgekehrt gilt, dass alle Schwingungen, die antisymmetrisch sind, im Ramanspektrum verboten sind. II. Allgemeiner Teil -22- 6. Verwendete Chemikalien und Geräte 6.1 Chemikalien Tab. 1: Verwendete Chemikalien Bezeichnung Formel Reinheit bzw. Konzentration Platinmetalle Pt, Ir, Os, Ru, Rh 99,9% Schwefelsäure H2SO4 97% Salpetersäure HNO3 65% Salzsäure HCl 34-36% Chlor Cl2 99,8% H2SO4∙SO3 65% SO3 Hydrazin N2H4·H2O 80% 15-Krone-5 C10H20O5 98% 18-Krone-6 C12H24O6 99% Kaliumchlorid KCl 99,5% Lithiumchlorid LiCl 99,5% Kaliumnitrit KNO2 97% Natriumchlorid NaCl 99,5% Schwefelsäure rauchend (Oleum) Herkunft Heraeus, Hanau, Deutschland Riedel-de-Haen, Seelze, Deutschland Merck, Darmstadt, Deutschland Fischer, Karlsruhe, Deutschland Air Liquide, Düsseldorf, Deutschland Merck, Darmstadt, Deutschland Riedel-de-Haen, Seelze, Deutschland Alfa Aesar, Karlsruhe, Deutschland Alfa Aesar, Karlsruhe, Deutschland Merck, Darmstadt, Deutschland Merck, Darmstadt, Deutschland Alfa Aesar, Karlsruhe, Deutschland Fluka, Buchs, Deutschland II. Allgemeiner Teil Ammoniumchlorid -23- NH4Cl 99,5% SE2O3 (SE = La, Nd, Seltenen-Erd-Oxide Sm - Gd, Dy - Lu, Y) 99,9% CeO2, Pr6O11, Tb4O7 Cerchlorid CeCl3∙7H2O 99,9% Roth, Karlsruhe, Deutschland Chempur, Karlsruhe, Deutschland Roth, Karlsruhe, Deutschland 6.2 Geräte Tab. 2: Verwendete Geräte Bezeichnung Typ Herkunft Stickstoff-Handschuh-Box Unilab Braun, Garching, Deutschland Blockthermostat 5999 6501 Image-Plate-Diffraction-System IPDS I Pulverdiffraktometer STADI P Pulverdiffraktometer D5000 SDTA/TGA TGA/SDTA 851e IR-Spektrometer Tensor 27 Polarisationsmikroskop KL 1500 Schott, Deutschland Trockenschrank ET5054 Heraeus, Hanau, Deutschland Liebisch Labortechnick, Bielefeld, Deutschland Stoe & Cie, Darmstadt, Deutschland Stoe & Cie, Darmstadt, Deutschland Siemens, München, Deutschland Mettler-Toledo GmbH, Schwerzenbach, Schweiz Bruker, Karlsruhe, Deutschland II. Allgemeiner Teil -24- 7. Verwendete Computerprogramme Folgende PC-Software wurde im Rahmen dieser Arbeit verwendet: - STOE X-RED 1.22 [24] Programm zur Aufbereitung von Einkristall-Diffraktometer-Daten. - STOE X-SHAPE 1.06 [25] Programm zur Optimierung der Gestalt von Einkristallen zur anschließenden numerischen Absorptionskorrektur. - STOE X-STEP32 1.06f [26] Benutzeroberfläche für Strukturlösungs- und -verfeinerungsprogramme. - STOE WIN X-POW 2.20 [27] Programmpaket zur Steuerung von Pulverdiffraktometern und zur graphischen Darstellung und Auswertung von Pulverdiffraktometriedaten. - SHELXS-86/-97 u. SHELXL-93/-97 [28] Programm zur Berechnung eines Strukturvorschlags aus Intensitätsdaten unter Verwendung von Patterson- oder direkten Methoden bzw. Programm zur Strukturverfeinerung nach dem „least-squares“-Verfahren. - Diamond 3.2d [29] Visualisierungsprogramm für Kristallstrukturen. - Platon 1.081 [30] Programm zur Umsetzung von geometrischen Berechnungen und zur Überprüfung, Korrektur bzw. Optimierung von Kristallstrukturen. - EndNote X2.0.1 [31] Programm zur Verwaltung von Literatur. - X-Seed 2.0 [32] Programm zur Kristallstrukturbestimmung und Front-End Interface für SHELX-97. - Match! 1.9h [33] Programm zur Phasenidentifikation von Pulverdiffraktogrammen. - SciFinder Scholar 2007 [34] Benutzeroberfläche zum Durchsuchen der Chemical Abstracts (CA) Datenbanken. - Origin 8 [35] Analyse- und Darstellungsprogramm für wissenschaftliche Daten. II. Allgemeiner Teil - FindIt 1.4.6 [36] Anorganische Kristallstrukturendatenbank des Fachinformationszentrums (FIZ) Karlsruhe -25- III. 1. Chlorometallate der Selten-Erd-Elemente -26- III. Spezieller Teil 1. Chlorometallate der Selten-Erd-Elemente 1.1 Allgemeines Durch intensive Forschungsarbeiten auf dem Gebiet der Hexachlorometallate der Selten-ErdElemente konnten in unserer Arbeitsgruppe im Laufe der letzten Jahre eine Vielzahl an Verbindungen charakterisiert werden. Der Begriff „Metallate“ umschließt dabei die Platinmetalle Platin, Osmium, Iridium, Ruthenium und Rhodium. Ausgehend von den Elementen wurde das Platinmetall zunächst in eine lösliche Form überführt. Hierzu konnte die entsprechende Säure mit der allgemeinen Formel „H2MCl6·2H2O“ [37] oder ein Tetraoxid wie RuO4 verwendet und mit einer entsprechenden Selten-Erd-Quelle umgesetzt werden. Abhängig vom eingesetzten Platinmetall und Selten-Erd-Element ergaben sich die in Tabelle 1.2 zusammengefassten Verbindungen, für die vielfach metallübergreifend Isotypie gefunden wurde. So sind z.B. die Verbindungen der Metalle Platin, Osmium und Iridium mit verschiedenen Selten-Erd-Elementen isotyp: [Nd(NO3)2(H2O)6]2[PtCl6]·2H2O, [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O und [Ce(H2O)6(NO3)2]2 [IrCl6]·2H2O. Diese Verwandschaft wird durch unterschiedliche Schattierungen in der Übersichtstabelle hervorgehoben. Eine weitere strukturelle Besonderheit besteht in der Anzahl der Nitratgruppen, die an das SeltenErd-Element gebunden sind oder zum Ladungsausgleich in der Kristallstruktur eingebaut sein können. Zur Verdeutlichung wurden unterschiedliche Bereiche der Übersicht eingefärbt. Der grüne Bereich kennzeichnet Verbindungen, die über zwei chelatisierende Nitratgruppen verfügen, blau hervorgehoben sind Verbindungen mit nur einer chelatisierenden Nitratgruppe, gelb eingefärbt sind Chlorometallate ohne chelatisierende Nitratgruppen und rot gekennzeichnete Verbindungen weisen keine Nitratgruppen zum Ladungsausgleich auf. Weitere strukturelle Besonderheiten werden in den entsprechenden Kapiteln behandelt. Auch sei auf die Dissertation von Büchner hingewiesen, der ein ähnliches Verhalten bei Chloroauraten beobachten konnte [38]. Größtenteils wurden die im Folgenden besprochenen Verbindungen während der eigenen Promotions- und Diplomarbeitszeit [39] synthetisiert und charakterisiert. Ein weiterer Teil wurde der Dissertationsarbeit von Arndt entnommen [40]. Ebenfalls stammen einige Verbindungen aus betreuten Bachelor- und Forschungsarbeiten [41-43]. Eine genaue Aufschlüsselung der Herkunft findet sich im Anhang dieser Arbeit. III. 1. Chlorometallate der Selten-Erd-Elemente -27- Die Hexachloroplatinate [La(NO3)2(H2O)6]2[PtCl6]·2H2O und [Gd(NO3)(H2O)7][PtCl6] 4H2O [44] weisen Potenzial als Precursor für die Selten-Erd-Oxid-Abscheidung auf und dienten in der Vergangenheit darüber hinaus als Ausgangsverbindungen zur Darstellung eines bemerkenswerten Platin(III)-Sulfates [45]. Diese interessante Einsatzmöglichkeit lieferte ursprünglich den Anstoß weitere Vertreter in der Reihe der Platinmetalle zu synthetisieren und auf ihre Tauglichkeit zur Synthese komplexer Sulfate zu analysieren. Ergebnisse hierzu finden sich in Kapitel 3. III. 1. Chlorometallate der Selten-Erd-Elemente -28- 1.2 Übersichtstabelle Lanthan Platin Osmium [La(NO3)2(H2O)6]2[PtCl6]·2H2O [La(NO3)2(H2O)6]2[OsCl6]·2H2O [Ce(NO3)2(H2O)6][IrCl6]·2H2O Cer [Ce(H2O)9][IrCl6]Cl·2H2O Praseodym [Pr(NO3)2(H2O)6]2[PtCl6]·2H2O Neodym [Nd(NO3)2(H2O)6]2[PtCl6]·2H2O Samarium [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O Ruthenium Rhodium [Ce(H2O)9]2[Ru2OCl10]Cl2 [Pr(H2O)9]2[Ru2OCl10]Cl2 [Pr(H2O)9][RhCl6]·2H2O [Eu(NO3)(H2O)7][OsCl6]∙4H2O Europium Gadolinium [Gd(NO3)(H2O)7][PtCl6] 4H2O Dysprosium [Dy(NO3)(H2O)7][PtCl6] 4H2O Erbium [Er(H2O)8][PtCl6]NO3 ·4H2O Ytterbium [Yb(H2O)8][PtCl6]NO3·4H2O [Dy(NO3)(H2O)7][IrCl6]∙4H2O [Dy(H2O)8][IrCl6]∙6H2O [Dy(H2O)8][RhCl6]·6H2O [Lu(H2O)8][IrCl6]NO3∙4H2O Lutetium Yttrium Iridium [Y(H2O)8][PtCl6]NO3·4H2O Legende: Grün = Zwei Nitratgruppen, Blau = Eine Nitratgruppe, Gelb = Keine chelatisierende Nitratgruppe, Rot = Keine Nitratgruppe III. 1. Chlorometallate der Selten-Erd-Elemente -29- 1.3 Hexachloroplatinate(IV) 1.3.1 Allgemeines Die Hexachloroplatinate gehören zu den am besten untersuchten Metallaten, da sie bereits Gegenstand einer Doktor- bzw. Diplomarbeit in der Arbeitsgruppe waren [39, 40]. Obwohl die Hexachloroplatinate von Samarium und Yttrium bisher in keiner dieser Arbeiten erwähnt wurden, sollen sie hier nicht eingehend besprochen werden, zumal beide Verbindungen einen isotypen Vertreter mit der entsprechenden Lanthan-, Praesodym-, Neodym- bzw. ErbiumVerbindung haben. Dennoch war es sinnvoll weitere Forschungsarbeit zu investieren, um die Übergangsgrenzen innerhalb der Selten-Erd-Reihe festzustellen. Anstelle einer eingehenden Kristallstrukturbesprechung sei an dieser Stelle auf die bereits vorhandene Literatur verwiesen. Im Folgenden werden nur kurz tabellarisch die kristallographischen Daten aufgelistet und anschließend eine kurze Zusammenfassung gegeben. 1.3.2 Synthese Zur Darstellung von 100 ml 0,25 M Hexachloroplatinsäure-Lösung wurden 4,929 g (25,26 mmol) Platin in 75 ml konz. HCl und 25 ml rauchender Salpetersäure in einem 200 ml Becherglas gelöst und zum Sieden erhitzt. Zum Austreiben nitroser Gase wurde mit HCl aufgekocht, bis keine braun-roten Dämpfe mehr aufstiegen. Die Lösung der Hexachloroplatinsäure wurde in einen 100 ml Maßkolben überführt und mit dest. Wasser aufgefüllt. Zur Darstellung von z.B. [Y(H2O)8][PtCl6]NO3·4H2O wurden 346,5 mg (2 mmol) Y(NO3)3·6H2O in 8 ml 0,25 M H2[PtCl6]·2H2O (Pt) = 2 mmol) in der Wärme gelöst und das Lösungsmittel isotherm bei Raumtemperatur verdampft. Es wurden Kristalle in Form gelber Nadeln isoliert (Abb. 17). Y(NO3)3·6H2O konnte zuvor aus Y2O3 und HNO3 dargestellt werden. Dazu wurden 10 g Y2O3 in gerade soviel HNO3 gegeben, wie zum Lösen des Oxids benötigt. Es Abb. 17: Kristalle von [Y(H2O)8][PtCl6]NO3·4H2O wurde in der Wärme aufgelöst, bis die Lösung aufklarte, und dann fünf Minuten bis zur Trockne eingedampft. Die Darstellung der Praesodym-, Neodym- und SamariumVerbindungen erfolgte unter Berücksichtigung der molaren Massen der SE-Nitrate III. 1. Chlorometallate der Selten-Erd-Elemente -30- (SE = Selten-Erd) analog. Für weitere Synthesen der Hexachloroplatinate sei auf die angeführte Literatur verwiesen. 1.3.3 Kristallstrukturen von [SE(NO3)2(H2O)6]2[PtCl6]·2H2O (SE = La, Pr, Nd, Sm) Tab. 3: Kristallographische Daten von [La(NO3)2(H2O)6]2[PtCl6]·2H2O und [Pr(NO3)2(H2O)6]2[PtCl6]·2H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [La(NO3)2(H2O)6]2[PtCl6]·2H2O [Pr(NO3)2(H2O)6]2[PtCl6]·2H2O 1185,87 monoklin P21/c (Nr. 14) a = 697,4(3) pm b = 1654,5(1) pm c = 1317,7(6) pm = 93,966(5)° 1516,9(1) ų 2 0,979 0,979 0,0137; 0,0267 0,0169; 0,0271 0,512/ -0,399 e/ų 417948 1189,6 monoklin P21/c (Nr. 14) a = 695,5(1) pm b = 1652,5(2) pm c = 1318,5(3) pm = 93,93(2)° 1511,8(5) ų 2 1,291 1,291 0,0610; 0,1312 0,0659; 0,1326 3,193/ -2,735 e/ų 415843 Tab. 4: Kristallographische Daten von [Nd(NO3)2(H2O)6]2[PtCl6]·2H2O und [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [Nd(NO3)2(H2O)6]2[PtCl6]·2H2O [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O 1196,3 monoklin P21/c (Nr. 14) a = 693,01(4) pm b = 1649,5(1) pm c = 1308,36(8) pm = 94,004(7)° 1491,9(2) ų 2 1,191 1,191 0,1032; 0,2239 0,1121; 0,2272 6,283/ -3,447 e/ų 416481 1208,8 monoklin P21/c (Nr. 14) a = 692,33(3) pm b = 1641,4(1) pm c = 1296,37(6) pm = 93,970(5)° 1469,6(1) ų 2 1,039 1,039 0,0134; 0,0256 0,0178; 0,0260 0,506/ -0,393 e/ų 421771 III. 1. Chlorometallate der Selten-Erd-Elemente -31- 1.3.4 Kristallstrukturen von [SE(NO3)(H2O)7][PtCl6] 4H2O (SE = Gd, Dy) Tab. 5: Kristallographische Daten von [Gd(NO3)(H2O)7][PtCl6] 4H2O und [Dy(NO3)(H2O)7][PtCl6] 4H2O [Gd(NO3)(H2O)7][PtCl6] 4H2O Molmasse [g/mol] 825,23 Kristallsystem monoklin Raumgruppe P21/n (Nr. 14) Gitterkonstanten a = 838,72(3) pm b = 2131,98(6) pm c = 1142,63(3) pm = 95,670(4)° Zellvolumen 2033,2(1) ų Zahl der Formeleinheiten 4 1,173 Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) 1,173 0,0384; 0,0870 R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) 0,0475; 0,0892 Max./Min. Restelektronendichte 1,463/ -2,021 e/ų CSD 416470 [Dy(NO3)(H2O)7][PtCl6] 4H2O 830,48 monoklin P21/n (Nr. 14) a = 838,40(2) pm b = 2139,50(7) pm c = 1143,10(3) pm = 95,698(3)° 2040,3(1) ų 4 1,082 1,082 0,0295; 0,0810 0,0337; 0,0858 1,599/ -2,181 e/ų 416472 1.3.5 Kristallstrukturen von [SE(H2O)8][PtCl6]NO3 ·4H2O (SE = Er, Y) Tab. 6: Kristallographische Daten von [Er(H2O)8][PtCl6]NO3·4H2O und [Y(H2O)8][PtCl6]NO3 ·4H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [Er(H2O)8][PtCl6]NO3 ·4H2O 853,25 triklin P 1 (Nr. 2) a = 954,07(5) pm b = 1032,79(7) pm c = 1276,34(8) pm = 111,200(7)° γ = 92,767(7)° 1070,8(1) ų 2 0,950 0,950 0,0228; 0,0509 0,0297; 0,0521 0,899/ -1,461 e/ų 417949 [Y(H2O)8][PtCl6]NO3 ·4H2O 774,90 triklin P 1 (Nr. 2) a = 959,68(6) pm b = 1039,11(7) pm c = 1287,06(9) pm = 111,087(8)° γ = 92,800(8)° 1094,4(1) ų 2 1,044 1,044 0,0182; 0,0393 0,0257; 0,0525 1,125/ -1,360 e/ų 421772 III. 1. Chlorometallate der Selten-Erd-Elemente -32- 1.3.6 Kristallstruktur von [Yb(H2O)8][PtCl6]NO3 ·4H2O Tab. 7: Kristallographische Daten von [Yb(H2O)8][PtCl6]NO3 ·4H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [Yb(H2O)8][PtCl6]NO3 ·4H2O 859,03 orthorhombisch Cmca (Nr. 64) a = 2112,9(1) pm b = 1409,4(1) pm c = 1477,21(7) pm 4399,3(5) ų 8 0,970 0,970 0,0402; 0,0932 0,0517; 0,0966 2,993/ -3,501 e/ų 417950 1.3.7 Zusammenfassung Insgesamt sind bisher neun Hexachloroplatinate der Selten-Erd-Elemente bekannt. Die monokline Kristallstruktur [SE(NO3)2(H2O)6]2[PtCl6]·2H2O (SE = La, Pr, Nd, Sm) weist zwei chelatisierende Nitratgruppen auf. Diese befinden sich in trans-Position zueinander (Abb. 18) und binden an das zehnfach von Sauerstoffatomen koordinierte SE3+-Ion. SE O N H Abb. 18: Transständige Nitratgruppen im kationischen Komplex [SE(NO3)2(H2O)6]+ Interessanterweise finden sich nur für diesen Typ isotype Vertreter bei zwei weiteren Platinmetallen. Somit ist dies das häufigste Strukturmotiv. III. 1. Chlorometallate der Selten-Erd-Elemente -33- Die Verbindungen [SE(NO3)(H2O)7][PtCl6] 4H2O (SE = Gd, Dy) kristallisieren im orthorhombischen Kristallsystem. Der auffallendste Unterschied zu der zuvor besprochenen Reihe besteht in der nur noch neunfachen Koordination des SE3+-Ions und der damit einhergehenden Bindung nur einer Nitratgruppe. Ursächlich dafür ist der abnehmende Ionenradius der SE3+-Ionen innerhalb der Reihe. [SE(H2O)8][PtCl6]NO3·4H2O (SE = Er, Y) kristallisiert triklin mit einem nur noch achtfach von Sauerstoffatomen koordinierten SE-Ion. Der Ladungsausgleich findet durch eine freie Nitratgruppe statt. Bedingt durch die vergleichsweise kleine Masse des Yttrium-Ions ist eine Einordnung in die Reihe der Lanthanoide nicht direkt möglich. Aufgrund des Ionenradius könnte man das Element aber nach dem Dysprosium-Ion eingliedern (Abschnitt 5.3.2). [Yb(H2O)8][PtCl6]NO3·4H2O weist bei einem nicht isotypen Charakter die gleiche Summenformel wie die zuvor beschriebenen Verbindungen des Erbiums und Yttriums auf, kristallisiert allerdings in einer höhersymmetrischen orthorhombischen Raumgruppe. III. 1. Chlorometallate der Selten-Erd-Elemente -34- 1.4 Hexachloroosmate(IV) 1.4.1 Allgemeines Mit den Hexachloroosmaten gelang es erstmals, unsere Kenntnisse über Hexachloroplatinate der Selten-Erd-Elemente auf ein weiteres Platinmetall auszuweiten. Hierbei musste zuerst das Osmium durch Chlorierung in einer Alkalichloridschmelze verfügbar gemacht und anschließend aufgearbeitet werden. Aus der Übersichtstabelle 1.2 ist erkennbar, dass die Verbindungen [SE(NO3)2(H2O)6]2[OsCl6]·2H2O (La, Pr) isotyp zu den Vertretern des Platins kristallisieren. Aus diesem Grund wird im Folgenden auf die bisher unbekannte Verbindung [Eu(NO3)(H2O)7][OsCl6]∙4H2O (a = 672,00(3) pm, b = 2149,75(9) pm, c = 732,61(3) pm, = 106,549(1)°) eingegangen. Im Vergleich zu einer der Summenformel nach analogen Platinverbindung [Gd(NO3)(H2O)7][PtCl6] 4H2O (a = 838,72(3) pm, b = 2131,98(6) pm, c = 1142,63(3) pm, = 95,670(4)°) fällt auf, dass sie mit unterschiedlichen Zellparametern kristallisieren. 1.4.2 Synthese [9] Zunächst wurden 4 g (21 mmol) feines Osmiumpulver mit 8 g (137 mmol) NaCl zu einer homogenen gräulichen Masse verrieben und diese anschließend in ein Quarzglasschiffchen gegeben. Nachdem dieses in ein Quarzrohr eingebracht wurde, begann ein zweistündiger Trocknungsvorgang bei 200 °C im Röhrenofen. Während der Trocknung durchströmte ein kontinuierlicher Stickstoffstrom das Rohr. Die abgeschlossene Trocknung war durch ausbleibendes Kondenswasser am hinteren, kalten Ende des Quarzrohres zu erkennen. Nun wurde von Stickstoff- auf Chlorgas umgestellt und ein kontinuierlicher Gasstrom zugeführt. Bei 625 °C erfolgte die Chlorierung der Reaktionsmasse für mindestens sechs Stunden im Ofen: Os + 2 NaCl +2 Cl2 Na2[OsCl6] Nach beendeter Chlorierung wurde die Reaktionsmischung mit der im Rohr verbliebenen Chlorgasatmosphäre über Nacht zum Abkühlen stehen gelassen. Am nächsten Morgen wurde das im Rohr und der Apparatur verbliebene Chlorgas mittels Stickstoffgasspülung ausgetrieben und das Schiffchen entnommen. III. 1. Chlorometallate der Selten-Erd-Elemente -35- Der größtenteils aus Na2[OsCl6] bestehende Schmelzkuchen zeigte eine rot-bräunliche Färbung (Abb. 19). Abb. 19: Na2[OsCl6] als Schmelzkuchen (links) und als Pulver (rechts) Dieser wurde in ein 100 ml Becherglas gegeben und in möglichst wenig heißem Wasser (40 ml) gelöst. Sodann konnte mit einer Filterfritte (Porengröße 4) heiß filtriert werden, um unreagiertes Osmium zu separieren. Durch Einleiten von Chlorwasserstoffgas (Apparaturaufbau s. Punkt 2.4, Allgemeinen Teil) erfolgte die Fällung von überschüssigen Natrium-Ionen als NaCl. Anschließend wurden 20 ml Königswasser (KW) hinzugegeben, zum Sieden erhitzt und mit einer heißen Lösung von 4 g (75 mmol) NH4Cl in 10 ml Wasser vermischt. Nach Abkühlung auf Raumtemperatur wurde die Reaktionsmischung für weitere 40 Minuten im Eisbad zum Auskristallisieren stehen gelassen. Es konnten tiefrote Oktaeder von (NH4)2[OsCl6] isoliert werden (Abb. 20). Abb. 20: (NH4)2[OsCl6] als Oktaeder und als Pulver Das erhaltene (NH4)2[OsCl6] wurde zweimal mit je 20 ml NH4Cl-Lösung, Ethanol und Diethylether gewaschen und dann an der Luft getrocknet. Das gereinigte Produkt wurde anschließend in 250 ml Königswasser gelöst und bis zur quantitativen Umsetzung des Ammoniums im Wasserbad erhitzt. Zur vollständigen Zersetzung von HNO3 erfolgte mehrfaches Eindampfen und ein Volumenausgleich mit konz. HCl. Dabei war darauf zu achten, dass weder zu weit eingedampft noch zu hoch geheizt wurde, da ansonsten eine III. 1. Chlorometallate der Selten-Erd-Elemente -36- thermische Zersetzung der Osmiumsäure stattfand. Die restliche HCl-Lösung wurde nach abgeschlossenem Eindampfvorgang im Vakuum abgezogen und ca. 15 ml tieforanges Produkt verblieben im Becherglas. Anschließend wurde in einen Maßkolben überführt und dieser mit dest. Wasser aufgefüllt. Es konnte eine orangefarbene H2[OsCl6]-Lösung mit c(Os) = 0,1 mmol/ml erhalten werden. Die Darstellung von [Eu(NO3)(H2O)7][OsCl6]∙4H2O erfolgte durch Lösen von 427,3 mg (1 mmol) Eu(NO3)3·6H2O und 10 ml der H2[OsCl6]-Lösung (Os = 1 mmol) in 10 ml dest. Wasser. Anschließend wurde mehrere Tage isotherm in einer Kristallisierschale stehen gelassen und rote Kristalle (Abb. 21), die an der Luft langsam verwittern, isoliert. Das Selten-Erd-Nitrat konnte, wie unter Punkt 1.3.2 beschrieben, aus Eu2O3 dargestellt werden. Abb. 21: Kristalle von [Eu(NO3)(H2O)7][OsCl6]∙4H2O III. 1. Chlorometallate der Selten-Erd-Elemente -37- 1.4.3 Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O [Eu(NO3)(H2O)7][OsCl6]∙4H2O kristallisiert monoklin in der Raumgruppe P21/m mit zwei Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein Os4+-Ion, dass sich auf der speziellen Lage 2a befindet. Dabei liegt es entsprechend seiner d6-Konfiguration in einer nahezu perfekten oktaedrischen Umgebung vor. Die internuklearen Os-Cl-Abstände liegen im Bereich von 233,4 pm - 234,0 pm (Tab. 9). Die Winkel zwischen den Cl-Atomen betragen entsprechend einer oktaedrischen Koordination 180° bzw. ca. 90° (Tab. 9). Die OsCl62--Anionen sind von dem komplexen Kation [Eu(NO3)(H2O)7]2+ umgeben. Das Eu3+-Ion ist dabei von neun Sauerstoffatomen in Form eines verzerrten trigonalen Prismas (rot gekennzeichnet in Abb. 22) koordiniert, welches an den drei Vierecksflächen von Sauerstoffatomen überkappt ist (gelb gekennzeichnet in Abb. 22). Zwei der überkappenden Sauerstoffatome gehören zu einer Nitratgruppe, die Restlichen zu Wassermolekülen. Die Nitratgruppen zeigen dabei orthogonal zur b-Achse in Richtung der [OsCl6]2-- Oktaeder (Abb. 24). Die Eu-O-Abstände liegen in dem literaturbekannten Bereich von 238 pm - 258 pm (Tab. 9). Dabei sind die Abstände der verbrückenden O-Atome der Nitratgruppe zum Europiumatom im Mittel 14,4 pm länger (253 pm - 259 pm) als die Abstände der O-Atome der koordinierenden Wassermoleküle (238 pm - 243 pm) zum Zentralatom. Ferner differieren die N-O-Abstände innerhalb der Nitratgruppe. Die O-Atome, die direkt an das Zentralatom binden, haben einen längeren Abstand (126 pm - 127 pm), verglichen mit dem nicht koordinierenden O-Atom der Nitratgruppe (124 pm). Ferner sind in der Elementarzelle (Abb. 24) acht Moleküle Kristallwasser enthalten. Ein Donor-Akzeptor-Abstand von 280 pm - 380 pm zwischen den Sauerstoffatomen des kationischen Komplexes und den Sauerstoffatomen Kristallwassermolekülen deutet auf mäßig starke bis schwache H-Brücken hin. Eu O N Abb. 22: Kationischer Komplex [Eu(NO3)(H2O)7]2+ in der Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O ................ III. 1. Chlorometallate der Selten-Erd-Elemente -38- Os Cl Abb. 23: Oktaedrisch koordiniertes [OsCl6]2--Ion in der Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O a b Os Cl Eu O H N Abb. 24: Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O in Richtung [001] III. 1. Chlorometallate der Selten-Erd-Elemente -39- Tab. 8: Kristallographische Daten von [Eu(NO3)(H2O)7][OsCl6]∙4H2O [Eu(NO3)(H2O)7][OsCl6]∙4H2O 815,05 monoklin P21/m (Nr. 11) a = 672,00(3) pm b = 2149,75(9) pm c = 732,61(3) pm = 106,549(1)° 1014,51(7) ų 2 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 19581 5580 4746 0,0417; 0,0385 SHELXS97 und SHELXL97[28] 0,904 0,904 0,0262; 0,0473 0,0316; 0,0488 1,772/ -2,024 e/ų 421768 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Tab. 9: Ausgewählte internukleare Abstände [pm] [Eu(NO3)(H2O)7][OsCl6]∙4H2O Eu1- O1 O2 O3 O4 O11 O12 Os1- Cl1 Cl2 Cl3 O11 O12 O13 N1- Cl1-Os1-Cl2 Cl1-Os1-Cl2 Cl1-Os1-Cl3 Cl1-Os1-Cl3 Cl2-Os1-Cl3 Cl2-Os1-Cl3 243,2(3) (2x) 243,4(3) (2x) 238,2(3) 240,9(3) (2x) 258,4(4) 252,7(3) Ø244,9(3) 233,99(8) (2x) 234,00(7) (2x) 233,41(8) (2x) 125,4(5) 126,7(5) 123,5(5) 90,09(3) 89,91(3) 90,28(3) 89,72(3) 90,25(3) 89,75(3) und Winkel [°] in III. 1. Chlorometallate der Selten-Erd-Elemente O11-N1-O12 O11-N1-O13 O12-N1-O13 N1-O11-Eu1 N1-O12-Eu1 O1-Eu1-O2 O1-Eu1-O3 O1-Eu1-O4 O1-Eu1-O11 O1-Eu1-O12 O2-Eu1-O2 O2-Eu1-O4 O2-Eu1-O12 O3-Eu1-O4 O3-Eu1-O11 O4-Eu1-O4 O11-Eu1-O12 -40- 116,5(3) 121,6(4) 121,9(4) 59,5(2) 57,0(2) 71,7(1) 78,19(8) 73,1(1) 68,37(7) 81,65(8) 72,0(2) 69,7(1) 72,59(9) 79,1(1) 76,7(1) 68,5(2) 49,6(1) 1.4.3.1 Thermischer Abbau von [Eu(NO3)(H2O)7][OsCl6]∙4H2O Für die thermische Analyse wurden ca. 10 mg [Eu(NO3)(H2O)7][OsCl6]∙4H2O in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur gegeben. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Wie dem Diagramm (Abb. 25) zu entnehmen ist, existiert nur ein klar definierter Zersetzungsschritt des [Eu(NO3)(H2O)7][OsCl6]∙4H2O. Der thermische Abbau der Verbindung beginnt bereits bei 50 °C und endet, ohne isolier- und erkennbare Zwischenstufen, bei 600 °C und einem Massenverlust von 69,2%. Bis zur Zieltemperatur von 1100 °C beträgt der totale Massenverlust 71,4%. Es ist folglich nicht möglich Intermediate des thermischen Abbaus zu bestimmen und so beschränkten sich die Untersuchungen auf eine Rückstandsanalyse. Die pulverdiffraktometrische Analyse des gräulichen Rückstandes (Abb. 26) wiesen die Europium-Verbindungen EuOCl und Eu2O3 zweifelsfrei nach. Nicht zugeordnete Peak-Intensitäten sind Messartefakten zuzuordnen. Bemerkenswert ist jegliches Fehlen einer Osmium-Verbindung oder elementarem Osmiums. Vor allem letzteres wäre nach Erfahrungen mit den Hexachloroplatinaten und der untersuchten isotypen Iridium-Verbindung [Dy(NO3)(H2O)7][IrCl6]∙4H2O [41] zu erwarten gewesen. In beiden Fällen ist als Rückstand u.a. Platin bzw. Iridum nachgewiesen worden. III. 1. Chlorometallate der Selten-Erd-Elemente -41- Es kann daher nur gemutmaßt werden, dass sich leicht flüchtige Verbindungen des Osmiums, wie z.B. OsO4 bei der Zersetzung gebildet und beim Heizvorgang verflüchtigt haben. Dies legt auch der hohe Massenverlust bis ca. 200 °C nahe. TG DTA 100 6 Masse [%] 60 3 DTA-Signal T [°C] 80 40 20 0 200 400 600 800 1000 Temperatur [°C] Abb. 25: DTA/TG-Kurve des thermischen Abbaus von [Eu(NO3)(H2O)7][OsCl6]∙4H2O 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 EuOCl-simuliert -80 Eu2O3-simuliert -100 20 30 40 2 50 60 [°] Abb. 26: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Eu(NO3)(H2O)7][OsCl6]∙4H2O III. 1. Chlorometallate der Selten-Erd-Elemente -42- 1.4.4 Kristallstrukturen von [SE(NO3)2(H2O)6]2[OsCl6]·2H2O (SE = La, Pr) Tab. 10: Kristallographische Daten von [La(NO3)2(H2O)6]2[OsCl6]·2H2O und [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [La(NO3)2(H2O)6]2[OsCl6]·2H2O [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O 1180,9 monoklin P21/c (Nr. 14) a = 692,79(4) pm b = 1645,0(1) pm c = 1309,76(8) pm = 93,831(7)° 1489,3(2) ų 2 0,939 0,939 0,0175; 0,0362 0,0226; 0,0369 0,812/ -0,949 e/ų 421769 1184,9 monoklin P21/c (Nr. 14) a = 692,93(2) pm b = 1641,95(4) pm c = 1307,92(3) pm = 93,870(2)° 1484,70(7) ų 2 0,992 0,992 0,0128; 0,0292 0,0156; 0,0296 0,506/ -0,393 e/ų 421770 1.4.5 Zusammenfassung Die Synthese der Hexachloroosmate unterscheidet sich stark von jenen der Hexachloroplatinate. Die Reaktionsträgheit des Osmiums erforderte den Einsatz eines starken Oxidationsmittels wie Chlorgas und Temperaturen von über 600 °C. Einmal oxidiert, zeichnete sich die Osmiumsäure H2[OsCl6]·2H2O durch thermische Instabilität aus. Sowohl bei der Synthese der Säure als auch bei der anschließenden thermischen Zersetzung von [Eu(NO3)(H2O)7][OsCl6]∙4H2O war ein rascher Zerfall des Hexachloroosmats zu beobachten. Musste bei der Aufarbeitung von (NH4)2[OsCl6] penibel auf das richtige Temperaturfenster (< 100 °C) geachtet werden, zeichnete sich bei der gewollten thermischen Zersetzung von [Eu(NO3)(H2O)7][OsCl6]∙4H2O der Grund ab. Ursächlich könnten einmal die bereits angesprochene Flüchtigkeit des Osmiums, als z.B. OsO4, sein. Genauso wichtig erscheint aber die mit der Aufarbeitung einhergehende Instabilisierung des OsCl62--Ions. Befand sich direkt nach der Chlorierung das Osmium noch in der dichtgepackten kubischen Struktur (K2PtCl6Typ, Raumgruppe Fm3m ) von Na2[OsCl6] und somit in einem engen Verbund mit weiteren Oktaedern und Kationen, so liegt das OsCl62--Ion in der Säure und in der Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O weitestgehend isoliert vor. III. 1. Chlorometallate der Selten-Erd-Elemente -43- Trotz zahlreicher Versuche gelang es nicht, [SE(NO3)2(H2O)6]2[OsCl6]·2H2O (La, Pr) oder [Eu(NO3)(H2O)7][OsCl6]∙4H2O als Ausgangsverbindungen für die Umsetzung mit Mineralsäuren wie Schwefelsäure, Oleum oder Selensäure in Ampullen oder Autoklaven zu nutzen. In letzteren konnte generell keine Reaktion oder Kristallbildung, sondern nur ein Lösen des Edukts in der Säure beobachtet werden. Bei niedrigen Reaktionstemperaturen (<200 °C) in Duranglasampullen wurden regelmäßig die bereits charakterisierten Selten-ErdHydrogensulfate SE(HSO4)3 [46] erhalten. Bei Temperaturen deutlich über 200 °C gelang die Darstellung der ersten wasserfreien Selten-Erd-Disulfate SE2(S2O7)3 (SE = La, Ce, Pr, Nd) [47], die in Kapitel 5.3 eingehend behandelt werden. III. 1. Chlorometallate der Selten-Erd-Elemente -44- 1.5 Hexachloroiridate(III) und Hexachloroiridate(IV) 1.5.1 Allgemeines Weitere aufschlussreiche Ergebnisse wurden ausgehend von dem Platinmetall Iridium erhalten. Die Hexachloroiridate sind den Hexachloroosmaten strukturell ähnlicher als den Hexachloroplatinaten, wie aus der Übersichtstabelle 1.2 erkennbar ist. Die Kristallstruktur der Verbindung [Ce(NO3)2(H2O)6]2[IrCl6]·2H2O ist isotyp zu der entsprechenden LanthanVerbindungen des Platins und Osmiums. Isostrukturell kristallisieren ebenfalls das Hexachloroplatinat [Y(H2O)8]2[PtCl6]NO3·4H2O und das Hexachloroiridat [Lu(H2O)8]2[IrCl6]NO3·4H2O. Eine entsprechende Verbindung des Osmiums ist zu erwarten, wurde aber bisher nicht erhalten. Dagegen ist [SE(NO3)(H2O)7][PtCl6]∙4H2O (Gd, Dy) nicht isotyp zu [Dy(NO3)(H2O)7][IrCl6]∙4H2O [48]. Isotyp kristallisieren allerdings die Verbindungen [Eu(NO3)(H2O)7][OsCl6]∙4H2O und [Dy(NO3)(H2O)7][IrCl6]∙4H2O. Aus den strukturellen Verwandtschaftsverhältnissen ist zu ersehen, dass eine erneute Strukturbeschreibung von [Ce(NO3)2(H2O)6]2[IrCl6]·2H2O und [Dy(NO3)(H2O)7][IrCl6]∙4H2O nicht notwendig ist. Lohnenswerter erscheint die Diskussion der bisher nicht bekannten und nitratfreien Verbindungen [Ce(H2O)9][IrCl6]Cl·2H2O und [Dy(H2O)8][IrCl6]∙6H2O, die Thema dieses Kapitels sein sollen. 1.5.2 Synthese [49] Wie bereits unter Punkt 1.4.2 beschrieben verläuft auch die Synthese der benötigten Iridiumsäure „H2[IrCl6]·2H2O“ durch die Oxidation von elementarem Iridium im Chlorgasstrom. Dazu wurden 4 g (21 mmol) feines Iridium-Pulver mit 8 g (137 mmol) NaCl im Quarzglasschiffchen bei 625 °C chloriert. Der größtenteils aus Na2[IrCl6] bestehende Schmelzkuchen zeigte eine tiefrote bis braune Färbung (Abb. 27). Abb. 27: Na2[IrCl6] als Schmelzkuchen im Quarzglasschiffchen III. 1. Chlorometallate der Selten-Erd-Elemente -45- Die Aufarbeitung verlief ebenfalls analog Punkt 1.4.2, wobei sich die Iridiumsäure thermisch weitaus stabiler verhielt. Es konnte problemlos bis zur Trockne eingedampft werden. Mehrfache Kristallisierungsversuche der Iridiumsäure verliefen leider erfolglos. Dafür wurde in einer gesättigten Lösung, die durch eine Kältemischung aus Ethanol und Natriumchlorid gekühlt wurde, mit einem Glasstab längere Zeit gerührt bzw. an der Glaswand gerieben. Abb. 28 zeigt eine bis zur Trockne eingedampfte Iridiumsäure-Lösung und die entsprechende Lösung mit dest. Wasser aufgefüllt im Maßkolben. Bei dem violetten äußeren Rand im Becherglas handelt es sich um „IrO2·xH2O“, welches bei der Hydrolyse von Ir4+ Verbindungen gebildet und abgeschieden wird. Abb. 28: H2[IrCl6]·xH2O zur Trockne eingeengt (links) und in Lösung (rechts) Die Darstellung von [Ce(H2O)9][IrCl6]Cl·2H2O erfolgte durch Lösen von 372,57 mg (1 mmol) CeCl3·7H2O und 5 ml der 0,1 mM H2[IrCl6]-Lösung in 10 ml dest. Wasser. [Dy(H2O)8][IrCl6]∙6H2O wurde erhalten, indem 457 mg (1 mmol) Dy(NO3)3∙6H2O in 10 ml der 0,1 mM H2[IrCl6]-Lösung gegeben wurden. Anschließend ruhten beide Versuchsansätze mehrere Tage in einer Kristallisierschale. Es sei an dieser Stelle daraufhin gewiesen, dass bei der Synthese von [Dy(H2O)8][IrCl6]∙6H2O eine andere „Charge“ Iridiumsäure verwendet wurde als bei der Darstellung der übrigen Hexachloroiridate. Vermutlich durch unvollständige Oxidation bei der Chlorierung ergab sich ein Gemisch aus H3[IrCl6]·2H2O und H2[IrCl6]·2H2O bei der Aufarbeitung der Säure. Folglich wurde bei der Kristallisierung der Ansätze ebenfalls eine Mischphase von Kristallen aus [Dy(H2O)8][IrCl6]∙6H2O und [Dy(NO3)(H2O)7][IrCl6]∙4H2O bzw. Ir3+/Ir4+ erhalten. III. 1. Chlorometallate der Selten-Erd-Elemente -46- Für [Dy(H2O)8][IrCl6]∙6H2O ergaben sich Kristalle in Form hellgelber bis farbloser luftstabiler Nadeln und für [Ce(H2O)9][IrCl6]Cl·2H2O rote bis orange Plättchen, wobei die Farbe je nach Dicke des Plättchens schwächer oder intensiver und von einem Rot ins Orange wechselte (Abb. 29). Abb. 29: Kristalle von [Ce(H2O)9]2[IrCl6]Cl·2H2O (links) und die Mischphase von [Dy(H2O)8][IrCl6]∙6H2O und [Dy(NO3)(H2O)7][IrCl6]∙4H2O (rechts) 1.5.3 Kristallstruktur von [Ce(H2O)9][IrCl6]Cl·2H2O [Ce(H2O)9][IrCl6]Cl·2H2O kristallisiert orthorhombisch in der azentrischen Raumgruppe P212121 mit vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein Ir4+-Ion, das sich, wie alle anderen Atome in der Zelle, auf einer allgemeinen Lage befindet. Dabei liegt es entsprechend seiner d5-Konfiguration in einer nahezu perfekt oktaedrischen Umgebung vor. Die internuklearen Ir-Cl-Abstände liegen im Bereich von 230,4 pm - 233,2 pm (Tab. 12). Die Winkel zwischen den Cl-Atomen betragen entsprechend einer nahezu oktaedrischen Koordination 180° bzw. ca. 90°, wobei eventuelle Abweichungen < 1,4° betragen (Tab. 12). Die IrCl62--Anionen sind von dem kationischen Komplex [Ce(H2O)9]3+ umgeben. Es ist dabei eine abwechselnde Anordnung beider Einheiten zu beobachten (Abb. 31). Das Ce3+-Ion ist von neun kristallographisch unterscheidbaren Sauerstoffatomen koordiniert. Jedes dieser Sauerstoffatome gehört dabei zu einem Wassermolekül. Cer- und Sauerstoffatome bilden dabei ein dreifach überkapptes trigonales Prisma (Abb. 30). Solch ein Koordinationspolyeder wurde bereits unter 1.4.3 für das Europiumatom in der Kristallstruktur von [Eu(NO3)(H2O)7][OsCl6]∙4H2O beobachtet und gehört allgemein zu den häufigsten für [SEO9]-Polyeder, da es sich bei dieser Konformation um den ernergieärmsten Zustand der Sauerstoffatome handelt [50, 51]. Die Ce-O-Bindungslängen liegen im erwarteten Bereich von 250,1 pm - 257,3 pm und stimmen sehr gut mit den in der Literatur verzeichneten Werten III. 1. Chlorometallate der Selten-Erd-Elemente -47- von 248 pm - 260 pm für CeCl3∙7H2O überein [52]. Wie erwartet haben die das Prisma aufspannenden Sauerstoffatome einen im Durchschnitt um 3 pm kürzeren Abstand zum Zentralatom als die überkappenden Sauerstoffatome. Durch die in der Elementarzelle (Abb. 31) befindlichen Chlorid-Ionen und die freien Kristallwassermolekülen zusammengehalten. IrCl62--Anionen werden Dies geschieht über mäßig [Ce(H2O)9]3+-Kationen und starke bis schwache Wasserstoffbrückenbindungen. Zwischen den Wassermolekülen des kationischen Komplexes und den Kristallwassermolekülen betragen die Wasserstoffbrückenbindungen 276 pm - 287 pm. Brückenbindungen ergeben sich ebenfalls zwischen den Chloridionen (Akzeptor) der anionischen Komplexe und den koordinierten Wassermolekülen (Donor) von 327 pm - 335 pm. Vielfältige Donor-Akzeptor Bindungen im Bereich von 313 pm - 325 pm treten weiterhin zwischen den freien Chlorid-Ionen und Wassermolekülen [Ce(H2O)9]3+-Kations auf. Ce O Abb. 30: Koordinationspolyeder der kationischen Einheit [Ce(H2O)9]3+ in der Kristallstruktur von [Ce(H2O)9][IrCl6]Cl·2H2O ................ b c Ir Cl Ce O Abb. 31: Kristallstruktur von [Ce(H2O)9][IrCl6]Cl·2H2O in Richtung [100] des III. 1. Chlorometallate der Selten-Erd-Elemente -48- Tab. 11: Kristallographische Daten von [Ce(H2O)9][IrCl6]Cl·2H2O [Ce(H2O)9][IrCl6]Cl·2H2O 756,47 orthorhomisch P212121 (Nr. 19) a = 853,34(3) pm b = 935,56(4) pm c = 2530,2(1) pm 2020,0(2) ų 4 Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 17974 3797 3133 0,0417; 0,0385 SHELXS97 und SHELXL97[28] 0,821 0,821 0,0240; 0,0410 0,0316; 0,0417 0,991/ -1,132 e/ų -0,023(7) 421763 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte Flack-x Parameter CSD Tab. 12: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [Ce(H2O)9][IrCl6]Cl·2H2O Ce1- O1 O2 O3 O4 O5 O6 O7 O8 O9 Ir1- Cl1 Cl2 Cl3 Cl4 Cl5 Cl6 250,1(7) 253,8(6) 253,8(6) 257,3(5) 254,1(6) 252,7(4) 255,4(5) 252,7(5) 251,8(6) Ø253,5(6) 233,0(2) 233,1(2) 232,8(2) 233,2(2) 230,4(2) 232,0(2) III. 1. Chlorometallate der Selten-Erd-Elemente Cl1-Ir1-Cl2 Cl1Ir1-Cl4 Cl2-Ir1-Cl4 Cl3Ir1-Cl1 Cl3-Ir1-Cl2 Cl3-Ir1-Cl4 Cl5-Ir1-Cl1 Cl5-Ir1-Cl2 Cl5-Ir1-Cl3 Cl5-Ir1-Cl4 Cl5-Ir1-Cl6 Cl6-Ir1-Cl1 Cl6-Ir1-Cl2 Cl6-Ir1-Cl3 Cl6-Ir1-Cl4 O1-Ce1-O2 O1-Ce1-O5 O1-Ce1-O9 O2-Ce1-O4 O2-Ce1-O5 O3-Ce1-O2 O5-Ce1-O4 O6-Ce1-O2 O6-Ce1-O4 O7-Ce1-O4 O8-Ce1-O3 O8-Ce1-O5 O9-Ce1-O2 O9-Ce1-O8 -49- 90,01(7) 89,44(7) 89,73(7) 178,93(8) 91,06(7) 90,51(7) 90,12(7) 89,17(7) 89,95(7) 178,82(8) 91,37(7) 89,45(7) 179,23(7) 89,48(7) 89,72(7) 69,0(2) 71,1(2) 92,4(2) , 124,2(2) 128,5(2) 136,0(2) , 67,9(2) 67,6(2) 67,7(2) 117,6(2) 77,7(2) 134,8(2) 68,5(2) 77,6(2) 1.5.3.1 Thermischer Abbau von [Ce(H2O)9][IrCl6]Cl·2H2O Für die thermische Analyse wurden ca. 10 mg [Ce(H2O)9][IrCl6]Cl·2H2O in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur gegeben. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von zwei Zersetzungsschritten (Tab. 13) beginnt bereits bei 25 °C, endet bei 381 °C und zeigt einen Massenverlust von 29,8%. Dies deutet rechnerisch auf den Abgang von sieben Molekülen Kristall- und Koordinationswasser sowie eineinhalb Cl2-Molekülen hin. Ein mögliches Intermediat wurde aber nicht pulverdiffraktometrisch bestimmt. In der zweiten und letzten Zersetzungsstufe von 381 °C - 900 °C bilden sich elementares Iridium und CeO2. Damit wäre vom Abgang von vier Moleküle HCl auszugehen. III. 1. Chlorometallate der Selten-Erd-Elemente -50- Beide Zersetzungsprodukte konnten pulverdiffraktometrisch im Rückstand der DTA/TGUntersuchungen an [Ce(H2O)9][IrCl6]Cl·2H2O zweifelsfrei nachgewiesen werden (Abb. 33). Der beobachtete Gesamtmassenverlust betrug 53,5% und stimmt genau mit dem errechneten Massenverlust von 53,3%, basierend auf den Rückständen Ir und CeO2, überein. Daher kann von einer hohen Phasenreinheit der Probe ausgegangen werden. Tab. Ergebnisse 13: der DTA/TG-Untersuchungen an [Ce(H2O)9][IrCl6]Cl·2H2O, M = 778,67 g/mol TBeginn [°C] 25 TEnde [°C] 381 Tmax [°C] 260 381 900 658 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 29,8 29,8 23,7 Produkt unbekanntes Intermediat 23,2 Ir, CeO2 ^endo 100 DTA TG 90 Masse [%] DTA-Signal [ T] 80 70 60 50 200 400 600 800 1000 T [°C] Abb. 32: DTA/TG-Kurve des thermischen Abbaus von [Ce(H2O)9][IrCl6]Cl·2H2O III. 1. Chlorometallate der Selten-Erd-Elemente -51- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Ir-simuliert -80 CeO2-simuliert -100 30 40 50 60 70 2 80 90 100 [°] Abb. 33: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Ce(H2O)9][IrCl6]Cl·2H2O 1.5.4 Kristallstruktur von [Dy(H2O)8][IrCl6]∙6H2O Die wasserreiche Verbindung [Dy(H2O)8][IrCl6]∙6H2O kristallisiert monoklin in der Raumgruppe P21/c in Form hellgelber bis farbloser Nadeln. Dabei finden sich vier Formeleinheiten in der Elementarzelle. Alle Atome liegen dabei auf allgemeinen WyckoffLagen. Die Iridiumatome weisen eine d6-Konfiguration mit der Oxidationsstufe +3 und oktaedrischer Koordination auf. In dem durch sechs Chlorid-Ionen gebildeten Oktaeder betragen die Ir-Cl-Abstände 235,6 pm - 237,7 pm. Die Cl-Ir-Cl-Winkel weichen bis zu 2° vom rechten Winkel ab (Tab. 14). Die IrCl63--Anionen sind von dem kationischen Komplex [Dy(H2O)8]3+ umgeben. Es ist dabei eine abwechselnde Anordnung beider Einheiten zu beobachten (Abb. 35), wobei sich entlang [010] der Gesamtstruktur leicht ineinander verschobene Schichten erkennen lassen. Das Dy3+-Ion ist von acht kristallographisch unterscheidbaren Sauerstoffatomen koordiniert. In dieser Koordinationssphäre gehört jedes dieser O-Atome zu einem Wassermolekül. Dysprosium- und Sauerstoffatome bilden dabei ein leicht verzerrtes quadratisches Antiprisma (Abb. 34), welches durch zwei Quadrate und acht gleichseitige Dreiecke aufgespannt wird. In der gezeigten Ansicht liegen beide Quadrate parallel zur Zeichenebene und werden von je vier Dreiecken umgeben. III. 1. Chlorometallate der Selten-Erd-Elemente -52- Zusätzlich findet sich die hohe Anzahl von sechs Molekülen Kristallwasser pro Elementarzelle. Daher können sich eine Vielzahl von Donor-Akzeptor-Wechselwirkungen zwischen den genannten Kristallwassermolekülen und den koordinierten Wassermolekülen sowie den Chloridatomen des Oktaeders ausbilden. Es werden Abstände von 276 pm - 330 pm beobachtet. Abb. 34: Koordinationspolyeder der kationischen Einheit [Dy(H2O)8]3+ in der Kristallstruktur von [Dy(H2O)8][IrCl6]∙6H2O (links) und ideales quadratisches Antiprisma (rechts) b c Ir Cl Dy O H Abb. 35: Kristallstruktur von [Dy(H2O)8][IrCl6]∙6H2O in Richtung [100] III. 1. Chlorometallate der Selten-Erd-Elemente -53- Tab. 14: Kristallographische Daten von [Dy(H2O)8][IrCl6]∙6H2O [Dy(H2O)8][IrCl6]∙6H2O 819,62 monoklin P21/c (Nr. 14) a = 1175,39(8) pm b = 1140,58(5) pm c = 1602,8(1) pm = 103,557(8)° 2088,8(2) ų 4 Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 21289 4112 2872 0,0738; 0,1139 SHELXS97 und SHELXL97[28] 0,585 0,583 0,0213; 0,0432 0,0444; 0,0442 1,341/ -0,834 e/ų 421764 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Tab. 15: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [Dy(H2O)8][IrCl6]∙6H2O Dy1- O1 O2 O3 O4 O5 O6 O7 O8 Ir1- Cl1 Cl2 Cl3 Cl4 Cl5 Cl6 231,2(4) 235,5(5) 234,8(5) 240,5(5) 237,5(5) 233,3(5) 235,8(5) 240,1(5) Ø236,1(5) 236,1(1) 235,6(1) 236,0(1) 236,0(2) 237,7(2) 236,7(2) III. 1. Chlorometallate der Selten-Erd-Elemente -5489,39(6) 91,40(5) 90,38(5) 90,48(5) 90,56(5) 90,11(5) 89,68(5) 88,00(5) 91,04(6) 89,62(5) 88,84(5) 90,51(6) 90,0(2) 70,7(2) 76,9(2) 75,4(2) 81,0(2) 95,2(2) 75,5(2) 70,9(2) 76,9(2) 70,1(2) 88,3(2) 73,3(2) 78,5(2) 73,0(2) 73,6(2) Cl1-Ir1-Cl3 Cl1-Ir1-Cl4 Cl1-Ir1-Cl5 Cl1-Ir1-Cl6 Cl2-Ir1-Cl3 Cl2-Ir1-Cl4 Cl2-Ir1-Cl5 Cl2-Ir1-Cl6 Cl3-Ir1-Cl4 Cl3-Ir1-Cl6 Cl4-Ir1-Cl5 Cl5-Ir1-Cl6 O1-Dy1-O2 O1-Dy1-O4 O1-Dy1-O5 O1-Dy1-O8 O2-Dy1-O4 O2-Dy1-O6 O2-Dy1-O7 O2-Dy1-O8 O3-Dy1-O4 O3-Dy1-O5 O3-Dy1-O6 O3-Dy1-O7 O5-Dy1-O6 O5-Dy1-O8 O6-Dy1-O7 1.5.4.1 Thermischer Abbau von [Dy(H2O)8][IrCl6]∙6H2O Für die thermische Analyse wurden ca. 10 mg [Dy(H2O)8][IrCl6]∙6H2O in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von vier Zersetzungsschritten (Tab. 16, Abb. 36) beginnt bereits bei 30 °C, endet bei 102 °C und zeigt einen Massenverlust von 5,0%. Dies deutet auf den Verlust von zwei Molekülen Kristallwasser hin. Während der zweiten und dritten Abbaustufe finden die Zersetzungen im Temperaturfenster von 102 °C - 484 °C statt. Es ist dabei nicht möglich sinnvolle Intermediate der Abbaustufen zu formulieren. Insgesamt tritt ein Massenverlust von 40,5% auf. In der vierten und letzten Zersetzungsstufe von 484 °C - 1050 °C bildet sich elementares Iridium. Damit wäre vom Abgang eines Cl2-Moleküls auszugehen. Ebenfalls liegt bereits im vorherigen Schritt gebildetes Dy2O3 vor, das neben Iridium III. 1. Chlorometallate der Selten-Erd-Elemente pulverdiffraktometrisch im Rückstand -55der DTA/TG-Untersuchungen an [Dy(H2O)8][IrCl6]∙6H2O nachgewiesen werden konnte (Abb. 37). Trotz sorgfältiger Separierung von Kristallen an [Dy(H2O)8][IrCl6]∙6H2O aus der Mischphase mit [Dy(NO3)(H2O)7][IrCl6]∙4H2O ist eine leichte Verunreinigung der Probe nicht auszuschließen und so eine Diskrepanz zwischen dem beobachteten und berechneten Massenverlust erklärbar. Tab. 16: Ergebnisse der DTA/TG-Untersuchungen an [Dy(H2O)8][IrCl6]∙6H2O, M = 819,65 g/mol TBeginn [°C] 30 TEnde [°C] 102 Tmax [°C] 82 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 5,0 4,4 mögliches Produkt [Dy(H2O)8][IrCl6]∙4H2O 102 256 173 20,6 --- unbekanntes Intermediat 256 484 358 19,9 --- unbekanntes Intermediat 484 1100 857 7,1 8,6 Ir, Dy2O3 TG DTA 100 3 90 70 T [°C] Masse [%] 2 DTA-Signal 80 1 60 50 0 200 400 600 800 1000 Temperatur [°C] Abb. 36: DTA/TG-Kurve des thermischen Abbaus von [Dy(H2O)8][IrCl6]∙6H2O III. 1. Chlorometallate der Selten-Erd-Elemente -56- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Dy2O3-simuliert Ir-simuliert -80 -100 20 30 40 50 60 70 Abb. 37: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Dy(H2O)8][IrCl6]∙6H2O 1.5.5 Kristallstrukturen von [Ce(NO3)2(H2O)6][IrCl6]·2H2O, [Dy(NO3)(H2O)7] [IrCl6]∙4H2O und [Lu(H2O)8][IrCl6]NO3∙4H2O Tab. 17: Kristallographische Daten von [Ce(NO3)2(H2O)6][IrCl6]·2H2O und [Dy(NO3)(H2O)7][IrCl6]∙4H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [Ce(NO3)2(H2O)6]2[IrCl6]·2H2O [Dy(NO3)(H2O)7][IrCl6]∙4H2O 1185,40 monoklin P21/c (Nr. 14) a = 691,59(3) pm b = 1641,57(7) pm c = 1306,67(8) pm = 93,875(6)° 1480,1(1) ų 2 0,918 0,916 0,0205; 0,0412 0,0265; 0,0420 0,793/ -0,874 e/ų 421764 827,59 monoklin P21/m (Nr. 11) a = 670,94(2) pm b = 2139,04(6) pm c = 731,67(2) pm = 106,905(2)° 1004,69(5) ų 2 0,854 0,855 0,0259; 0,0295 0,0420; 0,0312 1,780/ -1,130 e/ų 421766 III. 1. Chlorometallate der Selten-Erd-Elemente -57- Tab. 18: Kristallographische Daten von [Lu(H2O)8][IrCl6]NO3∙4H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte [Lu(H2O)8][IrCl6]NO3∙4H2O 419,63 triklin P 1 (Nr. 2) a = 993,66(8) pm b = 1018,66(8) pm c = 1268,5(1) pm = 95,670(4)° 1090,5(2) ų 2 0,830 0,913 0,0314; 0,0585 0,0566; 0,0645 2,090/ -1,565 e/ų 1.5.6 Zusammenfassung Es konnte gezeigt werden, dass auch ausgehend von Selten-Erd-Chloriden, wie CeCl3·7H2O, Hexachlorometallate, hier [Ce(H2O)9][IrCl6]Cl·2H2O, dargestellt werden können. Anders als bei den in vorherigen Kapiteln besprochenen nitrathaltigen Hexachlorometallaten, wird hier der Ladungsausgleich durch ein Chlorid-Ion erreicht. Es ist damit also prinzipiell möglich, verschiedenartige, einfach geladene Anionen chelatisierend oder „frei“ in die Kristallstruktur einzubauen. Der thermische Abbau zeigt Analogien zur Zersetzung der Hexachloroplatinate. In beiden Fällen bleibt, anders als bei den Hexachloroosmaten, elementares Platin bzw. Iridium zurück. Mit [Dy(H2O)8][IrCl6]∙6H2O gelang es erstmals ein Hexachloroiridat(III) mit einem komplexen Selten-Erd-Kation zu kristallisieren und zu charakterisieren. Es ist keine Gegenwart eines weiteren Anions nötig, da der Ladungsausgleich durch die kationische Einheit [Dy(H2O)8]3+ erfolgt. Bemerkenswert ist der um zwei Moleküle erhöhte Kristallwasseranteil der Verbindung, verglichen mit z.B. [Dy(NO3)(H2O)7][IrCl6]∙4H2O. Vermutlich werden fehlende Anionen und der damit verbundene Platzgewinn in der Zelle durch Kristallwassermoleküle kompensiert. Neben der strukturellen Aufklärung der Hexachloroiridate sollte ihr Potenzial als Ausgangssubstanz zur Umsetzung mit Mineralsäuren ergründet werden. Aus diesen Bemühungen ging ausgehend von [Pr(H2O)6(NO3)2][IrCl6]·2H2O der dreikernige Iridiumcluster Pr2[Ir3O(SO4)6(HSO4)2(H2O)] (H2SO4)4 hervor, der in Kapitel III. 3. ausführlich diskutiert wird. III. 1. Chlorometallate der Selten-Erd-Elemente -58- 1.6 Chlororuthenate(IV) 1.6.1 Allgemeines Während für die bereits diskutierten Hexachlorometallate des Platins, Osmiums und Iridiums vielfach isotype Verbindungen der gleichen Selten-Erd-Elemente gefunden wurden, gelingt die Synthese entsprechner Ruthenate nicht. Es wurde bei der Synthese der Rutheniumsäure „H2[RuCl6]·xH2O“ analog den vorangegangen Synthesen der Metallsäuren verfahren. Allerdings findet sich in der Literatur kein Hinweis auf die Existenz dieser Säure. Anders als z.B. bei Osmium ist die bevorzugte Oxidationsstufe des Rutheniums nicht +IV sondern +III. Daher wird die Existenz einer Rutheniumsäure der Summenformel „H3[RuCl6]·xH2O“ vermutet [10]. Ruthenium neigt ferner dazu, mehrkernige, oft über Sauerstoff verbrückte Komplexe der Summenformel. [Ru2Cl10O]4- zu bilden [53]. Charakteristisch dafür ist die Linearität der Ru-O-Ru-Gruppe und der kurze Ru-O-Abstand sowie der Diamagnetismus, die durch Zweielektronen-Dreizentren-π-Bindungen erklärt werden [54]. Ferner sind Oxo-Verbindungen häufig Nebenprodukte bei der Darstellung der Chlororuthenate(IV) [55]. Erfolgte nun eine Umsetzung einer Hexachlororuthenat-Lösung, die analog zu den bisherigen Platinmetallsäuren dargestellt wurde, mit einer Selten-Erd-Quelle, wie SE(OH)3, so kristallisierten Verbindungen des Typs [SE(H2O)9]2[Ru2OCl10]Cl2 (SE = Ce, Pr, Ho) aus, die nur Koordinationswasser enthielten. Alternativ wurden Versuche unternommen, ausgehend von RuO4, die Rutheniumsäure „H2[RuCl6]·2H2O“ zu erhalten. Hierzu wurde RuO4 in eine HCl-Lösung eingeleitet und diese anschließend mit einer Selten-Erd Verbindung versetzt. Es konnten wieder Verbindungen des Typs [SE(H2O)9]2[Ru2OCl10]Cl2 kristallisiert werden. Ein reines Hexachlororuthenat der Oxidationsstufe +IV konnte also auch auf diesem Syntheseweg nicht hergestellt werden. Außerdem war zu beobachten, dass Verbindungen mit Selten-Erd-Ionen ab dem Element Holmium zwar Einkristalle lieferten, die Einkristallstrukturlösungen aber oft so starke Fehlordnung an den Wassermolekülen des Selten-Erd-Ions aufwiesen, dass sie strukturell nicht sinnvoll gelöst werden konnten. Daher wird hier auf eine Diskussion der erhaltenen Verbindung [Ho(H2O)9]2[Ru2OCl10]Cl2 verzichtet und nur eine Charakterisierung der untereinander isotypen Verbindungen [SE(H2O)9]2[Ru2OCl10]Cl2 (SE = Ce, Pr) vorgenommen, wobei beispielhaft unter Punkt 1.6.3 die Kristallstruktur des Praseodyms diskutiert wird. III. 1. Chlorometallate der Selten-Erd-Elemente -59- 1.6.2 Synthese Wie bereits unter Punkt 1.4.2 beschrieben, verläuft auch die Synthese der Rutheniumsäuren „H2[RuCl6]·xH2O“ bzw. „H3[RuCl6]·xH2O“ durch die Oxidation von elementarem Ruthenium im Chlorgasstrom. Dazu wurden 4 g (39 mmol) feines Rutheniumpulver mit 8g eines LiCl/NaCl-Gemisches im Quarzglasschiffchen bei 625 °C chloriert. Anders als bei den vorangegangenen Chlorierungen wurde bei Ruthenium das eutektische Gemisch der Alkalimetallchloride ausgenutzt, da sonst keine Schmelze erhalten werden konnte. Der größtenteils aus Na2[RuCl6] bzw. Li2[RuCl6] bestehende Schmelzkuchen zeigte eine bräunliche Färbung. Die anschließende Aufarbeitung verlief analog Punkt 1.4.2. Außerdem schloss sich eine Behandlung mit HCl-Gas an. Hinterher wurde bis zur Trockne eingedampft und tiefrote Rauten des Produkts erhalten (Abb. 38). Abb. 38: Eingedampfte Rutheniumsäure Die Darstellung von [SE(H2O)9]2[Ru2OCl10]Cl2 (SE = Ce, Pr) erfolgte durch Lösen von 191,14 mg bzw. 192,0 mg (1 mmol) SE(OH)3 und 5 ml der 0,1 mM Rutheniumsäure-Lösung in 10 ml dest. Wasser. Anschließend wurden beide Versuchsansätze mehrere Tage zum isothermen Abdampfen in einer Kristallisierschale stehen gelassen und Kristalle in Form roter Plättchen erhalten. III. 1. Chlorometallate der Selten-Erd-Elemente -60- 1.6.3 Kristallstruktur von [Pr(H2O)9]2[Ru2OCl10]Cl2 [Pr(H2O)9]2[Ru2OCl10]Cl2 kristallisiert monoklin in Raumgruppe P21/c mit vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein Ru4+-Ion, das sich auf einer allgemeinen Lage befindet. Dabei liegt es entsprechend der d4-Konfiguration in einer nicht ganz idealen oktaedrischen Umgebung vor (Abb. 39). Die internuklearen Ru-Cl-Abstände liegen im Bereich von 235,3 pm - 236,5 pm (Tab. 20). Die Winkel zwischen den Cl-Atomen betragen entsprechend einer nahezu oktaedrischen Koordination ca. 180° bzw. ca. 90°, wobei eventuelle Abweichungen < 3,5° betragen. (Tab. 20). Das Sauerstoffatom des Ruthenium-Oktaeders liegt speziell auf der Wyckoff-Lage 2c. Als Besonderheit in dieser Kristallstruktur verbrückt dieses Sauerstoffatom zwei Oktaeder zu einer [Ru2OCl10]-Einheit. Der Ru-O-Abstand beträgt dabei 178,4 pm und ist damit fast 60 pm länger, als die Ru-Cl-Abstände. Die [Ru2OCl10]4--Anionen sind von dem kationischen Komplex [Pr(H2O)9]3+ umgeben. Das Pr3+-Ion ist von neun kristallographisch unterscheidbaren Sauerstoffatomen koordiniert. Jedes dieser Sauerstoffatome gehört dabei zu einem Wassermolekül. Praseodym- und Sauerstoffatome bilden ein dreifach überkapptes trigonales Prisma, wie es schon unter 1.4.3 und 1.5.3 beschrieben wurde. Die Pr-O-Bindungslängen liegen im erwarteten Bereich von 247,9 pm - 255,5 pm und stimmen sehr gut mit den in der Literatur verzeichneten Werten von 248 pm - 260 pm für CeCl3∙7H2O überein [52]. Ebenfalls befinden sich Chlorid-Ionen in der Elementarzelle, die dem Ladungsausgleich dienen. Anders als in den bisher diskutierten Strukturen können nur vereinzelt sehr schwache Wasserstoffbrückenbindungen > 300 pm beobachtet werden. Ursächlich dafür ist das Fehlen jeglichen nichtkoordinerenden Kristallwassers in der Kristallstruktur. Ru Cl O Abb. 39: Oxo-verbrückte Ru-Einheiten in der Kristallstruktur von [Pr(H2O)9]2[Ru2OCl10]Cl2 ................ III. 1. Chlorometallate der Selten-Erd-Elemente -61- c b Ru Cl Pr O Abb. 40: Kristallstruktur von [Pr(H2O)9]2[Ru2OCl10]Cl2 in Richtung [100] Tab. 19: Kristallographische Daten von [SE(H2O)9]2[Ru2OCl10]Cl2 (SE = Ce, Pr) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [Ce(H2O)9]2[Ru2OCl10]Cl2 [Pr(H2O)9]2[Ru2OCl10]Cl2 1229,92 1249,65 monoklin monoklin P21/n (Nr. 14) P21/n (Nr. 14) a = 852,15(6) pm a = 848,80(6) pm b = 2174,8(2) pm b = 2178,0(2) pm c = 923,80(6) pm c = 925,90(6) pm = 93,489(8)° = 93,384(3)° 1708,8(2) ų 1708,9(2) ų 2 2 Stoe IPDS I Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 15583 21815 3194 4788 1313 3234 0,1374; 0,2181 0,0832; 0,0668 SHELXS97 und SHELXL97[28] 0,605 0,970 0,605 0,970 0,0351; 0,0599 0,0403; 0,0995 0,1101; 0,0685 0,0727; 0,1122 0,800/ -1,195 e/ų 1,932/-1,735 e/ų 421775 42177 III. 1. Chlorometallate der Selten-Erd-Elemente -62- Tab. 20: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [Pr(H2O)9]2[Ru2OCl10]Cl2 Pr1- O2 O3 O4 O5 O6 O7 O8 O9 O10 Ru1- Cl1 Cl2 Cl3 Cl4 Cl5 O1 O1-Ru1-Cl1 O1-Ru1-Cl3 O1-Ru1-Cl4 O1-Ru1-Cl5 Cl1-Ru1-Cl4 Cl1-Ru1-Cl5 Cl2-Ru1-Cl1 Cl2-Ru1-Cl3 Cl2-Ru1-Cl4 Cl2-Ru1-Cl5 Cl3-Ru1-Cl4 Cl3-Ru1-Cl5 O2-Pr1-O4 O3-Pr1-O2 O3-Pr1-O4 O3-Pr1-O5 O4-Pr1-O5 O6-Pr1-O4 O6-Pr1-O5 O6-Pr1-O8 O6-Pr1-O10 O7-Pr1-O3 O7-Pr1-O5 O8-Pr1-O5 O8-Pr1-O7 O8-Pr1-O10 O9-Pr1-O2 O9-Pr1-O3 O9-Pr1-O7 O9-Pr1-O8 O9-Pr1-O10 O10-Pr1-O2 253,1(5) 250,8(5) 253,6(5) 255,5(5) 248,0(4) 250,6(4) 250,2(4) 247,9(4) 252,4(4) Ø251,3(4) 236,3(2) 235,3(1) 235,6(1) 236,4(2) 236,5(2) 178,38(4) 90,89(4) 93,42(4) 93,84(4) 90,95(4) 89,51(6) 92,69(6) 86,57(5) 89,14(5) 87,11(6) 88,21(6) 88,96(6) 88,49(6) 70,6(2) 68,0(2) 69,5(2) 90,5(3) 71,2(2) 67,7(2) 70,4(2) 75,4(2) 68,6(2) 68,7(2) 67,8(2) 79,1(2) 71,8(1) 69,4(2) 75,0(2) 80,9(2) 68,5(1) 80,4(2) 72,6(2) 71,1(2) III. 1. Chlorometallate der Selten-Erd-Elemente -63- 1.6.3.1 Thermischer Abbau von [Pr(H2O)9]2[Ru2OCl10]Cl2 Für die thermische Analyse wurden ca. 15 mg [Pr(H2O)9]2[Ru2OCl10]Cl2 in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von zwei Zersetzungsschritten (Tab. 21, Abb. 41) beginnt bereits bei 30 °C, endet bei 218 °C und zeigt einen Massenverlust von 35,5%. Eine pulverdiffraktometrische Charakterisierung der Zwischenstufe wurde nicht durchgeführt. Daher kann nur gemutmaßt werden, dass der Abbau wahrscheinlich mit der Bildung von RuCl3 und einer PraseodymVerbindung einher geht. Während der zweiten und letzten Abbaustufe findet die Zersetzung zu PrOCl, im Temperaturfenster von 218 °C - 1050 °C, statt. Der beobachtete Massenverlust beträgt 17,7%. Das Produkt konnte pulverdiffraktometrisch im Rückstand der DTA/TGUntersuchungen an [Pr(H2O)9]2[Ru2OCl10]Cl2 nachgewiesen werden (Abb. 42). Bemerkenswert ist jegliches Fehlen einer Ruthenium-Verbindung oder elementarem Rutheniums im Rückstand (s. zum Vergleich 1.4.3.1). Der beobachtete Gesamtmassenverlust betrug 53,2% und stimmt nährungsweise mit dem errechneten Massenverlust von 68,7%, basierend auf dem Rückstand PrOCl, überein. Die relativ hohe Differenz kann möglicherweise durch eine Verunreinigung der Probe, oder einen bei der Synthese eingesetzten Überschuss an SE(OH)3, erklärt werden. Tab. 21: Ergebnisse der DTA/TG-Untersuchungen an [Pr(H2O)9]2[Ru2OCl10]Cl2, M = 1229,92 g/mol TBeginn [°C] 30 TEnde [°C] 218 Tmax [°C] 120 218 1050 622 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 35,5 --17,7 --- Produkt unbekanntes Intermediat PrOCl III. 1. Chlorometallate der Selten-Erd-Elemente -64- ^endo 100 DTA TG 90 Masse [%] DTA-Signal [ T] 80 70 60 50 200 400 600 800 1000 T [°C] Abb. 41: DTA/TG-Kurve des thermischen Abbaus von [Pr(H2O)9]2[Ru2OCl10]Cl2 100 80 DTA-Rückstand beobachtet relative Intensität [%] 60 40 20 0 -20 -40 -60 PrOCl-simuliert -80 -100 20 30 40 50 2 60 70 80 [°] Abb. 42: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Pr(H2O)9]2[Ru2OCl10]Cl2 90 III. 1. Chlorometallate der Selten-Erd-Elemente -65- 1.6.4 Zusammenfassung Es gelang das Platinmetall Ruthenium durch verschiedenartige Oxidationsverfahren verfügbar zu machen. Allerdings konnte keine den anderen Platinmetallen isotype oder strukturell ähnliche Verbindung erhalten werden. Ursächlich dafür war der Misserfolg beim Synthetisieren eines RuCl62- enthaltenden Komplexes. Stattdessen wurde das über Sauerstoff verbrückende komplexe Anion [Ru2OCl10]4- erhalten. Eine Erklärung könnte in der Instabilität des RuCl62--Komplexanions liegen. Die einzige Analogie lässt sich im Vorhandensein des kationischen Komplexes [Pr(H2O)9]3+ in der bis dahin unbekannten Gesamtstruktur von [Pr(H2O)9]2[Ru2OCl10]Cl2 sehen, der auch in anderen Kristallstrukturen der Hexachlorometallate der Seltenen-Erd-Elemente beschrieben wurde. Der thermische Abbau ähnelt dem Zersetzungsprozess von [Eu(NO3)(H2O)7][OsCl6]∙4H2O (Abschnitt 1.4.3.1), da nur das entsprechende SEOCl zurück bleibt. Das eingesetzte Ruthenium verflüchtigt sich wahrscheinlich in Form von RuO4. Neben der strukturellen Aufklärungsarbeit an Rutheniumverbindungen mit komplexen Anionen sollte ihr Potenzial als Ausgangssubstanz zur Umsetzung mit Mineralsäuren ergründet werden. Aus diesen Bemühungen gingen reproduzierbare grüne Einkristalle hervor, die bei der Umsetzung eines Gadolinium-Hexachlororuthenats mit konz. Schwefelsäure bei 350 °C in Glasampullen erhalten wurden (Abb. 43). Auf Grund eines kristallographischen Problems konnte die Struktur jedoch nicht sinnvoll gelöst werden. Abb. 43: Einkristalle aus der Ampullenreaktion eines GadoliniumChlororuthenats mit Schwefelsäure III. 1. Chlorometallate der Selten-Erd-Elemente -66- 1.7 Hexachlororhodate(III) 1.7.1 Allgemeines Mit dem Element Rhodium enden die Untersuchungen der Chlorometallate. Wie bei Ruthenium liegen die wichtigsten und stabilsten Verbindungen des Rhodiums in der Oxidationsstufe +III vor. Die bedeutendsten Vertreter des dreiwertigen Rhodiums sind der Hexachloro-Komplex [RhCl6]3- und das Chlorid RhCl3. Ersterer wurde im Rahmen dieser Arbeit auf vielfältigem Wege dargestellt und am effektivsten ausgehend von in Schwefelsäure aufgelöstem Rhodium erhalten. Dieses durch Einkristalldiffraktometrie nicht zu charakterisierende Rhodiumsulfat wurde ebenfalls eingehend untersucht [42]. Aus den Arbeiten an dem Platinmetall Rhodium gingen zwei Verbindungen hervor, wie der Übersichtstabelle 1.2 zu entnehmen ist. Zum einen gelang eine Charakterisierung von [Dy(H2O)8][RhCl6]·6H2O [48], welches isotyp zu [Dy(H2O)8][IrCl6]∙6H2O ist. Zum anderen wurde eine bis dahin nicht bekannte Struktur der Summenformel [Pr(H2O)9][RhCl6]·2H2O erhalten. Der Syntheseweg, die Kristallstruktur und die thermische Zersetzung der Praseodym-Verbindung werden im Folgenden ausführlich erläutert. 1.7.2 Synthese Ausgehend von Rhodium sollte für die Umsetzungen mit Metallen der Selten-Erd-Elemente eine entsprechende Rhodiumsäure dargestellt werden. Am Anfang stand die Chlorierung des elementaren Rhodiums, wie unter Punkt 1.4.2 erläutert. Allerdings musste im ersten Schritt zunächst zum RhCl3 chloriert werden. Dazu wurden 4,0 g (0,05 mol) fein verriebenes Rhodium-Pulver vier Stunden bei 600 °C im Chlorgasstrom erhitzt. Nach Abkühlung in diesem wurde das Pulver zur vollständigen Chlorierung nochmals gemörsert und erneut zwei Stunden im Chlorgasstrom gehalten. Nach Abkühlung erhielt man RhCl3 als rötlich-graues Pulver (5,1 g, 0,03 mol). Dieses konnte dann in einer Na3[RhCl6]- bzw. Li3/K3[RhCl6]Schmelze zur weiteren Reaktion gebracht werden. Alternativ konnte zur Darstellung der Rhodiumsäure „H3[RhCl6]·xH2O“ von in Schwefelsäure aufgelöstem Rhodium ausgegangen werden. Die verschiedenen Herangehensweisen der Aufarbeitung zum oktaedrischen Chlorokomplex des Rhodiums verliefen unterschiedlich erfolgreich und sind im folgenden Reaktionsschema [43] (Abb. 44) dargestellt. III. 1. Chlorometallate der Selten-Erd-Elemente -67- Abb. 44: Reaktionsschema zur Umsetzung von Rhodium zur Rhodiumsäure „H3[RhCl6]·xH2O“ ................ An dieser Stelle sei nur auf die Darstellung von „H3[RhCl6]·xH2O“ aus Rh-Sulfat eingegangen, das durch Auflösen von Rh in Schwefelsäure erhalten wurde. Unter Rühren und in der Wärme erfolgte die Zugabe von 2,3 g Rh-Sulfat in 25 ml dest. Wasser. Anschließend erfolgte die Filtration (Porengröße 4) der noch warmen Lösung und das Hinzutropfen einer NaOH-Lösung zum gelben Filtrat. Der milchig-weiße Niederschlag wurde abfiltriert (Porengröße 4). Es konnte ein hellgelber Feststoff von Rh(OH)3 (1,6 g, 5 mmol) erhalten werden, der in 10 ml konz. HCl aufgenommen wurde. Die erhaltene dunkelrote [RhCl6]3-Lösung war Ausgangsverbindung für weitere Umsetzungen mit Verbindungen der SeltenErd-Elemente. 4 ml H3[RhCl6] (c (Rh) = ~0,5 mmol/ml) wurden mit 630 mg (1,5 mmol) Pr(NO3)3·6H2O in dest. Wasser gelöst und isotherm bei Raumtemperatur abgedampft. Es wurden rote Plättchen der Zusammensetzung [Pr(H2O)9][RhCl6]·2H2O erhalten (Abb. 45). Abb. 45: Kristalle von [Pr(H2O)9][RhCl6]·2H2O unter dem Lichtmikroskop III. 1. Chlorometallate der Selten-Erd-Elemente -68- 1.7.3 Kristallstruktur von [Pr(H2O)9][RhCl6]·2H2O Die Verbindung [Pr(H2O)9][RhCl6]·2H2O kristallisiert monoklin in der Raumgruppe C2/c mit vier Formeleinheiten in der Elementarzelle. Die Atome Pr, Rh und O5 liegen speziell auf den Wyckoff-Lagen 4e, 4d und 4e. Alle anderen Atome befinden sich auf allgemeiner Lage. Kristallographisch gesehen gibt es ein Rh-Atom, dass entsprechend einer d6-Konfiguration in der Oxidationsstufe +3 und oktaedrischer Koordination vorliegt. In dem durch sechs ChloridIonen gebildeten Oktaeder betragen die Rh-Cl Abstände 233,9 pm - 235,2 pm. Die Cl-Rh-Cl Winkel weichen bis zu 1,6° vom rechten Winkel ab (Tab. 23) und ergeben eine nahezu ideale Oh-Symmetrie des Oktaeders. Die RhCl63--Anionen sind von dem kationischen Komplex [Pr(H2O)9]3+ umgeben (Abb. 46). Das Pr3+-Ion ist von fünf kristallographisch unterscheidbaren Sauerstoffatomen koordiniert. Jedes dieser Sauerstoffatome gehört dabei zu einem Wassermolekül. Praseodym- und Sauerstoffatome bilden dabei ein dreifach überkapptes trigonales Prisma, wie schon unter 1.4.3, 1.5.3 und 1.6.3 beschrieben. Die Pr-O-Bindungslängen liegen im erwarteten Bereich von 247,8 pm - 256,0 pm und stimmen sehr gut mit den in der Literatur verzeichneten Werten von 248 pm - 260 pm überein. Der kationische Komplex und die [RhCl6]2--Oktaeder wechseln sich in ihrer Anordnung ab und bilden dabei eine schichtartige Struktur aus, wie in Abb. 46 zu erkennen ist. In der Elementarzelle sind zwei Moleküle Kristallwasser enthalten. Es können Wasserstoffbrückenbindungen im Bereich von 272 pm - 310 pm zwischen den Wassermolekülen des kationisches Komplexes und den Kristallwassermolekülen beobachtet werden. a c Rh Cl Pr O H Abb. 46: Kristallstruktur von [Pr(H2O)9][RhCl6]·2H2O in Richtung [010] III. 1. Chlorometallate der Selten-Erd-Elemente -69- Tab. 22: Kristallographische Daten von [Pr(H2O)9][RhCl6]·2H2O [Pr(H2O)9][RhCl6]·2H2O 654,70 monoklin C2/c (Nr. 15) a = 1905,32(8) pm b = 1099,38(5) pm c = 975,85(4) pm = 118,668(1)° 1793,5(1) ų 4 Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 29978 6466 6139 0,0309; 0,0184 SHELXS97 und SHELXL97[28] 1,094 1,094 0,0137; 0,0320 0,0149; 0,0323 0,630/ -1,049 e/ų 421774 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Tab. 23: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [Pr(H2O)9][RhCl6]·2H2O Pr1- O1 O2 O3 O4 O5 Rh1- Cl1 Cl2 Cl3 Cl3-Rh1-Cl1 Cl3-Rh1-Cl2 Cl1-Rh1-Cl2 O1-Pr1-O2 O1-Pr1-O4 O1-Pr1-O8 O2-Pr1-O4 O2-Pr1-O6 O2-Pr1-O7 O3-Pr1-O4 O3-Pr1-O5 O3-Pr1-O6 255,23(6) (2x) 248,99(6) (2x) 247,77(6) (2x) 247,81(6) (2x) 255,96(9) (1x) Ø250,62(6) 234,40(2) (2x) 235,24(2) (2x) 233,92(2) (2x) 90,029(7) 90,361(7) 88,431(7) 90,0(2) 70,7(2) 75,4(2) 81,0(2) 95,2(2) 75,5(2) 76,9(2) 70,1(2) 88,3(2) III. 1. Chlorometallate der Selten-Erd-Elemente -70- Tab. 24: Kristallographische Daten von [Dy(H2O)8][RhCl6]·6H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD [Dy(H2O)8][RhCl6]·6H2O 730,33 monoklin P21/c (Nr. 14) a = 1174,78(6) pm b = 1139,55(4) pm c = 1603,61(8) pm = 103,622(6)° 2086,4(2) ų 4 0,823 0,822 0,0198; 0,0351 0,0332; 0,0365 0,974/ -0,498 e/ų 421773 1.7.3.1 Thermischer Abbau von [Pr(H2O)9][RhCl6]·2H2O Für die thermische Analyse wurden ca. 10 mg [Pr(H2O)9][RhCl6]·2H2O in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von vier Abbauschritten (Tab. 25, Abb. 47) beginnt bei 150 °C, endet bei 200 °C und zeigt einen Massenverlust von 29,1%. Zersetzungsschritte in diesem Temberaturbereich deuten auf den Abgang von diversen Molekülen Wasser hin. Jedoch wurden keine pulverdiffraktometrischen Messungen zur Identifizeirung der Intermediate unternommen. Ein zweiter Abbauschritt kann in einem Temperaturbereich von 340 °C - 380 °C detektiert werden. Bei einer Massendifferenz von 18,3% könnte hierbei ein Verlust von Cl2 und HCl aufgetreten sein. Im weiteren Verlauf ist bei der dritten Stufe ein Massenverlust von 5,1%, zu beobachten. Die thermische Zersetzung ist bei Erreichen der maximalen Heiztemperatur und einem Verlust von 5,3% noch nicht ganz abgeschlossen. Das Endabbauprodukt des vierten Schrittes wurde pulverdiffraktometrisch untersucht. Ein Vergleich mit Literaturdaten erbrachte in großer Übereinstimmung die Zuordnung zu der Verbindung PrOCl und elementarem Rhodium (Abb. 48). Der beobachtete Gesamtmassenverlust betrug 57,8% und stimmt gut mit dem errechneten Massenverlust von 55,1%, basierend auf dem Rückstand Rhodium und PrOCl, überein. III. 1. Chlorometallate der Selten-Erd-Elemente -71- Tab. 25:: Ergebnisse der DTA/TG-Untersuchungen an [Pr(H2O)9][RhCl6]·2H2O, M = 819,65 g/mol TBeginn [°C] 150 TEnde [°C] 200 Tmax [°C] 170 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 29,1 --- 340 380 370 18,3 --- unbekanntes Intermediat 400 450 430 5,1 --- unbekanntes Intermediat 580 >1050 870 5,3 --- PrOCl, Rh Produkt unbekanntes Intermediat ^endo 100 DTA TG 90 DTA-Signal [ T] Masse [%] 80 70 60 50 40 200 400 600 800 T [°C] Abb. 47: DTA/TG-Kurve des thermischen Abbaus von [Pr(H2O)9][RhCl6]·2H2O 1000 III. 1. Chlorometallate der Selten-Erd-Elemente -72- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Rh-simuliert -80 PrOCl-simuliert -100 10 20 30 40 2 50 60 [°] Abb. 48: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Pr(H2O)9][RhCl6]·2H2O 1.7.4 Zusammenfassung Es konnte gezeigt werden, dass ausgehend von wasserhaltigen Selten-Erd-Nitraten, wie Pr(NO3)3·6H2O und der Rhodiumsäure „H3[RhCl6]·xH2O“ Hexachlorometallate mit komplexen Anionen der Summenformel [Pr(H2O)9][RhCl6]·2H2O und [Dy(H2O)8][RhCl6]·6H2O (Tab. 24) dargestellt werden können. Im Gegensatz zu bereits besprochenen Hexachloroplatinaten ähnlicher Zusammensetzung ist kein Einbau von chelatisierenden Nitratgruppen zu beobachten. Einhergehend mit der Lanthanoidenkontraktion nimmt die Koordinationszahl für den kationischen Komplex des Praseodyms bzw. Dysprosiums mit geringer werdendem Ionenradius ab. Die Untersuchung des thermischen Abbaus an [Pr(H2O)9][RhCl6]·2H2O führt zu dem erwarteten Abbauprodukt Rhodium und dem entsprechenden Selten-Erd-Oxid-Chlorid PrOCl. Eine Bildung des reinen Oxids, wie es z.B. bei Cer-haltigen Verbindungen beobachtet werden kann, ist nicht begünstigt. Neben der strukturellen Aufklärung der Hexachlororhodate sollte ihr Potenzial als Ausgangsubstanz zur Umsetzung mit Mineralsäuren ergründet werden. Die Reaktion von III. 1. Chlorometallate der Selten-Erd-Elemente -73- [Pr(H2O)9][RhCl6]·2H2O mit Schwefelsäure, Oleum oder Selensäure führte allerdings zu keinen Ergebnissen. Auch umfangreiche Variierungen der Temperatur, der verwendeten Mineralsäurekonzentration und Reaktanden führten nicht zum Erfolg. Allerdings konnte ausgehend von elementarem Rhodium mit Schwefelsäure erstmals ein Rhodiumsulfat der Summenformel Rh2(SO4)3(H2O)2 strukturell charakterisiert werden. Ergebnisse dazu finden sich in Abschnitt III. 4. III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -74- 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern 2.1 Allgemeines Kronenether-Moleküle sind seit vielen Jahren bekannt und erlangten große Beachtung im Jahr 1987 als u.a. Pedersen für ihre Entdeckung mit dem Nobelpreis für Chemie ausgezeichnet wurde [56, 57]. Gebräuchliche Kronenether sind z. B. 18-Krone-6 oder Dibenzo-18-Krone-6, die ringartig aus mehreren Ethylenoxyeinheiten zusammengesetzt sind. Sie sind bekannt dafür ein weites Spektrum an Kationen zu koordinieren. Abhängig vom eingesetzten Makrozyklus können verschieden starke Affinitäten zur Bindung von Kationen, wie Kalium-Ionen [58], protonierten Aminen oder Lanthan(III)-Ionen [57] beobachtet werden. Insbesondere der Effekt der Kronenether als stabilisierende Liganden für Oxonium-Ionen (H+ ·(H2O)n) (n = 1, 2, 3, 4) wurde erst kürzlich von Junk untersucht [59]. Übrige einfache Anionen, wie Cl- [60] oder Br3- formen komplexe Netzwerke mit den eingeschlossenen Kationen. Aber auch komplexere Anionen wie HSO4- [61] oder Pd2Cl62- können Netzwerke ausbilden, wie z. B. in [H3O+·18C6][Pd2Cl62-] [62]. Abhängig vom eingesetzten Anion ist es oft möglich diese Komplexe in einkristalliner Form zu isolieren und zur Ausbildung von komplexen supramolekularen Strukturen zu nutzen [63, 64]. Ziel dieses Forschungsprojekts war es, verschiedenartige Platinverbindungen, die im Laufe der letzten Jahre in der Arbeitsgruppe dargestellt und untersucht wurden, mit diversen Kronenethern umzusetzen. Dabei sollte ihr Potenzial zur Ausbildung von Netzwerkstrukturen im Vordergrund stehen. Gegenstand der Arbeit waren Hexachloroplatinate(IV) und Platin(III)-Sulfate mit einfachen und komplexen Kationen bzw. Anionen. Begonnen wurde mit der strukturell vergleichsweise einfachen Hexachloroplatinsäure (H3O)2[PtCl6]. Des Weiteren erfolgte die Analyse von Verbindungen, die komplexere Kationen, wie [La(NO3)2(H2O)6]+ in [La(NO3)2(H2O)6]2[PtCl6]·2H2O und [Sm(NO3)2(H2O)6]+ in [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O enthielten. Und schließlich konnten mit K2[Pt2(SO4)4(H2O)2] die Untersuchungen an einer Verbindung mit dem komplexen Anion [Pt2(SO4)4(H2O)2]2beendet werden. Vorliegende Arbeiten wurden an der School of Chemistry im Arbeitskreis von Prof. P. Junk und Prof. G. Deacon an der Monash University in Melbourne, Australien, durchgeführt. Messungen an den Verbindungen [La(NO3)(H2O)2·(18C6)][PtCl6] und [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O erfolgten am Australian Synchrotron, ebenfalls in Melbourne. III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -75- 2.2 Die Hexachloroplatinsäure [H3O+·18C6]2[PtCl6] 2.2.1 Synthese Die Synthese der Hexachloroplatinsäure-Lösung erfolgte wie unter Punkt 1.3.2 beschrieben. Zur Darstellung von [H3O+·18C6]2[PtCl6] wurde die (H3O)2[PtCl6]-Lösung mit der doppelten Menge an 18-Krone-6 in einer wässrigen Lösung im Becherglas umgesetzt und wenige Minuten bei Raumtemperatur gerührt. Das Lösungsmittel wurde isotherm bei Raumtemperatur verdampft und tieforange, quaderförmige Kristalle von 4 mm Kantenlänge erhalten (Abb. 49). 4 mm Abb. 49: Kristall von [H3O+·18C6]2[PtCl6] 2.2.2 Kristallstruktur von [H3O+·18C6]2[PtCl6] Die Verbindung [H3O+·18C6]2[PtCl6] kristallisiert monoklin in der Raumgruppe P21/n. Dabei finden sich vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein Pt4+-Ion, das sich wie alle anderen Atome in der Zelle auf der allgemeinen Wyckoff-Lage 4e befindet. Dabei liegt es entsprechend einer d6-Konfiguration in einer nahezu perfekt oktaedrischen Umgebung vor. Die internuklearen Pt-Cl-Abstände liegen im Bereich von 231,9 pm - 233,0 pm. Die Winkel zwischen den Cl-Atomen betragen entsprechend der nahezu perfekt oktaedrischen Koordination 180° bzw. ca. 90°, wobei eventuelle Abweichungen < 1,3° betragen. (Tab. 27). Die [PtCl6]2--Anionen sind von [(H3O+·18C6)]-Einheiten umgeben. In diesen Einheiten ist jeweils ein Oxonium-Ion in dem Kronenether eingeschlossen und wird dabei durch drei starke Wasserstoffbrückenbindungen in diesem gehalten (Abb. 50). Die Abstände O(Krone)-O(Oxonium-Ion) liegen dabei im literaturbekannten Bereich von 268 - 270 pm [65, 66]. Es befinden sich zwei kristallographisch unterscheidbare H3O+-Ionen und damit auch zwei III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -76- unterscheidbare Kronenetheringe in der monomeren Einheit. Dabei ist einer der Ringe um das O2-Atom stark fehlgeordnet, das Oxonium-Ion selbst jedoch nicht. Die Sauerstoff- und Kohlenstoffpositionen dieses Rings sind jeweils halbbesetzt (Abb. 51). Ferner verläuft genau zwischen zwei fehlgeordneten Ringen eine Spiegelebene. Die so erzeugten H3O+-Ionen weisen einen Abstand von 294 pm auf (Abb. 50). Die beiden H3O+-Ionen (O1) des zweiten nicht fehlgeordneten Kronenetherings liegen 338 pm voneinander entfernt. Weitere DonorAkzeptor-Bindungen sind in der Struktur nicht zu beobachten, was auch auf das Fehlen jeglicher Kristallwassermoleküle zurückzuführen ist. Die Geometrie des H3O+-Ions kann als pyramidal beschrieben werden, wie sie z. B. auch für [H3O+·18C6]2[ReCl6] bekannt ist [67]. Dabei tritt das Oxonium-Ion (O1) 44,5 pm aus der durch die Sauerstoffatome des Kronenethers aufgespannte Ebene hervor und ist damit nicht so weit ausgelenkt, wie z.B. in [H3O+·18C6]2[ReOCl4(H2O)] mit 87 pm [68], aber weiter als in der Struktur von [H3O+·18C6]2[Cl-H-Cl]. Dort liegt das H3O+-Ion mit 9 pm [69] nahezu coplanar zum Makrozyklus vor. Die durchschnittliche C-C-Bindungslänge liegt für den nicht fehlgeordneten Kronenethering im Bereich von 149 pm und zeigt somit die charakteristische literaturbekannte Bindungslänge im Bereich von 147 pm - 149 pm [62, 70]. Für den fehlgeordneten Ring beträgt der durchschnittliche C-C-Abstand 144 pm und liegt damit etwas unter dem erwarteten Bereich. Die durchschnittliche C-O-Bindungslänge (Literatur) liegt bei 143 pm - 145 pm und die beobachtete bei durchschnittlich 143 pm bzw. 144 pm (fehlgeordneter Kronenethering). III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -77- 269 pm 270 pm 268 pm 294 pm Pt O Cl C H Abb. 50: Monomere Einheit mit pyramidalem Oxonium-Ion (links) und Orientierung der durch eine Spiegelebene erzeugten Kronenetherringe (rechts) in der Kristallstruktur von [H3O+·18C6]2[PtCl6] O C H Abb. 51: Fehlgeordneter Kronenetherring mit eingeschlossenem Oxonium-Ion in einer [(H3O+·18C6)]-Einheit der Verbindung [H3O+·18C6]2[PtCl6] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -78c b Pt O Cl C H ´ Abb. 52: Kristallstruktur von [H3O+·18C6]2[PtCl6] in Richtung [100] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -79- Tab. 26: Kristallographische Daten von [H3O+·18C6]2[PtCl6] [H3O+·18C6]2[PtCl6] Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CCDC 974,46 monoklin P21/n (Nr. 14) a = 1304,29(3) pm b = 2073,68(5) pm c = 1372,12(3) pm = 95,003(1)° 3697,0(2) ų 4 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 40873 8450 5821 0,0900; 0,0843 SHELXS97 und SHELXL97[28] 0,945 0,945 0,0403; 0,0636 0,0751; 0,0724 0,877/ -2,026 e/ų 777704 Tab. 27: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [H3O+·18C6]2[PtCl6] Pt1- Cl1 Cl2 Cl3 Cl4 Cl5 Cl6 O4-C4 O5-C5 O7-C2 O8-C9 O9A-C13AO9B-C24BO10A-C14A O10B-C14B O11A-C16A O11B-C16B O12A-C19A O12B-C18B O12B-C19B O13A-C21A C17A-C18A C19A-C20A 232,5(1) 232,6(1) 233,0(1) 231,9(1) 232,8(1) 232,1(1) 141,5(6) 143,4(6) 143,1(6) 141,8(6) 142(1) 137(2) 144(1) 142(1) 158(2) 143(1) 139(2) 140(2) 146(1) 143(1) 150(2) 153(2) O13B-C20B O14A-C23A O14A-C22A O14B-C22B O11B-C17B O12A-C19A O12B-C19B O13A-C20A O13B-C20B O13B-C21B O14A-C22A O14B-C23B C1-C8 C2-C7 C3-C10 C4-C5 C6-C9 C11-C12 C13A-C14A C15A-C16A C14A-O10A-C15A C17A-O11A-C16A 143(1) 140(1) 143(2) 143(1) 142(1) 139(2) 146(1) 142(1) 143(1) 143(2) 143(2) 143(1) 147,3(8) 149,7(8) 149,0(7) 148,7(7) 149,9(7) 149,7(7) 150(1) 115(2) 113,2(7) 122,6(9) III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern C21A-C22A C23A-C24A Cl4-Pt1-Cl6 Cl6-Pt1-Cl1 Cl6-Pt1-Cl5 Cl4-Pt1-Cl3 Cl1-Pt1-Cl3 Cl5-Pt1-Cl3 C4-O4-C3 C5-O5-C8 C7-O6-C1 C24B-O9B-C13B 149(2) 145(2) 88,68(5) 90,79(5) 89,43(5) 90,04(5) 90,48(5) 90,86(5) 111,9(4) 109,9(4) 112,0(4) 111(1) C17B-O11B-C16B C23B-O14B-C22B O6-C1-C8 O4-C3-C10 O5-C5-C4 O8-C9-C6 O3-C11-C12 O10A-C14A-C13A C15A-C16A-O11A O11A-C17A-C18A O11B-C17B-C18B O12B-C18B-C17B O13B-C20B-C19B -80112,5(8) 113,8(9) 108,3(4) 107,7(5) 109,1(4) 108,0(4) 108,9(4) 110,9(8) 120(1) 107,7(9) 112,8(9) 106(1) 109,3(9) 2.2.2.1. Thermischer Abbau von [H3O+·18C6]2[PtCl6] Für die thermische Analyse wurden ca. 10 mg [H3O+·18C6]2[PtCl6] in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der thermische Abbau beginnt bei 122 °C und endet ohne weiteren Zwischenschritt bei 600 °C (Tab. 28, Abb. 53). Sowohl der detektierte, als auch der berechnete Massenverlust stimmen überein und betragen ca. 80% (Tab. 28). Damit deuten sie auf elementares Platin als Rückstand hin. Diese Annahme wird durch eine pulverdiffraktometrische Untersuchung des Zersetzungsrückstandes gedeckt. In Abb. 54 ist deutlich nur der Rückstand des Platins zu erkennen. Vergleicht man den thermischen Abbau von [H3O+·18C6]2[PtCl6] mit dem der reinen Platinsäure (H3O)2[PtCl6], so ist bemerkenswert, dass keine stabilen Zwischenstufen, z.B. PtCl2 von 282 °C - 376 °C, bei der Zersetzung von [H3O+·18C6]2[PtCl6] beobachtet werden. Tab. 28: Ergebnisse der DTA/TG-Untersuchungen an [H3O+·18C6]2[PtCl6], M = 974,46 g/mol TBeginn [°C] TEnde [°C] Tmax [°C] 122 600 160 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 79,9 79,9 Produkt Pt III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -81- ^endo 100 DTA TG 90 80 Masse [%] DTA-Signal [ T] 70 60 50 40 30 20 200 400 600 800 1000 T [°C] Abb. 53: DTA/TG-Kurve des thermischen Abbaus von [H3O+·18C6]2[PtCl6] 100 TG (H3O)2PtCl6 + TG [H3O ·18C6]2[PtCl6] 90 80 [PtCl4] Masse [%] 70 [PtCl2] 60 50 ~44% 40 30 20 ~19% 10 100 200 300 400 500 600 T [°C] Abb. 54: TG-Kurven des thermischen Abbaus von (H3O)2PtCl6 und [H3O+·18C6]2[PtCl6] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -82- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Pt-simuliert -80 -100 40 50 60 2 70 80 [°] Abb. 55: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [H3O+·18C6]2[PtCl6] 90 III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -83- 2.3 Lanthan-Hexachloroplatinat(IV) [La(NO3)(H2O)2·(18C6)][PtCl6] 2.3.1 Synthese Zur Synthese von [La(NO3)(H2O)2·(18C6)][PtCl6] wurde eine wässrige Lösung von [La(NO3)2(H2O)6]2[PtCl6]·2H2O präpariert (vgl. Abschnitt 1.3.2) mit der äquimolaren Menge an 18-Krone-6 im Becherglas bei Raumtemperatur für wenige Minuten gerührt und anschließend zum isothermen Verdampfen des Lösungsmittels für mehrere Tage in einer Kristallisierschale stehen gelassen. Es fielen tieforange Kristalle von [La(NO3)(H2O)2·(18C6)][PtCl6] an (Abb. 56), die nach wenigen Wochen an der Luft verwitterten. Abb. 56: Kristalle von [La(NO3)(H2O)2·(18C6)][PtCl6] 2.3.2 Kristallstruktur von [La(NO3)(H2O)2·(18C6)][PtCl6] Die Verbindung [La(NO3)(H2O)2·(18C6)][PtCl6] kristallisiert orthorhomisch in der Raumgruppe Pbca und 16 Formeleinheiten in der Elementarzelle. Alle Atome in der Zelle befinden sich auf der allgemeinen Wyckoff-Lage 8c. Kristallographisch gesehen gibt es zwei unterscheidbare Pt4+-Ionen. Sie liegen entsprechend einer d6-Konfiguration in einer nahezu perfekt oktaedrischen Umgebung vor. Die internuklearen Pt-Cl-Abstände liegen im Bereich von 232 pm - 235 pm. Die Winkel zwischen den Cl-Atomen betragen entsprechend einer nahezu oktaedrischen Koordination 180° bzw. ca. 90°, wobei eventuelle Abweichungen < 1,5° betragen (Tab. 30). Die [PtCl6]2--Anionen sind von [La(NO3)(H2O)2·(18C6)]2+-Einheiten umgeben. Es finden sich zwei kristallographisch unterscheidbare Lanthanatome in der Elementarzelle und damit auch zwei zu differenzierende Kronenetheringe. III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -84- In den erwähnten Einheiten sind die Lanthan-Ionen jeweils von Sauerstoffatomen des Kronenethers, einer zweizähnig angreifenden Nitratgruppe und zwei Molekülen Wasser koordiniert. Er ergibt sich eine Koordinationszahl von zehn und ein verzerrtes zweifachüberkapptes, quadratisches Antiprisma als Koordinationspolyeder. Die beiden Wassermoleküle koordinieren auf einer Seite des Makrozyklus, wohingegen die Nitratgruppe auf der entgegengesetzten Seite lokalisiert ist (Abb. 57). Diese Anordnung ergibt sich wahrscheinlich auf Grund des sterischen Anspruchs der Nitratgruppe. Die La-OH2-Abstände (O1-O4) liegen im Bereich von 253 pm - 255 pm und stimmen damit sowohl mit den Abständen für bereits diskutierte Hexachloroplatinate der Selten-Erd-Elemente (Abschnitt 1.3), wie z. B. [La(NO3)2(H2O)6]2[PtCl6]·2H2O mit 249 pm - 257 pm, als auch mit literaturbekannten Komplexen der Selten-Erd-Elemente mit Kronenethern, wie z. B. [La(NO3)(H2O)4·(12C4)]Cl2·CH3CN mit 256 pm [71], überein. Anders als in [La(NO3)2(H2O)6]2[PtCl6]·2H2O beobachtet, sind die Abstände der verbrückenden O-Atome der Nitratgruppen zum Lanthanatom im Mittel nicht länger als die Abstände der O-Atome der koordinierenden Wassermoleküle zum Zentralatom. Da das Lanthan-Ion den höchsten effektiven Ionenradius (148 pm für La3+, KoZ 10) der Lanthanoide aufweist, ist es fähig an die Sauerstoffatome des Kronenethers zu koordinieren ohne diesen dabei selbst stark zu verzerren, wie es z. B. bei kleineren 4f-Elementen der Fall ist [71]. Dennoch ist eine merkliche Deformation in Richtung der Nitratgruppe zu beobachten, so dass diese leicht vom Kronenether umhüllt wird (Abb. 57). Der Grund wird beim Vergleich der aufgespannten Winkel der Wassermoleküle und des La3+-Ions O1-La-O2 (68°) und der Sauerstoffatome der koordinierenden Nitratgruppe an das Zentralatom O3N-La-O2N (48°) (Tab. 30) offensichtlich. Die durchschnittliche C-C-Bindungslänge der Kronenetheringe liegt im Bereich von 144 pm und zeigt somit die charakteristische literaturbekannte Bindungslänge im Bereich von 143 pm - 157 pm [71] für derartige Verbindungen. Die durchschnittliche C-O-Bindungslänge (Literatur) liegt bei 138 pm - 148 pm und die beobachtete bei durchschnittlich 142 pm. Donor-Akzeptor-Bindungen der Länge 285 pm - 288 pm werden in der Struktur zwischen den koordinierten Wassermolekülen und dem freien Sauerstoffatom der Nitratgruppe beobachtet (Abb. 58). Ferner treten Wechselwirkungen zwischen den genannten Wassermolekülen und den Chloridatomen des Oktaeders im Bereich von 324 pm - 329 pm auf. Weitere Donor-Akzeptor-Bindungen sind in der Struktur nicht vorhanden, was auch auf das Fehlen von Kristallwassermolekülen zurückzuführen ist. III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern Pt La N O Cl C H Abb. 57: Asymmetrische Einheit in der Kristallstruktur von [La(NO3)(H2O)2·(18C6)][PtCl6] 288 pm 285 pm Abb. 58: Wasserstoffbrückenbindungen in der Kristallstruktur von [La(NO3)(H2O)2·(18C6)][PtCl6] -85- III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -86b c Pt La N O Cl C H Abb. 59: Kristallstruktur von [La(NO3)(H2O)2·(18C6)][PtCl6] in Richtung [100] Tab. 29: Kristallographische Daten von [La(NO3)(H2O)2·(18C6)][PtCl6] [La(NO3)(H2O)2·(18C6)][PtCl6] Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CCDC 909,05 orthorhombisch Pbca (Nr. 61) a = 1514,7(3) pm b = 2053,5(4) pm c = 3278,3(7) pm 10197(4) ų 12 Australian Synchrotron (λ = 77,53 pm) Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 110597 8080 6952 0,0818; 0,0291 SHELXS97 und SHELXL97[28] 1,034 0,0386; 0,0986 0,0461; 0,1033 2,688/ -1,876 e/ų 777702 III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -87- Tab. 30: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [La(NO3)(H2O)2·(18C6)][PtCl6] La1- Pt1- O1 O2 O2N O3N O5 O6 O7 O8 O9 O10 Cl1 Cl2 Cl3 Cl4 Cl5 Cl6 N1O1N O2N O3N O6-C2 O10-C11 O12-C15 C8-C7 C2-C1 C19-C20 C18-C17 O10A-C14A O10B-C14B O11A-C16A O11B-C16B Cl1-Pt1-Cl2 Cl2-Pt1-Cl4 Cl6-Pt1-Cl1 Cl7-Pt2-Cl8 Cl9-Pt2-Cl7 Cl11-Pt2-Cl10 Cl12-Pt2-Cl10 255(3) 255(3) 265(3) 262(3) 261(3) 264(3) 259(3) 261(3) 258(3) 265(3) Ø260,5(3) 233(1) 234(1) 232,7(9) 235(1) 233(1) 232(1) 124(5) 125(5) 127(5) 147(6) 144(5) 137(6) 151(7) 144(9) 123(12) 145(8) 144(1) 142(1) 158(2) 143(1) 91,5(4) 89,4(4) 89,9(4) 90,3(4) 89,8(4) 89,3(5) 89,1(4) La2- Pt2- O3 O4 O5N O6N O11 O12 O13 O14 O15 O16 Cl7 Cl8 Cl9 Cl10 Cl11 Cl12 N2O4N O5N O6N O3N-La1-O2N. O3N-La1-O10 O5N-La2-O6N O1-La1-O2 O1-La1-O7 O2-La1-O5 O9-La1-O6 O4-La2-O3 O14-La2-O15 O14-La2-O11 O16-La2-O14 C10-O10-C11 C8-O9-C9 C4-O7-C5 O5-C12-C11 O9-C9-C10 O13-C16-C15 O16-C23-C24 255(3) 253(3) 260(3) 264(3) 262(3) 263(4) 265(3) 261(3) 266(4) 258(3) Ø262,6(3) 233(1) 233(1) 232,5(9) 235(1) 233(1) 233(1) 124(4) 126(5) 127(5) 48,3(9) 70,3(9) 49(1) 68(1) 74(1) 78(1) 169(1) 69(1) 62(1) 145(1) 122(1) 111(3) 117(4) 114(4) 107(3) 108(4) 112(5) 106(4) III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -88- 2.3.2.1. Thermischer Abbau von [La(NO3)(H2O)2·(18C6)][PtCl6] Für die thermische Analyse wurden ca. 10 mg [La(NO3)(H2O)2·(18C6)][PtCl6] in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von zwei Zersetzungsschritten beginnt bereits bei 25 °C, endet bei 239 °C und zeigt einen Massenverlust von 25,8% (Tab. 31, Abb. 60). Dies könnte auf den Verlust des Kronenethermoleküls 18-Krone-6 hindeuten. Während der zweiten und letzten Abbaustufe findet nachweislich (Abb. 61) die Zersetzung zum elementaren Platin und LaOCl, im Temperaturfenster von 239 °C - 1000 °C und einem Massenverlust von 30,3%, statt. Der beobachtete Gesamtmassenverlust betrug 56,1% und stimmt mit dem errechneten Verlust von 57,6% überein. Tab. 31: Ergebnisse der DTA/TG-Untersuchungen an [La(NO3)(H2O)2·(18C6)][PtCl6], M = 909,05 g/mol TBeginn [°C] 30 TEnde [°C] 239 Tmax [°C] 122 239 1000 419 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 25,8 29,0 30,3 Produkt “[La(NO3)(H2O)2][PtCl6]” 28,6 Pt, LaOCl ^endo 100 DTA TG 90 DTA-Signal [ T] Masse [%] 80 70 60 50 200 400 600 800 1000 T [°C] Abb. 60: DTA/TG-Kurve des thermischen Abbaus von [La(NO3)(H2O)2·(18C6)][PtCl6] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -89- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Pt-simuliert -80 LaOCl-simuliert -100 10 20 30 40 50 2 60 70 80 90 [°] Abb. 61: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [La(NO3)(H2O)2·(18C6)][PtCl6] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -90- 2.4 Das Samarium-Hexachloroplatinat(IV) [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O 2.4.1 Synthese Zur Synthese von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O wurde eine wässrige Lösung von [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O, wie unter Abschnitt 1.3.2 beschrieben, präpariert. Sodann wurde mit der dreifachen äquimolaren Menge an 15-Krone-5 im Becherglas bei Raumtemperatur gerührt und anschließend das Lösungsmittel isotherm abdampfen gelassen. Es bildeten sich tieforange Kristalle von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O (Abb. 62). Abb. 62: Kristalle von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O 2.4.2 Kristallstruktur von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O Die Verbindung [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O kristallisiert tetragonal in der Raumgruppe I4/m und acht Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es zwei Pt4+-Ionen, die sich, wie fast alle anderen Atome auf speziellen WyckoffLagen befinden. Für Pt1 ist dies die Lage 4d und für Pt2 die Lage 4e. Dabei liegen die Platinatome entsprechend ihrer d6-Konfiguration in einer nahezu perfekt oktaedrischen Umgebung vor. Die internuklearen Pt-Cl-Abstände liegen im Bereich von 233 pm - 234 pm. Die Winkel zwischen den Cl-Atomen betragen entsprechend einer perfekt oktaedrischen Koordination 180° bzw. ca. 90°, wobei eventuelle Abweichungen < 0,2° betragen. (Tab. 33). Die [PtCl6]2--Anionen sind von [Sm(H2O)9·(15C5)3]-Einheiten umgeben. Das zentrale Samariumatom befindet sich auf der Lage 8h in der Elementarzelle. Das Sm3+-Ion ist von sechs kristallographisch unterscheidbaren Sauerstoffatomen neunfach koordiniert. In dieser Koordinationssphäre gehört jedes dieser Sauerstoffatome zu einem Wassermolekül. Die Sauerstoffatome bilden dabei ein kaum verzerrtes quadratisches Antiprisma (Vgl. 1.5.4). III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -91- Die Sm-O-Abstände (O1-O6) liegen im Durchschnitt bei erwarteten 247 pm und stimmen mit den Bindungslängen für bereits diskutierte Hexachloroplatinate der Selten-Erd-Elemente überein. Anders als bei den bisher besprochenen Strukturen mit Kronenethern ist es einem 15-Krone-5-Molekül nicht möglich, Ionen von der Größe eines Samarium-Ions (127 pm Ionenradius für Sm3+, KoZ 9) [10] zu umschließen. Selbst in literaturbekannten Strukturen, wie [Cd(H2O)2·(15C5)][(HSO4)2] in denen das Cd2+-Ion einen um 10 pm geringeren Ionenradius (117 pm Ionenradius für Cd2+, KoZ 7) aufweist, gelingt dieses nicht [72]. Stattdessen umgeben je drei 15-Krone-5 Moleküle ein Sm(H2O)93+-Kation. Die noch frei bleibenden Seiten des Polyeders werden von zwei Chlorid-Ionen und einem Kristallwassermolekül abgeschirmt. Es entsteht eine vollständige Isolierung der Selten-ErdEinheit innerhalb der Einheitszelle der Kristallstruktur (Abb. 64). Die C-C-Bindungslängen der Kronenetheringe liegen im literaturbekannten Bereich von 149 pm - 151 pm. Auffällig sind die verkürzten Atomabstände zwischen C14-C15 und C13-C12 von 129 pm bzw. 100 pm. Dies ist auf eine leichte Fehlordung des 15-Krone-5Moleküls zurückzuführen. Die durchschnittliche C-O-Bindungslänge (Literatur) liegt bei 138 pm - 148 pm und die beobachtete bei durchschnittlich 143 pm. Abweichungen werden auch hier durch fehlgeordnete Atome des Makrozyklus verursacht, besonders auffällig sind die Bindungslängen C12-O13 mit 191 pm und O12-C11 mit 112 pm. Bemerkenswert sind vielfältige Wechselwirkungen, die sich insbesondere zwischen den an das Samarium-Ion koordinierten Wassermolekülen und den Sauerstoffatomen des Kronenethers bzw. den Kristallwassermolekülen ausbilden (Abb. 63). Die stärkste Wasserstoffbrückenbindung befindet sich mit einer Länge von 268 pm zwischen den Wassermolekülen O4 und O15. Weitere Donor-Akzeptor Bindungen ergeben sich ebenfalls zwischen den freien Chloridionen (Akzeptor) und den koordinierten Wassermolekülen der Samarium-Einheit (Donor) im Bereich von 302 pm - 371 pm. Die Chloridionen der anionischen [PtCl6]-Einheiten liegen isoliert vor und bilden keine Brückenbindungen aus (Abb. 63). III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -92- 281 pm 285 pm 268 pm 273 pm 291 pm 270 pm Abb. 63: Wasserstoffbrückenbindungen in der Kristallstruktur von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O b c Pt Sm O Cl C H Abb. 64: Kristallstruktur von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O in Richtung [100] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -93- Tab. 32: Kristallographische Daten von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CCDC 1434,53 tetragonal I4/m (Nr. 87) a = 2020,5(3) pm c = 2740,6(6) pm 11188(3) ų 8 Australian Synchrotron (λ = 77,53 pm) Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 60476 8080 6952 0,0473; 0,0171 SHELXS97 und SHELXL97[28] 1,049 1,049 0,0348; 0,0811 0,0358; 0,0817 1,559/ -1,595 e/ų 777701 Tab. 33: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O Sm1- O1 O2 O3 O4 O5 O6 Pt1- Cl1 Cl2 Cl3 Cl4 Cl5 Pt2C1-C2 C3-C4 C6-C5 C9-C10 242,0(6) 248,4(4) (2x) 242,6(6) 250,0(6) 250,0(5) (2x) 246,7(4) (2x) Ø247,2(5) 234,0(3) 233,7(1) (4x) 233,1(3) 234,0(1) (4x) 232,8(2) (2x) 149(9) 149(10) 151(10) 151(9) C14-C15 C13-C12 O7-C1 O7-C10 O8-C9 O9-C7 O9-C6 O10-C4 O10-C5 O11-C2 O12-C11 O12-C12 C12-O13 C13-O13 O13-C14 O14-C15 129(2) 100(6) 142,7(7) 141,9(7) 143,4(7) 142,3(8) 142,9(8) 143,3(8) 142,1(8) 143,2(7) 112(2) 136(6) 191(5) 150(3) 126(2) 134(1) (2x) III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern Cl2-Pt1-Cl1 Cl3-Pt1-Cl2 Cl5-Pt2-Cl4 O1-Sm1-O2 O1-Sm1-O3 O1-Sm1-O5 O1-Sm1-O6 O2-Sm1-O5 O3-Sm1-O2 O3-Sm1-O5 O3-Sm1-O6 O6-Sm1-O2 O6-Sm1-O5 C2-O11-C3 C5-O10-C4 C7-O9-C6 C9-O8-C8 C10-O7-C1 89,87(3) 90,13(3) 90,12(3) 72,8(2) 133,9(2) 141,1(2) 86,9(1) 70,0(2) 138,6(1) 73,8(2) 80,07(9) 139,7(1) 69,9(2) 112,6(4) 113,4(5) 112,9(5) 112,9(5) 113,3(4) C11-O12-C12 C12-C13-O13 C13-C12-O12 C14-O13-C12 C14-O13-C13 C14-C15-O14 C13-O13-C12 C15-O14-C15 O7-C1-C2 O7-C10-C9 O8-C8-C7 O8-C9-C10 O9-C6-C5 O10-C5-C6 O11-C2-C1 O11-C3-C4 O12-C11-C11 O12-C12-O13 O13-C14-C15 -94- 145(2) 98(3) 128(2) 145(2) 140(2) 124(1) 31(1) 120(2) 107,9(5) 107,2(5) 110,6(5) 108,4(5) 114,0(5) 110,6(6) 108,0(5) 112,3(5) 113(2) 117(1) 123(1) 2.4.2.1. Thermischer Abbau von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O Für die thermische Analyse wurden ca. 13 mg [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von drei Zersetzungsschritten beginnt bereits bei 30 °C, endet bei 108 °C und zeigt einen Massenverlust von 9,9% (Tab. 34, Abb. 65). Dies deutet auf den Abgang von acht Molekülen Koordinations- und Kristallwasser hin. Ein zweiter Abbauschritt kann in einem Temperaturbereich von 108 - 220 °C detektiert werden. Bei einer Massendifferenz von 46,1% könnte ein Verlust von drei 15-Krone-5-Molekülen aufgetreten sein. Während der dritten und letzten Abbaustufe findet die Zersetzung zum elementaren Platin und Sm2O3, im Temperaturfenster von 239 °C - 1000 °C und einem Massenverlust von 22,3%, statt. Die pulverdiffraktometrischen Aufnahmen in Abb. 66 stützen diese Annahme zweifelsfrei. Der beobachtete Gesamtmassenverlust betrug 78,3% und stimmt mit dem errechneten Verlust von 74,3% fast überein. III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -95- Tab. 34: Ergebnisse der DTA/TG-Untersuchungen von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O, M = 1434,53 g/mol TBeginn [°C] 30 TEnde [°C] 108 Tmax [°C] 57 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 9,9 --- 108 220 197 46,1 --- unbekanntes Intermediat 220 1000 387 22,3 --- Pt, Sm2O3 Produkt unbekanntes Intermediat ^endo 100 DTA TG 90 80 Masse [%] DTA-Signal [ T] 70 60 50 40 30 20 200 400 600 800 1000 T [°C] Abb. 65: DTA/TG-Kurve des thermischen Abbaus von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Pt-simuliert -80 Sm2O3-simuliert -100 30 40 50 60 70 80 2 [°] Abb. 66: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -96- 2.5 Das Platinsulfat [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O 2.5.1 Synthese Zuerst musste in einer fünfstufigen Synthese die Verbindung K2[Pt2(SO4)4(H2O)2], ausgehend von elementarem Platin, dargestellt werden [73]. Hierzu wurden im ersten Reaktionsschritt in ein 250 ml-Becherglas 2,5 g (12,82 mmol) Platin zu einer Mischung von 7,5 ml konzentrierter Salpetersäure und 22,5 ml konzentrierter Salzsäure gegeben und zum Sieden erhitzt: Pt(s) + 4NOCl(aq) + 2HCl(aq) → H2[PtCl6](aq) + 4NO(g) Die Lösung färbte sich erst gelb, dann orange und schließlich nach vollständigem Auflösen rot. Anschließend wurde dreimal auf 7,5 ml eingeengt und wiederholt 12,5 ml Salzsäure hinzugefügt, bis die Entwicklung nitroser Gase ausblieb. Das erhaltene Produkt der Hexachloroplatinsäure konnte noch im gelösten Zustand weiter umgesetzt werden. Das Produkt von Reaktionsschritt 1 wurde in einem 250-ml-Becherglas unter Rühren auf 100 ml verdünnt. Im Anschluss erfolgte die Zugabe von 11,40 g (153,92 mmol) Kaliumchlorid und nach kurzem Erhitzen die Abkühlung der Reaktionsmischung auf Raumtemperatur: H2[PtCl6](aq) + 2KCl(aq) → K2[PtCl6] (s) + 2HCl(aq) Der resultierende gelbe Niederschlag wurde abfiltriert, zweimal mit 50 ml kaltem Wasser gewaschen und daraufhin im Vakuum getrocknet. Es konnten 6,08 g (12,51 mmol) des Produktes als kanariengelbes Pulver gewonnen werden. Im dritten Schritt wurden 70 ml Wasser und 6,08 g (12,51 mmol) K2[PtCl6] zusammen gegeben. Danach tropfte man über einen Zeitraum von 10 Minuten 0,31 g 80%-ige Hydrazinlösung hinzu, während die Temperatur auf 50 °C stieg und das Reaktionsgemisch sich langsam rot färbte: K2[PtCl]6(s) + 0,5 N2H4(aq) → K2[PtCl4](s) + 0,5 N2(g) + 2HCl(aq) Nach Beendigung der Gasentwicklung wurde die Lösung kurz aufgekocht und danach auf Raumtemperatur abgekühlt. Die ausfallenden roten Kristalle waren wasserlöslich. Verbleibendes Edukt und elementares Platin konnten über einen Glasfilter (Porengröße 4) entfernt werden. Anschließend wurde das Lösungsmittel zuerst durch Einengen auf einer Heizplatte, dann im Vakuum entfernt. Das gewünschte Produkt fiel in Form rot-brauner Kristalle aus. III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -97- Im Folgenden wurden 7,98 g (19,22 mmol) K2[PtCl4] in 75 ml Wasser gelöst und auf 60 °C erwärmt. Unter ständigem Rühren erfolgte eine Zugabe von 5,89 g (69,21 mmol) Kaliumnitrit: K2[PtCl4](s) + 4 KNO2(aq) → K2[Pt(NO2)4](aq) + 4KCl(s) Die Lösung wechselte die Farbe von rot-braun über hellgrün zu hellgelb bishin zu farblos. Danach wurde die Lösung bis auf 30 ml langsam eingedampft und auf Raumtemperatur abgekühlt. Die ausgefallenen farblosen Kristalle an K2[Pt(NO2)4] konnten abfiltriert und mit 15 ml kaltem Wasser gewaschen werden. Das Filtrat wurde nochmals eingeengt und eine zweite Produktfraktion entnommen, die wieder mit 15 ml kaltem Wasser gewaschen wurde. Die vereinigten Fraktionen wurden im Vakuum getrocknet. Ingesamt konnten 7,23 g (15,81 mmol) des Produktes isoliert werden. Abschließend erfolgte das Lösen von 7,23 g (15,81 mmol) K2[Pt(NO2)4] in 75 ml 5 M Schwefelsäure, das Erwärmen auf 120 °C sowie einstündiges Rühren. Die Farbe der Lösung wechselte von farblos über blau und grün zu gelbbraun. Hiernach wurde die entstandene Suspension auf 60 °C abgekühlt, 45 ml Wasser zugegeben und wiederum eine Stunde gerührt. Anschließend wurde auf Raumtemperatur abgekühlt, der Feststoff abgetrennt und zweimal mit 20 ml kaltem Wasser gewaschen. Am Ende erfolgte die Trocknung im Vakuum. Das Produkt fiel als hell ockerfarbenes Pulver an (Abb. 67). Abb. 67: Pulver von K2[Pt2(SO4)4(H2O)2] Zur Synthese von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O wurde eine klare, wässrige Lösung von K2[Pt2(SO4)4(H2O)2] hergestellt, indem in der Wärme gelöst und abfiltriert wurde. Die so erhaltene klare orangefarbene Lösung wurde anschließend mit zwei Äquivalenten 18-Krone-6 im Becherglas bei Raumtemperatur für wenige Minuten gerührt und anschließend zum isothermen Verdampfen des Lösungsmittels für mehrere Tage in einer Kristallisierschale III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -98- stehen gelassen. Es fielen orangebraune Einkristalle von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O an (Abb. 68). Abb. 68: Kristalle von [(K+·18C6)]2[Pt2(SO4)4(H2O)2]·H2O 2.5.2 Kristallstruktur von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O Die Verbindung [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O kristallisiert monoklin in der Raumgruppe P21/c. Dabei finden sich zwei Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein Pt3+-Ion, das sich wie alle anderen Atome auf einer allgemeinen WyckoffLage befindet. Die Pt2-Hantel, die aus je zwei Pt3+-Ionen gebildet wird, weist in der Mitte ihrer Bindung ein Inversionszentrum auf (Abb. 69). Die verdoppelte Summenformel der Einheit [Pt2(SO4)4(H2O)2] soll hervorheben, dass die Hauptbaugruppen in der Kristallstruktur Pt26+-Ionen sind. Der Abstand zwischen den Pt3+-Ionen liegt mit 246,4 pm (Tab. 36) im erwarteten Bereich und stimmt sehr gut mit der literaturbekannten Ausgangsverbindung K2[Pt2(SO4)4(H2O)2] mit 246,1 pm überein [74]. Die Pt2-Hantel wird von vier chelatisierend angreifenden SO42--Gruppen und zwei terminal einzähnig angreifenden H2O-Molekülen umgeben (Abb. 69). Die internuklearen Pt-O-Abstände liegen im Bereich von 200,1 pm - 200,9 pm für die chelatisierend angreifenden SO42--Gruppen und bei 215 pm für die endständigen Moleküle des Wassers (Tab. 36). Die O-S-O-Winkel innerhalb der SO42-Tetraeder liegen im Bereich von 106,4° - 115,8° (Tab. 36). Betrachtet man die Bindungswinkel der chelatisierend koordinierenden O-Atome und der entsprechenden Schwefelatome mit ca. 106,8° so ergibt sich ein etwas abweichender idealer Tetraederwinkel (109,47°). III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -99- Die anionische Einheit [Pt2(SO4)4(H2O)2]2- ist von jeweils zwei kationischen Einheiten [K+·18C6]+ umgeben. Es findet sich ein kristallographisch unterscheidbares Kalium-Ion in der Elementarzelle und damit auch ein zu differenzierender Kronenethering. In den erwähnten Einheiten ist das Kalium-Ion von den Sauerstoffatomen des Kronenethers und einem freien Sauerstoffatoms einer Sulfat-Gruppe koordiniert. Bemerkenswerterweise bildet letztere die mit 272,1 pm (O13) zweitkürzeste Bindung eines Sauerstoffatoms zum Kalium-Ion aus. Ähnliche Bindungsverhältnisse finden sich in der Verbindung [Pb2+·18C6][(HSO4)2] [72]. Der niedrigste Bindungsabstand eines fehlgeordneten Sauerstoffatoms des umschließenden Kronenetherrings zum Kalium-Ion beträgt mit 271,9 pm (O6) (Tab. 36), d. h. nur minimal mehr. Nimmt man den Mittelwert der Bindungsabstände der beiden fehlgeordneten Sauerstoffatome O6 und O6a (285,65 pm) so wäre das nicht fehlgeordnete O2 mit 281,8 pm der nächste Bindungspartner des Kalium-Ions. Folglich ist O13, das Sauerstoffatom der Sulfat-Gruppe, mit einem 9,7 pm kürzeren Abstand der nächstliegende Bindungspartner. Der mittlere Abstand aller Sauerstoffatome des Rings beträgt 291,4 pm. Diese relativ starke Bindung des Sauerstoffatoms der Sulfat-Gruppe hat zur Folge, dass das Kalium-Ion um ca. 69 pm aus der durch die Sauerstoffatome des Makrozyklus aufgespannten Ebene hervortritt (Abb. 69). Dabei wurden die stärksten Sauerstoff-Kalium-Abstände (O2, O4A, O6) zur Berechnung der Auslenkung herangezogen. Ungefähr die Hälfte des Kronenetherrings (O3-O6 und C5-C10) ist fehlgeordnet. Die entsprechenden Atome sind halbbesetzt. Das bereits diskutierte O6 (O6A)-Atom tritt dabei leicht aus der Ebene des Rings hervor. Die durchschnittliche C-C-Bindungslänge des Kronenetherings liegt im Bereich von 146 pm und zeigt somit die charakteristische literaturbekannte Bindungslänge von 143 pm - 157 pm [71]. Die durchschnittliche C-O-Bindungslänge (Literatur) liegt bei 138 pm - 148 pm und die beobachtete im Mittel bei 142 pm. Es werden einige Wasserstoffbrückenbindungen in der Struktur ausgebildet. Mit 266 pm besonders stark zwischen den terminalen Wassermolekülen der Pt2-Hantel und dem vorhandenen Kristallwassermolekül. Und mit 285 pm zwischen dem koordinierten Wassermolekül und dem Sauerstoffatom einer Sulfat-Einheit (O10). III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -100- O6 272 pm O13 Abb. 69: Wasserstoffbrückenbindungen in der Kristallstruktur von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O ohne eingezeichnete Fehlordnung c a Pt S O K C H Abb. 70: Kristallstruktur von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O in Richtung [010] III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -101- Tab. 35: Kristallographische Daten von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CCDC 1453,31 monoklin P21/c (Nr. 14) a = 1039,24(2) pm b = 965,19(2) pm c = 2301,49(5) pm = 90,496(1)° 2308,46(8) ų 2 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 76844 8518 6368 0,0549; 0,0476 SHELXS97 und SHELXL97[28] 0,923 0,961 0,0244 ; 0,0516 0,0417 ; 0,0541 1,554/ -0,939 e/ų 777703 Tab. 36: Ausgewählte internukleare Abstände [pm] und Winkel [°] in [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O Pt1Pt1- Pt1 O7 O9 O11 O12 O15 K1- O1 O2 O3 O3A O4 O4A O5 O6 O6A 246,45(2) 200,1(2) 200,9(2) 200,4(2) 200,2(2) 215,6(2) Ø203,4(2) 288,0(3) 281,8(3) 307,3(9) 282,1(9) 297,6(7) 281,8(7) 313(1) 271,9(9) 299,4(9) Ø291,4(7) O7 O8 O13 S1O11 O12 O13 O14 S2O7 O8 O9 O10 O1-C12 O3-C5 O3A-C5A O4-C7 O5-C9 O6A-C10A 304,4(2) 297,5(3) 272,1(2) 153,6(2) 154,5(2) 143,1(2) 143,7(2) 154,3(2) 143,5(2) 153,4(2) 143,8(2) 140,0(4) 142,0(6) 142,3(6) 141,7(6) 142,4(6) 133(1) III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern C1-C2 C5-C6 C6A-C5A C7-C8 C7A-C8A C9-C10 O7-Pt1-O9 O7-Pt1-O15 O9-Pt1-O15 O12-Pt1-O9 O12-Pt1-O11 150,0(5) 148,9(7) 148,9(7) 146,3(7) 144,2(7) 149,7(7) 178,91(8) 87,95(9) 91,87(9) 89,68(8) 179,51(9) O6-K1-O13 O13-K1-O3A O2-K1-O8 O8-K1-O6A O13-S1-O14 O13-S1-O11 O11-S1-O12 O8-S2-O10 O8-S2-O7 O10-S2-O7 -102- 141,8(3) 80,5(3) 78,09(7) 97,3(2) 115,8(1) 110,0(1) 106,9(1) 115,6(1) 106,4(1) 109,8(1) 2.5.2.1. Thermischer Abbau von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O Für die thermische Analyse wurden ca. 10 mg [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 800 °C erhitzt. Der thermische Abbau beginnt bei 88 °C und endet, ohne über einen längeren Bereich stabile Zwischenstufen aufzuzeigen, bei 800 °C. Es soll versucht werden, die in der DTA/TG-Kurve (Abb. 71) angedeuteten Zwischenstufen der Verbindung I, [K+·18C6]2 [Pt2(SO4)4(H2O)2]·H2O, mit Hilfe der thermischen Untersuchungen an der kohlenstofffreien Verbindung II, K2[Pt2(SO4)4(H2O)2], nachzuvollziehen. Aus den Tabellen 37 und 38 ist eine teilweise einheitliche Zersetzung, die jedoch jeweils in verschiedenen Temperaturbereichen stattfindet, nach Abgang der 18-Krone-6-Moleküle zu entnehmen. Es ist dabei von der Ausbildung unterschiedlicher Intemediate für I und II auszugehen. Der erste von drei bzw. vier Zersetzungsschritten beginnt für I bereits bei 88 °C, endet bei 180 °C und zeigt einen Massenverlust von 18,3%. Dies könnte auf den Abgang von einem Molekül Kronenether hindeuten. Für II ist in diesem Temperaturfenster keine Zersetzung zu beobachten. Im folgenden zweiten bzw. im ersten Abbauschritt bilden sich für beide Verbindungen unterschiedliche Intermediate, die jedoch mit einem gleichen Massenverlust von 28,8% und 12,9% bezogen auf das Molekulargewicht auftreten. Dies geschieht von 180 °C - 240 °C bzw. 150 °C - 436 °C. Theorethisch könnte dabei für I der Abgang von einem weiteren Molekül 18-Krone-6, einem Molekül SO3 und drei Molekülen Wasser III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -103- angenommen werden, wohingegen II möglicherweise ebenfalls ein Molekül SO3 und drei Moleküle Wasser abgibt. Anschließend findet in beiden Fällen die Bildung von K2SO4 und 2x PtO unter eventueller Abgabe von zwei Einheiten SO3 und einem halben Molekül O2 im Temperaturbereich von 220 °C - 357 °C bzw. 436 °C - 581 °C und einem Massenverlust von 13,8% und 18,5% statt. Während der vierten bzw. dritten und damit letzten Abbaustufe findet die Zersetzung zu elementarem Platin unter Beibehaltung von K2SO4, im Temperaturfenster von 357 °C - 800 °C bzw. 581 °C - 800°C und einem Massenverlust von 2,5% und 3,8% statt. Die pulverdiffraktometrischen Aufnahmen in Abb. 72 stützen diese Annahme des gebildeten Zersetzungsrückstandes Die detektierten und berechneten Massenverluste stimmen überein und betragen 63,4% bzw. 60,0% für Verbindung I und 35,2% und 36% für Verbindung II. Die Differenz von 3,4% bei der Zersetzung von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O ist wahrscheinlich auf anhaftendes Lösungsmittel zurückzuführen. Dieses zusätzliche Wasser könnte in der ersten Zersetzungsstufe anstelle des Kristall- und Molekülwassers abgegeben werden und so die Berechnungen für die nachfolgenden Zersetzungsstufen und Intermediate beeinflussen. Die 1974 angestellten thermogravimetrischen Analysen von Muraveiskaya et al. [73] weisen starke Ähnlichkeit zu den hier gemachten Untersuchungen an K2[Pt2(SO4)4(H2O)2] auf. Es wurde auf die gleichen Zersetzungsprodukte SO3, H2O und O2 geschlussfolgert. Allerdings herrschte trotz umfangreicher Analysen zu diesem Zeitpunkt noch keine vollkommene Klarheit über die tatsächliche Summenformel der bis dahin mit K2(H3O)[Pt2(SO4)4(OH)(H2O)] beschriebenen Verbindung vor. Diese klärte sich erst zehn Jahre später nach Untersuchungen am Einkristall auf [74]. Tab. 37: Ergebnisse der DTA/TG-Untersuchungen an [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O, M = 1453,31 g/mol TBeginn [°C] 88 TEnde [°C] 180 Tmax [°C] 139 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 18,3 --- 180 240 220 28,8 --- unbekanntes Intermediat 240 357 277 13,8 --- K2SO4, 2 PtO 357 800 620 2,5 2,2 K2SO4, 2 Pt Produkt unbekanntes Intermediat III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -104- Tab. 38: Ergebnisse der DTA/TG-Untersuchungen an K2[Pt2(SO4)4(H2O)2], M = 888,64 g/mol TBeginn [°C] 150 TEnde [°C] 436 Tmax [°C] 414 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 12,9 --- 436 581 545 18,5 --- K2SO4, 2 PtO 581 800 609 3,8 3,6 K2SO4, 2 Pt Produkt unbekanntes Intermediat ^endo 100 TG: K2[Pt2(SO4)4(H2O)2] + TG: [(K ·18C6)]2[Pt2(SO4)4(H2O)2]·H2O + DTA: [(K ·18C6)]2[Pt2(SO4)4(H2O)2]·H2O 90 DTA-Signal [ T] Masse [%] 80 70 60 50 40 30 100 200 300 400 500 600 700 T [°C] Abb. 71: TG-Kurve des thermischen Abbaus von K2[Pt2(SO4)4(H2O)2] und DTA/TG-Kurve des thermischen Abbaus von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O 800 III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -105- Abb. 72: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O 2.6. Zusammenfassung Vier neuartige Verbindungen der Hexachloroplatinate(IV) und eines Platin(III)-Sulfats mit verschiedenen Kronenethern konnten hergestellt und kristallographisch charakterisiert werden. Dabei handelt es sich um Untersuchungen an bisher noch nicht bekannten Kombinationen von Anionen und Kationen in komplexen Netzwerken in Gegenwart von Kronenethern. Thermogravimetrische Untersuchungen lieferten einen Einblick in die intramolekularen Zersetzungsprozesse derartiger Verbindungen. Die Kristallstruktur von [H3O+·18C6]2[PtCl6] fügt sich in die bisher in unserer Gruppe durchgeführten thermoanalytischen Arbeiten [39] über die Zersetzung von (H3O)2[PtCl6] und der damit gewonnenen Erkenntnisse über den strukturellen Aufbau [37] und die Zusammensetzung von Metallsäuren ein. Lanthanoidverbindungen mit 18-Krone-6-Molekülen sind seit 1980 bekannt [70, 75], allerdings nur wenige mit komplexen Anionen. [La(NO3)(H2O)2·(18C6)][PtCl6] ist die erste Verbindung ihrer Art mit einem Nitrat- und zwei Neutralliganden koordiniert am Selten-Erd- III. 2. Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern -106- Metallatom und einem [PtCl6]2--Ion, welches die Ladung dieser Einheit ausgleicht. DTA/TG-Untersuchungen an dieser Verbindung zeigten die gleichen Zersetzungsrückstände, wie bei der Ausgangsverbindung [La(NO3)2(H2O)6]2[PtCl6]·2H2O. In [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O ist das Sm3+-Ion nicht mehr umgeben von einem Kronenether, wie in den anderen erhaltenen Kristallstrukturen. Stattdessen umgeben drei 15-Krone-5-Moleküle das Ion und schirmen dieses ab. Ebenfalls zeichnen zahlreich vorhandene Wasserstoffbrückenbindungen und die damit verbundene Ausbildung eines dichten Netzwerks diese Verbindung aus. [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O hingegen enthält, anders als bei den bisher diskutierten Strukturen, kein [PtCl6]2--Ion, sondern das komplexere [Pt2(SO4)4(H2O)2]2--Ion. Dieses konnte in der Gegenwart des Kronenethers vollständig isoliert werden. Zwei 18-Krone-6-Moleküle umschließen die Kalium-Ionen. Dabei werden selbige merklich von den Sauerstoffatomen der Sulfat-Gruppen des Anions aus der Ebene des Makrozyklus bewegt. In [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O wurde das erste Mal ein Kronenether eingesetzt, um eine Pt26+-Hantel enthaltene Verbindung zu kristallisieren. Die thermogravimetrischen Analysen von Muraveiskaya et al. [73] decken sich größtenteils mit den durchgeführten Untersuchungen an K2[Pt2(SO4)4(H2O)2] und [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O. Es wurde auf die gleichen Zersetzungsprodukte SO3, H2O und O2 geschlussfolgert. III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -107- 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Schwefelsäure 3.1 Allgemeines Bereits zu Beginn des letzten Jahrhunderts veröffentlichte Delépine Arbeiten zu ungewöhnlichen dreikernigen Iridium-Komplexen [76]. Der daraufhin in der Literatur als Delépine-Salz bekannt gewordene grüne Komplex, wurde ursprünglich als K4H2NIr3(SO4)6·3H2O und damit als reiner Ir(III)-Komplex beschrieben. In späteren Arbeiten korrigierte Delépine seine Ansicht aus den Jahren 1906-1910 und veröffentlichte eine gemischtvalente Zusammensetzung K4[Ir3N(SO4)6(H2O)3], die bis heute Bestand hat. In Folgeuntersuchungen von JØrgensen und Orgel [77, 78] im Jahre 1959 wurde ein erster Strukturvorschlag des Trimers veröffentlicht, in dem zwei Ir(IV)- und ein Ir(III)-Atom pro Formeleinheit vorliegen. Eine Strukturbestimmung aus Einkristalldaten wurde einige Jahre später von Ciechanowicz et al. am Ammoniumsalz des komplexen Ions [Ir3N(SO4)6(H2O)3]4vollzogen [79]. Erfolgte die Darstellung des Delépinschen Salzes aus Na3IrCl6 und (NH4)2SO4 in konzentrierter Schwefelsäure, so wurde bei der Reaktion von Na3IrCl6 in konzentrierter Schwefelsäure ein andersartiger, dreikerniger Komplex erhalten. 1883 erstmals von Lecoq de Boisbaudran [80] beschrieben, im Nachhinein nach diesem benannt, wurde er als K10[Ir3O(SO4)9(H2O)3] identifiziert und war damit das erste Sauerstoffanalogon zu K4[Ir3N(SO4)6(H2O)3]. Allerdings ist die Gemischtvalenz in Lecoqs-Salz mit Ir (IV, III, III) pro trimerer Einheit eine andere. Weitere Arbeiten zu [Ir3O] behandelnden Komplexen wurden in den Jahren 1991 und 1996 publiziert. Zhilyaev et al. bestimmten aus „unvollkommenen Einkristallen“ die schwach gesicherte Struktur von Cs3K[Ir3O(SO4)6(HSO4)2(H2O)] [81]. Kristallographisch kann jedoch nicht zwischen Sulfat- und Hydrogensulfat-Einheiten unterschieden werden, da weder charakteristische Bindungslängen noch Wasserstoffatome zugeordnet werden können und einige Sulfat-Tetraeder stark verzerrt erscheinen. Folglich bleibt auch die Ladung des Clusters ungewiss. Ezerskaya et al. führten eine Vielzahl von Redox-Transformationen an den dreikernigen Iridium-Oxohexasulfaten K8[Ir3O(SO4)6(SO4)3], K2[Ir3O(SO4)6(H2O)3]·3K2SO4 und Cs5[Ir3O(SO4)6(H2O)3]·4H2O durch [82]. Entgegen bereits erwähnter Literatur geht er dabei von keiner Gemischtvalenz der Verbindungen aus. Ferner wird zur Klärung der Strukturen auf die einkristallographischen Messungen von Zhilyaev, der als einziger derartige Untersuchungen an trimeren oxo-verbrückten Iridiumverbindungen vorgenommen hat, verwiesen. Da in den Hochtemperatur-Syntheserouten bei Reaktionstemperaturen von bis zu III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -108- 325 °C und bei den elektrochemischen Messungen teilweise mit konz. Schwefelsäure oder in schwefelsaurem Medium gearbeitet wurde, ist die Bildung von Hydrogensulfatgruppen anstelle der angenommenen Sulfatgruppen prinzipiell möglich. In Abschnitt 5.6.2 dieser Arbeit wird ein stabiles Sulfat-Hydrogensulfat-Wasser-Addukt vorgestellt, das aus wässriger Schwefelsäurelösung bei eben solchen Temperaturen dargestellt wurde. Bis heute sind nur wenige Ir(IV)-Komplexe mit sauerstoffhaltigen Liganden, wie z.B. [Ir3O(O2CR)6(py)3]2+ Ir (IV, IV, III) bekannt, die keine Sulfat-Gruppen enthalten. Die ausgebildeten Strukturen sind dabei alle zu [Cr3O(O2CR)6(H2O)3]+ analog [10, 83]. Mit Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 liegt nun ein weiterer Vertreter dieser interessanten Verbindungsklasse der dreikernigen Iridium-Komplexe vor. Die grünen Kristalle enthalten ebenfalls eine gemischtvalente, koplanare [Ir3O]-Einheit. Allerdings unterscheidet sich die Verbindung in Form und Zusammensetzung von den bereits bekannten Strukturen. Erstmals gelang es neben den bereits charakterisierten reinen Sulfaten ein gemischtes SulfatHydrogensulfat-Schwefelsäure-Addukt in Gegenwart eines Selten-Erd-Elementes darzustellen. Anders als bei den erwähnten Verbindungen weist die Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 nur ein Molekül Wasser pro Summenformel auf. Ergänzend wurde die Struktur elektrochemisch mittels zyklischer Voltammetrie untersucht und charakterisiert. Die Farbe und das elektrochemische Verhalten sind ähnlich zu dem Delépine-Salz K4[Ir3N(SO4)6(H2O)3]. Allerdings ist unter Berücksichtigung der guten kristallographischen Daten und den damit erhaltenen typischen Bindungslängen für Schwefelsäure-, Hydrogensulfat- Gemischtvalenz auszugehen. und Sulfat-Einheiten von einer Ir (IV, III, III) III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -109- 3.1.1 Synthese Zur Darstellung der grünen, luft- und feuchtigkeitsempfindlichen Einkristalle von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 (Abb. 73) wurden 150 mg an [Pr(NO3)2(H2O)6][IrCl6]·2H2O (Darstellung s. Punkt 1.3.2) mit 1 ml Oleum in einer geschlossenen Normalglasampulle umgesetzt. Dabei wurde die Ampulle während einer 25-stündigen Aufheizzeit im Blockthermostat auf 350 °C gebracht, diese Temperatur 48 Stunden gehalten und dann innerhalb von 170 Stunden auf Raumtemperatur abgekühlt. Abb. 73: Kristalle von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 unter dem Lichtmikroskop 3.1.2 Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Die Verbindung Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 kristallisiert monoklin in der Raumgruppe C2/c. Es finden sich vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es zwei Iridiumatome Ir1 und Ir2, die in der gemischtvalenten Verbindung die Ladung +III bzw. +IV tragen. Ir1 liegt auf der allgemeinen Wyckoff-Lage 8f und Ir2 speziell auf 4e. Durch eine zweizählige Drehachse entsteht ein weiteres symmetrieäquivalentes Ir1-Teilchen pro Formeleinheit. So kann insgesamt von einer (IV, III, III)-Gemischtvalenz der Iridiumatome und einer d6- bzw. d5-Konfiguration ausgegangen werden. Jedes Iridiumatom ist dabei von sechs Sauerstoffatomen oktaedrisch umgeben. Die internuklearen Ir-O-Abstände liegen im Bereich von 196,1, pm - 233,0 pm (Tab. 41). Die kürzeste Bindung von 196 pm tritt dabei zwischen dem zentralen Sauerstoffatom O1 und Ir2 auf. Die Bindungslänge zwischen Ir2 und dem Sauerstoffatom O5 des koordinierten Wassermoleküls beträgt 203,1 pm. Generell sind Sauerstoffbindungen zum Ir2 im Mittel um 31,3 pm verlängert. Die Winkel zwischen den O-Atomen der Oktaeder betragen entsprechend einer stark verzerrten Koordination 180° bzw. ca. 90,6°, wobei eventuelle Abweichungen bei < 12,5° liegen (Tab. 41). Jeweils drei Iridiumatome bilden mit dem Sauerstoffatom O1 eine trimere oxo-verbrückte [Ir3O]-Einheit (Abb. 74) in der die III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -110- Ir-O-Abstände 198,1 pm (Ir1) und 196,1 pm (Ir2) betragen. Im Vergleich dazu liegen die Ir-N-Abstände in NH4[Ir3N(SO4)6(H2O)3] bei 191,8 pm [79] und die Ir-O-Abstände in Cs3K[Ir3O(SO4)6(HSO4)2(H2O)] bei 200,7 pm und 184,3 pm [81]. O5 Ir2 O1 Ir1 Ir1 Ir O S H - Abb. 74: Anionische Einheit [Ir3O(SO4)6(HSO4)2(H2O)]5 in der Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Innerhalb der anionischen Einheit [Ir3O(SO4)6(HSO4)2(H2O)]6- treten sechs zweifach geladene Sulfat- und zwei einfach geladene Hydrogensulfat-Gruppen auf. Vergleicht man an dieser Stelle den literaturbekannten dreikernigen Iridium-Komplex K4[Ir3N(SO4)6(H2O)3] von Delépine mit Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4, so ist eine gleiche Anzahl an koordinierenden Gruppen festzustellen. Die Kaliumverbindung setzt sich allerdings nur aus Sulfat- und Wassermolekülen zusammen, wohingegen in der Praseodymverbindung zwei Wassermoleküle durch Hydrogensulfat-Einheiten ersetzt werden. Die so um zwei erhöhte negative Ladung des Iridiumclusters wird durch die höhere Ladung der Pr3+-Ionen kompensiert. Des Weiteren ist die Einheit [Ir3O(SO4)6(HSO4)2(H2O)]6- von kristallographisch identischen Praseodymatomen umgeben. Diese koordinieren zweizähnig (3x), einzähnig (2x) und dreizähnig (1x) an die Sauerstoffatome der Sulfat- und Hydrogensulfat-Einheiten des erwähnten anionischen Clusters und wirken so verbrückend. Zwei Moleküle Schwefelsäure, die nur an weitere Praesodym-Einheiten binden, ein freies, nicht weiter koordinierendes Molekül Säure und eine Hydrogensulfat-Gruppe komplettieren die Koordinationssphäre des III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -111- Pr3+-Ions (Abb. 75). Letztgenannte Hydrogensulfat-Einheit und die nicht koordinierende Schwefelsäure weisen eine leichte Fehlordung am Schwefel- und einigen Sauerstoffatomen auf. Die Pr3+-Ionen sind von insgesamt neun Sauerstoffatomen koordiniert. Sechs davon bilden ein trigonales Prisma, das auf den Vierecksflächen dreifach überkappt ist. Pr O S H Abb. 75: Koordiniertes Pr3+-Ion in der Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Neben Zyklovoltammetrie-Messungen an Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 (Abschnitt 3.1.2.2) war eine zweifelsfreie Lokalisierung der Wasserstoffatome zur Bestimmung der Gemischtvalenz der Iridiumatome essentiell. Verglichen mit den aus den Einkristallstrukturdaten ermittelten Bindungslängen für S-O (Ø = 142,2 pm) ist die SchwefelSauerstoff-Bindung in H-O-S (Ø = 152,4 pm) im Mittel um 10,2 pm verlängert (Tab. 41). So ist eine kristallographische Identifizierung der SO42--, HSO4-- und H2SO4-Gruppen möglich, die durch Fourier-Elektronendichtekarten (Abschnitt 3.1.2.1.) gestützt wird. Es ist daraus keine Restelektronendichte an den betreffenden Sauerstoffatomen ersichtlich, die auf das Übersehen eines H-Atoms hindeutet und dadurch die Ladung des Komplexes beeinflusst. Wie erwartet ist die Schwefel-Sauerstoff-Bindung in der Hydrogensulfat-Einheit, im Vergleich zu den koordinierten Schwefelsäuremolekülen, um 3,6 pm verlängert. Zur Übersicht sind in Tabelle 39 alle betreffenden Schwefel-Sauerstoff-Bindungslängen der Tetraeder aufgeführt. Aus dieser Tabelle ist ebenfalls ersichtlich, dass die Metall-Sauerstoff-Abstände in Ir-O-S (Ø = 149,8 pm) im Mittel um 5,9 pm länger sind als die Abstände in Pr-O-S (Ø = 143,9 pm). III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -112- b a Ir Pr O S Abb. 76: Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 ohne H-Atome in Richtung [001] Tab. 39: Abstände der Sauerstoffatome der SO4-Tetraeder zu Bindungspartnern in Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 S1- S2- S3- S4- S5- S6- O2 O3 O4 O26 O6 O7 O8 O9 O10 O11 O12 O13 O14 O15 O16 O17 O18 O19 O20 O21 O22 O23 O24 O25 Sauerstoff-Bindungspartner Bindungslänge [pm] Ir Ir Pr Pr Ir --Pr Ir HO-SO3 Pr --Ir Pr (HO)2SO2 --(HO)2SO2 Pr Pr (HO)2SO2 (HO)2SO2 Pr Pr Ir Ir 150,3(3) 150,2(3) 144,3(3) 144,6(3) 149,3(3) 146,5(3) 144,2(3) 149,1(3) 155,2(4) 146,0(4) 138,7(4) 149,7(3) 141,6(4) 150,8(5) 141,3(6) 152,1(4) 142,4(3) 142,5(3) 152,5(4) 151,1(4) 146,2(3) 143,7(3) 150,0(3) 149,7(3) III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -113- Tab. 40: Kristallographische Daten von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten 2055,24 monoklin C2/c (Nr. 15) a = 1528,36(4) pm b = 1622,36(5) pm c = 1526,99(4) pm = 98,815(2)° 3741,5(2) ų 4 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 17615 4649 3993 0,0267; 0,0288 SHELXS97 und SHELXL97[28] 1,091 1,076 0,0219; 0,0422 0,0326; 0,0446 1,090/ -0,982 e/ų 421777 Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Tab. 41: Ausgewählte internukleare Abstände [pm] und Winkel [°] in Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Ir1Ir1- Ir2- Pr1- Ir2 O1 O2 O9 O13 O24 O25 O1 O3 O5 O6 O4 O8 O11 O14 O18 O19 O22 O23 O26 341,1(3) 198,1(2) 202,1(3) 202,8(3) 203,7(3) 203,6(3) 202,0(3) 196,1(4) 202,6(3) 203,2(5) 202,8(3) 243,4(3) 244,8(3) 245,8(3) 250,2(3) 249,0(3) 259,6(3) 259,5(3) 251,6(3) 243,5(3) O1-Ir2-O5 O1-Ir2-O6 O3-Ir2-O6 O3-Ir2-O6 O6-Ir2-O6 O6-Ir2-O5 Ir1-O1-Ir1 Ir2-O1-Ir1 S1-O4-Pr1 S4-O14-Pr1 S5-O18-Pr1 S5-O19-Pr1 S6-O22-Pr1 O4-Pr1-O18 O11-Pr1-O14 O11-Pr1-O18 O14-Pr1-O22 O22-Pr1-O19 O26-Pr1-O18 O26-Pr1-O19 180,000(1) 96,21(9) 90,6(1) 88,8(1) 167,6(2) 83,79(9) 120,3(2) 119,9(1) 155,8(2) 158,8(2) 152,1(2) 145,6(2) 133,2(2) 136,0(1) 133,4(1) 111,6(1) 143,2(1) 139,7(1) 125,4(1) 129,5(1) III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum S3A- O10A O11 O12 O13 S4O15A O16A S4AO14 O15 O15A O16 O16A O17A O1-Ir1-O2 O1-Ir1-O13 O2-Ir1-O24 O2-Ir1-O13 O9-Ir1-O24 O2- Ir1-O24 154(2) 135,2(7) 155,6(8) 139,9(7) 124(8) 161(9) 142(2) 141(3) 130(9) 147(2) 187(9) 144(5) 98,7(1) 177,2(1) 93,1(1) 79,0(1) 170,0(1) 91,6(1) O26-Pr1-O23 S1-O2-Ir1 S1-O3-Ir2 S2-O9-Ir1 S6-O25-Ir1 O12-S3-O11 O8-S2-O9 O18-S5-O20 O7-S2-O6 O23-S6-O24 O11-S3-O10 O21-S5-O20 O4-Pr1-O22 O4-Pr1-O14 O26-Pr1-O14 O4-Pr1-O11 O4-Pr1-O26 O18-Pr1-O23 -114128,0(1) 122,2(2) 125,9(2) 128,3(2) 129,9(2) 118,5(2) 111,6(2) 109,2(2) 108,3(2) 107,9(2) 107,5(2) 105,2(3) 89,7(1) 76,7(1) 71,3(1) 70,5(1) 69,1(1) 66,3(1) 3.1.2.1 Fourier-Elektronendichtekarten von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Diffenrenzfourierkarten geben Auskunft über eventuell verbliebene Restelektronendichten in der gelösten Kristallstruktur. Diese Betrachtung bietet sich in Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 besonders an, da zwischen SO42--, HSO4-- und H2SO4Gruppen unterschieden werden musste, also zwischen dem Vorhandensein und Fehlen von Wasserstoffatomen. Dabei sind grüne Bereiche in den Karten ein Indiz für überschüssige Elektronendichte im errechneten Kristallstrukturmodell. Abb. 77 zeigt die Umgebung des dreifach gebundenen Sulfat-Ions (S2). Bei O7 handelt es sich um das einzige, nicht weiter koordinierende Sauerstoffatom des Tetraeders, welches keine auffällige negative Ladung in der unmittelbaren Umgebung zeigt. Gleiches gilt für O12 des zweifach gebundenen Hydrogensulfat-Ions (S3) (Abb. 78) und O16 des teilweise fehlgeordneten und einfach gebundenen H2SO4-Moleküls (S4a) (Abb. 79). III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -115- Abb. 77: Differenzfourierkarte für den Schnitt durch das dreifach gebundene Sulfat-Ion (S2) in der Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Abb. 78: Differenzfourierkarte für den Schnitt durch das zweifach gebundene Hydrogensulfat-Ion (S3) in der Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -116- Abb. 79: Differenzfourierkarte für den Schnitt durch das teilweise fehlgeordnete und einfach gebundene H2SO4-Molekül (S4a) in der Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 3.1.2.2 Zyklovoltammetrische Untersuchungen Trimere Oxo- und Nitridoiridium Sulfate wurden in der Vergangenheit zur Klärung der Oxidationsstufen der Metallatome eingehend untersucht. 1970 nahmen Brown et al. erste elektrochemische Untersuchungen vor und fanden im zyklischen Voltammogramm für das Lecoq-Salz K10[Ir3O(SO4)9(H2O)3] in 1 M Schwefelsäure zwei reversible Redox-Paare bei 0,3 V und 0,9 V (vs. SCE, Saturated Calomel Electrode) [84]. Dies entspräche einer Reduktion von (IV, III, III) zu (III, III, III) mit anschließender Oxidation. Zu einem ähnlichen Ergebnis kommt Ezerskaya bei Messungen an dem grünen Komplex K8[Ir3O(SO4)6(SO4)3]. Hier wurden eine Reduktion von (IV, III, III) zu (III, III, III) bei 0,10 V und die entsprechende Oxidation bei 0,5 V in 0,1 M Na2SO4-Lösung detektiert (vs. SCE, Saturated Calomel Electrode). Für Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 ergibt sich ein entsprechendes reversibles Redox-Verhalten bei 0,32 V bzw. 0,42 V (Abb. 80). Es stellt sich hierbei generell die Frage, ob die untersuchten Komplexe in Lösung die gleiche Zusammensetzung wie im Festkörper haben oder in Abhängigkeit des Lösungsmittels eine Protonierung oder Deprotonierung der Sulfatgruppen stattfindet. III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum -117- Ezerskaya bemerkte eine Umwandlung der gemutmaßten (IV, IV, IV) Form im Festkörper von K8[Ir3O(SO4)6(SO4)3] zu (IV, III, III), sobald die Substanz in Na2SO4-Lösung gebracht wurde. Dies ging mit einer Farbänderung von Grün zu Blau einher. Die gleiche Beobachtung konnte nach der Aufnahme eines zyklischen Voltammogramms an Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 in konz. Schwefelsäure gemacht werden. Eine Auswertung der erhaltenen Ergebnisse ist nun denkbar schwierig, solange keine Klarheit über die sich in Lösung befindliche Gemischtvalenz des Komplexes herrscht. Außerdem sollte zur Vergleichbarkeit mit den Literaturdaten im gleichen Lösungsmittel, also verdünnter Schwefelsäure- oder Na2SO4-Lösung anstatt konz. Schwefelsäure, gemessen werden. Dieses ist auf Grund der Empfindlichkeit von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 gegenüber Feuchtigkeit schwierig. Am sinnvollsten erscheint die Annahme eines Ir3(IV, III, III)Komplexes, der bei E0 = 0,32 V zu (III, III, III) reduziert und bei 0,42 V wieder zur Ausgangsform oxidiert wird. Die Reduktion deckt sich gut mit den von Brown erhaltenen Ergebnissen. Für den erhaltenen Wert der Oxidation findet sich in der Arbeit von Ezerskaya ein passender Oxidationsschritt von Ir3(III, III, III) zu Ir3(IV, III, III) bei 0,5 V. Sicher lassen sich die Messergebnisse nur dahingehend interpretieren, dass mindestens ein Iridiumatom in Lösung von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 in konz. Schwefelsäure die Oxidationszahl IV tragen muss und reversibel einer Redox-Reaktion unterzogen werden kann. Es konnten im Scanbereich von 0 V - 2 V an der Verbindung Pr2[Ir3O(SO4)6(HSO4)2(H2O)] (H2SO4)4 weitere Redoxvorgänge beobachtet werden, die jedoch von der Zersetzung der Schwefelsäure überlagert waren und daher nicht ausgewertet wurden. Betroffen davon ist nicht der ausgewertete Potentialbereich von 0,2 V - 0,6 V (Abb. 81). Ebenfalls wurden verschiedenartige Gegenelektroden bei den Messungen verwendet, was eine Vergleichbarkeit weiter erschwerte. Tab. 42: Messparameter der zyklischen Voltammetrie-Messungen Gegenelektrode Pt Low E (V) 0,2 Referenzelektrode Ag Scan Rate (V/s) 0,05 Arbeitselektrode Glas-Kohlenstoff Segment 2 Lösungsmittel konz. H2SO4 Smpl Interval (V) 0,001 Init E (V) 0,2 Sensitivity 1e-5 High E (V) 0,6 III. 3. Umsetzung von Praseodym-Hexachloroiridat(IV) mit Oleum Red Ox + e(III) (III) (III) (IV) (III) (III) E° = 0,42 V 0,002 0,001 -5 Stromstärke / 1e A -118- 0,000 -0,001 -0,002 -0,003 Ox + e Red (IV) (III) (III) (III) (III) (III) E° = 0,32 V -0,004 -0,005 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55 0,60 Potential / V -5 Stromstärke / 1e A Abb. 80: Zyklovoltammogramm von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 0,002 0,012 0,001 0,010 0,008 0,000 0,006 -0,001 0,004 -0,002 0,002 -0,003 0,000 -0,004 [Ir3O]-Cluster -0,005 0,20 -0,002 konz. Schwefelsäure 0,25 0,30 0,35 0,40 0,45 0,50 0,55 0,60 Potential / V Abb. 81: Zyklovoltammogramm von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 und H2SO4 III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -119- 4. Das Rhodiumsulfat Rh2(SO4)3(H2O)2 4.1 Allgemeines Bereits seit vielen Jahren sind Mischsulfate des Rhodiums(III) der Summenformel Cs[Rh(SO4)2(H2O)6]·6H2O oder Na4[Rh2(SO4)4(H2O)2]·4H2O literaturbekannt [85, 86]. Auch das eine Rh-Rh-Bindung enthaltene Ion [Rh2(SO4)4]4- konnte bei der Umsetzung des Hexaaquakomplexes [Rh(H2O)10]4+ mit verdünnter Schwefelsäure erhalten werden [10]. Trotz zahlreicher Bemühungen gelang es bisher nicht, ein reines Rhodiumsulfat eindeutig zu isolieren und strukturell zu charakterisieren. Dies ist aufgrund der technischen Bedeutung von Rhodiumsulfat als Ausgangsverbindung für galvanische Beschichtungen von Oberflächen oder als Zwischenprodukt bei der Rhodiumproduktion durchaus erstaunlich. Beschrieben sind bisher ein gelbes, ein rotes und ein grünes Sulfat des Rhodiums, wobei das grüne Sulfat noch vollkommen unerforscht ist. Für das gelbe und das rote Rhodiumsulfat lautet die Summenformel mit großer Wahrscheinlichkeit Rh2(SO4)3·nH2O. Der Wasseranteil n variiert indes in Abhängigkeit von der Farbe des publizierten Sulfats. Je nach Quelle wird n = 12 für die gelbe und n = 6 für die rote Verbindung [10] oder n = 15 und n = 4 [9] angenommen. In einem Lehrbuch wird eine Zusammensetzung von n = 10, 14 oder 15 für das gelbe Sulfat und n = 4 oder 6 für das rote Sulfat diskutiert [8]. Die Syntheserouten der Rhodiumsulfate werden einheitlich als mehrstufiger Prozess beschrieben, der maßgeblich auf Krauss und Umbach [87] zurückgeführt werden kann. Diese gingen von metallischem Rhodium aus, vermischten es mit Bariumchlorid und schlossen dann unter Erhitzen mit feuchtem Chlor auf. Das resultierende Produkt lösten sie in Wasser und neutralisierten es mit Bariumhydroxid, welches so lange zugegeben wurde, bis Rhodiumhydroxid ausfiel. Das Lösen dieses Hydroxids in verdünnter Schwefelsäure führte zu dem gelben Rhodiumsulfat. Das rote Sulfat erhielten sie entweder durch Eindampfen einer wässrigen Lösung des gelben Sulfats oder indem sie das in verdünnter Schwefelsäure gelöste Rhodiumhydroxid mit Bariumhydroxid versetzten, erhitzten und anschließend eindampften. Das grüne Sulfat konnte durch Erhitzen des roten Sulfats auf 250 °C gewonnen werden [88]. Wie bereits erwähnt, wurde strukturell keines der Rhodiumsulfate charakterisiert, lediglich für das wasserfreie Rhodiumsulfat eine einfache ionische Struktur vorgeschlagen [89]. Daher wurden in unserem Arbeitskreis Versuche zur Klärung der Struktur unternommen [42], die auf den bereits erwähnten Syntheserouten fußten, aber leider zunächst erfolglos blieben. III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 Letztlich gelang es aber im Rahmen -120dieser Arbeit auf dem Wege einer Hochtemperatursyntheseroute die ersten Einkristalle an Rh2(SO4)3(H2O)2 zu erhalten und eingehend zu untersuchen. 4.1.1 Synthese Aus allen vorangegangenen Untersuchungen an Rhodiumsulfaten lässt sich der Schluss ziehen, dass die erhaltenen Produkte stets in geringen Ausbeuten zugänglich, von amorphem Charakter und folglich nicht geeignet für einkristalldiffraktometrische Untersuchungen sind. Umkristallisierungsversuche der über die bekannten Syntheserouten erhaltenen Produkte blieben ausgehend von Rh2O3∙5H2O und Rh(OH)3 erfolglos [42]. Literaturbekannt hingegen ist das Vermögen von konzentrierter Schwefelsäure Rhodium unter Druck zu lösen [90]. Folglich bot sich eine Direktsynthese des Rhodiumsulfats in einem geschlossen System an. Zur Darstellung der orangefarbenen, luft- und feuchtigkeitsunempfindlichen Einkristalle von Rh2(SO4)3(H2O)2 (Abb. 82) wurden 200 mg Rhodium mit 3 ml konz. Schwefelsäure in einer geschlossenen Duranglasampulle umgesetzt. Dabei wurde die Ampulle während einer 160-stündigen Aufheizzeit im Blockthermostat einer Temperatur von 465 °C unterworfen, diese 80 Stunden gehalten und dann innerhalb von 160 Stunden auf Raumtemperatur abgekühlt. Bereits ab 250 °C löste sich das Rhodium fast komplett rötlich-braun in der Schwefelsäure auf und setzte sich im weiteren Verlauf der Reaktion als Rh2(SO4)3(H2O)2 gut zwei Zentimeter oberhalb des Schwefelsäurespiegels ab. Die Umsetzung des Rhodiums erfolgt quantitativ und es blieb eine tief gelbe Schwefelsäurelösung zurück (Abb. 82). Wurde eine kürzere Reaktionszeit gewählt so konnte neben dem Rh-Sulfat ein roter, amorpher Feststoff aus der Lösung isoliert werden. Besonders die Wahl der hohen Reaktionstemperatur von 465 °C trug zum Gelingen der Reaktion bei. Bei früheren Umsetzungen von Rhodium mit Schwefelsäure unterhalb von 400 °C konnte zwar eine Reaktion des Rhodiums aber keine Einkristalle beobachtet werden. Durch das oben aufgezeigte Syntheseverfahren ist eine phasenreine Darstellung von Rh2(SO4)3(H2O)2 (Abb. 83) im dreistelligen Milligrammbereich möglich. Vor der Aufnahme des Pulverdiffraktogramms wurde das isolierte Produkt zum Befreien von anhaftender Schwefelsäure mehrfach mit THF gewaschen, filtriert und anschließend an der Luft getrocknet. III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -121- Abb. 82: Kristalle von Rh2(SO4)3(H2O)2 unter dem Lichtmikroskop (links) und eine Ampulle nach der Reaktion im Blockthermostaten (rechts) 100 80 Rh2(SO4)3(H2O)2- beobachtet relative Intensität [%] 60 40 20 0 -20 -40 -60 Rh2(SO4)3(H2O)2- simuliert -80 -100 10 20 30 40 2 50 60 [°] Abb. 83: Pulverdiffraktogramm von gereinigtem Rh2(SO4)3(H2O)2 im Vergleich mit simulierten Daten aus der Einkristalluntersuchung 70 III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -122- 4.1.2 Kristallstruktur von Rh2(SO4)3(H2O)2 Die Verbindung Rh2(SO4)3(H2O)2 kristallisiert orthorhombisch in der Raumgruppe Pnma. Es finden sich vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es zwei Rhodiumatome Rh1 und Rh2, die sich beide auf den speziellen Wyckoff-Lagen 4c bzw. 4a befinden und dabei entsprechend einer d6-Konfiguration in einer verzerrt oktaedrischen Umgebung vorliegen. Die internuklearen Rh-O-Abstände liegen im Bereich von 198,8 pm - 203,4 pm. Die Winkel zwischen den O-Atomen betragen ca. 180° bzw. ca. 90°, wobei eventuelle Abweichungen bei ≤ 4,7° liegen. (Tab. 44). In der Kristallstruktur werden die Rhodiumatome über kristallographisch nicht äquivalente Sulfat-Einheiten (S1, S2) verbrückt (Abb. 84). Erwähnenswert ist dabei das Schwefelatom S1, das speziell auf einer Spiegelebene liegt. Der Schwefel-Sauerstoff-Abstand beträgt im Mittel 148,0 pm und befindet sich damit im erwarteten Bereich. Die O-S-O-Winkel innerhalb der SO42--Tetraeder liegen im Bereich von 101,7° - 112,5° (Tab. 44) und weichen teilweise, aufgrund einer leichten Verzerrung, vom idealen Tetraederwinkel mit 109,47° ab. S1 Rh2 O8 Rh1 O7 S2 Rh O S H Abb. 84: Koordinierte Rhodiumatome in der Kristallstruktur von Rh2(SO4)3(H2O)2 Das Atom Rh2 wird insgesamt von sechs Sulfateinheiten koordiniert, wohingegen Rh1 als Besonderheit, neben vierfacher Koordination durch Sulfatgruppen, zwei koordinierte Moleküle Wasser aufweist (Abb. 84). Diese stehen cis zueinander und die entsprechenden Sauerstoffatome (O7, O8) liegen speziell auf der Lage 4c. Die zugehörigen Rh-OBindungslängen betragen 198,8 pm und 201,3 (Literatur: 201,6 pm [85])und sind im Durchschnitt die kürzesten zu beobachtenden Abstände dieser Art in der Verbindung Rh2(SO4)3(H2O)2. III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -123- Das der Sulfat-Einheit (S2) zugehörige Sauerstoffatom O4 koordiniert als einziges an kein in der Zelle befindliches Rhodiumatom. Dadurch ist es in der Lage, mäßig starke Wasserstoffbrückenbindungen der Länge 267 pm und 285 pm zu den Koordinationswassermolekülen auszubilden (Abb. 85). Es ergibt sich ein DHA-Winkel (Donor-Wasserstoffatom-Akzeptor) von 165° für O4-H81-O8 und 156° für O7-H71-O4. Die DHA-Winkel können neben den Bindungslängen ebenfalls als Maß für die Stärke der Bindung angesehen werden und sollten idealerweise linear mit 180° vorliegen. Gemäß der Klassifizierung nach Jeffrey ist von einer mäßig starken Donor-Akzeptor-Beziehung oberhalb von 130° und 250 pm auszugehen [91]. Donor-Akzeptor-Beziehungen existieren außerdem zwischen den cis-ständigen Wassermolekülen (276 pm). Möglich wären ferner schwache Brückenbindungen zwischen dem Koordinationswasser und den verbrückenden Sauerstoffatomen der Sulfattetraeder, die mit 331 pm jedoch deutlich schwächer ausfallen. c b Rh O S H Abb. 85: Kristallstruktur von Rh2(SO4)3(H2O)2 in Richtung [100] mit ausgebildeten Wasserstoffbrückenbindungen (rot eingezeichnet) III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -124- a b Rh O S H Abb. 86: Kristallstruktur von Rh2(SO4)3(H2O)2 in Richtung [001] Tab. 43: Kristallographische Daten von Rh2(SO4)3(H2O)2 Rh2(SO4)3(H2O)2 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD 530,03 orthorhombisch Pnma (Nr. 62) a = 920,46(2) pm b = 1244,47(3) pm c = 833,37(2) pm 954,61(4) ų 4 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 22354 2178 2039 0,0260; 0,0141 SHELXS97 und SHELXL97[28] 1,100 1,100 0,0199; 0,0518 0,0219; 0,0528 0,968/ -1,544 e/ų 421778 III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -125- Tab. 44: Ausgewählte internukleare Abstände [pm] und Winkel [°] in Rh2(SO4)3(H2O)2 Rh1Rh1- Rh2 O5 O6 O7 O8 O9 Rh2O1 O2 O3 S1O1 O6 O9 S2O2 O3 O4 O5 O5-Rh1-O5 O5-Rh1-O9 O6-Rh1-O5 456,6(1) 202,9(1) (2x) 199,6(2) 201,3(2) 198,8(2) 203,4(2) 201,5(1) (2x) 201,4(1) (2x) 201,3(1) (2x) 148,7(1) (2x) 147,3(2) 146,5(2) 149,5(1) 148,8(1) 144,5(1) 150,0(1) 174,01(7) 91,87(4) 92,53(4) O6-Rh1-O7 O6-Rh1-O9 O7-Rh1-O5 O7-Rh1-O9 O8-Rh1-O5 O8-Rh1-O6 O8-Rh1-O9 O2-Rh2-O1 O3-Rh2-O1 O3-Rh2-O2 O1-S1-O1 O6-S1-O1 O9-S1-O6 O2-S2-O5 O3-S2-O2 O4-S2-O2 S1-O9-Rh1 S1-O1-Rh2 S2-O2-Rh2 94,65(8) 83,43(8) 88,20(4) 178,08(8) 87,52(4) 178,13(8) 94,70(8) 88,53(6) 93,07(5) 90,03(5) 101,7(1) 112,45(7) 107,3(1) 110,59(8) 102,24(8) 111,88(8) 136,4(1) 127,51(8) 125,62(8) 4.1.2.1 IR-Schwingungsspektrum von Rh2(SO4)3(H2O)2 Im Allgemeinen absorbiert in Verbindungen enthaltenes Wasser im Bereich von 3550 cm-13200 cm-1 (antisymmetrische und symmetrische OH-Streckschwingung) und im Bereich von 1630 cm-1- 1600 cm-1 (HOH-Beugeschwingung) [92]. Dabei ist ein fließender Übergang zwischen charakteristischen Absorptionsbanden von Kristallwasser- und Koordinationswasser-Molekülen festzustellen. Ferner kann für Hydroxo-Komplexe ähnliches Verhalten wie für wasserhaltige Verbindungen oder Hydroxide erwartet werden. Allerdings können von der Hydroxo-Gruppe und dem Hydroxid-Ion durch das Fehlen der Beugeschwingungen nahe 1600 cm-1 von Kristallwassermolekülen unterschieden werden [93]. Das bereits unter Punkt 4.1.2. besprochene Vorhandensein von Koordinationswasser wird nun durch die schwingungsspektroskopischen Untersuchungen an Rh2(SO4)3(H2O)2 weiter gestützt. Es sind deutlich die OH-Streckschwingungen bei 3146 cm-1 und die HOH-Beugeschwingung bei 1614 cm-1 zu erkennen (Abb. 87) und damit die Anwesenheit einer Hydroxo-Gruppe oder eines Oxo-Liganden ausgeschlossen. Komplizierter gestaltet sich die Auswertung für die IR-aktiven Banden im FingerprintBereich der zwei in Rh2(SO4)3(H2O)2 zu unterscheidenden Sulfatgruppen (Abschnitt 4.1.2.). Das Sulfat-Ion hat im unverzerrten Zustand Td-Symmetrie. Für diesen Idealfall werden vier III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -126- Normalschwingungen erwartet, wovon nur ν3 und ν4 infrarot-aktiv und beide dreifach entartet sind. Wird die Symmetrie des Sulfat-Ions durch seine strukturelle Umgebung beeinflusst, d. h. vom Idealzustand ausgehend erniedrigt, kann die Entartung teilweise oder ganz aufgehoben werden. Somit können ν1- und ν2-IR-Aktivität auftreten. Im Fall des Rhodiumsulfats ergibt sich für die Sulfatgruppen eine C1- und eine Cs- Symmetrie (S1 bzw. S2). Für nicht lineare Moleküle gilt Gleichung 15 (Abschnitt II. Allgemeiner Teil) und somit n = 9 bzw. 18 theoretische Schwingungsfreiheitsgrade, da zwei nicht äquivalente Sulfatgruppen vorliegen. Aufgrund der beschriebenen Lagesymmetrien ergeben sich aus der theoretischen Annahme 18 aktive IR-Banden [94, 95]. Da diese im schmalen Bereich von 1200 cm-1-550 cm-1 auftreten ist eine deutliche Überlagerung von 1075 cm-1 - 755 cm-1 zu erkennen, die eine Auswertung erschwert. Daher und aufgrund der hohen IR-Aktivität wurde auf Literaturdaten der Minerale Görgeyit K2Ca5(SO4)6·H2O [96] und Coelestin SrSO4 [97] vergleichend zurückgegriffen. Görgeyit weist nur Sulfatgruppen auf der C1-Lage und Coelestin nur auf der Cs-Lage auf. Nachfolgende Tabelle 45 zeigt eine Zuordnung der Valenzbanden der Sulfat-Ionen. Eine Valenzschwingung (Rh-O) wird im Bereich von ca. 334 cm-1 erwartet [98] und konnte messtechnisch nicht erfasst werden. Tab. 45: IR-Banden für H2O-Moleküle und SO4-Gruppen in Rh2(SO4)3(H2O)2 Zuordnung as,s(O-H) δ(H-O-H) 3(SO4) 3(SO4) 3(SO4) 1(SO4) Überlagerter Bereich 4 4(SO4) 4(SO4) 2(SO4) Energie/cm 3146 1614 1211 1157 1108 1007 957 704 602 575 554 1 Lage S C1 Cs Cs Cs C1 C1 , Cs C1 C1 , Cs III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -127- 100 1614 1211 3146 1157 . 60 1108 Transmission [%] 80 575 554 957 3200 2800 2400 2000 1600 1200 602 704 1007 . 40 800 -1 Wellenzahl [cm ] Abb. 87: IR-Spektrum von Rh2(SO4)3(H2O)2 4.1.2.2 Thermischer Abbau von Rh2(SO4)3(H2O)2 Für die thermische Analyse wurden ca. 10 mg Rh2(SO4)3(H2O)2 in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur gegeben. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von zwei Zersetzungsschritten (Tab. 46, Abb. 88) beginnt bei 475 °C und endet bei 737 °C mit einem Massenverlust von 53,2%. Dies deutet auf den Verlust der Koordinationswassermoleküle und sämtlicher Sulfatgruppen hin. Als stabiles Intermediat konnte Rh2O3 bei 750 °C isoliert und pulverdiffraktometrisch nachgewiesen werden (Abb. 89). Während der zweiten und letzten Abbaustufe findet die Zersetzung zu elementarem Rhodium, im Temperaturfenster von 770 °C - 938 °C und einem Massenverlust von 8,7%, statt. Der beobachtete Gesamtmassenverlust betrug 61,9% und stimmt gut mit dem errechneten Verlust von 61,2% überein. Erstaunlich ist der späte Verlust der koordinierten Wassermoleküle bei 475 °C, was auf die relativ starken Wasserstoffbrückenbindungen (Abschnitt 4.1.2) zurück zu führen ist. Da bei dieser Temperatur auch die Sulfat-Einheiten abgebaut werden, ist es nicht möglich Rh2(SO4)3(H2O)2 zu entwässern. III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -128- Tab. 46: Ergebnisse der DTA/TG-Untersuchungen an Rh2(SO4)3(H2O)2, M = 530,03 g/mol TBeginn [°C] 475 TEnde [°C] 737 Tmax [°C] 578 770 938 868 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 53,2 52,1 8,7 Produkt Rh2O3 9,1 2 Rh ^endo 100 DTA TG 90 DTA-Signal [ T] Masse [%] 80 70 60 50 40 200 400 600 800 1000 T [°C] Abb. 88: DTA/TG-Kurve des thermischen Abbaus von Rh2(SO4)3(H2O)2 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Rh2O3-simuliert -80 -100 20 30 40 50 60 2 70 80 [°] Abb. 89: Pulverdiffraktogramm des DTA-Rückstandes der Zwischenstufe bei 750 °C 90 III. 4. Rhodiumsulfat Rh2(SO4)3(H2O)2 -129- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Rh-simuliert -80 -100 30 40 50 60 2 70 80 [°] Abb. 90: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von Rh2(SO4)3(H2O)2 90 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -130- 5. Disulfate und saure Sulfate der Selten-Erd-Elemente 5.1 Allgemeines Durch metall-fraktionierende Kristallisation konnten von Prandtl bereits um 1930 Alkalidoppelsulfate der Selten-Erd-Elemente isoliert werden [99]. Bis zur Ablösung durch chromatographische Methoden in den 1940er Jahren wurden die Selten-Erd-Elemente durch Kristallisation getrennt. Besonders während dieser Zeit wurden sulfathaltige Komplexe der Lanthanoide eingehend erforscht und eine Vielzahl an Verbindungen publiziert [100, 101], auch wenn vergleichsweise wenig über ihre strukturellen Eigenschaften bekannt war. Mittlerweile sind Strukturen von wasserhaltigen Sulfaten der Selten-Erd-Elemente ebenso zahlreich wie gut mit röntgenographischen Methoden untersucht worden. Allerdings sind auf dem Gebiet der wasserfreien binären Sulfate, nur wenige Verbindungen, wie z.B. Nd2(SO4)3 oder Er2(SO4)3 literaturbekannt [102, 103]. Noch limitierter ist die Kenntnis von Disulfaten der Lanthanoide. Tatsächlich wurde bis jetzt nur über Nd(S2O7)(HSO4) berichtet [11]. Durch die Reaktion von SE2O3 (SE = La, Ce, Pr, Nd) in Oleum (~65% SO3) konnten nun erstmals reine Selten-Erd-Disulfate der Summenformel SE2(S2O7)3 erhalten werden [104, 105]. Dies ist insbesondere bemerkenswert, da mit Sb2(S2O7)3 nur ein weiterer Vertreter dieser Art mit einem dreiwertigen Metall bekannt ist [12]. Unter den gleichen Reaktionsbedingungen erfolgte für die Selten-Erd-Elemente Sm - Lu und Y die Darstellung der bisher unbekannten Sulfat-Hydrogensulfate der Zusammensetzung SE(S2O7)(HSO4). Diese sind isotyp zum erwähnten Nd(S2O7)(HSO4). Damit ist einzig für das Element Neodym sowohl ein reines Disulfat, als auch ein Disulfat-Hydrogensulfat bekannt. Neben den letztgenannten Verbindungen gibt es noch weitere saure Sulfate der Selten-ErdElemente. Diese umfassen Verbindungen mit Oxonium-Ionen, wie (H3O)La(SO4)2·3H2O [13] und die zahlreichen Hydrogensulfate der allgemeinen Formel SE(HSO4), die in der Vergangenheit bereits für alle stabilen Lanthanide und Yttrium charakterisiert wurden [14]. Temperaturabhängig können neben SE(HSO4) Verbindungen des Typs SE(SO4)(HSO4) entstehen [14]. Neben dem 1998 erstmals beschriebenen Er(SO4)(HSO4) [15], gelang es mit Dy(SO4)(HSO4) einen weiteren, nicht isotypen Vertreter zu charakterisieren. Unter Variierung der Reaktionsbedingungen gelang mit Nd3(SO4)4(HSO4)(H2O)2 sogar die Darstellung eines beispiellosen wasserhaltigen Sulfat-Hydrogensulfats, indem die Wassermoleküle an das Selten-Erd-Element koordinieren. III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -131- 5.2 Reaktionsübersicht Ausgehend von Nitraten und Oxiden der Selten-Erd-Elemente konnten bei der Umsetzung mit Schwefelsäure eine Vielzahl an Verbindungen von sauren Sulfaten dargestellt werden, wie Abb. 91 verdeutlicht. Ausschlaggebend sind dabei die eingesetzten Konzentrationen an Schwefeltrioxid im Reaktionsmedium, die Reaktionsführung, sowie die Wahl des Selten-ErdElements. Die eingesetzten Nitrate zeigten naturgemäß eine höhere Reaktivität und eigneten sich besonders zu Erzeugung großer Einkristalle der entsprechenden Verbindung. Eine Abhängigkeit der Kristallgröße von der Temperatur ist ebenfalls beobachtet worden. Hochtemperaturansätze lieferten durchweg bessere Resultate. Die erhaltenen Ergebnisse gingen alle aus Reaktionen in Glasampullen im Blockthermostaten hervor: SE(HSO4)3 + H2SO4 ab 150 °C SE-Nitrat / SE-Oxid + halb. konz. H2SO4, 300 °C, geschlossenes System SE3(SO4)4(HSO4)(H2O)2 + Oleum SE2(S2O7)3 bzw. 300 - 400 °C SE(S2O7)(HSO4) + halb. konz. H2SO4, 300 °C, offenes System SE(SO4)(HSO4) Abb. 91: Reaktionsschema der Selten-Erd Oxide und Nitrate mit Schwefelsäure unterschiedlicher Konzentration Am zugänglichsten sind Selten-Erd-Hydrogensulfate der Summenformel SE(HSO4)3. Sie fallen bei Reaktionstemperaturen von 150 °C - 350 °C in offenen oder geschlossenen Normalglasampullen in Form langer, relativ luftstabiler Nadeln an (Abb. 92). Abb. 92: Kristalle von La(HSO4)3 unter dem Lichtmikroskop III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -132- In Abhängigkeit vom Selten-Erd-Element und der Reaktionstemperatur bilden sich bei der Umsetzung mit rauchender Schwefelsäure Verbindungen des Typs SE2(S2O7)3 bzw. SE(S2O7)(HSO4) (SE = La - Nd bzw. Sm - Lu und Y) im geschlossenen System. Bei Reaktionen mit halbkonzentrierter Schwefelsäure bei 300 °C wurden Kristalle von Nd3(SO4)4(HSO4)(H2O)2 und Dy(SO4)(HSO4) isoliert. Hierbei ist es, anders als z. B. bei den reinen Hydrogensulfaten, entscheidend, dass unter Luft- und Feuchtigkeitsausschluss gearbeitet wird. 5.3 Die Disulfate SE2(S2O7)3 (SE = La - Nd) 5.3.1 Synthese Erstmals konnte ein reines Disulfat eines Selten-Erd-Elements bei Umsetzungen von [Eu(NO3)(H2O)7][OsCl6]∙4H2O mit Oleum (Abschnitt 1.4) beobachtet werden. Es gelang daraufhin die Verbindungen SE2(S2O7)3 (SE = La - Nd) erst aus den entsprechenden Nitraten und später aus den Oxiden darzustellen. Hierzu wurden 50 mg des Oxids z.B. La2O3 oder des Nitrats z.B. La(NO3)3·6H2O mit 1 ml Oleum in einer Duranglasampulle unter Vakuum eingeschmolzen. Anschließend wurde diese während einer 20-stündigen Aufheizzeit im Blockthermostat auf eine Temperatur von 300 °C gebracht, diese für 20 Stunden gehalten und dann innerhalb von 200 Stunden auf Raumtemperatur abgekühlt. Es konnten der Farbe des Selten-Erd-Ions entsprechende Kristalle in polyedrischer Form isoliert werden (Abb. 93). Abb. 93: Kristalle von Pr2(S2O7)3 (links) und Nd2(S2O7)3 (rechts) unter dem Lichtmikroskop III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -133- 5.3.2 Kristallstrukturen von SE2(S2O7)3 (SE = La - Nd) Aufgrund einer nicht auflösbaren Fehlordnung einiger Atome in den Strukturen der Lanthan-, Praseodym- und Neodym-Verbindung wurde durch Vergrößerung der Elementarzellen eine Lösung der Strukturen ermöglicht. Bei der Cer-Verbindung zeigte sich diese Notwendigkeit nicht und es konnte bei den ursprünglichen Gitterkonstanten belassen werden. Exemplarisch für alle vier Strukturen sollen anhand von La2(S2O7)3 typische Bindungslängen und Winkel diskutiert werden (Tab. 49). Die Verbindungen SE2(S2O7)3 (SE = La - Nd) kristallisieren monoklin in der Raumgruppe P21/c. Es finden sich vier bzw. zwölf Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es sechs bzw. zwei Selten-Erd-Atome, die sich wie alle anderen Atome auf der allgemeinen Wyckoff-Lage 4e befinden. Diese SE3+-Ionen sind von neun kristallographisch unterscheidbaren Sauerstoffatomen in Form eines dreifach überkappten trigonalen Prismas koordiniert. Solch ein Koordinationspolyeder wurde bereits mehrfach in dieser Arbeit beobachtet und gehört allgemein zu den häufigsten für [SEO9]-Polyeder. Jedes der angesprochenen Sauerstoffatome ist Teil einer S2O72--Gruppe. Sechs O-Atome gehören zu drei chelatisierenden Disulfat-Gruppen (rote doppelte Tetraeder) und die übrigen drei zu einzähnig angreifenden Disulfat-Einheiten (blaue Tetraeder) (Abb. 94). La O O S Abb. 94: Koordinationsumgebung des La3+-Ions (rot eingezeichnet Tetraeder chelatisierender Disulfatgruppen und blau markiert einzähnig angreifende Disulfat-Einheiten) III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -134- Winkel und Bindungslängen innerhalb der S2O72--Ione korrespondieren mit literaturbekannten Verbindungen wie Nd(S2O7)(HSO4), Sb2(S2O7)3 oder K2S2O7 [11, 12, 106]. Die S-O-Bindungslängen zu den verbrückenden Sauerstoffatomen der Disulfat-Einheiten liegen bei Ø 162,9 pm und sind somit 19,3 pm länger als die S-O-Abstände der nicht verbrückenden Sauerstoffatome (S-O-Bindung Ø 143,6 pm) (Tab. 49). Die Winkel zwischen den Schwefelatomen und den verbindenden Sauerstoffatomen betragen Ø 123,4° und stimmt mit den Literaturangaben von 122,5° für Nd(S2O7)(HSO4) und 124,3° für K2S2O7 überein. Allerdings kann in diesen Verbindungen kristallographisch nicht zwischen ein- bzw. zweizähnig angreifenden Gruppen unterschieden werden. Unter Berücksichtigung der Bindungssituation der Disulfat-Gruppen ergeben sich in La2(S2O7)3 durchschnittliche Winkel von 125,4° bzw. 121,4° für einfach bzw. zweifach koordinierende S2O72--Ione. Im ersten Fall binden die Disulfat-Gruppen an zwei unterschiedliche Lanthanatome und werden dadurch leicht in ihren S-O-S-Bindungen deformiert, d. h. aufgeweitet. Bei zweizähnig angreifenden Gruppen tritt ein genau gegenteiliger Effekt auf. Dieser Sachverhalt lässt sich noch ausgeprägter mit durchschnittlich 126,5° und 119,1° für einzähnige bzw. zweizähnige Koordination in Sb2(S2O7)3 beobachten. Ferner weichen die O-S-O-Winkel in den einzelnen Sulfat-Einheiten stark voneinander ab, da durch die Bildung der Disulfat-Einheiten starke Verzerrungen auftreten. Es werden Werte im Bereich von 99,9° - 115,2° gemessen, die maximal 9,5° vom idealen Tetraederwinkel (109,47°) differieren. a c La O S Abb. 95: Kristallstruktur von La2(S2O7)3 in Richtung [010] III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente Tab. 47: Kristallographische Daten von SE2(S2O7)3 (SE = La, Ce) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD La2(S2O7)3 Ce2(S2O7)3 806,18 808,60 monoklin monoklin P21/c (Nr. 14) P21/n (Nr. 14) a = 2260,29(8) pm a = 1280,72(7) pm b = 1127,33(4) pm b = 1123,36(5) pm c = 2229,00(8) pm c = 1309,4(1) pm = 118,256(1)° = 118,240(8)° 5002,9(3) ų 1659,6(2) ų 12 4 Bruker APEX II Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 143229 21517 31006 3919 22867 3114 0,0348; 0,0248 0,0555; 0,0479 SHELXS97 und SHELXL97[28] 1,026 0,856 1,026 0,849 0,0248; 0,0568 0,0196; 0,0362 0,0382; 0,0604 0,0299; 0,0372 1,568/-1,043 e/ų 1,219/-1,422 e/ų 421782 421783 Tab. 48: Kristallographische Daten von SE2(S2O7)3 (SE = Pr, Nd) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Pr2(S2O7)3 Nd2(S2O7)3 810,18 816,84 monoklin monoklin P21/c (Nr. 14) P21/c (Nr. 14) a = 2242,27(6) pm a = 2237,47(6) pm b = 1113,83(3) pm b = 1109,98(3) pm c = 2210,16(6) pm c = 2202,76(6) pm = 118,305(1)° = 118,308(1)° 4859,9(2) ų 4816,4(2) ų 12 12 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 171104 169697 30016 30331 23118 24327 0,0409; 0,0236 0,0832; 0,0668 SHELXS97 und SHELXL97[28] 1,081 1,094 1,081 1,094 0,0262; 0,0545 0,0255; 0,0534 0,0367; 0,0570 0,0352; 0,0504 1,383/-1,315 e/ų 1,373/-2,234 e/ų 421784 421780 -135- III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -136- Tab. 49: Ausgewählte internukleare Abstände [pm] und Winkel [°] in La2(S2O7)3 La1- O6 O13 O18 O21 O22 O27 O44 O45 O54 La3- O9 O19 O35 O40 O48 O49 O50 O56 O57 S10-O47 S12-O53 S14-O60 S3-O9 S4-O14 S7-O21 S10-O49 S11-O52 255,7(1) 256,7(1) 252,9(1) 250,1(1) 256,2(1) 260,8(1) 250,3(1) 256,4(1) 258,3(1) Ø255,3(1) 252,0(1) 253,3(1) 262,1(1) 241,8(1) 246,6(1) 266,0(1) 250,0(1) 245,3(1) 253,3(1) Ø252,3(1) 161,2(1) 163,3(1) 164,6(1) 142,9(1) 143,2(1) 144,5(1) 143,9(1) 143,2(1) O21-La1-O54 O45-La1-O13 O45-La1-O27 O40-La3-O48 O48-La3-O50 O56-La3-O9 S2-O4-S1 S3-O11-S4 S5-O25-S6 S7-O17-S8 S9-O47-S10 S12-O53-S11 S14-O60-S13 S16-O38-S15 S17-O32-S18 O5-S1-O7 O10-S3-O8 O10-S3-O11 O8-S3-O11 O14-S4-O11 O26-S6-O25 O28-S6-O25 O20-S7-O17 O15-S8-O17 O36-S10-O49 O55-S12-O56 O31-S17-O30 70,02(4) 64,88(4) 74,79(4) 70,54(5) 66,09(4) 79,19(5) 119,32(8) 128,75(9) 121,88(7) 122,95(7) 119,75(8) 128,22(8) 119,39(8) 127,81(9) 121,65(7) Ø123,3(8) 115,24(9) 112,75(9) 100,25(8) 107,72(7) 99,98(8) 105,41(7) 101,28(7) 106,04(7) 102,03(7) 114,76(8) 113,14(8) 113,75(8) 5.3.2.1 Thermischer Abbau von SE2(S2O7)3 (SE = La, Pr) Für die thermische Analyse wurden ca. 15 mg La2(S2O7)3 bzw. ca. 41 mg Pr2(S2O7)3 in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Die Lanthanverbindung konnte vor der thermischen Zersetzung, durch Waschen mit trockenem THF, von anhaftendem Oleum befreit werden. Bei der Praseodymverbindung blieb dieser Reinigungsschritt aus. Es sollte festgestellt werden inwiefern eine Abgabe von anhaftender Mutterlauge thermisch erfolgen kann. Daher wurde ergänzend zur oben genannten Heizrate 60 Minuten bei 250 °C gehalten. III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -137- Der erste von zwei Zersetzungsschritten von La2(S2O7)3 (Tab. 50, Abb. 96) beginnt bei 422 °C, endet bei 521 °C und zeigt einen Massenverlust von 30,3%. Dies deutet auf den Verlust von drei Molekülen Schwefeltrioxid hin. Als stabiles Intermediat kann von La2(SO4)3 ausgegangen werden. Während der zweiten und letzten Abbaustufe findet die Zersetzung zu La2O2SO4, im Temperaturfenster von 521 °C - 1036 °C und einem Massenverlust von 19,8%, statt. La2O2SO4 [107] konnte pulverdiffraktometrisch und im IR (Abschnitt 5.3.2.2) nachgewiesen werden (Abb. 97). Der beobachtete Gesamtmassenverlust betrug 50,1% und stimmt sehr gut mit dem errechneten Verlust von 49,7% überein. Tab. 50: Ergebnisse der DTA/TG-Untersuchungen an La2(S2O7)3, M = 806,18 g/mol TBeginn [°C] 422 TEnde [°C] 521 Tmax [°C] 500 842 1036 984 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 30,3 29,8 19,8 19,9 Produkt La2(SO4)3 La2O2SO4 Die thermische Zersetzung von Pr2(S2O7)3 weist analoge Stufen zu der DTA/TG-Kurve von La2(S2O7)3 auf (Abb. 96). Allerdings beginnt der Abbau des Oleums bereits bei 58 °C und endet bei 245 °C. Nach zwei sich anschließenden Zersetzungsschritten wurde als Endprodukt ebenfalls das Oxidsulfat des Praseodyms erhalten. Bemerkenswert ist allerdings, dass der erste Abbauschritt bereits bei ca. 300 °C auftritt und damit ca. 120 °C früher als bei La2(S2O7)3. Der zweite Schritt verläuft wiederum analog zur isotypen Lanthanverbindung. Es ist folglich generell möglich die Disulfate durch kontrolliertes Erhitzen von anhaftendem Oleum zu befreien. Tab. 51: Ergebnisse der DTA/TG-Untersuchungen an Pr2(S2O7)3, M = 810,18 g/mol TBeginn [°C] 58 TEnde [°C] 245 Tmax [°C] 210 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 26,7 --- 300 518 404 30,6 29,4 Pr2(SO4)3 820 985 960 19,8 19,6 Pr2O2SO4 Produkt Pr2(S2O7)3 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -138- ^endo 100 TG La2(S2O7)3 DTA La2(S2O7)3 TG Pr2(S2O7)3 90 DTA-Signal [ T] Masse [%] 80 70 60 50 200 400 600 800 1000 T [°C] Abb. 96: DTA/TG-Kurve des thermischen Abbaus von La2(S2O7)3 und TG-Kurve von Pr2(S2O7)3 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 La2O2SO4-simuliert -80 -100 10 20 30 40 50 2 60 [°] Abb. 97: Pulverdiffraktogramm des DTA-Rückstandes von La2(S2O7)3 70 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -139- 5.3.2.2 Schwingungsspektrum von La2O2SO4 Unter 4.1.3 wurde bereits ausführlich auf die IR-Aktivität von Sulfat-Gruppen eingegangen und an dieser Stelle sei auf diesen Abschnitt verwiesen. In La2O2SO4 liegt eine zu unterscheidende Sulfat-Gruppe mit C2v-Symmetrie vor. Es ergibt sich für ν1, ν2, ν3 und ν4 IR-Aktivität, wobei die ν2-Schwingung im nicht erfassten Bereich bei 462 cm-1 zu erwarten wäre. Abb. 98 zeigt fünf messbare Banden, die zweifelsfrei und in guter Übereinstimmung mit den Literaturangaben zugeordnet werden können [93]. Tab. 52: IR -Banden der SO4-Gruppe in La2O2SO4 Zuordnung 3(SO4) 3(SO4) 3(SO4) 1(SO4) 4(SO4) Energie/cm 1174 1106 1059 955 655 1 100 955 655 C2v-Symmetrie: 60 . O R O O R S 1174 O 1106 Transmission [%] 80 40 . 1059 20 1800 1600 1400 1200 1000 800 -1 Wellenzahl [cm ] Abb. 98: IR-Spektrum des DTA-Rückstandes von La2(S2O7)3 600 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -140- 5.4 Die Disulfat-Hydrogensulfate SE(S2O7)(HSO4) (SE = Sm - Lu, Y) 5.4.1 Synthese Die Synthese erfolgte analog Abschnitt 5.3.1 durch die Umsetzung der entsprechenden Selten-Erd-Oxide mit Oleum in geschlossenen Duranglasampullen, allerdings bei einer Temperatur von 350 °C. Die späten Lanthanoide ab dem Element Holmium erforderten eine Reaktionsführung bei 350°C - 400 °C. Es wurden der Farbe der Selten-Erd-Ionen entsprechende Kristalle in polyedrischer Form gefunden (Abb. 99). Abb. 99: Kristalle von Lu(S2O7)(HSO4) (links) und Ho(S2O7)(HSO4) (rechts) unter dem Lichtmikroskop bei verschiedenen Vergrößerungsstufen 5.4.2 Kristallstrukturen von SE(S2O7)(HSO4) (SE = Sm - Lu, Y) Die Verbindungen SE(S2O7)(HSO4) (SE = Sm - Lu, Y) kristallisieren monoklin in der Raumgruppe P21/n. Es finden sich vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein zu unterscheidendes Selten-Erd-Atom, das sich wie alle anderen Atome auf der allgemeinen Wyckoff-Lage 4e befindet. Dieses SE3+-Ion ist von acht kristallographisch unterscheidbaren Sauerstoffatomen koordiniert. Entsprechend der Lanthanoidenkontraktion zeigt sich mit zunehmender Masse der SeltenErd-Elemente eine Verringerung des Volumens der Elementarzelle in SE(S2O7)(HSO4) (SE = Sm - Lu, Y) (Abb. 102). Ursächlich dafür ist die Verkleinerung des Ionen-Radius von Samarium bis hin zu Lutetium, da ansonsten keine Änderung in der Zusammensetzung der Verbindungen auftritt. Das Metall Yttrium fällt aufgrund seiner geringeren Masse aus der Reihe. Vom Volumen her ist es nach dem Dysprosium einzuordnen. Ebenfalls lässt sich in Abb. 103 eine Abnahme der durchschnittlichen SE-O-Bindungslänge beobachten. Beträgt III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -141- diese für Samarium noch 239,8 pm, so wurde für Lutetium nur noch ein Wert von 230,4 pm gemessen. Selten-Erd-Ionen und Sauerstoffatome bilden dabei ein leicht verzerrtes quadratisches Antiprisma (III. Punkt 1.5.4). Jedes der angesprochenen Sauerstoffatome ist Teil einer S2O72-oder einer HSO4--Gruppe. Zwei Sauerstoffatome gehören zu einer chelatisierend angreifenden Disulfat-Gruppe (rote doppelte Tetraeder), drei Sauerstoffatome zu einfach koordinierten Disulfat-Einheiten (blaue Tetraeder) und die restlichen drei Sauerstoffatome zu Hydrogensulfat-Gruppen (grüne Tetraeder) (Abb. 100). Ho O S H . Abb. 100: Koordinationsumgebung des Ho3+-Ions (rot hervorgehoben: Tetraeder der chelatisierenden Disulfatgruppe, blau markiert einzähnig angreifende Tetraeder von Disulfatgruppen und grün hervorgehoben Tetraeder der Hydrogensulfat-Gruppen) Zwei der einzähnig angreifenden Disulfat-Gruppen binden über beide freien Sauerstoffatome jeweils an ein Selten-Erd-Atom. Die dritte Gruppe weist neben einem bindenden ein nicht weiter koordinierendes O-Atom auf. Eine ähnliche Bindungssituation der Sauerstoffatome lässt sich für die chelatisierend angreifende Disulfat-Gruppe feststellen, drei O-Atome koordinieren weiter zu den Metallatomen, eines hingegen nicht (Abb. 101). Exemplarisch für alle elf Strukturen der Selten-Erd-Disulfat-Hydrogensulfate sollen anhand von Ho(S2O7)(HSO4) typische Bindungslängen und Winkel diskutiert werden (Tab. 57). III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -142- Die S-O-Bindungslängen zum verbrückenden Sauerstoffatom der zweizähnig angreifenden Disulfat-Einheit liegen bei Ø 162,9 pm und sind 18,7 pm länger als der S-O-Abstand, der nicht verbückenden Sauerstoffatome (S-O-Bindung Ø 144,3 pm) (Tab. 57). Der Winkel zwischen den Schwefelatomen und den verbindenden Sauerstoffatomen beträgt 122,1° und stimmt im Rahmen der Standardabweichung genau mit den Literaturdaten (121,9°) überein [11, 108]. Bei den einzähnig angreifenden Disulfat-Gruppen lassen sich identische Werte feststellen und anders als für La2(S2O7)3 (Abschnitt 5.3.2) diskutiert, findet keine Aufweitung der S-O-S-Bindung statt. In den Hydrogensulfat-Einheiten beträgt die Schwefel-Sauerstoff-Bindungslänge im Durchschnitt 145,6 pm bzw. 153,1 pm in H-O-S. Die O-S-O-Winkel in den Sulfat-Einheiten liegen im Bereich von 101,6° - 114,7° und weichen stark voneinander ab, da durch die Bildung der Disulfat-Einheiten eine starke Verzerrung der Sulfat-Tetraeder auftritt. Es kann eine mäßig starke Wasserstoffbrückenbindung mit einer Länge von 260 pm zwischen dem Sauerstoffatom O8 der Hydrogensulfat-Einheit und dem bereits angesprochenen nicht weiter koordinierenden O-Atom der einzähnig angreifenden Disulfat-Gruppe beobachtet werden. Der DHA-Winkel (Donor-Wasserstoffatom-Akzeptor) O8-H1-O11 beträgt entsprechend einer mäßig starken Donor-Akzeptor Beziehung 158° [91]. c b Ho O S H Abb. 101: Kristallstruktur von Ho(S2O7)(HSO4) in Richtung [100] III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -143- 88 Y Masse / u 89 90 150 160 Sm Gd Eu Dy Er Tb 170 Yb Ho Tm Lu 180 840 830 820 810 Zellvolumen / A 800 790 3 Abb. 102: Masse/Volumen Abhängigkeit in SE(S2O7)(HSO4) 88 Y Masse / u 89 90 150 160 Sm Gd Eu Dy Er Tb 170 Yb Ho Tm Lu 180 238 236 234 232 Durchschnittliche SE-O-Bindungslänge / pm Abb. 103: Masse/SE-O-Bindungslänge Abhängigkeit in SE(S2O7)(HSO4) 230 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -144- Tab. 53: Kristallographische Daten von SE(S2O7)(HSO4) (SE = Sm, Eu, Gd) Sm(S2O7)(HSO4) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Eu(S2O7)(HSO4) Gd(S2O7)(HSO4) 423,54 425,15 430,44 monoklin monoklin monoklin P21/n (Nr. 14) P21/n (Nr. 14) P21/n (Nr. 14) a = 847,28(3) pm a = 847,92(8) pm a = 841,70(3) pm b = 1049,63(4) pm b = 1049,1(1) pm b = 1044,73(4) pm c = 964,44(3) pm c = 962,59(8) pm c = 957,78(4) pm = 99,354(1)° = 99,21(1)° = 99,318(2)° 846,30(5) ų 845,3(1) ų 831,11(6) ų 4 4 4 Bruker APEX II Stoe IPDS I Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 39937 12937 40203 6197 1911 5154 5789 1385 4790 0,0343; 0,0195 0,0860; 0,0556 0,0492; 0,0238 SHELXS97 und SHELXL97[28] 1,123 0,985 1,110 1,122 0,985 1,110 0,0145; 0,0319 0,0423; 0,1064 0,0164; 0,0375 0,0170; 0,0323 0,0628; 0,1165 0,0189; 0,0380 0,821/ -1,112 e/ų 2,490/-3,974 e/ų 1,759/-1,217 e/ų 421791 421788 421785 Tab. 54: Kristallographische Daten von SE(S2O7)(HSO4) (SE = Tb, Dy, Yt) Tb(S2O7)(HSO4) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Dy(S2O7)(HSO4) Y(S2O7)(HSO4) 432,11 435,69 362,10 monoklin monoklin monoklin P21/n (Nr. 14) P21/n (Nr. 14) P21/n (Nr. 14) a = 837,72(4) pm a = 836,60(8) pm a = 834,90(8) pm b = 1041,10(5) pm b = 1039,68(8) pm b = 1039,3(1) pm c = 955,18(5) pm c = 952,08(9) pm c = 950,2(1) pm = 99,337(2)° = 99,47(1)° = 99,42(1)° 822,02(7) ų 816,83(1) ų 813,4(2) ų 4 4 4 Bruker APEX II Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 38793 11826 9683 5182 1901 1964 4909 1632 1190 0,0444; 0,0201 0,1042; 0,0498 0,1350; 0,1242 SHELXS97 und SHELXL97[28] 1,170 0,856 0,797 1,170 0,849 0,797 0,0161; 0,0356 0,0184; 0,0409 0,0380; 0,0734 0,0180; 0,0361 0,0241; 0,0421 0,0786; 0,0828 1,212/-1,167 e/ų 1,427/-1,222 e/ų 0,976/-0,979 e/ų 421795 421786 421793 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -145- Tab. 55: Kristallographische Daten von SE(S2O7)(HSO4) (SE = Ho, Er, Tm) Ho(S2O7)(HSO4) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Er(S2O7)(HSO4) Tm(S2O7)(HSO4) 438,12 monoklin P21/n (Nr. 14) a = 833,57(7) pm b = 1038,28(7) pm c = 951,91(8) pm = 99,08(1)° 813,6(1) ų 4 440,45 442,12 monoklin monoklin P21/n (Nr. 14) P21/n (Nr. 14) a = 831,74(8) pm a = 827,49(6) pm b = 1038,66(7) pm b = 1034,77(7) pm c = 947,45(9) pm c = 946,49(8) pm = 99,32(1)° = 99,292(9)° 807,7(1) ų 799,8(1) ų 4 4 Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 11732 11486 11883 2010 1992 1969 1751 1598 1686 0,0533; 0,0288 0,0554; 0,0369 0,0756; 0,0369 SHELXS97 und SHELXL97[28] 1,062 1,041 0,984 1,062 1,041 0,984 0,0172; 0,0434 0,0225; 0,0568 0,0228; 0,0572 0,0221; 0,0445 0,0328; 0,0656 0,0277; 0,0582 0,983/-1,397 e/ų 1,409/-1,586 e/ų 2,041/-1,627 e/ų 421789 421787 421792 Tab. 56: Kristallographische Daten von SE(S2O7)(HSO4) (SE = Yb, Lu, Gd) Yb(S2O7)(HSO4) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD Lu(S2O7)(HSO4) 446,23 448,16 monoklin monoklin P21/n (Nr. 14) P21/n (Nr. 14) a = 827,14(6) pm a = 823,3(1) pm b = 1033,10(6) pm b = 1030,83(8) pm c = 942,60(7) pm c = 940,6(1) pm = 99,159(9)° = 99,27(1)° 795,20(9) ų 787,8(2) ų 4 4 Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 11814 10109 1960 1938 1757 1486 0,0437; 0,0235 0,0836; 0,0556 SHELXS97 und SHELXL97[28] 1,026 0,939 1,026 0,939 0,0189; 0,0442 0,0212; 0,0473 0,0233; 0,0454 0,0349; 0,0489 1,521/-1,341 e/ų 1,130/-2,191 e/ų 421794 421790 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -146- Tab. 57: Ausgewählte internukleare Abstände [pm] und Winkel [°] in Ho(S2O7)(HSO4) Ho1- S1- O1 O2 O4 O5 O6 O7 O9 O10 O3 O4 O9 O10 S2O1 O2 O5 O8 S3O3 O6 O7 O11 O1-Ho1-O6 O1-Ho1-O10 O2-Ho1-O4 O2-Ho1-O5 O2-Ho1-O10 O4-Ho1-O10 O5-Ho1-O6 226,7(3) 228,1(2) 228,5(3) 231,1(3) 236,9(2) 240,4(2) 240,7(2) 242,1(2) Ø234,3(2) 162,4(3) 144,4(2) 144,7(3) 144,3(3) 145,5(3) 145,8(2) 145,4(3) 153,1(3) 163,3(3) 144,6(3) 143,9(3) 143,6(3) 94,5(1) 71,31(9) 75,17(9) 86,42(9) 78,68(9) 71,44(8) 95,5(1) O5-Ho1-O7 O6-Ho1-O4 O7-Ho1-O9 O4-S1-O3 O4-S1-O9 O9-S1-O3 O10-S1-O3 O10-S1-O4 O10-S1-O9 O5-S2-O1 O5-S2-O2 O1-S2-O2 O5-S2-O8 O1-S2-O8 O2-S2-O8 O11-S3-O7 O11-S3-O6 O7-S3-O6 O11-S3-O3 O7-S3-O3 O6-S3-O3 S1-O3-S3 S1-O9-Ho1 S1-O10-Ho1 S2-O1-Ho1 S2-O2-Ho1 S3-O6-Ho1 S3-O7-Ho1 78,23(9) 70,61(8) 72,31(8) 106,6(1) 113,1(2) 105,2(2) 101,6(1) 114,7(2) 114,2(2) 112,5(2) 112,8(2) 110,0(2) 103,7(2) 108,5(2) 109,2(2) 114,7(2) 114,7(2) 112,2(2) 107,2(2) 101,6(1) 105,1(1) 122,1(2) 146,1(2) 156,3(2) 161,5(2) 150,2(2) 142,6(2) 151,1(2) III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -147- 5.4.2.1 Thermischer Abbau von Dy(S2O7)(HSO4) Für die thermische Analyse wurden ca. 7 mg Dy(S2O7)(HSO4) in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von zwei Zersetzungsschritten (Tab. 58, Abb. 104) beginnt bei 320 °C, endet bei 400 °C und zeigt einen Massenverlust von 27,2%. Dies deutet auf den Verlust von drei Molekülen Schwefeltrioxid und einem Molekül Wasser hin. Als stabiles Intermediat konnte Dy2(SO4)3 (isotyp zu Gd2(SO4)3) bei 550 °C isoliert und pulverdiffraktometrisch nachgewiesen werden (Abb. 105). Während der zweiten und letzten Abbaustufe findet die Zersetzung zu Dy2O2SO4, im Temperaturfenster von 820 °C - >1050 °C mit einem Massenverlust von 19,1% statt. Es werden zwei Moleküle Schwefeltrioxid und ein Molekül Sauerstoff abgespalten. Aufgrund fehlender Literaturdaten zu pulverdiffraktometrischen Untersuchungen an Dy2O2SO4 wurde erneut mit dem isotypen Gd2O2SO4 verglichen (Abb. 106). Der beobachtete Gesamtmassenverlust der thermischen Zersetzung betrug 46,3% und stimmt mit dem errechneten Verlust von 51,4% überein. Die Differenz beider Werte kann durch die noch nicht abgeschlossene Zersetzung zu Dy2O2SO4 bei 1050 °C erklärt werden. Tab. 58: Ergebnisse der DTA/TG-Untersuchungen an Dy(S2O7)(HSO4), M = 435,69 g/mol TBeginn [°C] 320 TEnde [°C] 400 Tmax [°C] 375 820 >1050 910 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 27,2 29,5 19,1 21,9 Produkt Dy2(SO4)3 Dy2O2SO4 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -148- ^endo 100 DTA TG 90 DTA-Signal [ T] Masse [%] 80 70 60 50 200 400 600 800 1000 T [°C] Abb. 104: DTA/TG-Kurve des thermischen Abbaus von Dy(S2O7)(HSO4) 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Gd2(SO4)3-simuliert -80 -100 15 20 25 30 2 35 40 [°] Abb. 105: Pulverdiffraktogramm des DTA-Rückstandes der Zwischenstufe bei 550 °C 45 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -149- 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 -80 Gd2O2SO4-simuliert -100 20 30 2 40 [°] Abb. 106: Pulverdiffraktogramm des DTA-Rückstandes von Dy(S2O7)(HSO4) 50 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -150- 5.5 Das Sulfat-Hydrogensulfat Dy(SO4)(HSO4) 5.5.1 Synthese Es wurden 50 mg Dy(NO3)3·6H2O mit 1 ml halbkonzentrierter Schwefelsäure in einer offenen Duranglasampulle im Blockthermostat zur Reaktion gebracht. Nach einer achtstündigen Aufheizzeit betrug die Zieltemperatur 300 °C. Anschließend wurde diese Temperatur 20 Stunden gehalten. Es folgte ein Abkühlvorgang auf Raumtemperatur innerhalb von 140 Stunden. Kristalle von Dy(SO4)(HSO4) konnten in Form farbloser Plättchen erhalten werden. 5.5.2 Kristallstruktur von Dy(SO4)(HSO4) Dy(SO4)(HSO4) kristallisiert orthorhombisch in der azentrischen Raumgruppe P21 mit zwei Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es ein Dy3+-Ion, das sich wie alle anderen Atome auf der allgemeinen Wyckoff-Lage 2a befindet. Dieses Ion ist von acht kristallographisch unterscheidbaren Sauerstoffatomen koordiniert. Die Dy-OBindungslänge beträgt Ø 237,9 pm. Das Dy3+-Ion und die Sauerstoffatome bilden dabei ein leicht verzerrtes quadratisches Antiprisma, das schon mehrfach in dieser Arbeit diskutiert wurde. Jedes der angesprochenen Sauerstoffatome ist Teil einer Sulfat- oder HydrogensulfatGruppe. Betrachtet man die Umgebung des Metall-Ions, so kann zwischen Sulfat- und Hydrogensulfat-Einheiten unterschieden werden. Zwei O-Atome gehören in dieser Umgebung zu einer chelatisierend angreifenden Sulfat-Gruppe (grüner Tetraeder), drei Sauerstoffatome zu einfach koordinierten Sulfat-Einheiten (rote Tetraeder) und die restlichen drei Sauerstoffatome zu Hydrogensulfat-Gruppen (blaue Tetraeder). Alle freien Sauerstoffatome der Tetraeder koordinieren weiter zu den sich in der Zelle befindenden Dy3+- Ionen. Die S-O-Bindungslängen liegen bei Ø 145,7 pm und bei Ø 154,0 pm für die S-(OH)-Abstände. Die O-S-O-Winkel in den Sulfat-Einheiten liegen im Bereich von 103,0° - 111,9°. Der kleinste Winkel von 103,0° wird durch die zweizähnig angreifende Sulfatgruppe (grün markiert in Abb. 107) aufgespannt. Es kann eine mäßig starke Wasserstoffbrückenbindung mit einer Länge von 261 pm zwischen dem Sauerstoffatom O3 der Hydrogensulfat-Einheit und dem Sauerstoffatom O6 der Sulfat-Gruppe beobachtet werden. Der DHA-Winkel O3-H1-O6 beträgt 167°. III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -151- Dy O S H Abb. 107: Koordination des Dy3+-Ions (grün hervorgehoben: Tetraeder chelatisierender Sulfatgruppe, rot und blau markiert einzähnig angreifende Sulfat- bzw. Hydrogensulfat-Einheiten) b c Dy O S H Abb. 108: Kristallstruktur von Dy(SO4)(HSO4) in Richtung [100] III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -152- Tab. 59: Kristallographische Daten von Dy(SO4)(HSO4) Dy(SO4)(HSO4) Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte Flack-x Parameter CSD 530,03 orthorhombisch P21 (Nr. 62) a = 665,9(1) pm b = 658,88(7) pm c = 679,06(9) pm = 104,79(2)° 288,07(7) ų 2 Stoe IPDS I Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 4341 1404 1362 0,0359; 0,0283 SHELXS97 und SHELXL97[28] 1,015 1,005 0,0149; 0,0323 0,0158; 0,0324 0,957/-0,707 e/ų -0,027(10) 421779 Tab. 60: Ausgewählte internukleare Abstände [pm] und Winkel [°] in Dy(SO4)(HSO4) Dy1- O1 O2 O4 O5 O5 O6 O7 O8 S1- O1 O2 O3 O4 O5 O6 O7 O8 S2- O1-Dy1-O5 O1-Dy1-O5 O2-Dy1-O5 O2-Dy1-O5 231,4(3) 231,6(3) 229,6(3) 244,8(3) 253,0(3) 248,4(3) 233,8(3) 231,1(3) Ø237,9(3) 145,8(3) 145,8(3) 154,0(4) 145,5(3) 145,8(3) 145,8(3) 154,0(4) 145,5(3) 72,6(1) 79,0(1) 75,4(1) 71,6(1) O4-Dy1-O6 O4-Dy1-O7 O4-Dy1-O8 O5-Dy1-O5 O6-Dy1-O5 O7-Dy1-O5 O8-Dy1-O2 O1-S1-O3 O2-S1-O1 O2-S1-O3 O4-S1-O2 O4-S1-O3 O7-S2-O8 O8-S2-O6 O7-S2-O5 O8-S2-O5 O6-S2-O5 O7-S2-Dy1 O8-S2-Dy1 O6-S2-Dy1 O5-S2-Dy1 73,8(1) 81,1(1) 77,6(1) 98,99(6) 55,6(1) 95,4(1) 83,2(1) 107,9(2) 111,8(2) 107,1(2) 111,9(2) 106,0(2) 110,9(2) 111,7(2) 110,4(2) 109,1(2) 103,0(2) 112,4(2) 136,7(1) 51,7(1) 53,6(1) III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -153- 5.5.3 Gitterkonstantenverfeinerung von Pr(SO4)(HSO4) In der Vergangenheit wurden in der Arbeitsgruppe pulverdiffraktometrische Messungen an Pr(SO4)(HSO4) durchgeführt. Eine Strukturlösung aus Einkristalldaten konnte hingegen nicht erhalten werden. Daher wurde überprüft, ob Dy(SO4)(HSO4) isotyp zu der entsprechenden Praseodym-Verbindung ist. Die Ergebnisse der Indizierung des Pulverdiffraktogramms von Pr(SO4)(HSO4) auf Basis der Gitterkonstanten von Dy(SO4)(HSO4) sind in Tabelle 61 aufgeführt. Nach Vorgabe von fünf hkl-Werten aus dem simulierten Diffraktogramm von Dy(SO4)(HSO4) konnten durch eine least-square Verfeinerung mit 27 Reflexen die folgenden Gitterkonstanten erhalten werden: a = 675,3(2) pm, b = 679,5(1) pm, 696,3(1) pm und β = 104,02(2)°. Das gemessene Pulverdiffraktogramm wurde anhand der Verfeinerung als phasenrein identifiziert und alle Reflexe unter Verwendung der oben genannten Zelle indiziert. Folglich ist die Verbindung Pr(SO4)(HSO4) zu Dy(SO4)(HSO4) isotyp. Tab. 61: Ergebnisse der Indizierung von Pr(SO4)(HSO4) n 1* 2* 3* 4* 5* 6 7 8 9 2θ(obs.) 13,104 13,504 18,508 18,804 21,023 24,824 26,214 26,582 27,198 10 11 29,412 30,263 12 13 14 31,08 32,625 33,132 15 16 17 33,843 35,253 35,745 18 19 37,663 38,118 20 21 22 41,315 42,225 42,739 23 24 25 26 43,265 47,593 48,644 48,829 27 52,505 h 0 1 0 1 1 1 0 -1 2 -2 0 2 -2 -1 1 2 -2 1 1 2 -2 -1 2 -2 3 0 2 -2 -1 -1 3 2 -2 -3 k 0 0 1 1 0 1 2 0 0 0 2 1 1 2 0 0 0 2 1 1 1 2 2 2 0 1 2 2 3 2 1 3 3 1 l 1 0 1 0 1 1 0 2 0 1 1 0 1 1 2 1 2 1 2 1 2 2 0 1 0 3 1 2 1 3 1 0 1 3 2θ(calc.) 13,094 13,503 18,505 18,799 21,034 24,815 26,208 26,579 27,199 27,203 29,403 30,263 30,266 31,07 32,608 33,128 33,137 33,844 35,247 35,733 35,741 37,673 38,13 38,132 41,305 42,245 42,723 42,73 43,279 47,585 48,659 48,844 48,846 52,528 Δ2θ(obs.-calc.) 0,0092 0,0003 0,0036 0,0047 -0,011 0,0091 0,0053 0,0037 -0,0006 -0,0041 0,0098 0 -0,0032 0,0093 0,0171 0,0036 -0,0051 -0,0005 0,0057 0,0119 0,0037 -0,0097 -0,0117 -0,0143 0,0097 -0,0201 0,0162 0,0091 -0,0137 0,0077 -0,015 -0,0156 -0,0177 -0,0235 Intensität 100 44,2 45,4 58,5 92,2 23,7 43,2 47,9 49,5 d(obs.) 6,751 6,5519 4,7899 4,7154 4,2223 3,5837 3,3969 3,3506 3,2761 67,6 77,9 3,0343 2,9509 14,9 22,1 19 2,8752 2,7424 2,7017 19,8 22,1 25,3 2,6465 2,5439 2,5099 13,5 21,4 2,3864 2,359 15 23,4 28 2,1835 2,1385 2,114 21,6 41,2 23,8 24 2,0895 1,9091 1,8703 1,8636 16,3 1,7415 * vorgegebene hkl-Werte, grau schattiert sind doppelt zugeordnete Reflexe d(calc.) 6,7557 6,552 4,7909 4,7165 4,2202 3,585 3,3975 3,3511 3,276 3,2756 3,0353 2,9509 2,9506 2,8761 2,7438 2,7019 2,7013 2,6465 2,5443 2,5107 2,5102 2,3858 2,3583 2,3581 2,184 2,1376 2,1147 2,1144 2,0889 1,9094 1,8697 1,8631 1,863 1,7407 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -154- 5.6 Das Sulfat-Hydrogensulfat-Hydrat Nd3(SO4)4(HSO4)(H2O)2 5.6.1 Synthese Es wurden 200 mg Nd(NO3)3·5H2O mit 1 ml halbkonzentrierter Schwefelsäure in einer geschlossenen Normalglasampulle im Blockthermostat zur Reaktion gebracht. Nach einer 80-stündigen Aufheizzeit betrug die Zieltemperatur 350 °C. Nach einer Haltezeit von weiteren 80 Stunden erfolgte der Abkühlungsvorgang auf Raumtemperatur innerhalb von 160 Stunden. Es wurden Kristalle an Nd3(SO4)4(HSO4)(H2O)2 in Form rosa-farbener Polyeder erhalten (Abb. 109). Abb. 109: Kristalle von Nd3(SO4)4(HSO4)(H2O)2 unter dem Lichtmikroskop 5.6.2 Kristallstruktur von Nd3(SO4)4(HSO4)(H2O)2 Nd3(SO4)4(HSO4)(H2O)2 kristallisiert monoklin in der Raumgruppe P21/n mit vier Formeleinheiten in der Elementarzelle. Kristallographisch gesehen gibt es drei zu unterscheidende Nd3+-Ionen, die sich wie alle anderen Atome in der Zelle auf der allgemeinen Wyckoff-Lage 4e befinden. Bemerkenswert ist die unterschiedliche Koordinationszahl der Selten-Erd-Atome. Ein Neodym-Ion (Nd1) ist von neun und die übrigen zwei (Nd2, Nd3) von acht Sauerstoffatomen koordiniert. Die Nd-O-Bindungslängen erstrecken sich über einen Bereich von 228,8 pm - 266,5 pm und liegen im Mittel bei 246,5 pm. Nd3+-Ionen und Sauerstoffatome bilden ein stark verzerrtes, dreifach überkapptes trigonales Prisma (Nd1) (Abb. 110) und leicht verzerrte quadratische Antiprismen (Nd2, Nd3) (Abb. 111). Jedes Sauerstoffatom ist dabei Teil einer Sulfat- bzw. Hydrogensulfat-Gruppe oder eines Wassermoleküls. Die Koordination des Nd1-Atoms erfolgt durch zwei chelatisierend angreifende Sulfat-Gruppen (grüne Tetraeder) und fünf einzähnige Sulfat-Einheiten III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -155- (rote Tetraeder) (Abb. 110). Das Atom Nd2 wird von zwei cis-ständigen Wassermolekülen, vier Sulfat- (rote Tetraeder) und zwei Hydrogensulfat-Gruppen (blaue Tetraeder) koordiniert (Abb. 111). Das dritte Selten-Erd-Atom Nd3 weist neben sieben Sulfat-Einheiten (rote Tetraeder) ein Hydrogensulfat-Ion (blauer Tetraeder) in der Koordinationssphäre auf (Abb. 111). Nd1 O10 Nd O S H O9 Abb. 110: Koordination des Nd(1)3+-Ions (grün hervorgehoben: Tetraeder chelatisierender Sulfatgruppen, rot markiert einzähnig angreifende Sulfat-Einheiten) Nd2 Nd3 Abb. 111: Koordination der Nd(2)3+ (links) und Nd(3)3+-Ionen (rechts) (rot und blau markiert sind einzähnig angreifende Sulfat- bzw. Hydrogensulfat-Einheiten) III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -156- Die Nd-O-Bindungslängen zu den chelatisierenden Sulfat-Einheiten betragen im Durchschnitt 256,1 pm und sind im Vergleich zum durchschnittlichen Nd-O-Abstand um ca. 10 pm verlängert. Allerdings wird eine asymmetrische, zweizähnige Koordination der Tetraeder mit Nd1-O10 = 255,4 pm und Nd1-O9 = 266,5 pm beobachtet (Abb. 110). Alle freien Sauerstoffatome der Tetraeder koordinieren ein- oder zweizähnig weiter an die in der Zelle befindlichen Nd3+-Ionen. Die S-O-Bindungslängen liegen bei durchschnittlich 147,5 pm und bei 155,5 pm für S-(OH). Die O-S-O-Winkel in den Sulfat-Einheiten betragen 101,9° - 112,4°. Die kleinsten Winkel von 101,94° und 103,53° werden durch die zweizähnig angreifenden Sulfat-Gruppen aufgespannt. Es können mäßig starke Wasserstoffbrückenbindungen mit einer Länge von 262 pm und 273 pm zwischen den Sauerstoffatomen der Hydrogensulfat-Einheit bzw. der Wassermoleküle und Sauerstoffatomen der Sulfat-Gruppen beobachtet werden. Die DHA-Winkel betragen 162° und 156°. b c Nd O S H Abb. 112: Kristallstruktur von Nd3(SO4)4(HSO4)(H2O)2 in Richtung [100] III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -157- Tab. 62: Kristallographische Daten von Nd3(SO4)4(HSO4)(H2O)2 Nd3(SO4)4(HSO4)(H2O)2 Molmasse [g/mol] Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Zahl der Formeleinheiten Diffraktometer Datenkorrektur Absorptionskorrektur gemessene Reflexe symmetrieunabhängige Reflexe davon mit I0 > 2 (I0) Rint; Rσ Strukturbestimmung Goodness of fit (I0 > 2 (I0)) Goodness of fit (alle Daten) R1; wR2 (I0 > 2 (I0)) R1; wR2 (alle Daten) Max./Min. Restelektronendichte CSD 950,06 monoklin P21/c (Nr. 14) a = 934,95(5) pm b = 873,84(4) pm c = 2025,4(1) pm = 91,995(2)° 1653,8(1) ų 4 Bruker APEX II Polarisations- und Lorenzfaktoren numerisch, nach Kristallgestaltoptimierung[24, 25] 46960 10211 9889 0,0464; 0,0261 SHELXS97 und SHELXL97[28] 1,267 1,267 0,0222; 0,0487 0,0237; 0,0492 1,871/-1,322 e/ų 421781 Tab. 63: Ausgewählte internukleare Abstände [pm] und Winkel [°] in Nd3(SO4)4(HSO4)(H2O)2 Nd1- Nd2- Nd3- S1S2S3- O1 O2 O6 O9 O17 O11 O13 O15 O19 O20 O4 O7 O9 O12 O18 O2 O4 O7 O8 O10 O12 256,7(1) 246,3(1) 243,0(2) 266,5(2) 240,5(2) 254,7(2) 245,2(2) 247,3(1) 241,7(2) 240,7(2) 239,0(1) 255,3(1) 248,9(1) 244,1(2) 228,7(2) 150,5(1) 145,6(1) 150,2(2) 146,3(2) 145,7(2) 149,9(2) S4- O17 O18 S5O21 O23 O2-Nd1-O16 O19-Nd2-O22 O18-Nd3-O4 O1-S1-O2 O3-S1-O1 O3-S1-O2 O5-S2-O7 O6-S2-O7 O8-S2-O5 O9-S3-O10 O11-S3-O9 O12-S3-O11 O15-S4-O17 O16-S4-O15 O18-S4-O16 O21-S5-O22 O21-S5-O23 147,9(2) 146,7(2) 144,7(2) 155,5(2) 78,36(5) 68,41(6) 80,77(5) 103,53(8) 112,38(9) 108,79(9) 108,52(9) 106,81(9) 111,05(9) 101,94(8) 112,41(9) 109,8(1) 109,11(9) 110,02(9) 108,58(9) 113,1(1) 103,5(1) III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -158- 5.6.2.1 Thermischer Abbau von Nd3(SO4)4(HSO4)(H2O)2 Für die thermische Analyse wurden ca. 11 mg Nd3(SO4)4(HSO4)(H2O)2 in einen Korundtiegel eingewogen und in die SDTA/TG-Apparatur eingesetzt. Der Tiegel wurde im Stickstoffstrom mit einer Heizrate von 10 °C/min von Raumtemperatur auf eine Endtemperatur von 1050 °C erhitzt. Der erste von zwei Zersetzungsschritten von Nd3(SO4)4(HSO4)(H2O)2 (Tab. 64, Abb. 113) beginnt bei 200 °C, endet bei 492 °C und zeigt einen Massenverlust von 5,1%. Dies deutet auf den Verlust von zwei Molekülen Koordinationswasser hin. Während der zweiten und letzten Abbaustufe findet die Zersetzung im Temperaturfenster von 802 °C - 1050 °C mit einem Massenverlust von 19,8% statt. Bei einer maximalen Heiztemperatur von 1050 °C ist die vollständige Zersetzung zu Nd2O2SO4 allerdings noch nicht abgeschlossen, wie aus Abb. 113 zu ersehen ist. Vielmehr wurde am Endpunkt der Messung noch ein Gemisch an Nd2O2SO4 und Nd2(SO4)3 vorgefunden (Abb. 114). SE2(SO4)3 wurde bereits bei allen vorherigen thermischen Zersetzungen an sauren Sulfaten der Selten-Erd-Elemente eindeutig als Zwischenstufe beobachtet. Auf Grundlage der Annahme eines Rückstandgemisches lässt sich auch der hohe detektierte Massenrückstand von 81,3% erklären, der bei der alleinigen Annahme von Nd2O2SO4 nur bei 65,8% liegen dürfte. Tab. 64: Ergebnisse der DTA/TG-Untersuchungen an Nd3(SO4)4(HSO4)(H2O)2, M = 950,06 g/mol TBeginn [°C] 200 TEnde [°C] 492 Tmax [°C] 448 802 >1050 934 Massenverlust Massenverlust [%] (beob.) [%] (berech.) 5,1 3,8 13,7 --- Produkt Nd3(SO4)4(HSO4) Nd2(SO4)3/Nd2O2SO4 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -159- ^endo 100 DTA TG DTA-Signal [ T] Masse [%] 95 90 85 200 400 600 800 1000 T [°C] Abb. 113: DTA/TG-Kurve des thermischen Abbaus von Nd3(SO4)4(HSO4)(H2O)2 100 DTA-Rückstand beobachtet 80 relative Intensität [%] 60 40 20 0 -20 -40 -60 Nd2(SO4)3-simuliert -80 Nd2O2SO4-simuliert -100 20 30 40 50 2 60 70 [°] Abb. 114: Pulverdiffraktogramm des DTA-Rückstandes von Nd3(SO4)4(HSO4)(H2O)2 80 III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -160- 5.7 Zusammenfassung Insgesamt gelang es die Strukturen von 17 neuen Verbindungen zu bestimmen und mittels DTA/TG-Untersuchungen zu charakterisieren. Der Kristallstrukturaufbau der Disulfate SE2(S2O7)3 (SE = La - Nd) erfolgt durch einfach und chelatisierend am SE-Ion angreifende Disulfat-Gruppen. Bei der thermischen Zersetzung fand die Identifizierung des SE2O2SO4-Rückstandes mittels IR-Spektroskopie und Pulverdiffraktometrie statt. Ebenfalls konnte gezeigt werden, dass die Entfernung von an den Kristallen anhaftendem Oleum sowohl durch einen Waschvorgang als auch durch kontrolliertes Erhitzen möglich war. In den Verbindungen von SE(S2O7)(HSO4) (SE = Sm - Lu, Y) werden neben ein- und zweizähnig koordinierenden Disulfat-Gruppen ebenfalls einfach gebundene HydrogensulfatEinheiten beobachtet. In einer Gegenüberstellung der elf erhaltenen Verbindungen kann bei zunehmender Masse die mit Bindungsverkürzungen und Volumenabnahme verbundene Lanthanoidenkontraktion innerhalb der Reihe der entsprechenden Elemente beobachtet werden. Im sauren Sulfat Dy(SO4)(HSO4) koordinieren neben chelatisierend und einzähnig angreifenden Sulfat-Gruppen auch Hydrogensulfat-Einheiten an das zentrale Dy3+-Ion. Durch eine Gitterkonstantenverfeinerung am Pulver wurde Pr(SO4)(HSO4) als isotyp zu Dy(SO4)(HSO4) identifiziert und so die Verbindungsklasse der Sulfat-Hydrogensulfate um eine weitere Verbindung erweitert. Die mit Nd3(SO4)4(HSO4)(H2O)2 vorgestellte Verbindung enthält Nd3+-Ionen mit unterschiedlich hoher Koordinationszahl. Neben ein- und zweizähnig koordinierenden SulfatGruppen werden zwei cis-ständige Wassermoleküle gefunden. Die DTA/TG-Untersuchung der Verbindung war bei maximaler Heiztemperatur noch nicht abgeschlossen. Dennoch zeigte sich im Pulverdiffraktogramm des Rückstandes das Vorhandensein des Selten-Erd-OxidSulfats. Abschließend kann festgestellt werden, dass die Reaktionsführung bei erhöhten Temperaturen und Druck als maßgebliche Faktoren zur Synthese neuer Sulfate der Selten-Erd-Elemente angesehen werden kann. Ebenfalls nimmt die eingesetzte Schwefeltrioxid-Konzentration eine Schlüsselrolle ein, wie Abb. 115 zu entnehmen ist. Ausblickend lässt sich sagen, dass es nicht möglich sein wird, die Reaktionstemperatur weiter signifikant zu steigern. Material- und apparatetechnisch ist bei Temperaturen um 480 °C die maximale Belastbarkeit erreicht. III. 5. Disulfate und saure Sulfate der Selten-Erd-Elemente -161- SE2(S2O7)3 0,0 SE(S2O7)(HSO4) SE(HSO4)3 0,5 SE(HSO4)3·H2O 0,1 SE(SO4)(HSO4) 0,4 SE(HSO4)3·4H2O [% ] O 2 H SE(SO4)(HSO4)·4H2O 0,3 SE(HSO4)3·H2SO4·2H2O ] [% 0,3 SO 3 0,2 SE3(SO4)4(HSO4)(H2O)2/ 0,2 SE3(SO4)4(HSO4)·2H2O SE2(SO4)3·H2O 0,4 SE2(SO4)3·2H2O 0,1 SE2(SO4)3·3H2O 0,5 0,0 0,5 0,6 0,7 0,8 0,9 2- 1,0 SE2(SO4)3·4H2O SE2(SO4)3·5H2O SE2(SO4)3·8H2O SO4 [%] SE2(SO4)3·9H2O Abb. 115: Dreiecksdiagramm der Disulfate und sauren Selten-Erd-Sulfate Erfolgversprechender könnte jedoch eine Variierung der Schwefeltrioxid-Konzentration in der Reaktionslösung sein. So wären weitere Verbindungen der Summenformel SE3(SO4)4(HSO4)(H2O)n, mit n als variablem Wassergehalt, denkbar. In dem in Abb. 115 grau schattierten Bereich sind keine weiteren Sulfate der Selten-Erd-Elemente zu erwarten, da eine hohe Konzentration an Wasser und Schwefeltrioxid zu Schwefelsäure abreagiert und damit immer zu den entsprechenden Hydrogensulfaten führt. IV. Zusammenfassung und Ausblick -162- IV. Zusammenfassung und Ausblick In der vorliegenden Arbeit konnte ein breites Spektrum an neuen Verbindungen der Platinmetalle und der Selten-Erd-Elemente dargestellt werden. Die beiden Schwerpunkte bildeten die Erforschung neuer Precursor-Materialien aus Chloro-Verbindungen der Platinoide mit komplexen Oxo-Anionen und die Darstellung neuer Sulfate der erwähnten Metalle (Abb. 116, Abb. 117). [H3O+·18C6]2[PtCl6] [La(NO3)(H2O)2·(18C6)][PtCl6] [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O H2PtCl6 [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O KCl, N2H4, KNO2, H2SO4, 18C6 HNO3/HCl Pt 18C6/15C5 Ir Os Ru Rh 18C6 HNO3/HCl Glasampulle H2SO4, 465 °C Rh2(SO4)3(H2O)2 Cl2 Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 H2PtCl6 H2\3MCl6 4 SE-Nitrat Glasampulle SE-Nitrat Oleum, 350 °C SE-Hydroxid SE-Chlorid [SE(NO3)2(H2O)6]2[PtCl6]·2H2O (SE = La, Pr, Sm) [SE(H2O)9][MCl6]Cl·2H2O (SE = Ce, M = Ir) [SE(H2O)9][M2OCl10]Cl2 (SE = Pr, M = Ru ) [SE(NO3)2(H2O)6]2[MCl6]·2H2O (SE = La, Ce, Pr, M = Os, Ir) [SE(NO3)(H2O)7][PtCl6] 4H2O (SE = Gd, Dy) [SE(NO3)(H2O)7][MCl6] 4H2O (SE = Eu, Dy, M = Os, Ir) [SE(H2O)8][PtCl6]·NO3·4H2O (SE = Y) [SE(H2O)8][MCl6]NO3·4H2O (SE = Lu, M = Ir ) [SE(H2O)9][MCl6]·2H2O (SE = Pr, Ce, M = Ir, Rh ) Abb. 116: Schematische Darstellung der Syntheserouten aller untersuchter Verbindungen der Platinmetalle mit und ohne komplexe Oxo-Anionen der Selten-Erd-Elemente IV. Zusammenfassung und Ausblick -163- Glasampulle Oleum (~65% SO3), 350 °C - 400 °C Glasampulle Oleum (~65% SO3), 300 °C SE-Nitrat / SE-Oxid SE(S2O7)(HSO4) SE = La - Nd Glasampulle halb konz. H2SO4 Nd3(SO4)4(HSO4)(H2O)2 geschlossenes System SE2(S2O7)3 SE = Sm – Lu, Y 300 °C Dy(SO4)(HSO4) offenes System Abb. 116: Schematische Darstellung der Syntheserouten aller dargestellten und untersuchten Disulfate und sauren Sulfate der Selten-Erd-Elemente Chlorometallate der Selten-Erd-Elemente Ausgehend von den Elementen Platin, Iridium, Osmium, Ruthenium, Rhodium und einer Selten-Erd-Quelle wurden eine Reihe von Chloro-Verbindungen der Platinoide mit komplexen Oxo-Anionen dargestellt. Hierfür wurde versucht, die entsprechende Säure, mit der allgemeinen Formel H2MCl6·2H2O (M = Platinmetall) über einen Chlorierungsprozess oder ein Tetraoxid, welches in eine Salzsäure-Lösung eingeleitet wurde, herzustellen. Diese wurde mit Nitraten, Chloriden und Hydroxiden der Selten-Erd-Elemente umgesetzt. Die erhaltenen Verbindungen wiesen ausgeprägte Verwandtschaftsbeziehungen aus, was für die Reihe der recht ähnlichen Lanthanoid-Ionen auch zu erwarten war. Auch platinmetallübergreifend zeichnete sich ein isotyper Charakter ab, so sind z. B. die Verbindungen der Metalle Platin, Osmium und Iridium mit verschiedenen Selten-ErdElementen gleichartig (Tab. 65). Eine weitere strukturelle Besonderheit besteht in der Anzahl der Nitratgruppen, die an das Selten-Erd-Element gebunden sind oder zum Ladungsausgleich in der Kristallstruktur eingebaut sein können. Entsprechend der Lanthanoidenkontraktion kann eine Verringerung der Koordinationszahl der Ionen mit geringer werdendem Ionenradius beobachtet werden. Zehnfach von Sauerstoffatomen koordinierte SE-Ionen, wie La3+ weisen zwei chelatisierende Nitratgruppen auf, die sich in trans-Position zueinander befinden. Bei neunfacher Koordination, z. B. des Dy3+-Ions, findet sich nur noch eine bindende Gruppe. IV. Zusammenfassung und Ausblick -164- Das Y3+-Ion vermag bei achtfacher Koordination keine Nitratgruppe mehr über die Sauerstoffatome zu koordinieren und diese liegen „frei“ zum Ladungsausgleich in der Kristallstruktur vor. In [Ce(H2O)9][IrCl6]Cl·2H2O kann der Ausgleich auch durch ein Chlorid-Ion realisiert werden. Tab. 64: Kristallographische Daten für [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O (I), [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O (II) und [Ce(H2O)6(NO3)2]2[IrCl6]·2H2O (III) Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) I II III monoklin P21/c (Nr. 14) a = 692,33(3) pm b = 1641,4(1) pm c = 1296,37(6) pm monoklin P21/c (Nr. 14) a = 692,93(2) pm b = 1641,95(4) pm c = 1307,92(3) pm monoklin P21/c (Nr. 14) a = 691,59(3) pm b = 1641,57(7) pm c = 1306,67(8) pm = 93,970(5)° 1469,6(1) ų 2 0,0134; 0,0256 = 93,870(2)° 1484,70(7) ų 2 0,0156; 0,0296 = 93,875(6)° 1480,1(1) ų 2 0,0265; 0,0420 Ebenso wie der strukturelle Aufbau ähneln sich auch die thermischen Zersetzungsprodukte der Verbindungen. Hexachloroplatinate, -iridate und -rhodate zerfallen wieder zu den Elementen Platin, Iridium und Rhodium und in Abhängigkeit vom eingebauten kationischen Komplex zu SEO2, SE2O3 oder SEOCl. Bei pulverdiffraktometrischen Untersuchungen an den Zersetzungsrückständen der Hexachloroosmate und Chlororuthenate konnte hingegen nur das entsprechende Selten-Erd-Oxid oder das Selten-Erd-Oxid-Chlorid nachgewiesen werden (Abb. 117). Die eingesetzten Edelmetalle Osmium und Ruthenium verflüchtigten sich wahrscheinlich in Form der Tetraoxide. Zeichnete sich bei den bereits diskutierten Hexachlorometallaten ein gewisser Trend zu isotypen Verbindungen innerhalb der Gruppen ab, so setzte sich dieser beim Ruthenium nicht fort. Es konnte bei der Synthese der Rutheniumsäure keine zweiprotonige Säure erhalten werden. Vielmehr neigt Ruthenium dazu, mehrkernige, oft über Sauerstoff verbrückte Komplexe der Summenformel [Ru2Cl10O]4- zu bilden. Daher konnten auch bei der sich anschließenden Umsetzung mit SE-Edukten nur Verbindungen [SE(H2O)9]2[Ru2OCl10]Cl2 (SE = Ce, Pr, Ho) erhalten und charakterisiert werden. des Typs IV. Zusammenfassung und Ausblick -165- 100 80 DTA-Rückstand beobachtet relative Intensität [%] 60 40 20 0 -20 -40 -60 PrOCl-simuliert -80 -100 20 30 40 50 2 60 70 80 90 [°] Abb. 116: Pulverdiffraktogramm des DTA-Rückstandes der Zersetzung von [Pr(H2O)9][Ru2OCl10]Cl2 Hexachloroplatinate(IV) und Platin(III)-Sulfat mit Kronenethern Die Umsetzung von Hexachloroplatinaten(IV) und einem Platin(III)-Sulfat mit diversen Kronenether-Molekülen in wässriger Lösung führte zu den in Tabelle 65 aufgelisteten Verbindungen. Tab. 65: Kristallographische Daten für [H3O+·18C6]2[PtCl6] (I), [La(NO3)(H2O)2·(18C6)][PtCl6] (II), [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O (III) und [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O (IV). Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) I II III IV monoklin P21/n (Nr. 14) a = 1304,29(3) pm b = 2073,68(5) pm c = 1372,12(3) pm = 95,003(1)° 3697,0(2) ų 4 orthorhombisch Pbca (Nr. 61) a = 1514,7(3) pm b = 2053,5(4) pm c = 3278,3(7) pm tetragonal I4/m (Nr. 87) a = 2020,5(3) pm c = 2740,6(6) pm 10197(4) ų 12 11188(3) ų 8 monoklin P21/c (Nr. 14) a = 1039,24(2) pm b = 965,19(2) pm c = 2301,49(5) pm = 90,496(1)° 2308,46(8) ų 2 0,0403; 0,0636 0,0386; 0,0986 0,0348; 0,0811 0,0244 ; 0,0516 DTA/TG-Untersuchungen an [H3O+·18C6]2[PtCl6] (Abb. 117) fügen sich in die bisher in unserer Gruppe durchgeführten thermoanalytischen Arbeiten über die Zersetzung von (H3O)2[PtCl6] und der damit gewonnenen Erkenntnisse über den strukturellen Aufbau und die Zusammensetzung von Metallsäuren ein. IV. Zusammenfassung und Ausblick -166- 269 pm 270 pm 268 pm Pt O Cl C H O C H Abb. 117: Asymmetrische Einheit mit pyramidalem Oxonium-Ion (links) und fehlgeordneter Kronenetherring (rechts) in der Kristallstruktur von [H 3O+·18C6]2[PtCl6] [La(NO3)(H2O)2·(18C6)][PtCl6] ist die erste Verbindung ihrer Art, die ein Nitrat- und zwei Neutralliganden am Selten-Erd-Metallatom koordiniert aufweist und ein [PtCl6]2--Ion zum Ladungsausgleich dieser Einheit in der Kristallstruktur vorliegen hat (Abb. 118). DTA/TG-Untersuchungen an dieser Verbindung zeigten die gleichen Zersetzungsrückstände wie bei der Ausgangsverbindung [La(NO3)2(H2O)6]2[PtCl6]·2H2O. In [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O ist das Sm3+-Ion nicht mehr, wie in den anderen erhaltenen Kristallstrukturen, von einem Kronenether-Molekül umgeben. Stattdessen fassen drei 15-Krone-5-Moleküle das Ion ein und schirmen es ab (Abb. 118). Zahlreich vorhandene Wasserstoffbrückenbindungen und die damit verbundene Ausbildung eines dichten Netzwerks zeichnen diese Verbindung ebenfalls aus. Pt SE N O Cl C H Abb. 118: Asymmetrische Einheiten in der Kristallstruktur von [La(NO3)(H2O)2·(18C6)][PtCl6] (links) und [Sm(H2O)9·(15C5)3][PtCl6]Cl·H2O (rechts) IV. Zusammenfassung und Ausblick -167- [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O hingegen enthält, anders als bei den bisher diskutierten Strukturen, kein [PtCl6]2--Ion, sondern das komplexere [Pt2(SO4)4(H2O)2]2--Ion. Dieses konnte in der Gegenwart des Kronenethers vollständig isoliert werden. Zwei 18-Krone-6-Moleküle umschließen die Kalium-Ionen. Dabei werden selbige merklich von den Sauerstoffatomen der Sulfat-Gruppen des Anions aus der Ebene des Makrozyklus bewegt (Abb. 119). In [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O wurde das erste Mal ein Kronenether eingesetzt, um eine Pt26+-Hantel enthaltene Verbindung zu kristallisieren. Durchgeführte DTA/TG-Experimente an [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O und der Ausgangsverbindung K2[Pt2(SO4)4(H2O)2] zeigten unterschiedliches Zersetzungsverhalten, wobei nach Abgabe der Kronenether-Moleküle identische Intermediate gebildet wurden (Abb. 120). ^endo 100 TG: K2[Pt2(SO4)4(H2O)2] + TG: [(K ·18C6)]2[Pt2(SO4)4(H2O)2]·H2O + DTA: [(K ·18C6)]2[Pt2(SO4)4(H2O)2]·H2O 90 DTA-Signal [ T] Pt S O K C H Masse [%] 80 70 60 50 40 30 100 200 300 400 500 600 700 800 T [°C] Abb. 119: Asymmetrische Einheit Abb. 120: Thermischer Abbau von + [K ·18C6]2[Pt2(SO4)4(H2O)2]·H2O K2[Pt2(SO4)4(H2O)2] und + [K ·18C6]2[Pt2(SO4)4(H2O)2]·H2O Umsetzung von Praseodym-Hexachloroiridat(IV) mit Schwefelsäure Aus der Umsetzung von [Pr(NO3)2(H2O)6][IrCl6]·2H2O in Oleum bei 350 °C in einer Duranglasampulle konnte das komplexe Sulfat Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 erhalten werden (Tab. 66). In der trimeren oxo-verbrückten [Ir3O]-Einheit liegen gemischtvalente Iridiumatome (IV, III, III) vor. IV. Zusammenfassung und Ausblick -168- Tab. 66: Kristallographische Daten für Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) Ir O S H monoklin C2/c (Nr. 15) a = 1528,36(4) pm b = 1622,36(5) pm c = 1526,99(4) pm = 98,815(2)° 3741,5(2) ų 4 0,0219; 0,0422 Abb. 121: Anionische Einheit [Ir3O(SO4)6(HSO4)2H2O]6- in der Kristallstruktur von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 Damit gelang es erstmals ein gemischtes Sulfat-Hydrogensulfat-Schwefelsäure-Addukt des Iridiums in Gegenwart eines Selten-Erd-Elements kristallographisch zu bestimmen. Ergänzend wurde die Struktur elektrochemisch charakterisiert. Neben ZyklovoltammetrieMessungen an Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 (Abb. 122) war eine zweifelsfreie Lokalisierung der Wasserstoffatome zur Bestimmung der Gemischtvalenz der Iridiumatome essentiell. Anhand von Fourier-Elektronendichtekarten (Abb. 122), Analysen typischer Bindungslängen für Schwefelsäure-, Hydrogensulfat- und Sulfat-Einheiten, der Auswertung des elektrochemischen Verhaltens und unter Berücksichtigung der Farbe der erhaltenen Kristalle von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 konnten die angenommenen Oxidationsstufen der Iridiumatome verifiziert werden. 0,002 -5 Stromstärke / 1e A 0,001 Red Ox + e(III) (III) (III) (IV) (III) (III) E° = 0,42 V 0,000 -0,001 -0,002 -0,003 Ox + e Red (IV) (III) (III) (III) (III) (III) E° = 0,32 V -0,004 -0,005 0,20 0,25 0,30 0,35 0,40 0,45 0,50 Potential / V Abb. 122: Differenzfourierkarte (links) mit Schnitt durch eine SO42--Gruppe und zyklisches Voltammogramm (rechts) von Pr2[Ir3O(SO4)6(HSO4)2(H2O)](H2SO4)4 0,55 0,60 IV. Zusammenfassung und Ausblick -169- Rhodiumsulfat Rh2(SO4)3(H2O)2 Bei einer Hochtemperatursynthese in Duranglasampullen von elementarem Rhodium in konz. Schwefelsäure bei 465 °C gingen Einkristalle des ersten binären Rhodium-Sulfates Rh2(SO4)3(H2O)2 Tab. 67: Kristallographische Daten für Rh2(SO4)3(H2O)2 hervor (Tab. 67). In der Kristallstruktur wird ein Rhodiumatom koordiniert, von sechs wohingegen Kristallsystem Raumgruppe Gitterkonstanten Sulfateinheiten ein zweites, orthorhombisch Pnma (Nr. 62) a = 920,46(2) pm b = 1244,47(3) pm c = 833,37(2) pm 954,61(4) Å 4 kristallographisch unterscheidbares, Rhodiumatom neben vierfacher Koordination durch Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) Sulfatgruppen zwei koordinierte Moleküle Wasser 0,0199; 0,0518 aufweist (Abb. 123).Die phasenreine und im dreistelligen Milligrammbereich synthetisierbare Verbindung wurde pulverdiffraktometrisch, thermogravimetrisch und IR-schwingungsspektroskopisch eingehend charakterisiert. Dabei konnten die Banden der koordinierten Wassermoleküle im IR-Spektrum eindeutig zugeordnet werden. 100 1614 1211 3146 1157 . 60 1108 Transmission [%] 80 575 554 3200 2800 2400 2000 1600 1200 602 957 Rh O S H 704 1007 . 40 800 -1 Wellenzahl [cm ] Abb. 123: Kristallstruktur mit ausgebildeten Wasserstoffbrückenbindungen (links) und IR-Spektrum (rechts) von Rh2(SO4)3(H2O)2 Disulfate und saure Sulfate der Selten-Erd-Elemente Die Reaktion von Seltenen-Erden und Selten-Erd-Nitraten in unterschiedlich stark mit Schwefeltrioxid angereicherter Schwefelsäure führte zur Synthese einer Reihe neuer Sulfate. Insgesamt gelang es die Strukturen von 17 neuen Verbindungen zu bestimmen und u. a. mittels DTA/TG-Untersuchungen zu charakterisieren. IV. Zusammenfassung und Ausblick -170- Bei Reaktionstemperaturen von 300 °C wurden aus einer Ampullenreaktion die ersten reinen Disulfate der Lanthanoide mit der Formel SE2(S2O7)3 (SE = La - Nd) erhalten (Tab. 68). Tab. 68: Kristallographische Daten für SE2(S2O7)3 (SE = La - Nd) (I - IV) Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) I II III IV monoklin P21/c (Nr. 14) a = 2260,29(8) pm b = 1127,33(4) pm c = 2229,00(8) pm = 118,256(1)° 5002,9(3) ų 12 monoklin P21/c (Nr. 14) a = 1280,72(7) pm b = 1123,36(5) pm c = 1309,4(1) pm = 118,240(8)° 1659,6(2) ų 4 monoklin P21/c (Nr. 14) a = 2242,27(6) pm b = 1113,83(3) pm c = 2210,16(6) pm = 118,305(1)° 4859,9(2) ų 12 monoklin P21/c (Nr. 14) a = 2237,47(6) pm b = 1109,98(3) pm c = 2202,76(6) pm = 118,308(1)° 4816,4(2) ų 12 0,0382; 0,0604 0,0299; 0,0372 0,0262; 0,0545 0,0255; 0,0534 Der Kristallstrukturaufbau (Abb. 124) erfolgt durch einfach und chelatisierend am SE-Ion angreifende Disulfat-Gruppen. Aufgrund einer nicht auflösbaren Fehlordnung einiger Atome in den Strukturen der Lanthan-, Praseodym- und Neodym-Verbindungen wurden durch Verdoppelung der a- und c-Achsen die Elementarzellen vergrößert und so eine Lösung der Strukturen ermöglicht. Bei der Cer-Verbindung zeigte sich diese Notwendigkeit nicht und es konnte bei den ursprünglichen Gitterkonstanten belassen werden. Bei der thermischen Zersetzung fand die Identifizierung des SE2O2SO4-Rückstandes mittels IR-Spektroskopie und Pulverdiffraktometrie statt. Ebenfalls konnte gezeigt werden, dass die Entfernung von an den Kristallen anhaftendem Oleum sowohl durch einen Waschvorgang als auch durch kontrolliertes Erhitzen möglich war. La O S Abb. 124: Kristallstruktur von La2(S2O7)3 IV. Zusammenfassung und Ausblick -171- Disulfat-Hydrogensulfate der Selten-Erd-Elemente der Zusammensetzung SE(S2O7)(HSO4) (SE = Sm - Lu, Y) gingen aus der Reaktion des entsprechenden Oxids mit Oleum bei einer Temperatur von 350°C - 400 °C in geschlossenen Duranglasampullen hervor (Tab. 69 - 71). Tab. 69: Kristallographische Daten für SE(S2O7)(HSO4) (SE = Sm - Tb) (I-IV) Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) I II III IV monoklin P21/n (Nr. 14) a = 847,28(3) pm b = 1049,63(4) pm c = 964,44(3) pm = 99,354(1)° 846,30(5) ų 4 monoklin P21/n (Nr. 14) a = 847,92(8) pm b = 1049,1(1) pm c = 962,59(8) pm = 99,21(1)° 845,3(1) ų 4 monoklin P21/n (Nr. 14) a = 841,70(3) pm b = 1044,73(4) pm c = 957,78(4) pm = 99,318(2)° 831,11(6) ų 4 monoklin P21/n (Nr. 14) a = 837,72(4) pm b = 1041,10(5) pm c = 955,18(5) pm = 99,337(2)° 822,02(7) ų 4 0,0145; 0,0319 0,0423; 0,1064 0,0164; 0,0375 0,0161; 0,0356 Tab. 70: Kristallographische Daten für SE(S2O7)(HSO4) (SE = Dy, Y, Ho, Er) (V - VIII) Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) V VI VII VIII monoklin P21/n (Nr. 14) a = 836,60(8) pm b = 1039,68(8) pm c = 952,08(9) pm = 99,47(1)° 816,83(1) ų 4 monoklin P21/n (Nr. 14) a = 834,90(8) pm b = 1039,3(1) pm c = 950,2(1) pm = 99,42(1)° 813,4(2) ų 4 monoklin P21/n (Nr. 14) a = 833,57(7) pm b = 1038,28(7) pm c = 951,91(8) pm = 99,08(1)° 813,6(1) ų 4 monoklin P21/n (Nr. 14) a = 831,74(8) pm b = 1038,66(7) pm c = 947,45(9) pm = 99,32(1)° 807,7(1) ų 4 0,0184; 0,0409 0,0380; 0,0734 0,0172; 0,0434 0,0225; 0,0568 Tab. 71: Kristallographische Daten für SE(S2O7)(HSO4) (SE = Tm - Lu) (IX - XI) Kristallsystem Raumgruppe Gitterkonstanten Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) IX X XI monoklin P21/n (Nr. 14) a = 827,49(6) pm b = 1034,77(7) pm c = 946,49(8) pm = 99,292(9)° 799,8(1) ų 4 monoklin P21/n (Nr. 14) a = 827,14(6) pm b = 1033,10(6) pm c = 942,60(7) pm = 99,159(9)° 795,20(9) ų 4 monoklin P21/n (Nr. 14) a = 823,3(1) pm b = 1030,83(8) pm c = 940,6(1) pm = 99,27(1)° 787,8(2) ų 4 0,0228; 0,0572 0,0189; 0,0442 0,0212; 0,0473 In der Kristallstruktur werden neben ein- und zweizähnig koordinierenden Disulfat-Gruppen ebenfalls einfach gebundene Hydrogensulfat-Einheiten beobachtet (Abb.125). In einer Gegenüberstellung der elf erhaltenen Verbindungen konnte bei zunehmender Masse die mit IV. Zusammenfassung und Ausblick Bindungsverkürzungen und -172- Volumenabnahme verbundene Lanthanoidenkontraktion (Abb. 125) der entsprechenden Elemente beobachtet werden. 88 Y Masse / u 89 90 150 Sm 160 Gd Eu Dy Er Tb 170 SE O S H Yb Ho Tm Lu 180 238 236 234 232 230 Durchschnittliche SE-O-Bindungslänge / pm Abb. 125: Koordination des SE3+-Ions in der Kristallstruktur von SE(S2O7)(HSO4) (links) und Diagramm zur Masse/Volumen Abhängigkeit (rechts) Im sauren Sulfat der Formel Dy(SO4)(HSO4), welches aus einer halbkonzentrierter Ampullenreaktion mit Schwefelsäure und Dy(NO3)3·6H2O im offenen System bei 300 °C erhalten wurde, chelatisierend und koordinieren einzähnig neben Tab. 72: Kristallographische Daten für Dy(SO4)(HSO4) Kristallsystem Raumgruppe Gitterkonstanten angreifende Sulfat-Gruppen auch Hydrogensulfat-Einheiten an das zentrale SE-Ion (Abb. 126). Durch eine Rietveldverfeinerung wurde die bisher nur Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) orthorhombisch P21 (Nr. 62) a = 665,9(1) pm b = 658,88(7) pm c = 679,06(9) pm = 104,79(2)° 288,07(7) ų 2 0,0149; 0,0323 durch pulverdiffraktometrische Messungen bekannte Verbindung Pr(SO4)(HSO4) als isotyp zu Dy(SO4)(HSO4) identifiziert und so die Verbindungsklasse der SE-Sulfat/Hydrogensulfate um noch eine weitere Verbindung erweitert. IV. Zusammenfassung und Ausblick -173- Dy O S H Abb. 126: Koordination des Dy3+-Ions (links) und Kristallstruktur von Dy(SO4)(HSO4) (rechts) Das wasserhaltige Nd3(SO4)4(HSO4)(H2O)2 Umsetzung von halbkonzentrierter Sulfat/Hydrogensulfat wurde aus der Nd(NO3)3·5H2O Schwefelsäure in mit einer geschlossenen Normalglasampulle bei 350 °C Tab. 73: Kristallographische Daten für Nd3(SO4)4(HSO4)(H2O)2 Kristallsystem Raumgruppe Gitterkonstanten erhalten. Die bisher unbekannte Verbindung enthält Selten-Erd-Ionen mit unterschiedlich hoher Koordinationszahl. Neben ein- und zweizähnig Zahl der Formeleinheiten R1, wR2 (I0 > 2 (I0)) monoklin P21/n (Nr. 14) a = 934,95(5) pm b = 873,84(4) pm c = 2025,4(1) pm = 91,995(2)° 1653,8(1) ų 0,0222; 0,0487 koordinierenden Sulfat-Gruppen wurden zwei cis-ständige Wassermoleküle vorgefunden (Abb.127). Die thermische Zersetzung der Verbindung war bei maximaler Heiztemperatur noch nicht abgeschlossen. Dennoch konnte im Pulverdiffraktogramm des Rückstandes das Selten-Erd-Oxid-Sulfat nachgewiesen werden. Nd O S H Abb. 127: Koordination der Nd3+-Ionen: Verzerrtes, dreifach überkapptes trigonales Prisma (links) und leicht verzerrtes quadratisches Antiprisma (rechts) in der Kristallstruktur von Nd 3(SO4)4(HSO4)(H2O)2 IV. Zusammenfassung und Ausblick -174- Abschließend kann festgestellt werden, dass die Reaktionsführung bei erhöhten Temperaturen und Druck als maßgebliche Faktoren zur Synthese neuer Sulfate der Selten-Erd-Elemente angesehen werden kann. Die eingesetzte Schwefeltrioxid-Konzentration nimmt ebenfalls eine Schlüsselrolle ein, wie Abb. 128 zu entnehmen ist. SE2(S2O7)3 0,0 SE(S2O7)(HSO4) SE(HSO4)3 0,5 SE(HSO4)3·H2O 0,1 SE(SO4)(HSO4) 0,4 SE(HSO4)3·4H2O [% ] O 2 H SE(SO4)(HSO4)·4H2O 0,3 SE(HSO4)3·H2SO4·2H2O ] [% 0,3 SO 3 0,2 SE3(SO4)4(HSO4)(H2O)2/ 0,2 SE3(SO4)4(HSO4)·2H2O SE2(SO4)3·H2O 0,4 SE2(SO4)3·2H2O 0,1 SE2(SO4)3·3H2O 0,5 0,0 0,5 0,6 0,7 0,8 2- SO4 [%] 0,9 1,0 SE2(SO4)3·4H2O SE2(SO4)3·5H2O SE2(SO4)3·8H2O SE2(SO4)3·9H2O Abb. 128: Dreiecksdiagramm der Disulfate und sauren Selten-Erd-Sulfate IV. Zusammenfassung und Ausblick -175- Ausblick Mit der Darstellung von zahlreichen neuen Chlorometallaten der Platinoide wurde ein Einblick in die elementübergreifenden Verwandschaftsbeziehungen dieser Gruppe gewonnen. Es gelang in einer Übersicht detailliert Besonderheiten, Übergangsgrenzen, und Eckpfeiler strukturellen Verhaltens aufzuzeigen. DTA/TG-Messungen und Umsetzungen der Chlorometallate bei hohen Temperaturen gaben Aufschluss über das unterschiedliche thermische Verhalten der Verbindungen und über die Eignung als Vorläuferverbindung für Umsetzungen mit Mineralsäuren wie Schwefelsäure zu fungieren. Die Hexachloroosmate und Chlororuthenate eignen sich hierfür denkbar schlecht, da das Platinmetall sich bei hohen Temperaturen als Tetraoxid verflüchtigt. Weitere Versuche die z. B. auf die Synthese komplexer Sulfate zielen, auch aus den Elementen, erscheinen aussichtslos. Hexachloroiridate wurden hingegen erfolgreich umgesetzt, aber auch hier schmälert die Trägheit des Metalls eventuelle Erfolgsaussichten. Generell sollte dieses Reaktionsfeld daher als abgeschlossen angesehen werden, besonders weil keine neuen strukturellen Erkenntnisse bei den Chlorometallaten der Platinmetalle mit komplexen Anionen mehr zu erwarten sind. Lohnenswerter erscheinen weitere Untersuchungen des Rhodiums, welches sowohl in Verbindungen, als auch in elementarer Form eingesetzt werden kann. Wurde das erste binäre Rhodium-Sulfate Rh2(SO4)3(H2O)2 aus einer konz. Schwefelsäure-Lösung erhalten, so ist die Variation der Schwefeltrioxid-Konzentration in wässriger Lösung ein erfolgversprechender Ansatz, um weitere Sulfate mit variablem Wassergehalt herzustellen. Im Bereich der Kronenether-Platinverbindungen sind fast endlose Kombinationen von Reaktionspartnern denkbar. Interessant wären insbesondere Untersuchungen zur Isolierung komplexer Anionen, wie es z. B. in [K+·18C6]2[Pt2(SO4)4(H2O)2]·H2O realisiert wurde. Ebenfalls sind Kronenethermoleküle dafür bekannt als Kristallisationshilfe bei ansonsten eher röntgenamorphen Proben zu fungieren und so Messungen am Einkristall zu ermöglichen. Auch die im Rahmen dieser Arbeit vorgestellten Sulfate der Selten-Erd-Elemente stellen noch nicht den Schlusspunkt der Arbeit auf diesem Gebiet dar. Ist bei den Disulfat- und DisulfatHydrogensulfaten das ganze Spektrum der Selten-Erd-Elemente untersucht worden so eröffnen sich bei den Sulfat-Hydrogensulfaten und insbesondere bei den wasserhaltigen Verbindungen eine Reihe weiterer Möglichkeiten, wie auch den noch unausgefüllten Bereichen des Dreiecksdiagramms zu entnehmen ist. V. Anhang -176- V. Anhang Übersicht Hexachlorometallate der Platinmetalle Verbindung Quelle [La(NO3)2(H2O)6]2[PtCl6]·2H2O S. Schwarzer, Diplomarbeit, Universität Oldenburg, 2007. [Pr(NO3)2(H2O)6]2[PtCl6]·2H2O A. Arndt, Dissertation, Universität Oldenburg, 2007. [Nd(NO3)2(H2O)6]2[PtCl6]·2H2O A. Arndt, Dissertation, Universität Oldenburg, 2007. [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Gd(NO3)(H2O)7][PtCl6] 4H2O A. Arndt, Dissertation, Universität Oldenburg, 2007. [Dy(NO3)(H2O)7][PtCl6] 4H2O A. Arndt, Dissertation, Universität Oldenburg, 2007. [Er(H2O)8][PtCl6]NO3·4H2O A. Arndt, Dissertation, Universität Oldenburg, 2007. [Yb(H2O)8][PtCl6]NO3·4H2O A. Arndt, Dissertation, Universität Oldenburg, 2007. [Y(H2O)8][PtCl6]NO3·4H2O S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [La(NO3)2(H2O)6]2[OsCl6]·2H2O S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Ce(H2O)9][IrCl6]Cl·2H2O S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Ce(NO3)2(H2O)6]2[IrCl6]·2H2O S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Dy(NO3)(H2O)7][IrCl6]∙4H2O A. Kroning, Bachelorarbeit, Universität Oldenburg, 2009. [Dy(H2O)8][IrCl6]∙6H2O A. Kroning, Bachelorarbeit, Universität Oldenburg, 2009. [Eu(NO3)(H2O)7][OsCl6]∙4H2O A. Kroning, Bachelorarbeit, Universität Oldenburg, 2009. [Lu(H2O)8][IrCl6](NO3)∙4H2O A. Kroning, Bachelorarbeit, Universität Oldenburg, 2009. [Pr(H2O)9][Ru2OCl10]Cl2 S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Ce(H2O)9][Ru2OCl10]Cl2 S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Ho(H2O)9][Ru2OCl10]Cl2 S. Schwarzer, Dissertation, Universität Oldenburg, 2010. [Pr(H2O)9][RhCl6]·2H2O G. Graubner, Forschungsarbeit, Universität Oldenburg, 2009. [Dy(H2O)8][RhCl6]·6H2O G. Graubner, Forschungsarbeit, Universität Oldenburg, 2009. V. Anhang -177- Auflistung der isotypen Chlorometallate [La(NO3)2(H2O)6]2[PtCl6]·2H2O a = 697,4 pm, b = 1654,5 pm, c = 1317,7 pm, = 93,966° [La(NO3)2(H2O)6]2[OsCl6]·2H2O a = 692,79 pm, b = 1644,99 pm, c = 1309,76 pm, = 93,831° [Ce(NO3)2(H2O)6]2[IrCl6]·2H2O a = 691,59 pm, b = 1641,57 pm, c = 1306,67 pm, = 93,875° [Pr(NO3)2(H2O)6]2[PtCl6]·2H2O a = 695,5 pm, b = 1652,5 pm, c = 1318,5 pm, = 93,93° [Pr(NO3)2(H2O)6]2[OsCl6]·2H2O a = 692,93 pm, b = 1641,95 pm, c = 1307,92 pm, = 93,87° [Sm(NO3)2(H2O)6]2[PtCl6]·2H2O a = 692,33 pm, b = 1641,35 pm, c = 1296,37 pm, = 93,97° [Gd(NO3)(H2O)7][PtCl6] 4H2O a = 838,72 pm, b = 2131,98 pm, c = 1142,63 pm, = 95,670 [Dy(NO3)(H2O)7][PtCl6] 4H2O a = 838,40 pm, b = 2139,50 pm, c = 1143,10 pm, = 95,698 [Eu(NO3)(H2O)7][OsCl6]∙4H2O a = 672,00 pm, b = 2149,75 pm, c = 732,61 pm, = 106,549° [Dy(NO3)(H2O)7][IrCl6]∙4H2O a = 670,94 pm, b = 2139,04 pm, c = 731,67 pm = 106,905° [Lu(H2O)8][IrCl6]NO3∙4H2O a = 993,66 pm, b = 1018,66 pm, c = 1268,48 pm, α = 111,288°, = 111,502°, γ = 92,325° [Y(H2O)8][PtCl6]NO3·4H2O a = 959,68 pm, b = 1039,11 pm, c = 1287,06 pm, α = 111,006°, = 111,087°, γ = 92,8° [Dy(H2O)8][IrCl6]∙6H2O a = 1175,39 pm, b = 1140,58 pm, c = 1602,8 pm = 103,557° [Dy(H2O)8][RhCl6]·6H2O a = 1174,78 pm, b = 1139,55 pm, c = 1603,61 pm, = 103,622° V. Anhang -178- [Ce(H2O)9]2[Ru2OCl10]Cl2 a = 852,15 pm, b = 2174,77 pm, c = 923,8 pm, = 93,489° [Pr(H2O)9]2[Ru2OCl10]Cl2 a = 849,35 pm, b = 2174,99 pm, c = 925,48 pm, = 93,384° [Pr(H2O)9][RhCl6]·2H2O a = 1905,32 pm, b = 1099,38 pm, c = 975,85 pm, = 118,668° [Ce(H2O)9][IrCl6]Cl·2H2O a = 853,34 pm, b = 935,56 pm, c = 2530,22 pm, β = 90° VI. Literaturverzeichnis -179- VI. Literaturverzeichnis [1] N. Wiberg, E. Wiberg, A. F. Holleman, Lehrbuch der Anorgansichen Chemie, 102. Aufl., Walter de Gruyter, Berlin, New York, 2007, 1723. [2] A. Arndt, M. S. Wickleder, Z. Anorg. Allg. Chem., 2008, 634, 369-372. [3] M. Pley, Dissertation, Universität zu Köln, 2004. [4] J. H. Jones, Platinum Met. Rev., 2002, 44, 3, 94-105. [5] J. Guzman, S. Carrettin, J. C. Fierro-Gonzalez, Y. Hao, B. C. Gates, A. Corma, Angew. Chem., 2005, 117, 4856. [6] M. Pley, M. S. Wickleder, Z. Anorg. Allg. Chem., 2004, 1036-1039. [7] S. N. Shagabutdinova, M. A. Fedotov, A. V. Belyaev, V. D. Il’yashevich, E. I. Pavlova, Russ. J. Coord. Chem., 2008, 34, 12, 930-936. [8] Gmelin Handbook of Inorganic Chemistry, Springer Verlag, Berlin, Heidelberg, New York, 1982, 152-159. [9] G. Brauer, Handbuch der Präparativen Anorganischen Chemie, Ferdinand Enke Verlag, Stuttgart, 1975, 1747. [10] N. Wiberg, E. Wiberg, A. F. Holleman, Lehrbuch der Anorgansichen Chemie, 102. Aufl., Walter de Gruyter, Berlin, New York, 2007, 1703. [11] M. S. Wickleder, Z. Anorg. Allg. Chem., 2000, 626, 1468-1472. [12] J. Douglade, R. Mercier, Acta Cryst. B, 1979, 35, 1062-1067. [13] M. S. Wickleder, Z. Anorg. Allg. Chem., 2001, 627, 1439. [14] M. S. Wickleder, Chem. Rev., 2002, 102, 2011-2087. [15] M. S. Wickleder, Z. Anorg. Allg. Chem., 1998, 624, 1583-1587. [16] http://www.fiz-karlsruhe.de/obtaining_crystal_structure_data.html?&=&L=1. Tagesdatum des Abrufs: 23.05.2010. [17] https://www.ccdc.cam.ac.uk/cgi-bin/catreq.cgi. Tagesdatum des Abrufs: 23.05.2010. [18] W. Massa, Kristallstrukturbestimmung, 5. Aufl., Vieweg + Teubner, Wiesbaden, 2007. [19] H. Krischner, Einführung in die Röntgenfeinstrukturanalyse, 3. Aufl., Vieweg + Teubner, Braunschweig, Wiesbaden, 1987. [20] A. R. West, Grundlagen der Festkörperchemie, 1. Aufl., VCH, Weinheim, New York, Cambridge, Basel, 1992. [21] http://www.synchrotron.org.au/index.php/aussyncbeamlines/macromolecularcrystallography/publications-and-resources. Tagesdatum des Abrufs: 23.05.2010. VI. Literaturverzeichnis [22] -180- http://www.synchrotron.org.au/images/stories/beamline/factsheets/synchrotron-factsheet-px12.pdf. Tagesdatum des Abrufs: 23.05.2010. [23] M. Hesse, H. Meier, B. Zeeh, Spektroskopische Methoden in der organischen Chemie, 6.Aufl., Thieme, Stuttgart, New York, 2002. [24] Stoe & Cie, X-RED 1.22, Darmstadt, 2001. [25] Stoe & Cie, X-SHAPE 1.06, Darmstadt, 1999. [26] Stoe & Cie, X-STEP32 1.06f, Darmstadt, 2000. [27] Stoe & Cie, WIN X-POW 2.20, Darmstadt, 2006. [28] G. Sheldrick, SHELXS-86/-97 u. SHELXL-93/-97, Göttingen, 1997. [29] K. Brandenburg, Diamond 3.2d, Bonn, 2004. [30] A. L. Spek, Platon 1.081, Glasgow, 2005. [31] Thomson Reuters, EndNote X2.0.1, New York, 2008. [32] L. Barbour, X-Seed 2.0, Matieland, 2011. [33] K. Brandenburg, Match! 1.9h, Bonn, 2010. [34] Chemical Abstracts Service, SciFinder Scholar 2007, Columbus, 2007. [35] OriginLab, Origin 8, Northampton, 2007. [36] FIZ Karlsruhe, FindIt 1.4.6, Karlsruhe, 2009. [37] F. Rau, U. Klement, K.-J. Range, Z. Kristallogr., 1995, 210, 684. [38] O. Büchner, Dissertation, Universität Oldenburg, 2005. [39] S. Schwarzer, Diplomarbeit, Universität Oldenburg, 2007. [40] A. Arndt, Dissertation, Universität Oldenburg, 2007. [41] A. Kroning, Bachelorarbeit, Universität Oldenburg, 2009. [42] A. Fischer, Bachelorarbeit, Universität Oldenburg, 2009. [43] G. Graubner, Forschungsarbeit, Universität Oldenburg, 2009. [44] A. Arndt, D. Posavec, S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem. 2008, 634, 431-435. [45] A. Arndt, M. S. Wickleder, Z. Anorg. Allg. Chem., 2006, 632, 2104. [46] M. S. Wickleder, Z. Anorg. Allg. Chem., 1998, 624, 1583-1587. [47] S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem., 2009, Supplement Issue No. 29, 9. [48] A. Kroning, G. Graubner, S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem., 2009, Supplement Issue No. 29, 26. VI. Literaturverzeichnis [49] -181- G. Brauer, Handbuch der Präparativen Anorganischen Chemie, Ferdinand Enke Verlag, Stuttgart, 1975, 1735-1736. [50] B. P. Hay, Inorg. Chem., 1991, 30, 2876. [51] F. A. Cotton, G. Wilkinson, Advanced Inorganic Chemistry, Fifth Edition, John Wiley & Sons, New York, Chichester, Brisbane, Toronto, Singapore, 1988. [52] E. J. Peterson, E. I. Onstott, R. B. v. Dreele, Acta Cryst. B, 1979, 35, 805. [53] J. P. Deloume, R. Faure, G. Thomsas-David, Acta Cryst. B, 1979, 35, 558. [54] G. Wilkinson, Comprehensive Coordination Chemistry, Middle Transition Elements, Pergamon Press, New York, 1987. [55] G. Brauer, Handbuch der Präparativen Anorganischen Chemie, Ferdinand Enke Verlag, Stuttgart, 1975, 1749. [56] C. J. Pedersen, J. Am. Chem. Soc., 1967, 89, 2495. [57] C. J. Pedersen, J. Am. Chem. Soc., 1967, 89, 7017. [58] N. P. Rath, E. M. Holt, J. Chem. Soc., Chem. Commun., 1985, 665. [59] P. C. Junk, New J. Chem., 2008, 32, 762-773. [60] P. C. Junk, J Coord Chem., 2007, 60, 10, 1017-1028. [61] D. Braga, M. Gandolfi, M. Lusi, M. Polito, K. Rubini, F. Grepioni, Cryst. Growth Des., 2007, 7, 5, 919–924. [62] R. Chênevert, D. Chamberland, Can. J. Chem., 1989, 67, 32-36. [63] J. M. Harrington, S. B. Jones, P. H. White, R. D. Hancock, Inorg. Chem., 2004, 2918. [64] X. Hao, S. Parkin, C. P. Brock, Acta Crystallogr. Sect. B, 2005, 61, 675. [65] C. B. Shoemaker, L. V. McAfee, D. P. Shoemaker, C. W. DeKock, Acta Crystallogr., Sect. C: Cryst. Struct. Commun., 1986, 42, 1310. [66] J. P. Behr, P. Dumas, D. Moras, J. Am. Chem. Soc., 1982, 104, 4540. [67] M. Calleja, K. Johnson, W. J. Belcher, J. W. Steed, Inorg. Chem., 2001, 40, 4978. [68] V. S. Sergienko, L. K. Minacheva, N. K. Ashurova, M. A. Porai-Koshits, K. G. Yakubov, V. G. Sakharova, Russ. J. Inorg. Chem. 1991, 36, 381. [69] J. L. Atwood, S. G. Bott, A. W. Coleman, K. D. Robinson, S. B. Whetstone, C. M. Means, J. Am. Chem. Soc., 1987, 109, 8100. [70] J. D. J. Backer-Dirks, J. E. Cooke, A. M. R. Galas, J. S. Ghotra, C. J. Gray, F. A. Hart, M. B. Hursthouse, J. Chem. Soc., Dalton Trans., 1980, 2191. [71] R. D. Rogers, A. N. Rollins, Inorg. Chim. Acta, 1995, 230, 177-183. VI. Literaturverzeichnis [72] -182- D. Braga, M. Gandolfi, M. Lusi, M. Polito, K. Rubini, F. Grepioni, Cryst. Growth Des. 2007, 7, 5, 919-924. [73] G. S. Muraveiskaya, V. S. Orlova, O. N. Evstaf'eva, Zh. Neorg. Khim., 1974, 19, 1030-1035. [74] D. P. Bancroft, F. A. Cotton, L. R. Falvello, S. Han, W. Schwotzer, Inorg. Chim. Acta, 1984, 87, 147. [75] R. D. Rogers, A. N. Rollins, R. D. Etzenhoussr, E. J. Voss, C. B. Bauer, Inorg. Chem., 1993, 32, 3451-3462. [76] M. Delépine, C.R. Hebd. Seances Acad. Sci., 1906, 142, 631, 1525. [77] C. K. JØrgensen, Acta Chem. Scand., 1959, 13, 196. [78] C. K. JØrgensen, L.E.Orgel, Mol. Phys., 1961, 4, 215. [79] M. Ciechanowicz, W. P. Griffith, D. Pawson, A. C. Skapski, J. Chem. Soc. D, 1971, 876. [80] L. D. Boisbaudran, C. R. Hebd. Seances Acad. Sci., 1883, 96, 1336, 1406. [81] A. N. Zhilyaev, T. A. Fomina, P. A. Koz'min, T. B. Larina, M. D. Surazhskaya, I. B. Baranovskii, Russ. J. Inorg. Chem., 1991, 36, 400-405. [82] N. A. Ezerskaya, I. N. Kiseleva, T. A. Fomina, N. Zhilyaev, Russ. J. Inorg. Chem., 1996, 41, 9, 1489-1494. [83] B. N. Figgis, G. B. Robertson, Nature, 1965, 205, 694. [84] D. B. Brown, M. B. Robin, J. D. E. McIntyre, W. F. Peck, Inorg. Chem., 1970, 9, 10, 2315-2320. [85] R. S. Armstrong, J. K. Beattie, S. P. Best, B. W. Skelton, A. H. White, J. Chem. Soc., Dalton Trans., 1983, 9, 1973-1975. [86] L. M. Dikareva, Y. V. Zefirov, A. N. Zhilyaev, I. B. Baranovskii, M. A. Porai-Koshits, Zh. Neorg. Khim., 1987, 32, 64-68, 118-125. [87] F. Krauss, H. Umbach, Z. Anorg. Allg. Chem., 1929, 180, 42-56. [88] Gmelin Handbook of Inorganic Chemistry, Springer Verlag, Berlin, Heidelberg, New York, 1982, 158. [89] http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=159290. Tagesdatum des Abrufs: 23.05.2010. [90] N. Wiberg, E. Wiberg, A. F. Holleman, Lehrbuch der Anorgansichen Chemie, 102. Aufl., Walter de Gruyter, Berlin, New York, 2007, 1696. VI. Literaturverzeichnis [91] -183- G. A. Jeffrey, An Introduction to Hydrogen Bonding, Oxford University Press, Oxford, 1997. [92] D. M. Adams, A. Squire, J. Chem. Soc. A, 1970, 1808. [93] K. Nakamoto, Infrared and Raman Spectra of Inorganic and Coordination Compounds, 3. Aufl., John Wiley & Sons, Inc., New York, 1992. [94] S. D. Ross, Inorganic Infrared and Raman Spectra, Hill Book Company (UK) Ltd, London, 1972, 414. [95] S. D. Ross, Sulphates and other oxy-anions of group VI. In: The Infrared Spectra of Minerals, V.C. Farmer, Miner. Soc. Monogr., 4, 1974, 423-444. [96] J. T. Kloprogge, L. Hickey, L. V. Duong, W. N. Martens, R. L. Frost, Am. Mineral., 2004, 89, 266-272. [97] J. T. Kloprogge, H. Ruan, L. V. Duong, R. L. Frost, Neth. J. Geosci., 2001, 80, 2, 41-47. [98] I. B. Baranovskii, A. N. Zhilyaev, Russ. J. Inorg. Chem., 1984, 28, 1055-1061. [99] W. Prandtl, Z. Anorg. Allg. Chem., 1938, 238, 321. [100] L. Niinistö, Systematics and the Properties of the Lanthanides (Ed.: S. P. Sinha), D. Reidel Publishing Company, Dordrecht, 1983, 125. [101] A. A. Voronkov, N. V. Kadoshnikova, N. V. Mukhtarova, R. K. Rastsvetaev, N. A. Shumyatskaya, V. V. Ilyukhin, Probl. Teor. Kristallokhim. Slozhnykh. Oksidov (Ed.: A. N. Lazarev), Izv. Nauka: Leningrad, 1982, 5. [102] L. Niinistö, P. Saikkonen, P. Sonninen, Rare Earths Mod. Sci. Technol., 1982, 3, 257. [103] S. P. Sirotinkin, V. A. Efremov, L. M. Kovba, A. Prokovskii, N. Kristallografiya, 1977, 22, 1272. [104] S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem., 2009, Supplement Issue No. 29, 9. [105] S. Schwarzer, M. S. Wickleder, NWT Verlag, Conference Proceedings - Terrae Rarae, 2008, ISBN 9783941372009. [106] H. Lynthon, M. R. Truter, J. Chem. Soc., 1960, 5112-5118. [107] S. G. Zhukov, A. Yatsenko, V. V. Chernyshev, V. Trunov, E. Tserkovnaya, O. Antson, J. Hoelsae, P. Baules, H. Schenk, Mater. Res. Bull., 1997, 32, 43-50. [108] A. Simon, H. Wagner, Z. Anorg. Allg. Chem., 1961, 311, 102-109. VII. Danksagung -184- VII. Danksagung Es sei an dieser Stelle all jenen gedankt, die diese Doktorarbeit erst möglich gemacht und mich während der Anfertigung rege unterstützt haben. Als Erstes sei Herr Prof. Dr. Mathias S. Wickleder genannt, dem mein herzlicher und aufrichtiger Dank für die Bereitstellung des interessanten Themas und die hervorragende Betreuung gilt. Besonders möchte ich auch Herrn Prof. Dr. Rüdiger Beckhaus für die freundliche Übernahme des Korreferats danken. Herrn Prof. Dr. Thomas U. Müller danke ich für die freundliche Übernahme des Amtes des Drittprüfers. Herrn Prof. Dr. Peter Junk und Herrn Prof. Dr. Glen Deacon sei gedankt für die herzliche Aufnahme in ihre Arbeitsgruppe an der Monash University in Melbourne, Australien. Der Junk-Deacon Group für die schöne und unvergessliche Zeit. Allen Mitgliedern der Arbeitgruppen Müller und Beckhaus für die gute Zusammenarbeit und die netten Gespräche. Meinen lieben Arbeitskollegen für die gute Arbeitsatmosphäre, die vielen amüsanten Stunden und die entgegengebrachte Hilfsbereitschaft. Insbesondere sei Ulf Betke für die unermüdliche und kompetente Unterstützung bei kristallographischen und chemischen Problemstellungen erwähnt. Dr. Andrea Mietrach für ihre herzliche Art und die gemeinsame Arbeitszeit im ehemaligen Sanitätsraum. Katja Rieß und Dr. Mareike Ahlers für die Durchführung von DTA-Messungen. Christian Logemann und Katja Rieß gilt ein besonderer Dank für das intensive und unermüdliche Korrekturlesen dieser Arbeit. VII. Danksagung -185- Weiterhin möchte ich Herrn Wolfgang Saak und Ulf Betke für die zahlreichen Messungen am Einkristalldiffraktometer danken. Annika Kroning, Gitte Graubner und Annika Fischer sei gedankt für ihren Arbeitseifer und ihre erzielten Ergebnisse während ihrer Bachelor- bzw. Forschungsarbeitszeit. Giuseppe Montana für eine pulverdiffraktometrische Messung. Aron Urbatsch, Dr. Michal Wiecko und Dr. Craig Forsyth für ihre Hilfe bei Einkristallmessungen und Aufbereitung der Daten insbesondere am Australian Synchrotron während meiner Forschungszeit in Australien. Nicht zuletzt bedanke ich mich bei meiner Familie, insbesondere meinen lieben Eltern für die vielfältige Hilfe während meines gesamten Studiums. Und bei meiner Freundin Franziska für das Durchsehen der Arbeit, ihr stetes Interesse an chemischen Themen und ihre Unterstützung in der Endphase meiner Promotionszeit. VIII. Erklärung -186- VIII. Erklärung Hiermit versichere ich, dass die von mir vorgelegte Dissertation selbständig verfasst, die benutzten Quellen und Hilfsmittel vollständig angegeben und die Stellen der Arbeit, einschließlich Tabellen, Daten und Abbildungen, die anderen Werken im Wortlaut oder dem Sinn nach entnommen sind, in jedem Einzelfall als Entlehnung kenntlich gemacht wurden. Aus dieser Dissertation sind die auf den folgenden Seiten genannten Veröffentlichungen hervorgegangen. Die Dissertation hat weder zu Teilen noch in Gänze einer anderen wissenschaftlichen Hochschule zur Begutachtung in einem Promotionsverfahren vorgelegen. Stefan Schwarzer, Oldenburg 27. Mai 2010 VIII. Erklärung -187- Aus der vorliegenden Dissertation sind folgende Veröffentlichungen und Tagungsbeiträge hervorgegangen: Veröffentlichungen: A. Arndt, D. Posavec, S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem., 2008, 634, 431435. S. Schwarzer, M. S. Wickleder, Conferece Proceedings - Terrae Rarae 2008, NWT Verlag, 2008, ISBN 978-3-941372-00-9. S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem., 2009, Supplement Issue No. 29, 9. A. Kroning, G. Graubner, S. Schwarzer, M. S. Wickleder, Z. Anorg. Allg. Chem., 2009, Supplement Issue No. 29, 26. Tagungsbeiträge: Titel des Posterbeitrags: “The reaction of lanthanide chloroplatinates with sulfuric acid”. 10.03 - 13.03.2007, ECSSC XI, The 11th European Conference on Solid State Chemistry, Caen, Frankreich und 08.04 - 12.04.2008, AGICHEM 2008 Cardiff, England. Titel des Posterbeitrags: “Reaktion von Lanthanchloroplatinaten mit Schwefelsäure” 03.06 - 06.03.2008, 16. Jahrestagung der Deutschen Gesellschaft für Kristallographie, Erlangen. Titel des Posterbeitrags: “Reaktionen von Hexachlorometallaten der Platinmetalle mit konzentrierten Mineralsäuren” 25.09 - 26.09.2008, 11. Norddeutsches Doktorandenkolloquium der anorganisch-chemischen Institute, Braunschweig. Titel des Posterbeitrags: “Pr2(S2O7)3: The first anhydrous disulfate of a rare-earth element” 04.12 - 6.12.2008, XXI. Tage der Seltenen Erden - Terrae Rarae 2008, Bochum. Titel des Posterbeitrags: “Hexachlorometallate der Platinmetalle mit Selten-Erd-Ionen” 09.03. - 10.03.2009, 17. Jahrestagung der Deutschen Gesellschaft für Kristallographie, Hannover. IX. Lebenslauf -188- IX. Lebenslauf Lebenslauf Persönliche Daten Name: Stefan Schwarzer Geburtsdatum: 26.09.1981 Geburtsort: Vechta Familienstand: ledig Schulbildung 1988-1992 Grundschule Liobaschule-Vechta 1992-1994 Orientierungsstufe Vechta-Süd 1994-1998 Realschule Geschwister-Scholl-Schule-Vechta 1998-2001 Gymnasium Antonianum-Vechta 06/2001 Abitur Akademische Laufbahn 10/2002 Immatrikulation an der Carl von Ossietzky Universität Oldenburg im Fach Diplom Chemie 10/2007 Diplom (Note: sehr gut) Fachrichtung Anorganische Chemie Thema der Diplomarbeit: Lanthanchloroplatinate und ihr Einsatz zur Synthese von Lanthan-Platin(III)-Sulfaten 12/2007 Beginn der Promotion Fachrichtung Anorganische Chemie (Abschluss voraussichtlich im Juni 2010) 09-12/2009 Monash University Melbourne, Australien Forschungsaufenthalt IX. Lebenslauf -189- Berufliche Tätigkeiten 05-08/2001 08/200308/2007 seit 12/2007 Aushilftstätigkeit bei der Firma M.O.L. Vechta (Elastomertechnik) Studentische Hilfskraft im Bereich Studium und Lehre; Evaluation und Akkreditierung von Studiengängen der Fakultät V (Mathematik und Naturwissenschaften) Wissenschaftlicher Mitarbeiter am Institut für Reine und Angewandte Chemie der Carl von Ossietzky Universität Oldenburg (AG Wickleder) Stipendium 01-12/2009 Promotionsstipendium der Heinz Neumüller Stiftung Ehrenamtliche Tätigkeiten 2003-2007 08/2003 07-08/2006 08/2007 Fachschaftsarbeit an der Carl von Ossietzky Universität in Oldenburg Leitung eines mehrwöchigen Ferienlagers der Firma Höffmann Reisen in Griechenland Leitung und Betreuung von drei wissenschaftlichen Ferienlagern der Firma „Erlebnis-Wissenschaft“ im Bereich Computer und Physik. Leitung und Betreuung von zwei wissenschaftlichen Ferienlagern der Firma „Erlebnis-Wissenschaft“ im Bereich Chemie, Physik und Biologie Auslandsaufenthalt 08/200108/2002 Ersatzdienst im Pflegebereich Beit Avot Carmel Michans (Altenwohnstätte) in Haifa, Israel.