Zink-Luft Batterie
Werbung

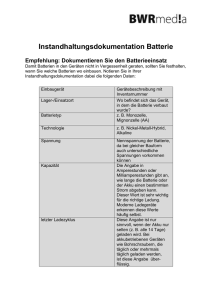
Die Zink-Luft Batterie Allgemeines: - eine Zink-Luft Batterie besteht, wie jede galvanische Zelle (Erzeugung von Strom durch Redoxreaktion), aus einer Kathode (Reduktion) und einer Anode (Oxidation) - Zink bildet in diesem Fall den Minuspol (Lösungsdruck) und Sauerstoff (welchen wir aus der Luft bekommen) den Pluspol (Abscheidungsdruck) - als Elektrolyt dient eine Kalilauge (wässrige Lösung von Kaliumhydroxid, sehr strake Base) Wo finden wir die Zink-Luft Batterie im Alltag? - eine Knopfbatterie (hohe Energiedichte, annähernd waagerechte Entladungskurve) - Stromquelle für Digitaluhren, Taschenrechner und Hörgeräte - auch für Langzeitanwendungen z.B. Weidezaungeräte oder Baustellenbeleuchtung - die Zink-Luft Batterie ist eine besondere Form der Knopfzelle - nach der Aktivierung sollte sie innerhalb von ca. 4 Wochen aufgebraucht werden - die maximale Spannung der Zink-Luft Batterie beträgt ca. 1,65 Volt - es handelt sich bei der Zink-Luft Batterie um eine Primärzelle (=nicht wieder aufladbar) Protokoll: Materialien: - verdünnte Kalilauge - Zinkblech - Kohlestab oder Kupferstab - Strommessgerät - Becherglas - Motor - Schutzbrille - 2 Elektrokabel Durchführung: Wir füllen die Kalilauge in das Becherglas. Danach schließen wir das Zinkblech und den Kohlestab/Kupferstab, mit Hilfe der zwei Elektrokabel, an das Strommessgerät an und tauchen Zinkblech und Kohlestab/Kupferstab in die Kalilauge (ohne, dass sich die Beiden berühren, sonst gibt es einen Kurzschluss). Nun lesen wir die Voltzahl ab. Anschließend schließen wir die beiden Metalle an einen Motor an und schauen was passiert. Beobachtung: Das Wasser fängt nicht an zu sprudeln,es findet keine Farbveränderung statt und die Metalle fangen auch nicht an sich aufzulösen. Jedoch können wir eine Voltzahl von 1,4 V ablesen. Nachdem wir die Metalle an den Motor geschlossen hatten, konnten wir feststellen, dass sich dieser dreht. Sobald man eines der beiden Metalle aus der Kalilauge heraus nimmt, läuft der Motor nicht mehr. Erklärung: Es wird eine Voltzahl von 1,4 V angezeigt. Diese Spannung (Entladespannung) wird aufgrund einer Zink-Sauerstoff Reaktion erzeugt. Es finden Lade-/ Entladevorgänge statt, in dieser Batterie handelt es sich um eine Sauerstoffreduktion und eine Zinkoxidation. Dabei werden Zink-Ionen und Hydroxid-Ionen frei, die miteinander reagieren. Ionen sind die Träger der elektrischen Ladung. Es findet eine Redoxreaktion statt, in der die freiwerdende Energie elektrochemisch genutzt wird. Der Motor dreht sich nur, wenn sich beide Metalle im Wasser befinden, da der Stromkreis sonst unterbrochen ist. Unser Kohlestab/Kupferstab dient bei diesem Versuch als leitendes Trägermaterial oder auch als Katalysator (=ein Stoff, der die Reaktionsgeschwindigkeit einer chemischen Reaktion beeinflusst, ohne dabei selbst verbraucht zu werden). Reaktionsgleichung: ! Oxidation (Anode) Elektronenabgabe, Lösungsdruck ! Reduktion (Kathode) Redoxreaktion ! Elektronenaufnahme, Abscheidungsdruck Referat von: Paula, Nike, Teresa, Lilli, Otto, Lennard, Moritz und Juliane