Galvanische Elemente - BFH
Werbung

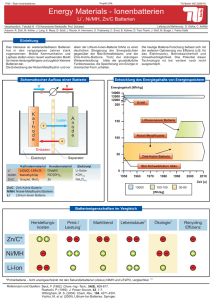
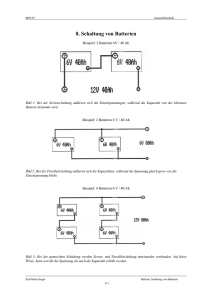
BFH-TI Automobiltechnik 14. Galvanische Elemente Abbildung 1: Versuch: Ein Kupfer und ein Aluminiumblech werden in Leitungswasser getaucht. Dabei entsteht eine Spannung von etwa 0,5 V. Zwei verschiedene Metalle erzeugen in einem Elektrolyt eine Spannung → galvanisches Element. Galvanische Elemente wandeln chemische Energie in elektrische Energie um. Sie bestehen aus zwei verschiedenen Metallen in einer oder zwei elektrolytischen Lösungen. Die Quellenspannung ist abhängig vom Elektrodenmaterial und vom Elektrolyt. Dabei handelt es sich um exotherme Reaktionen, das heisst, sie laufen von selbst ab und dabei wird Energie freigesetzt. Diese Reaktion wird vor allem durch die unterschiedlichen Normalpotentiale der Metalle verursacht. Man ordnet diese Werte auch unter dem Begriff "elektrochemische Spannungsreihe". Diese Tabelle [1] gilt ebenso wie diejenige der elektrochemischen Spannungsreihe, nur für genau definierte Standartbedingungen. In Wirklichkeit spielen viele andere Faktoren auch eine wesentliche Rolle. So vor allem die bei der Oxydation entstehende Schicht, welche sich vielleicht von der Elektrode ablöst oder eben haften bleibt. Im ersten Fall wird die Elektrode mit der Zeit aufgelöst (Auslaufen der Trockenbatterie). Im zweiten Fall kann der Stromfluss gehemmt werden oder es bildet sich mit der Oxydschicht ein zusätzliches Element. Die dabei entstehende Spannung nennt man Polarisationsspannung. Sie wirkt der eigentlichen Zellenspannung entgegen. Aus diesen Ueberlegungen folgt, dass die Bereitstellung chemischer Energiespeicher wesentlich schwieriger ist, als auf den ersten Blick angenommen wird. Abbildung 2: Normalpotenziale der Metalle Karl Meier-Engel Batterie; Galvanische Elemente 14-1 BFH-TI Automobiltechnik Das Leclanché-Element [2] Die wohl bekannteste und verbreitetste Primärzelle ist das Leclanché-Element: Anode (Minus-Pol): Kathode (Pluspol): und Depolarisator Elektrolyt: Zellenspannung: Zink Braunstein MnO2 (Manganoxyd) Salmiak → Ammoniumchloridlösung NH4Cl 1,5 V Der Zinkbecher oxydiert (Oxydation = Elektronenabgabe), gibt positive Ionen (Zn2+) an den Elektrolyten ab und wird negativ. Dafür wandern positive Wasserstoffionen (H+) vom Elektrolyten zur Kathode und geben dort ihre Ladung ab, werden also reduziert (Reduktion = Elektronenaufnahme). Der Wasserstoff verbindet sich chemisch mit dem Manganoxyd. Der zentrale Kohlestab wirkt als Leiter. Abbildung 3. Aufbau des Leclanché-Element Abbildung 4: Entladekennlinien verschiedener Zellen Karl Meier-Engel Batterie; Galvanische Elemente 14-2 BFH-TI Automobiltechnik Zink/Luft-Batterie [3] Eine Primärbatterie mit den Elementen Zink und Luft wird in Deutschland für Elektrofahrzeuge erprobt. Diese Batterie hat eine Energiedichte von 180 Wh/kg. Bestechend an dieser Batterie ist dabei, dass ein Reaktionspartner der Luft entnommen wird. Bei der deutschen Post untersucht man den Einsatz dieser Batterie in Fahrzeugen. Nach der Entladung muss die Batterie ersetzt werden. Das Zink wird in einer zentralen Anlage regeneriert und zu neuen Platten verarbeitet. Elektrochemische Korrosion Ueberall wo sich zwei verschiedene Metalle berühren, wird beim Kontakt mit einem Elektrolyt (Wasser) ein galvanisches Element entstehen. Dabei löst sich das unedlere Metall auf, während am edleren Wasserstoff und Hydroxidionen reduziert werden. Auf Grund dieser Erkenntnisse werden beim Automobilbau besonders korrosionsgefährdete Eisenbleche verzinkt. Da Zink unedler ist, das heisst gegenüber Eisen ein negatives Potential hat, löst es sich bei Verletzungen der Schutzschicht auf anstelle des Eisens. In besonderen Fällen werden Magnesiumstäbe als sogenannte Opferelektroden eingesetzt. Literaturverzeichnis [1] [2] [3] BOSCH: Kraftfahrtechnisches Taschenbuch, VDI-Verlag, 22. Auflage, ISBN 3-18-419122-2 Europa-Lehrmittel Nr. 30138: Fachkunde Elektrotechnik 29. Isata Conference: Electric Fuel Limited, Israel, Status of programs using the electric fuel zinc-air battery system, Florence 1996 Karl Meier-Engel Batterie; Galvanische Elemente 14-3