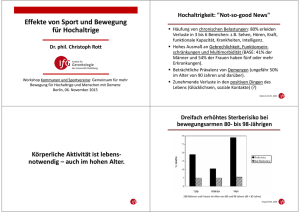
Effekte eines aeroben Ausdauertrainings
Werbung

Aus dem Institut für Rehabilitation und Behindertensport der Deutschen Sporthochschule Köln Geschäftsführender Leiter: Universitätsprofessor Dr. Sportwiss. K. Schüle ____________________________________________________________ Autonome Dysregulation bei Patienten mit Angst- und somatoformen Störungen: Effekte eines aeroben Ausdauertrainings Von der Deutschen Sporthochschule Köln zur Erlangung des akademischen Grades Doktor der Sportwissenschaften genehmigte Dissertation vorgelegt von Frauke Brauer aus Dannenberg Köln 2005 Vorsitzende des Promotionsausschusses: Prof. Dr. I. Hartmann-Tews 1. Berichterstatter: Prof. Dr. K. Schüle 2. Berichterstatter: Prof. Dr. H. Rüddel Datum des Rigorosums: 10. Februar 2006 Erklärung Hiermit versichere ich an Eides Statt, dass ich diese Arbeit selbständig und nur unter Benutzung der angegebenen Quellen verfasst habe. Wörtlich übernommene Textstellen, auch Einzelsätze oder Teile davon, sind als Zitat kenntlich gemacht worden. Köln, im September 2005 Inhaltsverzeichnis Abkürzungsverzeichnis 1 Einleitung 1 2 Störungsbilder 3 2.1 Epidemiologie 3 2.1.2 Diagnose-Kriterien 6 2.1.3 Störungsbild nach ICF 7 2.1.3.1 Schädigungen der Körperstrukturen und Körperfunktionen 2.1.3.2 Beeinträchtigungen der Aktivitäten 10 2.1.3.3 Beeinträchtigungen der Partizipation 11 2.1.3.4 Sporttherapie als fördernder Kontextfaktor 11 Somatoforme Störungen 8 12 2.2.1 Epidemiologie 12 2.2.2 Diagnose-Kriterien 14 2.2.3 Störungsbild nach ICF 15 2.2.3.1 Schädigungen der Körperstrukturen und Körperfunktionen 16 2.2.3.2 Beeinträchtigungen der Aktivitäten 17 2.2.3.3 Beeinträchtigungen der Partizipation 18 2.2.3.4 Sporttherapie als fördernder Kontextfaktor 19 Autonome Regulation 20 3.1 Physiologische Grundlagen 20 3.2 Indices autonomer kardiovaskulärer Regulation 25 3.2.1 Herzratenvariabilität 25 3.2.2 Baroreflexsensitivität 28 3.2.3 Kardiovaskuläre Reaktivität 30 3.3 4 3 2.1.1 2.2 3 Angststörungen Autonome Dysregulation 31 3.3.1 Autonome Dysregulation bei Angststörungen 32 3.3.2 Autonome Dysregulation bei somatoformen Störungen 35 Ausdauerleistungsfähigkeit 38 4.1 Definition Ausdauerleistungsfähigkeit 38 4.2 Ausdauertraining 39 4.3 Effekte von Ausdauertraining 40 4.3.1 Effekte auf die Baroreflexsensitivität und Herzratenvariabilität 41 4.3.2 Effekte auf die kardiovaskuläre Reaktivität 55 4.3.3 Effekte bei Angststörungen 60 4.3.4 Effekte bei somatoformen Störungen 64 5 Fragestellung und Hypothesen 70 6 Methodik 72 6.1 Behandlungskonzept der Klinik 72 6.2 Stichprobe der Untersuchung 73 6.3 Kontrollvariablen 79 6.4 Erhebung der physiologischen Parameter 80 6.4.1 Elektrokardiogramm 80 6.4.1.2 Blutdruck 81 6.4.1.3 Atemfrequenz 82 Indices der autonomen Regulation 82 6.4.2.1 Spektralanalyse 82 6.4.2.2 Baroreflexsensitivität 84 6.4.3 Untersuchungsbedingungen 86 6.4.3.1 Ruhephase 86 6.4.3.2 Belastungsphase 86 Messung der aeroben Ausdauerleistungsfähigkeit 87 6.5.1 Bestimmung der Laktatkonzentration 87 6.5.2 Messung der Herzfrequenzen 88 6.5.3 Vergleichswerte für die Ausdauerleistungsfähigkeit 88 6.6 Erhebung der psychometrischen Parameter 89 6.6.1 Symptom Checklist SCL90-R 89 6.6.2 Fragebogen zum Gesundheitszustand SF-36 90 6.6.3 Hospital Anxiety and Depression Scale HADS 92 6.6.4 Fragebogen zur Beurteilung der Rehabilitation FBReha 93 6.7 7 80 6.4.1.1 6.4.2 6.5 Abgeleitete Parameter Erhebung des Aktivitätsverhaltens mit dem Freiburger Fragebogen zur körperlichen Aktivität FFKA 94 6.8 Intervention Ausdauertraining 95 6.9 Untersuchungsdurchführung 96 6.10 Untersuchungsauswertung 98 Ergebnisse 101 7.1 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der Kontrollvariablen 7.2 101 Vergleich der Experimental- und Kontrollgruppe hinsichtlich ihres Aktivitätsverhaltens 104 7.2.1 Körperliche Aktivität 104 7.2.2 Sportliche Aktivität 106 7.3 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der Ausdauerleistungsfähigkeit, Überprüfen der Intervention 108 7.3.1 Maximale Leistungen 108 7.3.2 Herzfrequenzen bei definierten Leistungsstufen 111 7.3.3 Laktatkonzentrationen bei definierten Leistungsstufen 112 7.4 Vergleich der Gruppen hinsichtlich der Indices der autonomen kardiovaskulären Regulation 7.4.1 Vergleich der beeinträchtigten Gruppen 114 114 7.4.1.1 Herzratenvariabilität im gesamten Frequenzspektrum 114 7.4.1.2 Herzratenvariabilität im High Frequency-Band 115 7.4.1.3 Herzratenvariabilität im Mid Frequency-Band 117 7.4.1.4 Herzratenvariabilität im Respiratorischen Band 118 7.4.1.5 Baroreflexsensitivität 119 7.4.2 Veränderungsprüfung der unbeeinträchtigten Gruppen 121 7.4.2.1 Herzratenvariabilität im gesamten Frequenzspektrum 121 7.4.2.2 Herzratenvariabilität im High Frequency-Band 122 7.4.2.3 Herzratenvariabilität im Mid Frequency-Band 122 7.4.2.4 Herzratenvariabilität im Respiratorischen Band 123 7.4.2.5 Baroreflexsensitivität 124 7.4.3 Störungsspezifischer Vergleich in den beeinträchtigten und den unbeeinträchtigten Gruppen hinsichtlich der autonomen Regulation 126 7.5 7.4.3.1 Herzratenvariabilität im gesamten Frequenzspektrum 126 7.4.3.2 Herzratenvariabilität im High frequency-Band 127 7.4.3.3 Herzratenvariabilität im Mid frequency-Band 129 7.4.3.4 Herzratenvariabilität im Respiratorischen Band 130 7.4.3.5 Baroreflexsensitivität 131 Vergleich der Experimental- und Kontrollgruppe hinsichtlich des subjektiv eingeschätzten Rehabilitationserfolges 132 7.6 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der psychometrischen Parameter 7.6.1 Symptom Checklist SCL90-R 133 7.6.1.1 Die neun Skalen 133 7.6.1.2 Die globalen Kennwerte 135 7.6.2 Fragebogen zum Gesundheitszustand SF-36 137 7.6.3 Hospital Anxiety and Depression Scale HADS-D 140 7.6.3.1 Angstskala 140 7.6.3.2 Depressionsskala 142 7.7 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der kardiovaskulären Stress-Reaktivität 144 7.7.1 Herzratenvariabilität im gesamten Frequenzspektrum 144 7.7.2 Herzratenvariabilität im High Frequency-Band 145 7.7.3 Herzratenvariabilität im Mid Frequency-Band 146 7.7.4 Herzratenvariabilität im Respiratorischen Band 147 7.7.5 Baroreflexsensitivität 147 7.8 Prüfung des Zusammenhanges zwischen sportlicher Aktivität und den kardiovaskulären Parametern 8 133 149 7.8.1 Kardiovaskuläre Parameter in der Ruhephase 149 7.8.2 Kardiovaskuläre Parameter in der Belastungsphase 150 7.8.3 Kardiovaskuläre Parameter als Stress-Reaktivitätswerte 150 Diskussion 152 8.1 Interventionseffekte 152 8.2 Kardiovaskuläre Parameter 154 8.3 Subjektiv eingeschätzter Rehabilitationserfolg 158 8.4 Psychometrische Parameter 158 8.5 Kardiovaskuläre Stress-Reaktivität 160 8.6 Ausblick 162 9 Zusammenfassung 164 10 Literatur 168 Danksagung 191 Lebenslauf 192 Anhang 193 Verzeichnis der Abkürzungen A Angststörung AD Arterieller Blutdruck AG Aktiengesellschaft Aufl. Auflage AvgRR Abstand aller RR-Intervalle im gewählten Zeitbereich B Belastung BD Blutdruck BDI Beck-Depressions-Inventar BMI Körpermassenindex (Body-Mass-Index) BR arterielle Barorezeptoren BRD Bundesrepublik Deutschland BRS Baroreflexsensitivität bzw. beziehungsweise CARSPAN Cardiovascular Signal Analysis cm Zentimeter CR Chemorezeptoren d.h. das heißt diastol. diastolisch DSM-III-R Diagnostisches und Statistisches Manual psychischer Störungen durchschnittl. durchschnittlich ECA-Studie Epidemiological Catchment Area Study EDSP-Studie Early Development Stages of Psychopathology-Studie EG Experimentalgruppe EG dys Experimentalgruppe mit autonomer Dysfunktion EG norm Experimentalgruppe mit unauffälliger autonomer Regulation EKG Elektrokardiogramm EMG Elektromyogramm Ergom. Ergometrische Belastungsuntersuchung et al. und andere (et altera) etc. und so weiter (et cetera) f. folgende FFKA Freiburger Fragebogen zur körperlichen Aktivität Finapes FINger Arterial PRESsure geb. geboren GmbH Gesellschaft mit beschränkter Haftung GSI Grundsätzliche psychische Belastung h Stunde (hour) HADS Hospital Anxiety and Depression Scale HF High Frequency HMV Herzminutenvolumen HR Herzrate HRmax Maximale Herzrate HRRuhe Herzrate in Ruhe Hrsg. Herausgeber HRV Herzratenvariabilität Hz Hertz IBI Interbeatintervall ICD-10 Internationale Klassifikation psychischer Störungen ICF Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit insulinpflicht. insulinpflichtig J. Jahre Jr. Junior kg Kilogramm KG Kontrollgruppe KG dys Kontrollgruppe mit autonomer Dysfunktion KG norm Kontrollgruppe mit unauffälliger autonomer Regulation kg/m² Kilogramm pro Quadratmeter KHK Koronare Herzkrankheit km Kilometer körperl. körperlich LF Low Frequency LF% Prozentualer LF-Anteil am Gesamtspektrum LPR Low pressure-Rezeptoren M Arithmetisches Mittel männl. männlich MFS Münchner 7-Jahres-Follow-up-Studie mg Milligramm min Minute mmHg Millimeter Quecksilbersäule mmol/l Millimol pro Liter ms Millisekunden n Stichprobengröße n.s. nicht signifikant n.u. normalisierte Einheit NG Gruppe der Nichttrainierten nm Nanometer o.J. ohne Jahresangabe p Wahrscheinlichkeit pa arterieller Gasdruck pNN50 Prozentsatz aufeinander folgender RR-Intervalle, die mehr als 50 ms voneinander abweichen POD Peroxidase PSDI Stress-Index der Beschwerden PST Anzahl der Symptome mit vorliegender Belastung PWC170 Leistung bei einer Herzfrequenz von 170 S/min (Physical Work Capacity) r Korrelationskoeffizient der Stichprobe R Ruhe rMSSD Quadratwurzel des quadrierten Mittelwertes der Summe aller Differenzen sukzessiver RR-Intervalle RR-Intervall Abstand zwischen zwei Herzschlägen RRSD Standardabweichung aller RR-Intervalle RSA Respiratorische Sinusarrhythmie S Somatoforme Störung s. siehe S. Seite S/min Schläge pro Minute s.o. siehe oben Schlagnr. Schlagnummer SCL90-R Symptom-Checkliste SD Standardabweichung SD1 Zeitbereichsparameter für die Kurzzeitvariabilität SD2 Zeitbereichsparameter für die Langzeitvariabilität SDNN Standardabweichung aller RR-Intervalle SF-36 Fragebogen zum Allgemeinen Gesundheitszustand SNRI Serotonin-Noradrenalin Reuptake Hemmer SSRI Selektive Serotonin Reuptake Hemmer St. Sankt Suppl. Supplement SV Schlagvolumen sympath. sympathisch systol. systolisch T Messzeitpunkt TACOS-Studie Transitions in Alcohol Consumption and Smoking-Studie tägl. täglich Task Force Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology TG Gruppe der Trainierten TPR peripherer Gesamtwiderstand Trizykl. Antidepr. Trizyklische Antidepressiva u.a. unter anderem U/min Umdrehungen pro Minute unveröff. unveröffentlichte USA Vereinigte Staaten von Amerika (United States of America) v.a. vor allem vgl. vergleiche VK venöse Kapazität VLF Very Low Frequency VO2max Maximale Sauerstoffaufnahme VR venöser Rückfluss vs. gegenüber (versus) W Watt weibl. weiblich WHO Weltgesundheitsorganisation (World Health Organization) wöchentl. wöchentlich z.B. zum Beispiel Einleitung 1 Einleitung Psychische und psychosomatische Störungen sind weit verbreitete Formen von Erkrankungen, die mit einer starken, oft dauerhaften Einschränkung der Lebensführung für die Betroffenen verbunden sind. Da die Behandlung und Folgen der Störungen zugleich sehr kostenintensiv sind, stellen sie eine große Belastung für das Gesundheitssystem dar (WITTCHEN, MÜLLER, PFISTER, WINTER & SCHMIDTKUNZ, 1999). Zwei klinisch problematische und besonders gefährdete Patientengruppen stellen Patienten1 mit Angst- und somatoformen Störungen dar. Häufig stehen kardiovaskuläre Symptome wie Herzrasen, Atemnot oder Schwindel im Mittelpunkt der Erkrankung. Nach den gebräuchlichen Diagnoserichtlinien dürfen organ-pathologische Befunde zur Diagnosestellung beider Störungsformen nicht vorhanden sein bzw. nicht das Ausmaß der beklagten Symptomatik erklären. Neuere Untersuchungen weisen allerdings darauf hin, dass zumindest bei einem bedeutenden Anteil der Betroffenen gestörte autonome Regulationsprozesse vorliegen (LAEDERACH-HOFMANN, MUSSGAY, WILDE & RÜDDEL, 2002; YERAGANI et al., 1998). Regelmäßige körperliche Aktivität führt präventiv bei Gesunden nachgewiesenermaßen zu einer Reihe positiver Effekte wie die Reduktion der kardiovaskulären und gesamten Mortalität, ein verbessertes Lipidmuster, Senkung des Erkrankungsrisikos bestimmter Karzinomarten, große Durchblutungssteigerungen im Gehirn mit geminderter Schmerzintensität, gesteigertem Wohlbefinden, Reduktion von Angst- und depressiver Symptomatik sowie verbesserten kognitiven Prozessen auch im Sinne reduzierter Alterungsvorgänge im Gehirn (HOLLMANN & LÖLLGEN, 2002; HOLLMANN, STRÜDER & TAGARAKIS, 2003). Auch im Zusammenhang zahlreicher bestehender Erkrankungen ist die Wirksamkeit körperlicher Aktivität inzwischen gut belegt wie beispielsweise die sekundär-präventiven Effekte bei einer eingeschränkten Glucosetoleranz Übergewichtiger, bei koronarer Herzkrankheit (s. HALLE, BERG & HASENFUSS, 2003) oder bei bestehender Angststörung (BROOCKS, 2000, 86). Es gibt Hinweise darauf, dass ein regelmäßiges Training auch die autonome Regulation verbessern kann (MCDONALD, SANFILIPPO & SAVARD, 1993). Die Ergebnisse wurden vor allem mithilfe gesunder Probanden, in geringerem Umfang aber auch mit klinischen Stich1 An der vorliegenden Studie nahmen sowohl Frauen als auch Männer teil. Zugunsten einer besseren Lesbarkeit wird in dieser Arbeit die männliche Sprachform bei Personenbezeichnungen verwendet. 1 Einleitung proben gewonnen. Über die notwendige Indikation und Dosierung von körperlicher Aktivität zum Erreichen bestimmter Effekte, d.h. welche Art von körperlicher Bewegung mit welcher Frequenz, Dauer, Intensität und bei welcher Störung durchgeführt werden muss, gibt es vor allem bezüglich psychischer und psychosomatischer Störungen keine einheitlichen Richtlinien. Bei Patienten mit einer Angststörung oder einer somatoformen Störung entwickelt sich häufig ein übersteigertes Schonverhalten mit zunehmender Inaktivität, das zu einer stark eingeschränkten körperlichen Leistungsfähigkeit führt (BROOKS et al., 1997; RIEF & HILLER, 1998, 63), die wiederum im Zusammenhang mit einer autonomen Dysfunktion gesehen wird. Bisher sind mögliche Effekte eines Ausdauertrainings auf die autonome Regulation bei Patienten dieser Störungsgruppen nicht bekannt. In der vorliegenden Arbeit wird erstmals untersucht, ob sich bei Patienten mit einer Angst- bzw. somatoformen Störung die autonome Regulation durch gezielte körperliche Aktivität verbessern lässt und damit eine Besserung der Symptomatik erzielt werden kann. Zunächst werden die beiden Störungsbilder beschrieben, die autonomen Regulationsprozesse dargestellt sowie eine Übersicht der in der Literatur beschriebenen Effekte eines Ausdauertrainings auf die autonome Regulation und auf die beiden Störungsbilder vorgenommen. Anschließend wird die durchgeführte Untersuchung mit den Hypothesen und der Methodik vorgestellt. Die dargestellten Untersuchungsergebnisse werden anhand der aufgeführten Studienergebnisse diskutiert. Es soll geprüft werden, ob ein aerobes Grundlagenausdauertraining, das nach präventiv-medizinischen Gesichtspunkten konzipiert ist, die Behandlung von Patienten mit Angst- und somatoformen Störungen erweitern und verbessern kann. Die Untersuchung wurde als Projekt im Rahmen des Förderschwerpunktes Rehabilitationswissenschaften im Forschungsverbund Freiburg/Bad Säckingen durch den Verband Deutscher Rentenversicherungsträger sowie das Bundesministerium für Forschung und Technologie unterstützt. 2 Störungsbilder 2 Störungsbilder In die Untersuchung einbezogen wurden Patienten mit einer Angst- bzw. somatoformen Störung, die von einem erfahrenen Kliniker zu Beginn des Klinikaufenthaltes anhand der International Classification of Diseases ICD-10 (DILLING, MOMBOUR & SCHMIDT, 1993) diagnostiziert wurde. Die ICD-10 stellt das derzeit gültige Klassifikationssystem im Rahmen der psychosomatischen Rehabilitationsbehandlung dar. Die Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit (ICF), im Mai 2001 von der WHO verabschiedet, rückt mit den Begriffen der Aktivität, Teilhabe und Kontextfaktoren die Auswirkungen von Schädigungen bestimmter Funktionen und Strukturen in den Mittelpunkt. Da es für den Bereich der psychischen und psychosomatischen Störungen noch keine Anwendungshilfen zur Umsetzung der allgemeinen Rahmenrichtlinien gibt (vgl. SCHUNTERMANN, 2003), stellen die ICF in ihrer vorläufigen Fassung (DEUTSCHES INSTITUT FÜR MEDIZINISCHE DOKUMENTATION, 2004) sowie die Rahmenempfehlungen zur ambulanten Rehabilitation bei psychischen und psychosomatischen Erkrankungen (BUNDESARBEITSGEMEINSCHAFT FÜR REHABILITATION, 2003) lediglich eine Orientierung zur Beschreibung der beiden Stö- rungsbilder dar, die im Folgenden vorgestellt werden. 2.1 Angststörungen Eine häufige Form psychischer Störungen stellen die Angststörungen dar. Sie werden anhand von epidemiologischen Daten, Kriterien zur Diagnostik sowie einer Einordnung in die ICF – Rahmenrichtlinien beschrieben. 2.1.1 Epidemiologie Epidemiologische Untersuchungen weisen auf eine weite Verbreitung von Angststörungen in der deutschen Allgemeinbevölkerung hin. Zwei repräsentative Befragungen mittels standardisierter Erhebungsinstrumente ergaben eine Punktprävalenz von rund 9%. Demnach wiesen in einer Zusatzauswertung des Bundesgesundheitssurveys 1998 8,87% der 18-65jährigen Deutschen im Zeitraum der letzten vier Wochen eine Angststörung auf, wobei es keinen Unterschied zwischen den alten und neuen Bundesländern gab (WITTCHEN et al., 1999). In der Dresdner Angststudie (MARGRAF & POLDRACK, 2000) wurde eine Punktprävalenzrate von 8,8% für die gesamtdeutsche Bevölkerung, bezogen auf behandlungsrelevante Angstsyndrome, erfasst durch das 3 Störungsbilder Beck-Angst-Inventar, ermittelt. Der Münchner 7-Jahres-Follow-up-Studie zufolge entwickeln 13,9% der deutschen Allgemeinbevölkerung im Verlauf ihres Lebens eine Angststörung. Die Häufigkeitsangaben entsprechen weitgehend den Ergebnissen US-amerikanischer, kanadischer, australischer und britischer Untersuchungen (vgl. ANDREWS, HALL, TEESSON & HENDERSON, 1999; KESSLER et al., 1994; LIN, GOERING, LESAGE & STREINER, 1997; SINGLETON, BUMPSTEAD, O’BRIEN, LEE & MELTZER, 2000) sowie regional durchgeführter Erhebungen der EDSP-Studie in Süddeutschland (WITTCHEN, MÜLLER & STORZ, 1998). Die Prävalenz der unterschiedlichen Angststörungen sowie deren Gesamtprävalenz für die USA und die BRD zeigt Tabelle 2.1. Tabelle 2.1. Lebenszeitprävalenzen von Angsterkrankungen in den USA (ECA-Studie) und in der BRD (MFS-Studie) (nach MORSCHITZKY, 2002, S. 151). Lebenszeiterkrankung in % Art der Angststörung USA (ECA-Studie) BRD (MFS) Alle Angsterkrankungen 14,6 13,9 Agoraphobie 5,2 5,7 Panikstörung 1,6 2,4 Generalisierte Angststörung 8,5 Spezifische Phobie 10,0 8,0 Soziale Phobie 2,8 2,5 ECA – Epidemiological Catchment Area Study, MFS – Münchner 7-Jahres-Follow-up-Studie Angststörungen stellen bei Frauen die häufigste, bei Männern nach der Alkoholabhängigkeit die zweithäufigste der psychischen Störungen dar (MORSCHITZKY, 2002, 152). Frauen sind verglichen mit Männern mehr als doppelt so häufig betroffen (MAIER, LINDEN & SARTORIUS, 1996; WITTCHEN et al., 1999). BANDELOW (2001, 32) beschreibt für die Patienten einer Angstambulanz eine Häufung von Panikstörungen und Agoraphobie für die Altersgruppe zwischen 20 und 40 Jahren und einen Abfall ab dem 50. Lebensjahr. WITTCHEN et al. (1999) stellten in ihrer Stichprobe von 18-65jährigen keine Unterschiede zwischen den Altersgruppen bezüglich der Häufung von Angststörungen fest. Für den Altersbereich der Kinder fehlen epidemiologische Studien. Panikstörungen scheinen hier allerdings selten vorzukommen, sondern erst mit dem Beginn der Pubertät aufzutreten (s. BANDELOW, 2001, 32) und am häufigsten zwischen dem 30. und 44. Lebensjahr zu beginnen (EATON et al., 1989). 4 Störungsbilder Die häufigsten Formen von Angststörungen sind in klinischen Stichproben die Agoraphobien und sozialen Phobien. In der Allgemeinbevölkerung überwiegen dagegen neben den sozialen Phobien die spezifischen Phobien (MORSCHITZKY, 2002, 152). In einer Studie der WHO wiesen mehr als 10% der Patienten in Allgemeinarztpraxen behandlungsbedürftige Angststörungen auf, davon 1,6% akute Agoraphobien, 1,3% akute Panikstörungen und 8,5% generalisierte Angststörungen, wobei spezifische und soziale Phobien nicht erfasst wurden (MAIER, LINDEN & SARTORIUS, 1996). Dabei wurden von den Allgemeinmedizinern als erst behandelnde Ärzte 50% aller nach ICD-10 vorliegenden Angststörungen nicht erkannt bzw. fehl diagnostiziert, und die Diagnose einer Angststörung führte häufig nicht zu einer entsprechenden Behandlung (SARTORIUS, ÜSTÜN, LECRUBIER & WITTCHEN, 1996). Angststörungen treten häufig im Zusammenhang mit weiteren Störungen auf. Bei der überwiegenden Anzahl von Betroffenen tritt im Verlauf des Lebens mindestens eine weitere Angsterkrankung auf. Reine Angststörungen bestehen nach WITTCHEN und VOSSEN (1996) lediglich bei 8% der Panikstörungen, 25% der Agoraphobien und 44% der spezifischen und sozialen Phobien (lebenszeitlich in der BRD). Jeder zweite an Angststörung erkrankte Deutsche entwickelt mindestens einmal eine weitere psychische Störung. Am häufigsten findet sich die Komorbidität zwischen einer Angststörung und einer Depression. Darüber hinaus finden sich Überschneidungen mit Suizidalität, hypochondrischen Syndromen, somatoformen Störungen, Persönlichkeitsstörungen, Medikamentenmissbrauch sowie Alkoholabhängigkeit (s. BANDELOW, 2001, 43-50; MORSCHITZKY, 2002, 156-166). Angststörungen besitzen eine hohe gesundheitsökonomische Bedeutung. Die Patienten suchen im Vergleich zu Patienten mit anderen psychischen Störungen am häufigsten Allgemeinarztpraxen auf (KLERMAN et al., 1991) und finden sich oft als Notfälle in medizinischen Einrichtungen ein. Es entstehen hohe Kosten durch unnötige medizinische Maßnahmen aufgrund von Fehldiagnosen (s. KLERMAN, HIRSCHFELD & AL, 1993, 19f.). Ein hoher Kostenfaktor entsteht aus der vollständigen oder eingeschränkten Arbeitsproduktivität der Betroffenen. Betroffene gaben für die vergangenen vier Wochen 0,8 Arbeitsunfähigkeitstage und 4,6 Tage mit eingeschränkter Arbeitsproduktivität aufgrund ihrer psychischen Probleme an und lagen damit deutlich höher als Personen ohne psychische Störungen mit 0,1 bzw. 0,3 Tagen (WITTCHEN et 5 Störungsbilder al., 1999). MASSION, WARSHAW und KELLER (1993) zufolge erhielten etwa 26% der untersuchten Patienten mit einer generalisierten Angststörung Arbeitsunfähigkeitsbezüge. Nach BROOCKS (2000, 23) entstehen auch bei Patienten mit einer Panikstörung erhebliche wirtschaftliche Kosten durch Arbeitsausfallzeiten und vorzeitige Berentungen. Panikstörungen beeinträchtigen den Allgemeinzustand der Betroffenen in vielen Bereichen und führen zu einer erhöhten Mortalität. 2.1.2 Diagnose-Kriterien Angststörungen werden nach der ICD-10 in phobische Störungen (F40) und in andere Angststörungen (F41) eingeteilt. Bei den phobischen Störungen handelt es sich um eine Störungsgruppe, „bei der Angst ausschließlich oder überwiegend durch eindeutig definierte, im allgemeinen ungefährliche Situationen oder Objekte – außerhalb der betreffenden Person – hervorgerufen wird. Diese Situationen oder Objekte werden charakteristischerweise gemieden oder voller Angst ertragen“ (DILLING, MOMBOUR, SCHMIDT & SCHULTE-MARKWORT, 1994, S. 143). Die psychischen oder vegetati- ven Symptome müssen primäre Manifestationen der Angst sein und nicht auf Symptomen wie Wahn- oder Zwangsgedanken beruhen. Als Angstsymptome werden vegetative Symptome wie Herzklopfen, erhöhte Herzfrequenz oder Schweißausbrüche, Symptome, die Thorax und Abdomen betreffen wie Atembeschwerden, Beklemmungsgefühl oder Thoraxschmerzen, psychische Symptome wie Gefühle von Schwindel oder Schwäche, Angst vor Kontrollverlust oder die Angst zu sterben sowie allgemeine Symptome wie Hitzewallungen, Kälteschauer oder Gefühllosigkeit beschrieben. Das Vermeidungsverhalten oder die Angstsymptome stellen eine deutliche emotionale Belastung dar, und die Betroffenen haben die Einsicht, dass diese übertrieben oder unvernünftig sind. Die Symptome beschränken sich ausschließlich oder vornehmlich auf die gefürchteten Situationen oder Gedanken an diese (DILLING et al., 1994, S. 115f.). Bezogen auf die angstauslösende Situation bzw. das angstauslösende Objekt werden drei Untergruppen von Phobien beschrieben: Bei der Agoraphobie (F40.0) muss die Angst in mindestens zwei der folgenden umschriebenen Situationen auftreten: in Menschenmengen, auf öffentlichen Plätzen, bei Reisen mit weiter Entfernung von Zuhause oder bei Reisen alleine. 6 Störungsbilder Bei den sozialen Phobien (F40.1) treten die Ängste in sozialen Situationen wie Essen oder Sprechen in der Öffentlichkeit auf, in denen die Betroffenen im Zentrum der Aufmerksamkeit stehen. Spezifische (isolierte) Phobien (F40.2) beziehen sich auf ein bestimmtes Objekt wie z.B. Insekten oder auf eine bestimmte Situation bzw. Örtlichkeit wie z.B. im Fahrstuhl oder im Tunnel. Die Kategorie F41 umfasst andere Angststörungen, bei denen die Angstsymptome wie oben beschrieben auftreten. Die Panikstörung (episodisch paroxysmale Angst, F41.0) ist durch wiederholte Panikattacken gekennzeichnet, die nicht auf eine spezifische Situation oder ein spezifisches Objekt bezogen sind. Eine Panikattacke wird charakterisiert durch „eine einzelne Episode von intensiver Angst oder Unbehagen, sie beginnt abrupt, sie erreicht innerhalb weniger Minuten ein Maximum und dauert mindestens einige Minuten“ (DILLING et al., 1994, S. 119). Die generalisierte Angststörung (F41.1) bezieht sich auf einen Zeitraum von mindestens sechs Monaten, im dem Anspannung, Besorgnis und Befürchtungen bezogen auf Alltagsprobleme und –ereignisse vorherrschen. Dabei müssen mindestens vier der beschriebenen Angstsymptome vorliegen, eins davon aus dem Bereich der vegetativen Symptome. Als weitere Symptome kommen nach Dilling et al. (1994) Symptome der Anspannung wie Muskelverspannung, Schmerzen, Ruhelosigkeit oder Gefühle von Aufgedrehtsein sowie andere unspezifische Symptome wie Erschrecktwerden, Leeregefühl und Einschlafstörungen wegen der Besorgnis in Frage (s.o., S.121). 2.1.3 Störungsbild nach ICF Die Beschreibung der Angststörungen ist entsprechend der ICF in vier Teile gegliedert. Nach den Schädigungen werden die daraus resultierenden Beeinträchtigungen der Aktivitäten und Partizipation sowie die Möglichkeiten der Sporttherapie als fördernder Kontextfaktor dargestellt. 7 Störungsbilder 2.1.3.1 Schädigungen der Körperstrukturen und Körperfunktionen BANDELOW (2001, 169) beschreibt für Patienten mit Panikstörung und Agoraphobie eine „ererbte Vulnerabilität oder konstitutionelle Disposition für das Auftreten von Angst“. Dabei handelt es sich „nicht um eine allgemeine Ängstlichkeit, sondern um eine selektive Überempfindlichkeit in Hinblick auf bestimmte körperliche Sensationen“ (S. 173). An sich harmlose körperliche Stimuli werden von den Betroffenen als bedrohlich bewertet. GORMAN, KENT, SULLIVAN & COPLAN (2000) nehmen ein sogenanntes überempfindliches „Angstnetzwerk“ bestehend aus der Amygdala, dem Hippocampus, dem Thalamus, dem Hypothalamus und dem Griseum centrale im Mittelhirn an. Aus neurobiologischer Sicht scheinen die Neurotransmitter Serotonin und Noradrenalin die Angstentstehung zentral zu beeinflussen (BANDELOW, 2001, 152). Bewegungsmangel reduzierte kardiopulmonale Fitness Vermeidungsverhalten auch in Bezug auf Sport psychosozialer Rückzug vegetative Übererregbarkeit erhöhter Sympathikotonus Laktatintoleranz Wahrnehmung vegetativer, besonders kardialer Symptome, Panikattacken, Hyperventilation, „Herzneurose“ biologische Disposition psychische Disposition kognitive Faktoren Abbildung 2.1. Reduzierte kardiopulmonale Fitness als pathogenetisch wirksame Komponente innerhalb eines multifaktoriellen Modells zur Genese der Panikstörung (nach BROOCKS et al., 1997b, 388). 8 Störungsbilder Die Zusammenhänge sind jedoch letztendlich noch ungeklärt. BROOCKS et al. (1997b) bewerten die „reduzierte kardiopulmonale Fitneß als pathogenetische wirksame Komponente innerhalb eines multifaktoriellen Modells“ (S. 388) als eine wichtige Komponente in der Entstehung von der Panikstörung (s. Abbildung 2.1). Auch geringe körperliche Belastungen lösen die Symptome und Reaktionen aus, so dass die Betroffenen sich noch mehr in ihrem Schonverhalten bestätigt sehen, und der Bewegungsmangel in einem Teufelskreis verstärkt wird. Im Sinne der ICF- „Klassifikation der Körperfunktionen“ (SCHUNTERMANN, 2002, 1020) können Angststörungen zu Einschränkungen folgender Funktionen führen (vgl. BANDELOW, 2001, 11, 17-24; BROOCKS, 2000, 21-24; HAND, 2005; MASSION, 1993; MORSCHITZKY, 2002, 6,14): • Emotionale Funktionen im Sinne übersteigerter Angst, Anspannung und Sorgen • Funktionen der Aufmerksamkeit, der Wahrnehmung und Selbstwahrnehmung durch Aufmerksamkeitsrichtung auf mögliche angstauslösende, körperliche Symptome und deren unrealistische Bewertung • Funktionen des Denkens durch unlogische Vermutungen über mögliche Gefahren, da die sonst logisch arbeitenden Zentren des Gehirns durch die Ängste unterdrückt werden • Funktionen des Schlafes durch Besorgnis • Funktionen des kardiovaskulären Systems bestehend in einer autonomen Dysregulation (s. Abschnitt 3.3.2) • Funktionen der kardiorespiratorischen Belastbarkeit, da aufgrund des Schonverhaltens die Ausdauerleistung, aerobe Kapazität und Belastbarkeit teilweise extrem eingeschränkt sind (vgl. Übersicht bei BROOCKS et al., 1997b) • Atmungsfunktionen, da es häufig durch erlebten Luftmangel zu erhöhter Atemfrequenz, verflachter Atmung und zur Hyperventilation kommt • Mit dem kardiovaskulären und Atmungssystem verbundene Empfindungen wie Aussetzen des Herzschlages, Herzklopfen, Kurzatmigkeit, Empfindung von Brustenge, Erstickungsgefühl etc. • Funktionen der Muskelkraft durch das Schonverhalten • Funktionen des Muskeltonus durch ständige Anspannung • Mit den Funktionen der Muskeln und der Bewegung in Zusammenhang stehende Empfindungen wie Muskelanspannung oder Muskelverspannung 9 Störungsbilder 2.1.3.2 Beeinträchtigungen der Aktivitäten Aufgrund der funktionellen Beeinträchtigungen ist es den von einer Angststörung Betroffenen nur noch eingeschränkt bzw. nicht mehr möglich, eine Reihe von Aktivitäten auszuführen, die unter der „Klassifikation der Aktivitäten und Partizipation“ in der ICF (s. SCHUNTERMANN, 2002, 23-32) aufgeführt werden (vgl. BANDELOW, 2001, 11, 17-24; BROOCKS, 2000, 21-24; HAND, 2005; KLERMAN et al., 1991; MASSION, 1993; MORSCHITZKY, 2002, 6,14): • Die tägliche Routine durchführen: das eigene Aktivitätsniveau handhaben. • Die psychische Belastbarkeit ist eingeschränkt, so dass der Umgang mit Stress und anderen psychischen Anforderungen schwierig ist. • Die Mobilität ist durch das Vermeidungsverhalten teilweise extrem eingeschränkt. Weite Entfernungen gehen oder sich auf andere Weise fortbewegen wie rennen, joggen, Treppen steigen oder schwimmen ist aufgrund der eingeschränkten kardiorespiratorischen Belastbarkeit nicht möglich. Besonders bei agoraphobischen Störungen entfernen die Betroffenen sich nicht weit vom vermeintlich sicheren Zuhause, so dass sie sich nicht mehr in verschiedenen Umgebungen fortbewegen können. Die Fortbewegung mit Transportmitteln ist stark eingeschränkt, da Agoraphobiker öffentliche Verkehrsmittel meiden, Schiffs- und Flugreisen umgehen und Angst vor dem Autofahren haben. • Aufgrund der als schädlich bewerteten körperlichen Sensationen und durch das folgende Schonverhalten erhalten die Betroffenen kein angemessenes Niveau körperlicher Aktivität aufrecht, das einen wichtigen Teil zur Krankheitsbewältigung darstellen würde. • Das Beschaffen von Lebensnotwendigkeiten wie beispielsweise Waren und Dienstleistungen des täglichen Bedarfs ist aufgrund des Vermeidungsverhaltens eingeschränkt, da die Betroffenen Menschenansammlungen wie im Kaufhaus oder der Einkaufsstrasse nicht aufsuchen. • Komplexe interpersonelle Interaktionen werden eingeschränkt, da viele Betroffene auf ihre Angststörung mit sozialem Rückzug reagieren und Veranstaltungen und öffentliche Einrichtungen nicht mehr aufsuchen. 10 Störungsbilder 2.1.3.3 Beeinträchtigungen der Partizipation Infolge der vielen eingeschränkten Aktivitäten sind die Betroffenen von einigen gemeinschaftlichen Lebensbereichen ausgeschlossen. Das Erholungs- und Freizeitverhalten ist stark eingeengt, da viele Aktivitäten außerhalb des eigenen Zuhauses und häufig mit vielen anderen Menschen stattfinden. Viele Formen von Freizeitaktivitäten entfallen durch die Einschränkung der körperlichen Belastbarkeit und durch das Schonverhalten. Die Lebensqualität ist durch eine Angststörung oft erheblich eingeschränkt, insbesondere, wenn entsprechende unterstützende Möglichkeiten fehlen. Die Betroffenen sind physisch und psychisch auf Bezugspersonen angewiesen, mit deren Hilfe sie ihren Alltag organisieren und ihre Angst vor dem Alleinsein in den Griff bekommen. Die Folgen des sozialen Rückzuges sind die Einschränkung sozialer Interaktionen, Schwierigkeiten, Beziehungen aufzubauen bzw. aufrechtzuerhalten sowie der Verlust der sozialen Integration. Auch der Bereich Arbeit und Beschäftigung ist häufig beeinträchtigt, da sich die Betroffenen aufgrund ihrer psychischen Probleme nicht in der Lage sehen, ihrer Arbeit nachzugehen, und sich um Krankschreibungen bemühen (BROOCKS et al., 1997a). Wenn in dieser Weise die Erwerbsfähigkeit betroffen ist, ist schließlich auch die wirtschaftliche Eigenständigkeit bedroht, da viele Betroffene finanziell abhängig werden von ihren Eltern oder ihrem Partner. 2.1.3.4 Sporttherapie als fördernder Kontextfaktor Von den denkbaren Kontextfaktoren soll im Hinblick auf die untersuchte Studienintervention in Form eines Ausdauertrainings lediglich der sporttherapeutische Ansatz mit den entsprechenden Möglichkeiten erläutert werden. Das Hauptziel liegt in dem Durchbrechen des beschriebenen Teufelskreises bedingt durch das Schonverhalten (s. Abbildung 2.1). BROOCKS et al. (1997b) halten „die Reattributierung angstbesetzter Körpersensationen für einen entscheidenden Wirkfaktor...Während der Ausdauerbelastung erlebt der Patient die mit den Angstzuständen assoziierten Symptome wie Herzrasen, Schwitzen, schnelles Atmen und leichten Schwindel als völlig normale physiologische Reaktionen, die nach kurzer Zeit von selbst verschwinden“ (S. 389). Ein entsprechendes Programm soll das Erleben körperlicher Leistungsfähigkeit und deren Beeinflussbarkeit mit Hilfe gezielter Trainingsmaßnahmen ermöglichen, so dass die Betroffenen wieder Vertrauen in ihren Körper, die Wahrnehmung und Be11 Störungsbilder wertung der Körpersignale aufbauen. Darüber hinaus lässt sich durch die Bewegung die Fähigkeit vermitteln, über die Bewegung die eigene Befindlichkeit selbst zu stabilisieren bzw. zu verbessern. Soziale Interaktionen können in der Sportgruppe wieder aufgenommen und verbessert werden. Entsprechende Kontextfaktoren stellen Laufbzw. Walking-Treffs, Sportgruppen oder Vereinsangebote dar. 2.2 Somatoforme Störungen Eine weitere Form psychischer Störungen, die häufig auftritt, stellen die somatoformen Störungen dar. Sie werden anhand von epidemiologischen Daten, Kriterien zur Diagnostik sowie einer Einordnung in die ICF – Rahmenrichtlinien beschrieben. 2.2.1 Epidemiologie Die vorhandenen epidemiologischen Daten sind infolge unklarer Diagnosekriterien und hochselektiver Stichproben nur bedingt aussagekräftig. MORSCHITZKY (2000) beschreibt für die Allgemeinbevölkerung „eine Lebenszeithäufigkeit von 0,2-0,5% bei Konversionsstörungen, von 0,4-0,5% bei der streng definierten Somatisierungsstörung und von 4-13% beim multiplen Somatisierungssyndrom“ (S. 165). Im Zusatzsurvey „psychische Störungen“ wurde für die deutsche Durchschnittsbevölkerung im Alter zwischen 18 und 65 Jahren eine Vier-Wochen-Querschnittsprävalenz von 7,5% bezogen auf eine somatoforme Störung nach ICD-10 Kriterien diagnostiziert festgestellt (WITTCHEN et al., 1999). Dabei lag die Rate in den alten Bundesländern mit 8,0% höher als in den neuen Bundesländern mit 5,5%. Die Divergenz zu den Ergebnissen anderer Untersuchungen führen die Autoren auf Unterschiede in der Definition und Befragung zurück. Sie vermuten, dass die Angabe subjektiv geäußerter psychischer Beschwerden von den manifesten Formen einer somatoformen Störung abweicht. In der im norddeutschen Raum erhobenen TACOS-Studie ergab sich für die 18- bis 64-jährigen eine Lebenszeitprävalenz von 12,9% (MEYER, RUMPF, HAPKE, DILLING & JOHN, 2000). Frauen sind häufiger als Männer von einer somatoformen Störung betroffen (9,99% vs. 4,93%). Altersgruppenspezifische Unterschiede wurden bei WITTCHEN et al. (1999) nicht gefunden, MORSCHITZKY (2000, 166) beschreibt jedoch eine zweigipflige Altersverteilung mit einer Häufung bei den 15-25jährigen und den 45-55jährigen. 12 Störungsbilder In der Bremer Jugendstudie (ESSAU, CONRADT & PETERMANN, 2000) wurde eine Lebenszeitprävalenz für somatoforme Störungen von 13,1% der untersuchten 12- bis 17jährigen festgestellt. Die Häufigkeit nahm mit dem Alter zu. Laut RIEF und HILLER (1998, 16f.) ist die Somatisierungsstörung mit einem niedrigeren Bildungsniveau und einer niedrigeren sozialen Schicht assoziiert und scheint in städtischen Gebieten häufiger zu sein. Bei somatoformen Störungen besteht in den meisten Fällen eine Komorbidität mit anderen psychischen Erkrankungen. Am häufigsten besteht nach RIEF und HILLER (1998, 19-21) bei den Patienten mit einer somatoformen Störung bzw. einem multiplen Somatisierungssyndrom eine Lebenszeitkomorbidität mit einer Depression (fast zwei Drittel) oder einer Angststörung (20-50%). Die von Komorbidität betroffenen Patienten weisen eine schwerere Symptomatik auf und sind in ihren psychosozialen Funktionen deutlich beeinträchtigter. Medizinische Behandlungseinrichtungen werden häufig aufgrund von unklaren körperlichen Beschwerden aufgesucht. In diesen klinischen Stichproben wird eine wesentlich höhere Prävalenz von somatoformen Störungen bzw. dem weiter gefassten Somatisierungssyndrom festgestellt (s. NANKE & RIEF, 2003). Patienten mit einer somatoformen Störung nehmen häufig medizinische Leistungen in Anspruch. So suchten in einer Studie von NANKE und RIEF (2003) Patienten mit unklaren Körperbeschwerden relativ zum bundesweiten durchschnittlichen Arztbesuch fast dreimal so häufig einen Arzt auf (durchschnittlich fünfzehn Arztbesuche in den letzten sechs Monaten vs. elf jährliche Arztbesuche). SMITH, MONSON und RAY (1986) stellten fest, dass die Behandlungskosten bei somatoformen Störungen verglichen mit der Durchschnittsbevölkerung im Durchschnitt bis zu 9fach erhöht sind. Die Eingriffe sind dabei oft erheblich. Die ökonomischen Kosten werden durch Arbeitsunfähigkeitszeiten erheblich erhöht. Laut WITTCHEN et al. (1999) waren die Arbeitsunfähigkeitstage und die Tage mit eingeschränkter Arbeitsproduktivität bedingt durch eine somatoforme Störung bei den Betroffenen höher als in der Vergleichsgruppe ohne psychische Störungen (0,7 vs. 0,1 bzw. 2,7 vs. 0,3 Tage in den letzten vier Monaten). RIEF, CUNTZ und FICHTER (2001) fanden in einer klinischen Erhebung sogar eine durchschnittliche Arbeitsunfähigkeitszeit von 128 Tagen in den vergangenen 24 Monaten. 13 Störungsbilder 2.2.2 Diagnose-Kriterien Die unter F45 im ICD-10 beschriebenen somatoformen Störungen lassen sich durch „die wiederholte Darbietung körperlicher Symptome in Verbindung mit hartnäckigen Forderungen nach medizinischen Untersuchungen trotz wiederholter negativer Ergebnisse“ (DILLING et al., 1993, S. 170) charakterisieren. Die multiplen und wechselnden Symptome lassen sich nicht durch eine diagnostizierte körperliche Krankheit erklären bzw. wenn vorhanden, erklären sie nicht „die Schwere, das Ausmaß, die Vielfalt und die Dauer der körperlichen Beschwerden oder die damit verbundene soziale Behinderung“ (DILLING et al., 1994, S. 130). Die Diagnose einer Somatisierungsstörung (F45.0) umfasst Klagen über multiple Symptome seit mindestens zwei Jahren, die zu einem andauernden Leiden und mehrfachen ärztlichen Konsultationen oder Zusatzuntersuchungen führen. Die Patienten weigern sich hartnäckig zu akzeptieren, dass medizinisch keine ausreichende körperliche Ursache für die Symptome festzustellen ist. Insgesamt müssen mindestens sechs der folgenden Symptome aus mindestens zwei Gruppen nach DILLING et al. (1994, S. 131) vorliegen: Gastro-intestinale Symptome: 1. Bauchschmerzen 2. Übelkeit 3. Gefühl von Überblähung 4. schlechter Geschmack im Mund oder extrem belegte Zunge 5. Klagen über Erbrechen oder Regurgitation von Speisen 6. Klagen über häufigen Durchfall oder Austreten von Flüssigkeit aus dem Anus Kardiovaskuläre Symptome: 7. Atemlosigkeit ohne Anstrengung 8. Brustschmerzen Urogenitale Symptome: 9. Dysurie oder Klagen über die Miktionshäufigkeit 10. unangenehme Empfindungen in oder um den Genitalbereich 11. Klagen über ungewöhnlichen oder verstärkten vaginalen Ausfluss Haut- und Schmerzsymptome: 12. Klagen über Fleckigkeit oder Farbveränderungen der Haut 13. Schmerzen in den Gliedern, Extremitäten oder Gelenken 14. unangenehme Taubheit oder Kribbelgefühl. 14 Störungsbilder Für die undifferenzierte Somatisierungsstörung (F45.1) gelten die Diagnosekriterien der Somatisierungsstörung bezogen auf einen Zeitraum von mindestens sechs Monaten. Die ärztlichen Konsultationen bzw. die Anzahl der Symptome müssen jedoch nicht vollständig erfüllt sein. Die hypochondrische Störung (F45.2) ist vor allem gekennzeichnet durch die beharrliche Beschäftigung mit der Möglichkeit, an einer oder mehreren schweren und fortschreitenden körperlichen Erkrankungen zu leiden. Die ständige Sorge verursacht andauerndes Leiden oder eine Störung des alltäglichen Lebens. Die medizinische Feststellung, dass es keine ausreichende körperliche Ursache gibt, wird hartnäckig zurückgewiesen. Bei der somatoformen autonomen Funktionsstörung (F45.3) werden hartnäckige und störende Symptome der vegetativen Stimulation wie Herzklopfen, Schwitzen, Zittern oder Erröten sowie zusätzliche subjektive, unspezifische Symptome (fließende Schmerzen, Brennen, Schwere) als Anzeichen einer körperlichen Erkrankung geschildert. Die häufigsten und auffallendsten Beispiele beziehen sich auf das kardiovaskuläre System („Herzneurose“), das respiratorische System (psychogene Hyperventilation) und das gastrointestinale System („Magenneurose“ oder „nervöser Durchfall“). Es gibt dabei keinen Nachweis einer Störung von Struktur oder Funktion der betroffenen Organe oder Systeme. Die anhaltende somatoforme Schmerzstörung (F45.5) beinhaltet einen mindestens sechs Monate kontinuierlichen, an den meisten Tagen anhaltenden, schweren und belastenden Schmerz in einem Körperteil, der Hauptfokus für die Aufmerksamkeit der Patienten ist. Hierbei muss eine funktionelle Komponente nachgewiesen werden. 2.2.3 Störungsbild nach ICF Die Beschreibung der somatoformen Störungen ist entsprechend der ICF in vier Teile gegliedert. Nach den Schädigungen werden die daraus resultierenden Beeinträchtigungen der Aktivitäten und Partizipation sowie die Möglichkeiten der Sporttherapie als fördernder Kontextfaktor dargestellt. 15 Störungsbilder 2.2.3.1 Schädigungen der Körperstrukturen und Körperfunktionen Somatoformen Störungen scheint eine multifaktorielle Genese zugrunde zu liegen, die sich in einem kognitiv-bio-psycho-sozialen Erklärungsmodell niederschlägt (MORSCHITZKY, 2000, 203; RIEF & HILLER, 1998, 28; RIEF & NANKE, 1999). Zwillings-, Adop- tiv- und Familienstudien weisen auf eine genetische Prädisposition hin (RIEF & HILLER, 1998, 29). Patienten mit somatoformen Störungen scheinen eine verringerte basale Aktivität der Hypothalamus-Hypophysen-Nebennierenrindenachse aufzuweisen, was sich in Veränderungen des Kortisolspiegels zeigt. Die Betroffenen sind somit anfälliger für Stressbelastungen und besitzen eine verstärkte Schmerzwahrnehmung (vgl. MORSCHITZKY, 2000, 205f.). RIEF, SHAW und FICHTER (1998) sowie RIEF und AUER (2001) fanden eine physiologische Übererregung bei Patienten mit somatoformen Störungen, die sich besonders unter einer mentalen Belastung in der erhöhten Herzrate und in einem zunehmenden Anspannungsgefühl zeigte. Laut MORSCHITZKY (2000) weisen „Somatisierungspatienten bei selektiven Aufmerksamkeits- prozessen und intensiven emotionalen Reizen spezifische hirnphysiologische Aktivierungsmuster auf“ (S. 207). WITTLING (1998) zufolge spielt das Gehirn eine zentrale Rolle bei der Entstehung somatoformer Störungen, die durch spezifische Funktionsmerkmale des neuronalen Systems, insbesondere über das autonome Nervensystem beeinflusst wird (s. hierzu auch Abschnitt 3.3.2). Im Sinne der ICF- „Klassifikation der Körperfunktionen“ (SCHUNTERMANN, 2002, 1020) können somatoforme Störungen zu Einschränkungen folgender Funktionen führen (vgl. MORSCHITZKY, 2000, 208-216; RIEF, 2005; RIEF & HILLER, 1998, 34-38): • Funktionen der Wahrnehmung: im Sinne eines interozeptiven Wahrnehmungsstils, bei dem körperliche Empfindungen als intensiv, schädlich und beeinträchtigend erlebt werden • Funktionen der Aufmerksamkeit: die Körperfunktionen werden intensiv und ängstlich beobachtet, die Aufmerksamkeit auf unangenehme Körperempfindungen und körperliche Beschwerden fokussiert, ständiges ängstliches Beobachten des Körpers („Checking“) und häufige Selbstuntersuchungen • Funktionen des Denkens: Körpersignale werden als bedrohliche Krankheitszeichen fehlinterpretiert, Aufbau einer persönlichen Krankheitstheorie mit dysfunktionalen Einstellungen zum Gesundheitsbegriff, falschen Annahmen über Körperfunktionen, physiologischen Zusammenhängen und Kausalattribuierungen sowie 16 Störungsbilder mit übertriebenen Ansprüchen an die Medizin, übermäßige Beschäftigung mit der Thematik von Gesundheit und Krankheit auch in Gesprächen mit Verwandten und Bekannten • Emotionale Funktion: Verstärkung der Angstgefühle verbunden mit wachsender Besorgnis • Die Selbstwahrnehmung betreffende Funktionen: Selbstverständnis von Schwäche, geringe Belastbarkeit oder körperliche Verletzlichkeit, stark gestörtes Körpererleben, häufig wird jede bewusste körperliche Wahrnehmung vermieden bzw. die Konfrontation mit bestimmten Körperbereichen gemieden • Schmerz: gesteigerte Schmerzwahrnehmung und –empfindung • Funktionen der kardiorespiratorischen Belastbarkeit: Ausdauerleistungsfähigkeit aufgrund des Schonverhaltens teilweise extrem niedrig • Funktionen von Muskelkraft, -tonus und -ausdauer: durch das Schonverhalten bedingt kommt es zu einer Muskeldysbalance, die Kraft der zur Schwäche neigenden Muskelgruppen ist zu gering, die zur Verkürzung neigenden Muskelgruppen sind nicht ausreichend dehnfähig • entsprechend der individuellen Symptomatik können in unterschiedlicher Kombination Funktionen im Zusammenhang mit dem kardiovaskulären und Atmungssystem, dem Verdauungssystem, dem Stoffwechsel- und endokrinen System, dem Urogenital- und reproduktiven System sowie neuromuskuloskeletale, bewegungsbezogene und Funktionen der Haut beeinträchtigt sein. 2.2.3.2 Beeinträchtigungen der Aktivitäten Aufgrund der funktionellen Beeinträchtigungen ist es den von einer somatoformen Störung Betroffenen nur noch eingeschränkt bzw. nicht mehr möglich, eine Reihe von Aktivitäten auszuführen, die unter der „Klassifikation der Aktivitäten und Partizipation“ in der ICF (s. SCHUNTERMANN, 2002, 23-32) aufgeführt werden (vgl. MORSCHITZKY, 2000, 210-214; NANKE & RIEF, 2003; RIEF, 2005; RIEF & HILLER, 1998, 34- 38; SMITH, MONSON & RAY, 1986; ZIELKE, 1998, 71-73): • Die tägliche Routine durchführen: Chronifizierte somatoforme Störungen beinhalten eine zunehmende Passivität und resignierende Hilflosigkeit der Betroffenen, die mit einem Verlust an Selbsthilfemöglichkeiten einhergehen. Das körperliche Aktivitätsniveau wird aufgrund des körperlichen Schonverhaltens gesenkt. 17 Störungsbilder • Mit Stress und anderen psychischen Anforderungen umgehen: Die Stressintoleranz und mangelnde Copingfertigkeiten führen zu einem erhöhten physiologischen Aktivierungsniveau, so dass entsprechende Anforderungen zu verstärkter Anspannung und Überforderungen führen. Das Vertrauen in die psychische Funktionstüchtigkeit der eigenen Person geht mit der abnehmenden Selbstsicherheit verloren. • Auf seine Gesundheit achten: Aufgrund von übersteigertem Gesundheitsverhalten kommt es noch zu einer Symptomverschlimmerung. Im Rahmen von Selbstuntersuchungen können Hautrötungen durch ständiges Betasten der betroffenen Stelle verstärkt werden. Übertriebenes Schonverhalten verbunden mit einer mangelnden körperlichen Aktivität aus Angst vor einer Symptomverschlimmerung führt zu einer weiteren Abnahme der Leistungsfähigkeit. Das dysfunktionale Krankheitsverhalten verstärkt als aufrechterhaltender Faktor die Symptomatik und trägt zur Chronifizierung bei. Dazu zählen das Aufsuchen vieler Ärzte („doctorhopping“), die vermehrte Inanspruchnahme medizinisch-diagnostischer Maßnahmen und unnötig lange stationäre Aufenthalte. Es besteht die Gefahr iatrogener Schäden durch wiederholte invasive Eingriffe sowie die Gefahr von Missbrauch oder Abhängigkeit von Medikamenten. • Erholung: Die passiven Entspannungsmöglichkeiten sind eingeschränkt, weil die physische und psychische Regenerierung wegen der chronischen Anspannung nicht mehr gelingt. 2.2.3.3 Beeinträchtigungen der Partizipation Die Betroffenen verlieren einen Teil ihrer physischen und psychischen Unabhängigkeit, da sie sich vom medizinischen Versorgungssystem abhängig machen. Unauffällige Befunde werden immer wieder angezweifelt und weitere Ärzte und „Spezialisten“ aufgesucht. Aufgrund der eingenommenen Krankenrolle erfolgt eine pathologische Stabilisierung sozialer Beziehungen, da der Patient mithilfe der somatoformen Störung die zwischenmenschlichen Beziehungen gestaltet und kritische soziale Situationen wie Auseinandersetzungen oder Durchsetzungsvorhaben vermeidet. Mögliche Folgen sind verstärkte Zuwendung der Mitmenschen und die Abnahme von als unangenehm empfundenen Verpflichtungen. Das ständige Klagen über die körperlichen Beschwerden belastet die Beziehungen auf Dauer jedoch erheblich. Durch die Ein18 Störungsbilder schränkung auf die Krankenrolle kommt es zu einem allgemeinen sozialen Rückzug und einer Gefährdung der sozialen Integration, zumal viele Freizeitaktivitäten aufgrund des Schonverhaltens entfallen. Die Beschwerden einer somatoformen Störung führen häufig zu einer Einschränkung der Arbeitsproduktivität und einer Arbeitsunfähigkeit, so dass die Erwerbstätigkeit erheblich gefährdet und die wirtschaftliche Eigenständigkeit der Betroffenen bei einer resultierenden Erwerbsunfähigkeit bedroht ist. 2.2.3.4 Sporttherapie als fördernder Kontextfaktor Von den denkbaren Kontextfaktoren soll in Hinblick auf die untersuchte Studienintervention in Form eines Ausdauertrainings lediglich der sporttherapeutische Ansatz mit den entsprechenden Möglichkeiten erläutert werden. Der Hauptansatzpunkt liegt auch hier, ähnlich wie bei den Angststörungen, im übertriebenen Schonverhalten. Dabei bieten sich laut PAHMEIER und BREHM (1998) Bewegung und sportliche Aktivität zur Bewältigung multipler Beschwerden an, da sie eine aktive Handlung verbunden mit einer unmittelbaren Auseinandersetzung mit dem Körper darstellen. Durch eine entsprechende körperliche Aktivität sollen die Betroffenen einen anderen Zugang zu ihrem Körper finden, indem sie psychophysiologische Zusammenhänge zwischen Belastung und den entsprechenden Körpersignalen als gesunde Bereitstellungsreaktionen des Körpers erleben. Die Steigerung der körperlichen Leistungsfähigkeit ist die Voraussetzung, um Vertrauen in den eigenen Körper zu entwickeln, sich wieder belastbarer zu fühlen und die Bewertung des Körpers als „beschwerdebeladen“ zu relativieren. Weitere Ziele liegen in der Spannungsregulation, in der Stabilisierung der Befindlichkeit über Bewegung, im Aufnehmen sozialer Interaktionen, einer Vergrößerung des sozialen Wirkungsfeldes und einer aktiven Alltags- und Freizeitgestaltung. In diesem Rahmen stellen Lauf- oder Walking-Treffs, Sportgruppen oder andere Vereinsangebote wichtige Kontextfaktoren dar. 19 Autonome Regulation 3 Autonome Regulation Die autonome Regulation bezeichnet die „Regelung der... inneren Lebensvorgänge (Aufrechterhaltung der Homöostase) und deren Anpassung an die Erfordernisse der Umwelt“ (HOFFMANN-LA ROCHE AG, URBAN & SCHWARZENBERG, 1984, S. 1645). Sie vollzieht sich in einzelnen Regelkreisen wie beispielsweise dem der Respiration oder des Blutdruckes, die in Verbindung mit zentralen Regelschleifen stehen. „Besonders sensitive Parameter autonomer Funktion sind respirokardiale und kardiovaskuläre Kopplungen“ (ZWIENER, HOYER, WICHER & HARDRAHT, 2002, S. 1041). Deshalb sollen im folgenden Kapitel die physiologischen Grundlagen der kardiovaskulären Regulation, ihre zwei zentralen Indices und die Bedeutung im Zusammenhang mit einer Angst- oder somatoformen Störung dargestellt werden. 3.1 Physiologische Grundlagen Ein Zentrum bildet das Herz, das als elektromechanischer Oszillator ein spezifisches, autonomes Erregungsbildungs- und Leitungssystem besitzt. Der Sinusknoten produziert durch Umpolung der Zellen rhythmisch-elektrische Aktivität, die über die Vorhöfe, den Atrioventrikularknoten (AV-Knoten), das Hissche Bündel und die Purkinjeschen Fäden auf die Arbeitsmuskulatur (Myokard) des Herzens übertragen wird. Das Myokard antwortet mit einer Kontraktion, so dass ein Aktionspotential im Sinusknoten einen Herzschlag auslöst. Die Impulsfrequenz des Sinusknotens bestimmt somit die Schlagfrequenz des Herzens (SILBERNAGL & DESPOPOULOS, 2003, 192). Die intrinsische elektrische Sinusaktivität beträgt etwa 110 in der Minute. Sie unterliegt einer Vielzahl von Einflussgrößen wie Temperatur, zirkulierende Hormone oder Alter. Für die kurzfristigen Anpassungsvorgänge wird die Sinusaktivität und damit die Herzfrequenz vor allem durch die Herznerven Vagus und Sympathikus beeinflusst, die zum vegetativen Nervensystem gehören (ESPERER, 1994). Das vegetative (oder auch autonome) Nervensystem besteht aus zwei Anteilen, dem Sympathikus und dem Parasympathikus (auch Vagus genannt). Von hier führen aus den kreislaufregulierenden Zentren des verlängerten Rückenmarks (Medulla oblongata) die sympathischen bzw. parasympathischen Nervenfasern u.a. zum Herzen (s. Abbildung 3.1; SCHMIDT, THEWS & LANG, 2000, 340-342). 20 Autonome Regulation Abbildung 3.1. Aufbau des peripheren vegetativen Nervensystems mit den beiden Anteilen Sympathikus und Parasympathikus. Aus Physiologie des Menschen (S.341) von R.F. SCHMIDT, G. THEWS & F. LANG, 2000, Berlin: Springer. Die Erregungsübertragung von den Endigungen der Herznerven auf die Herzmuskulatur erfolgt durch chemische Überträgerstoffe, deren Metabolismus die Wirkungsweise bestimmt. Der Sympathikus ruft eine Sinustachykardie hervor, eine Erhöhung der Frequenz der rhythmischen Spontanentladungen im Sinusknoten. Die daraus folgende Zunahme der Herzfrequenz wird als positive Chronotropie bezeichnet. Der sympathische Überträgerstoff ist das Noradrenalin. Dessen langsamer Metabolismus bedingt eine erst später einsetzende Wirkung des sympathischen Einflusses nach etwa 12 Sekunden. Der Parasympathikus führt zu einer Sinusbrachykardie, senkt also die Impulsfrequenz des Sinusknotens und damit auch die Herzfrequenz (negative Chronotropie). Der entsprechende Überträgerstoff ist das Acetylcholin mit einem raschen Metabolismus, der zu einer schnellen Latenzzeit führt. Kurzfristige Reaktionen wie Schlag-zu-Schlag-Veränderungen des Herzens und eine sofortige maximale Reaktion sind parasympathisch gesteuert. In Ruhe überwiegt die parasympathische Stimulation, so dass die intrinsische Sinusaktivität von 110 Potentialen in der Minute auf etwa 60-80 gesenkt und eine entsprechende Ruheherzfrequenz von 60-80 S/min erreicht wird. Eine Abnahme des vagalen Ruhetonus kann ohne sympathischen Einfluss zu einer Erhöhung der Herzfrequenz auf 100-120 S/min führen. Bei beginnender körperlicher Aktivität steigt die Herzfrequenz erst über die Abnahme des vagalen Einflusses, dann unterstützt durch die später einsetzende sympathische Aktivierung und ab 120 S/min über die Sympa21 Autonome Regulation thikusaktivität (ESPERER, 1994). Dadurch erklärt sich auch „die zeitlich verzögerte HfZunahme [Herzfrequenz] bei beginnender körperlicher Aktivität und die relativ schnelle Absenkung der Hf unmittelbar nach hoher Belastungsintensität“ (HOTTENROTT, 2002, S. 10). Die Stärke der sympathischen und parasympathischen Stimulationen wird durch mehrere physiologische Systeme, deren Rezeptoren und Reflexe bestimmt, die in vielfältig miteinander verbundenen Regelkreisen ein komplexes Netzwerk darstellen und deren gemeinsame Stellgröße die Herzfrequenz ist (ESPERER, 1994). Dieses Netzwerk der Herz-Kreislauf-Regulation, schematisch dargestellt in Abbildung 3.2, steht in Wechselbeziehung zum autonomen Nervensystem. Psychomentaler Stress Cortex Zirkadiane Zeitgeber Schmerz Hypothalamus Humorale Regelkreise Medulläres kardiorespiratorisches Netzwerk Sympathikus BR + LPR + SV HR _ CR V a g u s paO2/paCO2 Gasaustausch Respiration Volumenregulation HMV AD Atembewegungen Herz VR V K ReninAngiotensinSystem Temperaturregulation Orthostase Muskel + Physische Aktivität Haut TPR Abbildung 3.2. Die Herzfequenz-Steuerung als komplex vermaschter Mehrfachregelkreis. Nach H.D. ESPERER (1994).„Physiologische Grundlagen und pathophysiologische Aspekte der Herzfrequenzvariabilität beim Menschen“. Herzschrittmachertherapie & Elektrophysiologie, 5 (Suppl. 2), S. 3. AD: Arterieller Blutdruck, BR: arterielle Barorezeptoren, CR: Chemorezeptoren, HMV: Herzminutenvolumen, HR: Herzrate, LPR: Low pressure-Rezeptoren, pa: arterieller Gasdruck, SV: Schlagvolumen, TPR: peripherer Gesamtwiderstand, VK: venöse Kapazität, VR: venöser Rückfluss. Eine wichtige Rolle in diesem System der Herzaktivität nimmt der Regelkreis des arteriellen Baroreflexes (auch Baroreflexschleife genannt) als negatives FeedbackSystem ein. Das Eingangssignal bildet der Blutdruck. Die Messfühler, so genannte Barorezeptoren, befinden sich hauptsächlich in der Gefäßwand des Karotissinus und des Aortenbogens. Sie erfassen Blutdruckveränderungen über die Dehnung der Ge22 Autonome Regulation fäßwände in Abhängigkeit vom transmuralen Druck und leiten die Informationen an zentralnervöse Regelzentren weiter. Diese regeln über die Stimulation des autonomen Nervensystems die Stellgrößen (ESPERER, 1994). Der vagale Anteil beeinflusst ausschließlich die Aktivität des Sinusknotens, während der sympathische Anteil darüber hinaus auch die Herzmuskulatur und das periphere Gefäßsystem beeinflusst. Ein Blutdruckabfall führt zu einer Abnahme der Barorezeptorenaktivität, damit zu einer vermehrten sympathischen und einer Hemmung der parasympathischen Aktivität. Dadurch nehmen die Kontraktilität des Herzens und die Herzfrequenz zu (Tachykardie), der periphere Gefäßwiderstand wird erhöht und die Gefäße werden eng gestellt (Vasokonstriktion). Die Folge ist ein Blutdruckanstieg bis zum Ausgangswert und damit die Normalisierung des arteriellen Blutdruckes. Entsprechend folgt auf einen Blutdruckanstieg durch die vermehrte Barorezeptorenaktivität eine vagal bedingte Verringerung der Herzfrequenz (Bradykardie) und eine durch sympathische Hemmung bedingte Vasodilatation, die wiederum einen Blutdruckabfall bewirken. Die Abläufe sind in Abbildung 3.3 dargestellt. Abbildung 3.3. Kreislaufreaktionen bei veränderter Erregung der Barorezeptoren im Karotissinus. Aus Vegetative Physiologie von G. THEWS & P. VAUPEL (2001), Berlin: Springer, S. 198. 23 Autonome Regulation Die Veränderung der Herzfrequenz aufgrund einer Veränderung des Blutdrucks kann innerhalb eines Herzzyklus erfolgen. Die Reaktion der Barorezeptoren hängt von der Geschwindigkeit der Blutdruckveränderung ab (HILZ, STEMPER & NEUNDÖRFER, 2000). Die Atmung moduliert das System über verschiedene Wege und verursacht Schwankungen der Herzfrequenz, die als respiratorische Sinusarrhythmie bezeichnet werden. Denn zum einen besteht eine zentrale Kopplung zwischen dem Atemzentrum und den Kreislaufzentren des Hirnstamms, die eine inspiratorische Hemmung und exspiratorische Aktivierung des Herzvagus und damit eine inspiratorische Beschleunigung und exspiratorische Verlangsamung der Herzfrequenz bewirkt (KOEPCHEN, 1982). Zum anderen führt der Gasaustausch zu Änderungen der Sauerstoff- und Kohlendioxid-Partialdrucke und des ph-Wertes. Ein sinkender arterieller SauerstoffDruck führt zu einer Aktivierung der Chemorezeptoren und bedingt neben einer Steigerung der Atmung über das medulläre kardiorespiratorische Netz eine vagal induzierte Bradykardie (s. HILZ et al., 2000). Die Atmung nimmt auch über die Baroreflexschleife Einfluss auf die Herzfrequenz. Über respiratorisch bedingte Schwankungen des intrathorakalen Drucks werden der venöse Rückstrom und der kardiale Auswurf verändert. Über die Barorezeptoren führt ein hoher venöser Rückstrom zu einem Anstieg der Herzfrequenz (SILBERNAGL & DESPOPOULOS, 2003, 216). Darüber hinaus beeinflussen weitere Systeme diesen Mehrfachregelkreis wie das Thermo-Regulations-System und das Renin-Angiotensin-System, das für die Volumenregulation verantwortlich ist. Verringert es den peripheren Gefäßwiderstand, so vermindert es auch den Einfluss des baroreflektorischen Systems (HOTTENROTT, 2002, 12). Ein Beispiel humoraler Einflüsse findet sich in frei zirkulierenden Katecholaminen, die direkt positiv chronotrop am Sinusknoten wirken. Die Herzkreislaufregulation ist zentral integriert, so dass auch Anteile des zentralen Nervensystems die Herzfrequenzsteuerung durch Reize wie Emotionen, Schmerz oder psychomentaler Stress beeinflussen. Autonome Aktivitäten im Zusammenhang mit psychosozialen Interaktionen werden über das limbische System vermittelt (ZWIENER et al., 2002). ESPERER (1994) bezeichnet das neurovegetative System als „wichtiges Bindeglied zwischen physiologischen und psychologischen Zuständen und die Herzfrequenz ein Spiegel dieses Zusammenspiels“ (S. 7). 24 Autonome Regulation 3.2 Indices autonomer kardiovaskulärer Regulation Die autonome kardiovaskuläre Regulation wird durch verschiedene Kennwerte ausgedrückt. Im Einzelnen sollen die Herzratenvariabilität, die Baroreflexsensitivität und die Stress-Reaktivität beschrieben werden. 3.2.1 Herzratenvariabilität Die Herzratenvariabilität (HRV) kennzeichnet nach HOTTENROTT (2002) „die Variation (Schwankung) der Herzfrequenz über einen definierten Messzeitraum (bis zu 24 h) bei einer Analyse aufeinander folgender Herzperioden. Die HRV ist eine Messgröße der neurovegetativen Aktivität und autonomen Funktion des Herzens und beschreibt die Fähigkeit des Herzens, den zeitlichen Abstand von Herzschlag zu Herzschlag belastungsabhängig laufend zu verändern, um sich wechselnden Anforderungen schnell anzupassen. Die HRV ist damit eine Kenngröße für die Anpassungsfähigkeit des menschlichen Organismus an exogene und endogene Belastungsfaktoren“ (S. 10). Diese Anpassungsfähigkeit hängt von einem optimalen Zusammenspiel des sympathischen und parasympathischen Nervensystems ab und wird von den Faktoren beeinflusst, die sich auch auf die Herzfrequenz auswirken wie beispielsweise Lebensalter, Geschlecht, Körperlage oder Muskelaktivität (s. zusammenfassend HOTTENROTT, 2002). In Körperruhe überwiegt der parasympathische Einfluss, und die Herzratenvariabilität ist wesentlich größer als unter körperlicher Belastung. Der zunehmende Impulseinstrom aus der Muskulatur bei ansteigender Belastung führt direkt zu einer Abnahme des vagalen Einflusses (TULPPO et al., 1998). Bei zunehmender sympathischer Aktivität nehmen die Schwankungen von Herzschlag zu Herzschlag ab und sind bei einer hohen Herzfrequenz kaum noch zu messen. Den Ausgangspunkt für die Messung der Herzratenvariabilität bildet die Aufzeichnung des Elektrokardiogramms (EKG), das die elektrischen Erregungszustände des Herzens in ihrem zeitlichen Verlauf darstellt. Die R-Zacken werden bestimmt und Artefakte identifiziert (R-Zackendetektion), um dann die Zeitabstände zwischen zwei RZacken (RR-Intervalle) als Tachogramm darzustellen. Dieses HerzfrequenzTachogramm wird einer mathematischen Analyse unterzogen. Für eine solche Herz25 Autonome Regulation ratenvariabilitäts-Analyse werden drei verschiedene Verfahren eingesetzt. Das der nichtlinearen Dynamik spielt eher eine geringe Rolle und soll nicht näher beschrieben werden. Die Zeitbereichsanalyse soll im Folgenden zusammen mit ihren Parametern erläutert werden, da sie neben der Frequenzanalyse häufig zur Erfassung der Herzratenvariabilität in Untersuchungen herangezogen wird (s. Abschnitt 4.3.1). Im Mittelpunkt der Zeitbereichsanalyse steht die variierende Zeitdauer (Einheit: ms) aufeinander folgender Herzschläge. Die Folge der Herzschläge ist dabei unrelevant. Tabelle 3.1. Definitionen der Parameter in der Zeitbereichsanalyse der Herzratenvariabilität (nach HOTTENROTT, 2002, S. 15). Weitere Bezeich- Ein- Definition/ nung heit Maß der Herzratenvariabilität Parameter RR NN ms Abstand zweier Herzschläge (R-Zacken im EKG) AvgRR RRMW ms Mittlerer Abstand aller RR-Intervalle im gewählten Zeitbereich RRSD SD, SDRR, SDNN ms Standardabweichung aller RR-Intervalle / Gesamtvariabilität RMSSD r-MSSD, rMSSD ms Quadratwurzel des quadrierten Mittelwertes der Summe aller Differenzen sukzessiver RR-Intervalle / vagaler Einfluss, Kurzzeitvariabilität ∆RRSD SDSD ms Standardabweichung der Differenzen zwischen benachbarten RR-Intervallen pNN50 % (NN50) Prozentsatz (Anzahl) aufeinander folgender RR-Intervalle, die mehr als 50 ms voneinander abweichen / größere Schwankungen der Herzfrequenz, wenn hoch, dann hohe spontane Änderungen, vagaler Einfluss DL DL ms Länge des Längsdurchmessers der 95%-Vertrauensellipse im Poincaré Plot DQ DQ, DW ms Länge des Querdurchmessers der 95%-Vertrauensellipse im Poincaré Plot SD1 stdb, SOQ, SD- ms Standardabweichung der orthogonalen Abstände der RRi/RRi+1-Punkte zum Querdurchmesser der Ellipse im Poin- quer caré Plot / Kurzzeitvariabilität SD2 stda, längs SOL, SD- ms Standardabweichung der orthogonalen Abstände der RRi/RRi+1-Punkte zum Längsdurchmesser der Ellipse im Poincaré Plot / Langzeitvariabilität A. HORN (Vortrag am 8.11.2003) sieht in der Standardabweichung das wichtigste Maß dieser Berechnungsmethode. Sie wird aus der Standardabweichung aller im 26 Autonome Regulation Messzeitbereich liegenden RR-Intervalle berechnet und gilt als frequenzunabhängiger Indikator der Gesamtvariabilität (HOTTENROTT, 2002). Die Folge der gemessenen RR-Intervalle kann auch geometrisch analysiert werden, wie es im Poincaré Plot der Fall ist. Die Herzschlagabstände werden durch Punkte in einem Koordinatensystem als zweidimensionales Streudiagramm dargestellt und ergeben die Form einer Ellipse. Die Form und die Größe der Ellipse spiegeln sich in verschiedenen Maßen der Herzratenvariabilität wider, wobei der Längsdurchmesser der Ellipse die Langzeitabweichung, ihr Querdurchmesser kurzzeitige Änderungen der Herzfrequenz beschreibt (s. dazu FERSCHA, POKAN, BACHL & SMEKAL, 1998; HOTTENROTT, 2002). Eine Auflistung der Parameter der Zeitbereichsanalyse findet sich in Tabelle 3.1. Die Frequenzanalyse oder auch Spektralanalyse wurde für die vorliegende Studie ausgewählt, da sie bei der Auswertung von Kurzzeitaufzeichnungen genauere Informationen über die Modulation durch Sympathikus und Parasympathikus und damit der Abschätzung der sympatho-vagalen Balance geben (s. FERSCHA et al., 1998). Das frequenzanalytische Verfahren wird im Rahmen der Untersuchungsmethodik beschrieben (s. Abschnitt 6.5.2.1). Tabelle 3.2. Normwerte der Herzfrequenzvariabilität (nach MALIK, 1996, S. 1061; SCHMIDT, HOFFMANN & WERDAN, 2002, S. S77). Spektralanalyse Zeitbereichsanalyse 3466 ± 1018 ms² Total Power LF 54 ± 4 n.u. 1770 ± 416 ms² High Frequency (HF) 29 ± 3 n.u. 975 ± 203 ms² LF/HF-Quotient VLF RRSD (SDNN) 141±39 ms RMSSD 27±12 ms pNN50 9±7 1,5 - 2,0 1782 ± 965 ms² HF: High frequency (0,15-0,40 Hz), LF: Low frequency (0,04-0,15 Hz), ms: Millisekunden, n.u.: normalized unit berechnet als LF/(Total Power-VLF)x100 oder HF/(Total power-VLF)x100, pNN50: Prozentsatz der Differenzen zwischen nachfolgenden RR-Intervallen, die größer als 50 ms sind, RMSSD: Quadratwurzel des Mittelwertes der Summe der mittleren quadratischen Abweichung aufeinander folgender RR-Intervalle, RRSD: Standardabweichung aller RR-Intervalle, VLF: very low frequency (0,003-0,04 Hz). Für die wichtigsten Parameter der Herzratenvariabilität werden Normwerte angegeben, die für die Spektralanalyse aus einer fünfminütigen Aufzeichnung im Liegen und für die Zeitbereichsanalyse in einer 24-Stunden-Analyse gewonnen wurden (s. Tabel27 Autonome Regulation le 3.2). Die Parameter der verschiedenen Methoden sind in einer Zeile aufgeführt, wenn sie sich bezogen auf Langzeitaufzeichnungen über 24 Stunden in etwa entsprechen (s. dazu TASK FORCE OF THE EUROPEAN SOCIETY OF CARDIOLOGY AND THE NORTH AMERICAN SOCIETY OF PACING AND ELECTROPHYSIOLOGY, 1996). Die Angabe in normalisierten Einheiten (n.u.) betont das balancierte Verhalten des parasympathischen und sympathischen Anteils des autonomen Nervensystems und minimiert den Effekt von Änderungen der Gesamtvarianz auf die Werte der LF- und HF-Komponenten (TASK FORCE, 1996). 3.2.2 Baroreflexsensitivität Der Barorezeptorenreflex nimmt eine zentrale Rolle in der konstanten Herz-KreislaufRegulation ein, insbesondere bei orthostatischer Belastung (HILZ et al., 2000). Die Konstanthaltung des arteriellen Blutdrucks erfolgt hauptsächlich durch die Funktion der Barorezeptoren innerhalb der Baroreflexschleife (HOHAGE & GERHARDT, 2000). Die Effektivität dieses Regelkreises wird mit der Baroreflexsensitivität ausgedrückt. Nach MUSSGAY und RÜDDEL (1998) lässt sich als Baroreflexsensitivität „die Empfindlichkeit, mit der Blutdruckanstiege durch eine Senkung der Herzrate beantwortet werden“ quantifizieren (S. 33). Die Maßeinheit der Baroreflexsensitivität beträgt Millisekunden pro mmHg, entsprechend der Zunahme des RR-Intervalls bezogen auf den Anstieg des systolischen Blutdrucks (HOHNLOSER, 1999). Zur Messung der Baroreflexsensitivität haben sich drei verschiedene Methoden mit entsprechenden Vor- und Nachteilen etabliert (s. hierzu HILZ et al., 2000). Die pharmakologische Methode (auch „Oxford“-Methode genannt) geht auf SMYTH, SLEIGHT und PICKERING (1969) zurück. Durch die mehrmalige, intravenöse Gabe der αAgonisten Angiotensin II oder Phenylephrin wird eine Erhöhung des Blutdruckes von 25 bis 30 mmHg bewirkt. Die systolischen Blutdruckwerte und die entsprechende Herzfrequenz in Form von RR-Intervallen werden in ein Koordinatensystem eingetragen, und es wird eine Regressionsanalyse durchgeführt. Die Steigung der Regressionsgeraden gibt die Baroreflexsensitivität an. Die größten Nachteile dieser Methode liegen in unerwünschten Nebenwirkungen wie v.a. die Beeinflussung des Baroreflexes oder die Veränderung der autonomen Ruheaktivität. 28 Autonome Regulation Die „neck chamber“-Methode basiert auf einer Unter- bzw. Überdruckstimulation der Barorezeptoren im Bereich der Aorta carotis. Diese Luftdruckänderung erfolgt entweder über eine von vorn über Hals und Karotisrezeptoren angelegte Halbschale oder einer den Hals umschließenden Kammer. Unterdruck simuliert einen Blutdruckanstieg, Überdruck einen Blutdruckabfall. ECKBERG und FRITSCH (1993) entwickelten ein Testschema, nach dem der Druck der „neck chamber“ schrittweise um 15 mmHg gesenkt wird. Aus der Differenz des systolischen Blutdrucks und dem „neck chamber“Druck wird der Karotisdistensionsdruck berechnet. Aus der Verbindung der Wertepaare der einzelnen Karotisdistensionsdruck-Werte und der jeweils entsprechenden Änderung der RR-Intervalle ergibt sich die typische sigmaförmige Kurve der Barorezeptorsensitivität. Die wichtigsten Maße sind das Maximum und das Minimum, das heißt der höchste und der niedrigste Wert der RR-Intervalländerungen. Außerdem werden der „range“ als Differenz zwischen diesen beiden Werten sowie der „operational point“ als „Verhältnis zwischen dem RR-Intervall bei systolischem Ruheblutdruck und dem „range“ der RR-Intervalle...in Prozent angegeben“ (HILZ et al., 2000, S. 43). Eine andere Testmethode mittels „neck chamber“ sieht ebenfalls die Nutzung der Unterdruckreize vor. Allerdings wird dabei jeweils über zwei Minuten ein gleich bleibender Maximaldruck von 30 mmHg genutzt, und die Stimulationsfrequenz variiert. Die Veränderungen des RR-Intervalles nach zwölf Stimulationszyklen pro Minute stellen den Index für die vagale, die Veränderungen nach sechs Zyklen pro Minute stellen den Index für die sympathische Modulation nach Barorezeptoraktivierung dar (BERNARDI, PASSINO, ROBERGS & APPENZELLER, 1997). Viele Probanden empfinden diese Methode als lästig und unangenehm. Ein wichtiger Nachteil liegt in der Art des Stimulus, da diese externen Druckveränderungen nicht physiologisch erfolgen (s. HILZ et al., 2000). Die dritte Methode bestimmt die so genannte „spontane“ Baroreflexsensitivität über eine Spektralanalyse und wurde für die vorliegende Studie verwendet. Die Beschreibung des Verfahrens findet sich im Kapitel Methodik (s. Abschnitt 6.5.2.2). Als Normalwert der Baroreflexsensitivität gibt HOHNLOSER (1999) nach ECKBERG und SLEIGHT (1992) den Bereich von 13 bis 18 ms/mmHg an, der mit der PhenylephrinMethode bei herzgesunden Probanden ermittelt wurde. La ROVERE, BIGGER, MARCUS, MORTARA & SCHWARTZ (1998) fanden bei Patienten nach Myokardinfarkt Werte von 7 29 Autonome Regulation bis 9 ms/mmHg. Laut HOHNLOSER (1999) gelten Werte unter 3 ms/mmHg als signifikant reduziert. Aufgrund der hohen Korrelation mit der pharmakologischen Bestimmung der Baroreflexsensitivität (MULDER, 1988, 125; ROBBE et al., 1987) können diese Referenzwerte auch für die spektralanalytisch bestimmte Baroreflexsensitivität angenommen werden. Eine hohe Baroreflexsensitivität geht mit einer hohen Herzvariabilität und einer niedrigen Blutdruckvariabilität einher (HOHAGE & GERHARDT, 2000). Mit steigender körperlicher Belastung nimmt der Einfluss des Barorezeptorenreflexes auf die Herzfrequenz zunehmend ab, so dass es zu dem typischen Anstieg von Blutdruck und Herzfrequenz unter physischer Belastung kommt. Unter Stress ist die Baroreflexantwort ebenfalls gehemmt (HILZ et al., 2000). Darüber hinaus führt der Konsum von Nikotin zu einer akuten und chronischen Abnahme der Baroreflexsensitivität (HOHAGE & GERHARDT, 2000). 3.2.3 Kardiovaskuläre Reaktivität Kardiovaskuläre Reaktivität beinhaltet die Änderungen der Aktivität des HerzKreislaufsystems als Antwort auf wechselnde Umgebungsbedingungen, die als stressvoll erlebt werden. Diese Bedingungen sind oft diskrete und identifizierbare Stressoren wie kurze Laboraufgaben, können aber auch einen längeren Zeitraum betreffen wie beispielsweise eine Anzahl an Arbeitsstunden (TURNER, 1994, 3). Die Reaktivität lässt sich aus der Differenz vom Aktivitätslevel unter der Belastung und dem Ausgangslevel unter Ruhebedingungen errechnen. Die kardiovaskuläre Reaktivität weist eine hohe interindividuelle Variabilität auf (SHERWOOD & TURNER, 1992), wird aber von VÖGELE (1999) als ein zeitlich stabiles und individualspezifisches Phänomen beschrieben. Das bedeutet, dass Individuen dazu neigen, auf externe Stimuli, besonders auf psychische Reize, mit bestimmten, ihnen eigenen kardiovaskulären Veränderungen zu reagieren (SHERWOOD & TURNER, 1992). Eine erhöhte kardiovaskuläre Reaktivität wird im Zusammenhang mit der Entwicklung einer Hypertonie (FREDRIKSON & MATTHEWS, 1990) und einer koronaren Herzkrankheit gesehen (KRANTZ & MANUCK, 1984). 30 Autonome Regulation 3.3 Autonome Dysregulation Eine autonome Dysregulation beinhaltet Störungen der autonomen Regulation, die die beschriebenen Regelkreise betreffen kann. Bezogen auf die Indices autonomer kardiovaskulärer Regulation können eine Verminderung der Herzratenvariabilität und/oder der Baroreflexsensitivität bzw. eine Veränderung der parasympathischsympathischen Balance mit einer vermehrten sympathischen und/oder einer gesenkten vagalen Aktivität die autonome Dysregulation widerspiegeln. Eine autonome Dysregulation wird im Zusammenhang mit verschiedenen Erkrankungen berichtet. HILZ et al. (2000) beschreiben für Patienten mit einem länger bestehenden Bluthochdruck eine Abnahme der Baroreflexsensitivität. In Folge derer bedarf es „nicht nur eines höheren Blutdruckausgangswertes, sondern zusätzlich eines stärkeren Blutdruckanstieges als bei Gesunden, um eine vordefinierte Abnahme der Herzfrequenz zu induzieren“ (S. 39). Ein Anstieg des Blutdruckes führt dann zu einem geringeren Absenken der Herzfrequenz, die maximale Veränderbarkeit der Herzfrequenz ist eingeschränkt und die Ruheherzfrequenz ist höher als bei Gesunden. Eine Zusammenstellung von Studien, die den klinischen Wert der Herzratenvariabilität bei verschiedenen kardiologischen Erkrankungen untersucht haben, findet sich bei der TASK FORCE (1996). Eine reduzierte Herzratenvariabilität wurde im Zusammenhang mit Bluthochdruck, dekompensierter Herzinsuffizienz, Herztransplantationen, Mitralklappenprolapssyndrom, Myokardiopathie, plötzlichem Herztod sowie Herzrhythmusstörungen festgestellt. VAN RAVENSWAAIJ-ARTS, KOLLÉE, HOPMAN, STOELINGA und VAN GEIJN (1993) stellen in ihrem Überblicksartikel fest, dass eine niedrigere Herzratenvariabilität bei Patienten mit Diabetes mellitus oder nach einem Myokardinfarkt mit einem erhöhten Risiko für den plötzlichen Herztod verbunden ist. Eine Vielzahl von Studien bestätigt diesen Zusammenhang für die Herzratenvariabilität und ebenso für die Baroreflexsensitivität. HENNERSDORF und STRAUER (2002) beschreiben eine autonome kardiale Neuropathie bei Patienten mit einem Diabetes mellitus, die sich in einer Reduktion der Herzratenvariabilität und der Baroreflexsensitivität zeigt. Sie vermuten, dass die diabetische Stoffwechsellage über eine Reduktion der parasympathischen Aktivität zur erhöhten 31 Autonome Regulation Rate plötzlicher Herztodesfälle bei Diabetikern beiträgt. GERRITSON et al. (2001) ermittelten ein doppelt erhöhtes Mortalitätsrisiko für Diabetiker, wenn eine Einschränkung der autonomen Regulation vorlag. NOLAN et al. (1998) ermittelten in einer groß angelegten, prospektiven Studie bei Patienten mit chronischer Herzinsuffizienz ein neunfach erhöhtes Mortalitätsrisiko, wenn die Herzratenvariabilität deutlich niedriger war (SDNN < 50 ms). Die Autoren halten die Messung der Herzratenvariabilität für ein einfach einzusetzendes Instrument, um Risikopatienten mit chronischer Herzinsuffizienz zu identifizieren. DEKKER et al. (1997) zufolge war bei Männern mittleren und höheren Alters eine verminderte Herzratenvariabilität (SDNN < 20 ms) nicht nur mit herzbedingten Todesursachen, sondern mit einem erhöhten Mortalitätsrisiko aller Ursachen, insbesondere durch Krebserkrankungen verbunden. Die Autoren folgern aus ihren Ergebnissen, dass eine verminderte Herzratenvariabilität einen Indikator für eine eingeschränkte generelle Gesundheit darstellen könnte. In einer Untersuchung bei Patienten mit dilatativer Kardiomyopathie fanden OSTERZIEL et al. (1995) in einer reduzierten Baroreflexsensitivität einen unabhängigen Risi- koparameter für die Mortalität. MORTARA et al. (1997) stellten eine reduzierte Baroreflexsensitivität als unabhängigen Prädiktor der kardialen Mortalität bei Patienten mit chronischer Herzinsuffizienz fest. In der ATRAMI-Studie (Autonomic Tonus and Reflexes After Myocardial Infarction) wurden prospektiv anhand einer großen Stichprobe sowohl eine reduzierte Herzratenvariabilität als auch eine verminderte Baroreflexsensitivität als statistisch unabhängige Prädiktoren der kardialen Mortalität bis zu 21 Monate nach einem Myokardinfarkt identifiziert. Eine niedrigere Herzratenvariabilität (SDNN < 70ms) barg ein 3,2faches, eine reduzierte Baroreflexsensitivität (< 3,0 ms/mmHg) barg das 2,8fache relative Risiko und beide Prädiktoren gleichzeitig bargen sogar das 7,3fache relative Risiko zu sterben (LA ROVERE et al., 1998). 3.3.1 Autonome Dysregulation bei Angststörungen Psychosoziale Interaktionen unterliegen ZWIENER et al. (2002) zufolge einer zerebralen autonomen Steuerung auf höheren zerebralen Ebenen und bilden damit die Voraussetzung abnormer autonomer Muster bei psychosomatischen Erkrankungen: „Da 32 Autonome Regulation die jeweils übergeordneten Ebenen dieser autonomen Hierarchie mit dieser Differenzierung auch mehr und mehr einen differenzierteren Einfluss auf untergeordnete Ebenen erlangen, sind auch bei psychischen Störungen eine Vielzahl autonomer Störmuster möglich“ (S. 1045). Patienten mit einer Panikstörung leiden unter körperlichen Missempfindungen wie Brustschmerzen, Herzklopfen bzw. –rasen, Schwindel, Kurzatmigkeit oder Schwitzen. Diese Symptome sind häufig Alarmsignale im Zusammenhang mit kardiovaskulären Erkrankungen. Es wurden allerdings keine pathophysiologischen Veränderungen, die einen Hinweis auf eine kardiovaskuläre Erkrankung geben, generell für Patienten mit Panikstörung festgestellt (EHLERS, MARGRAF, TAYLOR & ROTH, 1988; JEEJEEBHOY, DORIAN & NEWMAN, 2000). Panikstörungen sind jedoch häufig mit einer ko- ronaren Herzerkrankung (FLEET, LAVOIE & BEITMAN, 2000) und einem Übermaß an Morbidität und Mortalität, bedingt durch kardiovaskuläre Ereignisse (BIGGER et al., 1992; GRASBECK et al., 1996; HAINES, IMESON & MEADE, 1987; KAWACHI et al., 1995; VAN RAVENSWAAIJ-ARTS et al., 1993; WEISSMAN et al., 1990), verbunden. Da eine verminderte Herzratenvariabilität einen Prädiktor für kardiovaskuläre Erkrankungen und eine erhöhte Mortalität darstellt (DEKKER et al., 1997; MORTARA et al., 1997), könnte die erhöhte Morbiditäts- und Mortalitätsrate bei Panikstörungen durch eine entsprechende autonome Dysregulation bedingt sein. Der Zusammenhang zwischen einer Angststörung und der autonomen Regulation scheint nicht eindeutig geklärt zu sein (s. BERNTSON, SARTER & CACIOPPO, 1998). Es gibt jedoch viele Hinweise auf eine autonome Dysfunktion bei Angststörungen im Sinne einer verminderten Herzratenvariabilität, einer reduzierten parasympathischen Aktivität und einem erhöhten sympathischen Einfluss (FRIEDMAN et al., 1993; FRIEDMAN & THAYER, 1998a; HAMADA et al., 1998; KLEIN et al., 1995; WATKINS et al., 1998; YERAGANI et al., 1993; YERAGANI et al., 1998). WATKINS, GROSSMAN, KRISHNAN und BLUMENTHAL (1999) fanden bei älteren Menschen eine höhere Zustandsangst assoziiert mit einer reduzierten Baroreflexsensitivität. MUSSGAY und RÜDDEL (2004) untersuchten in einer klinischen Stichprobe Patienten mit einer Angststörung. Im Mittel lag die Baroreflexsensitivität mit 6,86 ms/mmHg deutlich unter dem mittleren Wert der gesunden Vergleichsgruppe mit 12,3 ms/mmHg. 41% der Patienten lagen mit ihrer Baroreflexsensitivität unter dem niedrigsten Wert, der in der gesunden Kontrollgruppe gemessen wurde. Bei 15% der Panikpatienten wurde eine Baroreflexsensitivität unter 3 ms/mmHg gemessen, was mit einem erhöhten Risiko kardiovaskulärer Mortali33 Autonome Regulation tät verbunden ist (HONZIKOVA, FISER & SEMRAD, 2000; KLINGENHEBEN et al., 1999). Die reduzierte Baroreflexsensitivität bei den Angstpatienten ging mit einer erhöhten Herzrate, einer gesenkten Herzratenvariabilität und einer veränderten sympathischparasympathischen Balance einher (MUSSGAY & RÜDDEL, 2004). Die gemessenen Unterschiede in der autonomen Regulation scheinen sich stärker in der Reaktivität als in Ausgangsmessungen unter Ruhebedingungen abzubilden (BERNTSON et al., 1998). Bei Patienten mit Panikstörungen wurde eine eingeschränkte Flexibilität und Anpassungsfähigkeit an biologische, affektive und verhaltensbezogene Anforderungen beobachtet (FRIEDMAN & THAYER, 1998b; MCCRATY, ATKINSON, TOMASINO & STUPPY, 2001). Derzeit ist noch unklar, ob die häufig festgestellte autonome Dysregulation einen auslösenden Faktor bei der Entstehung einer Angststörung darstellt, oder ob sie sich aus der Störung bzw. aus möglichen Verhaltensänderungen, die Folge der Störung sind, heraus entwickelt. ASMUNDSON, NORTON, WILSON und SANDLER (1994) führten die erhöhte Herzfrequenz unter Ruhe und submaximaler Belastung bei Angstpatienten verglichen mit gesunden Kontrollprobanden auf die verminderte körperliche Leistungsfähigkeit zurück. BROOKS et al. (1997b) stellten eine deutlich niedrigere kardiopulmonale Leistungsfähigkeit (maximale Sauerstoffaufnahme, maximale Leistung und erbrachte Leistung bei einer Laktatkonzentration von 4 mmol/l) bei Patienten mit Panikstörung im Vergleich zu gesunden, untrainierten Kontrollpersonen fest. Der überwiegende Anteil der Patienten berichtete, Ausdaueranforderungen aus Angst vor Herzerkrankungen oder –anfällen zu vermeiden. In einer Untersuchung von MIYAKODA et al. (1990) entsprach die Fahrradergometerleistung von Patienten mit Herzneurose etwa der Leistung von organisch Herzkranken. TAYLOR et al. (1987) berichteten eine signifikante Korrelation zwischen reduzierter Leistung auf dem Fahrradergometer und der Frequenz von Panikattacken. ASMUNDSON et al. (1994) fanden bei dem Vergleich von Panikpatienten mit gesunden Probanden keine Unterschiede in den autonomen Reaktionen, als sie zwei Gruppen gleichen Alters, Geschlechtes und Sportgewohnheiten in ihre Studie einschlossen. Das könnte bedeuten, dass autonome Regulationsstörungen nicht durch die Angststörung an sich, sondern möglicherweise in Verbindung mit einer verminderten körperlichen Leistungsfähigkeit entstehen. Diese kann als Folge vermehrter Inaktivität bei Panikstörungen gesehen werden, wie sie von TAYLOR et al. 34 Autonome Regulation (1987) verglichen mit inaktiven Kontrollpersonen festgestellt wurde. VAITL und HAMM (1995) berichten, dass Patienten mit einer Panikstörung deutlich mehr Zeit am Tag in liegender Position verbringen. Dies könne zu einer Verschlechterung der Orthostasetoleranz, zu einer Zunahme des Schonverhaltens und schließlich einem Absinken der körperlichen Leistungsfähigkeit führen (s. hierzu Abschnitt 2.1.3.1). Im Vergleich mit körperlich leistungsfähigeren Probanden zeigte sich bei weniger leistungsfähigen bzw. inaktiven Probanden in einer Vielzahl von Studien eine verminderte Herzratenvariabilität und Baroreflexsensitivität als Zeichen einer autonomen Dysregulation (s. Abschnitt 4.3.1). Dieser Zusammenhang scheint auch bei Angststörungen vorzuliegen. 3.3.2 Autonome Dysregulation bei somatoformen Störungen Wie bei den Angststörungen auch spielen die Wahrnehmung und Fehlinterpretation körperlicher Sensationen bei den somatoformen Störungen eine entscheidende Rolle. Nach BARSKY (1992) basiert die Somatisierung auf einer verstärkten Wahrnehmung von Körpersignalen. Diese führt laut PENNEBAKER (1982, 3) bei befragten Probanden zu häufiger berichteten körperlichen Symptomen. Sehr wahrscheinlich kann eine autonome Dysregulation irritierende Symptome hervorrufen (s. dazu SHARPE & BASS, 1992), die besonders bei Anpassungen an tägliche Anforderungen auftreten, da veränderte Bedingungen ein reibungsloses Funktionieren des autonomen Nervensystems und seiner Regelkreise erfordern. Der Zusammenhang zwischen der autonomen Regulation und somatoformen Störungen wurde bisher weniger häufig als der bezogen auf Angststörungen untersucht. LAEDERACH-HOFMANN et al. (2002) fanden innerhalb einer klinischen Stichprobe bei einem Anteil von 23% der Patienten mit einer somatoformen Störung eine reduzierte Baroreflexsensitivität, die mit Veränderungen in der Herzratenvariabilität verbunden war. RIEF, SHAW und FICHTER (1998) beobachteten bei Patienten mit Somatisierungssyndrom ein erhöhtes physiologisches Erregungsniveau verglichen mit gesunden Kontrollpersonen, das sich in einer höheren Herzrate, erhöhtem morgendlichen Kortisolspiegel und einem größeren Spannungsgefühl äußerte. Die Ergebnisse wurden von RIEF und AUER (2001) bestätigt. Sie stellten bei Patienten mit Somatisierungssyndrom spezifische physiologische Anpassungsprozesse fest. Im Gegensatz zu den gesunden Kontrollprobanden sank die Herzfrequenz der klinischen Stichprobe nicht 35 Autonome Regulation in den Pausen zwischen den mentalen Belastungsphasen ab. Die Erregung blieb hoch, so dass die Entlastungsphase nicht als Erholungsphase genutzt werden konnte. Die Patienten mit Somatisierungssyndrom fühlten sich zunehmend angespannt, während die Kontrollpersonen im Verlauf der Untersuchung sich immer entspannter fühlten. Die steigende Anspannung ging nicht mit einer erhöhten Muskelaktivität, gemessen mit dem EMG, einher. COHEN et al. (2000) stellten bei Patientinnen mit Fibromyalgie eine autonome Dysfunktion im Sinne einer erhöhten Herzrate, einer verminderten Herzratenvariabilität und parasympathischen Aktivität sowie einer gesteigerten sympathischen Aktivität unter Ruhebedingungen fest. Eine Untersuchung von MARTÍNEZ-LAVÍN, HERMOSILLO, ROSAS und SOTO (1998) bestätigte dieses Ergebnis. Die Autoren folgern daraus eine sympathische Überaktivität bei Patienten mit Fibromyalgie, die mit einer eingeschränkten Orthostasetoleranz einhergeht (BOU-HOLAIGAH et al., 1997; KELEMAN, LANG, BALINT, TROCSANYI & MÜLLER, 1988; MARTÍNEZ-LAVÍN et al., 1997; RAJ, BROUILLARD, SIMPSON, HOPMAN & ABDOLLAH, 2000). MARTÍNEZ-LAVÍN et al. (1998) fanden bei Patienten mit Fibromyalgie eine verringerte Herzratenvariabilität in 24-StundenAufzeichnungen aufgrund von einer nächtlich erhöhten sympathischen Aktivität mit übersteigertem sympathischen Einfluss auf den Sinusknoten. Abweichende TagesNacht-Rhythmen mit nächtlicher sympathischer Aktivität könnten die Schlafstörungen bei Fibromyalgie verursachen (MARTÍNEZ-LAVÍN ET AL., 1999). Zusammenfassend gehen COHEN, NEUMANN, KOTLER und BUSKILA (2001) von einem paradoxen Verhalten des autonomen Nervensystems aus: eine sympathische Überaktivität in Ruhe, die zu Symptomen wie Müdigkeit, Schlafstörungen und Missempfindungen führen kann, ist verbunden mit einer verminderten Reaktivität, die durch geschädigte Barorezeptoren bedingt sein kann. Die autonome Dysfunktion bei Fibromyalgie scheint bei Frauen stärker ausgeprägt zu sein als bei Männern. Bei Patientinnen mit Fibromyalgie ist die sympathische Aktivität stärker erhöht und der vagale Tonus stärker vermindert als bei Männern mit Fibromyalgie (COHEN, NEUMANN, ALHOSSHLE et al., 2001). Die Mortalität bei Patienten mit Fibromyalgie ist erhöht (WOLFE, HAWLEY, ANDERSON & WICHITA, 1999). Da Veränderungen der Herzratenvariabilität ebenfalls einen Prädiktor für kardiovaskuläre Morbidität und Mortalität darstellen, scheint die autonome Dysregulation bei Fibromyalgie erhebliche Bedeutung zu besitzen. 36 Autonome Regulation Ähnliche Auffälligkeiten wie eine sympathische Überaktivität und Instabilität des sympathischen Tonus wurden auch bei Patienten mit Spannungskopfschmerz (POGACNIK, SEGA, MESEC & KIAUTA, 1993) sowie mit Reizkolon (HEITKEMPER et al., 1998; KARLING et al., 1998) festgestellt. WITTLING (1998) berichtet von Unterschieden in der Stärke des tonischen Ausprägungsniveaus des Sympathikus und des Parasympathikus. Der Autor findet bemerkenswert, dass „spezifische Reaktionsmuster (z.B. hohe sympathische/niedrige parasympathische Aktivierung) außerordentlich enge Beziehungen zur somatischen Streßreagibilität und Störungsanfälligkeit sowie zu Persönlichkeitsmerkmalen der betroffenen Individuen“ aufweisen (S. 232). Bei Patienten mit somatoformen Störungen ist die körperliche Leistungsfähigkeit bedingt durch häufiges Schonverhalten teilweise stark vermindert. Der Trainingszustand kann laut RIEF und HILLER (1998) so stark reduziert sein, dass „selbst leichte körperliche Belastung bereits zu körperlichen Mißempfindungen führt“ (S. 63). BENNET et al. (1989) stellten in einer Untersuchung fest, dass über 80% der untersuchten Patienten mit Weichteilrheumatismus körperlich nicht fit waren und führen eine Anzahl der geschilderten Symptome auf den mangelnden Trainingszustand zurück. Möglicherweise entstehen also die Missempfindungen und wahrgenommenen Symptome bei somatoformen Störungen aufgrund von einer unzureichenden körperlichen Leistungsfähigkeit und einer autonomen Dysfunktion. Da ein Ausdauertraining eine Verbesserung der autonomen Regulation bei Gesunden und bei Patienten mit anderen Störungen bewirken kann (s. Abschnitt 4.3.1), könnte ein Ausdauertraining und eine verbesserte Leistungsfähigkeit sich möglicherweise auf die autonome Regulation bei Patienten mit somatoformen Störungen auswirken und damit zu einer Verbesserung der Symptomatik führen. Angststörungen und somatoformen Störungen liegen sehr ähnliche Wahrnehmungsund Bewertungsmuster zugrunde. Das Schonverhalten und die unzureichende Leistungsfähigkeit verstärken das Muster zunehmend. Beide Störungsformen stehen in Verbindung mit einer autonomen Dysregulation. Aufgrund dieser Überschneidungen wurden in der vorliegenden Studie sowohl Patienten mit einer Angststörung als auch Patienten mit einer somatoformen Störung mit einbezogen. 37 Ausdauerleistungsfähigkeit 4 Ausdauerleistungsfähigkeit Die Intervention der vorliegenden Untersuchung umfasste ein Training zur Verbesserung der Ausdauerleistungsfähigkeit, das anhand veröffentlichter Untersuchungsergebnisse über die Wirkung bestimmter Trainingsformen geplant wurde. Da zum Zeitpunkt der Untersuchungskonzeption keine Ergebnisse über die Effekte einer solchen Intervention auf die autonome Regulation bei Angst- und somatoformen Störungen vorlagen, wurden Untersuchungen bei gesunden Probanden oder Patienten mit anderen Störungsbildern herangezogen. Die beobachteten Effekte dieser Untersuchungen sollen nach einer Definition der Begriffe Ausdauer und Ausdauertraining dargestellt werden. Die Effekte auf die autonome Regulation werden für die Baroreflexsensitivität, die Herzratenvariabilität sowie die Reaktivität beschrieben. Eine tabellarische Übersicht veröffentlichter Untersuchungen findet sich bezogen auf die Leistungsfähigkeit, Herzratenvariabilität und Baroreflexsensitivität für Querschnittstudien (s. Tabelle 4.1) und in Längsschnittstudien (s. Tabelle 4.2). Die Studien über die kardiovaskuläre Reaktivität werden aufgrund der geringeren Anzahl veröffentlichter Untersuchungsergebnisse zusammengefasst (s. Tabelle 4.3). Daran anschließend werden die veröffentlichten Effekte eines Ausdauertrainings auf andere Parameter als die der autonomen Regulation für die beiden Störungsbilder getrennt beschrieben. 4.1 Definition Ausdauerleistungsfähigkeit Die Ausdauer lässt sich nach ZINTL (1994) definieren als „die Fähigkeit, physisch und psychisch lange einer Belastung zu widerstehen, deren Intensität und Dauer letztlich zu einer unüberwindbaren (manifesten) Ermüdung (= Leistungseinbuße) führt, und/oder sich nach physischen und psychischen Belastungen rasch zu regenerieren“ (S. 28). Nach HOLLMANN und HETTINGER (2000, 262) bezeichnet Ausdauer die Fähigkeit, eine bestimmte muskuläre Leistung langdauernd zu erbringen, also ermüdungswiderstandsfähig zu sein. Es werden mehrere Formen von Ausdauerleistungsfähigkeit unterschieden je nach Muskeleinsatz, Energiebereitstellung oder Belastungsdauer. In der vorliegenden Arbeit wird ausschließlich die allgemeine aerobe dynamische Ausdauer berücksichtigt, da sie in der Literatur als die am besten geeignete Methode 38 Ausdauerleistungsfähigkeit beschrieben wird, die Leistungsfähigkeit von Untrainierten präventivmedizinisch zur Erhaltung der Gesundheit zu verbessern (vgl. DE MARÉES, 2003, 317-319). Die Form ist gekennzeichnet durch • den Einsatz von mehr als 1/7 bis 1/6 der Skelettmuskulatur (allgemein) • eine Energiebereitstellung hauptsächlich aus den Brennstoffen Glukose und Fettsäuren unter Sauerstoffverbrauch (aerob) • einen rhythmischen Wechsel zwischen Kontraktion und Erschlaffung der Muskulatur (dynamisch). 4.2 Ausdauertraining HOLLMANN und HETTINGER (2000) definieren Training als „systematische Wiederholung gezielter überschwelliger Muskelanspannungen mit morphologischen und funktionellen Anpassungserscheinungen zum Zwecke der Leistungssteigerung“ (S. 117). Ein Training der allgemeinen aeroben dynamischen Ausdauerleistungsfähigkeit sollte nach folgenden Kriterien ausgelegt sein (s. DE MARÉES, 2003, 317-319): • Intensität: 50-70% der maximalen Kreislauftätigkeit • Methode: Prinzip der Dauermethode, d.h. Belastung ohne Unterbrechung • Dauer: mindestens zehn Minuten täglich, oder bei dreimaliger Belastung in der Woche etwa 30 Minuten pro Einheit • Sportarten: Laufen, Walking, Radfahren, Inlinern, Schwimmen, Skilanglauf Die Richtlinien der verschiedenen Organisationen und Kommissionen zur empfohlenen körperlichen Aktivität unterscheiden sich in der Art, Dauer, Häufigkeit und Belastungsstärke. Die American Heart Association empfiehlt beispielsweise ein moderates Ausdauertraining von 30 Minuten täglich bei einer Intensität von 40-60 Prozent der maximalen Ausdauerleistungsfähigkeit kombiniert mit einem Kraft- und Flexibilitätstraining (PEARSON et al., 2002). Die Trainingseffekte sind abhängig vom Ausgangsniveau und der Trainierbarkeit, die zum Teil auch auf genetische Faktoren zurückzuführen ist. Deshalb sollte das Training möglichst individuell ausgelegt sein. 39 Ausdauerleistungsfähigkeit 4.3 Effekte von Ausdauertraining Ein kurzfristiges Training führt zunächst hauptsächlich Auswirkungen in der Körperperipherie herbei, die die Hämodynamik und den Metabolismus betreffen. Die entstehenden gesundheitlichen Konsequenzen aufgrund herzbezogener Veränderungen fassen HOLLMANN und HETTINGER (2000) folgendermaßen zusammen: „Die Leis- tungsfähigkeit des Herzens steigt an (vergrößertes Schlagvolumen, damit vergrößertes Herzzeitvolumen). Die Ökonomie der Herzarbeit wird verbessert....Die Herzbelastung für eine gegebene physikalische Leistung der Skelettmuskulatur kann gesenkt werden“ (S. 384). Adaptationen funktionell Vegetative Regulation funktionell + morphologisch Blut Hämostase Stoffwechsel Endotheliale Sympathikotonus -freie Katecholamine -ß-Adrenorezeptorendichte -α-Adrenorezeptorendichte Parasympathikotonus NO-Synthase-Express. Peripherer Widerstand => vagotone Anteile => Ruheherzfrequenz Aerob: Muskulatur -aerobe Enzymkapazität -Myoglobin Blutlaktatspiegel bei submaximaler Belastung => oxidativer Stoffwechsel Fette -Enzymaktivität -Lipidtransport -Triglyzeride => Fettstoffwechselanteil an Energiebereitstellung -HDL-Cholesterin -LDL-Cholesterin => Schutz Arteriosklerose Kohlenhydrate -muskul. Insulinsensitiv. morphologisch Gefäße Herz Plasmavolumen Kapillardichte Ery absolut Kollateralen Rheologie Ery Arter. Gefäßquerschnitt Thrombozytenaggregation Fibrinolyseaktivität => Thrombusbildung im Blut => Infarktrisiko ( ) Myokardmasse Herzvolumen => Ökonomisierung der Herzarbeit Abbildung 4.1. Adaptationen durch aerobes Ausdauertraining (nach Jeschke & Zeilberger, 2000 und Zintl, 1994, S.125). Eine dreimalige Ausdauerbelastung pro Woche für jeweils 30 bis 40 Minuten führt schon nach zwei bis drei Wochen zu einem verringerten Atemvolumen und einer niedrigeren Herzfrequenz für vergleichbare Belastungen, wahrscheinlich bedingt durch eine verbesserte Verteilung des durch den arbeitenden Muskel fließenden Blutes und einer verbesserten Kapillarisierung der Muskelfasern. Dadurch steigt die Sauerstoffausschöpfung im Muskel (DE MARÉES, 2003, 318). Im weiteren Trainings40 Ausdauerleistungsfähigkeit verlauf kommt es zu einer verbesserten aeroben Energiebereitstellung in der Muskelzelle durch eine Vermehrung der Mitochondrien und Enzyme, größeren Glykogendepots sowie einer leichteren Mobilisierbarkeit der Fettsäuren aus den Fettdepots. Das Blutvolumen vergrößert sich und das Schlagvolumen steigt an (HECK, 1990, 68f.), so dass auch die Herzfrequenz unter Ruhebedingungen sinkt. ZINTL (1994, 70) beschreibt ein Überwiegen des Vagotonus in Ruhe bei Trainierten, das eine verkürzte Erholungszeit nach Belastungen und die Senkung der Ruheherzfrequenz zufolge hat. Eine Übersicht der Anpassungsveränderungen durch ein Ausdauertraining gibt Abbildung 4.1. HOLLMANN und HETTINGER (2000) führen die Veränderungen als „kardial und vaskulär protektive Mechanismen von regelmäßiger körperlicher Aktivität“ auf und stellen zusammenfassend fest: „Zwischen ausdauertrainierten Personen und gleichaltrigen untrainierten bestehen hochsignifikante Differenzen in kardiopulmonalen, hämodynamischen, metabolischen und hormonellen Detailfaktoren“ (S. 382f.). 4.3.1 Effekte auf die Baroreflexsensitivität und Herzratenvariabilität Da eine verminderte Herzratenvariabilität und Baroreflexsensitivität im Zusammenhang mit einer erhöhten Mortalität stehen, erscheint die Frage bedeutend, wie die beiden Parameter erhöht werden können. Aufgrund der bekannten kardiovaskulären Auswirkungen eines Ausdauertrainings wurde die These erstellt, ein Ausdauertraining könnte die Herzratenvariabilität und Baroreflexsensitivität erhöhen. Empirische Belege zur Überprüfung der These wurden mittels zweier unterschiedlicher Ansätze verfolgt. Zum einen wurden in Querschnittstudien (s. Tabelle 4.1) trainierte bzw. aktive mit untrainierten bzw. inaktiven Probanden verglichen. Zum anderen wurden in Längsschnittstudien (s. Tabelle 4.2) die Auswirkungen einer Intervention in Form eines Ausdauertrainings auf die Parameter der autonomen Regulation untersucht. Die vorliegenden Ergebnisse sind uneinheitlich. In Querschnittstudien wurde eine höhere (BARNEY et al., 1988; GREGOIRE et al., 1996; STEPTOE et al., 1993; UENO et al., 2002), eine gleich hohe (FIOCCHI et al., 1985; REILING & SEALS, 1988) und eine niedrigere Herzratenvariabilität bzw. Baroreflexsensitivität (SMITH & RAVEN, 1986) bei Trainierten im Vergleich mit Untrainierten festgestellt. Allerdings überwiegen die Studien, die eine höhere Ausprägung der Parameter für Trainierte festgestellt haben. Auch im Bereich der Längsschnittstudien gibt es keine einheitliche Ergebnislage. Es wurde eine Verbesserung der Baroreflexsensitivität (LA ROVERE et al., 2002; MCDO41 Ausdauerleistungsfähigkeit NALD et al, 1993; SOMERS et al., 1991) sowie der Herzratenvariabilität (COATS et al., 1992; LEE et al., 2003; SCHUIT et al., 1999; SOMERS et al., 1991) nach einem Ausdauertraining gefunden. In anderen Studien zeigten sich hingegen keine Veränderungen durch Training bezogen auf die Herzratenvariabilität (BONADUCE et al., 1998; BOUTCHER & STEIN, 1995; LOIMAALA et al., 2000; MACIEL et al., 1985) oder die Baroreflexsensitivität (DAVY et al., 1997; DE GEUS, 1996; UUSITALO et al., 1998). MTINANGI und HAINSWORTH (1998; 1999) stellten ein Absinken der Baroreflexsensitivität nach einem Ausdauertraining fest. Die Aussagekraft einiger Studien wird begrenzt durch nicht kontrollierte Studienbedingungen, eine fehlende Randomisierung oder die geringe Probandenanzahl. Darüber hinaus gibt es eine Anzahl methodischer Gründe für diese unterschiedlichen Ergebnisse. Die Messbedingungen sind nicht einheitlich. Die Baroreflexsensitivität wurde pharmakologisch, durch Druck- bzw. Unterdrucktechniken über die Karotisrezeptoren oder mittels unterschiedlicher Berechnungsformen der Blutdruckund Herzfrequenzvarianz gemessen. Die beiden ersten Verfahren verändern die kardiovaskuläre Regulation bereits vor der Messung und können durch den emotionalen Stress für die Patienten unerwünschte Auswirkungen auf die Messergebnisse erzielen (vgl. DE GEUS et al., 1996; HILZ, 2000). Die Herzratenvariabilität wurde teilweise über eine Zeitbereichs- und teilweise über eine Frequenzanalyse ermittelt. Zumindest bei Trainierten korrelierten die Parameter beider Verfahren nicht miteinander (SACKNOFF, GLEIM, STACHENFELD & COPLAN, 1994). Die Aufzeichnung der Herzschläge erfolgte mit unterschiedlicher Dauer (von wenigen Minuten bis hin zu Langzeitaufzeichnungen von 48 Stunden) und unterschiedlicher Genauigkeit. Die Probandenpopulationen waren sehr unterschiedlich. Eine Anzahl der Studien untersuchte gesunde Probanden, andere Patienten nach Herzinfarkt, mit einem Diabetes oder einer Adipositas. Die Interventionen der Längsschnittstudien wichen stark voneinander ab in der Interventionsdauer, Trainingsfrequenz und –intensität. 42 Ergebnisse Ergometrie, Messung der BRS über Karotisrezeptoren VO2max größer, HRRuhe niedriger und BRS niedriger in TG1 als in TG2 und in NG Baroreflexsensitivität niedriger bei Ausdauertrainierten Design 43 n=24; gesunde, männl. Studenten TG = 12; Mitglieder im Crosslauf-Team NG = 12; kein regelmäßiges Ausdauertraining Reiling & Seals, 1988 HRV-Messung in Ruhe, Zeitbereichsanalyse, Messung der BRS über Karotisrezeptoren Ergometrie, Untersuchung BRS über Karotisrezeptoren HRRuhe bei TG niedriger, HRV: RRSD n.s. und BRS n.s. verschieden zwischen TG und NG keine signifikanten Korrelationen zwischen BRS und Variablen wie Alter, Gewicht, HR, Leistungsfähigkeit Postulat, parasympathische Aktivität sei höher im ausdauertrainierten Status wurde experimentell nicht nachgewiesen. Es gibt keine Beziehung zwischen BRS und der HR oder anderen Parametern körperl. Fitness. Unwahrscheinlich, dass körperliches Training oder Fitness signifikanten Einfluss auf die Höhe der BRS haben. n=20; gesunde junge Männer, 19-31J. VO2max und Aktivitätslevel: TG = 11; sehr fit NG = 9; inaktiv n=16; gesunde Männer TG = 8; trainiert NG = 8; nicht trainiert Barney et al., 1988 Goldsmith, Bigger, Steinman & Fleiss, 1992 Ergometrie, LangzeitAufzeichnung zur Messung der HRV, Zeitbereichs- und Spektralanalyse Ruhemessung des Vagotonus und der BRS über die Karotisrezeptoren Es besteht ein signifikantes Verhältnis zwischen der Leistungsfähigkeit und der Ausgangsherzfrequenz, Respiratorischer Sinusarrhythmie und der BRS. Bei erhöhter Leistungsfähigkeit (VO2max) sind der Vagotonus und die BRS erhöht. Parasympathische Aktivität erheblich größer bei Trainierten, Ausdauertraining kann parasympathische Aktivität anheben und autonome Dysregulation kardiovaskulärer Erkrankungen verbessern. RRSD und RSA höher in TG, BRS höher als in NG HF tagsüber, nachts und während 24hVerlauf größer in TG als in NG Baroreflexsensitivität und/oder Herzratenvariabilität höher bei Ausdauertrainierten n=24; männl. Radfahrtouristen, durchschnittl. 41J. Schlussfolgerungen Bei Ausdauertrainierten wird der Blutdruck weniger effektiv aufrechterhalten, was auf eine verminderte BRS zurückgeführt wird. Baroreflexsensitivität oder Herzratenvariabilität unbeeinflusst bei Ausdauertrainierten n=24; junge Männer TG1 = 8; ausdauertrainiert TG2 = 8; Gewichtheber NG = 8; inaktiv Probanden Fiocchi, Fagard, Staessen, Vanhees & Amery, 1985 Smith & Raven, 1986 Autor Tabelle 4.1. Querschnittstudien über die Leistungsfähigkeit, Herzratenvariabilität und Baroreflexsensitivität bei aktiven und inaktiven Probanden. Ausdauerleistungsfähigkeit 44 Ergometrie, Messung der spontanen BRS in Ruhe, während und nach mentalen Belastungsaufgaben, denen Ergometerbelastung vorausging n=80; gesunde Frauen und Ergometrie, HRVMessung unter Ruhe, Männer Spektralanalyse 8 Gruppen, jeweils n=10 gebildet nach Geschlecht, Alter (18-30, 40-55J.), Trainingszustand (trainiert: mehr als 5x45 min/ Woche) n=72; junge Männer TG = 36; Athleten NG = 36; inaktiv Steptoe, Kearsley & Walters, 1993 Ruhemessung der HRV, Spektralanalyse Gregoire, Tuck, Yamamoto & Hughson, 1996 n=66; gesunde, junge Männer TG = 33; Athleten, durchschnittl. Trainingszeit 18h pro Woche NG = 33; inaktiv Puig et al., 1993 Ergometrie, Blutdruckmessung, HRV-Messung nach der Methode von De Meersman Messung HRV mit Zeitben=30 (4 weibl.); gesund TG = 12; hochtrainierte Aus- reichs- und Spektralanalyse in Ruhe dauerathleten NG = 18; untrainiert n=144; gesunde Männer, 15-83J. TG = 72; hohe altersbezogene VO2max NG = 72; geringe altersbezogene VO2max De Meersman, 1993 Design Sacknoff, Gleim, Stachenfeld & Coplan, 1994 Probanden Autor Regelmäßige körperli. Aktivität spielt eine Rolle bei Aufrechterhaltung erhöhter HRV aktiver Männer, scheint langfristig ausgeübt das altersbedingte Absinken der HRV abzuschwächen, mögliche nichtmedikamentöse kardioprotektive Therapieform. Schlussfolgerungen HRRuhe niedriger bei Trainierten, Trainierte mittleren Alters höhere Total Power, Sympathische Aktivität niedriger, bei Frauen HRV höher und sympath. Anteil niedriger als bei Männern, aktive mittleren Alters niedrigere HRV als junge Aktive HRRuhe niedriger in TG, pNN50 und RRSD höher in TG, Total Power, HF und LF niedriger in TG als in NG, Korrelation zwischen Zeitbereichs- und Spektralanalyseparameter nur in NG, nicht in TG VO2max höher, HRRuhe niedriger und BRS höher unter Ruhe in TG als in NG, unter mentaler Stressbelastung keine Unterschiede in der HR, aber systolischer und diastolischer Blutdruck in TG niedriger als in NG Regelmäßige körperl. Aktivität im mittleren Alter führt zu reduzierter sympathischer und gesteigerter parasympathischer Aktivität in Ruhe, trägt damit zu Gesundheit und vermindertem Risiko kardiovaskulärer Erkrankungen bei. Höhere HRV und parasympathischer Anteil könnten Faktor für das bekannte niedrigere kardiovaskuläre Risiko von Frauen sein. Trainierte weisen in der Zeitbereichsanalyse, nicht aber in der Spektralanalyse, höhere HRV und parasympathische Aktivität auf. Spektralanalyse möglicherweise zu ungenau bei hoch Ausdauertrainierten. Sportlich Aktive mit erhöhter Leistungsfähigkeit haben in Ruhe eine erhöhte BRS, die die Fähigkeit widerspiegelt, Blutdruckänderungen über die Herzrate gut auszugleichen, und die zu einer höheren Stabilität in der kardiovaskulären Regulation führt. Die Reaktivität bezogen auf mentale Belastungen nach körperlicher Belastung scheint bezogen auf den Blutdruck verbessert zu sein. HR niedriger bei TG als bei NG (durchschnittl. Körperliches Training führt zu einem Senken der HR und einem Anstieg der HRV aufgrund 18 S/min), von gesteigerter parasympathischer Aktivität. alle auf die R-R-Intervalle bezogenen Parameter höher in TG als in NG, Total Power, LF und HF höher für TG als für NG, LF/HF nicht unterschiedlich VO2max in den Altersgruppen höher für TG, Abnahme der funktionellen aeroben Kapazität pro Altersdekade niedriger für TG, HRV und RSA höher bei TG als bei NG für die Altersgruppen 15-26J., 46-5J. und 56-65J. Ergebnisse Ausdauerleistungsfähigkeit n=30; gesunde junge Männer (durchschnittl. 21J.) TG = 15; hochtrainierte Radfahrer nach 1 Monat reduziertem Training NG = 15; kein Leistungssport n=40; gesunde Studenten, durchschnittl. 19J. TG = 20; sehr aktiv/fit NG = 20; wenig aktiv/fit n=37; gesunde Männer, durchschnittl. 33J. nach selbstberichtetem wöchentl. Aktivitätslevel: TG1 = 12; hoch aktiv TG2 = 10; moderat aktiv TG3 = 15; wenig aktiv Bonaduce et al., 1998 Rossy & Thayer, 1998 Melanson, 2000 HRRuhe, VO2max und HRV-Parameter höher in TG als in NG, LF/HF-Verhältnis geringer 45 5 aufeinander folgende Tage HRV-Messung, Zeitbereichs- und Spektralanalyse Reproduzierbarkeit HR und HRV-Parameter R > 0,90 unbeachtet des Aktivitätslevels, HRRuhe in TG1 niedriger, HRV-Parameter tendenziell höher bei Aktiven (TG1 und TG2), zwischen TG1 und TG2 keine Unterschiede N-EX: Fragebogen zur TG höhere HRV und HF in Ruhe, Selbsteinschätzung der Frauen höhere HF als Männer Fitness, Messung HRV mit Zeitbereichs- und Spektralanalyse in Ruhe und unter mentaler Belastung Ergometrie, LangzeitAufzeichnung der HRV, Zeitbereichs- und Spektralanalyse Messungen der HR und HRV hoch reduzierbar ungeachtet körperlichen Aktivitätslevels. HRV-Parameter scheinen höher bei Aktiven, aber Zunahme nicht dosisabhängig mit steigendem Aktivitätslevel zusammenzuhängen. Kleine Unterschiede der aeroben Leistungsfähigkeit resultieren in bedeutenden Unterschieden der autonomen Regulation. Die vagale Dominanz der sehr fitten Probanden zeigt sich bei verschiedenen Laborstressoren. Geschlechtsspezifische Unterschiede zeigen sich in höherer vagalen Aktivität der Frauen, die sich ähnlich wie körperl. Fitness in der Reduktion des KHK-Risikos auswirkt. Athleten besitzen nach einem Monat aktiver Trainingspause (5x1h/Woche Training) eine erhöhte parasympathische Aktivität und geringere Herzrate in Ruhe verglichen mit Nichtathleten. Die hoch ausdauertrainierten Läufer haben eine erhöhte HRV und eine höhere parasympathische Aktivität im Vergleich zu weniger Aktiven. Diese könnte die niedrigere HR erklären. Gesteigerte HRV könnte die positiven präventiven Effekte von Training bezogen auf kardiovaskuläre Mortalität erklären. Rennradfahren als Ausdauertraining führt zu einer gesteigerten parasympathischen Kontrolle der HR über einen verstärkten vagalen Antrieb des Sinusknotens. HRRuhe niedriger, Ausdauerleistungsfähigkeit höher, AvgRR und HF höher in TG als in NG n=29; junge, gesunde Män- Langzeit-Aufzeichnung der HR nachts in TG niedriger als in NG, durchschnittl. 14 S/min, HRV, Zeitbereichs- und ner HRV in allen Spektralbereichen höher, Spektralanalyse TG = 16; Leistungssportler pNN50 und rMSSD höher in TG als in NG im Mittel-/Langstreckenlauf NG = 13; inaktiv bis moderat aktiv Schlussfolgerungen Ergebnisse Jensen-Urstad, Saltin, Ericson, Storck & Jensen-Urstad, 1997 Ergometrie, Messung der HRV, Spektralanalyse Design n=20; gesunde Männer TG = 10; Rennradfahrer NG = 10; ≤ 2h Sport/Woche Probanden Macor, Fagard & Amery, 1996 Autor Ausdauerleistungsfähigkeit Messung der HRV, Spekt- Unter Ruhebedingungen Total Power, HF und Ältere Menschen mit höherer kardiorespiratorischer Fitness haben höhere parasympathiralanalyse, Lagewechsel- BRS höher in TG als in NG test zur Messung der BRS sche Aktivität, die altersbedingte Veränderungen des Herzens reduzieren, die sonst zu Absinken der BRS führen würden. Aktiver Lebensstil im Sinne eines kardioprotektiven Faktors. 46 Anmerkungen. AvgRR: Mittlerer Abstand aller RR-Intervalle im gewählten Zeitbereich, BRS: Baroreflexsensitivität, h: Stunde, HF: High frequency-Band, HR: Herzrate, HRmax: Maximale Herzrate, HRRuhe: Herzrate in Ruhe, HRV: Herzratenvariabilität, J.: Jahre, KHK: Koronare Herzkrankheit, LF: Low frequency-Band, LF%: Prozentualer LF-Anteil am Gesamtspektrum, LF/HF: Verhältnis von Low Frequency zu High Frequency Power, min: Minute, n: Stichprobengröße, NG: Gruppe der Nichttrainierten, n.s.: nicht signifikant, pNN50: Prozentsatz aufeinander folgender RR-Intervalle, die mehr als 50 ms voneinander abweichen, rMSSD: Quadratwurzel des quadrierten Mittelwertes der Summe aller Differenzen sukzessiver RR-Intervalle, RR: Abstand zweier Herzschläge, RRSD: Standardabweichung aller RR-Intervalle, RSA: Respiratorische Sinusarrhythmie, S/min: Schläge pro Minute, TG: Gruppe der Trainierten, VO2max: Maximale Sauerstoffaufnahme. n=24; gesunde ältere Männer, 60-70J. nach Fahrradergometrie: TG = 12; fit NG = 12; unfit Ueno, Hamada & Moritani, 2002 Parasympathikus spielt im Ausdauerbereich eine größere Rolle als im Kraftsport, für den der Sympathikus entscheidender zu sein scheint. HRV und parasympathische Aktivität bei Ausdauertrainierten höher als bei Inaktiven. HRRuhe in TG1 niedriger als in TG2 und NG, Parameter der HRV TG2 vs. NG nicht unterschiedlich, TG1 vs. NG: Total Power und HF höher in Liegephasen, keine Unterschiede im LF, TG1 vs. TG2: LF% niedriger standardisierter Lagewechseltest mit Messung der HRV, Zeitbereichsund Spektralanalyse BRS kann durch regelmäßige Aktivität im mittleren Alter aufrechterhalten werden. Das altersbedingte Absinken der BRS kann durch Aktivität reduziert werden, wobei bereits moderate Aktivität ausreichenden Reiz darstellt. Schlussfolgerungen VO2max am niedrigsten bei Inaktiven, am höchsten bei Trainierten, nahm mit zunehmendem Alter ab, HRRuhe niedriger mit steigender Aktivität, bei Inaktiven BRS sinkend mit steigendem Alter, bei Aktiven (jung, mittel) kein Unterschied, bei jungen Männern BRS unabhängig von Alter, bei den Älteren Aktive höhere BRS als Inaktive Ergebnisse König, Schumacher, n=116 (45 weibl.); 18-40J. Schmidt-Trucksäss & TG1 = 76; ausdauertrainiert Berg, 2002 TG2 = 10; Kraftsportathleten (TG1 und TG2: A-D-Kader) NG = 30 Design Ergometrie, Lagewechseltest zur Messung der BRS (Valsalvas Manöver) und HRV, Zeitbereichs- und Spektralanalyse Probanden n=133; gesunde Männer, 18-79J., 9 Gruppen: 3 Altersklassen und 3 Aktivitätsstufen: inaktiv, moderat (3-5x/Woche), ausdauertrainiert Monahan et al., 2000 Autor Ausdauerleistungsfähigkeit nicht kontrolliert Kraft- und Ausdauertraining 11-12min tägl. bis zu einem altersspezifischen Ziel Ergometrie, Messung Blutdruck, der Orthostasetoleranz im Lagewechseltest, der BRS über die Karotisrezeptoren nicht kontrolliert Fitness und Orthostasetoleranz 2-3 Monate Kraft- und Ausdauertraining, 11- angestiegen, BRS gesunken 12min tägl. mit altersspezifischem Ziel Ergometrie, Messung Orthostasetoleranz in Lagewechseltest, BRS über Karotisrezeptoren n=14; unerklärte Anfälle von Synkopen und niedriger Orthostasetoleranz n=11 (2 weibl.); inaktiv Mtinangi & Hainsworth, 1998 Mtinangi & Hainsworth, 1999 Ergebnisse 47 Schlussfolgerungen Moderates körperliches Training führt zu einer Verbesserung der Orthostasetoleranz bei Inaktiven, deren Ausgangswert niedrig ist. Die BRS fiel dabei deutlich ab. Moderates Training senkt die BRS, aber steigert die Orthostasetoleranz und das subjektive Befinden mit einer Verbesserung der Symptome. Reduktion der Ruheherzfrequenz wurde bestätigt, kein Anhaltspunkt für eine Steigerung der parasympathischen Aktivität in Ruhe durch körperliche Aktivität oder gesteigerte Fitness Ein kurzes aerobes Ausdauertraining führt zu keiner HRV-Veränderung. Der HRVAusgangswert könnte die Adaptationsfähigkeit an aerobes Training beeinflussen. VO2max gesteigert, HRRuhe gesenkt, HRV und RSA nach Training unverändert, keine Korrelation zwischen VO2max und RSA-Größe HRRuhe gesenkt, VO2max gesteigert, EG mit hoher Ausgangs-HRV höhere Anstiege der VO2max, bei HRV-Parametern kein Unterschied zwischen EG und KG nicht kontrolliert; 10 Wochen Ergometertraining, 5x/Woche, 60-90% HRmax Ergometrie, Messung RSA und HRV durch Atropingabe randomisiert, kontrolliert 9 Wochen Ausdauertraining: 3x20-30min/Woche, 60% HRmax Ergometrie, Messung HRV in Zeitbereichsanalyse n=7; gesunde Männer, durchschnittl. 29J. n=34; inaktive Männer mittleren Alters EG = 19 KG = 15 EG unterteilt in hohe HRV = 5 niedrige HRV = 5 Maciel et al., 1985 Boutcher & Stein, 1995 Baroreflexsensitivität und/oder Herzratenvariabilität unbeeinflusst durch Ausdauertraining HR und Blutdruck gesunken, Orthostasetoleranz gestiegen, BRS gesunken, Verbesserung der Symptome Baroreflexsensitivität gesenkt durch Ausdauertraining Design Probanden Autor Tabelle 4.2. Längsschnittstudien über die Leistungsfähigkeit, Herzratenvariabilität und Baroreflexsensitivität nach Trainingsinterventionen. Ausdauerleistungsfähigkeit 48 n=22 (13 weibl.); inaktiv, insulinpflicht. Diabetes EG1 = 8, keine autonome Neuropathie EG2 = 8, beginnende autonome Neuropathie EG3 = 6, manifestierte autonome Neuropathie n=15; hochtrainierte, junge, männl. Radfahrer nach 1 Monat aktiver Trainingspause Howorka et al., 1997 Bonaduce et al., 1998 nicht kontrolliert 5 Monate hochintensives Training: 21h/Woche Radfahren und 5x1h/Woche zusätzliches Ausdauertraining Ergometrie, Messung Blutdruck, HRV mit Zeitbereichs- und Spektralanalyse intrapersoneller Vergleich durch Baselineerhebung 4-6 Wochen vor Trainingsbeginn 12 Wochen Training: Fahrradergometer, 2x30min/Woche, 60-70% der maximalen Leistungsfähigkeit Ergometrie, Messung Blutdruck, HRV mit Zeitbereichs- und Spektralanalyse n=8; weibl., inaktiv, post- nicht kontrolliert 12 Wochen Ausdauertraining eigenständig menopausal, 50-60J., zuhause, 3,3x43min/Woche gehen, 70% mit erhöhtem Blutdruck HRmax Ergometrie, Messung Blutdruck, HRV in Zeitbereichs- und Spektralanalyse und spontane BRS Davy, Willis & Seals, 1997 nicht randomisiert EG1 und EG2 1,5-2,5h/Woche Training EG3 mindestens 2,5h/Woche Training bei 70% HRmax Ergometrie, Messung Blutdruck, HRV mit Spektralanalyse und spontaner BRS in Ruhe und unter mentaler Stressbelastung Design n=60; inaktive Männer EG1=19; 4 Monate Training, 4 Monate inaktiv EG2=19; 4 Monate inaktiv, 4 Monate Training EG3=11; 8 Monate Training KG = 11; inaktiv Probanden De Geus et al., 1996 Autor Ein intensives Training verändert bei Athleten trotz gestiegener Leistungsfähigkeit und gesunkener Herzrate nicht die HRV und die parasympathische Aktivität. Regelmäßiges Ausdauertraining erhöht bei Diabetikern ohne oder mit beginnender autonomer Dysregulation die HRV durch verbesserte sympathische und parasympathische Aktivität. Bei manifestierter Neuropathie konnten mit diesem Training keine Effekte auf die HRV erzielt werden. VO2max angestiegen, Blutdruck gesenkt nur nach Training, Total Power und HF in EG1 und EG2 nach Training erhöht, nach 4-6 Wochen Pause nicht mehr erhöht, EG3 keine Änderungen in HRV VO2max gesteigert, HRRuhe und diastol. Blutdruck gesenkt HRV-Parameter bei der Zeitbereichs- und Spektralanalyse unverändert 12wöchiges, moderates Ausdauertraining führt zu keiner Änderung von HRRuhe, HRV in Ruhe oder BRS trotz einer Blutdrucksenkung des zuvor erhöhten Blutdruckes. Änderung bedarf größerer Trainingsreize und/oder anderer physiologischer Veränderungen. Ausdauertraining beeinflusst nicht den Vagotonus oder die BRS in Ruhe oder unter mentaler Belastung, aber die Reaktivität im Sinne einer gesenkten HR und eines niedrigeren Blutdruckes. Bei Personen mit geringem Vagotonus wie z.B. Hypertoniker könnte ein Anstieg des Vagotonus und der BRS mit trainingsinduziertem Absinken der HR und des Blutdrucks einhergehen. Schlussfolgerungen Anstieg der Belastungszeit bei Ergometrie, keine signifikanten Änderungen von VO2max, HRRuhe, HRV in Ruhe oder BRS vor Training keine Beziehung zwischen VO2max, HRV oder BRS, keine Veränderungen der HRV oder BRS in Ruhe/Belastung, EG3 VO2max gesteigert, HR und diastol. Blutdruck unter Belastung gesenkt , bei größtem Absinken der HR nach Training tendenziell Anstieg der HRV Ergebnisse Ausdauerleistungsfähigkeit n=83; gesunde, untrainierte Männer, 35-55J. EG1 = 26 EG2 = 28 KG = 26; ≤ 2x/Woche körperliche Aktivität Loimaala, Huikuri, Oja, Pasanen & Vuori, 2000 49 kontrolliert, randomisiert 5 Monate Joggen/Walken, 1x/Woche angeleitet, 4-6x/Woche, mind. 30min EG1 55% VO2max; EG2 75% VO2max Ergometrie, Messung HRV mit Zeitbereichsund Spektralanalyse, BRS pharmakologisch kontrolliert, nicht randomisiert 6-9 Wochen sehr intensives Training: 7x/Woche, 70-90% VO2max, überwacht, Ziel: Übertraining Ergometrie, Messung HRV in Zeitbereichsanalyse, BRS pharmakologisch nicht randomisiert, kontrolliert 30 Wochen Walking/Joggen, 3-4x30-40min/Woche, 68-81% HRmax Ergometrie, Messung der HRV mit Zeitbereichsanalyse, Messung der BRS über Karotisrezeptoren randomisiert, kontrolliert 12 Wochen Training: EG: Ausdauer, 3x50min/Woche, ≥ 70% VO2max KG: Kräftigung/Dehnung 2x50min/Woche Ergometrie, HR und Blutdruck während und nach mentaler Stressbelastung n=19; gesunde, inaktive Männer, 45-68J. EG = 11; Intervention KG = 8; kein regelmäßiges Ausdauertraining n=35; gesunde Männer, durchschnittl. 42J. EG = 20 KG = 15 Blumenthal et al., 1990 nicht kontrolliert; 6 Monate Ausdauertraining, 5x40min/Woche, angeleitet Messung der BRS pharmakologisch, Messung der HRV mit Spektralanalyse Seals & Chase, 1989 Pagani et al., 1988 n=11 (3 weibl.); leicht erhöhter Blutdruck n=15; gesunde, trainierte Ausdauerathletinnen EG = 9 KG = 6 eigenes Trainingsschema Uusitalo, Uusitalo & Rusko, 1998 Design VO2max in allen Gruppen gestiegen, in EG2 höher als in KG, HRRuhe gesunken in EG2, keine Veränderung der BRS, HRV-Parameter in EG2 tendenziell gestiegen, keine signifikanten Änderungen VO2max unverändert in EG und KG, bei 5 der EG VO2max gesunken, BRS unverändert, LF in EG angestiegen Ergebnisse EG verglichen mit KG: VO2max gesteigert, HRRuhe gesenkt, Reduktion des Anstiegs der HR und des diastol. Blutdrucks während und nach Stressbelastung VO2max gesteigert, HRRuhe und HRmax gesenkt, RRSD gesteigert in EG verglichen mit KG, BRS unverändert, kein Unterschied zwischen EG und KG HRRuhe gesenkt, LF gesenkt und HF angestiegen, BRS angestiegen und positiv mit dem Absinken der HRRuhe korreliert Schlussfolgerungen Ein 5monatiges, erfolgreiches, hochintensives Ausdauertraining zeigt keinen Effekt auf die kardiale autonome Funktion gemessen an HRV und BRS. Klinisch relevante Steigerung der HRV oder BRS benötigt eine lange Trainingsdauer, wahrscheinlich über viele Jahre. Hochintensives Ausdauertraining bzw. Übertraining ändert nicht BRS, aber führt zu Anstieg der LF als Zeichen gestiegener sympathischer Aktivität. Um Änderung der BRS bei Ausdauerathleten zu erzielen, werden mehr als 6-9 Wochen benötigt. Bei sehr Trainierten gibt es unterschiedliche Typen in der Baroreflexreaktivität. Ausdauertraining reduziert die kardiovaskulären Antworten während und nach mentaler Stressbelastung im Sinne einer verbesserten Reaktivität. Strenges Ausdauertraining führt bei gesunden, inaktiven Männern mittleren Alters zu einem Anstieg der maximalen Leistungsfähigkeit, einer Reduktion der Ruheherzfrequenz und zu einem Anstieg der HRV in Ruhe durch Erhöhung des Vagotonus. Regelmäßiges Ausdauertraining sollte Bestandteil der Behandlung von Patienten mit KHK sein. Körperliches Training führt zu einer Wiederherstellung sympathovagaler Balance mit einer erhöhten BRS und einem Anstieg vagaler Modulation. Baroreflexsensitivtät und/oder Herzratenvariabilität erhöht durch Ausdauertraining Probanden Autor Ausdauerleistungsfähigkeit 50 Al-Ani, Munir, n=11 (1 weibl.); jung, White, Townend & gesund, relativ untraiCoote, 1996 niert n=13, inaktive, normotone Männer, 22-34J. EG = 9 KG = 4 McDonald, Sanfilippo & Savard, 1993 n=17; Männer mit chron. Herzinsuffizienz, ohne Angina PectorisAnzeichen, durchschnittl. 62J. Erst Training = 8 Erst Ruhe =9 Coats et al., 1992 n=9; junge, gesunde Athleten n=16 (2 weibl.); inaktiv, grenzwertig hyperton, durchschnittl. 35J. Somers, Conway, Johnston & Sleight, 1991 De Meersman, 1992 Probanden Autor VO2max gestiegen, HR, systol., diastol. und mittlerer arterieller Blutdruck in Ruhe gesenkt, keine Änderung der BRS über Karotisrezeptoren, spontane BRS angestiegen VO2max gesteigert, HRRuhe gesenkt, HRV und HF bei 9 Probanden gestiegen, bei 2 Probanden gesunken randomisiert, kontrolliert 10 Wochen Training: 3x60min/Woche Ergometer, angeleitet, 60% VO2max Ergometrie, Messung Blutdruck, BRS über Karotisrezeptoren und spontane BRS nicht kontrolliert 6 Wochen Ausdauertraining: 25min tägl. Radfahren, 85% HRmax Ergometrie, Messung HRV in Spektralanalyse, Messung RSA Intensives Training führt zum Anstieg der Leistungsfähigkeit verbunden mit einer Verbesserung der HRV. Das Absinken der HR scheint aufgrund des Anstiegs des vagalen Tonus verursacht zu sein. Eine sehr niedrige HRRuhe scheint den Anstieg des vagalen Tonus widerzuspiegeln. Ein 10wöchiges, moderates Ausdauertraining führt zu einem gesenkten arteriellen Blutdruck und gesenkter Herzrate in Ruhe. Die spontane BRS steigt durch das Training an. Ein hochintensives Ausdauertraining führt zu einem deutlichen Anstieg der Leistungsfähigkeit und der parasympathischen Aktivität. Ausgewählte Patienten mit chronischer Herzinsuffizienz können unabhängig vom Schweregrad durch Ausdauertraining die prognostisch ungünstige autonome Regulation verbessern, ähnlich wie gesunde Probanden oder Patienten mit einer KHK. Die Steigerung der sympathiko-vagalen Balance hängt mit der Steigerung der Belastungsfähigkeit zusammen. Anstieg der Ergometriedauer, VO2max, Absenken der submaximalen HR und HRRuhe, Verschieben der aerob-anaeroben Schwelle, 24h-HRV und HRV in Ruhe angestiegen, LF gesenkt, HF erhöht, Cardiac Output angestiegen, peripherer Widerstand gesenkt VO2max angestiegen, HRV und RSA angestiegen Ausdauertraining senkt den Blutdruck über den Tag in Ruhe und unter Belastung, erhöht BRS und HRV bei Wachheit und im Schlaf und führt vermutlich bei leichter Hypertonie zu einer reduzierten Morbidität und Mortalität. Schlussfolgerungen Dauer der Ergometrie angestiegen, systol. und diastol. Blutdruck gesunken, HRRuhe gesenkt, HRV und BRS angestiegen nach Training Ergebnisse nicht kontrolliert 8 Wochen Training: 7x1,5-2h/Woche, 75-90% HRmax Ergometrie, Messung HRV und RSA Crossover, kontrolliert, randomisiert 8 Wochen Fahrradergometrie, 5x20min/Woche, 60-80% HRmax und 8 Wochen Ruhe, nur Alltagsbewegung Ergometrie, haemodynamische Messung, Langzeit-Aufzeichnung, Messung HRV mit Spektralanalyse nicht kontrolliert, 6 Monate Training: 2xtägl. 10-12min intensiv Aerobic und 3-4x20min/Woche Joggen Ergometrie, Messung Blutdruck und HRV intraarteriell, Messung BRV pharmakologisch Design Ausdauerleistungsfähigkeit n=49 (10 weibl.); durchschnittl. 57J., nach einem unkomplizierten akuten Herzinfarkt EG = 26; Training KG = 23; Hauswalking n=26; gesunde, untrainierte Männer EG1=13, 60-82J. EG2=11, 24-32J. Levy et al., 1998 n=22 (13 weibl.); inaktiv, insulinpflicht. Diabetes EG1 = 8, keine autonome Neuropathie EG2 = 8, beginnende autonome Neuropathie EG3 = 6, manifestierte autonome Neuropathie Howorka et al., 1997 Leitch et al., 1997 n=30 (2 weibl.); nach einem unkomplizierten Herzinfarkt, durchschnittl. 52J. EG = 22 KG = 8 Probanden Malfatto et al., 1996 Autor 51 nicht kontrolliert, Vergleich zweier Altersgruppen 6 Monate Ausdauertraining: 45x75min/Woche Walking, Joggen, Radfahren, 50-60% => 80-85% HRmax Ergometrie, Messung HRV mit Atropin und Zeitbereichsanalyse kontrolliert, randomisiert 6 Wochen Training: 3-4x30-60min/Woche, angeleitetes, individuelles Programm mit Liegendergometer und Circuittraining UND Hauswalking-Programm: 2x5min tägl. => 2x30min tägl. Ergometrie, Messung HRV mit Zeitbereichsund Spektralanalyse, BRS pharmakologisch intrapersoneller Vergleich durch Baselineerhebung 4-6 Wochen vor Trainingsbeginn 12 Wochen Training: Fahrradergometer, 2x30min/Woche, 60-70% der maximalen Leistungsfähigkeit Ergometrie, Messung Blutdruck, HRV mit Zeitbereichs- und Spektralanalyse kontrolliert, nicht randomisiert 8 Wochen Ausdauertraining: 5xh/Woche Callesthenics und Fahrradergometer bis 80% HRmax, danach 2-3x/Woche körperliche Aktivität zuhause Ergometrie, Messung HRV mit Zeitbereichsund Spektralanalyse, 1J-Katamnese Design HRRuhe gesunken, bei den Älteren stärker, HR bei submaximaler Leistung gesunken, HRV in Ruhe und bei submaximaler Leistung gestiegen Anstieg der Ausdauerleistungsfähigkeit in EG, Anstiege der BRS und HRV in EG und KG ohne signifikante Unterschiede zwischen den Gruppen VO2max angestiegen, Blutdruck gesenkt nur nach Training, Total Power und HF in EG1 und EG2 nach Training erhöht, nach 4-6 Wochen Pause nicht mehr erhöht, EG3 keine Änderungen in HRV EG: Testdauer und Leistung angestiegen, HRV Zeitbereichsparameter angestiegen, HF angestiegen, LF und LF/HF gesunken, KG keine Veränderungen, nach 1J. HRV höher in EG Ergebnisse Ausdauertraining steigert die HRV und parasympathische Aktivität bei jungen und älteren Männern. Das Training gleicht die altersbedingten Defizite in der parasympathischen Aktivität teilweise aus. Der Ruhepuls scheint mit zunehmendem Alter unter geringerem parasympathischen Einfluss zu stehen. Ruhepuls steigt nicht mit Alter an. Es ist unklar, welche Rolle körperliche Aktivität neben der natürlichen Wiederherstellung der autonomen Regulation nach Herzinfarkt bei der Verbesserung der BRS und HRV spielt. Infarktpatienten mit niedrigem Risiko scheint ein zusätzliches Training keine signifikante Verbesserung der autonomen Regulation über die des Hauswalking-Programmes hinaus zu bringen. Regelmäßiges Ausdauertraining erhöht bei Diabetikern ohne oder mit beginnender autonomer Regulation die HRV durch verbesserte sympathische und parasympathische Aktivität. Bei manifestierter Neuropathie konnten mit diesem Training keine Effekte auf die HRV erzielt werden. Achtwöchiges Ausdauertraining nach Herzinfarkt moduliert die kardiovaskuläre autonome Regulation, indem es sympathische Aktivität senkt und parasympathische Aktivität steigert. Effekte halten unter Beibehaltung körperli. Aktivität an. Schlussfolgerungen Ausdauerleistungsfähigkeit Körpergewicht und Körperfett reduziert, VO2 anaerobe Schwelle gestiegen, HR gesunken, Total Power, HF und LF gestiegen unkontrolliert 12 Wochen Ausdauertraining: 3x30 min/Woche auf dem Fahrradergometer, anaerobe Schwelle Ergometrie, Messung Körperzusammensetzung, Messung der HRV mit Spektralanalyse n=18 (9 weibl.); inaktive, adipöse, ansonsten gesunde Probanden Amano, Kanda, Ue & Moritani, 2001 52 12wöchiges Ausdauertraining steigert sympathische und parasympathische Aktivität adipöser Probanden mit auffälliger autonomer Regulation. Das Training besitzt einen Wiederherstellungseffekt, der auch die thermoregulatorische Kontrolle bei Adipositas beeinflussen könnte. Regelmäßige aerobe Aktivität kann die BRS bei Männern mittleren und höheren Alters erhöhen unabhängig von Veränderungen der Leistungsfähigkeit oder Reduktion der Ruheherzfrequenz. Ausdauertraining steigert HRV und BRS bei Patienten mit Koronarsklerose und ist damit eine effektive nichtmedikamentöse Intervention, um die vagale Aktivität und die Prognose zu verbessern. Die Wirkung hängt nicht von einer Verbesserung der funktionellen Kapazität ab. In EG VO2max gestiegen, HRRuhe gesunken, RRSD und BRS gestiegen, keine Korrelationen zwischen VO2max und RRSD oder BRS, kein Unterschied ob Herzinfarkt oder nicht vorliegend Ergometriedauer angestiegen, HR bei submaximalen Belastungsstufen gesunken, keine signifikante Änderung VO2max und HRRuhe, HRV unverändert, BRS gestiegen, keine physiologischen Korrelate zu BRSVeränderung Ein 6monatiges Trainingsprogramm steigert die HRV. Körperliche Aktivität kann bei älteren Menschen effektiv sein, um einen Faktor verbunden mit einem gesteigerten Risiko kardialer Ereignisse positiv zu beeinflussen. VO2max und HRV in EG gesteigert, besonders bei Probanden, die zuvor inaktiv waren, Veränderungen der HRV waren assoziiert mit einer Veränderung der HR nicht kontrolliert 3 Monate Ausdauertraining: Walking, 5x45min/Woche, 65-80% HRmax Ergometrie, Messung HRV mit Zeitbereichsund Spektralanalyse, BRS im Lagewechseltest (Valsalva) kontrolliert, randomisiert 2 Wochen überwachtes Ausdauertraining: 2x30min am Tag 6x/Woche, insgesamt 24x Fahrradergometer, 85% HRmax und Freiübungen Ergometrie, Messung der HRV mit Zeitbereichsanalyse, spontane BRS Schlussfolgerungen Ergebnisse n=13, inaktive Männer mittleren und höheren Alters n=86; männl. Patienten nach gefäßerweiterndem Eingriff, mit und ohne erstem Herzinfarkt EG = 45 KG = 41; Gehen und Freiübungen Iellamo, Legramante, Massaro, Raimondi & Galante, 2000 kontrolliert, randomisiert 6 Monate 3x45min/Woche Ausdauertraining, angeleitet Ergometrie, Langzeit-Aufzeichnung, Messung der HRV in Zeitbereichs- und Spektralanalyse Design Monahan et al., 2000 n=51; ältere gesunde Männer und Frauen EG = 27 KG = 24 Probanden Schuit et al., 1999 Autor Ausdauerleistungsfähigkeit 53 Training kann die BRS und die Langzeitprognose für Herzinfarktpatienten signifikant verbessern, vorausgesetzt sie führt zu einem Anstieg der vagalen Aktivität. größerer Anstieg der Leistung in EG, BRS stark angestiegen, nach 10J. Überlebensrate für Patienten mit Anstieg der BRS ≥ 3ms/mmHg höher kontrolliert, randomisiert, prospektiv 4 Wochen Ausdauertraining: 5x30min/Woche, wöchentliche Steigerung der Intensität Ergometrie, Messung der BRS pharmakologisch, 10J. telefonische Interviews n=95; männl. Patienten mit erstem Herzinfarkt EG = 49 KG = 46; kein Training La Rovere, Bersano, Gnemmi, Specchia & Schwartz, 2002 Durch das Ausdauertraining ergab sich eine gesenkte HR und ein Anstieg der parasympathischen Aktivität in Ruhe und während der Erholungsphasen. Die Anpassungen fanden sich schneller in den Erholungsphasen als in Ruhe. HRRuhe gesunken, VO2max gestiegen, in Erholungsphasen und nach Belastung HR niedriger, LF niedriger und HF höher HRRuhe gesunken, Zunahme der Ein Ausdauertraining kann bei Untrainierten in RRSD, dRRMW, RMSSD relativ kurzer Zeit zu einem Absenken der Ruheherzfrequenz führen, das begleitet wird von einer Verbesserung der HRV. kontrolliert, nicht randomisiert 6 Wochen Ausdauertraining: 4x40min/Woche Fahrradfahren, 80% VO2max Ergometrie, Messung HRV mit Spektralanalyse Ein moderat bis anstrengendes Ausdauertraining verbessert nach 12 Wochen die HRV und die parasympathische Aktivität, unabhängig von HRRuhe. Verbesserungen der HF sind möglich durch ein intensives (>70% HRmax) oder längeres (>12 Wochen) Training. Eine höhere HRV bei Untrainierten scheint die Trainingsanpassungsfähigkeit des kardiovaskulären Systems widerzuspiegeln. Schlussfolgerungen aerobe Leistungsfähigkeit in EG angestiegen, HRRuhe unverändert, pNN50, rMSSD und HF angestiegen in EG nach 12 Wochen Ergebnisse nicht kontrolliert, „Pilotstudie“ 10 Wochen Ausdauertraining: Laufen/Gehen, 2x60min/Woche Messung HRV mit Zeitbereichsanalyse n=12; gesunde, männl. Studenten EG = 7 KG = 5 Yamamoto, Miyachi, Saitoh, Yoshioka & Onodera, 2001 kontrolliert, nicht randomisiert 16 Wochen angeleitetes Ausdauertraining: 3x30min/Woche Fahrradergometer, moderat bis anstrengend Baseline 8 Wochen, alle 4 Wochen Messungen: Ergometrie, HRV in Zeitbereichs- und Spektralanalyse Design Fromme, Gen=7 (6 weibl.); durchschwinde, Mooren, schnittl. 40J. Thorwesten & Völker, 2002 n=16; inaktive, gesunde Männer, 25-45J. EG = 11 KG = 5; sollten Aktivitätslevel nicht verändern Probanden Melanson & Freedson, 2001 Autor Ausdauerleistungsfähigkeit 54 kontrolliert, randomisiert unter Berücksichtigung von BRS und Raucherstatus 52 Wochen Training: Ausdauer, 1x/Woche angeleitet: Joggen/Walken, 2x/Woche mind. 30min, 6575% VO2max und angeleitetes Muskelaufbautraining 2x/Woche Ergometrie, Messung HRV mit Zeitbereichsund Spektralanalyse, BRS pharmakologisch, Peripherer Widerstand, Kardialer Index mit Impedanzkardiographie kontrolliert, randomisiert 2 Wochen Ausdauertraining: insgesamt 8x40min Fahrradergometer, hohe Intensität Ergometrie, Messung HRV mit Spektralanalyse in Ruhe, unter vorgegebenem und spontanem Atmen sowie nach Lagewechsel kontrolliert, nicht randomisiert 12 Wochen angeleitetes Ausdauertraining: 2-3x40-60min/Woche Laufen, Intensität bei etwa 2mmol/l Laktat vor, 6. Woche, nach Training leistungsdiagnostische Untersuchung auf Laufband, Messung HRV mit Zeitbereichsanalyse Design VO2max und Muskelkraft gesteigert, HRRuhe gesenkt, BRS angestiegen, HRV-Parameter unverändert VO2max gestiegen, HRVParameter gestiegen unter vorgegebenem Atmen (12/min) und beim Lagewechseltest, nicht beim spontanen Atmen Laufgeschwindigkeit bei 4mmol/l Laktat gesteigert, HR gesenkt linear über die Trainingswochen, HRV-Parameter angestiegen (RRSD, SD1, SD2), mit größerer Verbesserung der Leistungsfähigkeit größere Steigungen der SD1 Ergebnisse Training verbessert die BRS bei Typ IIDiabetes zusätzlich zur Verbesserung der Ausdauerleistungsfähigkeit und Muskelkraft. Diese Verbesserungen können mit einer verbesserten Prognose der Typ II-Diabetiker verbunden sein. Bereits 2wöchiges Ausdauertraining steigert die vagale Modulation während vorgegebener Atemfrequenz und in Kipplage. Die Unterschiede zwischen vorgegebener und spontaner Atmung belegen den Einfluss der Atmung auf die HRV-Parameter. Ausdauertraining bei Untrainierten führt zu einer deutlichen Verbesserung der Leistungsfähigkeit und erhöhten HRV als Ausdruck gesteigerter vagaler Modulation. Zu Beginn des Trainings erfolgt Aktivierung des Sympathikus, die bei zunehmender Anpassung ans Training abnimmt. Schlussfolgerungen Anmerkungen. BRS: Baroreflexsensitivität, diastol.: diastolisch, durchschnittl.: durchschnittlich, EG: Experimentalgruppe (mit Intervention), h: Stunde, HF: High frequencyBand, HR: Herzrate, HRmax: Maximale Herzrate, HRRuhe: Herzrate in Ruhe, HRV: Herzratenvariabilität, insulinpflicht.: insulinpflichtig, J.: Jahre, KG: Kontrollgruppe, KHK: Koronare Herzkrankheit, LF: Low frequency-Band, männl.: männlich, min: Minute, n: Stichprobengröße, n.s.: nicht signifikant, pNN50: Prozentsatz aufeinander folgender RRIntervalle, die mehr als 50 ms voneinander abweichen, rMSSD: Quadratwurzel des quadrierten Mittelwertes der Summe aller Differenzen sukzessiver RR-Intervalle, RR: Abstand zweier Herzschläge, RRSD: Standardabweichung aller RR-Intervalle, RSA: Respiratorische Sinusarrhythmie, SD1: Zeitbereichsparameter für die Kurzzeitvariabilität, SD2: Zeitbereichsparameter für die Langzeitvariabilität, systol.: systolisch, VO2max: Maximale Sauerstoffaufnahme, weibl.: weiblich. n=49; Männer mit Typ IIDiabetes, ohne klinische Neuropathie EG = 24 KG = 25 n=24; gesunde, untrainierte Männer, durchschnittl. 23J. EG = 12 KG = 12 Lee, Wood & Welsch, 2003 Loimaala et al., 2003 n=30 (15 weibl.); gesund, ausdaueruntrainiert EG = 14 KG = 16 Probanden Schulz, Horn, Linowsky, Plogmaker & Heck, 2002 Autor Ausdauerleistungsfähigkeit Ausdauerleistungsfähigkeit CARTER, BANISTER und BLABER (2003) kommen in ihrem Review-Artikel aufgrund der ausgewerteten Studien zu dem Schluss, dass Ausdauertraining, langfristig betrieben, die autonome Kontrolle des Herzens beeinflusst, die Herzratenvariabilität und die parasympathische Aktivität steigert und die sympathische Aktivität senkt. Es gibt aber momentan keine Theorie, die genau das erforderliche Schema, die Trainingsdauer und –intensität umfasst, die zu den entsprechenden physiologischen Anpassungen führen. 4.3.2 Effekte auf die kardiovaskuläre Reaktivität Die Auswirkungen von körperlicher Leistungsfähigkeit und Ausdauertraining auf die kardiovaskuläre Reaktivität sind bisher nicht wirklich geklärt, da auch hierbei unterschiedliche Ergebnisse gefunden wurden. Tabelle 4.3 gibt einen Überblick über Querschnitt- und Längsschnittstudien. Im Vergleich zwischen trainierten und untrainierten Probanden fanden sich bei einem hohen Fitnesslevel reduzierte physiologische Antworten bei Laborstressoren im Sinne einer besseren Reaktivität (HOLMES & ROTH, 1985; LIGHT, OBRIST, JAMES & STROGATZ, 1987; ROSSY & THAYER, 1998; STEPTOE, KEARSLEY & WALTERS, 1993). SALVATOR, RICARTE, GONZÁLEZ-BONO und MOYA-ALBIOL (2001) fanden diesen Zusammenhang nur bei Männern. SINYOR, SCHWARTZ, PERONNET, BRISSON und SERAGANIAN (1983) fanden eine schnellere physiologische und subjektiv erlebte Erholung nach psychologischem Stress bei einem höheren Fitnesslevel der Probanden. Dieses Ergebnis wurde von BROOKE und LONG (1987) bestätigt. In der Reaktivität während der Belastung unterschieden sich die Probanden allerdings nicht voneinander. DORHEIM et al. (1984) sowie SUMMERS, LUSTYK, HEITKEMPER und JARRETT (1999) fanden keine Unterschiede zwischen Trainierten und Untrainierten. Insgesamt zeigt sich in diesen Querschnittstudien ein linearer Zusammenhang zwischen der körperlichen Leistungsfähigkeit und der Reaktivität (s. TURNER, 1994, 141). 55 Design Ergebnisse Schlussfolgerungen 56 Längsschnittstudie, randomisiert, kontrolliert 7 Wochen Training: Ausdauer, 4x90min/ Woche, > 70% VO2max Ergometrie, Messung der HR, Impedanzkardiographie, Blutdruck, RSA, Zustandsangst in Ruhe, unter Stressoren, nach Belastung Querschnittstudie Ergometertest mit Messung der HR und Wattleistung, Messung der HR und selbst berichteter Erregung und Angst vor, während und nach psychosozialen Stressoren Querschnittstudie Messung der Herzrate, der Katecholamine, Kortisol und der subjektiv empfundenen Angst vor und nach einem Klettertest n=22; inaktive, junge Männer, durchschnittl. 24J. EG = 14 KG = 8 n=30; Männer, 20-30J. TG = 15; trainiert, geschätzte VO2max= 69,1 ml/kg/min NG = 15; untrainiert, geschätzte VO2max= 32,8 ml/kg/min n=18; junge Männer, Anfänger im Klettersport TG = 9; sehr fit, VO2max: 58 ml/kg/min NG = 9; wenig fit, VO2max: 48 ml/kg/min De Geus, Van Doornen, De Visser & Orlebeke, 1990 Sinyor, Schwartz, Peronnet, Brisson & Seraganian, 1983 Brooke & Long, 1987 Langstreckenlauf und aerobe Ausdauerleistungsfähigkeit senkt nicht die kardiovaskuläre Reaktivität bei mittelschweren mentalen Stressbelastungen. Ein kurzes Ausdauertraining kann die physiologische Stressreaktivität nicht verbessern. Die Leistungsfähigkeit kann durch ein kurzes Training verbessert werden, allerdings sind die Anpassungserscheinungen interindividuell sehr verschieden. TG niedrigere HR in Ruhe als NG, Blutdruck in Ruhe nicht unterschiedlich, keine Unterschiede während der Belastungen VO2max in EG höher nach 7 Wochen, in KG keine Veränderung, keine signifikanten Unterschiede der Parameter unter der Belastung oder in der Erholungsphase zwischen EG und KG TG niedrigere HR während aller Messungen als NG, subjektive Angst und Adrenalin schneller gesunken in der Erholungsphase bei TG verglichen mit NG, HR und Kortisol nicht unterschiedlich in TG und NG HRRuhe niedriger in TG als in NG, HR und Angst während Belastung nicht unterschiedlich, am Ende der Belastung berichtete TG weniger Angst als NG, TG schneller nach Belastung auf Ausgangslevel der HR als NG Hoher Fitnesslevel ist verbunden mit besseren Copingfähigkeiten im Sinne schnellerer Erholung nach einem realitätsnahen Stressor. Die Herzraten-Reaktivität ist davon jedoch nicht betroffen. Die Vergleichsgruppe besaß jedoch einen relativ hohen Fitnesslevel im Vergleich zur Allgemeinbevölkerung. Eine höhere körperliche Leistungsfähigkeit ist verbunden mit einer besseren Erholungsfähigkeit nach psychosozialen Belastungen. Die Erholungsfähigkeit zeigt sich sowohl physiologisch als auch in der subjektiven Einschätzung. Erholungsfähigkeit verbessert bei höherer körperlicher Leistungsfähigkeit Querschnittstudie Messung der HR und des Blutdrucks in Ruhe, unter Lagewechsel und mentaler Stressbelastung, in der Erholung n=24; gesunde Männer, durchschnittl. 39J. TG = 12; sehr trainierte Langstreckenläufer NG = 12; untrainiert Kardiovaskuläre Reaktivität unabhängig von körperlicher Leistungsfähigkeit bzw. von Effekten eines Ausdauertrainings Probanden Dorheim et al., 1984 Autor Tabelle 4.3. Studien über die kardiovaskuläre Reaktivität in Abhängigkeit von körperlicher Leistungsfähigkeit oder von Effekten eines Ausdauertrainings. Ausdauerleistungsfähigkeit Design Ergebnisse Schlussfolgerungen 57 n=174; gesunde, junge Männer nach berichtetem, wöchentl. Ausdauertraining mit Sportart, Frequenz, Dauer und Intensität: TG1 = 56, wenig aktiv TG2 = 59, moderat aktiv TG3 = 59, sehr aktiv n=24; inaktive, junge Männer, durchschnittl. 24J. De Geus, Van Doornen, De Visser & Orlebeke, 1990 Querschnittstudie Ergometrie mit Messung der VO2max, Messung der HR, Impedanzkardiographie, Blutdruck, RSA, Zustandsangst in Ruhe, unter Stressoren, nach Belastung Querschnittstudie Ergometertest bei leichter Belastung mit Messung der HR, Messung der HR und des Blutdrucks in Ruhe und während mentaler Stressbelastung (5 min. Reaktionstest) Querschnittstudie Messung der HR in Ruhe, während mentaler Stressbelastung, in der Erholungsphase n=20; Frauen TG = 10; sehr fit, VO2max= 53,5 ml/kg/min NG = 10; wenig fit, VO2max= 28,8 ml/kg/min Holmes & Roth, 1985 Light, Obrist, James & Strogatz, 1987 Querschnittstudie Messung des Blutdrucks, der HR, der Katecholamine und psychologischer Antworten vor, während, nach mentaler und körperlicher Belastung n=55 (20 weiblich); in vier Gruppen geteilt je nach Dauer des Ergometertests, vier Stufen des Fitnesslevels während der Belastungen waren hohe VO2max-Werte verbunden mit geringerem Absinken der RSA, geringeren Anstiegen des mittleren arteriellen und diastol. Blutdrucks, geringerer absoluter HR und reduzierter Antwort des Totalen Peripheren Widerstandes, keine Unterschiede in der Erholungsphase Die Reaktivität der RSA und des diastolischen Blutdrucks ist verbunden mit dem Fitnesslevel bei aktiv zu bewältigenden Belastungen. Das Absinken der RSA unter Belastung bei einem höheren Fitnesslevel zeigt, dass der parasympathische Einfluss bei leistungsfähigeren Personen intakter ist. Eine Verbindung zwischen dem Fitnesslevel und der Erholungsfähigkeit bestand nicht. Junge Männer, die von geringer Ausdaueraktivität berichten, haben eine höhere HRRuhe als solche, die von hoher Aktivität berichten. Die wenig Aktiven zeigen eine höhere kardiovaskuläre Reaktivität unter mentaler Stressbelastung als die sehr Aktiven. Bei jungen gesunden Männern ist eine bessere kardiovaskuläre Reaktivität mit einem Anstieg der Ausdauerleistungsfähigkeit assoziiert. Der Level aerober Leistungsfähigkeit beeinflusst die Antwort auf Stressbelastungen. Möglicherweise beeinflusst der Stressgrad den Zeitpunkt: bei hohem Stress zeigt sich eine höhere Erholungsfähigkeit, bei geringerem Stress während der Belastung selbst eine geringere Reaktivität, wenn die Leistungsfähigkeit höher ist. HRRuhe niedriger in TG als in NG, unter Belastung HR auch niedriger in TG als in NG, Differenz größer als in Ruhe, Unterschied der HR von TG und NG in Erholungsphase wie in Ruhe TG1 in Ruhe höhere HR als TG3, TG2 keine signifikanten Unterschiede, TG1 unter leichter körperlicher Belastung höhere HR als TG3, TG1 höhere HR und systol. Blutdruckwerte bei Reaktionstest als TG3, TG2 keine signifikanten Unterschiede Es gibt keinen Hinweis auf einen allgemeinen Effekt körperlicher Leistungsfähigkeit bezüglich der Reaktivität auf aktive psychologische Aufgaben/mentalen Stressanforderungen bei unter 40jährigen. Über 40jährige zeigten bei höherer Fitness eine bessere kardiovaskuläre Reaktivität. HRRuhe nur niedriger in der sehr fitten Gruppe, Über 40J.: systol. Blutdruck in Ruhe niedriger bei fitteren, geringere Labilität des diastol. Blutdrucks unter Belastung Kardiovaskuläre Reaktivität (Herzrate/Blutdruck/Atmung) besser bei höherer körperlicher Leistungsfähigkeit in Querschnittstudien Probanden Hull, Young & Ziegler, 1984 Autor Ausdauerleistungsfähigkeit n=72; junge Männer, 20-35J. TG = 36; Sportler, mindestens 3x30min./Woche NG = 36; inaktiv, weniger als 30min./Woche Steptoe, Kearsley & Walters, 1993 Querschnittstudie Ergometrie mit Messung der VO2max, Messung der spontanen BRS in Ruhe, während und nach mentalen Belastungsaufgaben, denen Ergometerbelastung vorausging Design VO2max höher, HRRuhe niedriger und BRS höher unter Ruhe in TG als in NG, unter mentaler Stressbelastung keine Unterschiede in der HR, aber systolischer und diastolischer Blutdruck in TG niedriger als in NG Ergebnisse Sportlich Aktive mit erhöhter Leistungsfähigkeit haben in Ruhe eine erhöhte BRS, die die Fähigkeit widerspiegelt, Blutdruckänderungen über die Herzrate gut auszugleichen und eine höhere Stabilität in der kardiovaskulären Regulation zu besitzen. Die Reaktivität bezogen auf mentale Belastungen nach körperlicher Belastung scheint bezogen auf den Blutdruck verbessert zu sein. Schlussfolgerungen 58 vor Training keine Beziehung zwischen VO2max, HRV oder BRS keine Veränderungen der HRV oder BRS in Ruhe/Belastung EG3 VO2max gesteigert, HR und diastol. Blutdruck unter Belastung gesenkt bei größtem Absinken der HR nach Training tendenziell Anstieg der HRV Längsschnittstudie, nicht randomisiert EG1 und EG2 1,5-2,5h/Woche Training EG3 mindestens 2,5h/Woche Training bei 70% HRmax Ergometrie, Messung Blutdruck, HRV mit Spektralanalyse und spontaner BRS in Ruhe und unter mentaler Stressbelastung n=60; inaktive Männer EG1=19; 4 Monate Training, 4 Monate inaktiv EG2=19; 4 Monate inaktiv, 4 Monate Training EG3=11; 8 Monate Training KG = 11; inaktiv De Geus et al., 1996 Ausdauertraining beeinflusst nicht den Vagotonus oder die BRS in Ruhe oder unter mentaler Belastung, aber die Reaktivität im Sinne einer gesenkten HR und eines niedrigeren Blutdruckes. EG verglichen mit KG: VO2max gesteigert, Ausdauertraining reduziert die kardiovaskulären HRRuhe gesenkt, Antworten während und nach mentaler StressbeReduktion des Anstiegs der HR und des lastung im Sinne einer verbesserten Reaktivität. diastol. Blutdrucks während und nach Stressbelastung Längsschnittstudie, randomisiert, kontrolliert 12 Wochen Training: EG: Ausdauer, 3x50min/Woche, ≥ 70% VO2max KG: Kräftigung/Dehnung 2x50min/Woche Ergometrie, HR und Blutdruck während und nach mentaler Stressbelastung n=35; gesunde Männer, durchschnittl. 42J. EG = 20 KG = 15 Blumenthal et al., 1990 Kardiovaskuläre Reaktivität (Herzrate/Blutdruck/Atmung) verbessert durch Ausdauertraining in Längsschnittstudien Probanden Autor Ausdauerleistungsfähigkeit 59 n=45 (22 weiblich); 1929 J., Nichtraucher EG1 = 15; Ausdauertraining EG2 = 15; Krafttraining KG = 15; keine Intervention Spalding, Lyon, Steel & Hatfield, 2004 bei Männern signifikanter Anstieg der HR bei Belastung und signifikanter Abfall nach Belastung, HR-Werte beim ersten Test höher als beim zweiten; bei Frauen nicht signifikanter Anstieg der HR bei Belastung, aber signifikanter Abfall nach Belastung, keine Unterschiede zwischen beiden Testzeitpunkten Hoher Anstieg der VO2max in EG1, geringer in EG2, kein Anstieg in KG; während Stress und in der Erholungsphase HR in EG1 niedriger als in EG2 und KG sowie systol. BD niedriger in EG1 als in KG Längsschnittstudie, nicht kontrolliert Messung der HR vor, während und nach mentaler Stressbelastung nach einer 1,5monatigen Trainingspause und nach 5 Monaten Training Längsschnittstudie, kontrolliert, randomisiert 6 Wochen Interventionszeit Messung der VO2max,, Messung von HR und BD in Ruhe, unter psychologischem Stress und in Erholungsphasen Ergebnisse Ausdauertraining senkt kardiovaskuläre Reaktivität während psychologischem Stress und in den Erholungsphasen bei gesunden, jungen Erwachsenen und schützt vor altersbedingten Herzerkrankungen, wenn das Training früh begonnen und lebenslang beibehalten wird. Nur bei den Männern zeigen sich Trainingseffekte auf das autonome Nervensystem im Sinne einer verbesserten Reaktivität bei mentaler Stressbelastung. Schlussfolgerungen n=40; gesunde Studenten, durchschnittl. 19J. TG = 20; sehr aktiv/fit NG = 20; wenig aktiv/fit Querschnittstudie N-EX: Fragebogen zur Selbsteinschätzung der Fitness, Messung HRV mit Zeitbereichs- und Spektralanalyse in Ruhe und unter mentaler Belastung TG höhere HRV und HF in Ruhe als NG, Frauen höhere HF als Männer TG höhere HRV und HF unter Stressbedingungen Kleine Unterschiede der aeroben Leistungsfähigkeit resultieren in bedeutenden Unterschieden der autonomen Regulation. Die vagale Dominanz der sehr fitten Probanden zeigt sich bei verschiedenen Laborstressoren im Sinne einer besseren kardiovaskulären Reaktivität. Anmerkungen. BD: Blutdruck, BRS: Baroreflexsensitivität, diastol.: diastolisch, durchschnittl.: durchschnittlich, EG: Interventionsgruppe, h: Stunde, HF: High frequency-Band, HR: Herzrate, HRRuhe: Herzrate in Ruhe, HRV: Herzratenvariabilität, J.: Jahre, kg: Kilogramm, KG: Kontrollgruppe, min: Minute, ml: Milliliter, n: Stichprobengröße, NG: Gruppe der Nichttrainierten, RSA: Respiratorische Sinusarrhythmie, systol.: systolisch, TG: Gruppe der Trainierten, VO2max: Maximale Sauerstoffaufnahme, wöchentl.: wöchentlich. Rossy & Thayer, 1998 n=18 (8 weiblich); junge Eliteathleten Salvador, Ricarte, González-Bono & Moya-Albiol, 2001 Design Kardiovaskuläre Reaktivität (Herzratenvariabilität) verbessert bei höherer körperlicher Leistungsfähigkeit in Querschnittstudie Probanden Autor Ausdauerleistungsfähigkeit Ausdauerleistungsfähigkeit Einen Überblick über den Zusammenhang körperlicher Leistungsfähigkeit bzw. körperlicher Aktivität und kardiovaskulärer Reaktivität geben FILLINGIM und BLUMENTHAL (1992). Sie berichten über die inkonsistenten Ergebnisse, die sich zum Teil aus den methodischen Schwierigkeiten einiger Studien ergeben. Zusammenfassend wird, den Autoren zufolge, die Annahme, wenn auch nicht generell, gestützt, dass ein Ausdauertraining die kardiovaskuläre Reaktivität absenkt. Die Querschnittstudien zeigen geringere kardiovaskuläre Reaktionen auf akute Stressbelastungen bei Probanden, die eine höhere Ausdauerleistungsfähigkeit besitzen. Die Ergebnisse der Längsschnittuntersuchungen erscheinen allerdings inkonsistent. Es gibt nur wenige Längsschnittstudien, die die Effekte eines Trainings auf die kardiovaskuläre Reaktivität untersuchen. Die Ergebnisse von BLUMENTHAL et al. (1990), von DE GEUS et al. (1996), von STEPTOE, KEARSLEY und WALTERS (1993) sowie von SPALDING, LYON, STEEL und HATFIELD (2004) deuten darauf hin, dass sich die Reaktivität durch ein gezieltes Ausdauertraining verbessern lässt. SINYOR, GOLDEN, STEINERT und SERAGANIAN (1986) verglichen ein Ausdauertraining mit einem Krafttraining und fanden keine Unterschiede bezüglich der Herzratenreaktivität bei einer Reihe von mentalen Belastungsaufgaben. DE GEUS, VAN DOORNEN, DE VISSER und ORLEBEKE (1990) fanden in einer Studie im Querschnittsvergleich von trainierten und untrainierten Probanden eine Beziehung zwischen Fitness und Reaktivität bezogen auf mentalen Stress. In ihrer kontrollierten Längsschnittstudie stellten sie allerdings keine Verbesserungen der Reaktivität nach einem siebenwöchigen Ausdauertraining fest. Die Autoren schließen aus den unterschiedlichen Ergebnissen von Quer- und Längsschnittuntersuchung, dass die psychologischen oder physiologischen Veränderungen, die einer reduzierten Reaktivität zugrunde liegen, eines Trainings von längerer Dauer bedürfen. 4.3.3 Effekte bei Angststörungen Der Einsatz körperlicher Aktivität ist Bestandteil vieler Therapiekonzepte zur Behandlung von Angststörungen. Körperliche Belastung wird im Rahmen einer Konfrontation mit körperlichen Sensationen zur „Uminterpretation der sonst als gefährlich erlebten Symptome“ (MARGRAF & SCHNEIDER, 1990, S. 31; s. auch BROOCKS, 2000, 288f.) sowie zur Steigerung der Leistungsfähigkeit, zum Abbau überschüssiger Energie und zur Vorbeugung von Panikanfällen (MORSCHITZKY, 2002, 485-498) eingesetzt. 60 Ausdauerleistungsfähigkeit BROOCKS (2000, 106) fordert ein Ausdauertraining als grundsätzliche Komponente einer Behandlung bei Panikstörungen. Effekte von körperlicher Aktivität auf Angst wurden sowohl bei gesunden als auch bei klinischen Probanden untersucht. SCHLICHT (1994) schließt in seiner Meta-Analyse ausschließlich Studien mit gesunden Probanden von 1980 bis 1990 ein. Durch Auswertung von den 20 Studien ergab sich nur ein geringer Beleg für die Hypothese, dass körperliche Aktivität Angst reduziert unabhängig von Geschlecht oder Art der Aktivität (wobei es sich meistens um aerobes Training handelte). Für Personen mittleren Alters (31 bis 50 Jahre) gab es einen engeren Zusammenhang. MCDONALD und HODGDON (1991, 116-120) fanden ein statistisch signifikantes Absinken der Zustands- und Eigenschaftsangst vor allem bei männlichen Probanden. Insgesamt stellten sie eine höhere Effektstärke für die Auswirkungen von Ausdauertraining auf die Angstreduktion fest. Das könnte darauf zurückzuführen sein, dass sie auch Studien mit klinischen Stichproben in ihre Meta-Analyse eingeschlossen haben. Allerdings ließ die geringe Anzahl klinischer Stichproben keinen Vergleich mit nicht-klinischen Gruppen zu. Die Vielzahl an Reviews über die angstsenkenden Effekte körperlicher Aktivität beschreibt die unterschiedlichen Ergebnisse und weist auf die großen methodischen Probleme der Studien hin wie unzureichende Beschreibung der Studie (v.a. des Bewegungsprogrammes), Einsatz unzureichender Messinstrumente, unzureichende Auswahl der Stichproben sowie fehlende Kontrollbedingungen bzw. Randomisierung (s. BYRNE & BYRNE, 1993; DILORENZO et al., 1999). Zusammenfassend ist jedoch anhand der Literatur von positiven Effekten körperlicher Aktivität auf Angst auszugehen (PETRUZZELLO, LANDERS, HATFIELD, KUBITZ, & SALAZAR, 1991; SCULLY, KREMER, MEADE, GRAHAM & DUDGEON, 1998; YEUNG, 1996). Darüber hinaus fanden LAFONTAINE et al. (1992) als übereinstimmende Schlussfolgerungen der Autoren, dass Ausdauertraining effektiv in der Behandlung von leichter bis moderater Angst sei, dass stärker Ängstliche am meisten profitierten und dass die Verbesserungen unabhängig von einem Anstieg kardiovaskulärer Leistungsfähigkeit seien. Im Folgenden sollen zwei Studien ausführlicher beschrieben werden, da sie methodischen Anforderungen entsprechen und die eher als tendenziell beschriebenen Effekte körperlicher Aktivität auf Angst empirisch eindeutig belegen. 61 Ausdauerleistungsfähigkeit DILORENZO et al. (1999) untersuchten anhand einer Stichprobe von 111 (68% weiblich) gesunden, inaktiven Erwachsenen Kurz- und Langzeiteffekte eines Ausdauertrainings auf psychologische Parameter. Die 82 Probanden der Experimentalgruppe (EG) wurden zwei unterschiedlichen Interventionsgruppen randomisiert zugeteilt. Beide Gruppen nahmen an einem überwachten, 12wöchigen Ausdauertraining auf einem Fahrradergometer teil. Das Training fand vier Mal wöchentlich bei einer Intensität von 70-85% der maximalen Herzrate statt. Die erste Gruppe absolvierte ein jeweils 24minütiges Intervalltraining, während die zweite Gruppe ein jeweils 48minütiges Dauertraining durchführte. 29 Probanden bildeten als Warteliste die Kontrollgruppe. Sie wurden aufgefordert, ihren Lebensstil in den folgenden 12 Wochen beizubehalten, und kein Training, keine Diät und kein Entspannungstraining zu beginnen. Alle Probanden wurden zu Beginn, 12 Wochen später (EG nach der Trainingsintervention) sowie zu einer 3-, 6- und 12-Monatskatamnese einer fahrradergometrischen Belastungsuntersuchung zur Feststellung der körperlichen Leistungsfähigkeit (maximale Leistung und Herzrate bei submaximaler, vorgegebener Leistung) unterzogen. Psychologische Parameter wurden mittels Fragebögen erhoben: u.a. die depressive Symptomatik mit dem BDI (BECK, WARD, MENDELSON, MOCK & ERBAUGH, 1961), Anspannung sowie die State- und Trait-Angst. Die Messungen nach 12 Wochen ergaben eine signifikante Verbesserung der Leistungsfähigkeit in den Experimentalgruppen, während die Kontrollgruppe keine Verbesserungen aufwies. Die maximale Leistung wurde um 26% gesteigert, die submaximale Herzrate um etwa 12% gesenkt. Dabei gab es keine Unterschiede zwischen den beiden Experimentalgruppen. Die Autoren deuten dieses Ergebnis als einen Hinweis darauf, dass die Trainingsfrequenz und -intensität bei kurzen Trainingsinterventionen wichtiger zur Steigerung der Leistungsfähigkeit ist als die Dauer der einzelnen Trainingseinheit. In der 3Monatskatamnese ist die Leistungsfähigkeit der Experimentalgruppen wieder deutlich zurückgegangen. Ein Jahr nach Interventionsende zeigte sich jedoch noch immer ein deutlicher Leistungszuwachs zum Ausgangswert bei Studienbeginn. Die gesteigerte Leistungsfähigkeit ging in den Experimentalgruppen mit einer Verbesserung der psychologischen Parameter einher, während sich in der Kontrollgruppe keine Veränderungen ergaben. So konnten die Angst-Werte trotz relativ niedriger Ausgangswerte nach 12 Wochen Ausdauertraining reliabel gesenkt werden. Zur 3-MonatsKatamnese näherten sich die Werte dem Ausgangsniveau leicht an, änderten sich aber zur 6- und 12-Monats-Katamnese nicht mehr signifikant. Ein Jahr nach Interven62 Ausdauerleistungsfähigkeit tionsende zeigten die Experimentalgruppen noch immer reliable Verbesserungen in den psychologischen Parametern wie der Ängste. DILORENZO et al. (1999) schließen aus den Ergebnissen, dass eine trainingsbedingte Steigerung der aeroben Ausdauerleistungsfähigkeit kurz- und langfristige positive psychologische Effekte herbeiführt. BROOCKS et al. (1998; s. auch BROOCKS, 2000, 71-90) führten eine kontrollierte, randomisierte Studie bei Patienten mit Panikstörung (mit oder ohne Agoraphobie) durch, um den Effekt eines Ausdauertrainings auf die Symptomatik zu untersuchen. 46 Patienten (23 weiblich) wurden randomisiert einer Trainingsgruppe (n=16), einer Gruppe mit Clomipramin-Gabe (n=15) und einer Gruppe mit Placebo-Gabe (n=15) zugeteilt. Die Trainingsgruppe legte einmal wöchentlich gemeinsam mit einem Medizinstudenten eine Strecke von 6km und mindestens zweimal wöchentlich die Strecke eigenständig zurück. In der ersten Woche wurde die Strecke gehend, dann mit kurzen Laufphasen und schließlich laufend bewältigt, das Tempo spielte dabei keine Rolle. Das Training ging über zehn Wochen und wurde in einem Aktivitätstagebuch festgehalten. Die Behandlung mit Clomipramin oder Placebo erfolgte doppelblind. Die Gesamtdosis betrug ab der dritten Woche 112,5 mg täglich. Die Dropout-Rate betrug in der Trainingsgruppe 31% und in der Placebogruppe 27%. Unter der Gabe von Clomipramin kam es zu keinem vorzeitigen Studienabbruch. Die körperliche Leistungsfähigkeit wurde zu Studienbeginn und nach 10 Wochen in einer stufenförmigen fahrradergometrischen Belastungsuntersuchung festgestellt. Hierbei wurden die maximale Leistung bezogen aufs Körpergewicht, die gewichtsbezogene Leistung bei einer Herzfrequenz von 150 S/min, die gewichtsbezogene Leistung bei Erreichen einer Laktatkonzentration von 4 mmol/l sowie die maximale Sauerstoffaufnahme ermittelt. Vor Behandlungsbeginn gab es keine signifikanten Unterschiede zwischen den drei Gruppen hinsichtlich der demographischen Angaben und der klinischen Symptomatik. Die Teilnahme am Trainingsprogramm führte im Vergleich zur PlaceboBehandlung zu einer signifikanten Verbesserung der Angstsymptomatik ab der sechsten Trainingswoche. Die Gabe von Clomipramin verglichen mit der von Placebo führte zu hochsignifikanten Verbesserungen der Angstsymptomatik. Deutliche Effekte traten hierbei bereits zwischen der zweiten und vierten Behandlungswoche auf. Im Vergleich mit dem Training zeigte die Gabe von Clomipramin signifikant bessere 63 Ausdauerleistungsfähigkeit Therapieergebnisse in der Messwiederholungs-Analyse. Am Ende der Intervention gab es besonders deutliche Unterschiede in den Dimensionen Vermeidungsverhalten, Erwartungsangst und berufliche bzw. soziale Beeinträchtigung. Nebenwirkungen traten in der Trainingsgruppe nur in Form von vorübergehenden Muskel- und Gelenkbeschwerden auf, die jedoch ohne Behandlung zurückgingen. Häufige Beschwerden in den anderen beiden Behandlungsgruppen stellten Mundtrockenheit, Schwitzen, leichter Tremor, Schwindel, Übelkeit und Durchfall dar. Patienten, die mit Clomipramin behandelt wurden, berichteten signifikant mehr Nebenwirkungen als die der beiden anderen Gruppen (PEKRUN, 1998, 133), beendeten aber trotzdem die Studie. Die Teilnahme am Ausdauertraining führte zu einem signifikanten Anstieg der maximalen Leistung sowie der Leistung bei Erreichen einer Laktatkonzentration von 4 mmol/l, während sich die Parameter der Leistungsfähigkeit in den anderen beiden Gruppen nicht signifikant veränderten. Zusammenfassend stellen BROOCKS et al. (1998) fest, dass ein Ausdauertraining allein signifikante, klinisch relevante Verbesserungen bei Patienten mit einer Panikstörung bewirkt, und „daß zumindest eine Subgruppe der Patienten mit Panikstörung durch die alleinige Ausübung von Ausdauertraining symptomfrei wird“ (S. 390). 4.3.4 Effekte bei somatoformen Störungen BROOCKS et al. (1998) nehmen aufgrund ihrer Erfahrungen mit Angstpatienten an, dass auch Patienten mit somatoformen Störungen von sporttherapeutischen Interventionen profitieren können, vermissen allerdings Studienbelege hierfür. Ähnlich wie bei den Angststörungen stellen der Aufbau körperlicher Aktivität und Abbau des Schonverhaltens einen (geforderten) Bestandteil der Behandlung bei somatoformen Störungen dar (MORSCHITZKY, 2000, 231f.; RAITHEL, 1989). Bisher existieren allerdings nur wenige Studien über die Wirksamkeit. Anhaltspunkte bieten Untersuchungen an gesunden Probanden. So stellten ANSHEL und RUSSELL (1994) in einer kontrollierten und randomisierten Studie an 48 untrainierten, gesunden Männern fest, dass sich die Schmerztoleranz und Vitalität durch ein zwölfwöchiges Ausdauertraining steigern lässt verbunden mit einem Senken der Müdigkeit, Spannung und Depressivität. Die Verbesserungen zeigten sich signifikant im Vergleich zu den Kontrollgruppen mit Muskelaufbautraining bzw. inaktivem Lebensstil. VUORI (2001) gibt einen Überblick über die Effekte zwischen körperlicher Aktivität und Rückenschmerzen und kommt nach Auswertung von über 200 Studien und 30 Re64 Ausdauerleistungsfähigkeit views zu dem Schluss, dass körperliche Aktivität mit starker Evidenz einen primärpräventiven Effekt bezogen auf chronische Rückenschmerzen besitzt. Ebenso stark ist die Evidenz, dass spezielle Übungen zwar keinen Effekt auf akute Rückenschmerzen besitzen, aber dass die Aufnahme wenig intensiver ausdauernder Aktivitäten in den ersten zwei Wochen die Wiederherstellung steigert und die Ausfälle mindert. Nicht ganz so stark ist die Evidenz für die Auswirkungen im Rahmen der sekundären Prävention. Allerdings scheint körperliche Aktivität, insbesondere strukturierte Übungen, die Symptome des chronischen Rückenschmerzes zu vermindern und die Funktionalität zu verbessern. Darüber hinaus gibt es einige wenige Untersuchungen mit Patienten somatoformer Störungen. BURNS, JOHNSON, MAHONEY, DEVINE und PAWL (1998) erhoben bei 94 Patienten mit chronischen Schmerzen vor und nach einer multidisziplinären Behandlung die Schmerzsymptomatik, die Ausdauerleistungsfähigkeit und die Ausübung von Aktivitäten. Sie stellten einen signifikanten Zusammenhang zwischen einem Anstieg der körperlichen Leistungsfähigkeit und einem Zuwachs an Aktivitäten verbunden mit weniger Ruhezeiten fest. Darüber hinaus nahm das Gefühl, dem Schmerz hilflos ausgeliefert zu sein, mit zunehmender Leistungsfähigkeit ab. WIGERS, STILES und VOGEL (1996) untersuchten prospektiv 55 Patientinnen und 5 Patienten mit Fibromyalgie. Die Probanden wurden randomisiert einer Ausdauergruppe (n=18), einer Stress-Management-Gruppe (n=18) und einer Kontrollgruppe (n=19) zugeteilt. Die Interventionsdauer betrug vierzehn Wochen. Die Ausdauergruppe fand angeleitet dreimal wöchentlich 45 Minuten statt und beinhaltete Ganzkörperübungen, Spiele und einen 20minütigen Ausdauerteil bei 60 bis 70% der maximalen Herzrate. In der zweiten Interventionsgruppe wurden Entspannungsmethoden und Copingverhaltensregeln kognitiv-verhaltenstherapeutisch vermittelt. Die Gruppenzeit betrug wie in der Ausdauergruppe insgesamt 30 Stunden. Die Probanden der Kontrollgruppe behielten ihre Behandlung wie gewohnt bei, d.h. überwiegend medikamentös. Alle Probanden wurden vor der Intervention, im Anschluss daran und in einer 4-Jahres-Katamnese untersucht: die Schmerzsymptomatik, die TenderPoints und die Leistungsfähigkeit in einer Fahrradergometrie bis zur maximalen Ausbelastung mit Registrierung der Herzfrequenz. Vor der Intervention gab es keine signifikanten Gruppenunterschiede. Nach der Intervention hatten sich in der Ausdau65 Ausdauerleistungsfähigkeit ergruppe im Vergleich zur Kontrollgruppe die Leistungsfähigkeit und das allgemeine subjektive Empfinden gesteigert sowie die Schmerz-Verteilung, die Schmerzsymptomatik und der Mangel an Energie reduziert. Die Effekte waren durch das Ausdauertraining größer als durch das Stress-Management-Programm. Die Unterschiede waren nach vier Jahren nicht mehr vorhanden. WIGERS et al. (1996) führen diese kurzfristigen Ergebnisse auf die mangelnde Compliance zurück, da trotz guter Vorsätze lediglich vier Probanden das Ausdauertraining und neun Probanden das Entspannungstraining beibehielten. Von den vier Aktiven erfüllten allerdings drei in der Katamnese nicht mehr die Kriterien einer Fibromyalgie. MCCAIN, BELL, MAI und HALLIDAY (1988) untersuchten ebenfalls Patienten mit primärer Fibromyalgie. Die 42 Probanden wurden randomisiert den beiden Versuchsgruppen zugeteilt. Die erste Gruppe (n=18) absolvierte ein Ausdauertraining bei 150 S/min auf dem Fahrradergometer, während die zweite Gruppe (n=20) an einem Training zur Dehnfähigkeit bis maximal 115 S/min teilnahm. Die Interventionsdauer betrug 20 Wochen und bestand jeweils aus drei 60minütigen, angeleiteten Gruppeneinheiten pro Woche. Vor und nach der Intervention wurde eine Ergometrie mit Messung der Herzfrequenz zur Bestimmung der Leistungsfähigkeit über die PWC170 durchgeführt und das Schmerzausmaß (Tender-Points, Schmerzdiagramm und Visual Analog Scale), die Schlafqualität sowie die subjektiv empfundene Beeinträchtigung durch körperliche und psychische Symptome (SCL90-R) erhoben. 38 Probanden beendeten die Studie und hatten mit 90% eine sehr hohe Teilnahmerate an den Trainingsgruppen. Es kam zu keinen bedeutenden Nebenwirkungen während der Intervention. Die Ausdauergruppe steigerte im Vergleich zur Flexibilitätsgruppe die körperliche Leistungsfähigkeit und verbesserte die Schmerzschwelle gemessen über die Tender- Points. Außerdem zeigte sich eine signifikante Verbesserung der Klagsamkeit im SCL90-R nach der Intervention in beiden Gruppen, ohne dass sie sich voneinander unterschieden. MCCAIN et al. (1988) folgern aus ihren Ergebnissen, dass Patienten mit primärer Fibromyalgie, die ihre kardiovaskuläre Fitness mit einem entsprechenden Ausdauertraining steigern, Verbesserungen der Schmerzsymptomatik erreichen, die sowohl subjektiv als auch objektiv zu messen sind. In diesem Sinne ist ein Ausdauertraining in der Behandlung von primärer Fibromyalgie nützlich. 66 Ausdauerleistungsfähigkeit MEIWORM et al. (1999) untersuchten ebenfalls die Auswirkungen eines Ausdauertrainings auf die Schmerzsymptomatik und das Allgemeinbefinden bei Patienten mit Fibromyalgie. Es handelte sich um eine kontrollierte, aber nicht randomisierte Studie. Die zwölf Kontrollpersonen (elf weiblich) erhielten keine Intervention, sondern sollten lediglich ihren inaktiven Lebensstil beibehalten. Die 27 Probanden (25 weiblich) nahmen an einem 12wöchigen aeroben Ausdauertraining teil, das sie eigenständig durchschnittlich zwei bis drei Mal für 20 bis 30 Minuten pro Woche durchführten bei einer Intensität von 50% der maximalen Sauerstoffaufnahme (entsprechend einer Laktatkonzentration von etwa 1,4 mmol/l). Zu Beginn der Studie und zwölf Wochen später wurde ein stufenförmiger Belastungstest auf dem Fahrradergometer vorgenommen mit Bestimmung der Laktatwerte und spirometrischer Registrierung der Herzfrequenz und der Atemgase. Die Schmerzsymptomatik wurde über die Druckempfindlichkeit der Tender-Points, des Schmerzdiagrammes und der Visual Analog Scale bestimmt. Die Maximalwerte bei der Ergometrie nahmen nicht signifikant zu. Auf den submaximalen Belastungsstufen sanken die Herzrate und die Sauerstoffaufnahme der Trainingsgruppe signifikant ab verglichen mit der Kontrollgruppe. Die Schmerzsymptomatik verbesserte sich in der Ausdauergruppe signifikant. Die Anzahl der positiven Tender-Points nahm ebenso wie die vom Schmerz betroffene Größe der Körperoberfläche im Schmerzdiagramm ab. Vier Patienten erfüllten nach dem Training nicht mehr die Diagnosekriterien einer Fibromyalgie. Anhand der punktbezogenen Schmerzschwellen konnte nur ein signifikanter Trainingseffekt für den Bereich der Glutealmuskulatur festgestellt werden. Die Autoren sehen hierin den direkten Zusammenhang von lokaler Beanspruchung (schnelles Gehen, Radfahren) und Reduktion der Schmerzempfindlichkeit. Der subjektive Allgemeinzustand verbesserte sich signifikant in der Trainingsgruppe, nicht jedoch in der Kontrollgruppe. MEIWORM et al. (1999) stellten eine Verbesserung der Schmerzsymptomatik und des Allgemeinbefindens bei Fibromyalgie durch ein Ausdauertraining fest, die nicht primär von Umfang und Intensität der körperlichen Belastung abhängt. 67 Ausdauerleistungsfähigkeit PETERS, STANLEY, ROSE, KANEY und SALMON (2002) untersuchten Patienten mit anhaltenden, unerklärbaren körperlichen Symptomen in der ärztlichen Grundversorgung. Die 228 Patienten (121 weiblich) wurden randomisiert auf zwei Gruppen verteilt, 51 Patienten erschienen allerdings nicht zur ersten Trainingseinheit. Die Intervention erfolgte über 10 Wochen in zwei einstündigen, angeleiteten Gruppeneinheiten pro Woche. Die Ausdauergruppe (n=87) absolvierte ein Circuittraining mit dem Ziel, die Herzrate auf 60-65% der geschätzten altersentsprechenden maximalen Herzrate zu halten. Die Stretching-Gruppe (n=90) machte Dehnübungen, bei denen die Herzrate unter 50% der geschätzten altersentsprechenden maximalen Herzrate liegen sollte. Zusätzlich sollten alle Probanden zuhause drei mal wöchentlich mindestens 20 Minuten Übungen machen, die individuell abgestimmt und in einem strukturierten Tagebuch festgehalten werden sollten. Die klinischen Daten wurden von den behandelnden Ärzten erhoben und umfassten Informationen über die Zahl der Arztbesuche, die Zahl und Art der Verschreibungen und des Aufsuchens von Fachärzten sowie der vorherrschenden Beschwerden bzw. Symptome. Über Selbstbeurteilung wurden psychometrische Parameter zum emotionalen Status (HADS), zur Somatisierung und zur gesundheitsbezogenen Lebensqualität (SF-36) erhoben. Außerdem wurden die Einschätzung der Erwartungen über die Trainingseffekte und die Lebenseinschränkung durch das hauptsächliche Problem festgestellt. Die Ausdauerleistungsfähigkeit wurde in einem dreistufigen Ergometertest über die maximale Sauerstoffaufnahme bestimmt. Die Messzeitpunkte der meisten Parameter lagen nach der Rekrutierung, zu Trainingsbeginn, nach dem Training und sechs Monate später. Die Patienten der beiden Gruppen unterschieden sich zu Beginn des Trainings weder in demographischen, noch in klinischen oder psychologischen Parametern. Die Teilnahmerate betrug im Median elf Einheiten von 20 angebotenen. Nur 50% der Trainingsteilnehmer führten das Trainingstagebuch. Die durchschnittliche Herzrate während des Trainings war in der Ausdauergruppe mit 111 S/min signifikant höher als in der Stretching-Gruppe mit 86 S/min. Die maximale Sauerstoffaufnahme blieb unverändert in beiden Gruppen. Die Inanspruchnahme medizinischer Leistung war bei der Katamnese niedriger (Anzahl der Arzt- und Facharztbesuche, Verschreibungen) und die Anzahl der Symptome war deutlich niedriger. Die Patienten zeigten zur Katamnese einen verbesserten psychologischen Status und eine Verbesserung der körperlichen Symptome. Depressivität, Angst und Somatisierung sanken, und die Patienten fühlten sich weniger einge68 Ausdauerleistungsfähigkeit schränkt. Die Ergebnisse zeigten sich in beiden Versuchsgruppen, so dass sich das Ausdauertraining im Gegensatz zu der Studie von MCCAIN et al. (1988) nicht als effektiver im Vergleich zum Stretching-Programm erwies. Allerdings war die durchschnittliche Trainingsherzfrequenz für ein Ausdauerprogramm so niedrig, dass ausbleibende Effekte auch auf eine zu geringe Trainingsintensität zurück zu führen sind. Die Reduktion der Inanspruchnahme medizinischer Leistungen war abhängig von der Anzahl der absolvierten Trainingseinheiten, so dass die Autoren hierin eine unmittelbare Wirkung des Trainings sehen. Die Verbesserung der subjektiven Einschätzung zeigte sich davon allerdings unabhängig. PETERS et al. (2002) sehen in körperlichem Training eine alternative Möglichkeit für die oft problematische Behandlung von Patienten mit unerklärbaren, körperlichen Symptomen. 69 Fragestellung und Hypothesen 5 Fragestellung und Hypothesen Angst- und somatoforme Störungen sind mit hohen Belastungen für die einzelnen Betroffenen, aber auch für die Gesellschaft durch die hohen gesundheitsökonomischen Folgen verbunden. Dadurch wird eine erfolgreiche Behandlung dieser Patientengruppen dringlich. Die bei einem Teil der Betroffenen bestehende autonome Dysregulation blieb in der Behandlung bisher unberücksichtigt. Da bisherige Untersuchungsergebnisse wie beschrieben darauf hindeuten, dass sich ein Ausdauertraining und/oder eine erhöhte körperliche Leistungsfähigkeit auf die autonome Regulation auswirkt, wird in der vorliegenden Arbeit untersucht, ob durch ein systematisches aerobes Ausdauertraining die autonome Regulation beeinflusst werden kann, eine bestehende autonome Dysfunktion bei Patienten mit einer Angst- oder somatoformen Störung sich normalisiert, und ob die Ergebnisse einer multimodalen Rehabilitationsbehandlung bei den betroffenen Patienten verbessert werden können. Das entsprechende Ausdauertraining ist einfach und unter geringem Aufwand durchzuführen, so dass die Behandlung um ein kostengünstiges Element erweitert werden könnte. Aus dieser Fragestellung heraus wurden die folgenden Hypothesen für die vorliegende Untersuchung formuliert: 1. Hypothese: Die Experimentalgruppe mit autonomer Dysregulation (EG dys) zeigt eine Normalisierung der Indices der kardiovaskulären Regulation relativ zur Kontrollgruppe (KG dys) im Sinne eines Anstiegs der Baroreflexsensitivität um 3 ms/mmHg und im Sinne eines Anstiegs der Herzratenvariabilität. 1a Die Effekte sind nach vier Wochen nur tendenziell erkennbar, sie erreichen klinisch und statistisch die Signifikanz bei der katamnestischen Erhebung. 1b Die trainierten und untrainierten Probanden mit unauffälliger Regulation (EG norm und KG norm) zeigen im Gesamtverlauf keine Veränderung der autonomen Regulation. 70 Fragestellung und Hypothesen 1c Patienten mit einer Angststörung und Patienten mit einer somatoformen Stö- rung unterscheiden sich innerhalb der beeinträchtigten und der nicht beeinträchtigten Gruppe hinsichtlich der autonomen Regulation und ihrer Veränderung im Verlauf nicht voneinander. 2. Hypothese: Ein zusätzliches aerobes Training verbessert den Rehabilitationserfolg in den Gruppen EG dys und EG norm (erfasst mit dem klinikinternen Fragebogen zum Rehabilitationserfolg) zu den Messzeitpunkten T2 und T3 relativ zu den Kontrollgruppen KG dys und KG norm. 3. Hypothese: Die Verbesserung zeigt sich insbesondere in einer affektiven Verbesserung im Sinne einer reduzierten Angst- und depressiven Symptomatik. 4. Hypothese: Die kardiovaskuläre Stress-Reaktivität ist in den Experimentalgruppen EG dys und EG norm zu den Messzeitpunkten T2 und T3 geringer als bei den Patienten mit der etablierten Standardbehandlung KG dys und KG norm. 71 Methodik 6 Methodik Die Hypothesen sollten mittels einer eigenen Längsschnittstudie überprüft werden. Im Folgenden werden die Untersuchungsbedingungen dargestellt, die Stichprobe, die Messung und Erhebung der physiologischen und psychometrischen Parameter, das Ausdauertraining als Intervention sowie die Untersuchungsdurchführung und Auswertung. 6.1 Behandlungskonzept der Klinik Die Untersuchung wurde in der Psychosomatischen Fachklinik St. Franziska-Stift in Bad Kreuznach durchgeführt. In der Klinik werden bis zu 180 erwachsene Patienten mit allen Formen psychischer und psychosomatischer Störungsbilder rehabilitiert (RÜDDEL, 2004). Die stationär behandelten Patienten verbringen die ersten Tage auf der Aufnahmestation zur Diagnostik, zur ersten Informationsvermittlung und zum Festlegen vorläufiger Behandlungs- und Rehabilitationsziele. Anhand der gewonnenen Informationen erfolgt eine differentielle Zuweisung zur psychoanalytisch oder zur verhaltensmedizinisch ausgerichteten Abteilung. In die Untersuchung wurden nur Patienten von Stationen mit verhaltensmedizinischem Ansatz einbezogen, um Effekte der unterschiedlichen Behandlungsansätze auszuschließen. Daher bezieht sich die Beschreibung des Behandlungskonzeptes entsprechend nur auf das der verhaltensmedizinischen Abteilung. Gruppentherapeutische Verfahren stehen im Mittelpunkt der Therapie. Die Basisgruppe als verhaltenstherapeutische Problemlösegruppe findet an zwei Terminen wöchentlich statt und wird erweitert durch einen wöchentlichen Einzeltermin beim jeweiligen Bezugstherapeuten. Je nach Behandlungsschwerpunkt erfolgt die Teilnahme an einer störungsspezifischen indikativen Gruppe (z.B. Schmerzbewältigungsgruppe oder Angstbewältigungsgruppe). Neben den psychotherapeutischen Verfahren ist die Teilnahme an Teamsport, Entspannungsverfahren (Progressive Muskelentspannung nach Jacobson) und Feldenkrais verpflichtend. Darüber hinaus wird die Behandlung nach Bedarf durch sozialtherapeutische Maßnahmen, Ernährungsberatung, Gestaltungstherapie, balneo-physikalische und krankengymnastische Maßnahmen, seelsorgerische Betreuung und Sportangebote (Frühsport, Gymnastik, 72 Methodik Wassergymnastik oder Sportspiele) ergänzt (PSYCHOSOMATISCHE FACHKLINIK ST. FRANZISKA-STIFT, 1997). 6.2 Stichprobe der Untersuchung Die vorliegende Untersuchung umfasst stationär behandelte Patienten der verhaltensmedizinischen Stationen in der Psychosomatischen Fachklinik St. Franziska-Stift in Bad Kreuznach mit einer nach dem ICD-10 (DILLING et al., 1993) diagnostizierten Angststörung (F40 oder F41) und/oder einer somatoformen Störung (F45). Um die Einflussfaktoren auf die autonome Regulation zu minimieren und eine möglichst homogene Stichprobe zu erhalten, wurden die folgenden Einschluss- bzw. Ausschlusskriterien festgelegt: Einschlusskriterien: • Eingangsdiagnose nach ICD-10 F 40, F 41 oder F 45 • Alter zwischen 20 und 60 Jahren • Body-Mass-Index zwischen 18,5 und 35 kg/m² • Behandlung auf einer verhaltensmedizinischen Station Ausschlusskriterien: • Regelmäßig betriebener Ausdauersport/Ausdauertrainiertheit • Einnahme von Herz-Kreislauf-wirksamen Medikamenten • Blutdruckwerte systolisch >160 und diastolisch >95mmHg • Vorliegen eines insulinpflichtigen Diabetes mellitus, einer Polyneuropathie, einer manifesten Hypo- oder Hyperthyreose oder einer koronaren Herzerkrankung • Vorliegen einer Suchtmittelabhängigkeit oder Umweltgifttoxikation • Laufende Begutachtung für ein Rentenverfahren Der Altersbereich wurde begrenzt, da der Einfluss des Lebensalters auf die autonome Regulation nachgewiesen worden ist. Die Herzratenvariabilität nimmt mit zunehmendem Alter aufgrund einer verminderten parasympathischen Aktivität ab (DAUCHOT & GRAVENSTEIN, 1971; ODEMUYIWA, 1995). MOLGAARD, HERMANSEN und BJER- REGAARD (1994) stellten fest, dass die vagale Aktivität (HF-Bereich) um 13% und der Index der sympatho-vagalen Interaktion (LF-Bereich) um 15% pro Dekade abneh73 Methodik men. LEVY et al. (1998) stellten eine verminderte Herzratenvariabilität bei älteren Männern im Vergleich zu jüngeren fest und bestätigten die Ergebnisse vorheriger Untersuchungen (BYRNE, FLEG, VAITKEVICIUS, WRIGHT & PORGES, 1996; JENSENURSTAD, STORCK et al., 1997; YAMASAKI et al., 1996). Bezüglich der kardiovaskulären Reaktivität beschreibt LIGHT (1989) größere Blutdruckreaktionen in höherem Alter auf Stressoren im Laborversuch. Der Gewichtsbereich wurde ebenfalls begrenzt, da verglichen mit Normalgewichtigen sowohl adipöse Probanden (TUCK, 1992; ZAHORSKA-MARKIEWICZ, KUAGOWSKA, KUCIO & KLEIN, 1993) als auch untergewichtige, von einer Anorexia nervosa betroffene, Patientinnen (BRUNNER, MALONEY, DANIELS, MAYS & FARRELL, 1989) eine höhere Aktivität und Reaktivität des sympathischen Nervensystems aufwiesen. Darüber hinaus kann ein regelmäßiges Ausdauertraining für die Gewichtszunahme innerhalb einer Behandlung der Anorexia nervosa kontraindikativ sein. Die Teilnahme wurde auf Patienten der verhaltensmedizinischen Abteilung beschränkt, um eine bessere Standardisierbarkeit der Behandlung zu erreichen und mögliche verschiedene Effekte der beiden theoretisch unterschiedlich begründeten psychotherapeutischen Ansätze auszuschließen. Ausdauertrainierte Patienten wurden von der Studie ausgeschlossen, da sich körperliches Training auf die autonome Regulation auswirkt. So zeigen sich bei einer hohen Ausdauerleistungsfähigkeit eine trainings-induzierte Bradykardie (DE MARÉES, 2002, 304; WEINECK, 1994) und eine geringere Herzfrequenz bei vergleichbarer Belastung (GALLO et al., 1995). Die Herzratenvariabilität zeigte sich erhöht bei höherer körperlicher Fitness (PUIG et al., 1993) und stieg durch ein entsprechendes Training bei anfangs Untrainierten an (LEVY et al., 1998). Darüber hinaus sollen mit der Untersuchung die Effekte eines Ausdauertrainings im Kontrollgruppenvergleich gemessen werden. Bei Anfängern sind stärkere Trainingseffekte zu erwarten als bei bereits Trainierten, so dass sich möglich Effekte im zur Verfügung stehenden Untersuchungszeitraum leichter zeigen lassen (vgl. HOLLMANN & HETTINGER, 2000, 115). Als Trainierte galten Patienten, die in der fahrradergometrischen Belastungsuntersu- chung über der von ROST (1995, 278) angegebenen „normalen Leistungsfähigkeit“ Untrainierter lagen. Die maximale Sollleistung beträgt für Männer 3 Watt/kg Körper74 Methodik gewicht abzüglich 1% pro Jahr über dem 30. Lebensjahr und für Frauen 2,5 Watt/kg Körpergewicht abzüglich 0,8% pro Jahr jenseits des 30. Lebensjahres. Die Einnahme bestimmter Medikamente galt als Ausschlusskriterium, insofern Auswirkungen auf die autonome Regulation durch das betreffende Medikament festgestellt wurden. Hierzu zählten die ß-Blocker. Die Auswirkungen unter Ruhebedingungen scheinen zwar geringer als angenommen (TASK FORCE, 1996), unter Stressbedingungen (z.B. mentale Aufgaben) senken ß-Blocker jedoch die Herzratenreaktivität (FREISCHUSS, HJEMDAHL, JUHLIN-DANNFELT & LINDE, 1988; RÜDDEL, LANGEWITZ, SCHÄCHINGER, SCHMIEDER & SCHULTE, 1988; SHAPIRO, KRANTZ & GRIM, 1986) und verstär- ken die Veränderungen des totalen peripheren Widerstandes (RÜDDEL, LANGEWITZ et al., 1988; RÜDDEL, SCHMIEDER, LANGEWITZ & SCHULTE, 1988). Außerdem wurde die Teilnahme bei Einnahme von Benzodiazepinen ausgeschlossen. Unter Stressbedingungen zeigte sich eine Reduktion der sympathischen Aktivität (GOLDSTEIN, 1987) und des Blutdrucks (CHARNEY, BREIER, JATLOW & HENNINGER, 1986). Hypertone Blutdruckwerte galten als Ausschlusskriterium, da bei Hypertonie die Herzratenvariabilität signifikant reduziert ist (PERKIOMAKI et al., 1996), und Hypertoniker auf Stress mit höheren Blutdruckanstiegen als Normotoniker reagieren (FREDRIKSON & MATTHEWS, 1990). In der Hoorn-Studie fanden GERRITSON et al. (2000) die ar- terielle Hypertonie und Einnahme blutdrucksenkender Medikamente als unabhängige Prädiktoren für eine autonome Dysregulation. Außerdem sollte eine Gefährdung durch das Ausdauertraining bei möglichen Belastungsblutdruckspitzen ausgeschlossen werden. Beim Vorliegen bestimmter Erkrankungen war eine Teilnahme nicht möglich, da die Erkrankungen oft mit einer gestörten autonomen Dysregulation einhergehen. HENNERSDORF und STRAUER (2002) zufolge zeigen sich bei 40% der Patienten mit einem manifesten Diabetes mellitus Anzeichen einer autonomen Neuropathie, die sich in einer erhöhten Ruheherzfrequenz und einer Frequenzstarre unter Belastung äußern. WESTON et al. (1996) fanden bei Diabetikern verglichen mit einem Normalkollektiv sowohl die Herzfrequenzvariabilität als auch die Baroreflexsensitivität signifikant verringert. Diabetiker mit einer Polyneuropathie wiesen eine verminderte Herzratenvari- 75 Methodik abilität unter Ruhe und unter Stressbelastung im Sinne einer reduzierten Reaktivität auf (HARTL, 1995; PAULI, HARTL, MARQUARDT, STALMAN & STRIAN, 1991). Eine Hypo- oder Hyperthyreose impliziert als endokrine Störung eine veränderte Aktivität der Hypothalamus-Hypophysen-Nebennierenrinden-Achse. Aufgrund der zu erwartenden Auswirkungen auf die autonome Regulation wurden betroffene Patienten ebenfalls von der Studie ausgeschlossen. Verschiedene Herzerkrankungen können HENNERSDORF und STRAUER (2002) zufolge mit einer autonomen Dysfunktion einhergehen. „Der Status der Infarktarterie scheint neben der linksventrikulären Auswurffraktion der wichtigste Faktor für eine Einschränkung der autonomen Funktion zu sein“ (S. 1074). Außerdem reagieren Patienten mit einer koronaren Herzerkrankung mit höheren Blutdruckwerten auf mentale Belastungen als gesunde Kontrollpersonen (SUNDIN, ÖHMAN, PALM & STRÖM, 1995). Als weitere Ausschlusskriterien galten eine bestehende Suchtmittelabhängigkeit oder eine Umweltgifttoxikation, da Alkohol, Lösungsmittel oder Schwermetalle gravierende neurotoxische Folgen hervorrufen können (SCHWARTZ, 2000, 165f., 351-354) und in Abhängigkeit von Dosis und Expositionsdauer Schäden im Bereich des peripheren und zentralen Nervensystems verursachen, die zu einer autonomen Neuropathie, zumeist im Rahmen einer generalisierten Polyneuropathie, führen können (ASBURY, 1991). Patienten, die im Rahmen eines laufenden Rentenantrages zur Begutachtung ihrer Leistungsfähigkeit in der Klinik aufgenommen wurden, waren ebenfalls von der Studie ausgeschlossen, da bei diesen Patienten relativ schlechte Rehabilitationsergebnisse erwartet werden mussten. Unter Berücksichtigung der genannten Ein- bzw. Ausschlusskriterien nahmen insgesamt 139 Patienten an der Untersuchung teil. In Tabelle 6.1 sind die soziodemographischen Angaben, in Tabelle 6.2 die anthropometrischen Daten der Stichprobe dargestellt. Die Stichprobe umfasst alle Patienten, die mindestens die Untersuchung zum ersten Messzeitpunkt komplett abgeschlossen haben. Die Übersicht beinhaltet 76 Methodik die Zugehörigkeit zur Experimental- bzw. Kontrollgruppe. Die Gruppenzuteilung erfolgte über eine Randomisierung per Zufallslisten (s. S. 97). Tabelle 6.1. Soziodemographische Angaben der Experimental- und Kontrollgruppe gesamt sowie getrennt nach Geschlecht (männl.: männlich, weibl.: weiblich). Experimentalgruppe gesamt weibl. Kontrollgruppe männl. gesamt weibl. männl. Schulbildung Haupt-/Volksschulabschluss 38 23 15 31 22 9 Realschulabschluss/mittlere 27 24 3 20 19 1 13 11 2 10 7 3 3 3 0 4 3 1 Ohne Berufsabschluss 10 8 2 9 9 0 Lehre/Fachschule 58 44 14 43 34 9 Meister/Techniker 3 1 2 4 1 3 Fachhochschule/Universität 4 2 2 1 1 0 Ledig 12 9 3 12 9 3 Verheiratet 45 34 11 28 20 8 3 3 0 7 6 1 15 9 6 11 10 1 Verwitwet 0 0 0 3 3 0 Wieder verheiratet 3 3 0 0 0 0 Kinderlos 19 15 4 17 13 4 Kinder 59 43 16 44 35 9 Reife Fachabitur/Abitur Berufsabschluss Noch in Berufsausbildung Familienstand Getrennt lebend Geschieden Von den 139 Patienten absolvierten 93 Patienten alle Messzeitpunkte einschließlich der Katamnese, so dass der Drop-Out bei 46 Patienten, einem Anteil von 33 Prozent lag. Der Ausstiegszeitpunkt und die Gründe finden sich in Tabelle 6.3. 77 Methodik Tabelle 6.2. Mittelwerte (M) und Standardabweichungen (SD) der anthropometrischen Daten und Body-Mass-Index (BMI) der Untergruppen und Gesamtgruppe, geschlechtsspezifisch unterteilt. Größe Alter Gewicht BMI [cm] [Jahre] [kg] [kg/m²] Anzahl Gesamt KG dys KG norm EG dys EG norm (n) M SD Alle 139 169 ± 8,5 41,3 ± 8,9 72,4 ± 12,8 25,4 ± 3,7 weibl. 106 166 ± 6,1 40,7 ± 8,6 69,1 ± 11,0 25,2 ± 3,7 männl. 33 177 ± 8,9 43,3 ± 9,4 82,5 ± 13,1 26,2 ± 3,6 Alle 30 167 ± 7,6 43,8 ± 9,3 67,2 ± 11,2 24,1 ± 3,1 weibl. 24 164 ± 6,3 42,1 ± 9,0 63,7 ± 8,0 männl. 6 176 ± 4,8 50,7 ± 7,8 81,2 ± 11,8 26,0 ± 3,9 Alle 31 170 ± 9,0 39,8 ± 8,0 76,2 ± 14,0 26,3 ± 4,0 weibl. 24 167 ± 5,0 39,9 ± 6,8 71,5 ± 10,6 25.8 ± 4,0 männl. 7 183 ± 8,8 39,3 ± 11,9 92,4 ± 12,2 27,8 ± 3,6 Alle 40 169 ± 7,7 44,1 ± 8,3 73,2 ± 12,3 25,8 ± 4,0 weibl. 30 166 ± 5,6 43,5 ± 8,7 70,3 ± 11,8 25,7 ± 4,4 männl. 10 177 ± 7,4 45,7 ± 7,1 81,6 ± 10,2 26,1 ± 3,0 Alle 38 169 ± 9,6 37,6 ± 8,5 72,4 ± 12,7 25,4 ± 3,5 weibl. 28 166 ± 7,4 37,0 ± 8,7 70,5 ± 11,7 25,6 ± 3,3 männl. 10 178 ± 9,9 39,2 ± 7,9 77,8 ± 14,5 24,7 ± 4,1 M SD M SD M SD 23,6 ± 2,7 Tabelle 6.3. Der Drop-Out mit dem jeweiligen Zeitpunkt und den angegebenen Gründen des Abbruchs für die Gesamtgruppe sowie für Experimental- und Kontrollgruppe und deren Untergruppen. Gesamt EG KG Alle Dys Norm Alle Dys Norm Zeitpunkt T1 10 7 1 6 3 1 2 T2 36 18 7 11 18 10 8 Insgesamt 46 25 8 17 21 11 10 Keine Zeit wegen Arbeit/Stress 11 8 5 3 3 1 2 Krankheit/Verletzung 12 5 2 3 7 7 0 Schwangerschaft 2 1 0 1 1 1 0 Wollte nicht mehr teilnehmen 14 8 0 8 7 1 6 Unbekannt verzogen 3 2 1 1 1 0 1 Vorzeitiger Therapieabbruch 4 1 0 1 2 1 1 Grund für Abbruch Anmerkungen. Dys: autonome Dysregulation - BRS < 6,819ms/mmHg, EG: Experimentalgruppe, KG: Kontrollgruppe, männl.: männlich, Norm: Unauffällige autonome Regulation - BRS > 6,819ms/mmHg, T1: 1.Datenerhebung komplett abgeschlossen, T2: 2. Datenerhebung abgeschlossen ohne Katamnese, weibl.: weiblich. 78 Methodik 6.3 Kontrollvariablen Aufgrund der Ein- und Ausschlusskriterien (s. Abschnitt 6.2) wurde ein gewisser Grad an Homogenität der Stichprobe erzielt. Um die Vergleichbarkeit zwischen der Kontroll- und der Experimentalgruppe herzustellen, wurden die folgenden Kontrollvariablen aus den Patientenakten (ergänzt durch mündliche und schriftliche Befragung der Patienten) erfasst: • Alter • Geschlecht • Gewicht • Zigarettenkonsum • Ausmaß körperlicher Aktivität • Einnahme von Medikamenten Die Kontrollvariablen wurden aufgrund ihrer bekannten Einflussnahme auf die autonome Regulation ausgewählt. Alter, Körpergewicht und kardiovaskuläre Regulation scheinen besonders relevante Variablen zu sein (s. 6.2). Den Einfluss des Geschlechts wiesen GREGOIRE et al. (1996) nach, die bei Frauen eine höhere Herzratenvariabilität als bei altersgleichen Männern feststellten. Einer Metaanalyse zufolge lässt sich darüber hinaus bei Männern mittels des systolischen Blutdrucks eine ausgeprägtere Stressreaktivität feststellen (STONEY, DAVIS & MATTHEWS, 1987). Die Menge an Zigarettenkonsum wurde erfragt, da der Konsum von Zigaretten die kardiovaskuläre Reaktivität beeinflusst (DEMBROWSKI, 1986). GALLAGHER, TERENZI und DE MEERSMAN (1992) beschreiben eine gesteigerte Sympathikusaktivität über eine Stimulierung adrenerger Prozesse durch das Rauchen von Zigaretten. LUCINI, BERTOCCHI, MALLIANI und PAGANI (1996) stellten bei Rauchern eine verringerte Baroreflexsensitivität fest. Das Ausmaß körperlicher Aktivität wurde mittels des Freiburger Fragebogen zur körperlichen Aktivität (FREY & BERG, 1995) erfragt (s. 6.7), da sich bei trainierten Athleten eine höhere Herzratenvariabilität als bei untrainierten Kontrollpersonen fand (DE MEERSMANN, 1993; PUIG et al., 1993). Die Herzratenvariabilität steigt nach KENNEY (1985) mit zunehmender maximaler Sauerstoffaufnahme exponentiell an. Auch die kardiovaskuläre Reaktivität scheint durch regelmäßiges Sporttreiben abzunehmen (HOLMES & ROTH, 1988; LIGHT et al., 1987). Die Intervention der Untersuchung be79 Methodik steht aus einem moderaten Ausdauertraining für Anfänger, so dass alle körperlichen Aktivitäten erfasst werden sollen, um mögliche Einflüsse körperlicher Aktivität auf eine Veränderung der Ausdauerleistungsfähigkeit und der autonomen Regulation unabhängig von der Intervention festzustellen. Die Einnahme von Medikamenten, die nicht unter die Ausschlusskriterien fielen, wurde ebenfalls erfragt, um mögliche Auswirkungen auf die autonome Regulation berücksichtigen zu können, die bei Untersuchungsbeginn noch nicht bekannt waren. 6.4 Erhebung der physiologischen Parameter Die psychophysiologische Untersuchung wurde in aufrechter Sitzposition der Patienten auf einem Entspannungssessel (Modell Trocadero, Firma EVERSTYL, Aachen, Deutschland) im psychophysiologischen Labor des St. Franziska-Stiftes durchgeführt und die Auswertung und Berechnung der Indices der autonomen Regulation vorgenommen. 6.4.1 Abgeleitete Parameter Alle elektrokardiographischen sowie die Blutdruck- und Atemwerte wurden nicht invasiv erhoben. Die psychophysiologischen Daten wurden mit Hilfe der „TURBOLAB“-Software gesammelt und umgewandelt. Alle von den Elektroden ausgehenden analogen Körpersignale wurden mittels einer A/D-Wandelkarte (Analogic Data Acquisition Systems MSDAS-12) mit einer Abtastrate von 1000 Hz digitalisiert und als Rohdaten im Multiplex-Format auf der Festplatte eines 486er-Computers (Modell IBM 100DXU/P von der Firma IBM, Portsmouth, England) gespeichert (MUSSGAY, o.J.). 6.4.1.1 Elektrokardiogramm Das EKG wurde mit einem Bio-Universalverstärker (Firma ZAK, Simbach/Inn, Deutschland) und vier Einweg-Klebeelektroden (Modell Blue Sensor von der Firma AMBU, Medicotest, Ølstykke, Dänemark), die unter den Schlüsselbeinen rechts und links vom Brustbein und jeweils seitlich am Ansatz des Rippenbogens angebracht wurden, abgeleitet. Anhand der Brustwandableitung vom linken Schlüsselbein gegen den linken untersten Rippenbogen wurden die R-Zacken mithilfe eines Auswertungsprogrammes für kardiovaskuläre Parameter erfasst. Artefakte, meist in Form von Extrasystolen, und nicht erkannte R-Zacken wurden anhand der graphischen 80 Methodik Darstellung manuell korrigiert. Wenn die Zeitstrecke der Artefakte mehr als 5% der gesamten Ableitezeit ausmachten, wurde die Aufzeichnung nicht in die statistische Auswertung aufgenommen. Das Programm errechnete die Interbeat-Intervalle als Zeit in ms zwischen zwei R-Zacken. Die Herzrate als Anzahl der Herzschläge in einer Minute wurde nach folgender Formel berechnet: HR = 60000/IBI Dabei ist: HR = Herzrate (S/min) IBI = Interbeat-Intervall, Zeit zwischen zwei R-Zacken (ms) 6.4.1.2 Blutdruck Der Blutdruck wurde mit Finapres (FINger Arterial PRESsure; Modell Ohmeda 2300 von der Firma OHMEDA, Englewood, USA) erfasst, da mit dieser Methode der Blutdruck kontinuierlich und nicht invasiv gemessen werden kann (WESSELING, 1991). Zur Messung ruhte der linke Arm des Patienten möglichst entspannt in Herzhöhe auf einer Lehne. Die Messmanschette wurde am zweiten Glied des Mittelfingers appliziert. Dem Fingerumfang entsprechend wurde die Manschettengröße ausgewählt. Ein Vergleich zwischen Finapres und dem Riva-Rocci-Korotkoff-Verfahren zeigte in verschiedenen Studien Differenzen in den ermittelten Blutdruckwerten (SCHÄCHINGER, FUNKE, RÜDDEL & SCHULTE, 1991; WESSELING, 1984). Für Messungen mit dem Finapres, die direkt hintereinander geschaltet werden, ergibt sich eine hohe TestRetest-Reliabilität (systolisch: r = ,93; diastolisch: r = ,97). Wenn die Manschette zwischen den Messungen abgenommen wird, besteht eine wesentlich geringere Reliabilität (systolisch: r = ,57; diastolisch: r = ,47). SCHÄCHINGER et al. (1991) zufolge lassen sich die mit Finapres ermittelten Blutdruckwerte nicht uneingeschränkt interpretieren. Für den Vergleich zwischen der Ruhe- und Belastungsphase in der vorliegenden Untersuchung können die Veränderungswerte des Blutdrucks mit dem Finapres demnach reliabel erfasst werden, da die Manschette zwischen den Phasen nicht abgenommen wird. Bei den Verlaufsmessungen gilt es, die herabgesetzte Reliabilität entsprechend zu berücksichtigen. 81 Methodik 6.4.1.3 Atemfrequenz Die Atemfrequenz wurde mit einem Piezokeramischen Atemgürtel (Modell ATA20100 von der Firma ZAK GmbH, Simbach) gemessen. Der Atemgürtel wurde mit einem Gummiband und zwei Klemmknöpfen am Körper des Patienten unterhalb der Rippenbögen befestigt. Über den Sensor-Steg werden Belastungsänderungen bei Atembewegungen als Spannung an einen Impedanzumwandler abgegeben. So konnte die Atemfrequenz in Atemzyklen pro Minute bestimmt werden. 6.4.2 Indices der autonomen Regulation Aus den abgeleiteten Parametern wurden die spektralanalytischen Parameter der autonomen Balance und die Baroreflexsensitivität als Kennwerte berechnet. 6.4.2.1 Spektralanalyse Eine etablierte Form zur Erfassung der Herzratenvariabilität und der Aktivität des autonomen Nervensystems stellen die „frequency-domain“-Messungen als Spektralanalyse des Herzraten-Signals dar (BERNTSON et al., 1997; FERSCHA et al., 1998; TASK FORCE, 1996). Die Grundlage für das Verfahren bildet das aufgezeichnete EKGSignal, das in eine Zeitreihe konsekutiver RR-Intervalle (Tachogramm) umgesetzt wird. Dieses Eingangssignal wird durch eine Spektralanalyse zerlegt, so dass die einzelnen Bestandteile der Herzratenvariabilität als periodische Funktionen abgebildet werden. Die spektrale Energiedichte wird dabei über der jeweiligen Frequenz aufgetragen (BRÜGGEMANN, WEIß & ANDRESEN, 1994). Ein Beispiel für ein solches Spektrum, erstellt aus einem RR-Tachogramm, zeigt Abbildung 6.1. Die langsamen Schwingungen sind auf der linken, die schnelleren Schwingungen auf der rechten Seite abgebildet. In der vorliegenden Studie wurde die Fast Fourier Transformation als mathematische Methode eingesetzt, um die Gewichtung der einzelnen Frequenzen am Gesamtspektrum differenziert zu bestimmen. Das CARSPAN-Programm (Cardiovascular Signal Analysis Program, MULDER, 1988; MULDER, VAN DELLEN, VAN DER MEULEN & OPHEIKENS, 1988) wurde verwendet, da die Korrelation des Ursprungssignals mit sich selbst das Resampling der Rohdaten ersetzt und eine Transformation aller entsprechenden kardiovaskulären und respiratorischen Parameter ermöglicht. Die einzelnen Frequenzen aus der Transformation des Herzratensignals, die im Bereich von 82 Methodik 0.02 bis 0.40 Hz auftreten können, werden zu so genannten Frequenzbändern zusammengefasst (s. Tabelle 6.4). Abbildung 6.1. Prinzip der Spektralanalyse der Herzfrequenzvariabilität mit einem EKG-Signal, einem Tachogramm der RR-Intervalle und einer spektralanalytischen Darstellung. Aus T. BRÜGGEMANN, D. WEIß & D. ANDRESEN (1994). „Spektralanalyse zur Beurteilung der Herzfrequenzvariabilität“. Herzschrittmachertherapie und Physiologie, 5 (Suppl. 2), S. 20. Anmerkungen: bpm: Schläge pro Minute (S/min), EKG: Elektrokardiogramm, Hz: Hertz, RR-Intervall: Abstand zwischen zwei Herzschlägen, s: Sekunde, Schlagnr.: Schlagnummer. Tabelle 6.4. Definitionen der Parameter der HRV-Frequenzanalyse bei Kurzzeit-EKG-Auswertungen nach MULDER (1988, S. 118). Parameter Total Power Einheit ms² Definition Gesamtspektrum (Gesamtleistungsdichtespektrum) Varianz aller RR-Intervalle ≤0.4 Hz Low frequency-Band ms² Leistungsdichtespektrum von 0.02 bis 0.06 Hz Mid frequency-Band ms² Leistungsdichtespektrum von 0.07 bis 0.14 Hz High frequency-Band ms² Leistungsdichtespektrum von 0.15 bis 0.40 Hz Alle drei Frequenzbereiche zusammengenommen werden als Gesamtspektrum „Total Power“ bezeichnet. Im angelsächsischen Raum wird eine andere Einteilung üblicherweise verwendet. Der Bereich der „Low frequency“ wird dort mit der „Very low frequency“ und der Bereich des „Mid frequency“-Bands mit der „Low frequency“ bezeichnet (TASK FORCE, 1996). 83 Methodik In Ruhe ist die Herzratenvariabilität am höchsten. Unter Lagewechsel, körperlicher Belastung oder mentaler Belastung nimmt die Total Power ab und die Gewichtung der verschiedenen Frequenzbänder verändert sich. Das High frequency-Band gilt als Ausdruck der parasympathischen Aktivität (MALLIANI, 1995; FALLEN & KAMATH, 1995; PAGANI et al., 1995; TASK FORCE, 1996). In diesem Bereich wird die respiratorische Sinusarrhythmie erfasst und quantifiziert, die sich entsprechend einer Atemfrequenz von etwa 15 Atemzyklen pro Minute darstellt (BRÜGGEMANN et al., 1994). Dies entspricht dem Bereich der Atemfrequenz in Ruhe, die beim Erwachsenen zwischen zehn und 18 Atemzyklen pro Minute, im Mittel 14/min beträgt (DE MARÉES, 2003, 225). Das Mid frequency-Band wird sowohl parasympathisch als auch sympathisch beeinflusst (YERAGANI et al., 1991). Allerdings ergeben sich Veränderungen in diesem Frequenzband beispielsweise unter mentaler Stressbelastung als Folge sympathischer Aktivität. Deshalb besteht die Annahme, dass das Mid frequency-Band vor allem die sympathische Aktivität widerspiegelt (CERUTTI, BIANCHI & MAINARDI, 1995; MALLIANI, 1995; PAGANI et al., 1995). Entscheidender für die vorliegende Untersuchung ist dieser Frequenzbereich allerdings als Indikator für die barorezeptorische Aktivität (s. Abschnitt 6.5.2.2). Das Low frequency-Band bleibt in der vorliegenden Studie unberücksichtigt, da die physiologische Interpretation noch nicht klar genug erscheint (TASK FORCE, 1996). Das so genannte „Respiration frequency“-Band (Respiratorisches Band) wird als Index aus der Herzratenpower im Bereich ± 0.03 Hz um das Maximum der Atemfrequenz bestimmt (PORGES, MCCABE & YONGUE, 1982). Der Porges-Index konnte nur berechnet werden, wenn die Atemfrequenz unter 25 Atemzyklen pro Minute lag. 6.4.2.2 Baroreflexsensitivität Die Baroreflexsensitivität wurde frequenzanalytisch bestimmt. Ausgangspunkt ist die intrinsische Frequenz der Barorezeptorenschleife, die bei etwa 0,10 Hz liegt (HOTTENROTT, 2002, 18). AKSELROD et al. (1985) ermittelten spektralanalytisch für die auf den Baroreflex bezogene Herzratenvariabilität eine Frequenz von 0,1 Hz. Diese Frequenz lässt sich darüber hinaus in den Schwankungen des Blutdruckes finden, in den so genannten Mayer-Wellen (HOTTENROTT, 2002, 19). Die Bestimmung der Baroreflexsensitivität beginnt folglich mit einer Spektralanalyse der Herzfrequenz- und der Blutdruckmodulation im Mid frequency-Band (Leistungs84 Methodik dichtespektrum von 0.07 bis 0.14 Hz). Mithilfe des CARSPAN-Programmes (MULDER, 1988; MULDER et al., 1988) ist es möglich, das beschriebene spektralanalytische Verfahren auch mit den durch Finapres kontinuierlich erhobenen Blutdruckwerten durchzuführen. Da sich die Variabilität zwischen dem systolischen und dem diastolischen Blutdruck nur wenig voneinander unterscheidet, wurden in die Berechnungen lediglich die systolischen Werte einbezogen. Dann wird die Kohärenz zwischen der Blutdruck- und Herzfrequenzmodulation berechnet, um festzustellen, ob ein linearer Zusammenhang zwischen der Variabilität des systolischen Blutdrucks und der Herzrate besteht. Bei entsprechend hoher Kohärenz ist die Voraussetzung erfüllt, um den Modulus als „Ausdruck der Verstärkung, mit der sich eine Blutdruckmodulation auf die Modulation der Herzfrequenz auswirkt“ (HILZ et al., 2000, S. 45) zu berechnen. Die frühere Konvention einer Kohärenz von mindestens 0,50 führte teilweise zu paradoxen Effekten. Trotz vorhandener Kohärenz konnte eine Baroreflexsensitivität von Null resultieren. Deshalb wurde in der vorliegenden Untersuchung eine Kohärenz zwischen der Blutdruckamplitude und der Herzratenvariabilität von über 0,35 gefordert, damit der Modulus im Mid fequencyBand einen Indikator für die Baroreflexsensitivität darstellt. Diese nicht invasive Erfassung der Baroreflexsensitivität wurde mehrfach validiert. ROBBE et al. (1987) fanden hohe Korrelationen (r = ,94) zwischen der nicht invasiven Methode mittels Spektralanalyse und der herkömmlichen pharmakologischen Bestimmung der Baroreflexsensitivität mittels Phenylephrin. MULDER (1988, 125) konnte diese Ergebnisse in seiner Untersuchung bestätigen. Darüber hinaus ergab sich in allen Frequenzbändern eine signifikante Test-Retest-Reliabilität bezogen auf die Variabilität von Herzrate, den systolischen Blutdruck und den Modulus (SCHÄCHINGER et al., 1996). Für die vorliegende Untersuchung wurde die Methode der Spektralanalyse ausgewählt, da sie nicht invasiv und unter natürlichen Bedingungen durchgeführt werden kann, das heißt ohne medikamentöse oder äußere Druckstimulation. Zudem ermöglicht diese Vorgehensweise die Bestimmung der Baroreflexsensitivität sowohl unter Ruhe als auch unter mentalen Belastungsanforderungen. 85 Methodik 6.4.3 Untersuchungsbedingungen Unter Belastung in Form von mentalen Aufgaben vermindern sich die Herzratenvariabilität und die Baroreflexsensitivität. Die Höhe der Veränderung zwischen dem Ausgangswert in Ruhe und dem Wert unter Belastung drückt sich in der Stressreaktivität aus. Sie wird durch die Differenz beider Untersuchungsbedingungen berechnet. Alle beschriebenen Parameter wurden deshalb sowohl in einer fünfminütigen Ruhephase als auch unter fünfminütiger Belastung aufgezeichnet. 6.4.3.1 Ruhephase Während der Ruhephase befindet sich der Patient in aufrechter Sitzposition auf einem Entspannungssessel (Modell Trocadero, Everstyl, Aachen, Deutschland). Er erhält die Instruktion, sich möglichst ruhig und entspannt zurückzulehnen. 6.4.3.2 Belastungsphase Als Anforderungsbedingung in der Belastungsphase wurde das BonnDet (Modell BonnDet Version 7.0, Firma HERIBERT B. BIELING, Köln) verwendet. In der Testeinheit sind hinter einer undurchsichtigen Milchglasscheibe zehn Lampen in fünf Farben verborgen. Darunter befinden sich fünf leichtgängige Tasten in den entsprechenden Farben, die so angeordnet sind, dass sie durch einen Finger ohne Verlagerung des Unterarms betätigt werden können. Die Lampen leuchten in unterschiedlicher Reihenfolge auf, und der Patient soll möglichst schnell die jeweils passende Farbtaste drücken. Nach einem Probedurchlauf, in dem sich der Patient mit dem Gerät und der Aufgabe vertraut macht, erfolgt der fünfminütige Dauerdurchgang. Dabei wird die Arbeitsgeschwindigkeit der bisher gezeigten Reaktionsleistung angeglichen. Zeigt der Patient überwiegend richtige Reaktionen, sinkt der Reizabstand, und das Arbeitstempo erhöht sich. Im anschließenden Weißlichtversuch soll der Patient nur die weiße Taste drücken, wenn das Weißlicht, in zufälligen Abständen, aufleuchtet. So lässt sich die reine Reaktionszeit messen und mit der unter Stress beobachteten Reaktionszeit vergleichen (BIELING, 1991). Das BonnDet wurde als standardisierter Stressor gewählt, da es eine moderate Aufmerksamkeitsanforderung darstellt, die als Bearbeitung einer fast alltäglichen Aufgabe keinen besonderen Stress und keine emotionale Belastung bedeutet. Darüber hinaus eignet sich das Verfahren besonders für wiederholte Messungen, da durch Anpassen der Geschwindigkeit der Reizfolge an die gezeigte Leistung eine Gewöh86 Methodik nung an den Stressor verhindert wird. Durch die absolut zufällige Reizfolge ist ein Erlernen der Reizfolge ausgeschlossen. Das Verfahren gewährleistet eine hohe TestRetest-Reliabilität und eine hohe interpersonelle Varianz verglichen mit der intrapersonellen Varianz (LANGEWITZ, BIELING, STEPHAN & OTTEN, 1987). 6.5 Messung der aeroben Ausdauerleistungsfähigkeit Alle Teilnehmenden absolvierten einen stufenförmigen Belastungstest bis zur subjektiven Erschöpfung auf einem Tretkurbelergometer (Modell Ergometer Typ 900 von der Firma ERGOLINE GmbH, Bitz). Als Belastungsschema wurde das WHO-Schema gewählt, da an der Untersuchung gemäß den Einschlusskriterien nur ausdaueruntrainierte Patienten teilgenommen haben. Ausgehend von der Einstiegsbelastung von 25 Watt wurde die Belastung alle zwei Minuten um 25 Watt bis zum Abbruch der Ergometrie gesteigert. Die Teilnehmenden wurden angehalten, mit einer Umdrehungszahl von 60 U/min zu treten. Das Unterschreiten der Tretfrequenz von 50 U/min führte zum Abbruch der Belastung. Zum Ende jeder Belastungsstufe erfolgte die Messung des Blutdrucks nach der Methode von RIVA-ROCCI, die Registrierung der Herzfrequenz und die Blutabnahme aus dem hyperämisierten Ohrläppchen zur Bestimmung des Laktats. 6.5.1 Bestimmung der Laktatkonzentration Zur kapillaren Blutgewinnung am Ohr wurde mit einer Einmallanzette in das manuell hyperämisierte Ohrläppchen gestochen. Es wurden 10 µl Blut mit geeichten GlasEinmal-Mikropipetten (Kapillarpipetten 10 µl der Firma DR. BRUNO LANGE GmbH & Co. KG, Berlin) entnommen und in die Fertigreagenz der Messküvette Laktat (Küvette LKM 140 der Firma DR. LANGE, Berlin) ausgeblasen und für zehn Sekunden manuell vermischt. Die Blutlaktatwerte wurden anhand einer enzymatischen Farbmethode (LOX-PAP) mittels eines Phonometers (Miniphonometer plus LP 20 der Firma DR. LANGE, Berlin) in Serienmessung bestimmt. Die hämolysierten Küvetten wurden maximal eine halbe Stunde gelagert. Nach Zusatz der Startreagenz wird entsprechend der Reaktionsgleichung I Laktat mittels Laktatoxidase zu Pyruvat oxidiert. Das hierbei entstehende Wasserstoffperoxid reagiert entsprechend der Reaktionsgleichung II mit 487 Methodik Chlorphenol und 4-Aminophenazon unter Einfluss der Peroxidase, Enzym in der Reagenz, unter Bildung eines Chinoniminfarbstoffes. Reaktionsgleichung I Laktat + O2 Laktatoxidase Pyruvat + H2O2 Reaktionsgleichung II H2O2 + 4-Aminophenazon + 4-Chlorphenol POD roter Chinoniminfarbstoff Dabei ist: POD = Peroxidase Die Chinoniminfarbstoffkonzentration wird spektrophotometrisch bei einer Wellenlänge von 520 nm bestimmt. Bei der Auswertung wird das Erythrozytenvolumen der jeweiligen Probe berücksichtigt. Die Methode der Laktatbestimmung mittels des Phonometers und den dazugehörigen Küvetten wurde umfangreichen Felderprobungen unterworfen. Vergleichsmessungen mit herkömmlichen, in der Sportmedizin angewandten Labormethoden korrelierten hochsignifikant (BENEKE et al., 1994). 6.5.2 Messung der Herzfrequenzen Die Registrierung der Herzfrequenz während der Ergometrie erfolgte mit einem Herzfrequenzgerät (Modell MD 5306 Crane Sports von der Firma MEDION, Mühlheim/Ruhr), bei dem von einem Sender (Brustgurt) ein Signal der elektrischen Herzaktion an einen Empfänger (Uhr) gesendet wurde. Die Werte wurden am Ende jeder Belastungsstufe abgelesen und im Untersuchungsprotokoll festgehalten. 6.5.3 Vergleichswerte für die Ausdauerleistungsfähigkeit Die normale Leistungsfähigkeit bei der fahrradergometrischen Belastungsuntersuchung (maximale Ausbelastung) untrainierter, gesunder Probanden im Alter von 20 bis 30 Jahre gibt Rost (1995, S. 278) für Männer mit drei Watt/kg und für Frauen aufgrund des geringeren Muskelanteils mit 2,5 Watt/kg Körpergewicht an. Bei Personen, die älter als 30 Jahre sind, wird wegen des altersbedingten Leistungsabfalls bei Männern 1%, bei Frauen 0,8% pro zusätzliches Lebensjahr abgezogen. 88 Methodik 6.6 Erhebung der psychometrischen Parameter Zur Untersuchung von psychometrischen Veränderungen wurden verschiedene Fragebogenverfahren eingesetzt, die den Patienten ausgehändigt und selbstständig ausgefüllt wurden. 6.6.1 Symptom Checklist SCL90-R Die SCL90-R (nach DEROGATIS in der deutschen Version von FRANKE, 1995) misst als Fragebogenverfahren die subjektiv empfundene Beeinträchtigung durch körperliche und psychische Symptome innerhalb der letzten sieben Tage. Dieser Index der „Klagsamkeit“ lässt sich zwischen der Befindlichkeitsmessung und der Persönlichkeitsmessung einordnen. Der Fragebogen (s. Anhang 7, S. 210) umfasst 90 Items, die jeweils in fünf Abstufungen beantwortet werden sollen. Der jeweilige Ausprägungsgrad entspricht in der Auswertung einem Itemwert von eins bis fünf. Die Items lassen sich den neun Skalen zuordnen (s. Tabelle 6.5). Für jede Skala werden die entsprechenden Itemwerte zu Summenwerten addiert. Die Summenwerte dividiert durch die Items der jeweiligen Skala ergeben die Skalenwerte. Darüber hinaus werden die generelle Symptomatik, die Beschwerdenanzahl und der Stress-Index der Beschwerden als globale Kennwerte berechnet (s. Tabelle 6.6). Tabelle 6.5. Zuordnung der Items zu den Skalen der SCL90-R mit Angabe der Normbereiche (nach FRANKE, 1995). Skala Name Nummern der Items Normbereich 1 Somatisierung 1, 4, 12, 27, 40, 42, 48, 52, 53, 56, 58 0,36 + ,42 2 Zwanghaftigkeit 3, 9, 10, 28, 38, 45, 46, 51, 55, 65 0,39 + ,45 3 Unsicherheit im Sozialkontakt 6, 21, 34, 36, 37, 41, 61, 69, 73 0,29 + ,39 4 Depressivität 5, 14, 15, 20, 22, 26, 29, 30, 31, 32, 54, 71, 79 0,36 + ,44 5 Ängstlichkeit 2, 17, 23, 33, 39, 57, 72, 78, 80, 86 0,30 + ,37 6 Aggressivität u. Feindseligkeit 11, 24, 63, 67, 74, 81 0,30 + ,40 7 Phobische Angst 13, 25, 47, 50, 70, 75, 82 0,13 + ,31 8 Paranoides Denken 8, 18, 43, 68, 76, 83 0,34 + ,44 9 Psychotizismus 7, 16, 35, 62, 77, 84, 85, 87, 88, 90 0,14 + ,25 89 Methodik Tabelle 6.6. Die drei globalen Kennwerte der SCL90-R mit Angabe der Berechnung und Normbereiche (nach FRANKE, 1995). Kürzel Globaler Kennwert GSI PST Berechnung Grundsätzliche psychische Gesamtsummenwert geteilt durch beantwor- Belastung tete Items Anzahl der Symptome mit vor- Anzahl aller Items mit einer Antwort > 0 liegender Belastung PSDI Intensität der Antworten, Normbereich 0,31 + ,31 19,29 + 15,48 Gesamtsummenwert dividiert durch die PST Stress-Index der Beschwerden 1,31 + ,42 Die internen Konsistenzen (Cronbachs Alpha) der einzelnen Skalen liegen bei klinischen Stichproben zwischen α= ,79 und α = ,89. Die Retest-Reliabilität liegt über den Zeitraum von einer Woche für Studierende im guten Bereich. Sie betrug in Abhängigkeit der einzelnen Skalen von r = ,78 (Skala Aggressivität/Feindseligkeit) bis r = ,90 (Skala Phobische Angst). Die Reliabilität des Testprofils kann für die Normstichprobe als befriedigend, für klinische Gruppen als gut bis sehr gut bezeichnet werden. Konfirmatorische Prüfungen stützen die neun Skalen vor allem in klinischen Gruppen. Anhand der Normstichprobe können geschlechts- und bildungsabhängige T-Werte gebildet werden. Die einzelnen Skalenwerte lassen sich ebenso wie die globalen Kennwerte anhand von Referenzwerten für gesunde und klinische Gruppen in die Bereiche unauffällig bis pathologisch einordnen. 6.6.2 Fragebogen zum Gesundheitszustand SF-36 Der SF-36 (nach WARE, SNOW, KOSINSKI und GANDEK in der deutschen Version von BULLINGER & KIRCHBERGER, 1998) ist ein Fragebogen zur Erfassung der gesundheitsbezogenen Lebensqualität bzw. der subjektiven Gesundheit unter Berücksichtigung psychischer, körperlicher und sozialer Aspekte. Die Befragten geben selbst Auskunft über ihr Befinden und ihre Funktionsfähigkeit, indem sie für jedes der Items eine Antwortalternative ankreuzen. Die Antwortkategorien reichen von binären bis hin zu sechsstufigen Antwortskalen. Der Fragebogen (s. Anhang 9, S. 215) umfasst 36 Items in acht unterschiedlichen Skalen (s. Tabelle 6.7). 90 Methodik Tabelle 6.7. Gesundheitskonzepte im SF-36 mit Itemanzahl, dem Mittelwert und der Standardabweichung der gesamtdeutschen Normpopulation im Alter von 31-40 und 41-50 Jahren sowie mit dem Inhalt der acht Skalen (nach BULLINGER & KIRCHBERGER, 1998, S. 12, 107-114). Konzepte Itemanzahl M (SD) Körperliche 10 93,60 (14,69) Ausmaß, in dem der Gesundheitszustand körperliche Aktivitäten wie 88,95 (17,61) Selbstversorgung, Gehen, Treppen steigen, bücken, heben und mittel- Funktionsfähigkeit Normbereich Beschreibung des Inhaltes schwere oder anstrengende Tätigkeiten beeinträchtigt Körperliche 4 Rollenfunktion 90,16 (24,09) Ausmaß, in dem der körperliche Gesundheitszustand die Arbeit oder 87,49 (27,69) andere tägliche Aktivitäten beeinträchtigt, z.B. weniger schaffen als gewöhnlich Körperliche Schmerzen 2 86,84 (21,05) 78,90 (28,05) Arbeit, im und außerhalb des Hauses Allgemeine Gesund- 5 74,23 (15,82) Persönliche Beurteilung der Gesundheit und des aktuellen Gesundheits- 68,00 (18,88) zustandes, Erwartungen und Widerstandsfähigkeit gegenüber Erkrankun- heitswahrnehmung Ausmaß an Schmerzen und Einfluss der Schmerzen auf die normale gen Vitalität Soziale Funktions- 4 2 fähigkeit Emotionale 3 Rollenfunktion Psychisches Wohlbefinden 5 65,66 (15,69) Sich energiegeladen und voller Schwung fühlen versus müde und er- 64,13 (16,47) schöpft 89,54 (17,12) Ausmaß, in dem die körperliche Gesundheit oder emotionale Probleme 89,36 (17,34) normale soziale Aktivitäten beeinträchtigen 91,33 (23,65) Ausmaß, in dem emotionale Probleme die Arbeit oder andere tägliche 91,50 (22,76) Aktivitäten beeinträchtigen 74,31 (15,26) Allgemeine psychische Gesundheit, einschließlich Depression, allgemei- 73,66 (15,55) ne positive Gestimmtheit Die Auswertung beginnt mit einer Umkodierung und Rekalibrierung von 10 Items. Über die Addition der angekreuzten Itembeantwortungen jeweils einer Skala ergeben sich die Rohwerte, die in transformierte Skalenwerte auf einer Skala von 0 bis 100 umgerechnet werden. Höhere Werte entsprechen einem besseren Gesundheitszustand. So bedeutet beispielsweise ein hoher Wert in der Schmerzskala Schmerzfreiheit. Der SF-36 stellt ein ökonomisches, standardisiertes Verfahren zur Erfassung der subjektiven Gesundheit dar. Die Reliabilität und Validität können als sehr gut bewertet werden. Die interne Konsistenz (Cronbachs Alpha) der Subskalen liegt mit zwei Ausnahmen („Soziale Funktionen“ und „Allgemeine Gesundheitswahrnehmung“) über dem α = ,70 Kriterium. Die konvergente Validität wurde durch ausreichend hohe Korrelationen zwischen inhaltlich vergleichbaren Subskalen des SF-36 und dem Nottingham Health Profile (HUNT, MCKENNA & MCEWEN, 1989) festgestellt. Die Zusammenhänge waren dabei in den erkrankten Populationen wie Rückenschmerz-Patienten stärker ausgeprägt als in gesunden Stichproben. Da mit dem SF-36 zwischen Patientenuntergruppen differenziert werden konnte, liegt ebenfalls eine diskriminante Validi91 Methodik tät des Fragebogens vor. Die Sensitivität wurde anhand verschiedener Patientengruppen nachgewiesen. Wird der SF-36 mit dem zeitlichen Bezug auf die vergangene Woche verwendet, besitzt das Verfahren eine gute Änderungssensitivität, wie in Therapiestudien mit unterschiedlichen Erkrankungen gezeigt wurde. Bei einigen Fragen, z.B. nach allgemeinen Tätigkeiten bei der Arbeit oder zu Hause, ergeben sich jedoch Probleme beim Einsatz im stationären Bereich. Diese können reduziert werden mit dem Hinweis an Patienten, sie sollen sich auf den Verhaltensinhalt und nicht auf die Umstände des Verhaltens konzentrieren.Im Manual liegen bevölkerungsbezogene Normwerte getrennt nach Altersgruppe, Geschlecht und verschiedenen Erkrankungsgruppen für die Skalen vor. Darüber hinaus werden die Referenzwerte für die Subskalen stratifiziert nach Altersgruppe und Geschlecht bezogen auf Ost-, West- und Gesamtdeutschland aufgeführt. 6.6.3 Hospital Anxiety and Depression Scale HADS Die HADS-D (nach SNAITH und ZIGMOND in der deutschen Version von HERRMANN, BUSS & SNAITH, 1995) ist ein Selbstbeurteilungsfragebogen zur Erfassung von Angst und Depressivität, der aus 14 Items besteht (s. Anhang 6, S. 209). Bezugszeitraum der Fragen ist die vergangene Woche. Beide Subskalen umfassen jeweils sieben Items in alternierender Abfolge mit vierstufigen itemspezifischen Antwortmöglichkeiten (0-3). Die Items betreffen Leitsymptome im ICD-10 wie Nervosität, Anspannung oder Paniksymptome in der Angstskala und Interessenverlust oder Verminderung des Antriebs in der Depressionsskala. Tabelle 6.8. Einteilung der Angst- bzw. Depressivitätssymptomatik nach Summenwert im HADS-D (nach HERRMANN et al., 1995, S. 11). Summenwert ≤7 Ausprägung der Symptomatik unauffällig 8 – 10 grenzwertig 11 – 14 klinisch auffällig (schwer) 15 - 21 klinisch auffällig (sehr schwer) Die Punktwerte aller Items werden anhand einer Auswertehilfe ermittelt und für jede Subskala zu einem Skalenrohwert addiert. So ergibt sich sowohl für die Depressionsskala HADS-D/D als auch für die Angstskala HADS-D/A ein möglicher Wertebe92 Methodik reich von 0-21. Anhand des Summenwertes kann der Ausprägungsgrad der jeweiligen Symptomatik bestimmt werden (s. Tabelle 6.8). Die Durchführung und Auswertung der HADS-D ist durch die schriftlich vorgegebene Instruktion und die standardisierten Auswerterichtlinien hoch objektiv. Die Reliabilität und die Validität können als gut bezeichnet werden. Die interne Konsistenz (Cronbachs Alpha) liegt für die Angstskala bei α = ,80 und für die Depressionsskala bei α = ,81. Die sequentielle Stabilität ist mit einer Retest-Korrelation für Befragungsintervalle von bis zu zwei Wochen mit r = ,81 (Angstskala) und r = ,89 (Depressionsskala) hoch. Bei einem Befragungsintervall von über sechs Wochen bis hin zu über einem Jahr liegen die Koeffizienten noch bei r = ,70. Die erfragte Symptomatik bezieht sich auf die vergangene Woche, so dass die HADS-D mit ihrer Sensitivität gegenüber mittelfristigen Änderungen auch gut für eine Verlaufsdiagnostik eingesetzt werden kann. Die konvergente Validität wurde im Vergleich zu anderen Messverfahren festgestellt. Dabei lagen die Koeffizienten bezogen auf die psychiatrische Stichprobe höher mit r = ,68 für die Angstskala und r = ,77 für die Depressionsskala. Die mittlere Korrelation mit Fremdrating-Werten liegt bei r = ,65 (Angstskala) und r = ,70 (Depressionsskala). Als Referenzwerte liegen alters- und geschlechtsnormierte Prozentrang- und T-Werte für klinische und gesunde Gruppen vor. 6.6.4 Fragebogen zur Beurteilung der Rehabilitation FBReha Dieser klinikeigene Fragebogen dient zur Erfassung der subjektiven Beurteilung des Behandlungserfolges durch den Patienten. In sechs Fragen sollen gesundheitsbedingte Einschränkungen im Beruf und Alltag und eine mögliche Veränderung durch die Rehabilitation auf einer fünfstufigen Ratingskala von „stark gebessert“ (1) bis zu „stark verschlechtert“ (5) eingeschätzt werden. Die Fragen betreffen die Kontakte zu anderen Menschen sowie körperliche und seelische Probleme und beziehen sich auf den alltäglichen, den beruflichen und den Freizeitbereich (s. Anhang 8, S. 213). 93 Methodik 6.7 Erhebung des Aktivitätsverhaltens mit dem Freiburger Fragebogen zur körperlichen Aktivität FFKA Der Freiburger Fragebogen zur körperlichen Aktivität (FREY & BERG, 1995) dient zur Erfassung der Sport- und Alltagsaktivitäten. Die Kurzform (s. Anhang 4, S. 207) besteht aus acht Fragen, die auch die Dauer und Frequenzen der einzelnen Aktivitäten während eines definierten Zeitraumes (Tag, Woche oder Monat) beinhalten. Die Aktivität bei der Berufsausübung wird erfragt, allerdings nicht in die Aktivitätsberechnung einbezogen. Alle Zeitangaben der sieben Aktivitätsfragen werden auf Minuten pro Woche umgerechnet und anhand einer Auswertungsmatrix (s. Anhang 5, S. 208) in Aktivitätspunkten ausgedrückt. Diese richten sich nach dem energetischen Inhalt der jeweiligen Aktivität, wie sie AINSWORTH et al. (1993; 2000) für über 600 spezifische Aktivitäten aufgeführt haben. Die Angaben bei Frage 6 und 7 beziehen sich auf Trainingsaktivitäten, so genannte „Sportarten im klassischen Sinne, die regelmäßig ausgeführt werden und im wesentlichen der Erhaltung oder der Verbesserung der persönlichen Fitness dienen und Schwimmen“ (FREY, BERG & KEUL, 1996, S. 591f.) und einen relativ hohen Energieumsatz beinhalten. Die errechneten Punkte werden für die Unterkategorie „Sportpunkte“ addiert. Zusammen mit den Punkten der Alltags- und Freizeitaktivitäten ergibt sich die Gesamtpunktzahl. Als grobe Beurteilung nehmen die Autoren eine dreistufige Einteilung vor (s. Tabelle 6.10), die sich auf die Aktivitätsempfehlungen für die Prävention von Herzkreislauferkrankungen bezieht (s. FREY & Berg, 1995). Tabelle 6.10. Beurteilung des Aktivitätsverhaltens nach Punktezahl im Freiburger Fragebogen zur körperlichen Aktivität (nach FREY & BERG, 1995). Punktezahl Beurteilung < 14 Gesamtpunkte Viel zu wenig aktiv 15-29 Gesamtpunkte Mindestanforderung erfüllt ≥ 30 Gesamtpunkte oder ≥ 14 Sportpunkte Ausreichend aktiv Die Anwendung des Fragebogens ist ökonomisch und kann zielgruppenunabhängig erfolgen. In der Auswertungsmatrix sind nur einige herkömmliche Sportarten berücksichtigt, Trendsportarten wie Inlinern werden nicht berücksichtigt. Deshalb wurde bei 94 Methodik der Auswertung anderer Sportarten auf die Liste von AINSWORTH et al. (2000) zurückgegriffen. Problematisch erscheint die berufliche Aktivität, da sie bei der Berechnung der Punktezahl nicht einbezogen wird. Insgesamt erlaubt der Fragebogen eine Abschätzung der körperlichen Aktivität, da zum einen die Intensität der Aktivität wenig abzustufen ist und zum anderen mit einer Über- bzw. Unterschätzung durch den Auszufüllenden gerechnet werden muss. Der Freiburger Fragebogen ist momentan das einzige zumindest teilweise standardisierte Verfahren zur Erfassung der körperlichen Aktivität im deutschsprachigen Raum. 6.8 Intervention Ausdauertraining Als Intervention wurde mit der Experimentalgruppe ein Training der allgemeinen aeroben dynamischen Ausdauer nach dem Prinzip der Dauermethode durchgeführt, wie es aus präventivmedizinischer Sicht empfohlen wird (s. Abschnitt 4.1 und 4.2; DE MARÉES, 2003, 309-319). Mittels der Eingangsuntersuchung auf dem Fahrradergometer (s Abschnitt 6.6) wurde anhand der Auswertung der Laktatleistungskurve für jeden Patienten die individuelle Trainingsherzfrequenz festgelegt. Sie wurde anhand der Schwellenkonzeption nach MADER et al. (1976) mit 70% der Leistung, die der metabolischen Intensität von 4 mmol/l Blutlaktat entsprach, berechnet. Neben dem von MADER et al. (1976) erstmals publizierten Konzept der fixen Schwelle bei 4 mmol/l Laktat existieren noch weitere Schwellenkonzeptionen, von denen allerdings auch keine als allgemeiner Standard anerkannt wird. Allgemein anerkannt wird HECK und ROSSKOPF (1993) zufolge, dass sich individuelle Quantifizierungen einer Belastungsintensität und trainingsbedingte Veränderungen mittels der Laktatdiagnostik gut bestimmen lassen. Die Teilnehmer nahmen vier Wochen an einer Ausdauergruppe teil, die dreimal pro Woche jeweils für eine Stunde von einer Diplomsportlehrerin durchgeführt wurde. Die Teilnehmer erhielten zunächst einen Herzfrequenzmesser und eine Einführung zur Handhabung, um das Training anhand der berechneten Trainingsherzfrequenz möglichst selbständig durchzuführen. Der 10minütigen Vorbereitungsphase mit Dehnungsübungen folgte die Laufeinheit von einer halben Stunde auf einem ebenen Rundkurs in der Umgebung der Klinik. Das Training wurde individuell über den 95 Methodik Herzmesser gesteuert. Alle Teilnehmenden sollten ihre individuelle Trainingsherzfrequenz möglichst konstant durch Walking und/oder leichtes Joggen einhalten. Anschließend wurden erneut Dehnungsübungen ausgeführt. Zur Unterstützung diente ein Manual, das die wichtigsten Informationen für Laufeinsteiger und ein Trainingstagebuch zum Protokollieren der Trainingseinheiten durch die Teilnehmer enthielt. Die Teilnehmer wurden angehalten, das Training in der erlernten Form eigenständig mit Hilfe des Herzfrequenzmessers und des Manuals weiterzuführen. Alle vier Wochen fand zur Überprüfung und Motivationssteigerung ein Telefonkontakt statt, mit dem halbstrukturiert das Trainings- und Aktivitätsverhalten sowie die Medikamenteneinnahme und der Konsum von Zigaretten erfragt wurden. 6.9 Untersuchungsdurchführung Die Untersuchung wurde von der Ethik-Kommission der Landesärztekammer Rheinland-Pfalz und der Ethik-Kommission der Caritas Trägergesellschaft Trier (ctt) begutachtet und mit einem positiven Votum beschieden. Die Datenerhebung wurde in der Zeit von Februar 2002 bis Dezember 2003 in der Psychosomatischen Fachklinik St. Franziska-Stift in Bad Kreuznach vorgenommen. In der ersten Aufenthaltswoche, in der sich die Patienten auf der Aufnahmestation befanden, wurde die Auswahl der möglichen Patienten anhand der Ein- und Ausschlusskriterien durch die leitende Psychologin und die Stationsärztin vorgenommen. Alle ausgewählten Patienten wurden mündlich und schriftlich (s. Anhang 2, S. 204) über die Ziele und den Verlauf der Untersuchung informiert und darum gebeten, an der Studie teilzunehmen. Die Teilnahme an der Studie erfolgte auf freiwilliger Basis, und den Patienten wurde zugesichert, die Untersuchungen jederzeit abbrechen zu können. Alle Patienten, die zur Teilnahme bereit waren, gaben ihre schriftliche Einwilligung (s. Anhang 3, S. 206). Zur Veranschaulichung ist in Abbildung 6.2 der Untersuchungsablauf dargestellt. Den Teilnehmern wurde zunächst das psychophysiologische Labor der Klinik gezeigt und der genaue Ablauf erklärt, um eventuell bestehende Ängste zu reduzieren. Dann wurde die erste Testung (T1) vorgenommen, bestehend aus der psychophysiologischen Erhebung und der anschließenden fahrradergometrischen Belastungsuntersu- 96 Methodik chung. Die Patienten erhielten die Fragebögen und wurden gebeten, diese auszufüllen und abzugeben. Im Anschluss an die erste Untersuchung wurden die Teilnehmer randomisiert nach Zufallslisten getrennt nach Geschlecht und Störungsbild der Experimentalgruppe bzw. der Kontrollgruppe zugeteilt (s. S. 77). KG EG KG Standard- + Aerobes behandlung Training Standard behandlung Standard- + Aerobes behandlung Training 6 Monate Aerobes Training zu Hause Aerobes Training zu Hause T3 Ruheerhebung + Belastungsvorgabe EG T2 Ruheerhebung + Belastungsvorgabe Ruheerhebung +Belastungsvorgabe 4 Wochen Standardbehandlung Labor Fragebogen Ergom. Abhängige Variablen Somatisierung Angst T1 SCL90-R SF-36 HADS FFKA SCL90-R SF-36 HADS FFKA FBReha SCL90-R SF-36 HADS FFKA Abbildung 6.2. Studiendesign: Zeitlicher Ablauf und abhängige Variablen Anmerkungen. BD: Blutdruck, EG: Experimentalgruppe, EKG: Elektrokardiogramm, Ergom.: Ergometrie, Fragebogen: s. Abschnitt 6.6 und 6.7, HF: Herzfrequenz, KG: Kontrollgruppe, T1-3: Messzeitpunkte. Teilnehmer der Experimentalgruppe nahmen zusätzlich zum Standardbehandlungsprogramm der Klinik an der Ausdauergruppe teil, während die Kontrollgruppe nur mit dem Standardprogramm behandelt wurde. Nach vier Wochen erfolgte der zweite Messzeitpunkt (T2) entsprechend der ersten Untersuchung für beide Gruppen. Die Teilnehmer der Experimentalgruppen erhielten ihre Trainingsherzfrequenz anhand der zweiten fahrradergometrischen Belastungsuntersuchung und wurden angehalten, das Training zu Hause weiterzuführen und ihre Einheiten im Manual zu protokollieren. Einmal monatlich wurde ein Telefonkontakt zu ihnen hergestellt. Fünf Monate nach der zweiten Untersuchung wurde telefonisch ein Termin zur Katamnese nach sechs Monaten ausgemacht. Die Patienten kamen in die Klinik zur 97 Methodik dritten Untersuchung (T3) und erhielten dafür die Reisekosten erstattet sowie eine Aufwandsentschädigung. Die Katamnese umfasste die psychophysiologische Erhebung im Labor, die fahrradergometrische Belastungsuntersuchung und die Fragebogenerhebung der psychometrischen Parameter. Im Anschluss an die Untersuchung wurden dem Patienten bei Interesse die Ergebnisse mitgeteilt. 6.10 Untersuchungsauswertung Die Verwaltung und statistische Auswertung der erhobenen Daten erfolgte mit dem Programm STATISTICA in der Version 5.1 für WINDOWSTM. Die graphischen Darstellungen wurden mit dem Programm PLOTIT in der Version 3.2 für WINDOWSTM erstellt. Zunächst wurde eine Extremscorebildung vorgenommen, um zwei Subgruppen zu bilden. Anhand des Medians der Baroreflexsensitivität in der ersten Ruhemessung wurde die Gruppe halbiert. Der Cut-Off-Point lag bei 6,819 ms/mmHg. Somit ergaben sich sowohl für die Experimentalgruppe (EG) als auch für die Kontrollgruppe (KG) jeweils eine Untergruppe mit unauffälliger autonomer Regulation mit einer Baroreflexsensitivität > 6,819 ms/mmHg (EG norm bzw. KG norm) und eine Untergruppe mit autonomer Dysfunktion bei einer Baroreflexsensitivität < 6,819 ms/mmHg (EG dys bzw. KG dys). Zur Überprüfung der Kontrollvariablen und der Intervention wurden unter Berücksichtigung der jeweiligen Voraussetzungen die folgenden Werte berechnet bzw. folgende Prüfverfahren angewendet: • Arithmetisches Mittel (M) • Standardabweichung (SD) • Häufigkeit (n) • Varianzanalysen für die intervallskalierten Variablen mit Tukeys HSDTest als Post hoc-Test • Rang-Varianzanalysen (Median-Test, Kruskal-Wallis-Test) für rangskalierte Variablen • Chi²-Kontingenztafeltest für nominalskalierte Variablen 98 Methodik In der anschließenden statistischen Auswertung wurden das Arithmetische Mittel (M) und die Standardabweichung (SD) berechnet, um zur Überprüfung der Hypothesen die im Folgenden beschriebenen Prüfverfahren anzuwenden. Für Gruppenvergleiche wurde eine zweifaktorielle Varianzanalyse (MANOVA) angewendet, die im Statistikprogramm STATISTICA als Vergleich der Mittelwerte mit Messwiederholungen durchgeführt wird. Die homogene Varianz als Voraussetzung für die Durchführung der Varianzanalyse wird durch das Programm automatisch überprüft. Das Alter wurde jeweils als Kovariable einbezogen (s. 7.1). Wegen fehlender Voraussetzungen bezüglich der Kovarianzmatrix für das Messwiederholungsdesign (compount-symmetry) wurde für die Messwiederholungseffekte der p-Wert, wenn er im signifikanten bis hochsignifikanten Bereich lag, zusätzlich nach Greenhouse/Geisser korrigiert. Für den Fall des Vorliegens von (bereits korrigierten) signifikanten Faktorenunterschieden wurde ein multipler Mittelwertvergleich, das Post-hoc-Verfahren Tukeys HSD-Test, angeschlossen. Darüber hinaus wurde als statistisches Prüfverfahren der gepaarte t-Test als Prüfung des Mittelwertunterschiedes zweier abhängiger Stichproben durchgeführt. Die Normalverteilung beider Stichproben und die Homogenität der Varianzen gelten als Voraussetzung eines t-Tests für abhängige Stichproben. Geprüft wird, ob sich die Mittelwerte der beiden Stichproben signifikant unterscheiden. Für die beiden beschriebenen statistischen Verfahren gelten die folgenden Signifikanzschranken: = nicht signifikant p > ,05 * = signifikant p ≤ ,05 ** = hoch signifikant p ≤ ,01 99 Methodik Für die Haupthypothesen wurde die Effektstärke Cohen’s D aus den Mittelwerten (M), den Stichprobengrößen (n) und den Standardabweichungen (SD) nach der folgenden Formel berechnet: (M2 − M1) Cohen’s D = n1SD1² + n2SD2² n1 + n2 Für die berechneten Effektstärken gilt die folgende Einteilung: = klein < 0,4 + = mittel 0,4 – 0,8 ++ = groß > 0,8. Um den Zusammenhang zwischen sportlicher Aktivität unabhängig von der Gruppenzuteilung und den kardiovaskulären Parametern zu überprüfen, wurde die Größe des Effektes der Aktivitätsänderung auf die Zielgrößen im Rahmen einer with-inRegression bestimmt. In die Regressionsberechnung gingen die Kovariablen Alter und Veränderung der sportlichen Aktivität (Freiburger Fragebogen zur körperlichen Aktivität) vom ersten zum dritten Messzeitpunkt ein. Bedeutsame und signifikante Einflüsse der körperlichen Aktivität auf die Zielgrößen sind entsprechend kenntlich gemacht. Die im Rahmen der Untersuchung erhobenen Daten werden nach den Empfehlungen der DEUTSCHEN FORSCHUNGSGEMEINSCHAFT unter Wahrung des Datenschutzes zur eventuellen Datenkontrolle für zehn Jahre aufbewahrt. 100 Ergebnisse 7 Ergebnisse Zunächst wird die Überprüfung der Vergleichbarkeit der Untersuchungsgruppen und der Wirksamkeit der Untersuchungsintervention dargestellt. Die sich anschließende Darstellung der Untersuchungsergebnisse erfolgt hypothesengeleitet (s. S. 70f.) in tabellarischer Form mit Angabe der Mittelwerte und Standardabweichungen. Wichtige Untersuchungsergebnisse werden darüber hinaus als Säulendiagramm der gemessenen Mittelwerte mit der Standardabweichung als Balken graphisch dargestellt. Das Signifikanzniveau wurde für die vorliegende Arbeit bei 5% festgelegt. Signifikante Zusammenhänge sind in den Tabellen und Graphiken kenntlich gemacht. In die statistischen Analysen wurden die Daten der Patienten einbezogen, die an den Untersuchungen zu den drei Messzeitpunkten teilgenommen haben. Somit ergibt sich eine Gesamtanzahl von 93 Patienten. 7.1 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der Kontrollvariablen Um die Vergleichbarkeit der Untersuchungsgruppen (EG norm/dys und KG norm/dys) bezüglich der erfassten Kontrollvariablen zu überprüfen, wurden für die intervallskalierten Variablen Varianzanalysen, und für die rangskalierten Variablen eine Rang-Varianzanalyse (Median-Test) herangezogen. Zur Überprüfung der Geschlechterverteilung, des Raucherstatus, des Schulabschlusses sowie der Einnahme von Medikamenten wurde der Chi-Quadrat-Kontingenztafeltest eingesetzt. Die jeweiligen Mittelwerte, Standardfehler sowie die durchgeführten Signifikanztests mit den Signifikanzniveaus sind zusammenfassend in Tabelle 7.1 aufgeführt. Die Geschlechterverteilung unterschied sich nicht in den Gruppen, wie mit dem ChiQuadrat-Kontingenztafeltest festgestellt wurde (Chi² (3) = ,429; p = ,934). Die unabhängige Variable Gruppe mit den vier Kategorien ging bei einer Varianzanalyse mit der abhängigen Variable Alter ein. Bei einem signifikanten Gesamteffekt zeigte der Post hoc-Test (Tukeys HSD-Test), dass sich insbesondere KG dys vs. KG norm, KG dys vs. EG norm, KG norm vs. EG dys sowie EG dys vs. EG norm signifikant bis hochsignifikant unterschieden (s. Tabelle 7.2). Zusammenfassend lag ein 101 Ergebnisse Altersunterschied der Gruppen dysfunktional vs. normalreguliert vor, während die Gruppen EG vs. KG keinen Altersunterschied aufwiesen. Tabelle 7.1. Vergleich der Patienten der vier Untersuchungsgruppen hinsichtlich der Kontrollvariablen mit Angabe der Mittelwerte und Standardabweichungen bzw. Häufigkeiten sowie der durchgeführten Signifikanztests und Signifikanzniveaus, n = 139. Variable Geschlecht (n) weibl./männl. Alter in Jahren Größe in cm Gewicht in kg BMI in kg/m² Zigaretten pro Tag Raucherstatus (n) Nicht-/Raucher Körperliche Aktivität im FFKA Sportliche Aktivität Im FFKA Schulabschluss (n) Ohne/Hauptschule Realschule Gymnasium Einnahme von Medikamenten (n) Hormone Analgetika Trizykl. Antidepr. SSRI SNRI Sedativa KG dys 24/6 KG norm 24/7 EG dys 30/10 EG norm 28/10 43,83 ± 9,34 167 ± 7,58 67,21 ±11,22 24,12 ± 3,07 6,63 ±11,47 15/12 39,77 ± 7,97 170 ± 9,01 76,19 ±13,96 26,27 ± 3,97 9,29 ± 9,77 13/18 44,05 ± 8,27 169 ± 7,74 73,16 ±12,32 25,75 ± 4,05 10,10 ±12,69 18/21 37,61 ± 8,45 169 ± 9,57 72,43 ±12,72 25,38 ± 3,49 5,47 ± 9,02 24/12 27,27 ± 20,81 3,28 ± 5,82 19,75 ± 22,21 5,78 ± 15,90 27,80 ± 25,18 6,96 ± 11,40 23,69 ± 24,03 4,97 ± 15,68 14 12 4 23 13 4 17 8 6 16 13 9 Signifikanztest Chi-Quadrat-Kontingenztest, p = ,934 HSD-Test, p = ,003** HSD-Test, p = ,463 HSD-Test, p = ,049* HSD-Test, p = ,135 Rang-Varianzanalyse, p = ,171 Chi-Quadrat-Kontingenztest, p = ,171 Median-Test, p = ,283 Median-Test, p = ,616 Chi-Quadrat-Kontingenztest, p = ,594 Chi-Quadrat-Kontingenztest, 2 3 2 4 1 0 2 0 1 2 3 1 2 4 2 2 4 1 2 4 5 3 2 1 p = ,988 p = ,329 p = ,657 p = ,686 p = ,696 p = ,601 SNRI: Serotonin-Noradrenalin Reuptake Hemmer, SSRI: Selektive Serotonin Reuptake Hemmer, Trizykl. Antidepr.: Trizyklische Antidepressiva. Tabelle 7.2. Wahrscheinlichkeiten (p) im Post hoc-Test (Tukeys HSD-Test) mit der abhängigen Variable Alter und dem Haupteffekt Gruppe, n=139. Gruppe KG dys KG norm EG dys EG norm KG dys p = ,243 p = ,999 p = ,014 * KG norm p = ,243 EG dys p = ,999 p = ,152 p = ,152 p = ,717 EG norm p = ,014 * p = ,717 p = ,005 ** p = ,005 ** Keine signifikanten Gruppenunterschiede lagen hinsichtlich der Körpergröße vor, wie die einfaktorielle Varianzanalyse zeigte (F(3,135) = ,86; p = ,463). 102 Ergebnisse In einer weiteren Varianzanalyse wurden die vier Gruppen bezüglich ihres Gewichtes verglichen. Bei einem gerade noch signifikanten Gesamteffekt (F(3,135) = 1,89; p < ,050) zeigte der Post hoc-Test (Tukeys HSD-Test), dass sich lediglich die beiden Kontrollgruppen signifikant unterschieden (p = ,028), während die Experimentalgruppen untereinander und verglichen mit den Kontrollgruppen keinen Unterschied aufwiesen. Aus dem Körpergewicht und der Körpergröße lässt sich der Body-Mass-Index (BMI) durch das Körpergewicht in Kilogramm pro quadrierte Körperlänge in Zentimetern berechnen. Für den BMI ergaben sich in der Varianzanalyse keine signifikanten Unterschiede zwischen den Gruppen (F(3,135) = 1,89; p = ,135). Der Raucherstatus (Nichtraucher/Raucher) unterschied sich nicht in den Gruppen, wie mit dem Chi-Quadrat-Kontingenztafeltest festgestellt wurde (Chi² (3) = 5,02; p = ,171). Der Zigarettenkonsum wurde in einer Rang-Varianzanalyse mit dem Median-Test überprüft. Es lagen ebenfalls keine Unterschiede in den Gruppen hinsichtlich des Zigarettenkonsums vor (Chi² (3) = 5,02; p = ,171). Das Aktivitätsverhalten wurde sowohl für die gesamte körperliche Aktivität als auch die sportliche Aktivität, erhoben im Freiburger Fragebogen für körperliche Aktivität überprüft. Die Gruppen unterschieden sich zu Beginn der Untersuchung in ihrem Aktivitätsverhalten nicht voneinander (H(3,139) = 3,43; Chi² = 3,81; p = ,283 bzw. H(3,139) = 2,49; Chi² = 1,80; p = ,616). Der Vergleich der Gruppen hinsichtlich der Schulbildung im Sinne des höchsten erreichten Abschlusses wurde mittels des Chi-Quadrat-Kontingenztafeltests aufgestellt. Es ergaben sich für die Haupt- und Realschulabschlüsse keine Unterschiede (Pearson Chi² (6) = 4,61; p = ,594). Die Medikamenteneinnahme wurde mit dem Chi-Quadrat-Kontingenztafeltest überprüft (s. Tabelle 7.3). Die Signifikanzprüfung ist wegen fehlender Voraussetzungen (Zellbesetzung teilweise < 5) nur unter Vorbehalt zu interpretieren. Die Wahrscheinlichkeitswerte sind jedoch so weit vom Signifikanzniveau entfernt, dass von einer 103 Ergebnisse Gleichheit der Medikamenteneinnahme in den Untersuchungsgruppen auszugehen ist. Tabelle 7.3. Ergebnisse des Gruppenvergleichs über die Einnahme von Medikamenten in sechs Kategorien im Chi-Quadrat-Kontingenztafeltest, n=139. Trizykl. Antidepr. Hormone Analgetika SSRI SNRI Sedativa 20,69 ,13 3,44 11,91 6,43 4,57 FG (df) 24 3 3 15 9 6 p-Wert ,657 ,988 ,329 ,686 ,696 ,601 Chi² SNRI: Serotonin-Noradrenalin Reuptake Hemmer, SSRI: Selektive Serotonin Reuptake Hemmer, Trizykl. Antidepr.: Trizyklische Antidepressiva. Zusammenfassend lässt sich feststellen, dass sich die vier Gruppen mit Ausnahme des Alters und des Gewichts nicht unterschieden. Der Gesamteffekt erreichte nur knapp die Signifikanz und betraf lediglich die Kontrollgruppen untereinander. Der BMI umfasst sowohl die Körpergröße als auch das Gewicht und bildet somit die Gegebenheiten einer Person besser ab als lediglich das Gewicht. Da der BMI keinen Unterschied aufwies, wurde dieses Maß bei der Auswertung nicht als Kovariable berücksichtigt. Das Alter unterschied sich deutlich in den einzelnen Gruppen, so dass es bei der Auswertung als Kovariable berücksichtigt wurde. 7.2 Vergleich der Experimental- und Kontrollgruppe hinsichtlich ihres Aktivitätsverhaltens Zum Vergleich der Gruppen hinsichtlich ihres Bewegungsverhaltens wurden KruskalWallis-Tests mit dem Faktor Gruppe (KG, EG) und dem Aktivitätswert im Freiburger Fragebogen zur körperlichen Aktivität (FFKA) als abhängige Variable für die drei Messzeitpunkte durchgeführt. Die Stichprobe umfasst 93 Patienten. 7.2.1 Körperliche Aktivität 104 Ergebnisse Die Mittelwerte und Standardabweichungen des körperlichen Aktivitätswertes sind für die vier Untersuchungsgruppen sowie die Gesamtgruppe in Tabelle 7.4, für die Experimental- und Kontrollgruppe in Tabelle 7.5 und Abbildung 7.1 mit den Ergebnissen der Kruskal-Wallis-ANOVA dargestellt. ** 120 110 Körperliche Aktivität FFKA 100 ** 90 80 70 60 50 40 30 20 10 0 T1 T2 T3 Kontrollgruppe (n = 43) T3 T1 T2 Experimentalgruppe (n = 50) Abbildung 7.1. Mittelwerte und Standardabweichungen der körperlichen Aktivität im FFKA für die Kontroll- und Experimentalgruppe zu den drei Messzeitpunkten. T1: H (1, 93) = ,90; p = ,343; T2: H (1, 93) = 12,42; p < ,001; T3: H (1, 93) = 14,73; p < ,001. Tabelle 7.4. Mittelwerte (M) und Standardabweichungen (SD) des körperlichen Aktivitätswertes im FFKA für die vier Gruppen (KG dys, EG dys, KG norm, EG norm) und die Gesamtgruppe (Gesamt) zu den drei Messzeitpunkten, n = 93. Körperlicher Aktivitätswert im FFKA KG dys EG dys KG norm EG norm Gesamt M ± SD M ±SD M ± SD M ± SD M ± SD T1 24,81 ± 19,44 28,38 ± 25,90 20,11 ± 25,62 25,55 ± 26,13 25,08 ± 24,44 T2 28,28 ± 24,92 47,81 ± 23,29 33,76 ± 32,78 52,34 ± 31,48 41,51 ± 29,18 T3 26,21 ± 52,53 45,11 ± 43,09 22,37 ± 26,45 48,39 ± 81,06 36,69 ± 54,16 105 Ergebnisse Tabelle 7.5. Mittelwerte (M) und Standardabweichungen (SD) des körperlichen Aktivitätswertes im FFKA für die Kontroll- und Experimentalgruppen sowie die Ergebnisse des Kruskal-Wallis-Tests zu den drei Messzeitpunkten, n = 93. Körperlicher Aktivitätswert im FFKA T1 T2 T3 KG (n = 41) EG (n = 52) M ± SD M ± SD 22,40 ± 22,66 31,09 ± 28,98 24,25 ± 40,80 Kruskal-Wallis-Test 27,18 ± 25,78 H (1, 93) = ,90; p = ,343 49,72 ± 26,86 H (1, 93) = 12,42; p < ,001 ** 46,50 ± 61,35 H (1, 93) = 14,7310; p < ,001 ** Zum ersten Messzeitpunkt wurden im Kruskal-Wallis-Test keine signifikanten Unterschiede zwischen der Kontroll- und der Experimentalgruppe hinsichtlich der körperlichen Aktivität im FFKA aufgezeigt (p = ,454). Zum zweiten und dritten Messzeitpunkt wies der berechnete Kruskal-Wallis-Test signifikante Unterschiede zwischen den beiden Gruppen nach. Die Experimentalgruppe wies einen hochsignifikant höheren körperlichen Aktivitätswert als die Kontrollgruppe auf (T2: p < ,001; T3: p < ,001). 7.2.2 Sportliche Aktivität Die Mittelwerte und Standardabweichungen des sportlichen Aktivitätswertes sind für die vier Untersuchungsgruppen in Abbildung 7.2 sowie zusammen mit der Gesamtgruppe in Tabelle 7.6 und für die Experimental- und Kontrollgruppe in Tabelle 7.7 mit den Ergebnissen der Kruskal-Wallis-ANOVA dargestellt. 106 Ergebnisse 120 110 Sportpunkte im FFKA 100 90 80 70 60 50 40 30 20 10 0 T1 T2 T3 T1 T2 T3 KG dys (n=20) EG dys (n=30) T1 T2 T3 T2 T1 T3 KG norm (n=21)EG norm (n=22) Abbildung 7.2. Mittelwerte und Standardabweichungen der Sportpunkte im FFKA für die vier Gruppen (KG dys, EG dys, KG norm, EG norm) zu den drei Messzeitpunkten (T1, T2, T3). Tabelle 7.6. Mittelwerte (M) und Standardabweichungen (SD) des sportlichen Aktivitätswertes im FFKA für die vier Gruppen (KG dys, EG dys, KG norm, EG norm) und die Gesamtgruppe (Gesamt) zu den drei Messzeitpunkten, n = 93. Sportlicher Aktivitätswert im FFKA KG dys EG dys KG norm EG norm Gesamt M ± SD M ±SD M ± SD M ± SD M ± SD T1 2,09 ± 4,53 7,22 ± 12,46 7,50 ± 19,02 7,72 ± 20,15 6,30 ± 15,15 T2 9,08 ± 8,20 23,16 ± 14,66 11,61 ± 14,62 24,22 ± 19,54 17,78 ± 16,12 T3 11,91 ± 45,48 13,45 ± 20,29 4,20 ± 5,37 31,78 ± 79, 42 15,36 ± 45, 82 Zum ersten Messzeitpunkt wurden im Kruskal-Wallis-Test keine signifikanten Unterschiede zwischen der Kontroll- und der Experimentalgruppe hinsichtlich der sportlichen Aktivität im FFKA aufgezeigt (p = ,276). Zum zweiten und dritten Messzeitpunkt wies der berechnete Kruskal-Wallis-Test signifikante Unterschiede zwischen den beiden Gruppen nach. Die Experimentalgruppe wies einen hochsignifikant höheren sportlichen Aktivitätswert als die Kontrollgruppe auf (T2: p = ,000; T3: p = ,003). 107 Ergebnisse Tabelle 7.7. Mittelwerte (M) und Standardabweichungen (SD) des körperlichen Aktivitätswertes im FFKA für die Kontroll- und Experimentalgruppen sowie die Ergebnisse des Kruskal-Wallis-Tests zu den drei Messzeitpunkten, n = 93. Sportlicher Aktivitätswert im FFKA T1 T2 T3 KG (n = 41) EG (n = 49) M ± SD M ± SD 4,86 ± 14,08 10,38 ± 11,85 7,96 ± 31,82 Kruskal-Wallis-Test 7,43 ± 15,99 H (1, 93) = 1,18 p = ,276 23,61 ± 16,73 H (1, 93) = 17,04 p = ,000 ** 21,20 ± 53,99 H (1, 93) = 9,14 p = ,003 ** 7.3 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der Ausdauerleistungsfähigkeit, Überprüfen der Intervention Die Intervention in der vorliegenden Untersuchung umfasste ein Training zur Verbesserung der Ausdauerleistungsfähigkeit. Um die Wirksamkeit der Intervention zu überprüfen, wurden die vier Untersuchungsgruppen hinsichtlich der Ausdauerleistungsfähigkeit verglichen. Als Parameter werden die maximale Leistung sowie die Herzfrequenz und der Laktatwert bei definierten Leistungen dargestellt. Die Stichprobengröße umfasst 90 Patienten, da zum zweiten Messzeitpunkt ein Patient wegen eines grippalen Infektes und ein Patient wegen einer Beinverletzung nicht an der Belastungsuntersuchung teilnehmen konnten. Ein weiterer Patient konnte infolge einer Operation den Belastungstest zum dritten Messzeitpunkt nicht absolvieren. 7.3.1 Maximale Leistungen Zum Vergleich der maximal erbrachten Leistung bei der fahrradergometrischen Belastungsuntersuchung wurde eine dreifaktorielle Varianzanalyse mit den Faktoren Gruppe (EG, KG) und autonomer Regulationsstatus (norm, dys) und mit dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und der maximal erreichten Wattzahl als abhängige Variable durchgeführt. Die Mittelwerte und Standardabweichungen sind in Tabelle 7.8 für die Gesamtgruppe und die vier Untersuchungsgruppen, in Abbildung 7.3 und Tabelle 7.9 für die Experimental- und Kontrollgruppe dargestellt. Signifikante Ergebnisse sind entsprechend gekennzeichnet. Die Ergebnisse der Va- 108 Ergebnisse rianzanalyse sowie der Post hoc-Tests mit dem Haupteffekt Zeit bzw. Gruppe und Zeit befinden sich im Anhang (s. Tabelle A1-3). ** 200 ** ** Maximale Leistung [Watt] 180 ** 160 140 120 100 80 60 40 20 0 T1 T2 T3 Kontrollgruppe (n = 41) T3 T1 T2 Experimentalgruppe (n = 49) Abbildung 7.3. Mittelwerte und Standardabweichungen der maximal erreichten Leistung bei der fahrradergometrischen Belastungsuntersuchung für die Experimental- und Kontrollgruppe zu den drei Messzeitpunkten (T1, T2, T3), F(2,172) = 4,58; p = ,002; n = 90. Tabelle 7.8. Mittelwerte (M) und Standardabweichungen (SD) der maximal erreichten Leistung bei der fahrradergometrischen Belastungsuntersuchung für die vier Gruppen (KG dys, EG dys, KG norm, EG norm) und die Gesamtgruppe (Gesamt) zu den drei Messzeitpunkten (T1, T2, T3), n = 90. Maximal erreichte Leistung [Watt] T1 T2 T3 KG dys EG dys KG norm EG norm Gesamt M ± SD M ± SD M ±SD M ± SD M ± SD 127,68 ± 29,14 123,81 ± 26,78 135,71 ± 42,99 128,33 ± 31,84 138,39 ± 30,79 135,71 ± 26,89 148,81 ± 42,19 137,50 ± 33,57 140,18 ± 24,85 132,14 ± 32,73 153,57 ± 38,15 138,33 ± 31,84 126,25 ± 27,48 126,25 ± 31,91 126,25 ± 27,48 109 Ergebnisse Tabelle 7.9. Mittelwerte (M) und Standardabweichungen (SD) der maximal erreichten Leistung absolut und bezogen aufs Körpergewicht bei der fahrradergometrischen Belastungsuntersuchung für die Experimental- und Kontrollgruppe (EG, KG) zu den drei Messzeitpunkten (T1, T2, T3), n = 90. Maximal erreichte Leistung [Watt] T1 T2 T3 Maximal erreichte Leistung/Körpergewicht [Watt/kg] KG (n = 41) EG (n = 49) KG (n = 41) EG (n = 49) M ± SD M ± SD M ± SD M ± SD 131,12 ± 35,55 1,77 ± ,36 1,79 ± ,43 142,86 ± 36,08 1,86 ± ,40 1,96 ± ,41 145,92 ± 31,84 1,83 ± ,38 2,01 ± ,45 125,00 ± 26,81 131,10 ± 29,46 129,27 ± 30,05 Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der maximalen Leistung zeigte mit der Wahrscheinlichkeit von p = ,000 hochsignifikante Unterschiede für die Gesamtgruppe. Der Post hoc-Test mit dem Haupteffekt Zeit wies eine statistisch hochsignifikante Zunahme vom ersten zum zweiten (p < ,001) und vom ersten zum dritten Messzeitpunkt auf (p < ,001). Die Varianzanalyse für den Vergleich der Experimental- und Kontrollgruppe über die Zeit zeigte mit der Wahrscheinlichkeit von p = ,002 hochsignifikante Unterschiede. Der Post hoc-Test mit dem Haupteffekt Gruppe/Zeit wies die im Folgenden beschriebenen statistischen Signifikanzen auf: Die Experimentalgruppe verzeichnete einen hochsignifikanten Zuwachs der maximalen Leistung vom ersten zum zweiten (p < ,001) und vom ersten zum dritten (p < ,001) Messzeitpunkt, während in der Kontrollgruppe kein signifikanter Unterschied vorlag (p = ,225; p = ,626). Zwischen den Gruppen bestand kein signifikanter Ausgangsunterschied zum ersten Messzeitpunkt (p = ,097). Zum zweiten (p < ,001) und zum dritten (p < ,001) Messzeitpunkt lag die maximale Leistung der Experimentalgruppe hochsignifikant höher als die der Kontrollgruppe. Hinsichtlich des autonomen Regulationsstatus gab es über die Zeit keine signifikanten Unterschiede (p = ,088). Für den Vergleich mit den Referenzwerten, die von ROST (1995, s. dazu Abschnitt 6.5.3) angegeben werden, wurde die maximal erreichte Leistung getrennt nach Geschlecht berechnet. Einer Sollleistung von 159 Watt bei den Frauen (40,85 Jahre; 69,90 kg) und 205 Watt bei den Männern (45,73 Jahre; 81,47 kg) stand eine erbrachte Leistung von durchschnittlich 117,25 Watt (± 22,60) bzw. 163,64 (± 30,60) Watt 110 Ergebnisse gegenüber. Die Leistung bezogen aufs Körpergewicht betrug in der vorliegenden Untersuchung bei den Frauen 1,70 (± ,34) Watt/kg und bei den Männern 2,04 (± ,45) Watt/kg. 7.3.2 Herzfrequenzen bei definierten Leistungsstufen Zum Vergleich der Herzfrequenz bei einer festgelegten Leistung wurde eine dreifaktorielle Varianzanalyse mit den Faktoren Gruppe (EG, KG) und autonomer Regulationsstatus (norm, dys) sowie mit dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und der Herzfrequenz bei einer Leistung von 75, 100 bzw. 125 Watt als abhängige Variable durchgeführt. Die Mittelwerte und Standardabweichungen für die vier Untersuchungsgruppen und die Gesamtgruppe sind in Tabelle 7.10 für die drei Leistungsstufen dargestellt. Die Ergebnisse der Varianzanalyse und des Post hocTests mit dem Haupteffekt Zeit befinden sich im Anhang (s. Tabelle A4-5). Mit zunehmender Leistungsanforderung sank die Anzahl der Patienten, die die Leistungsstufe noch erreichten. Dementsprechend verringerte sich die Stichprobengröße bei 75 Watt auf 88 Patienten, bei 100 Watt auf 84 und bei 125 Watt auf 60 Patienten. Tabelle 7.10. Mittelwerte (M) und Standardabweichungen (SD) der Herzfrequenz bei 75, 100 und 125 Watt während der fahrradergometrischen Belastungsuntersuchung für die vier Gruppen (KG dys, EG dys, KG norm, EG norm) und die Gesamtgruppe (Gesamt) zu den drei Messzeitpunkten, T1: n = 88; T2: n = 84; T3: n = 60. Herzfrequenz bei definierter Leistung [Schläge/Minute] Leistung [Watt] T1 75 T2 T3 T1 100 T2 T3 T1 125 T2 T3 KG dys EG dys KG norm EG norm Gesamt M ± SD M ±SD M ± SD M ± SD M ± SD 129,25 ± 12,21 125,37 ± 14,81 125,52 ± 12,22 123,20 ± 16,87 125,80 ± 14,11 125,70 ± 13,44 123,37 ± 15,07 121,33 ± 13,23 119,45 ± 15,25 122,52 ± 14,26 128,45 ± 16,17 126,85 ± 12,94 125,57 ± 12,60 119,60 ± 15,41 125,26 ±14,36 146,85 ± 13,65 140,92 ± 15,09 139,78 ± 10,01 138,90 ± 23,02 141,61 ± 16,20 142,60 ± 14,48 135,38 ± 13,85 135,22 ± 10,80 133,55 ± 18,49 136,63 ± 14,82 146,40 ± 17,97 140,81 ± 13,99 137,83 ± 14,18 135,75 ± 18,86 140,30 ± 16,46 152,22 ± 19,23 152,86 ± 18,02 154,69 ± 12,10 145,14 ± 18,52 151,45 ± 16,99 147,89 ± 17,07 147,69 ± 14,63 147,69 ± 13,28 138,50 ± 17,68 145,53 ± 15,53 152,22 ± 19,34 153,86 ± 16,88 152,63 ± 14,57 145,14 ± 20,26 151,25 ± 17,43 111 Ergebnisse Die Varianzanalyse wies zwischen den beeinträchtigten und den unbeeinträchtigten Patienten im Mittel einen signifikanten Unterschied der Herzfrequenz bei 75 Watt (Mnorm vs. Mdys: 122,45 vs. 126,50; p = ,017) und einen hochsignifikanten Unterschied bei 100 Watt (Mnorm vs. Mdys: 136,84 vs. 142,16; p = ,004) nach. Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Herzfrequenz bei definierten Leistungen zeigte signifikante bis hochsignifikante Unterschiede für die Gesamtgruppe (75W: p = ,041; 100W: p < ,001; 125W: p = ,001). Der Post hoc-Test wies für die Gesamtgruppe bei der definierten Leistung von 75 Watt eine signifikante (p = ,038), bei 100 (p < ,001) und 125 Watt (p = ,002) eine hochsignifikante Abnahme der Herzfrequenz vom ersten zum zweiten Messzeitpunkt nach. Bei der Leistung von 100 Watt zeigte sich darüber hinaus eine signifikante (p = ,020) und bei 125 Watt eine hochsignifikante (p = ,003) Zunahme der Herzfrequenz vom zweiten zum dritten Messzeitpunkt. Zwischen der Experimental- und Kontrollgruppe lagen keine statistisch signifikanten Unterschiede hinsichtlich der Mittelwerte der Herzfrequenz bei einer Leistung von 75 (p = ,832), 100 (p = ,925) und 125 Watt (p = ,850) im Verlauf der drei Messzeitpunkte vor. 7.3.3 Laktatkonzentrationen bei definierten Leistungsstufen Zum Vergleich der Laktatkonzentration bei einer festgelegten Leistung wurde eine dreifaktorielle Varianzanalyse mit den Faktoren Gruppe (EG, KG) und autonomer Regulationsstatus (norm, dys) sowie mit dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und dem Laktatwert bei einer Leistung von 75, 100 bzw. 125 Watt als abhängige Variable durchgeführt. Die Mittelwerte und Standardabweichungen für die vier Untersuchungsgruppen und die Gesamtgruppe sind in Tabelle 7.11 für die drei Leistungsstufen dargestellt. Die Ergebnisse der Varianzanalyse und die Ergebnisse des Post hoc-Tests mit dem Haupteffekt Zeit befinden sich im Anhang (Tabelle A6-7). Mit zunehmender Leistungsanforderung sank die Anzahl der Patienten, die die Leistungsstufe noch erreichten. Darüber hinaus konnten bei drei Patienten die Laktatwerte der höchsten Stufe nicht festgestellt werden, so dass sich die Stichprobengröße bei 75 Watt auf 87 Patienten, bei 100 Watt auf 81 und bei 125 Watt auf 59 Patienten reduzierte. 112 Ergebnisse Tabelle 7.11. Mittelwerte (M) und Standardabweichungen (SD) des Laktatwertes bei 75, 100 und 125 Watt während der fahrradergometrischen Belastungsuntersuchung für die vier Gruppen (KG dys, EG dys, KG norm, EG norm) und die Gesamtgruppe (Gesamt) zu den drei Messzeitpunkten, T1: n = 87; T2: n = 81; T3: n = 59. Laktatwert bei definierter Leistung [mmol/l] Leistung [Watt] T1 75 T2 T3 T1 100 T2 T3 T1 125 T2 T3 KG dys EG dys KG norm EG norm Gesamt M ± SD M ±SD M ± SD M ± SD M ± SD 2,055 ± ,596 2,004 ± ,485 1,900 ± ,641 1,837 ± ,603 1,954 ±,573 2,035 ± ,567 2,063 ± ,756 1,786 ± ,567 1,658 ± ,462 1,901 ±,626 2,160 ± ,517 2,141 ± ,498 2,024 ± ,698 1,853 ± ,582 2,054 ±,579 3,247 ± 1,105 3,148 ± ,853 2,724 ± ,924 2,910 ± 1,145 3,023 ±1,007 3,153 ± 1,114 2,960 ± ,926 2,653 ± ,687 2,465 ± ,887 2,819 ±,942 3,484 ± ,975 3,036 ± ,881 2,741 ± ,775 2,765 ± ,807 3,012 ±,898 3,867 ± 1,455 4,465 ± 1,219 3,880 ± ,981 3,587 ± 1,222 4,002 ±1,224 3,811 ± 1,367 4,235 ± 1,465 3,760 ± ,986 3,253 ±,890 3,800 ±1,237 4,589 ± 1,477 4,365 ± 1,217 3,940 ± 1,240 3,687 ± 1,082 4,119 ±1,246 Die Varianzanalyse wies zwischen den in der autonomen Regulation beeinträchtigten und den unbeeinträchtigten Patienten im Mittel einen signifikanten Unterschied des Laktatwertes bei 75 Watt (Mnorm vs. Mdys: 1,84 vs. 2,08; p = ,047) und bei 100 Watt (Mnorm vs. Mdys: 2,71 vs. 3,17; p = ,016) nach. Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Laktatwerte bei definierten Leistungen zeigte signifikante bis hochsignifikante Unterschiede für die Gesamtgruppe (75W: p = ,022; 100W: p = ,006; 125W: p = ,006). Der Post hoc-Test wies für die Gesamtgruppe bei der definierten Leistung von 75 und 100 Watt eine signifikante Zunahme (p = ,014; p = ,013) sowie bei 125 Watt eine hochsignifikante Zunahme (p = ,002) vom zweiten zum dritten Messzeitpunkt nach. Bei der Leistung von 100 Watt zeigte sich darüber hinaus eine signifikante Abnahme der Laktatwerte vom ersten zum zweiten Messzeitpunkt (p = ,013). Zwischen der Experimental- und Kontrollgruppe lagen keine statistisch signifikanten Unterschiede hinsichtlich der Mittelwerte der Laktatwerte bei einer Leistung von 75 (p = ,913), 100 (p = ,140) und 125 Watt (p = ,240) im Verlauf der drei Messzeitpunkte vor. 113 Ergebnisse 7.4 Vergleich der Gruppen hinsichtlich der Indices der autonomen kardiovaskulären Regulation Die zentralen Parameter der vorliegenden Untersuchung stellten als Indices der autonomen kardiovaskulären Regulation die Herzratenvariabilität und die Baroreflexsensitivität dar. Die Ergebnisdarstellung bezieht sich auf die 93 Patienten, die bei allen drei Zeitpunkten an der Untersuchung teilgenommen haben. Da die Auswertung hypothesengeleitet erfolgt, gehen in die erste Analyse nur die Patienten mit einer eingeschränkten autonomen Regulation ein. In einer weiteren Analyse soll überprüft werden, ob die in ihrer Regulation unbeeinträchtigten Patienten sich hinsichtlich der kardiovaskulären Parameter unverändert zeigten. Zuletzt werden die Patienten mit einer Angststörung mit den Patienten verglichen, die eine somatoforme Störung aufweisen. 7.4.1 Vergleich der beeinträchtigten Gruppen Zum Vergleich der kardiovaskulären Parameter zwischen den beiden beeinträchtigten Gruppen wurde eine zweifaktorielle Varianzanalyse mit dem Faktor Gruppe (EG dys und KG dys), dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und dem jeweiligen kardiovaskulären Parameter, sowohl unter Ruhebedingungen als auch unter Stressbelastung (BonnDet), als abhängige Variable durchgeführt. Die Stichprobe betrug 50 Patienten. 7.4.1.1 Herzratenvariabilität im gesamten Frequenzspektrum Die Mittelwerte und Standardabweichungen der Gesamtherzratenvariabilität für die beiden beeinträchtigten Gruppen und die Gesamtgruppe dys sind ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beeinträchtigten Gruppen in Tabelle 7.12 dargestellt. Die varianzanalytischen Ergebnisse befinden sich im Anhang (s. Tabelle A8). Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Gesamtherzratenvariabilität zeigte weder unter Ruhebedingungen (p = ,056) noch unter Belastung (p = ,689) signifikante Unterschiede für die Gesamtgruppe dys. 114 Ergebnisse Ebenso zeigte die Varianzanalyse keine statistisch signifikanten Unterschiede zwischen den beiden beeinträchtigten Gruppen hinsichtlich der Gesamtherzratenvariabilität im Verlauf der drei Messzeitpunkte auf (Ruhe: p = ,952; Stress: p = ,613). Tabelle 7.12. Mittelwerte (M) und Standardabweichungen (SD) der Gesamtherzratenvariabilität unter Ruhebedingungen und Stressbelastung für die beeinträchtigten Gruppen (KG dys, n = 20 und EG dys, n = 30) und die Teilgesamtgruppe (Gesamt dys) sowie die Effektstärken zu den drei Messzeitpunkten (T1, T2, T3), n = 50. Gesamtherzratenvariabilität [ ms² ] unter Ruhebedingungen und Belastung Gesamt dys KG dys EG dys M ± SD M ± SD M ± SD T1 1708,43 ± 2264,71 2088,32 ± 3044,49 1455,17 ± 1558,03 0,28 T2 2505,68 ± 3330,11 3004,71 ± 4750,80 2172,99 ± 1914,18 0,25 T3 1726,70 ± 1906,60 2220,01 ± 2511,97 1397,82 ± 1314,62 0,44 + T1 1120,98 ± 1122,81 1292,49 ± 1166,59 1006,64 ± 1097,60 0,25 T2 1234,50 ± 1022,94 1336,15 ± 1119,42 1166,74 ± 967,05 0,16 T3 1288,02 ± 1769,03 1654,16 ± 2158,31 1043,93 ± 1442,79 0,35 Untersuchungsbedingungen/ Messzeitpunkt Ruhebedingungen Stressbelastung (BonnDet) Effektstärke Cohen’s D Bei einer jeweils kleinen Effektstärke nach Cohen wiesen die Gruppen mit einer Ausnahme keine Unterschiede zu den einzelnen Messzeitpunkten auf. Bei einer mittleren Effektstärke von 0,44 nach Cohen unterschieden sich die beiden Gruppen in ihrer Gesamtherzratenvariabilität unter Ruhebedingungen zum dritten Messzeitpunkt. 7.4.1.2 Herzratenvariabilität im High Frequency-Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im High Frequency-Band für die beiden beeinträchtigten Gruppen sind in Abbildung 7.4 mit den varianzanalytischen Ergebnissen für den Haupteffekt Gruppe und Zeit und in Tabelle 7.13 mit den Werten der Gesamtgruppe dys sowie mit den Effektstärken Cohen’s D für den Vergleich zwischen den beeinträchtigten Gruppen dargestellt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten für den Post hoc-Test mit dem Haupteffekt Zeit befinden sich im Anhang (Tabelle A9-10). 115 Ergebnisse HRV im High frequency-Band [ms²] 3500 3000 2500 2000 1500 1000 500 0 T1 T2 T3 Ruhe T1 T1 T2 T3 Belastung T2 T3 Ruhe T1 T2 T3 Belastung EG dys (n=30) KG dys (n=20) Abbildung 7.4. Mittelwerte und Standardabweichungen der Herzratenvariabilität im High frequency Band unter Ruhebedingungen, F(2,96) = ,18; p = ,833 und Belastung, F(2,96) = ,32; p = ,724 für die beeinträchtigte Kontroll- und Experimentalgruppe (KG dys, EG dys) zu den drei Messzeitpunkten (T1, T2, T3). Tabelle 7.13. Mittelwerte (M) und Standardabweichungen (SD) der Herzratenvariabilität im High frequency - Band unter Ruhebedingungen und Stressbelastung für die beeinträchtigten Gruppen (KG dys, n = 20 und EG dys, n = 30) und die Teilgesamtgruppe (Gesamt dys) sowie die Effektstärken zu den drei Messzeitpunkten (T1, T2, T3), n = 50. Herzratenvariabilität im High frequency - Band [ ms² ] unter Ruhe und Belastung Gesamt dys KG dys EG dys M ± SD M ± SD M ± SD T1 648,54 ± 1125,23 788,98 ± 1539,00 554,92 ± 751,59 0,21 T2 1018,74 ± 1501,56 1239,17 ± 1987,64 871,79 ± 1079,53 0,24 T3 646,49 ± 850,38 759,41 ± 911,19 571,20 ± 814,39 0,22 T1 262,47 ± 479,74 315,87 ± 512,97 226,88 ± 461,73 0,18 T2 338,45 ± 448,23 380,86 ± 508,41 310,18 ± 409,76 0,16 T3 397,84 ± 936,86 546,05 ± 1143,10 299,04 ± 775,69 0,26 Untersuchungsbedingungen/ Messzeitpunkt Ruhebedingungen Stressbelastung (BonnDet) 116 Effektstärke Cohen’s D Ergebnisse Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Herzratenvariabilität im High frequency-Band unter Ruhebedingungen zeigte signifikante Unterschiede für die Gesamtgruppe dys (p = ,025). Der Post hoc-Test wies für die Gesamtgruppe dys eine signifikante Zunahme (p = ,034) unter Ruhe vom ersten zum zweiten Messzeitpunkt sowie eine signifikante Abnahme (p = ,030) vom zweiten zum dritten Messzeitpunkt nach. Zwischen den anderen Zeitpunkten und bei den Belastungswerten lagen keine signifikanten Veränderungen vor. Die Varianzanalyse zeigte keine statistisch signifikanten Unterschiede zwischen den beiden beeinträchtigten Gruppen hinsichtlich der Herzratenvariabilität im High frequency-Band im Verlauf der drei Messzeitpunkte auf (Ruhe: p = ,833; Stress: p = ,724). Bei einer jeweils kleinen Effektstärke nach Cohen wiesen die Gruppen keine Unterschiede zu den einzelnen Messzeitpunkten auf. 7.4.1.3 Herzratenvariabilität im Mid Frequency-Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im Mid frequency-Band für die beiden beeinträchtigten Gruppen und die Gesamtgruppe dys sind ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beeinträchtigten Gruppen in Tabelle 7.14 dargestellt. Die varianzanalytischen Ergebnisse befinden sich im Anhang (Tabelle A11). Tabelle 7.14. Mittelwerte (M) und Standardabweichungen (SD) der Herzratenvariabilität im Mid frequency-Band unter Ruhebedingungen und Stressbelastung für die beeinträchtigten Gruppen (KG dys, n = 20 und EG dys, n = 30) und die Teilgesamtgruppe (Gesamt dys) sowie die Effektstärken zu den drei Messzeitpunkten (T1, T2, T3), n = 50. Herzratenvariabilität im Mid frequency–Band [ ms² ] unter Ruhe und Belastung Gesamt dys KG dys EG dys M ± SD M ± SD M ± SD T1 380,67 ± 324,66 423,12 ± 314,46 352,37 ± 333,52 0,22 T2 577,25 ± 788,50 744,11 ± 1168,33 466,01 ± 352,42 0,35 T3 409,45 ± 441,97 547,33 ± 583,65 317,53 ± 291,57 0,53 + T1 266,59 ± 234,48 283,74 ± 179,55 255,16 ± 267,28 0,12 T2 375,72 ± 387,57 422,05 ± 445,31 344,84 ± 348,45 0,20 T3 351,68 ± 482,10 491,74 ± 654,27 258,30 ± 299,50 0,49 + Untersuchungsbedingungen/ Messzeitpunkt Ruhebedingungen Stressbelastung (BonnDet) 117 Effektstärke Cohen’s D Ergebnisse Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Herzratenvariabilität im Mid frequency-Band zeigte weder unter Ruhebedingungen (p = ,072) noch unter Belastung (p = ,173) signifikante Unterschiede für die Gesamtgruppe dys. Ebenso zeigte die Varianzanalyse keine statistisch signifikanten Unterschiede zwischen den beiden beeinträchtigten Gruppen hinsichtlich der Herzratenvariabilität im Mid frequency-Band im Verlauf der drei Messzeitpunkte auf (Ruhe: p = ,549; Stress: p = ,286). Bei einer mittleren Effektstärke nach Cohen von 0,53 unter Ruhe und 0,49 unter Belastung unterschieden sich die beiden Gruppen in ihrer Herzratenvariabilität im Mid frequency-Band zum dritten Messzeitpunkt. Bei einer jeweils kleinen Effektstärke nach Cohen wiesen die Gruppen keine Unterschiede zum ersten oder zweiten Messzeitpunkt auf. 7.4.1.4 Herzratenvariabilität im Respiratorischen Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im Respiratorischen Band für die beiden beeinträchtigten Gruppen und die Gesamtgruppe dys sind ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beeinträchtigten Gruppen in Tabelle 7.15 dargestellt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten für den Post hoc-Test befinden sich im Anhang (Tabelle A12-13). Tabelle 7.15. Mittelwerte (M) und Standardabweichungen (SD) der Herzratenvariabilität im Respiratorischen Band unter Ruhebedingungen und Stressbelastung für die beeinträchtigten Gruppen (KG dys, n = 20 und EG dys, n = 30) und die Teilgesamtgruppe (Gesamt dys) sowie die Effektstärken zu den drei Messzeitpunkten (T1, T2, T3), n = 50. Herzratenvariabilität im Respiratorischen Band [ ms² ] unter Ruhe und Belastung Gesamt dys KG dys EG dys M ± SD M ± SD M ± SD T1 293,58 ± 368,39 328,76 ± 455,33 270,13 ± 303,39 0,16 T2 544,55 ± 824,82 529,41 ± 667,65 554,64 ± 925,85 0,03 T3 334,26 ± 426,83 341,70 ± 1020,72 329,30 ± 488,50 0,02 T1 73,73 ± 110,72 71,28 ± 130,49 77,41 ± 74,85 0,06 T2 125,12 ± 165,99 108,52 ± 138,54 150,02 ± 201,67 0,23 T3 125,13 ± 234,78 115,59 ± 276, 35 139,44 ± 267,35 0,09 Untersuchungsbedingungen/ Messzeitpunkt Ruhebedingungen Stressbelastung (BonnDet) 118 Effektstärke Cohen’s D Ergebnisse Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Herzratenvariabilität im Respiratorischen Band unter Ruhebedingungen zeigte signifikante Unterschiede für die Gesamtgruppe dys (p = ,028). Der Post hoc-Test wies für die Gesamtgruppe dys eine signifikante Zunahme (p = ,017) unter Ruhe vom ersten zum zweiten Messzeitpunkt sowie eine signifikante Abnahme (p = ,049) vom zweiten zum dritten Messzeitpunkt nach. Zwischen den anderen Zeitpunkten und bei den Belastungswerten lagen keine signifikanten Veränderungen vor. Die Varianzanalyse zeigte keine statistisch signifikanten Unterschiede zwischen den beiden beeinträchtigten Gruppen hinsichtlich der Herzratenvariabilität im Respiratorischen Band im Verlauf der drei Messzeitpunkte auf (Ruhe: p = ,893; Stress: p = ,862). Bei einer jeweils kleinen Effektstärke nach Cohen wiesen die Gruppen keine Unterschiede zu den einzelnen Messzeitpunkten auf. 7.4.1.5 Baroreflexsensitivität Die Mittelwerte und Standardabweichungen der Baroreflexsensitivität für die beiden beeinträchtigten Gruppen sind in Abbildung 7.5 mit den varianzanalytischen Ergebnissen für den Haupteffekt Gruppe und Zeit und in Tabelle 7.16 mit den Werten der Gesamtgruppe dys sowie mit den Effektstärken Cohen’s D für den Vergleich zwischen den beeinträchtigten Gruppen dargestellt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten für den Post hoc-Test mit dem Haupteffekt Zeit befinden sich im Anhang (Tabelle A14-15). Tabelle 7.16. Mittelwerte (M) und Standardabweichungen (SD) der Baroreflexsensitivität unter Ruhe und Stress für die beeinträchtigten Gruppen (KG dys: n = 19, EG dys: n = 28/30) und die Teilgesamtgruppe (Gesamt dys) sowie die Effektstärken zu den drei Messzeitpunkten (T1, T2, T3). Baroreflexsensitivität [ms/mmHg] unter Ruhebedingungen und Belastung Gesamt dys KG dys EG dys M ± SD M ± SD M ± SD T1 4,294 ± 1,539 4,468 ± 1,343 4,176 ± 1,673 0,19 T2 6,072 ± 3,887 6,692 ± 5,029 5,650 ± 2,904 0,27 T3 5,588 ± 2,584 6,335 ± 2,622 5,082 ± 2,476 0,49 + T1 3,413 ± 2,176 3,653 ± 2,519 3,260 ± 1,958 0,18 T2 4,244 ± 2,507 4,637 ± 1,665 3,995 ± 2,918 0,26 T3 3,474 ± 2,087 3,674 ± 1,912 3,348 ± 2,219 0,15 Untersuchungsbedingungen/ Messzeitpunkt Ruhebedingungen (n = 47) Stressbelastung (BonnDet) (n = 49) 119 Effektstärke Cohen’s D Ergebnisse 12 Baroreflexsensitivität [ms/mmHg] 11 10 9 8 7 6 5 4 3 2 1 0 T1 T2 T3 Ruhe T1 T2 T3 Belastung KG dys (n=19) KG dys (n=19) T1 T2 T3 Ruhe T1 T2 T3 Belastung EG dys (n=28) EG dys (n=30) Abbildung 7.5. Mittelwerte und Standardabweichungen der Baroreflexsensitivität für die Kontroll- und Experimentalgruppe dys zu den drei Messzeitpunkten (T1, T2, T3) unter Ruhebedingungen (Ruhe), F(2,96) = ,56; p = ,575; n = 47 sowie unter Belastung, F(2,96) = ,09; p = ,911; n = 49. Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Baroreflexsensitivität unter Ruhebedingungen zeigte hochsignifikante Unterschiede für die Gesamtgruppe dys (p = ,001). Der Post hoc-Test wies für die Gesamtgruppe dys eine hochsignifikante Zunahme (p < ,001) unter Ruhe vom ersten zum zweiten Messzeitpunkt sowie eine signifikante Zunahme (p = ,011) vom ersten zum dritten Messzeitpunkt nach. Die Varianzanalyse für die Belastungswerte lag nur knapp über dem Signifikanzniveau (p = ,050). Die Varianzanalyse zeigte keine statistisch signifikanten Unterschiede zwischen den beiden beeinträchtigten Gruppen hinsichtlich der Baroreflexsensitivität im Verlauf der drei Messzeitpunkte auf (Ruhe: p = ,575; Stress: p = ,911). Bei einer jeweils kleinen Effektstärke nach Cohen wiesen die Gruppen keine Unterschiede zu den einzelnen Messzeitpunkten mit einer Ausnahme auf. Bei einer mittleren Effektstärke von 0,49 nach Cohen unterschieden sich die beiden Gruppen in ihrer Baroreflexsensitivität unter Ruhebedingungen zum dritten Messzeitpunkt. 120 Ergebnisse 7.4.2 Veränderungsprüfung der unbeeinträchtigten Gruppen Von den beiden Gruppen mit normaler autonomer kardiovaskulärer Regulation wurde angenommen, dass sich die Parameter der autonomen Regulation nicht verändern. Um diese Hypothese zu überprüfen, wurden gepaarte t-Tests für die Indices der autonomen Regulation zum Messzeitpunkt T1 und T2 bzw. T1 und T3 für jede Gruppe (EG norm bzw. KG norm) gerechnet. Um vorhandene Unterschiede möglichst sensibel zu erfassen, wurde das Signifikanzniveau auf 10% festgelegt. Die Stichprobe umfasst für die KG norm 21, in Ruhe 20 Patienten aufgrund zu vieler Artefakte einer EKG-Aufzeichnung, und für die EG norm 22 Patienten. 7.4.2.1 Herzratenvariabilität im gesamten Frequenzspektrum Die Mittelwerte und Standardabweichungen der Gesamtherzratenvariabilität unter Ruhe und Belastung sind für die beiden unbeeinträchtigten Gruppen (EG norm und KG norm) in Tabelle 7.17 mit den Ergebnissen des gepaarten t-Tests und den entsprechenden Wahrscheinlichkeitswerten dargestellt. Tabelle 7.17. Mittelwerte und Standardabweichungen der Gesamtherzratenvariabilität in der Ruheund Belastungsphase für die unbeeinträchtigten Gruppen (KG norm, EG norm) zu den drei Messzeitpunkten (T1, T2, T3) sowie die Ergebnisse des gepaarten t-Tests zum Vergleich der Messzeitpunkte T1-T2 und T1-T3, n = 43; T3 Ruhe: n = 42. Gesamtherzratenvariabilität [ ms² ] unter Ruhebedingungen und Belastung Untersuchungsbedingungen/ Messzeitpunkt T1 Ruhe T2 T3 T1 Stressbelastung BonnDet T2 T3 KG norm (n=21) M ±SD 4718,61 ± 4472,84 5430, 63 ± 5419,57 4702,11 ± 6662,51 2969,92 ± 3503,79 2856,02 ± 3985,66 3967,60 ± 6684,41 EG norm (n=22) t-Test T1 –T2 t(20) = -1,45 p = ,164 T1 – T3 t(19) = ,02 p = ,986 T1 –T2 t(20) = ,13 p = ,895 T1 – T3 t(20) = -,67 p = ,511 M ± SD 4921,96 ± 5340,51 5269,60 ± 5590,68 5106,15 ± 6736,93 2064,75 ± 1715,36 2238,44 ± 1987,58 2216,42 ± 2219,53 t-Test T1 –T2 t(21) = -,78 p = ,444 T1 – T3 t(21) = -,29 p = ,773 T1 –T2 t(21) = -1,45 p = ,1635 T1 – T3 t(21) = ,02 p = ,986 Die Prüfung der Mittelwertunterschiede der Herzratenvariabilität im gesamten Spektrum vom ersten zum zweiten und zum dritten Messzeitpunkt zeigte für beide Grup- 121 Ergebnisse pen sowohl unter Ruhe als auch unter Belastung keinen statistisch signifikanten Unterschied (Wahrscheinlichkeitswerte s. Tabelle 7.17). 7.4.2.2 Herzratenvariabilität im High Frequency-Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im High Frequency-Band unter Ruhe und Belastung sind für die beiden unbeeinträchtigten Gruppen (EG norm und KG norm) in Tabelle 7.18 mit den Ergebnissen des gepaarten t-Tests und den entsprechenden Wahrscheinlichkeitswerten dargestellt. Tabelle 7.18. Mittelwerte und Standardabweichungen der Herzratenvariabilität im High frequencyBand in der Ruhe- und Belastungsphase für die unbeeinträchtigten Gruppen (KG norm, EG norm) zu den drei Messzeitpunkten (T1, T2, T3) sowie die Ergebnisse des gepaarten t-Tests zum Vergleich der Messzeitpunkte T1-T2 und T1-T3, n = 43; T3 Ruhe: n = 42. Herzratenvariabilität im High frequency-Band [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ Messzeitpunkt T1 Ruhe T2 T3 T1 Stressbelastung BonnDet T2 T3 KG norm (n=21) M ±SD 2420,54 ± 3041,48 2861,82 ± 3535,26 2327,09 ± 3937,69 1218,80 ± 2035,27 1298,60 ± 2952,22 1922,19 ± 4089,14 EG norm (n=22) t-Test M ± SD 2749,20 ± 4650,44 3043,04 ± 4755,71 T1 –T2 t(20) = -1,71 p = ,103 T1 – T3 t(19) = ,22 p = ,832 3150,53 ± 5440,61 707,76 ± 1167,05 860,27 ± 1484,58 T1 –T2 t(20) = -,16 p = ,874 T1 – T3 t(20) = -,82 p = ,420 898,16 ± 1362,87 t-Test T1 –T2 t(21) = -,97 p = ,345 T1 – T3 t(21) = -,90 p = ,381 T1 –T2 t(21) = -1,21 p = ,238 T1 – T3 t(21) = -1,43 p = ,169 Die Prüfung der Mittelwertunterschiede der Herzratenvariabilität im High frequencyBand vom ersten zum zweiten und zum dritten Messzeitpunkt zeigte für beide Gruppen sowohl unter Ruhe als auch unter Belastung keinen statistisch signifikanten Unterschied (Wahrscheinlichkeitswerte s. Tabelle 7.18). 7.4.2.3 Herzratenvariabilität im Mid Frequency-Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im Mid Frequency-Band unter Ruhe und Belastung sind für die beiden unbeeinträchtigten 122 Ergebnisse Gruppen (EG norm und KG norm) in Tabelle 7.19 mit den Ergebnissen des gepaarten t-Tests und den entsprechenden Wahrscheinlichkeitswerten dargestellt. Tabelle 7.19. Mittelwerte und Standardabweichungen der Herzratenvariabilität im Mid FrequencyBand in der Ruhe- und Belastungsphase für die unbeeinträchtigten Gruppen (KG norm, EG norm) zu den drei Messzeitpunkten (T1, T2, T3) sowie die Ergebnisse des gepaarten t-Tests zum Vergleich der Messzeitpunkte T1-T2 und T1-T3, n = 43; T3 Ruhe: n = 42. Herzratenvariabilität im Mid frequency-Band [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ Messzeitpunkt T2 M ±SD 1443,91 ± 1780,74 1534,95 ±2449,56 T3 991,02 ± 970,69 T1 Ruhe Stressbelastung BonnDet KG norm (n=21) T1 T2 T3 604,95 ± 351,06 600,54 ± 481,00 629,97 ± 783,46 EG norm (n=22) t-Test T1 –T2 t(20) = -,26 p = ,796 T1 – T3 t(19) = 1,48 p = ,155 T1 –T2 t(20) = ,04 p = ,966 T1 – T3 t(20) = -,12 p = ,903 M ± SD 1205,48 ± 1151,55 1172,93 ± 910,86 877,95 ± 686,07 568,49 ± 374,51 641,86 ± 466,29 516,91 ± 442,87 t-Test T1 –T2 t(21) = ,21 p = ,837 T1 – T3 t(21) = 1,55 p = ,137 T1 –T2 t(21) = -,95 p = ,353 T1 – T3 t(21) = ,65 p = ,526 Die Prüfung der Mittelwertunterschiede der Herzratenvariabilität im Mid frequencyBand vom ersten zum zweiten und zum dritten Messzeitpunkt zeigte für beide Gruppen sowohl unter Ruhe als auch unter Belastung keinen statistisch signifikanten Unterschied (Wahrscheinlichkeitswerte s. Tabelle 7.19). 7.4.2.4 Herzratenvariabilität im Respiratorischen Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im Respiratorischen Band unter Ruhe und Belastung sind für die beiden unbeeinträchtigten Gruppen (EG norm und KG norm) in Tabelle 7.20 mit den Ergebnissen des gepaarten tTests und den entsprechenden Wahrscheinlichkeitswerten dargestellt. Tabelle 7.20. Mittelwerte und Standardabweichungen der Herzratenvariabilität im Respiratorischen Band in der Ruhe- und Belastungsphase für die unbeeinträchtigten Gruppen (KG norm, EG norm) zu den drei Messzeitpunkten (T1, T2, T3) sowie die Ergebnisse des gepaarten t-Tests zum Vergleich der Messzeitpunkte T1-T2 und T1-T3, n = 43; T3 Ruhe: n = 42. Herzratenvariabilität im Respiratorischen Band [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ KG norm (n=21) EG norm (n=22) 123 Ergebnisse Messzeitpunkt T1 Ruhe T2 T3 T1 Stressbelastung BonnDet T2 T3 M ±SD 1673,71 ± 1979,00 1989,80 ± 2780,21 1322,41 ± 1809,83 538,72 ± 885,68 656,25 ± 1121,72 501,32 ± 845,09 t-Test T1 –T2 t(20) = -,73 p = ,476 T1 – T3 t(19) = 1,59 p = ,128 T1 –T2 t(20) = -,63 p = ,533 T1 – T3 t(20) = ,16 p = ,871 M ± SD 2173,82 ± 3893,44 2129,40 ± 3678,08 2306,60 ± 4310,89 360,58 ± 637,65 488,75 ± 645,32 485,67 ± 645,61 t-Test T1 –T2 t(21) = ,15 p = ,880 T1 – T3 t(21) = -,34 p = ,735 T1 –T2 t(21) = -1,72 p = ,101 T1 – T3 t(21) = -1,51 p = ,147 Die Prüfung der Mittelwertunterschiede der Herzratenvariabilität im Respiratorischen Band vom ersten zum zweiten und zum dritten Messzeitpunkt zeigte für beide Gruppen sowohl unter Ruhe als auch unter Belastung keinen statistisch signifikanten Unterschied (Wahrscheinlichkeitswerte s. Tabelle 7.20). 7.4.2.5 Baroreflexsensitivität Die Mittelwerte und Standardabweichungen der Baroreflexsensitivität unter Ruhe und Belastung sind für die beiden unbeeinträchtigten Gruppen (EG norm und KG norm) in Abbildung 7.6 und in Tabelle 7.21 mit den Ergebnissen des gepaarten t-Tests und den entsprechenden Wahrscheinlichkeitswerten dargestellt. Signifikante Ergebnisse sind entsprechend kenntlich gemacht. 124 Ergebnisse 18 Baroreflexsensitivität [ms/mmHg] * 16 14 12 10 8 6 4 2 0 T1 T2 T3 Ruhe T1 T2 T3 Belastung T1 T2 T3 Ruhe T1 T2 T3 Belastung (n=22) EG norm (n=21) KG norm (n=21) Abbildung 7.6. Mittelwerte und Standardabweichungen der Baroreflexsensitivität unter Ruhe (KG norm,T1-T3: t(19) = 2,74; p = ,013; EG norm, T1-T3: t(21) = ,98; p = ,338) und Belastung (KG norm,T1T3: t(20) = 1,10; p = ,286; EG norm, T1-T3: t(20) = .1,65; p = ,114) zu den drei Zeitpunkten (T1, T2, T3). Tabelle 7.21. Mittelwerte und Standardabweichungen der Baroreflexsensitivität in Ruhe und Belastung für die unbeeinträchtigten Gruppen (KG norm, EG norm), drei Zeitpunkte (T1, T2, T3) sowie die Ergebnisse des gepaarten t-Tests zum Vergleich der Zeitpunkte T1-T2 und T1-T3, n = 43. Baroreflexsensitivität [ms/mmHg] unter Ruhebedingungen und Belastung Untersuchungsbedingungen/ KG norm (n=21) EG norm (n=22) Messzeitpunkt T1 Ruhe T2 T3 T1 Stressbelastung BonnDet T2 T3 M ±SD 11,939 ± 3,982 10,075 ± 4,186 7,967 ± 3,804 6,603 ± 3,893 5,570 ± 3,463 5,406 ± 3,045 t-Test T1 –T2 t(20) = 1,54 p = ,140 T1 – T3 t(19) = 2,74 p = ,013 * T1 –T2 t(20) = 1,25 p = ,227 T1 – T3 t(20) = 1,10 p = ,286 M ± SD 10,341 ± 3,740 9,826 ± 3,843 9,238 ± 5,131 5,829 ± 2,702 6,363 ± 3,606 7,474 ± 4,667 t-Test T1 –T2 t(21) = ,65 p = ,522 T1 – T3 t(21) = ,98 p = ,338 T1 –T2 t(20) = -,43 p = ,673 T1 – T3 t(20) = -1,65 p = ,114 Die Prüfung der Mittelwertunterschiede zeigte für die unbeeinträchtigte Kontrollgruppe vom ersten zum zweiten Messzeitpunkt keine signifikante Änderung (p = ,140), vom ersten zum dritten Messzeitpunkt wurde eine signifikante Abnahme der Baro- 125 Ergebnisse reflexsensitivität unter Ruhebedingungen (p =,013) sichtbar. Die Belastungswerte der Kontrollgruppe zeigten keine signifikanten Unterschiede. In der Experimentalgruppe zeigte sich sowohl unter Ruhe als auch unter Belastung kein statistisch signifikanter Unterschied (Wahrscheinlichkeitswerte s. Tabelle 7.21). 7.4.3 Störungsspezifischer Vergleich in den beeinträchtigten und den unbeeinträchtigten Gruppen hinsichtlich der autonomen Regulation Um zu überprüfen, ob bei Patienten mit einer Angststörung und Patienten mit einer somatoformen Störung wie angenommen ähnliche Bedingungen hinsichtlich der autonomen Regulation vorliegen, wurde eine zweifaktorielle Varianzanalyse mit dem Faktor Störungsbild (Angst-, somatoforme Störung) und einem messwiederholten Zeitfaktor, der Kovariable Alter und den einzelnen Indices der autonomen kardiovaskulären Regulation berechnet. Hierbei wurden bei einem Rechendurchgang nur die Patienten mit beeinträchtigter (n = 50), im zweiten Rechendurchgang nur die Patienten mit unbeeinträchtigter Regulation (n = 43) eingeschlossen. Da die Ruhemessung eines unbeeinträchtigten Patienten mit einer Angststörung (A norm) wegen zu vieler Artefakte nicht ausgewertet werden konnte, beziehen sich die Angaben dieser Gruppe (A norm) bei den Ruhewerten auf 29 Patienten. Das Signifikanzniveau wurde auf 10% festgesetzt, um möglichst sensibel vorhandene Unterschiede aufzuzeigen. 7.4.3.1 Herzratenvariabilität im gesamten Frequenzspektrum Die Mittelwerte und Standardabweichungen der Gesamtherzratenvariabilität unter Ruhe- und Belastungsbedingungen für die vier Gruppen unterteilt nach Störung und Regulationsstatus sind in Tabelle 7.22 für die drei Messzeitpunkte, die varianzanalytischen Ergebnisse in Tabelle 7.23 dargestellt. Tabelle 7.22. Mittelwerte und Standardabweichungen der Gesamtherzratenvariabilität in der Ruheund Belastungsphase für die störungsspezifischen Gruppen (A: Angststörung, S: Somatoforme Störung) nach Regulationsstatus getrennt (dys, norm) zu den drei Messzeitpunkten (T1, T2, T3), Ruhe: n = 92; Belastung: n = 93. 126 Ergebnisse Gesamtherzratenvariabilität [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ Messzeitpunkt Ruhe Stressbelastung BonnDet A dys (n=31) S dys (n=19) A norm (n=29/30) S norm (n=13) M ± SD M ± SD M ± SD M ±SD T1 1527,99 ± 1548,52 2002,82 ± 3133,36 5243,08 ± 5618,44 3892,75 ± 2569,97 T2 2276,40 ± 2089,47 2879,76 ± 4761,69 6183,72 ± 6224,04 3478,14 ± 2315,05 T3 1866,31 ± 2217,30 1498,91 ± 1270,12 5376,41 ± 1385,57 3881,65 ± 4572,13 T1 829,15 ± 515,43 1597,13 ± 1613,43 2409,74 ± 2296,00 2730,83 ± 3677,80 T2 1217,11 ± 906,12 1262,88 ± 1216,04 2951,62 ± 3590,44 1590,27 ± 1084,48 T3 1354,37 ± 2136,02 1179,77 ± 946,00 2933,16 ± 4448,71 3391,23 ± 6152,14 Tabelle 7.23. Ergebnisse der Varianzanalyse für den störungsspezifischen Gruppenvergleich innerhalb der beeinträchtigten bzw. unbeeinträchtigten Gruppe hinsichtlich der Gesamtherzratenvariabilität unter Ruhe (R) und Belastung (B) über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter, Ruhe: n = 92; Belastung: n = 93. Ergebnis der MANOVA: Übersicht der Effekte Gruppe und Gruppe Zeit dys norm Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe (R) Gruppe Zeit(R) 1 2 47 96 ,11 1,10 ,741 ,337 Gruppe (B) Gruppe Zeit(B) 1 2 47 96 ,89 2,33 ,351 ,103 Gruppe (R) Gruppe Zeit(R) 1 2 39 80 ,26 1,01 ,613 ,369 Gruppe (B) Gruppe Zeit(B) 1 2 40 82 ,01 1,24 ,905 ,296 Die berechnete Varianzanalyse für den störungsspezifischen Gruppenvergleich hat weder für den Haupteffekt Gruppe noch für den Haupteffekt Gruppe und Zeit signifikante Unterschiede hinsichtlich der Gesamtherzratenvariabilität unter Ruhe oder Belastung innerhalb der beeinträchtigten oder unbeeinträchtigen Gruppen gezeigt (pWerte s. Tabelle 7.23). 7.4.3.2 Herzratenvariabilität im High frequency-Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im High frequency-Band unter Ruhe- und Belastungsbedingungen für die vier Gruppen unterteilt 127 Ergebnisse nach Störung und Regulationsstatus sind in Tabelle 7.24 für die drei Messzeitpunkte dargestellt, die varianzanalytischen Ergebnisse in Tabelle 7.25. Tabelle 7.24. Mittelwerte und Standardabweichungen der Herzratenvariabilität im High frequencyBand in der Ruhe- und Belastungsphase für die störungsspezifischen Gruppen (A: Angststörung, S: Somatoforme Störung) nach Regulationsstatus getrennt (dys, norm) zu den drei Messzeitpunkten (T1, T2, T3), Ruhe: n = 92; Belastung: n = 93. Herzratenvariabilität im High frequency-Band [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ A dys (n=31) S dys (n=19) A norm (n=29/30) S norm (n=13) Messzeitpunkt Ruhe Stressbelastung BonnDet M ± SD M ± SD M ± SD M ±SD T1 547,82 ± 729,21 812,87 ± 1585,72 3042,60 ± 4543,63 1589,04 ± 1684,23 T2 907,97 ± 1144,72 1199,47 ± 1974,37 3596,26 ± 4816,10 1530,14 ± 1443,00 T3 698,44 ± 1004,74 561,73 ± 523,29 3149,39 ± 5214,27 1886,22 ± 3508,42 T1 140,81 ± 118,09 460,98 ± 732,26 956,38 ± 1548,53 959,55 ± 1930,32 T2 302,56 ± 389,03 396,99 ± 537,21 1379,33 ± 2705,59 370,52 ± 308,68 T3 471,54 ± 1169,44 277,60 ± 292,25 1312,73 ± 2777,45 1595,65 ± 3654,38 Tabelle 7.25. Ergebnisse der Varianzanalyse für den störungsspezifischen Gruppenvergleich innerhalb der beeinträchtigten bzw. unbeeinträchtigten Gruppe hinsichtlich der Herzratenvariabilität im High frequency-Band unter Ruhe (R) und Belastung (B) über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter, Ruhe: n = 92; Belastung: n = 93. Ergebnis der MANOVA: Übersicht der Effekte Gruppe und Gruppe Zeit dys norm Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe (R) Gruppe Zeit(R) 1 2 47 96 ,20 1,22 ,654 ,300 Gruppe (B) Gruppe Zeit(B) 1 2 47 96 ,41 2,34 ,524 ,102 Gruppe (R) Gruppe Zeit(R) 1 2 39 80 ,30 ,99 ,589 ,375 Gruppe (B) Gruppe Zeit(B) 1 2 40 82 ,07 1,67 ,789 ,195 Die berechnete Varianzanalyse für den störungsspezifischen Gruppenvergleich hat weder für den Haupteffekt Gruppe noch für den Haupteffekt Gruppe und Zeit signifikante Unterschiede hinsichtlich der Herzratenvariabilität im High frequency-Band unter Ruhe oder Belastung innerhalb der beeinträchtigten oder unbeeinträchtigen Gruppen gezeigt (p-Werte s. Tabelle 7.25). 128 Ergebnisse 7.4.3.3 Herzratenvariabilität im Mid frequency-Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im Mid frequency-Band unter Ruhe- und Belastungsbedingungen für die vier Gruppen unterteilt nach Störung und Regulationsstatus sind in Tabelle 7.26 für die drei Messzeitpunkte dargestellt, die varianzanalytischen Ergebnisse in Tabelle 7.27. Tabelle 7.26. Mittelwerte und Standardabweichungen der Herzratenvariabilität im Mid frequency-Band in der Ruhe- und Belastungsphase für die störungsspezifischen Gruppen (A: Angststörung, S: Somatoforme Störung) nach Regulationsstatus getrennt (dys, norm) zu den drei Messzeitpunkten (T1, T2, T3), Ruhe: n = 92; Belastung: n = 93. Herzratenvariabilität im Mid frequency-Band [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ A dys (n=31) S dys (n=19) A norm (n=29/30) S norm (n=13) Messzeitpunkt Ruhe Stressbelastung BonnDet M ± SD M ± SD M ± SD M ±SD T1 386,99 ± 333,10 370,34 ± 319,10 1307,77 ± 1446,53 1344,12 ± 1583,58 T2 510,59 ± 397,65 686,00 ± 1186,93 1469,49 ± 2084,27 1068,32 ± 900,02 T3 447,26 ± 490,33 347,75 ± 352,92 895,75 ± 782,94 1012,21 ± 941,42 T1 227,16 ± 172,01 330,92 ± 305,46 576,36 ± 361,93 609,23 ± 366,95 T2 370,34 ± 333,17 384,51 ± 473,05 681,64 ± 443,68 483,31 ± 512,01 T3 371,81 ± 552,68 318,84 ± 348,96 528,76 ± 439,41 672,19 ± 946,33 Die berechnete Varianzanalyse für den störungsspezifischen Gruppenvergleich hat weder für den Haupteffekt Gruppe noch für den Haupteffekt Gruppe und Zeit signifikante Unterschiede hinsichtlich der Herzratenvariabilität im Mid frequency-Band unter Ruhe oder Belastung innerhalb der beeinträchtigten oder unbeeinträchtigen Gruppen gezeigt (p-Werte s. Tabelle 7.27). Tabelle 7.27. Ergebnisse der Varianzanalyse für den störungsspezifischen Gruppenvergleich innerhalb der beeinträchtigten bzw. unbeeinträchtigten Gruppe hinsichtlich der Herzratenvariabilität im Mid frequency-Band unter Ruhe (R) und Belastung (B) über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter, Ruhe: n = 92; Belastung: n = 93. Ergebnis der MANOVA: Übersicht der Effekte Gruppe und Gruppe Zeit 129 Ergebnisse dys norm Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe (R) Gruppe Zeit(R) 1 2 47 96 ,02 1,01 ,887 ,368 Gruppe (B) Gruppe Zeit(B) 1 2 47 96 ,40 ,66 ,533 ,517 Gruppe (R) Gruppe Zeit(R) 1 2 39 80 ,00 ,85 ,945 ,430 Gruppe (B) Gruppe Zeit(B) 1 2 40 82 ,24 1,41 ,630 ,249 7.4.3.4 Herzratenvariabilität im Respiratorischen Band Die Mittelwerte und Standardabweichungen der Herzratenvariabilität im Respiratorischen Band unter Ruhe- und Belastungsbedingungen für die vier Gruppen unterteilt nach Störung und Regulationsstatus sind in Tabelle 7.28 für die drei Messzeitpunkte dargestellt, die varianzanalytischen Ergebnisse in Tabelle 7.29. Tabelle 7.28. Mittelwerte und Standardabweichungen der Herzratenvariabilität im Respiratorischen Band in der Ruhe- und Belastungsphase für die störungsspezifischen Gruppen (A: Angststörung, S: Somatoforme Störung) nach Regulationsstatus getrennt (dys, norm) zu den drei Messzeitpunkten (T1, T2, T3), Ruhe: n = 92; Belastung: n = 93. Herzratenvariabilität im Respiratorischen Band [ ms² ] unter Ruhe und Belastung Untersuchungsbedingungen/ Messzeitpunkt Ruhe Stressbelastung BonnDet A dys (n=31) S dys (n=19) A norm (n=29/30) S norm (n=13) M ± SD M ± SD M ± SD M ±SD T1 386,99 ± 333,10 370,34 ± 319,10 2156,67 ± 3534,14 1442,68 ± 1849,98 T2 510,59 ± 397,65 686,00 ± 1186,93 2592,93 ± 3764,51 880,59 ± 818,34 T3 447,26 ± 490,33 347,75 ± 352,92 2009,19 ± 3629,72 1455,91 ± 2753,74 T1 53,20 ± 58,86 107,23 ± 160,27 438,82 ± 760,23 467,79 ± 806,23 T2 119,14 ± 171,28 134,87 ± 161,07 648,29 ± 1024,20 391,16 ± 515,69 T3 138,69 ± 287,76 103,01 ± 105,84 467,15 ± 727,64 553,68 ± 796,70 Tabelle 7.29. Ergebnisse der Varianzanalyse für den störungsspezifischen Gruppenvergleich innerhalb der beeinträchtigten bzw. unbeeinträchtigten Gruppe hinsichtlich der Herzratenvariabilität im Respiratorischen Band unter Ruhe (R) und Belastung (B) über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter, Ruhe: n = 92; Belastung: n = 93. Ergebnis der MANOVA: Übersicht der Effekte Gruppe und Gruppe Zeit 130 Ergebnisse dys norm Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe (R) Gruppe Zeit(R) 1 2 47 96 ,02 1,01 ,887 ,368 Gruppe (B) Gruppe Zeit(B) 1 2 47 96 ,46 ,96 ,499 ,386 Gruppe (R) Gruppe Zeit(R) 1 2 39 80 ,04 2,42 ,846 ,096 Gruppe (B) Gruppe Zeit(B) 1 2 40 82 ,03 1,16 ,858 ,318 Die berechnete Varianzanalyse für den störungsspezifischen Gruppenvergleich hat weder für den Haupteffekt Gruppe noch für den Haupteffekt Gruppe und Zeit signifikante Unterschiede hinsichtlich der Herzratenvariabilität im Respiratorischen Band unter Ruhe oder Belastung innerhalb der beeinträchtigten oder unbeeinträchtigen Gruppen gezeigt (p-Werte s. Tabelle 7.29). 7.4.3.5 Baroreflexsensitivität Die Mittelwerte und Standardabweichungen der Baroreflexsensitivität unter Ruheund Belastungsbedingungen für die vier Gruppen unterteilt nach Störung und Regulationsstatus sind in Tabelle 7.30 für die drei Messzeitpunkte dargestellt, die varianzanalytischen Ergebnisse zeigt Tabelle 7.31. Wegen fehlender Werte weichen die Angaben von der angegebenen Stichprobengröße ab (A dys, Ruhemessung, n = 29; A norm, Belastungsmessung, n = 28). Die berechnete Varianzanalyse für den störungsspezifischen Gruppenvergleich hat weder für den Haupteffekt Gruppe noch für den Haupteffekt Gruppe und Zeit signifikante Unterschiede hinsichtlich der Baroreflexsensitivität unter Ruhe oder Belastung innerhalb der beeinträchtigten oder unbeeinträchtigen Gruppen gezeigt (p-Werte s. Tabelle 7.31). Tabelle 7.30. Mittelwerte und Standardabweichungen der Baroreflexsensitivität in Ruhe und Belastung für die störungsspezifischen Gruppen (A: Angst-, S: Somatoforme Störung) nach Regulationsstatus getrennt (dys, norm) zu den drei Messzeitpunkten (T1, T2, T3), Ruhe: n = 88; Belastung: n = 91. Baroreflexsensitivität [ms/mmHg] unter Ruhe und Belastung Untersuchungsbedingungen/ A dys (n=29/31) S dys (n=18) 131 A norm (n=29/28) S norm (n=13) Ergebnisse Messzeitpunkt Ruhe Stressbelastung BonnDet M ± SD M ± SD M ± SD M ±SD T1 4,496 ± 1,489 3,970 ± 1,606 11,23 ± 4,078 10,818 ± 3,589 T2 6,718 ± 4,619 5,031 ± 1,973 10,455 ± 3,985 8,805 ± 3,816 T3 6,005 ± 2,999 4,917 ± 1,574 8,902 ± 4,544 8,030 ± 4,654 T1 3,298 ± 2,227 3,610 ± 2,133 6,516 ± 3,633 5,600 ± 2,648 T2 4,396 ± 2,522 3,982 ± 2,530 6,292 ± 3,827 5,237 ± 2,707 T3 3,387 ± 1,885 3,625 ± 2,448 6,368 ± 3,782 6,515 ± 4,626 Tabelle 7.31. Ergebnisse der Varianzanalyse für den störungsspezifischen Gruppenvergleich innerhalb der beeinträchtigten bzw. unbeeinträchtigten Gruppe hinsichtlich der Baroreflexsensitivität unter Ruhe (R) und Belastung (B) über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter, Ruhe: n = 88; Belastung: n = 91. Ergebnis der MANOVA: Übersicht der Effekte Gruppe und Gruppe Zeit dys norm Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe (R) Gruppe Zeit(R) 1 2 44 90 2,75 ,73 ,104 ,487 Gruppe (B) Gruppe Zeit(B) 1 2 46 94 ,26 ,53 ,610 ,590 Gruppe (R) Gruppe Zeit(R) 1 2 39 80 ,05 ,28 ,832 ,758 Gruppe (B) Gruppe Zeit(B) 1 2 38 78 ,01 ,39 ,930 ,675 7.5 Vergleich der Experimental- und Kontrollgruppe hinsichtlich des subjektiv eingeschätzten Rehabilitationserfolges Für den Gruppenvergleich im Fragebogen zur Beurteilung der Rehabilitation FBReha wurde der Median-Test verwendet. In die Auswertung wurden nur die Patienten einbezogen, bei denen die erfragten Probleme zu Beginn der Rehabilitation bestanden. Daraus ergibt sich eine verringerte Stichprobengröße. Die Mittelwerte und Standardabweichungen der Itemwerte sind in Tabelle 7.32 dargestellt. Die Ergebnisse des Median-Tests zum Gruppenvergleich befinden sich im Anhang (Tabelle A16). Tabelle 7.32. Mittelwerte (M) und Standardabweichungen (SD) der Itemwerte im Fragebogen zum Rehabilitationserfolg FBReha zum zweiten Messzeitpunkt für die Experimental- und Kontrollgruppe (EG, KG) und die gesamte Gruppe (Gesamt). 132 Ergebnisse Itemwerte im FBReha Gesamt Item KG EG M ± SD n M ± SD n M ± SD n 1). Kontakte zu Menschen 1,989 ± ,742 50 2,038 ± ,774 26 1,917 ± ,717 24 2). Körperliche Probleme 2,048 ± ,771 63 2,033 ± ,719 30 2,061 ± ,827 33 3). Seelische Probleme 1,942 ± ,705 69 2,067 ± ,740 30 1,846 ± ,670 39 4). Alltäglicher Bereich 2,081 ± ,795 62 2,103 ± ,724 24 2,061 ± ,864 33 5). Beruflicher Bereich 2,228 ± ,846 57 2,360 ± ,757 25 2,125 ± ,907 32 6). Freizeitbereich 2,095 ± ,756 63 2,200 ± ,714 30 2,000 ± ,791 33 Der Gruppenvergleich mit dem Median-Test hinsichtlich der Itemwerte des Fragebogens zum Rehabilitationserfolg zeigte keine statistisch signifikanten Unterschiede zwischen den Gruppen beim zweiten Messzeitpunkt bezüglich des subjektiv eingeschätzten Rehabilitationserfolges. 7.6 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der psychometrischen Parameter Der Gruppenvergleich wurde für die ersten drei Fragebögen mit einer Varianzanalyse der Rohwerte berechnet, da bei diesen von einer Normalverteilung ausgegangen werden kann. Da die Fragebögen aller Patienten entsprechend ausgewertet werden konnten, umfasst die Stichprobengröße bei allen Darstellungen 93 Patienten. 7.6.1 Symptom Checklist SCL90-R Die Auswertung der SCL90-R erfolgt in neun Skalen und in drei globalen Kennwerten. Zum Vergleich zwischen der Experimental- und Kontrollgruppe wurde eine Varianzanalyse mit dem Faktor Gruppe (EG, KG), dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und dem Skalenwert der jeweiligen Skala bzw. den globalen Kennwerten als abhängige Variable durchgeführt. 7.6.1.1 Die neun Skalen Die Mittelwerte und Standardabweichungen für die Gesamtgruppe sowie der Experimental- und Kontrollgruppe finden sich in Tabelle 7.33 für alle Skalen. Beispielhaft werden in Abbildung 7.7 die Werte für die Skala Somatisierung dargestellt. Die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) sind in Tabelle 7.33 aufgeführt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten im Post hoc-Test befinden sich im Anhang (Tabelle A17-18). 133 Ergebnisse Skalenwert Somatisierung, SCL90-R 2.2 2.0 1.8 1.6 1.4 * 1.2 1.0 0.8 0.6 0.4 0.2 0.0 T1-3 T1-3 KG EG T1 T2 T1 T3 KG (n=41) T2 T3 EG (n=52) Abbildung 7.7. Mittelwerte und Standardabweichungen der Skala Somatisierung der SCL90-R für die Experimental- und Kontrollgruppe (EG, KG) zu den drei Messzeitpunkten (T1, T2, T3), F(2,182) = ,22; p = ,806 sowie die Mittelwerte insgesamt für die beiden Gruppen (T1-3), F(1,90) = 6,04; p = ,016. Die berechnete Varianzanalyse wies einen signifikanten Unterschied (p = ,016) zwischen der Experimentalgruppe und der Kontrollgruppe im Mittel hinsichtlich der Skala Somatisierung nach (MEG vs. MKG: 0,81 vs. 1,11). Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der Skalenwerte in der SCL90-R zeigte mit p-Werten von p < ,001 hochsignifikante Unterschiede für die Gesamtgruppe. Der Post-hoc-Test wies eine statistisch hochsignifikante Abnahme der Skalenwerte zwischen dem ersten und dem zweiten sowie dem ersten und dem dritten Messzeitpunkt für alle Werte auf (p = ,003). Zwischen dem zweiten und dritten Messzeitpunkt gab es keine signifikanten Unterschiede. Tabelle 7.33. Mittelwerte (M) und Standardabweichungen (SD) der Skalenwerte der neun Skalen der SCL90-R für die Gesamtgruppe (Gesamt) und die Experimental- und Kontrollgruppe (EG, KG) sowie die Effektstärke Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 93. Skalenwerte der Skalen in der SCL90-R Gesamt (n=93) EG (n=52) KG (n=41) Effektstärke M ± SD M ± SD M ± SD Cohen’s D T1 1,190 ± ,735 1,078 ± ,678 1,332 ± ,787 0,35 T2 ,823 ± ,693 ,675 ± ,578 1,010 ± ,784 0,50 + Skala 1 134 Ergebnisse Somatisierung 2 Zwanghaftigkeit 3 Unsicherheit im Sozialkontakt 4 Depressivität 5 Ängstlichkeit 6 Aggressivität und Feindseligkeit 7 Phobische Angst 8 Paranoides Denken 9 Psychotizismus T3 ,816 ± ,675 ,673 ± ,632 ,998 ± ,691 0,49 + T1 1,316 ± ,856 1,250 ± ,816 1,400 ± ,907 0,17 T2 ,814 ± ,705 ,733 ± ,658 ,917 ± ,756 0,26 T3 ,867 ± ,794 ,727 ± ,712 1,044 ± ,864 0,41 + T1 1,169 ± ,932 1,117 ± ,926 1,235 ± ,948 0,13 T2 ,720 ± ,668 ,633 ± ,582 ,831 ± ,757 0,30 T3 ,748 ± ,778 ,598 ± ,652 ,937 ± ,886 0,44 + T1 1,367 ± ,880 1,323 ± ,811 1,422 ± ,969 0,11 T2 ,788 ± ,705 ,704 ± ,576 ,895 ± ,836 0,27 T3 ,896 ± ,829 ,782 ± ,745 1,041 ± ,913 0,31 T1 1,184 ± ,739 1,106 ± ,695 1,283 ± ,790 0,24 T2 ,729 ± ,690 ,613 ± ,622 ,876 ± ,750 0,39 T3 ,743 ± ,691 ,621 ± ,613 ,898 ± ,758 0,41 + T1 ,765 ± ,610 ,762 ± ,670 ,769 ± ,533 0,01 T2 ,467 ± ,531 ,431 ± ,510 ,513 ± ,559 0,15 T3 ,568 ± ,616 ,525 ± ,636 ,622 ± ,591 0,16 T1 ,796 ± ,841 ,728 ± ,841 ,881 ± ,854 0,18 T2 ,445 ± ,606 ,403 ± ,553 ,498 ± ,670 0,16 T3 ,464 ± ,669 ,333 ± ,529 ,630 ± ,788 0,45 + T1 1,004 ± ,867 ,981 ± ,873 1,033 ± ,869 0,06 T2 ,649 ± ,750 ,601 ± ,750 ,710 ± ,755 0,14 T3 ,694 ± ,782 ,588 ± ,711 ,829 ± ,854 0,31 T1 ,668 ± ,598 ,671 ± ,606 ,663 ± ,596 0,01 T2 ,399 ± ,514 ,362 ± ,526 ,446 ± ,501 0,16 T3 ,519 ± ,572 ,373 ± ,597 ,478 ± ,541 0,18 Im Gruppenvergleich lagen keine statistisch signifikanten Unterschiede zwischen den Gruppen hinsichtlich der Skalenwerte der SCL90-R im Verlauf der drei Messzeitpunkte vor. Bei einer mittleren Effektstärke von 0,49 (Skala 1), 0,41 (2), 0,44 (3), 0,41 (5) und 0,45 (7) nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe zum dritten Messzeitpunkt voneinander. Bei einer jeweils kleinen Effektstärke nach Cohen wiesen die Gruppen keine Unterschiede zum ersten und zweiten Messzeitpunkt mit einer Ausnahme auf. Mit einer mittleren Effektstärke von 0,50 bestand ein Gruppenunterschied in Skala 1 auch zum zweiten Messzeitpunkt. 7.6.1.2 Die globalen Kennwerte 135 Ergebnisse Die Mittelwerte und Standardabweichungen für die Gesamtgruppe sowie der Experimental- und Kontrollgruppe sind in Tabelle 7.34 für die drei globalen Kennwerte und beispielhaft in Abbildung 7.8 für die Grundsätzliche psychische Belastung dargestellt. Die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) sind in Tabelle 7.34 aufgeführt. Die varianzanalytischen Ergebnisse und die Grundsätzl. psychische Belastung SCL90-R Wahrscheinlichkeiten im Post hoc-Test befinden sich im Anhang (s. Tabelle A19-20). 2.0 1.8 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 T1 T3 T2 T3 T1 T2 Experimentalgruppe (n = 52) Kontrollgruppe (n = 41) Abbildung 7.8. Mittelwerte und Standardabweichungen des globalen Kennwertes Grundsätzliche psychische Belastung (GSI) der SCL90-R für die Experimental- und Kontrollgruppe (EG, KG) zu den drei Messzeitpunkten (T1, T2, T3), F(2,182) = ,85; p = ,428; n = 93. Tabelle 7.34. Mittelwerte (M) und Standardabweichungen (SD) der Skalenwerte der globalen Kennwerte in der SCL90-R für die Gesamtgruppe (Gesamt) und die Experimental- und Kontrollgruppe (EG, KG) sowie die Effektstärke Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 93. Skalenwerte der globalen Kennwerte in der SCL90-R T1 Gesamt (n=93) EG (n=52) KG (n=41) Effektstärke M ± SD M ± SD M ± SD Cohen’s D 1,098 ± 0,663 1,048 ± ,632 1,161 ± ,702 0,17 136 Ergebnisse GSI PSDI PST T2 0,685 ± 0,569 ,603 ± ,519 ,789 ± ,618 0,33 T3 0,721 ± 0,637 ,606 ± ,582 ,867 ± ,680 0,42 + T1 1,846 ± 0,595 1,800 ± ,564 1,904 ± ,633 0,17 T2 1,436 ± 0,420 1,365 ± ,371 1,527 ± ,464 0,39 T3 1,465 ± 0,522 1,424 ± ,516 1,584 ± ,521 0,31 T1 49,46 ± 20,77 49,19 ± 19,224 49,80 ± 22,83 0,03 T2 38,06 ± 23,02 35,60 ± 22,13 41,20 ± 24,01 0,24 T3 38,09 ± 23,62 34,50 ± 22,46 42,63 ± 22,46 0,36 GSI: Grundsätzliche psychische Belastung; PSDI: Intensität der Antworten, Stress-Index der Beschwerden; PST: Anzahl der Symptome mit vorliegender Belastung Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der globalen Kennwerte in der SCL90-R zeigte mit p-Werten von p < ,001 hochsignifikante Unterschiede für die Gesamtgruppe. Der Post-hoc-Test wies eine statistisch hochsignifikante Abnahme der Kennwerte zwischen dem ersten und dem zweiten sowie dem ersten und dem dritten Messzeitpunkt für alle Werte auf (p < ,001). Zwischen dem zweiten und dritten Messzeitpunkt gab es keine signifikanten Unterschiede. Im Gruppenvergleich lagen keine statistisch signifikanten Unterschiede zwischen den Gruppen hinsichtlich der globalen Kennwerte der SCL90-R im Verlauf der drei Messzeitpunkte vor (s. Anhang Tabelle A19). Bei einer mittleren Effektstärke von 0,42 nach Cohen unterschieden sich die Kontrollund Experimentalgruppe zum dritten Messzeitpunkt bezüglich der Grundsätzlichen psychischen Belastung (GSI) in der SCL90-R voneinander. 7.6.2 Fragebogen zum Gesundheitszustand SF-36 Für den Gruppenvergleich wurde jeweils der Summenwert als Rohwert aller acht Skalen herangezogen. Zum Vergleich der Summenwerte zwischen der Experimentalund Kontrollgruppe wurde eine zweifaktorielle Varianzanalyse mit dem Faktor Gruppe (EG, KG), dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und dem 137 Ergebnisse Normpopulation Untersuchungsgruppe T1 Untersuchungsgruppe T2 Untersuchungsgruppe T3 100 90 Summenwert im SF-36 80 70 60 50 40 30 20 10 0 Skala 1 Skala 2 Skala 3 Skala 4 Skala 5 Skala 6 Skala 7 Skala 8 Abbildung 7.9. Vergleichswerte (Mittelwerte) der gesamtdeutschen Normpopulation und die Mittelwerte der Summenwerte der acht Skalen im SF-36 für die gesamte Untersuchungsgruppe zu den drei Messzeitpunkten (T1, T2, T3), n = 93. 100 Körperliche Schmerzen, SF-36 90 80 70 ** 60 50 40 30 20 10 0 T1-3 T1-3 KG EG T1 T2 T1 T3 KG (n=41) T2 T3 EG (n=52) Abbildung 7.10. Mittelwerte und Standardabweichungen der Skalenwerte der Skala Körperliche Schmerzen im SF-36 für Experimental- und Kontrollgruppe zu den drei Messzeitpunkten (T1, T2, T3) als zweifache Interaktion. F(2,182) = 2,11; p = ,125; sowie die Mittelwerte insgesamt für die beiden Gruppen (T1-3), F(1,90) = 7,59; p = ,007. 138 Ergebnisse Summenwert der jeweiligen Skala als abhängige Variable durchgeführt. Die Mittelwerte und Standardabweichungen für die Gesamtgruppe sowie der Experimentalund Kontrollgruppe sind in Tabelle 7.35 dargestellt. Die Summenwerte aller Skalen sowie die Vergleichswerte der gesamtdeutschen Normpopulation in der Altersgruppe von 41 bis 50 Jahre sind in Abbildung 7.9, die Summenwerte der Skala Soziale Funktionsfähigkeit sind in Abbildung 7.10 dargestellt. Die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) sind in Tabelle 7.35 aufgeführt. Tabelle 7.35. Mittelwerte (M) und Standardabweichungen (SD) der Skalenwerte der Skalen im SF-36 für die Gesamtgruppe (Gesamt) und die Experimental- und Kontrollgruppe (EG, KG) sowie die Effektstärke Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 93. Skalenwerte der Skalen im SF-36 Skala Gesamt EG (n=52) KG (n=41) Effektstärke M ± SD M ± SD M ± SD Cohen’s D T1 74,09 ± 20,93 74,13 ± 22,22 74,02 ± 19,44 0,01 1 T2 82,90 ± 18,90 85,96 ± 17,77 79,02 ± 19,79 0,37 Körperliche Funktionsfähigkeit T3 84,35 ± 18,96 87,31 ± 16,88 80,61 ± 20,92 0,36 T1 46,25 ± 44,19 50,48 ± 40,97 40,89 ± 47,94 0,22 2 T2 70,28 ± 43,14 73,77 ± 44,01 65,85 ± 42,11 0,18 Körperliche Rollenfunktion T3 68,01 ± 40,44 73,08 ± 39,59 61,59 ± 41,12 0,29 T1 37,58 ± 28,85 40,15 ± 28,51 34,32 ± 29,30 0,20 3 T2 52,83 ± 31,94 60,13 ± 30,91 43,56 ± 31,16 0,53 + Körperliche Schmerzen T3 58,48 ± 31,55 66,85 ± 29,95 47,88 ± 30,65 0,63 + 4 T1 47,10 ± 17,54 50,19 ± 18,31 43,17 ± 15,88 0,41 + Allgemeine Gesundheitswahr- T2 59,95 ± 20,58 64,42 ± 17,79 54,27 ± 22,63 0,51 + nehmung T3 57,63 ± 21,37 60,77 ± 19,54 53,66 ± 23,13 0,34 T1 34,68 ± 17,57 36,25 ± 16,18 32,68 ± 19,21 0,20 5 T2 56,77 ± 21,99 62,02 ± 17,75 50,12 ± 25,09 0,56 + Vitalität T3 48,44 ± 21,12 52,12 ± 18,87 43,78 ± 23,07 0,40 + T1 57,15 28,56 6 T2 71,41 ± 28,15 76,65 ± 25,25 64,76 ± 30,47 0,43 + Soziale Funktionsfähigkeit T3 71,40 ± 27,66 75,63 ± 27,66 66,02 ± 27,05 0,35 T1 19,24 ± 21,35 20,56 ± 19,08 17,56 ± 24,06 0,14 7 T2 31,18 ± 25,45 33,33 ± 23,01 28,46 ± 28,30 0,19 Emotionale Rollenfunktion T3 32,99 ± 20,81 35,60 ± 19,49 29,68 ± 22,18 0,29 T1 34,72 ± 14,08 34,79 ± 11,46 34,63 ± 16,98 0,01 8 T2 51,17 ± 18,52 54,21 ± 15,91 47,32 ± 20,95 0,38 Psychisches Wohlbefinden T3 47,70 ± 20,17 50,73 ± 17,82 43,85 ± 22,45 0,34 139 56,65 ± 27,28 57,78 ± 30,44 0,04 Ergebnisse Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten im Post hoc-Test befinden sich im Anhang (s. Tabelle A21-22). Die berechnete Varianzanalyse wies einen hochsignifikanten Unterschied (p = ,007) zwischen der Experimentalgruppe und der Kontrollgruppe im Mittel in der Skala Körperliche Schmerzen nach (MEG vs. MKG: 55,71 vs. 41,92). Signifikante Unterschiede zeigten sich für die Skalen Allgemeine Gesundheitswahrnehmung (MEG vs. MKG: 58,46 vs. 50,37; p = ,028) und Vitalität (MEG vs. MKG: 50,13 vs. 42,20; p = ,023). Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich der acht Skalen des SF-36 zeigte mit p-Werten von p < ,001 hochsignifikante Unterschiede für die Gesamtgruppe. Der Post-hoc-Test wies eine statistisch hochsignifikante Zunahme der Skalenwerte zwischen dem ersten und dem zweiten sowie dem ersten und dem dritten Messzeitpunkt für alle Werte auf (p < ,001). In der Skala Vitalität bestand darüber hinaus ein signifikanter Unterschied zwischen dem zweiten und dem dritten Messzeitpunkt in Form einer Abnahme (p < ,001), während es in den anderen sieben Skalen keine signifikanten Unterschiede zwischen den Messzeitpunkten gab. Zwischen den Gruppen lagen in keiner Skala des SF-36 statistisch signifikante Unterschiede im Verlauf der drei Messzeitpunkte vor. Die Skala Soziale Rollenfunktion reichte am nächsten an das Signifikanzniveau heran (p = ,058). Mit mittleren Effektstärken unterschieden sich die Kontroll- und Experimentalgruppe hinsichtlich ihres selbst eingeschätzten Gesundheitszustandes in den folgenden Skalen: Skala 3 zum zweiten (Cohen’s D = 0,53) und dritten Zeitpunkt (0,63), Skala 4 zum ersten (0,41) und zweiten (0,51), Skala 5 zum zweiten (0,56) und dritten (0,40) sowie Skala 6 zum zweiten Messzeitpunkt (0,43). 7.6.3 Hospital Anxiety and Depression Scale HADS-D Die HADS umfasst zwei Skalen. In die varianzanalytische Berechnung des Gruppenvergleichs gingen die Rohwerte ein. Die Ergebnisse werden zunächst für die Angstund anschließend für die Depressionsskala dargestellt. 7.6.3.1 Angstskala Zum Vergleich des Summenwertes in der Angstskala wurde eine zweifaktorielle Varianzanalyse mit dem Faktor Gruppe (EG, KG), dem messwiederholten Faktor Zeit140 Ergebnisse punkt, der Kovariable Alter und dem Summenwert als abhängige Variable durchgeführt. Die Mittelwerte und Standardabweichungen des Summenwertes sind für die Experimental- und Kontrollgruppe in Abbildung 7.11 dargestellt und in Tabelle 7.36 zusammen mit denen der Gesamtgruppe und den Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) aufgeführt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten im Post hoc-Test befinden sich im Anhang (s. Tabelle A23-24). 18 Summenwert HADS-Angstskala 16 14 12 10 8 6 4 2 0 T1 T2 T3 T3 T1 T2 Experimentalgruppe (n = 52) Kontrollgruppe (n = 41) Abbildung 7.11. Mittelwerte und Standardabweichungen der Summenwerte der Angstskala im HADS für die Experimental- und Kontrollgruppe (EG, KG) zu den drei Messzeitpunkten (T1, T2, T3) als zweifache Interaktion. F(2,182) = ,77; p = ,465; n = 93. Tabelle 7.36. Mittelwerte (M) und Standardabweichungen (SD) der Summenwerte der Angstskala im HADS für die Gesamtgruppe (Gesamt) und die Experimental- und Kontrollgruppe (EG, KG) sowie Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 93. Summenwert der Angstskala im HADS Gesamt EG (n=52) KG (n=41) M ± SD M ± SD M ±SD Effektstärke Cohen’s D T1 10,95 ± 4,02 10,67 ± 3,47 11,29 ± 4,64 0,15 T2 7,47 ± 4,64 6,79 ± 4,27 8,34 ± 4,99 0,34 T3 7,41 ± 4,79 6,71 ± 4,07 8,29 ± 5,48 0,33 141 Ergebnisse Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich des Summenwertes in der Angstskala des HADS zeigte für die Gesamtgruppe mit der Wahrscheinlichkeit von p = ,000 einen hochsignifikanten Unterschied für die Gesamtgruppe. Der Post-hoc-Test wies eine statistisch hochsignifikante Abnahme des Summenwertes vom ersten zum zweiten und vom ersten zum dritten Messzeitpunkt (p < ,001) nach. Es bestand kein signifikanter Unterschied zwischen dem zweiten und den dritten Messzeitpunkt (p = ,989). Zwischen den Gruppen lagen keine statistisch signifikanten Unterschiede (p = ,465) hinsichtlich des Summenwertes in der Angstskala des HADS im Verlauf der drei Messzeitpunkte vor. Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe in ihrer Angstsymptomatik nicht voneinander. 7.6.3.2 Depressionsskala Zum Vergleich des Summenwertes in der Depressionsskala wurde eine zweifaktorielle Varianzanalyse mit dem Faktor Gruppe (EG, KG), dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und dem Summenwert als abhängige Variable durchgeführt. Die Mittelwerte und Standardabweichungen des Summenwertes sind für die Experimental- und Kontrollgruppe in Abbildung 7.12 dargestellt und in Tabelle 7.37 zusammen mit denen der Gesamtgruppe und den Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) aufgeführt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten im Post hoc-Test befinden sich im Anhang (s. Tabelle A25-26). Tabelle 7.37. Mittelwerte (M) und Standardabweichungen (SD) der Summenwerte der Depressionsskala im HADS für die Gesamtgruppe (Gesamt) und die Experimental- und Kontrollgruppe (EG, KG) sowie Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 93. Summenwert der Depressionsskala im HADS Gesamt EG (n=52) KG (n=41) M ± SD M ± SD M ±SD Effektstärke Cohen’s D T1 10,38 ± 8,12 9,96 ± 3,94 10,90 ± 11,47 0,12 T2 6,34 ± 4,87 5,63 ± 4,24 7,24 ± 5,49 0,33 T3 6,51 ± 5,07 6,02 ± 4,88 7,12 ± 5,29 0,22 142 Ergebnisse Summenwert HADS-Depressionsskala 24 22 20 18 16 14 12 10 8 6 4 2 0 T1 T2 T3 Kontrollgruppe (n = 41) T3 T1 T2 Experimentalgruppe (n = 52) Abbildung 7.12. Mittelwerte und Standardabweichungen der Summenwerte der Depressionsskala im HADS für die Experimental- und Kontrollgruppe (EG, KG) zu den drei Messzeitpunkten (T1, T2, T3) als zweifache Interaktion, F(2,182) = ,12; p = ,885; n = 93. Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte hinsichtlich des Summenwertes in der Depressionsskala des HADS zeigte für die Gesamtgruppe mit der Wahrscheinlichkeit von p = ,000 einen hochsignifikanten Unterschied für die Gesamtgruppe. Der Post-hoc-Test wies eine statistisch hochsignifikante Abnahme des Summenwertes vom ersten zum zweiten und vom ersten zum dritten Messzeitpunkt (p < ,001) nach. Es bestand kein signifikanter Unterschied zwischen dem zweiten und dem dritten Messzeitpunkt (p = ,981). Zwischen den Gruppen lagen keine statistisch signifikanten Unterschiede (p = ,981) hinsichtlich des Summenwertes in der Depressionsskala des HADS im Verlauf der drei Messzeitpunkte vor. Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe in ihrer Depressivität nicht voneinander. 143 Ergebnisse 7.7 Vergleich der Experimental- und Kontrollgruppe hinsichtlich der kardiovaskulären Stress-Reaktivität Die Reaktivitätswerte wurden aus der Differenz der unter Belastung und unter Ruhe gemessenen Werte berechnet. Zum Vergleich zwischen der Experimental- und Kontrollgruppe wurde eine zweifaktorielle Varianzanalyse mit dem Faktor Gruppe (EG, KG), dem messwiederholten Faktor Zeitpunkt, der Kovariable Alter und dem Reaktivitätswert des jeweiligen kardiovaskulären Parameter als abhängige Variable durchgeführt. Da die Ruhemessung eines Patienten der Kontrollgruppe aufgrund zu vieler Artefakte nicht ausgewertet werden konnte, wurden in die Auswertung 92 Patienten einbezogen. 7.7.1 Herzratenvariabilität im gesamten Frequenzspektrum Die Mittelwerte und Standardabweichungen der auf die Gesamtherzratenvariabilität bezogenen Reaktivitätswerte sind für die Gesamtgruppe sowie die Experimental- und Kontrollgruppe ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen in Tabelle 7.38 dargestellt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten für den Post hoc-Test mit dem Haupteffekt Zeit befinden sich im Anhang (s. Tabelle A27-28). Tabelle 7.38. Mittelwerte (M) und Standardabweichungen (SD) der Reaktivität bezogen auf die Gesamtherzratenvariabilität für die Gesamtgruppe (Gesamt) sowie für die Kontroll- (KG) und Experimentalgruppe (EG) und deren Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 92. Reaktivität bezogen auf die Gesamtherzratenvariabilität [ ms² ] KG (n = 40) EG (n = 52) Gesamt M ± SD M ± SD Effektstärke Cohen’s D T1 -1295,23 ± 3623,31 -1467,58 ± 3107,94 0,05 -1392,65 ± 3323,74 T2 -2104,73 ± 3779,61 -1862,94 ± 2857,96 0,07 -1968,07 ± 3273,30 T3 -608,87 ± 4699,88 -1426,75 ± 3427,09 0,20 -1071,15 ± 4026,81 M ± SD Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte zeigte signifikante (p = ,042) Unterschiede hinsichtlich der Reaktivität bezogen auf die Gesamtherzratenvariabilität für die Gesamtgruppe auf. Der Post hoc-Test wies für die Gesamtgruppe eine signifikante Abnahme (p = ,024) vom zweiten zum dritten Mess144 Ergebnisse zeitpunkt nach. Zwischen den anderen Zeitpunkten lagen keine signifikanten Veränderungen vor. Die Varianzanalyse zeigte keine statistisch signifikanten Unterschiede zwischen den beiden Gruppen hinsichtlich der auf die Gesamtherzratenvariabilität bezogenen Reaktivitätswerte im Verlauf der drei Messzeitpunkte auf (p = ,794). Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe nicht voneinander. 7.7.2 Herzratenvariabilität im High Frequency-Band Die Mittelwerte und Standardabweichungen der auf die Herzratenvariabilität im High frequency-Band bezogenen Reaktivitätswerte sind für die Gesamtgruppe sowie die Experimental- und Kontrollgruppe ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen in Tabelle 7.39 dargestellt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten für den Post hoc-Test mit dem Haupteffekt Zeit befinden sich im Anhang (s. Tabelle A29-30). Tabelle 7.39. Mittelwerte (M) und Standardabweichungen (SD) der Reaktivität bezogen auf die Herzratenvariabilität im High frequency-Band für die Gesamtgruppe (Gesamt) sowie für die Kontroll- (KG) und Experimentalgruppe (EG) und deren Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 92. Reaktivität bezogen auf die Herzratenvariabilität im High frequency-Band [ ms² ] KG (n = 40) EG (n = 52) Gesamt M ± SD M ± SD Effektstärke Cohen’s D T1 -845,23 ± 1964,96 -1052,93 ± 2565,82 0,09 -962,63 ± 2314,11 T2 -1202,13 ± 1583,83 -1247,49 ± 2363,30 0,02 -1227,77 ± 2050,79 T3 -291,50 ± 2558,62 -1109,95 ± 2889,04 0,30 -754,10 ± 2765,83 M ± SD Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte zeigte signifikante (p = ,041) Unterschiede hinsichtlich der Reaktivität bezogen auf die Herzratenvariabilität im High frequency- Band für die Gesamtgruppe auf. Der Post hoc-Test wies für die Gesamtgruppe eine signifikante Abnahme (p = ,020) vom zweiten zum dritten Messzeitpunkt nach. Zwischen den anderen Zeitpunkten lagen keine signifikanten Veränderungen vor. 145 Ergebnisse Die Varianzanalyse zeigte keine statistisch signifikanten Unterschiede zwischen den beiden Gruppen hinsichtlich der auf die Herzratenvariabilität im High frequency- Band bezogenen Reaktivitätswerte im Verlauf der drei Messzeitpunkte auf (p = ,121). Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe nicht voneinander. 7.7.3 Herzratenvariabilität im Mid Frequency-Band Die Mittelwerte und Standardabweichungen der auf die Herzratenvariabilität im Mid frequency- Band bezogenen Reaktivitätswerte sind für die Gesamtgruppe sowie die Experimental- und Kontrollgruppe ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) in Tabelle 7.40 dargestellt. Die varianzanalytischen Ergebnisse befinden sich im Anhang (s. Tabelle A31). Tabelle 7.40. Mittelwerte (M) und Standardabweichungen (SD) der Reaktivität bezogen auf die Herzratenvariabilität im Mid frequency-Band für die Gesamtgruppe (Gesamt) sowie für die Kontroll- (KG) und Experimentalgruppe (EG) und deren Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 92. Reaktivität bezogen auf die Herzratenvariabilität im Mid frequency-Band [ ms² ] KG (n = 40) EG (n = 52) Gesamt M ± SD M ± SD Effektstärke Cohen’s D T1 -508,71 ± 1264,79 -325,58 ± 797,22 0,18 -405,20 ± 1024,74 T2 -627,12 ± 1758,45 -294,59 ± 540,08 0,27 -439,17 ± 1231,32 T3 -207,14 ± 1080,24 -186,92 ± 500,01 0,03 -195,71 ± 800,21 M ± SD Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte zeigte keine signifikanten (p = ,052) Unterschiede hinsichtlich der Reaktivität bezogen auf die Herzratenvariabilität im Mid frequency- Band für die Gesamtgruppe auf. Die Varianzanalyse zeigte keine statistisch signifikanten Unterschiede zwischen den beiden Gruppen hinsichtlich der auf die Herzratenvariabilität im Mid frequency- Band bezogenen Reaktivitätswerte im Verlauf der drei Messzeitpunkte auf (p = ,387). Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe nicht voneinander. 146 Ergebnisse 7.7.4 Herzratenvariabilität im Respiratorischen Band Die Mittelwerte und Standardabweichungen der auf die Herzratenvariabilität im Respiratorischen Band bezogenen Reaktivitätswerte sind für die Gesamtgruppe sowie die Experimental- und Kontrollgruppe ebenso wie die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) in Tabelle 7.41 dargestellt. Die varianzanalytischen Ergebnisse befinden sich im Anhang (s. Tabelle A32). Tabelle 7.41. Mittelwerte (M) und Standardabweichungen (SD) der Reaktivität bezogen auf die Herzratenvariabilität im Respiratorischen Band für die Gesamtgruppe (Gesamt) sowie für die Kontroll- (KG) und Experimentalgruppe (EG) und deren Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 92. Reaktivität bezogen auf die Herzratenvariabilität im Respiratorischen Band [ ms² ] KG (n = 40) EG (n = 52) Gesamt M ± SD M ± SD Effektstärke Cohen’s D T1 -690,61 ± 1300,86 -881,86 ± 2307,81 0,10 -798,71 ± 1928,53 T2 -849,54 ± 1757,16 -951,50 ± 2194,20 0,05 -907,17 ± 2006,01 T3 -512,82 ± 1142,78 -893,69 ± 2550,53 0,18 -728,09 ± 2059,49 M ± SD Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte zeigte keine signifikanten (p = ,330) Unterschiede hinsichtlich der Reaktivität bezogen auf die Herzratenvariabilität im Respiratorischen Band für die Gesamtgruppe auf. Die Varianzanalyse zeigte ebenso keine statistisch signifikanten Unterschiede zwischen den beiden Gruppen hinsichtlich der auf die Herzratenvariabilität im Respiratorischen Band bezogenen Reaktivitätswerte im Verlauf der drei Messzeitpunkte auf (p = ,563). Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe nicht voneinander. 7.7.5 Baroreflexsensitivität Die Mittelwerte und Standardabweichungen der auf die Baroreflexsensitivität bezogenen Reaktivitätswerte sind für die Gesamtgruppe sowie die Experimental- und Kontrollgruppe in Tabelle 7.42 und in Abbildung 7.13 dargestellt. Die Effektstärken Cohen’s D für den Vergleich zwischen den beiden Gruppen (EG, KG) sind in Tabelle 7.42 aufgeführt. Die varianzanalytischen Ergebnisse und die Wahrscheinlichkeiten 147 Ergebnisse für den Post hoc-Test mit dem Haupteffekt Gruppe befinden sich im Anhang (s. Ta- Reaktivität der Baroreflexsensitivität [ms/mmHg] belle A33). 3 * 2 1 0 -1 -2 -3 -4 -5 -6 -7 -8 -9 T1-3 T1-3 KG EG T1 T2 T1 T3 KG (n=38) T2 T3 EG (n=48) Abbildung 7.13. Mittelwerte und Standardabweichungen der Reaktivität der Baroreflexsensitivität für die Experimental- und Kontrollgruppe zu den drei Messzeitpunkten (T1, T2, T3) als zweifache Interaktion, F(2,168) = ,02; p = ,982; Mittelwerte insgesamt für beide Gruppen (T1-3), F(1,83) = 4,02; p = ,048. Tabelle 7.42. Mittelwerte (M) und Standardabweichungen (SD) der Reaktivität bezogen auf die Baroreflexsensitivität für die Gesamtgruppe (Gesamt) sowie für die Kontroll- (KG) und Experimentalgruppe (EG) und deren Effektstärken Cohen’s D zu den drei Messzeitpunkten (T1, T2, T3), n = 86. Reaktivität bezogen auf die Baroreflexsensitivität [ms/mmHg] KG (n = 38) T1 T2 T3 EG (n = 48) Gesamt M ± SD M ± SD Effektstärke Cohen’s D -3,358 ± 4,178 -2,130 ± 2,885 0,35 -2,673 ± 3,547 -3,520 ± 4,730 -2,379 ± 3,324 0,28 -2,883 ± 4,022 -2,649 ± 2,775 -1,611 ± 3,956 0,30 -2,070 ± 3,503 M ± SD Die berechnete Varianzanalyse wies einen signifikanten Unterschied (p = ,048) zwischen der Experimentalgruppe und der Kontrollgruppe im Mittel hinsichtlich der Reaktivitätswerte der Baroreflexsensitivität nach (MEG vs. MKG: -2,04 vs. -3,18). Die berechnete Varianzanalyse für den Vergleich der drei Messzeitpunkte zeigte keine sig148 Ergebnisse nifikanten (p = ,231) Unterschiede hinsichtlich der Reaktivität bezogen auf die Baroreflexsensitivität für die Gesamtgruppe auf. Die Varianzanalyse zeigte ebenso keine statistisch signifikanten Unterschiede zwischen den beiden Gruppen hinsichtlich der auf die Baroreflexsensitivität bezogenen Reaktivitätswerte im Verlauf der drei Messzeitpunkte auf (p = ,982). Mit kleinen Effektstärken nach Cohen unterschieden sich die Kontroll- und Experimentalgruppe nicht voneinander. 7.8 Prüfung des Zusammenhanges zwischen sportlicher Aktivität und den kardiovaskulären Parametern Um den Einfluss körperlicher Aktivität über das Ausdauertraining hinaus zu untersuchen, wurden die dargestellten Parameter in eine Regressionsberechnung einbezogen mit den Kovariablen Alter und sportliche Aktivität. Das Maß der sportlichen Aktivität stellte die Veränderung der sportlichen Aktivität vom ersten zum dritten Messzeitpunkt dar, wie sie mit dem Freiburger Fragebogen zur körperlichen Aktivität (FFKA) erhoben wurde. 7.8.1 Kardiovaskuläre Parameter in der Ruhephase Die Ergebnisse der Regressionsberechnung für sportliche Aktivität im FFKA und die kardiovaskulären Parameter in der Ruhephase sind in Tabelle 7.43 dargestellt. Ergebnisse, die das Signifikanzniveau erreichten, sind entsprechend gekennzeichnet. Tabelle 7.43. Ergebnisse der Regressionsberechnung für die Kovariable Sportliche Aktivität im FFKA (Veränderung von T1 zu T3) und den physiologischen Parametern in Ruhe mit der Kovariable Alter. Abhängige Variable Gesamtherzvariabilität HRV im High frequency-Band HRV im Mid frequency-Band HRV im Respiratorischen Band Baroreflexsensitivität Mult. R ,352 ,394 ,318 ,446 ,489 MANOVA, Regressionsergebnisse F-Wert p-Wert Kovariable (2,86) Alter ,003** 6,08 Sport (2,86) Alter ,001** 7,89 Sport (2,86) Alter ,010** 4,85 Sport (2,86) Alter ,009** 10,68 Sport (2,83) Alter ,000** 13,04 Sport Beta -,163 ,329 -,204 ,358 -,121 ,306 -,260 ,389 -,315 ,401 t-Wert -1,61 3,24 -2,05 3,59 -1,18 2,98 -2,68 4,01 -3,28 4,18 p-Wert ,112 ,002 ** ,044 * ,001 ** ,241 ,004 ** ,009 ** ,000 ** ,002 ** ,000 ** Die Regressionsanalyse für die kardiovaskulären Parameter unter Ruhebedingungen zeigte unter Berücksichtigung des Alters einen bedeutsamen und statistisch hochsignifikanten Einfluss der körperlichen Aktivität auf die folgenden Parameter: Gesamtherzratenvariabilität (Beta = ,329; p = ,002), Herzratenvariabilität im High fre149 Ergebnisse quency-Band (Beta = ,358; p = ,001), Herzratenvariabilität im Mid frequency-Band (Beta = ,306; p = ,004), Herzratenvariabilität im Respiratorischen Band (Beta = ,389; p = ,000) sowie Baroreflexsensitivität (Beta = ,401; p = ,000). 7.8.2 Kardiovaskuläre Parameter in der Belastungsphase Die Ergebnisse der Regressionsberechnung für sportliche Aktivität im FFKA und die kardiovaskulären Parameter in der Belastungsphase (BonnDet) sind in Tabelle 7.44 dargestellt. Ergebnisse, die das Signifikanzniveau erreichten, sind entsprechend gekennzeichnet. Tabelle 7.44. Ergebnisse der Regressionsberechnung für die Kovariable Sportliche Aktivität im FFKA (Veränderungswert von T1 zu T3) und den physiologischen Parametern in der Belastungsphase unter Einbeziehung der Kovariable Alter. Abhängige Variable Gesamtherzvariabilität HRV im High frequency-Band HRV im Mid frequency-Band HRV im Respiratorischen Band Baroreflexsensitivität Mult. R ,090 ,095 ,217 ,290 ,458 MANOVA, Regressionsergebnisse F-Wert p-Wert Kovariable (2,87) Alter ,702 ,36 Sport (2,87) Alter ,675 ,39 Sport Alter (2,87) ,123 2,15 Sport Alter (2,87) ,022* 3,99 Sport (2,84) Alter ,000** 11,16 Sport Beta -.053 ,078 -,034 ,092 -,215 ,055 -,208 ,223 -,431 ,168 t-Wert -,50 ,73 ,86 ,86 -2,05 ,52 -2,02 2,17 -4,45 1,73 p-Wert ,621 ,470 ,393 ,393 ,044 * ,605 ,047 * ,033 * ,000 * ,087 Die Regressionsanalyse der kardiovaskulären Parameter in der Belastungsphase zeigte unter Berücksichtigung des Alters einen bedeutsamen und statistisch signifikanten Einfluss körperlicher Aktivität auf die Herzratenvariabilität im Respiratorischen Band (Beta = ,223; p = ,033). Der Einfluss auf die Baroreflexsensitivität erwies sich als tendenziell (Beta = ,168; p = ,087), während sich bei den anderen Parametern kein signifikanter Einfluss zeigte. 7.8.3 Kardiovaskuläre Parameter als Stress-Reaktivitätswerte Die Ergebnisse der Regressionsberechnung für sportliche Aktivität im FFKA und die auf die kardiovaskulären Parameter bezogenen Reaktivitätswerte sind in Tabelle 7.45 dargestellt. Ergebnisse, die das Signifikanzniveau erreichten, sind entsprechend gekennzeichnet. 150 Ergebnisse Tabelle 7.45. Ergebnisse der Regressionsberechnung für die Kovariable Sportliche Aktivität im FFKA (Veränderungswert von T1 zu T3) und den physiologischen Parametern als Reaktivitätswerte unter Einbeziehung der Kovariable Alter. Abhängige Variable ∆ Gesamtherzvariabilität ∆ HRV im High frequency-Band ∆ HRV im Mid frequency-Band ∆ HRV im Respiratorischen Band ∆ Baroreflexsensitivität Mult. R ,341 ,409 ,221 ,437 ,292 MANOVA, Regressionsergebnisse F-Wert p-Wert Kovariable Alter (2,86) ,005** 5,66 Sport Alter (2,86) ,000** 8, 66 Sport Alter (2,86) ,116 2,21 Sport Alter (2,86) ,000** 10,17 Sport Alter (2,80) ,028* 3,72 Sport Beta ,150 -,321 ,226 -,364 -,052 -,210 ,243 -,388 -,065 -,283 t-Wert 1,48 -3,16 2,29 -3,69 -,49 -1,99 2,49 ,3,99 -,61 -2,65 p-Wert ,143 ,002 ** ,025 * ,000 ** ,627 ,050 * ,015 * ,000 ** ,547 ,010 ** Die Regressionsanalyse für die kardiovaskulären Parameter als Reaktivitätswerte zeigte unter Berücksichtigung des Alters einen bedeutsamen und statistisch hochsignifikanten Einfluss der körperlichen Aktivität auf die folgenden Parameter: Gesamtherzratenvariabilität (Beta = -,321; p = ,002), Herzratenvariabilität im High frequency-Band (Beta = -,364; p = ,000), Herzratenvariabilität im Respiratorischen Band (Beta = -,388; p = ,000) sowie Baroreflexsensitivität (Beta = -,283; p = ,010). Der Einfluss auf die Herzratenvariabilität im Mid frequency-Band erwies sich als signifikant (Beta = -,210; p = ,050). 151 Diskussion 8 Diskussion Im Mittelpunkt der vorliegenden Untersuchung stand die Frage, ob sich die beeinträchtigte autonome Regulation bei Patienten mit einer Angst- oder Somatisierungsstörung durch ein aerobes Ausdauertraining verbessern lässt. Für die Untersuchung wurden 139 Patienten rekrutiert, von denen 93 Patienten an der gesamten Untersuchung mit den drei Messzeitpunkten teilnahmen. Die Abbruchquote lag mit 25 Patienten der Experimentalgruppe und 21 Patienten der Kontrollgruppe gleichmäßig auf beide Gruppen verteilt. Bei einer Drop out-Rate von 33% konnte eine hohe Teilnehmermotivation der Patienten verzeichnet werden. Zunächst sollen die Ergebnisse der Interventionsüberprüfung diskutiert werden, um die Wirksamkeit des durchgeführten Trainings zu klären. Die Hypothesenüberprüfung bezieht sich entsprechend der Ergebnisdarstellung auf die kardiovaskulären Parameter, den subjektiv eingeschätzten Rehabilitationserfolg und psychometrische Parameter sowie auf die kardiovaskuläre Stress-Reaktivität. Abschließend soll ein Ausblick für zukünftige Fragestellungen gegeben werden. 8.1 Interventionseffekte Um die Wirksamkeit des Trainings zu überprüfen, wurden die Veränderungen des Aktivitätsverhaltens mit dem FFKA erfasst und die Ausdauerleistungsfähigkeit in einer fahrradergometrischen Belastungsuntersuchung gemessen. Das Aktivitätsverhalten der Patienten im FFKA zeigte sich zu Beginn der Untersuchung im Bereich des von FREY und BERG (1995) geforderten Mindestmaßes an körperlicher Aktivität. Dieses wurde bei den befragten Patienten hauptsächlich über alltägliche Bewegung erreicht. Wie in der von BROOCKS (2000, S. 55) beschriebenen Stichprobe betätigten sich die Patienten kaum sportlich. Während der Rehabilitationsbehandlung nahmen die körperliche Aktivität und die sportliche Betätigung im Rahmen des klinischen Bewegungsangebotes in der Gesamtgruppe hochsignifikant zu. Beim zweiten und auch, trotz leichter Abnahmen, beim dritten Messzeitpunkt wurde die Kategorie ausreichender Aktivität erreicht. Die Experimentalgruppe war zum zweiten und dritten Messzeitpunkt signifikant aktiver als die Kontrollgruppe. Dies zeigte sich vor allem in einem deutlichen Anstieg der Sportpunkte im FFKA, die unter anderem das Ausdauertraining enthielten. Auffällig erscheinen die extremen Unterschiede innerhalb der Gruppen, die sich in der hohen Standardabweichung nieder152 Diskussion schlagen. Nach Beenden der Klinikintervention haben einige Patienten der Experimentalgruppe ihr Training fast vollständig eingestellt, während einzelne Patienten der Kontrollgruppe ihre sportliche Aktivität deutlich gesteigert haben. Bei den Patienten der Experimentalgruppe mit einer autonomen Regulationsstörung ist ein deutlicher Abfall der sportlichen Aktivität im Katamnesezeitraum zu verzeichnen, der dem Aktivitätsanstieg der Patienten mit unauffälliger autonomer Regulation gegenübersteht. Bei der ersten fahrradergometrischen Belastungsuntersuchung zeigte sich eine deutlich reduzierte Ausdauerleistungsfähigkeit bezogen auf die alters- und geschlechtsspezifischen Referenzwerte (ROST, 1995, 278). Die Leistungen bezogen auf das Körpergewicht lagen mit 1,70 Watt/kg bei den Frauen und mit 2,04 Watt/kg bei den Männern unter den zu erwartenden Referenzwerten von 2,28 bzw. 2,52 Watt/kg und entsprachen den Werten, die BROOCKS (2000, 56) bei jüngeren Patienten mit Panikstörung festgestellt hat (Frauen: 1,97 und Männer: 2,53 Watt/kg). BROOCKS et al. (1997b, 388) zufolge führt der auf den durch Vermeidungsverhalten hervorgerufene Bewegungsmangel zu der beobachteten eingeschränkten Leistungsfähigkeit, die als mögliche Ursache autonomer Regulationsstörungen und als Ursache von Symptomen wie Panikattacken bei Angststörungen bzw. wie körperliche Missempfindungen bei somatoformen Störungen diskutiert wird (vgl. Abschnitt 3.3.1 und 3.3.2). Das Modell wird empirisch gestützt von der geringeren Leistungsfähigkeit der beeinträchtigten Gruppe, die signifikant höhere Herzfrequenzen und Laktatwerte bei 75 und 100 Watt zeigten als die normalregulierte Gruppe. Bei 125 Watt zeigte sich der Unterschied aufgrund einer geringeren Stichprobengröße nur tendenziell. Die maximal erreichte Leistung nahm in der Experimentalgruppe hochsignifikant vom ersten zum zweiten und vom ersten zum dritten Messzeitpunkt zu und unterschied sich bei beiden Messungen bedingt durch die Trainingsintervention hochsignifikant von der Kontrollgruppe. Die Zunahme der Leistungsfähigkeit von 1,79 auf 2,01 Watt/kg in der Experimentalgruppe entspricht den Ergebnissen in der Untersuchung von BROOCKS (2000, 85), in der eine Zunahme der Leistungsfähigkeit bei Patienten mit Panikstörung nach einer zehnwöchigen Behandlung mit Ausdauertraining von 2,18 auf 2,42 Watt/kg beschrieben wird. Hinsichtlich der Herzfrequenzen bei definierten Leistungsstufen gab es in der vorliegenden Untersuchung keine Unterschiede zwischen der Kontroll- und Experimentalgruppe. Das Ausdauertraining führte nicht zu einer Senkung der Herzfrequenz für 153 Diskussion festgelegte Belastungen, wie sie u.a. von DE MARÉES (2003, 318) nach einem moderaten Ausdauertraining bereits nach zwei bis drei Wochen beschrieben wird (s. Abschnitt 4.3). In der Gesamtgruppe zeigte sich allerdings eine Senkung der Herzfrequenz bei definierten Leistungsstufen vom ersten zum zweiten Messzeitpunkt. Verbesserungen der aeroben Energiebereitstellung konnten nicht festgestellt werden, wie die Laktatkonzentrationen bei definierten Leistungsstufen zeigen. Zusammenfassend lässt sich feststellen, dass die Intervention Effekte wie die Aktivitätssteigerung und die Zunahme der maximalen Leistung bewirkt hat. Die Auswirkungen des Ausdauertrainings auf die Leistungsfähigkeit sind allerdings geringer ausgefallen als angenommen. Dieses Ergebnis lässt sich auf die Steigerung der körperlichen Aktivität im Rahmen des klinischen Bewegungsangebotes zurückführen, die auch in der Kontrollgruppe unabhängig vom Ausdauertraining zu beobachten war. Das Ausdauertraining scheint in der durchgeführten Intensität und über den Zeitraum nicht entsprechend zusätzliche, messbar höhere Leistungszuwächse hervorgerufen zu haben. Aufgrund der gesteigerten sportlichen Aktivität in der gesamten Untersuchungsgruppe und dem unterschiedlichen Aktivitätsverhalten innerhalb beider Gruppen (kein Sport bis überdurchschnittlich viel Sport) ist es schwierig, mögliche Effekte des zusätzlichen Ausdauertrainings in einem varianzanalytischen Gruppenvergleich statistisch abzubilden. Um den Zusammenhang zwischen der sportlichen Aktivität (unabhängig von der Zugehörigkeit zur Experimental- oder Kontrollgruppe) und Veränderungen der autonomen Regulation zu überprüfen, wurde neben der varianzanalytischen Auswertung eine Regressionsanalyse der kardiovaskulären Parameter und der sportlichen Aktivität durchgeführt, die in den folgenden, hypothesengeleiteten Ausführungen berücksichtigt wurde. 8.2 Kardiovaskuläre Parameter Die Hypothese 1 der vorliegenden Untersuchung bezieht sich auf eine Normalisierung der Indices der kardiovaskulären Regulation durch ein aerobes Ausdauertraining. Die Veränderung sollte sich in einem Anstieg der Herzratenvariabilität und einem Anstieg der Baroreflexsensitivität in der Größenordnung von 3 ms/mmHg ausschließlich in der Gruppe mit einer autonomen Dysregulation zeigen. Die Unteraspekte dieser Hypothese betreffen den Zeitverlauf des erwarteten Anstiegs (Hypothese 1a), die Ausnahme der Patienten mit unauffälliger Regulation (Hypothese 1b) so- 154 Diskussion wie die Vergleichbarkeit von Patienten mit einer Angst- und somatoformen Störung (Hypothese 1c). Es finden sich entgegen der Erwartung keine signifikanten Veränderungen der kardiovaskulären Indices während des Untersuchungszeitraumes in der beeinträchtigten Experimentalgruppe. In der gesamten beeinträchtigten Untersuchungsgruppe finden sich signifikante Anstiege der Herzratenvariabilität unter Ruhebedingungen im High frequency-Band und im Respiratorischen Band als Maß parasympathischer Aktivität vom ersten zum zweiten Messzeitpunkt. Im Katamnesezeitraum führt der signifikante Abfall beider Parameter fast auf das Ausgangsniveau vom Beginn der Rehabilitationsbehandlung zurück. Da die Veränderungen sich jedoch nicht im Gruppenvergleich zwischen Experimental- und Kontrollgruppe zeigen (nicht signifikante Ergebnisse sowie kleine Effektstärken), konnten keine Effekte des Ausdauertrainings auf die Herzratenvariabilität nachgewiesen werden. Unter Berücksichtigung des Umfanges an sportlicher Aktivität unabhängig von der Gruppenzugehörigkeit zeigt die Regressionsberechnung einen hochsignifikanten Zusammenhang zwischen der Steigerung sportlicher Aktivität und allen vier erhobenen Parametern der Herzratenvariabilität unter Ruhebedingungen (s. Tabelle 7.43). Unter Belastung zeigt sich ein signifikanter Zusammenhang nur im Respiratorischen Band (s. Tabelle 7.44). In der Gesamtgruppe ist die Baroreflexsensitivität unter Ruhe signifikant angestiegen vom ersten zum zweiten bzw. zum dritten Messzeitpunkt. Es bestehen jedoch keine signifikanten Unterschiede zwischen der beeinträchtigten Experimental- und Kontrollgruppe, wie sowohl die Varianzanalyse als auch die Berechnung der Effektstärke nach Cohen ergeben haben. Auffällig sind im Vergleich der beiden Gruppen die höheren Werte der Gesamtherzratenvariabilität unter Ruhebedingungen, der Herzratenvariabilität im Mid frequencyBand unter Ruhe und Stressbelastung sowie bezüglich der Baroreflexsensitivität unter Ruhe in der beeinträchtigten Kontrollgruppe jeweils zum dritten Messzeitpunkt (mittlere Effektstärken). Trotz der Randomisierung ist ein Ausgangsunterschied in der Gruppe mit autonomer Dysregulation aufgetreten. Die Kontrollgruppe (KG dys) hatte zu Beginn der Untersuchungen verglichen mit der Experimentalgruppe (EG dys) unter Ruhe eine deutlich höhere Herzratenvariabilität und Baroreflexsensitivität, die sich möglicherweise in 155 Diskussion besseren Katamnesewerten niederschlagen. So nehmen BOUTCHER und STEIN (1995) unter Berücksichtigung ihrer Ergebnisse und der von KENNEY (1988) gefundenen hohen Korrelation zwischen der Herzratenvariabilität und der Leistungsfähigkeit (gemessen als maximale Sauerstoffaufnahme) an, dass die Adaptationsfähigkeit an Training vom Ausgangslevel der Herzratenvariabilität abhängt. MELANSON und FREEDSON (2001) vermuten, dass eine höhere Herzratenvariabilität bei Untrainierten eine bessere Trainingsanpassungsfähigkeit des kardiovaskulären Systems widerspiegelt. Regressionsanalytisch nachgewiesen wurde ein hochsignifikanter Zusammenhang zwischen der sportlichen Aktivität und der Baroreflexsensitivität unter Ruhe. Unter Belastungsbedingungen bestand nur ein tendenzieller Zusammenhang. Zusammenfassend konnte ein Anstieg der autonomen Regulation innerhalb der Rehabilitationsbehandlung erzielt werden. Es gibt entgegen der Hypothese jedoch keinen Hinweis auf einen Anstieg der Herzratenvariabilität und Baroreflexsensitivität durch die Intervention des aeroben Ausdauertrainings. Dieses Ergebnis steht im Einklang mit Untersuchungsergebnissen von DE GEUS et al. (1996), BOUTCHER und STEIN (1995) und LOIMAALA et al. (2000), die nach einer vergleichbaren Intervention keine Auswirkungen bezüglich der Herzratenvariabilität und Baroreflexsensitivität feststellen konnten. Der regressionsanalytisch nachgewiesene Zusammenhang zwischen Aktivität und autonomer Indices findet sich in Querschnittstudien wieder, die höhere Indices der kardiovaskulären Regulation bei Ausdauertrainierten verglichen mit nicht Trainierten beschreiben (STEPTOE et al., 1993; JENSEN-URSTAD, SALTIN et al., 1997; BONADUCE et al., 1998; KÖNIG et al., 2002). In Längsschnittstudien, die sich hinsichtlich der Intervention im Sinne eines mehrwöchigen moderaten Ausdauertrainings mit der vorliegenden Untersuchung vergleichen lassen, bewirkte das Training einen Anstieg der Herzratenvariabilität bzw. Baroreflexsensitivität bei zuvor untrainierten, gesunden Probanden (SOMERS et al., 1991; MCDONALD et al., 1993; MELANSON und FREEDSON, 2001; SCHULZ et al., 2002). LEE et al. (2003) fanden bereits nach zwei Wochen Ausdauertraining Verbesserungen der vagalen Modulation bei gesunden, jungen Männern. HOWORKA et al. (1997) berichten von Verbesserungen der Herzratenvariabilität durch Ausdauertraining bei Diabetikern ohne oder mit beginnender autonomer Dysregulation. CARTER, BANISTER & BLABER (2003) kommen in ihrem Review-Artikel auf156 Diskussion grund der ausgewerteten Studien zu dem Schluss, dass Ausdauertraining, wird es langfristig betrieben, die autonome Kontrolle des Herzens beeinflusst, die Herzratenvariabilität und die parasympathische Aktivität steigert sowie die sympathische Aktivität senkt. Die vorliegende Studie zeigt einen Zusammenhang zwischen sportlicher Aktivität und autonomer Regulation bei Patienten mit Angst- und somatoformer Störung auf, wenn auch eine Normalisierung der autonomen Dysregulation durch das Ausdauertraining nicht wie erwartet erreicht werden konnte. Da sich die in Hypothese 1 formulierte Normalisierung der autonomen Dysregulation innerhalb des Untersuchungszeitraumes nicht bestätigt hat, konnte ebenso die Hypothese 1a über den zeitlichen Verlauf der erwarteten Veränderung nicht verifiziert werden. In Hypothese 1 b ist die Annahme formuliert, dass sich die Indices der autonomen Regulation nicht in der Gruppe mit unbeeinträchtigter autonomer Regulation verändern. Auf die Parameter der Herzratenvariabilität bezogen trifft die Annahme zu. Es traten weder vom ersten zum zweiten, noch vom ersten zum dritten Messzeitpunkt signifikante Veränderungen auf. Bezüglich der Baroreflexsensitivität war dagegen eine signifikante Abnahme unter Ruhebedingungen vom ersten zum dritten Messzeitpunkt in der unbeeinträchtigten Kontrollgruppe zu verzeichnen. Möglicherweise steht diese Abnahme im Zusammenhang mit der deutlichen Reduzierung der ausgeführten körperlichen und sportlichen Aktivität in dieser Untergruppe während des Katamnesezeitraumes. In die Untersuchung wurden Patienten mit einer Angststörung und Patienten mit einer somatoformen Störung einbezogen. Es wurde in Hypothese 1c davon ausgegangen, dass bei beiden Patientengruppen ähnliche Bedingungen hinsichtlich der autonomen Regulation vorliegen, und sie in der Experimentalgruppe gleichermaßen auf die Trainingsintervention ansprechen. Das Signifikanzniveau wurde bei der Überprüfung auf 10% hoch gesetzt, um einen etwaigen Unterschied sicherer aufzuzeigen. Die Hypothese lässt sich als bestätigt ansehen, da im Gruppenvergleich keine signifikanten Unterschiede bezüglich eines der kardiovaskulären Parameter vorhanden waren. Dies stützt die Annahme, dass die häufig bestehende eingeschränkte kardiopulmonale Leistungsfähigkeit bei Patienten beider Störungsbilder, die sich aus einem 157 Diskussion durch Schonverhalten bedingten Bewegungsmangel entwickelt, mit ähnlichen Mustern autonomer Regulation bzw. Dysregulation verbunden ist (vgl. Abschnitt 3.3.1 und 3.3.2). 8.3 Subjektiv eingeschätzter Rehabilitationserfolg Der Fragebogen zur Beurteilung der Rehabilitation wird jedem Patienten nach Abschluss der Behandlung ausgehändigt, um eine eigene Einschätzung jedes Einzelnen zu erhalten, inwieweit die Rehabilitationsbehandlung erfolgreich war oder nicht. Im Rahmen der erwarteten physiologischen Verbesserungen wurde in Hypothese 2 eine Steigerung des subjektiv eingeschätzten Rehabilitationserfolges durch die Intervention des Ausdauertrainings angenommen. Diese Annahme lässt sich im Vergleich zwischen der Experimental- und der Kontrollgruppe nicht stützen. Auf Mittelwertsebene stuft die Experimentalgruppe ihren Rehabilitationserfolg in fünf von sechs Bereichen zwar höher ein als die Kontrollgruppe, die Unterschiede erreichen jedoch nicht das Signifikanzniveau. Der klinikeigene Fragebogen dient zu einer ersten Einschätzung und erfasst Veränderungen wenig sensitiv. Zudem werden nur Patienten einbezogen, die den jeweiligen erfragten Bereich vor der Rehabilitation als problematisch für sich einschätzen. Dadurch verringert sich wie in der vorliegenden Untersuchung die Fallzahl deutlich, so dass es schwierig ist, Unterschiede in der subjektiven Einschätzung statistisch signifikant abzubilden. 8.4 Psychometrische Parameter Durch das zusätzliche Ausdauertraining wurden laut Hypothese 3 Verbesserungen psychischer Parameter und Parameter der Befindlichkeit angenommen, unter denen insbesondere eine affektive Verbesserung im Sinne einer reduzierten Angst- und depressiven Symptomatik erwartet wurde. Während für die Gesamtgruppe eine signifikante Verbesserung sowohl der Angst- als auch der depressiven Symptomatik vom ersten zum zweiten und vom ersten zum dritten Messzeitpunkt erreicht wurde, lagen im Gruppenvergleich keine signifikanten Unterschiede zwischen Experimental- und Kontrollgruppe vor. Klinisch gesehen verbesserte sich die Angstsymptomatik in der Gruppe, die das Ausdauertraining absolvierte, allerdings entscheidend. Während die Angstausprägung zu Beginn des Trainings im klinisch auffälligen Bereich lag, senkte sich die Symptomatik zum zweiten Messzeitpunkt bis hin zur klinischen Unauffälligkeit. Selbst in der Katamneseerhebung erwies sich die Angstsymptomatik als klinisch 158 Diskussion unauffällig. Bei der mit dem SCL90-R erfassten Ängstlichkeit und der phobischen Angst lässt sich der Zusammenhang von zusätzlichem Ausdauertraining und Reduzierung der Angstsymptomatik belegen. In beiden Skalen ist die Ausprägung der Symptomatik in der Experimentalgruppe bei der Katamneseuntersuchung geringer ausgeprägt als in der Kontrollgruppe, wie die mittleren Effektstärken zeigen. Eine signifikante Reduktion der Angst durch ein mehrwöchiges, moderates Ausdauertraining fanden DILORENZO et al. (1999) bei gesunden, inaktiven Probanden und BROOCKS et al. (1998) bei Patienten mit Panikstörung. Die eindeutige Befundlage dieser Untersuchungen kann darauf zurückgeführt werden, dass die inaktive Kontrollgruppe im Gegensatz zur Kontrollgruppe der vorliegenden Studie ihre körperliche Aktivität während des Untersuchungszeitraums nicht gesteigert hat. Die Befindlichkeit und subjektiv erlebte Gesundheit der Patienten war zu Beginn der Untersuchung sehr stark eingeschränkt, wie der Vergleich mit den Normwerten zeigt (s. Abbildung 7.9). Während die Gesamtgruppe sich in allen Skalen und den drei globalen Kennwerten der SCL90-R sowie allen Skalen im SF-36 zum zweiten und zum dritten Messzeitpunkt verbessert hat, scheint die Experimentalgruppe vor allem im Katamnesezeitraum vom Ausdauertraining zu profitieren. Die Grundsätzliche psychische Belastung als globaler Kennwert zeigte sich sechs Monate nach Beendigung der Rehabilitationsbehandlung in der Experimentalgruppe niedriger als in der Kontrollgruppe, was durch die Effektstärke belegt ist. Die körperlichen Schmerzen, die im SF-36 und die Somatisierung, die in der SCL90-R erfasst sind, waren in der Experimentalgruppe zum zweiten bzw. dritten Messzeitpunkt niedriger als in der Kontrollgruppe. Da die Wahrnehmung und Fehlinterpretation körperlicher Sensationen im Mittelpunkt beider Störungsbilder steht (s. Abschnitt 2.1.3.1. und 2.2.3.1), scheint das Ausdauertraining eine zentrale Symptomatik positiv und nachhaltig zu beeinflussen. Die Teilnehmer der Ausdauergruppe nahmen sich allgemein als gesünder und vitaler wahr. Diese Effekte auf der Ebene der Körperfunktionen (im Sinne der ICF, s. 2.1.2.1 und 2.2.2.1) scheinen darüber hinaus Einfluss auf Bereiche der Aktivitäten und der Partizipation genommen zu haben, da die Patienten der Experimentalgruppe zum zweiten bzw. dritten Messzeitpunkt nach Absolvieren des Ausdauertrainings ihre soziale Funktionsfähigkeit (SF-36) höher und ihre Unsicherheit im Sozialkontakt (SCL90-R) niedriger einschätzten als die Patienten der Kontrollgruppe. Die Ergebnisse stehen im Einklang mit anderen veröffentlichten Studienergebnissen (s. 4.3.4.), 159 Diskussion denen zufolge sich durch eine Leistungssteigerung mittels eines Ausdauertrainings bei Gesunden eine Verbesserung der Schmerztoleranz und Vitalität (ANSHEL & RUSSELL, 1994), bei Patienten mit Fibromyalgie eine Steigerung des allgemeinen subjek- tiven Empfindens, eine Reduktion der Schmerzsymptomatik und Müdigkeit (WIGERS et al., 1996) und der Klagsamkeit im SCL90-R (MCCAIN et al., 1988) erzielen lassen. Dabei scheinen die Verbesserungen nicht unbedingt von einem Anstieg der kardiovaskulären Leistungsfähigkeit abzuhängen (LAFONTAINE et al., 1992). In einer Untersuchung von PETERS et al. (2002) wurde bei Patienten mit anhaltenden, unerklärbaren körperlichen Symptomen eine Verbesserung der körperlichen Symptome, der Somatisierung, der Angst und Depressivität (HADS) sowie der gesundheitsbezogenen Lebensqualität (SF-36) nach einem Ausdauertraining festgestellt, obwohl die Leistungsfähigkeit unverändert blieb. Die Wahrnehmung eigener körperlicher Leistungsfähigkeit scheint in Zusammenhang mit einer gesteigerten Befindlichkeit und einem verbesserten affektiven Zustand mindestens genauso wichtig zu sein wie die messbare aerobe Ausdauerleistungsfähigkeit (PLANTE, LANTIS & CHECA, 1998). 8.5 Kardiovaskuläre Stress-Reaktivität Hypothese 4 liegt die Annahme zugrunde, dass die kardiovaskuläre StressReaktivität bedingt durch das Ausdauertraining in der Experimentalgruppe zum zweiten und dritten Messzeitpunkt niedriger ist als in der Kontrollgruppe. Als Reaktivität wird die Differenz zwischen einer Erhebung unter Ruhebedingungen und einer Erhebung unter experimenteller Belastungsvorgabe, in der vorliegenden Studie ein Reaktionstest, verstanden. Die Reaktivitätswerte der Baroreflexsensitivität waren in der Experimentalgruppe, über den gesamten Untersuchungszeitraum gemittelt, signifikant niedriger als in der Kontrollgruppe. Es ist davon auszugehen, dass dieser Unterschied durch die ungleichen Ausgangswerte bedingt ist. Der Gruppenvergleich im zeitlichen Verlauf zeigte keine signifikanten Unterschiede, so dass entgegen der Hypothese kein Hinweis für die Senkung der auf die Baroreflexsensitivität bezogenen Stress-Reaktivität durch das Ausdauertraining gegeben ist. Regressionsanalytisch wurde allerdings ein hochsignifikanter Zusammenhang zwischen der sportlichen Aktivität und der Reaktivität der Baroreflexsensitivität belegt (s. Tabelle 7.45). Ein Zuwachs sportlicher Aktivität, unabhängig davon, ob als Teilnehmer der Experimentaloder Kontrollgruppe, hängt mit einer niedrigeren, auf die Baroreflexsensitivität bezogenen, Stress-Reaktivität zusammen. 160 Diskussion Bezüglich der Parameter der Herzratenvariabilität gab es ebenfalls keine signifikanten Unterschiede zwischen der Experimental- und Kontrollgruppe. Die kleinen Effektstärken stützen die Aussage, dass kein Effekt des Ausdauertrainings auf die StressReaktivität zu verzeichnen war. Auffällig ist die signifikante Abnahme der Reaktivitätswerte der Herzratenvariabilität im Gesamtspektrum und im High frequency-Band für die Gesamtgruppe vom zweiten zum dritten Messzeitpunkt. Die Stress-Reaktivität zeigte sich im unmittelbaren Anschluss an die Rehabilitationsbehandlung nicht verbessert, sondern erst im Katamnesezeitraum. Die Regressionsanalyse zeigt einen hochsignifikanten Zusammenhang zwischen sportlicher Aktivität und der Herzratenvariabilität (s. Tabelle 7.45). Je höher der Zuwachs an sportlicher Aktivität im Untersuchungszeitraum, desto niedriger ist die Stress-Reaktivität für die Herzratenvariabilität im Gesamtspektrum sowie in den parasympathischen Parametern des High frequency- und Respiratorischen Bands. Die Variabilität sinkt somit bei Belastung nicht mehr so stark ab im Sinne besserer Bearbeitungsressourcen der Patienten. Die sportliche Aktivität wirkt damit einem altersbedingten Anstieg der Stress-Reaktivität entgegen. In den bisherigen Studien (s. Abschnitt 4.3.2) wurde der Zusammenhang zwischen körperlicher Leistungsfähigkeit und Stress-Reaktivität fast ausschließlich für die Parameter Herzrate und Blutdruck untersucht. Die Querschnittstudien zeigen, dass geringere kardiovaskuläre Reaktionen auf akute Stressbelastungen mit einer höheren Ausdauerleistungsfähigkeit verbunden sind (HOLMES & ROTH, 1985; LIGHT et al., 1987; STEPTOE et al., 1993). Einige kontrollierte und randomisierte Längsschnittstudien belegen absenkende Effekte eines Ausdauertrainings auf die Stress-Reaktivität (BLUMENTHAL et al., 1990; DE GEUS et al., 1996; SPALDING et al., 2004). Der Zusammenhang von körperlicher Aktivität bzw. Leistungsfähigkeit und den Parametern der Reaktivität autonomer Regulation wie die Herzratenvariabilität und die Baroreflexsensitivität ist noch gänzlich ungeklärt. ROSSY & THAYER (1998) fanden in einer Querschnittsuntersuchung bei gesunden, jungen Menschen eine bessere kardiovaskuläre Reaktivität im Sinne einer höheren Herzratenvariabilität im Gesamtspektrum und im High frequency-Band bei den sehr aktiven Probanden. SHARMA, DEEPAK, BIJLANI & RAO (2004) fanden nach einem 15tägigen Training Veränderungen der sympathischen, nicht aber der parasympathischen Reaktivität. Diese ersten Ergebnisse deuten auf einen Zusammenhang zwischen vermehrter körperlicher Aktivi161 Diskussion tät und einer niedrigeren Stress-Reaktivität der Herzratenvariabilität hin, wie er für die Parameter Herzrate und Blutdruck bereits belegt wurde. Die vorliegende Untersuchung stützt diese These und gibt Anlass zu der Annahme, dass ein ähnlicher Zusammenhang zwischen sportlicher Aktivität und der Stress-Reaktivität der Baroreflexsensitivität als zentraler Index autonomer Regulation besteht. 8.6 Ausblick Die zentrale Annahme der vorliegenden Untersuchung, die autonome Dyregulation bei Patienten mit einer Angst- oder somatoformen Störung durch ein moderates, aerobes Ausdauertraining normalisieren zu können, wurde nicht bestätigt. Allerdings konnte für die beiden beschriebenen Störungsbilder der Zusammenhang zwischen einer höheren sportlichen Aktivität und einer verbesserten autonomen Regulation, erstmals auch einer verbesserten Stress-Reaktivität aufgezeigt werden. Dieses Ergebnis besitzt eine hohe klinische Relevanz, da eine erhöhte kardiovaskuläre Reaktivität in Verbindung mit der Entwicklung einer Hypertonie (FREDRIKSON & MATTHEWS, 1990) und einer koronaren Herzkrankheit steht (KRANTZ & MANUCK, 1984). Eine autonome Dysregulation im Sinne einer reduzierten Herzratenvariabilität und Baroreflexsensitivität erhöht als unabhängiger Risikoparameter die Mortalität (OSTERZIEL et al., 1995; MORTARA et al., 1997) aufgrund herzbedingter und anderer Todesursachen wie Krebserkrankungen (DEKKER et al., 1997). Daher ist es dringend erforderlich, Möglichkeiten zur Normalisierung bestehender Dysregulation bzw. primärpräventiv die Entstehung einer solchen Beeinträchtigung zu verhindern. Sportliche Aktivität scheint ein solches Mittel darzustellen. Es ist zudem kostengünstig und ohne große Nebenwirkungen mit der Möglichkeit, psychische Symptome und Befindlichkeitsparameter positiv zu beeinflussen, anzuwenden. Durch körperliche Aktivität wird ein zentraler Faktor in der Entstehung und Aufrechterhaltung von Angst- und somatoformen Störungen beeinflusst, nämlich die durch Schonverhalten eingeschränkte körperliche Leistungsfähigkeit verbunden mit einer verzerrten Wahrnehmung und Interpretation körperlicher Sensationen. Um die Effekte einer Trainingsintervention auf die autonome Regulation bestimmen zu können, werden Untersuchungen benötigt, die eine Steigerung der Aktivität in der Kontrollgruppe ausschließen. Die Voraussetzungen lassen sich eher in Studien außerhalb eines klinischen Settings erfüllen. Gleichzeitig lassen sich so die Einflüsse anderer Therapieformen gänzlich ausschließen. In der vorliegenden Studie wurde davon ausgegangen, dass sowohl die Patien162 Diskussion ten der Experimental- als auch der Kontrollgruppe im Mittel eine vergleichbare therapeutische Behandlung erfahren, obwohl konfundierende Effekte nicht gänzlich ausgeschlossen werden konnten. Darüber hinaus ist ein Vergleich unterschiedlicher Aktivitätsinterventionen notwendig, um ein Dosierungsschema für die effektivste Beeinflussung der autonomen Regulation durch körperliche Aktivität zu entwickeln. Von klinischer Relevanz wären katamnestische Erhebungen über einen längeren Zeitraum, um die zeitliche Stabilität positiver Effekte sicher zu stellen. Bei der Planung zukünftiger Untersuchungen sollte verstärkt das Problem der Weiterführung des Trainings berücksichtigt werden. In der vorliegenden Studie ist das Weiterführen des Trainings bei einem Teil der Patienten durch die Hinführung zum eigenständigen Training während der klinischen Behandlung und dem anschließenden monatlichen Telefonkontakt gut gelungen. Ausgerechnet bei den Patienten mit einer Beeinträchtigung der Regulation erwies es sich als schwierig, das Training eigenständig weiter zu führen. Deshalb sollte in zukünftigen Untersuchungen ein Augenmerk darauf gelegt werden, wie mit den Patienten auch unter Einbeziehung bestehender Bewegungsangebote wie Lauf- bzw. WalkingTreffs oder Gruppen im Sportverein ein „eigenverantwortliches, selbständiges Bewegungsverhalten am Heimatort“ (PAHMEIER, 2000) entwickelt werden kann. 163 Zusammenfassung 9 Zusammenfassung Angst- und somatoforme Störungen stellen zwei klinisch problematische und besonders gefährdete Patientengruppen dar. Bei einem bedeutenden Anteil der Betroffenen liegen gestörte autonome Regulationsprozesse vor, die mit einer durch Schonverhalten verminderten körperlichen Leistungsfähigkeit sowie einer verzerrten Wahrnehmung und Interpretation körperlicher Sensationen, insbesondere kardiovaskulärer Symptome, verbunden sind. Da regelmäßiges Ausdauertraining bei gesunden Probanden die autonome Regulation zu verbessern scheint, stellt sich die Frage, ob eine autonome Dysregulation bei Patienten mit einer Angst- oder somatoformen Störung durch ein moderates, aerobes Ausdauertraining normalisiert und eine Verbesserung der psychischen Befindlichkeit und des Rehabilitationserfolges bewirkt werden kann. In der vorliegenden Studie wurde diese Fragestellung an Patienten mit einer Angst- und Patienten mit einer somatoformen Störung in einer Psychosomatischen Fachklinik untersucht. Die zentralen Indices kardiovaskulärer autonomer Regulation Herzratenvariabilität und Baroreflexsensitivität wurden unter Ruhe und Belastung (Reaktionstest) frequenzanalytisch bestimmt, und die Stress-Reaktivität aus der Differenz berechnet. Die körperliche Leistungsfähigkeit wurde in einer fahrradergometrischen Belastungsuntersuchung nach dem WHO-Schema bestimmt. Psychometrische Parameter wurden mit der Symptom Checklist, dem Fragebogen zum Gesundheitszustand und der Hospital Anxiety and Depression Scale erhoben. Das Aktivitätsverhalten wurde mit dem Freiburger Fragebogen zur körperlichen Aktivität erfragt. Alle Daten wurden zu Beginn der Rehabilitationsbehandlung, vier Wochen später und als Katamnese sechs Monate später erhoben. Zum zweiten Messzeitpunkt wurde der subjektiv eingeschätzte Rehabilitationserfolg mit dem Fragebogen zur Beurteilung der Rehabilitation erfragt. An der Studie beteiligten sich 139 Patienten, 106 weiblich, durchschnittlich 43,8 Jahre alt, 167 cm groß und mit einem BMI von 24,1 kg/m². Die Patienten wurden getrennt nach Geschlecht und Störungsbild per Zufallslisten randomisiert der Experimental- bzw. Kontrollgruppe zugeteilt. Als Intervention wurde mit der Experimentalgruppe dreimal wöchentlich über vier Wochen ein 30minütiges aerobes Ausdauer164 Zusammenfassung training durchgeführt. Die Trainingsintensität wurde anhand der ersten Ergometrie mit 70% der Leistung festgelegt, die der metabolischen Intensität von 4 mmol/l Blutlaktat entsprach. Die individuelle Trainingsherzfrequenz sollte mit Hilfe eines Herzfrequenzmessers während des Trainings konstant gehalten werden. Die Kontrollgruppe erhielt über die klinische Standardbehandlung hinaus keine zusätzliche Intervention. Anhand des Medians der Baroreflexsensitivität in der ersten Ruhemessung wurde die Gruppe beim Cut-Off-Point von 6,819 ms/mmHg halbiert, so dass sich sowohl für die Experimental- als auch die Kontrollgruppe jeweils eine Gruppe mit unauffälliger autonomer Regulation und eine Gruppe mit autonomer Dysfunktion bildeten. Hinsichtlich der Kontrollvariablen gab es lediglich einen signifikanten Altersunterschied der Gruppen dysfunktional vs. normalreguliert, so dass das Alter als Kovariable bei der statistischen Auswertung berücksichtigt wurde. Bei einer Drop out-Rate von 33% absolvierten 93 Patienten alle drei Untersuchungen. Die Patienten der Experimentalgruppe zeigten eine signifikant höhere Aktivitätssteigerung als die Kontrollgruppe zum zweiten und dritten Messzeitpunkt bezüglich ihrer gesamten körperlichen Aktivität (T2: H(1,93) = 12,42, p < ,001; T3: H(1,93) = 14,73, p < ,001) und ihrer sportlichen Aktivität (T2: H(1,93) = 17,04, p = ,000; T3: H(1,93) = 9,14, p < ,003). Die Spannweite innerhalb beider Gruppen war auffällig hoch. Die maximale Leistungsfähigkeit nahm in der Experimentalgruppe signifikant vom ersten zum zweiten und zum dritten Messzeitpunkt zu und unterschied sich signifikant von der Leistungsfähigkeit in der Kontrollgruppe (F(2,172) = 4,58; p < ,002). Hinsichtlich der Herzfrequenz und des Laktatwertes bei festgelegten Stufen unterschieden sich die Gruppen nicht signifikant voneinander. Die Herzratenvariabilität, Baroreflexsensitivität und die kardiovaskuläre StressReaktivität zeigten sich im Vergleich der beiden beeinträchtigten Gruppen in der Varianzanalyse nicht signifikant unterschiedlich. Mit einer mittleren Effektstärke lag die Herzratenvariabilität im gesamten Spektrum in Ruhe (Cohen’s D = 0,44), die im Mid frequency-Band unter Ruhe (Cohen’s D = 0,53) und Belastung (Cohen’s D = 0,49) sowie die Baroreflexsensitivität in Ruhe (Cohen’s D = 0,49) jeweils zum dritten Messzeitpunkt in der Kontrollgruppe höher als in der Experimentalgruppe. 165 Zusammenfassung Um die sportliche Aktivität unabhängig von der Gruppenzugehörigkeit zu berücksichtigen, wurden regressionsanalytisch die Zusammenhänge zwischen einem Zuwachs an sportlicher Aktivität im gesamten Untersuchungszeitraum und den kardiovaskulären Parametern berechnet. Dabei wurde das Alter auspartialisiert, um mögliche verzerrende Alterseffekte auszuschließen. Es zeigten sich hochsignifikante Zusammenhänge zwischen einer höheren sportlichen Aktivität und, gemessen in Ruhe, einer höheren Herzratenvariabilität im Gesamtspektrum (F(2,86) = 6,08, p = ,002), im High frequency-Band (F(2,86) = 7,89, p = ,001), im Mid frequency-Band (F(2,86) = 4,85, p = ,004) und im Respiratorischen Band (F(2,86) = 10,68, p = ,000) sowie einer höheren Baroreflexsensitivität (F(2,83) = 13,04, p = ,000). Die sportliche Aktivität wirkte der altersbedingten Minderung autonomer Regulation entgegen. Unter Belastung wurde ausschließlich ein Zusammenhang zwischen einer höheren sportlichen Aktivität und einer höheren Herzratenvariabilität im Respiratorischen Band (F(2,87) = 3,99, p = ,033) gefunden. Eine niedrigere Stress-Reaktivität zeigte sich hinsichtlich der Herzratenvariabilität im Gesamtspektrum (F(2,86) = 5,66, p = ,002), im High frequency-Band (F(2,86) = 8,66, p = ,000) und im Respiratorischen Band (F(2,86) = 10,16, p = ,000) sowie der Baroreflexsensitivität (F(2,80) = 3,72, p = ,010) hochsignifikant mit einer höheren sportlichen Aktivität verbunden. Der subjektiv eingeschätzte Rehabilitationserfolg unterschied sich nicht signifikant in den beiden Gruppen. Für die psychometrischen Parameter zeigten sich varianzanalytisch keine signifikanten Unterschiede zwischen der Experimental- und Kontrollgruppe, jedoch in der Berechnung der Effektstärke nach Cohen. Mittlere Effekte zeigten katamnestisch in der Symptom Checklist für die Grundsätzliche psychische Belastung als globaler Kennwert (Cohen’s D = 0,42) sowie für die Skalen Somatisierung (T2 und T3: Cohen’s D = 0,49), Zwanghaftigkeit (Cohen’s D = 0,41), Unsicherheit im Sozialkontakt (Cohen’s D = 0,44), Ängstlichkeit (Cohen’s D = 0,41) und Phobische Angst (Cohen’ D = 0,45) eine geringere subjektive Belastung in der Experimentalgruppe. Dem entsprechend fanden sich im Fragebogen zum Gesundheitszustand bedeutende Verbesserungen in der Experimentalgruppe bezüglich der Skalen Körperliche Schmerzen (T2: Cohen’s D = 0,52; T3: Cohen’s D = 0,63), Vitalität (T2: Cohen’s D = 0,56; T3: Cohen’s D = 0,40) und Soziale Funktionsfähigkeit (T2: Cohen’s D = 0,43). Die Senkung der Symptomatiken im HADS erreichte trotz klinischer Relevanz nicht das festgelegte Signifikanzniveau. 166 Zusammenfassung Die zentrale Annahme der vorliegenden Untersuchung, die autonome Dysregulation bei Patienten mit einer Angst- oder somatoformen Störung durch ein moderates, aerobes Ausdauertraining normalisieren zu können, wurde nicht bestätigt. Allerdings konnte für diese beiden Störungsbilder der Zusammenhang zwischen einer höheren sportlichen Aktivität und einer verbesserten autonomen Regulation, erstmals auch einer verbesserten Stress-Reaktivität aufgezeigt werden. Dieses Ergebnis unterstreicht im Hinblick auf die hohen Risiken einer autonomen Dysfunktion die Notwendigkeit, gezielte sportliche Aktivität als einen zentralen Baustein in der Behandlung von Patienten mit Angst- und Patienten mit somatoformen Störungen zu etablieren. 167 Literatur 10 Literatur Ainsworth, B.E., Haskell, W.L., Leon, A.S., Jacobs, D.R., Jr., Montoye, H.J., Sallis, J.F. & Paffenbarger, R.S., Jr. (1993). Compendium of physical activities: Classification of energy costs of human physical activities. Medicine Science of Sports and Exercise, 25, 71-80. Ainsworth, B.E., Haskell, W.L., Whitt, M.C., Irwin, L., Swartz, A.M., Strath, S.J., O’Brien, W.L., Bassett, D.R., Jr., Schmitz, K.H., Emplaincourt, P.O., Jacobs, D.R., Jr. & Leon, A.S. (2000). Compendium of physical activities: An update of activity codes and MET intensities. Medicine Science of Sports and Exercise, 32 (Suppl. 9), S498-S516. Akselrod, S., Gordon, D., Madwed, J.B., Snidman, N.C., Shannon, D.C. & Cohen, R.J. (1985). Hemodynamic regulation: investigation by spectral analysis. American Journal of Physiology, 249 (4 Pt 2), H867-H875. Al-Ani, M., Munir, S.M., White, M., Townend, J. & Coote, J.H. (1996). Changes in R-R variability before and after endurance training measured by power spectral analysis and by the effect of isometric muscle contraction. European Journal of Applied Physiology and Occupational Physiology, 74, 397-403. Amano, M., Kanda, T., Ue, H. & Moritani, T. (2001). Exercise training and automatic nervous system activity in obese individuals. Medicine Science in Sports and Exercise, 33, 1287-1291. Andrews, G., Hall, W., Teesson, M. & Henderson, S. (1999). The mental health of Australians: National Survey of Mental Health and Wellbeing. Report 2. Canberra: Commonwealth Department of Health and Aged Care. Anshel, M.H. & Russell, K.G. (1994). Effect of aerobic and strength training on pain tolerance, pain appraisal and mood of unfit males as a function of pain location. Journal of Sports Sciences, 12, 535-547. Asbury, A. K. (1991). Diseases of the peripheral nervous system. In J.D. Wilson, E. Braunwald, K.J. Isselbacher, R.G. Petersdorf, J.B-Martin, A.S. Fanci & R. Roof (Eds.), Harrison’s Principles of Internal Medicine (pp. 2096-2107). New York: McGraw-Hill. Asmundson, G.J., Norton, G.R., Wilson, K.G. & Sandler, L.S. (1994). Subjective symptoms and cardiac reactivity to brief hyperventilation in individuals with high anxiety sensitivity. Behaviour Research and Therapy, 32, 237-241. Bandelow, B. (2001). Panik und Agoraphobie. Diagnose, Ursachen, Behandlung. Wien: Springer. Barney, J.A., Ebert, J.A., Groban, L., Farrell, P.A., Hughes, C.V. & Smith, J.J. (1988). Carotid baroreflex responsiveness in high-fit and sedentary young men. Journal of Applied Physiology, 65, 2190-2194. 168 Literatur Barsky, A.J. (1992). Amplification, somatization, and the somatoform disorders. Psychosomatics, 33, 28-34. Beck, A.T., Ward, C.H., Mendelson, M., Mock, J. & Erbaugh, J. (1961). An inventory for measuring depression. Archives of General Psychiatry, 4, 561-571. Beneke, R., Boldt, F., Richter, T., Kress, A., Leithäuser, R. & Behn, C. (1994). Laktatmessung in der Sportmedizin – drei Messgeräte im Vergleich. Deutsche Zeitschrift für Sportmedizin, 45, 60-69. Bennet, R.M., Clark, S.R., Goldberg, L., Nelson, D., Bonafede, R.P., Porter, J. & Specht, D. (1989). Aerobic fitness in patients with fibrositis. A controlled study of respiratory gas exchange and 133xenon clearance from exercise muscle. Arthritis and Rheumatism, 32, 454-460. Bernardi, L., Passino, C., Robergs, R. & Appenzeller, O. (1997). Acute and persistent effects of a 46kilometre wilderness trail run at altitude: cardiovascular autonomic modulation and baroreflexes. Cardiovascular Research, 34, 273-280. Berntson, G.G., Bigger, T., Dwain, J.R., Eckberg, L., Grossman, P., Kaufmann, P.G., Malik, M., Nagaraja, H.N., Porges, S.W., Saul, J.P., Stone, P.H. & Van der Molen, M.W. (1997). Heart rate variability: Origins, methods, and interpretive caveats. Psychophysiology, 34, 623-648. Berntson, G.G., Sarter, M. & Cacioppo, J.T. (1998). Anxiety and cardiovascular reactivity: the basal forebrain cholinergic link. Behavioural Brain Research, 94, 225-248. Bieling, H.B. (1991). BonnDet – Benutzerhandbuch. Köln: Autor. Bigger, J.T. Jr, Fleiss, J.L., Steinman, R.C., Rolnitzky, L.M., Kleiger, R.E. & Rottmann, J.N. (1992). Frequency domain measures of heart period variability and mortality after myocardial infarction. Circulation, 85, 164-171. Blumenthal, J.A., Fredrikson, M., Kuhn, C.M., Ulmer, R.L., Walsh-Riddle, M. & Appelbaum, M. (1990). Aerobic exercise reduces levels of cardiovascular and sympathoadrenal responses to mental stress in subjects without prior evidence of myocardial ischemia. American Journal of Cardiology, 65, 93-98. Bonaduce, D., Petretta, M., Cavallaro, V., Apicella, C., Ianniciello, A., Romano, M., Breglio, R. & Marciano, F. (1998). Intensive training and cardiac autonomic control in high level athletes. Medicine and Science in Sports and Exercise, 30, 691-696. Bou-Holaigah, I., Calkins, H., Flynn, J.A., Tunin, C., Chang, H.C., Kan, J.S. & Rowe, P.C. (1997). Provocation of hypotension and pain during upright tilt table testing in adults with fibromyalgia. Clinical and Experimental Rheumatology, 15, 239-246. 169 Literatur Boutcher, S.H. & Stein, P. (1995). Association between heart rate variability and training response in sedentary middle-aged men. European Journal of Applied Physiology and Occupational Physiology, 70, 75-80. Broocks, A. (2000). Körperliche Aktivität und psychische Gesundheit: psychische und neurobiologische Effekte von Ausdauertraining bei Patienten mit Panikstörung und Agoraphobie. Monographien aus dem Gesamtgebiete der Psychiatrie, Bd. 99. Darmstadt: Steinkopff. Broocks, A., Bandelow, B., Pekrun, G., George, A., Meyer, T., Bartmann, U., Hillmer-Vogel, U. & Rüther, E. (1998). Comparison of aerobic exercise, clomipramine, and placebo in the treatment of panic disorder. American Journal of Psychiatry, 155, 603-609. Broocks, A., Meyer, T.F., Bandelow, B., George, A., Bartmann, U., Ruther, E. & Hillmer-Vogel, U. (1997a). Exercise avoidance und impaired endurance capacity in patients with panic disorder. Neurobiology, 36, 182-187. Broocks, A., Meyer, T.F., George, A., Pekrun, G., Hillmer-Vogel, U., Hajak, G., Bandelow, B. & Rüther, E. (1997b). Zum Stellenwert von Sport in der Behandlung psychischer Erkrankungen. Psychotherapie, Psychosomatik und medizinische Psychologie, 47, 379-393. Brooke, S.T. & Long, B.C. (1987). Efficiency of coping with a real-life stressor: A multimodal comparison of aerobic fitness. Psychophysiology, 24, 173-180. Brüggemann, T., Weiß, D. & Andresen, D. (1994). Spektralanalyse zur Beurteilung der Herzfrequenzvariabilität. Herzschrittmachertherapie & Elektrophysiologie, 5 (Suppl. 2), 19-24. Brunner, R.L., Maloney, M.J., Daniels, S., Mays, W. & Farrell, M. (1989). A controlled study of type A behavior and psychophysiologic responses to stress in anorexia nervosa. Psychiatry Research, 30, 223-230. Bullinger, M. & Kirchberger, I. (1998). SF-36 Fragebogen zum Gesundheitszustand. Göttingen: Hogrefe. Bundesarbeitsgemeinschaft für Rehabilitation (2003). Rahmenempfehlungen zur ambulanten Rehabilitation bei psychischen und psychosomatischen Erkrankungen. Frankfurt/Main: Autor. Burns, J.W., Johnson, B.J., Mahoney, N., Devine, J. & Pawl, R. (1998). Cognitive and physical capacity process variables predict long-term outcome after treatment of chronic pain. Journal of Consulting and Clinical Psychology, 66, 434-439. Byrne, A. & Byrne , D.G. (1993). The effect of exercise on depression, anxiety and other mood states: A review. Journal of Psychosomatic Research, 37, 565-574. 170 Literatur Byrne, E.A., Fleg, J.L., Vaitkevicius, P.V., Wright, J. & Porges, S.W. (1996). Role of aerobic capacity and body mass index in the age-associated decline in heart rate variability. Journal of Applied Physiology, 82, 743-750. Carter, J.B., Banister, E.W. & Blaber, A.P. (2003). Effect of endurance exercise on autonomic control of heart rate. Sports Medicine, 33, 33-46. Cerutti, S., Bianchi, A.M. & Mainardi, L.T. (1995). Spectral analysis of the heart rate variabilità signal. In M. Malik & J.A. Camm (Eds.), Heart rate variability (pp. 63-74). New York: Futura Publishing. Charney, D.S., Breier, A., Jatlow, P.I. & Heninger, G.R. (1986). Behavioral, biochemical, and blood pressure responses to alprazolam in healthy subjects: Interactions with yohimbine. Psychopharmacology, 88, 133-140. Coats, A.J.S., Adamopoulos, S., Radaelli, A., McCance, A., Meyer, E., Bernardi, L., Solda, P.L., Davey, P., Ormerod, O., Forfar, C., Conway, J. & Sleight, P. (1992). Controlled trial of physical training in chronic heart failure. Exercise performance, hemodynamics, ventilation, and autonomic function. Circulation, 85, 2119-2131. Cohen, H., Neumann, L., Alhosshle, A., Kotler, M., Abu-Shakra, M. & Buskila, D. (2001). Abnormal sympathovagal balance in men with fibromyalgia. The Journal of Rheumatology, 28, 581-589. Cohen, H., Neumann, L., Kotler, M. & Buskila, D. (2001). Autonomic nervous system derangement in fibromyalgia syndrome and related disorders. The Israel Medical Association Journal, 3, 755-760. Cohen, H., Neumann, L., Shore, M., Amir, M., Cassuto, Y. & Buskila, D. (2000). Autonomic dysfunction in patients with fibromyalgia: application of power spectral analysis of heart rate variability. Seminars in Arthritis and Rheumatism, 29, 217-227. Dauchot, P. & Gravenstein, J.S. (1971). Effects on atropine on the electrocardiogram in different age groups. Clinical Pharmacology and Therapeutics, 12, 274-280. Davy, K.P., Willis, W.L. & Seals, D.R. (1997). Influence of exercise training on heart rate variability in post-menopausal women with elevated arterial blood pressure. Clinical Physiology, 17, 31-40. De Geus, E.J.C., Karsdorp, R., Boer, B., De Regt, G., Orlebeke, J.F. & Van Doornen, L.J.P. (1996). Effect of aerobic fitness training on heart rate variability and cardiac baroreflex sensitivity. Homeostasis, 37, 28-51. De Geus, E.J.C., Van Doornen, L.J.P., De Visser, D.C. & Orlebeke, J.F. (1990). Existing and training induced differences in aerobic fitness: Their relationship to physiological response patterns during different types of stress. Psychophysiology, 27, 457-478. De Marées, H. (2003). Sportphysiologie (9. vollständig überarbeitete u. erweiterte Aufl.). Köln: Sport und Buch Strauss. 171 Literatur De Meersman, R.E. (1992). Respiratory sinus arrhythmia alteration following training in endurance athletes. European Journal of Applied Physiology and Occupational Physiology, 64, 434-436. De Meersman, R.E. (1993). Heart rate variability and aerobic fitness. American Heart Journal, 125, 726-731. Dekker, J.M., Schouten, E.G., Klootwijk, P., Pool, J., Swenne, C.A. & Kromhout, D. (1997). Heart rate variability from short electrocardiographic recordings predicts mortality from all causes in middleaged and elderly men.The Zutphen Study. American Journal of Epidemiology, 145, 899-908. Dembrowski, T.M. (1986). Overview of classic and stress-related risk-factors : Relationship to substance effects on reactivity. In K.A. Matthews, S.M. Weiss, T. Detre, T.M. Dembrowski, B. Falkner, S.B. Manuck & R.B. Williams, Jr. (Eds.), Handbook of stress, reactivity, and cardiovascular disease (pp. 275-289). New York: John Wiley & Sons. Deutsches Institut für Medizinische Dokumentation und Information, DIMDI (Hrsg.). (2004). Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit (ICF) der Weltgesundheitsorganisation (WHO), deutschsprachige Internetfassung: www.dimdi.de/static/de/klassi/ICF/icf_dimdi_final_draft_1.pdf. Dilling, H., Mombour, W. & Schmidt, M.H. (Hrsg.). (1993). Internationale Klassifikation psychischer Störungen, ICD-10, Kapitel V (F), klinisch-diagnostische Leitlinien (S. 141-179). Bern: Huber. Dilling, H., Mombour, W., Schmidt, M.H. & Schulte-Markwort, E. (1994). Internationale Klassifikation psychischer Störungen, ICD-10, Kapitel V (F), Forschungskriterien (S. 115-135). Bern: Hans Huber. DiLorenzo, M., Bergman, P., Ropp, R., Brassington, G., Frensch, P. & LaFontaine, T. (1999). Longterm effects of aerobic exercise on psychological outcomes. Preventive Medicine, 28, 75-85. Dorheim, T.A., Rüddel, H., McKinney, M.E., Todd, G.L., Mellion, M.B., Buell, J.C. & Eliot, R.S. (1984). Cardiovascular response of marathoners to mental challenge. Journal of Cardiac Rehabilitation, 4, 476-480. Eaton, W.W., Kramer, M., Anthony, J.C., Dryman, A., Shapiro, S. & Locke, B.Z. (1989). The incidence of specific DIS/DSM-III mental disorders: data from the NIMH Epidemiologic Catchment Area Program. Acta Psychiatrica Scandinavica, 79, 163-178. Eckberg, D.L. & Fritsch, J.M. (1993). How should human baroreflexes be tested? News in Physiological Sciences, 8, 7-12. Eckberg, D.L. & Sleight, P. (1992). Human baroreflexes in health and disease. Oxford: Clarendon Press. 172 Literatur Ehlers, A., Margraf, J., Taylor, C.B. & Roth, W.T. (1988). Cardiovascular aspects of panic disorder. In T. Elbert, W. Langosch, A. Steptoe & D. Vaitl (Eds.), Behavioural Medicine in Cardiovascular Disorders (pp. 255-291). New York: Wiley. Esperer, H.D. (1994). Physiologische Grundlagen und pathophysiologische Aspekte der Herzfrequenzvariabilität beim Menschen. Herzschrittmachertherapie & Elektrophysiologie, 5 (Suppl. 2), 1-10. Essau, C.A., Conradt, J. & Petermann, F. (2000). Häufigkeit und Komorbidität Somatoformer Störungen: Ergebnisse der Bremer Jugendstudie. Zeitschrift für Klinische Psychologie und Psychotherapie, 29, 97-108. Fallen, E. & Kamath, M.V. (1995). Circadian rhythms of heart rate variability. In M. Malik & J.A. Camm (Eds.), Heart rate variability (pp. 293-310). New York: Futura Publishing. Ferscha, A., Pokan, R., Bachl, N. & Smekal, G. (1998). Herzfrequenzvariabilität in Ruhe und unter Belastung. Methodische Aspekte und deren Aussagekraft. Österreichisches Journal für Sportmedizin, 28, 3-35. Fillingim, R.B. & Blumenthal, J.A. (1992). Does aerobic fitness reduces stress responses? In J.R. Turner, A. Sherwood, & K.C. Light (Eds.), Individual differences in cardiovascular response to stress (pp. 203-217). New York: Plenum. Fiocchi, R., Fagard, R., Staessen, J., Vanhees, L. & Amery, A. (1985). Relationship between carotid baroreflex sensitivity, physical fitness and activity in cyclists. Journal of Hypertension, 3 (suppl. 3), S131-S133. Fleet, R., Lavoie, K. & Beitman, B.D. (2000). Is panic disorder associated with coronary artery disease? A critical review of the literature. Journal of Psychosomatic Research, 48, 347-356. Franke, G. (1995). SCL-90-R. Die Symptom-Checkliste von Derogatis – Deutsche Version - Manual. Göttingen: Beltz Test GmbH. Fredrikson, M. & Matthews, K.A. (1990). Cardiovascular responses to behavioral stress and hypertension: A meta-analytic review. Annals of Behavioral Medicine, 12, 30-39. Frey, I. & Berg, A. (1995). Freiburger Fragebogen zur körperlichen Aktivität. Freiburg: Autoren. Frey, I., Berg, A. & Keul, J. (1996). Notwendigkeit der Erfassung von körperlicher Aktivität. Deutsche Zeitschrift für Sportmedizin, 47, 591-594. Freyschuss, U., Hjemdahl, P., Juhlin-Dannfelt, A. & Linde, B. (1988). Cardiovascular and sympathoadrenal responses to mental stress: Influence of beta-blockade. American Journal of Physiology, 255 (6 Pt 2), H1443-H1451. 173 Literatur Friedman, B.H. & Thayer, J.F. (1998a). Anxiety and autonomic flexibility: a cardiovascular approach. Biological Psychology, 49, 303-323. Friedman, B.H. & Thayer, J.F. (1998b). Autonomic balance revisited: panic anxiety and heart rate variability. Journal of Psychosomatic Research, 44, 133-151. Friedman, B.H., Thayer, J.F., Borkovec T.D., Tyrrell, R.A., Johnson, B.-H. & Columbo, R. (1993). Autonomic characteristics of nonclinical panic and blood phobia. Biological Psychiatry, 34, 298310. Fromme, A., Geschwinde, C., Mooren, F.C., Thorwesten, L. & Völker, K. (2002) Auswirkungen eines zehnwöchigen Ausdauertrainings auf die Herzfrequenzvariabilität bei Laufeinsteigern. In K. Hottenrott (Hrsg.), Herzfrequenzvariabilität im Sport. Prävention – Rehabilitation – Training. (Bericht über das Symposium am 8. Dezember 2001 in Marburg, S. 89-94). Hamburg: Czwalina. Gallagher, D., Terenzi, T. & de Meersman, R. (1992). Heart rate variability in smokers, sedentary and aerobically fit individuals. Clinical Autonomic Research, 2, 383-387. Gallo, L., Maciel, B.C., Marin-Neto, J.A., Martins, L.E.B., Lima-Filho, E.C., Golfetti, R., Chacon, M.P.T. & Forti, V.A.M. (1995). Control of heart rate during exercise in health and disease. Brazilian Journal of Medical and Biological Research, 28, 1179-1184. Gerritsen, J., Dekker, J.M., TenVoorde, B.J., Bertelsmann, F.W., Kostense, P.J., Stehouwer, C.D.A., Heine, R.J., Nijpels, G., Heethaar, R.M. & Bouter, L.M. (2000). Glucose tolerance and other determinants of cardiovascular autonomic function: the Hoorn Study. Diabetologia, 43, 561-570. Gerritsen, J., Dekker, J.M., TenVoorde, B.J., Kostense, P.J., Heine, R.J., Bouter, L.M., Heethaar, R.M & Stehouwer, C.D. (2001). Impaired autonomic function is associated with increased mortality, especially in subjects with diabetes, hypertension, or a history of cardiovascular disease: the Hoorn Study. Diabetes Care, 24, 1793-1798. Goldsmith, R., Bigger, J.T., Steinman, R.C. & Fleiss, J.L. (1992). Comparison of 24-hour parasympathetic activity in endurance trained and untrained young men. Journal of the American College of Cardiology, 20, 552-558. Goldstein, D.S. (1987). Stress-induced activation of the sympathetic nervous system. Baillere’s Clinical Endocrinology and Metabolism, 1, 253-278. Gorman, J.M., Kent, J.M., Sullivan, G.M. & Coplan J.D. (2000). Neuroanatomical hypothesis of panic disorder. American Journal of Psychiatry, 157, 493-505. Grasbeck, A., Rorsman, B., Hagnell, O. & Isberg, P.E. (1996). Mortality of anxiety syndromes in a normal population. The Lundby Study. Neuropsychobiology, 33, 118-126. 174 Literatur Gregoire, J., Tuck, S., Yamamoto, Y. & Hughson, R.L. (1996). Heart rate variability at rest and exercise: Influence of age, gender and physical training. Canadian Journal of Physiology and Pharmacology, 21, 455-470. Haines, A.P., Imeson, J.D. & Meade, T.W. (1987). Phobic anxiety and ischaemic heart disease. British Medical Journal, 295, 297-299. Halle, M., Berg, A. & Hasenfuss, G. (2003). Sekundärprävention der koronaren Herzerkrankung. Körperliches Training als Therapiepfeiler. Deutsches Ärzteblatt, 100, B2213-B2216. Hamada, T., Koshino, Y., Misawa, T., Isaki, K. & Gejyo, F. (1998). Mitral valve prolapse and autonomic function in panic disorder. Acta Psychiatrica Scandinavica, 97, 139-143. Hand, I. (2005). Angststörungen. In R.-M. Frieboes, M. Zaudig & M. Nosper (Hrsg.), Rehabilitation bei psychischen Störungen (S. 183-191). München: Urban & Fischer. Hartl, L. (1995). A clinical approach to cardiac perception. In D. Vaitl & R. Schandry (Eds.), From the heart to the brain. The psychophysiology of circulation-brain interaction (pp. 251-263). Frankfurt/M.: Lang. Heck, H. (1990). Energiestoffwechsel und medizinische Leistungsdiagnostik. Studienbrief der Trainerakademie Köln des Deutschen Sportbundes, Bd. 8. Schorndorf: Hofmann. Heck, H. & Rosskopf, P. (1993). Die Laktat-Leistungsdiagnostik – valider ohne Schwellenkonzepte. Therapiewoche/TW Sport + Medizin: der Sportler in der Praxis, 5, 444-352. Heitkemper, M., Burr, R.L., Jarrett, M., Hertig, V., Lustyk, M.K. & Bond, E.F. (1998). Evidence for autonomic nervous system imbalance in women with irritable bowel syndrome. Digestive Diseases and Sciences, 43, 2093-2098. Hennersdorf, M.G. & Strauer, B.E. (2002). Autonome Dysfunktion bei Herzerkrankungen und Diabetes mellitus. Monitoring und Diagnostik. Der Internist, 43, 1065-1075. Herrmann, C., Buss, U. & Snaith, R.P. (Hrsg.). (1995). Hospital anxiety and depression scale: HADSD, deutsche Version, ein Fragebogen zur Erfassung von Angst und Depressivität in der somatischen Medizin. Bern: Hans Huber. Hilz, M.J., Stemper, B. & Neundörfer, B. (2000). Physiologie und Untersuchungsmethoden des Baroreflexes. Fortschritte der Neurologie. Psychiatrie, 68, 37-47. Hoffmann-La Roche AG, Urban & Schwarzenberg (Hrsg.). (1984). Roche Lexikon Medizin. München: Urban & Schwarzenberg. Hohage, H. & Gerhardt, U. (2000). Blutdruckvariabilität und Barorezeptorfunktion. Klinische und wissenschaftliche Relevanz. Medizinische Klinik, 95, 254-260. 175 Literatur Hohnloser, S.H. (1999). Untersuchung der Barorezeptorenfunktion. Deutsches Ärzteblatt, 96, 1365- 1368. Hollmann, W. & Hettinger, T. (2000). Sportmedizin – Grundlagen für Arbeit, Training und Präventivmedizin (4. völlig neu bearbeitete und erweiterte Aufl.). Stuttgart: Schattauer. Hollmann, W. & Löllgen, H. (2002). Bedeutung der körperlichen Aktivität für kardiale und zerebrale Funktionen. Deutsches Ärzteblatt, 99, B1152-B1154. Hollmann, W., Strüder, H.K. & Tagarakis, C.V.M. (2003). Körperliche Aktivität fördert Gehirngesundheit und –leistungsfähigkeit. Nervenheilkunde, 22, 467-474. Holmes, D.S. & Roth, D.L. (1985). Association of aerobic fitness with pulse rate and subjective responses to psychological stress. Psychophysiology, 22, 525-529. Holmes, D.S. & Roth, D.L. (1988). Effects of aerobic exercise training and relaxation training on cardiovascular activity during psychological stress. Journal of Psychosomatic Research, 32, 469474. Honzikova, N., Fiser, B. & Semrad, B. (2000). Critical value of baroreflex sensitivity determined by spectral analysis in risk stratification after myocardial infarction. Pacing and Clinical Electrophysiology, 23, 1965-1967. Hottenrott, K. (2002). Grundlagen zur Herzfrequenzvariabilität und Anwendungsmöglichkeiten im Sport. In K. Hottenrott (Hrsg.), Herzfrequenzvariabilität im Sport. Prävention – Rehabilitation – Training. (Bericht über das Symposium am 8. Dezember 2001 in Marburg, S. 9-26). Hamburg: Czwalina. Howorka, K., Pumprla, J., Haber, P., Koller-Strametz, J., Mondrzyk, J. & Schabmann, A. (1997). Effects of physical training on heart rate variability in diabetic patients with various degrees of cardiovascular autonomic neuropathy. Cardiovascular Research, 34, 206-214. Hull, E.M., Young, S.H. & Ziegler, M.G. (1984). Aerobic fitness affects cardiovascular and catecholamine responses to stressors. Psychophysiology, 21, 353-360. Hunt, S.M., McKenna, S.P. & McEwen, J. (1989). The Nottingham Health Profile: User’s manual. Manchester: Galen Research and Consultancy. Iellamo, F., Legramante, J.M., Massaro, M., Raimondi, G. & Galante, A. (2000). Effects of residential exercise training on baroreflex sensitivity and heart rate variability in patients with coronary artery disease: A randomized, controlled study. Circulation, 102, 2588-2592. Jeejeebhoy, F.M., Dorian, P. & Newman, D.M. (2000). Panic disorder and the heart: a cardiology perspective. Journal of Psychosomatic Research, 48, 393-403. 176 Literatur Jensen-Urstad, K., Saltin, B., Ericson, M., Storck, N. & Jensen-Urstad, M. (1997). Pronounced resting bradycardia in male elite runners is associated with high heart rate variability. Scandinavian Journal of Medicine & Science in Sports, 7, 274-278. Jensen-Urstad, K., Storck, N., Bouvier, F., Ericson, M., Linblad, L.E. & Jensen-Urstad, M. (1997). Heart rate variability in healthy subjects is related to age and gender. Acta physiologica Scandinavica, 160, 235-241. Jeschke, D. & Zeilberger, K. (2000). Körperliches Training bei koronarer Herzkrankheit. Der Internist, 41, 1374-1381. Karling, P., Nyhlin, H., Wiklund, U., Sjöberg, M., Olofsson, B.O. & Bjerle, P. (1998). Spectral analysis of heart rate variability in patients with irritable bowel syndrome. Scandinavian Journal of Gastroenterology, 33, 572-576. Kawachi, I., Sparrow, D., Vokonas, P.S. & Weiss, S.T. (1995). Decreased heart rate variability in men with phobic anxiety (data from the Normative Aging Study). The American Journal of Cardiology, 75, 882-885. Kelemen, J., Lang, E., Balint, G., Trocsanyi, M. & Müller, W. (1998). Orthostatic sympathetic derangement of baroreflex in patients with fibromyalgia. Journal of Rheumatology, 25, 823-825. Kenney, W.L. (1985). Parasympathetic control of resting heart rate: relationship to aerobic power. Medicine Science of Sports and Exercise, 17, 451-455. Kenney, W.L. (1988). Endurance training increases vagal control of heart rate. In C.O. Dotson & J.H. Humphrey (Eds.), Exercise physiology: current selected research (pp. 59-65). New York: AMS Press. Kessler, R.C., McGonagle, K.A., Zhao, S., Nelson, C.B., Hughes, M., Eshleman, S., Wittchen, H.-U. & Kendler, K.S. (1994). Lifetime and 12-month prevalence of DSM-III-R psychiatric disorders in the United States: Results from the National Comorbidity Survey. Archives of General Psychiatry, 51, 8-19. Klein, E., Cnaani, E., Harel, T., Braun, S. & Ben-Haim, S.A. (1995). Altered heart rate variability in panic disorder patients. Biological Psychiatry, 37, 18-24. Klerman, G.L, Hirschfeld, R. & Al, W.M. (1993). Panic anxiety and its treatments. Report of the World Psychiatric Association presidential educational program task force. Washington, DC: American Psychiatric Press. Klerman, G.L., Weissman, M.M., Quellette, R., Johnson, J. & Greenwald, S. (1991). Panic attacks in community. Social morbidity and health care utilization. The Journal of the American Medical Association, 265, 742-746. 177 Literatur Klingenheben, T., Credner, S., Grönefeld, G., Zabel, M., Li, Y. & Hohnloser, S.H. (1999). Kardialer autonomer Tonus zur Risikostratifizierung nach Myokardinfarkt: Ergebnisse einer prospektiven Langzeitstudie bei 411 konsekutiven Patienten. Zeitschrift für Kardiologie, 88, 400-409. Koepchen, H.P. (1982). Zentralnervöse und reflektorische Steuerung der Herzfrequenz. In B. Brisse & F. Binder (Hrsg.), Autonome Innervation des Herzens (S. 66-86). Darmstadt: Steinkopff. König, B.O., Schumacher, Y.O., Schmidt-Trucksäss, A. & Berg, A. (2002). Autonome cardiovaskuläre Kontrolle und Herzfrequenzvariabilität bei Ausdauerathleten, Kraftsportlern und untrainierten Normalpersonen. In K. Hottenrott (Hrsg.), Herzfrequenzvariabilität im Sport. Prävention – Rehabilitation – Training. (Bericht über das Symposium am 8. Dezember 2001 in Marburg, S. 75-87). Hamburg: Czwalina. Krantz, D.S. & Manuck, S.B. (1984). Acute psychophysiologic reactivity and risk of cardiovascular disease: A review and methodological critique. Psychological Bulletin, 96, 435-464. La Rovere, M.T., Bersano, C., Gnemmi, M., Specchia, G. & Schwartz, P.J. (2002). Exercise-induced increase in baroreflex-sensitivity predicts improved prognosis after myocardial infarction. Circulation, 106, 945-949. La Rovere, M., Bigger, J.T., Marcus, F.I., Mortara, A. & Schwartz, P.J. for the ATRAMI investigators (1998). Baroreflex sensitivity and heart rate variability in prediction of cardiac mortality after myocardial infarction. Lancet, 351, 478-484. Laederach-Hofmann, K., Mussgay, L., Wilde, T. & Rüddel, H. (2002). Autonome Neuropathie bei Patienten mit Somatisierungsstörungen. Psychotherapie, Psychosomatik, medizinische Psychologie, 52, 166-172. LaFontaine, T.P., DiLorenzo, T.M., Frensch, P.A., Stucky-Rop, R.C., Bergman, E.P. & McDonald, D.G. (1992). Aerobic exercise and mood. Sports Medicine, 13, 160-170. Langewitz, W., Bieling, H., Stephan, J.A. & Otten, H. (1987). A new self adjusting reaction time device (BonnDet) with high test-retest reliability. Journal of Psychophysiology, 1, 67-77. Lee, C.M., Wood, R.H. & Welsch, M.A. (2003). Influence of short-term endurance exercise training on heart rate variability. Medicine and Science in Sports and Exercise, 35, 961-969. Leitch, J.W., Newling, R.P., Basta, M., Inder, K., Dear, K. & Fletcher, P.J. (1997). Randomized trial of a hospital-based exercise training program after acute myocardial infarction: Cardiac autonomic effects. Journal of the American College of Cardiology, 29, 1263-1268. Levy, W., Cerqueira, M.D., Harp, G.D., Johannessen, K.A., Abrass, I.B., Schwartz, R.S. & Stratton, J.R. (1998). Effect of endurance exercise training on heart rate variability at rest in healthy young and older men. American Journal of Cardiology, 82, 1236-1241. 178 Literatur Light, K.C. (1989). Constitutional factors relating to differences in cardiovascular response. In N. Schneiderman, S.M. Weiss & P.G. Kaufmann (Eds.), Handbook of research methods in cardiovascular behavioral medicine (pp. 417-431). New York: Plenum. Light, K.C., Obrist, P.A., James, S.A. & Strogatz, D. (1987). Cardiovascular responses to stress: II. Relationships to aerobic exercise patterns. Psychophysiology, 24, 79-86. Lin, E., Goering, P.N., Lesage, A. & Streiner, D.L. (1997). Epidemiologic assessment of overmet need in mental health care. Social Psychiatry and Psychiatric Epidemiology, 32, 355-362. Loimaala, A., Huikuri, H.V., Kööbi, T., Rinne, M., Nenonen, A. & Vuori, I. (2003). Exercise training improves baroreflex sensitivity in type 2 diabetes. Diabetes, 52, 1837-1842. Loimaala, A., Huikuri, H.V., Oja, P., Pasanen, M, & Vuori, I. (2000). Controlled 5-mo aerobic training improves heart rate but not heart rate variability or baroreflex sensitivity. Journal of Applied Physiology, 89, 1825-1829. Lucini, D., Bertocchi, F., Malliani, A. & Pagani, M. (1996). A controlled study of the autonomic changes produced by habitual cigarette smoking in healthy subjects. Cardiovascular Research, 31, 633639. Maciel, B.C., Gallo Junior, L., Marin Neto, J.A., Lima Filho, E.C., Terra Filho, J. & Manco, J.C. (1985). Parasympathetic contribution to bradycardia induced by endurance training in man. Cardiovascular Research, 19, 642-648. Macor, F., Fagard, R. & Amery, A. (1996). Power spectral analysis of RR interval and blood pressure short-term variability at rest and during dynamic exercise: comparison between cyclists and controls. International Journal of Sports Medicine, 17 (3), 175-181. Mader, A., Liesen, H., Heck, H., Philippi, H. & Rost, R. (1976). Zur Beurteilung der sportspezifischen Ausdauerleistungsfähigkeit im Labor. Deutsche Zeitschrift für Sportmedizin, 27, 80-112. Maier, W., Linden, M. & Sartorius, N. (1996). Psychische Erkrankungen in der Allgemeinpraxis. Ergebnisse und Schlußfolgerungen einer WHO-Studie. Deutsches Ärzteblatt, 93, A1202-A1206. Malfatto, G., Facchini, M., Bragato, R., Branzi, G., Sala, L. & Leonetti, G. (1996). Short and long term effects of exercise training on the tonic autonomic modulation of heart rate variability after myocardial infarction. European Heart Journal, 17, 532-538. Malik, M. (1996). Heart rate variability. Standards of measurement, physiological interpretation and clinical use. Circulation, 93, 1043-1065. Malliani, A. (1995). Association of heart rate variability components with physiological regulatory mechanisms. In M. Malik & J.A. Camm (Eds.), Heart rate variability (pp. 173-188). New York: Futura Publishing. 179 Literatur Margraf, J. & Poldrack, A. (2000). Angstsyndrome in Ost- und Westdeutschland: Eine repräsentative Bevölkerungserhebung. Zeitschrift für Klinische Psychologie und Psychotherapie, 29, 157-169. Margraf, J. & Schneider, S. (1990). Panik. Angstanfälle und ihre Behandlung (2. überarbeitete Aufl.). Berlin: Springer. Martínez-Lavín, M., Hermosillo, A.G., Mendoza, C., Ortiz, R., Cajigas, J.C., Pineda, C., Nava, A. & Vallejo, M. (1997). Orthostatic sympathetic derangement in subjects with fibromyalgia. Journal of Rheumatology, 24, 714-718. Martínez-Lavín, M., Hermosillo, A.G., Rosas, M. & Soto, M.A. (1998). Circadian studies of autonomic nervous balance in patients with fibromyalgia. A heart rate variability analysis. Arthritis and Rheumatism, 41, 1966-1971. Martínez-Lavín, M., Koo, M., Meza, S., del-Campo, A.M., Hermosillo, A.G., Pineda, C., Amigo, M.C., Nava, A. & Drucker-Colin, R. (1999). Simultaneous studies of heart rate variability and polysomnography in patients with fibromyalgia. Arthritis and Rheumatism, 42 (Suppl. 9), S344. Massion, A.O., Warshaw, M.G. & Keller, M.B. (1993). Quality of life and psychiatric morbidity in panic disorder versus generalized anxiety disorder. American Journal of Psychiatry, 150, 600-607. McCain, G.A., Bell, D.A., Mai, F.M. & Halliday, P.D. (1988). A controlled study of the effects of a supervised cardiovascular fitness training program on the manifestations of primary fibromyalgia. Arthritis and Rheumatism, 31, 1135-1141. McCraty, R., Atkinson, M., Tomasino, D. & Stuppy, W.P. (2001). Analysis of twenty-four hour heart rate variability in patients with panic disorder. Biological Psychology, 56, 131-150. McDonald, D.G. & Hodgdon, J.A. (1991). Psychological effects of aerobic fitness training. New York: Springer. McDonald, M.P., Sanfilippo, A.J. & Savard, G.K. (1993). Baroreflex function and cardiac structure with moderate endurance training in normotensive men. Journal of Applied Physiology, 74, 24692477. Meiworm, L., Strass, D., Jakob, E., Walker, U.A., Peter, H.H. & Keul, J. (1999). Auswirkung eines aeroben Ausdauertrainings auf Schmerzsymptomatik und Allgemeinbefinden bei Patienten mit Fibromyalgie. Deutsche Zeitschrift für Sportmedizin, 50, 188-192. Melanson, E.L. (2000). Resting heart rate variability in men varying in habitual physical activity. Medicine and Science in Sports and Exercise, 32, 1894-1901. Melanson, E.L. & Freedson, P.S. (2001). The effect of endurance training on resting heart rate variability in sedentary adult males. European Journal of Applied Physiology and Occupational Physiology, 84, 442-449. 180 Literatur Meyer, C., Rumpf, H.-J., Hapke, U., Dilling, H. & John, U. (2000). Lebenszeitprävalenz psychischer Störungen in der erwachsenen Allgemeinbevölkerung. Ergebnisse der TACOS-Studie. Nervenarzt, 71, 535-542. Miyakoda, H., Kitamura, H., Kinuwaga, T., Saito, M., Kotake, H. & Mashiba, H. (1990). Cardiac neurosis: Exercise tolerance and the role of sympathetic activity. Japanese Journal of Medicine, 29, 493-499. Molgaard, H., Hermansen, K., Bjerregaard, P. (1994). Spectral components of short-term RR interval variability in healthy subjects and effects of risk factors. European Heart Journal, 15, 1174-1183. Monahan, K.D., Dinenno, F.A., Tanaka, H., Clevenger, C.M., DeSouza, C.A. & Seals, D.R. (2000). Regular aerobic exercise modulates age-associated declines in cardivagal baroreflex sensitivity in healthy men. The Journal of Physiology, 529, 263-271. Morschitzky, H. (2000). Somatoforme Störungen. Diagnostik, Konzepte und Therapie bei Körpersymptomen ohne Organbefund. Wien: Springer. Morschitzky, H. (2002). Angststörungen. Diagnostik, Konzepte, Therapie, Selbsthilfe (2. überarbeitete und erweiterte Aufl.). Wien: Springer. Mortara, A., La Rovere, M.T., Pinna, G.D., Prpa, A., Maestri, R., Febo, O., Pozzoli, M., Opasich, C. & Tavazzi, L. (1997). Arterial baroreflex modulation of heart rate in chronic heart failure. Circulation, 96, 3450-3458. Mtinangi, B.L. & Hainsworth, R. (1998). Increased orthostatic tolerance following moderate exercise training in patients with unexplained syncope. Heart, 80, 596-600. Mtinangi, B.L. & Hainsworth, L. (1999). Effects of moderate exercise training on plasma volume, baroreceptor sensitivity and orthostatic tolerance in healthy subjects. Experimental Physiology, 84, 121-130. Mulder, L.J.M. (1988). Assessment of cardiovascular reactivity by means of spectral analysis. Thesis, University of Groningen, Groningen. Mulder, L.J.M., Van Dellen, H.J., Van der Meulen, P. & Opheikens, B. (1988). CARSPAN, a spectral analysis program for cardiovascular time series. In F.J. Maarse, L.J.M. Muder, W. Sjouw & A. Akkerman (Eds.), Computers in psychology: methods, instrumentation & psychodiagnostics (pp. 3038). Lisse: Swets & Zeitlinger. Mussgay, L. (o.J.). The methodology of assessing autonomic cardiovascular regulation using frequency domain measures. Unveröff. Manuskript, St.-Franziska-Stift, Bad Kreuznach. 181 Literatur Mussgay, L. & Rüddel, H. (1998). Die Analyse autonomer Regulationsmechanismen als Entscheidungshilfe in der Diagnostik somatoformer Beschwerden bei Patienten mit langjähriger Umweltgift-Exposition. Zeitung für Umweltmedizin, 6 (1), 30-35. Mussgay, L. & Rüddel, H. (2004). Autonomic dysfunctions in patients with anxiety throughout therapy. Journal of Psychophysiology, 18, 27-37. Nanke, A. & Rief, W. (2003). Zur Inanspruchnahme medizinischer Leistungen bei Patienten mit somatoformen Störungen. Psychotherapeut, 48, 329-335. Nolan, J., Batin, P.D., Andrews, R., Lindsay, S.J., Brooksby, P., Mullen, M., Baig, W., Flapan, A.D., Cowley, A., Prescott, R.J., Neilson, J.M. & Fox, K.A. (1998). Prospective study of heart rate variability and mortality in chronic heart failure: results of the United Kingdom heart failure, evaluation and assessment of risk trial (UK-heart). Circulation, 98, 1510-1516. Odemuyiwa, O. (1995). Effect of age on heart rate variability. In M. Malik & J.A. Camm (Eds.), Heart rate variability (pp. 235-240). New York: Futura Publishing. Osterziel, K.J., Hanlein, D., Willenbrock, R., Eichhorn, C., Luft, F. & Dietz, R. (1995). Baroreflex sensitivity and cardiovascular mortality in patients with mild to moderate heart failure. British Heart Journal, 73, 517-522. Pagani, M., Lucini, D., Rimoldi, O., Furlan, R., Piazza, S. & Biancardi, L. (1995). Effects of physical and mental exercise on heart rate variability. In M. Malik & J.A. Camm (Eds.), Heart rate variability (pp. 245-266). New York: Futura Publishing. Pagani, M., Somers, V., Furlan, R., Dell’Orto, S., Conway, J., Baselli, G., Cerutti, S., Sleight, P. & Malliani, A. (1988). Changes in autonomic regulation induced by physical training in mild hypertension. Hypertension, 12, 600-610. Pahmeier, I. (2000). Bindung an sportliche Aktivität im Anschluss an eine Rehabilitationsmaßnahme. Gesundheitssport und Sporttherapie, 16, 186. Pahmeier, I. & Brehm, W. (1998). Multiple Beschwerden. In K. Bös & W. Brehm (Hrsg.), Gesundheitssport. Ein Handbuch. Beiträge zur Lehre und Forschung im Sport, 120 (S. 296-307). Schorndorf: Hofmann. Pauli, P., Hartl, L., Marquardt, C., Stalman, H. & Strian, F. (1991). Heartbeat and arrhythmia perception in diabetic autonomic neuropathy. Psychological Medicine, 21, 413-421. 182 Literatur Pearson, T.A., Blair, S.N., Daniels, S.R., Eckel, R.H., Fair, J.M., Fortmann, S.P., Franklin, B.A., Goldstein, L.B., Greenland, P., Grundy, S.M., Hong, Y., Miller, N.H., Lauer, R.M., Ockene, I.S., Sacco, R.L., Sallis, J.F. Jr., Smith, S.C. Jr., Stone, N.J. & Taubert, K.A. (2002). American Heart Association guidelines for primary prevention of cardiovascular disease and stroke: 2002 update: Consensus panel guide to comprehensive risk reduction for adult patients without coronary or other atherosclerotic vascular diseases. American Heart Association Science Advisory and Coordinating Committee. Circulation, 106, 388-391. Pekrun, G. (1998). Einfluß von Ausdauertraining, Clomipramin und Placebo auf psychologische Parameter bei Panikstörung. Göttingen: Cuvillier. Pennebaker, J.W. (1982). The psychology of physical symptoms. New York: Springer. Perkiomaki, M.V., Ikaheimo, M.J., Pikkujamsa, S.M., Rantala, A., Lilja, M., Kesaniemi, Y.A. & Hurikuri, H.V. (1996). Dispersion of the QT interval and autonomic modulation of heart rate in hypertensive men with and without left ventricular hypertrophy. Hypertension, 28, 16-21. Peters, S., Stanley, I., Rose, M., Kaney, S. & Salmon, P. (2002). A randomized controlled trial of group aerobic exercise in primary care patients with persistent, unexplained physical symptoms. Family Practice, 19, 665-674. Petruzzello, S.J., Landers, D.M., Hatfield, B.D., Kubitz, K.A. & Salazar, W. (1991). A meta-analysis on the anxiety-reducing effects of acute and chronic exercise: Outcomes and mechanisms. Sports Medicine, 11, 143-182. Plante, T.G., Lantis, A. & Checa, G. (1998). The influence of perceived versus aerobic fitness on psychological health and physiological stress responsivity. International Journal of Stress Management, 5, 141-156. Pogacnik, T., Sega, S., Mesec, A. & Kiauta, T. (1993). Autonomic function testing in patients with tension-type headache. Headache, 33, 63-68. Porges, S.W., McCabe, P.M. & Yongue, B.G. (1982). Respiratory-heart rate interactions: psychophysiological implications for pathophysiology and behavior. In J. Cacioppo & R. Petty (Eds.), Perspectives in cardiovascular psychophysiology (pp. 223-259). New York: Guilford Press. Psychosomatische Fachklinik St. Franziska-Stift (Hrsg.). (1997). Arbeitsgrundlage der Psychosomatischen Fachklinik St. Franziska-Stift Bad Kreuznach. Dillingen: ctt-Verlag. Puig, J., Freitas, J., Carvalho, M.J., Puga, N., Ramos, J., Fernandes, P., Costa, O. & de Freitas, A.F. (1993). Spectral analysis of heart rate variability in athletes. Journal of Sports Medicine and Physical Fitness, 33, 44-48. Raithel, K.S. (1989). Chronic pain and exercise therapy. The Physician and Sportsmedicine, 17, 203209. 183 Literatur Raj, S.R., Brouillard, D., Simpson, C.S., Hopman, W.M. & Abdollah, H. (2000). Dysautonomia among patients with fibromyalgia: A non-invasive assessment. Journal of Rheumatology, 27, 2660-2665. Reiling, M.J. & Seals, D.R. (1988). Respiratory sinus arrhythmia and carotid baroreflex control of heart rate in endurance athletes and untrained controls. Clinical Physiology, 8, 511-519. Rief, W. (2005). Somatoforme Störungen und Schmerzstörungen. In R.-M. Frieboes, M. Zaudig & M. Nosper (Hrsg.), Rehabilitation bei psychischen Störungen (S. 238-254). München: Urban & Fischer. Rief, W. & Auer, C. (2001). Is somatization a habituation disorder? Physiological reactivity in somatization syndrome. Psychiatry Research, 101, 63-74. Rief, W., Cuntz, U. & Fichter, M.M. (2001). Diagnostik und Behandlung somatoformer Störungen (funktioneller körperlicher Beschwerden). Versicherungsmedizin, 53, 12-17. Rief, W. & Hiller, W. (1998). Somatisierungsstörung und Hypochondrie. Göttingen: Hogrefe. Rief, W. & Nanke, A. (1999). Somatization disorder from a cognitive-psychobiological perspective. Current Opinion in Psychiatry, 12, 733-738. Rief, W., Shaw, R. & Fichter, M.M. (1998). Elevated levels of psychophysiological arousal and cortisol in patients with somatization syndrome. Psychosomatic Medicine, 60, 198-203. Robbe, H., Mulder, L., Rüddel, H., Langewitz, W., Veldman, J. & Mulder, G. (1987). Assessment of baroreceptor reflex sensitivity by means of spectral analysis. Hypertension, 10, 538-543. Rossy, L.A. & Thayer, J.F. (1998). Fitness and gender-related differences in heart period variability. Psychosomatic Medicine, 60, 773-781. Rost, R. (1995). Sport und Bewegungstherapie bei Inneren Krankheiten. Lehrbuch für Sportlehrer, Übungsleiter, Krankengymnasten und Sportärzte (2. erweiterte Aufl.). Köln: Deutscher ÄrzteVerlag. Rüddel, H. (2004). Arbeitsgrundlage. Psychosomatische Fachklinik St. Franziska-Stift, Bad Kreuznach. Bad Kreuznach: Matthias Ess. Rüddel, H., Langewitz, W., Schächinger, H., Schmieder, R. & Schulte, W. (1988). Hemodynamic response patterns to mental stress: Diagnostic and therapeutic implications. American Heart Journal, 116, 617-627. Rüddel, H., Schmieder, R., Langewitz, W. & Schulte, W. (1988). Impact of antihypertensive therapy on blood pressure reactivity during mental stress. Journal of Human Hypertension, 1, 259-265. Sacknoff, D.M., Gleim, G.W., Stachenfeld, N. & Coplan, N.L. (1994). Effect of athletic training on heart rate variability. American Heart Journal, 127, 1275-1278. 184 Literatur Salvador, A., Ricarte, J., González-Bono, E. & Moya-Albiol, L. (2001). Effects of physical training on endocrine and autonomic response to acute stress. Journal of Psychophysiology, 15, 114-121. Sartorius, N., Üstün, T.B., Lecrubier, Y. & Wittchen, H.-U. (1996). Depression comorbid with anxiety: Results from the WHO study on psychological disorders in primary health care. British Journal of Psychiatry, 168, Suppl. 30, 38-43. Schächinger, H., Funke, S., Rüddel, H. & Schulte, W. (1991). Comparison of blood pressure measured by FINAPRESTM and standard cuff techniques. In H. Rüddel & I. Curio (Eds.), Non-invasive continous blood pressure measurement: Methods, evaluation and applications of the vascular unloading technique (Peñaz-method) (pp. 43-49). Frankfurt am Main: Lang. Schächinger, H., Langewitz, W., Rüddel, H., Tenés Reino, S., Mulder, L.J.M., Roon, A. van, Veldman, J.B.P., Schmieder, R. & Schulte, W. (1996). Spectral measures of short-term blood pressure and heart rate variations: Methodological guidelines. Homeostasis, 37, 97-105. Schlicht, W. (1994). Does physical exercise reduce anxious emotions? A meta-analysis. Anxiety, Stress, and Coping, 6, 275-288. Schmidt, H., Hoffmann, T. & Werdan, K. (2002). Die autonome Dysfunktion des Herzkranken. Der Internist, 43 (Suppl. 1), S76-S83. Schmidt, R.F., Thews, G. & Lang, F. (Hrsg.). (2000). Physiologie des Menschen (28., korrigierte und aktualisierte Aufl.). Berlin: Springer. Schuit, A.J., van Amelsvoort, L.G.P., Verheij, T.C., Rijneke, R.D., Maan, A.C., Swenne, C.A. & Schouten, E.G. (1999). Exercise training and heart rate variability in older people. Medicine and Science in Sports and Exercise, 31, 816-821. Schulz, H., Horn, A., Linowsky, G., Plogmaker, A. & Heck, H. (2002). Einfluss eines Ausdauertrainings auf die Herzfrequenzvariabilität bei Untrainierten. In K. Hottenrott (Hrsg.), Herzfrequenzvariabilität im Sport. Prävention – Rehabilitation – Training. (Bericht über das Symposium am 8. Dezember 2001 in Marburg, S. 67-74). Hamburg: Czwalina. Schuntermann, M. (2002). Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit (ICF) der Weltgesundheitsorganisation (WHO). Einführung und Kurzfassung der ICF März 2002. Frankfurt am Main: VDR, Rehabilitationswissenschaftliche Abteilung. Schuntermann, M. (2003). Grundsatzpapier der Rentenversicherung zur Internationalen Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit (ICF) der Weltgesundheitsorganisation (WHO). Deutsche Rentenversicherung, 1-2, 52-59. Schwartz, A. (2000). Neurologie systematisch (2. Aufl.). Bremen: Uni-MED. 185 Literatur Scully, D. Kremer, J., Meade, M.M., Graham, R., Dudgeon, K. (1998). Physical exercise and psychological well being: a critical review. British Journal of Sports Medicine, 32, 111-120. Seals, D.R. & Chase, P.B. (1989). Influence of physical training on heart rate variability and baroreflex circulatory control. Journal of Applied Physiology, 66, 1886-1895. Shapiro, A.P., Krantz, D.S. & Grim, C.E. (1986). Pharmacologic agents as modulators of stress. In K.A. Matthews, S.M. Weiss, T. Detre, T.M. Dembrowski, B. Falkner, S.B. Manuck & R.B. Williams, Jr. (Eds.), Handbook of stress, reactivity, and cardiovascular disease (pp. 401-416). New York: John Wiley & Sons. Sharma, R.K., Deepak, K.K., Bijlani, R.L. & Rao, P.S. (2004). Short-term physical training alters cardiovascular autonomic response amplitude and latencies. Indian Journal of Physiology and Pharmacology, 48, 165-173. Sharpe, M. & Bass, C. (1992). Pathophysiological mechanisms in somatization. International Review of Psychiatry, 4, 81-97. Sherwood, A. & Turner, J.R. (1992). A conceptual and methodological overview of cardiovascular reactivity research. In J.R. Turner, A. Sherwood & K.C. Light (Eds.), Individual differences in cardiovascular response to stress (pp. 3-32). New York: Plenum. Singleton, N., Bumpstead, R., O’Brien, M., Lee, A. & Meltzer, H. (2000). Psychiatric morbidity among adults living in private households, 2000: Summary Report. London: Office for National Statistics. Silbernagl, S. & Despopoulos, A. (2003). Taschenatlas der Physiologie (6., korrigierte Aufl.). Stuttgart: Thieme. Sinyor, D.S., Golden, M., Steinert, Y. & Seraganian, P. (1986). Experimental manipulation of aerobic fitness and the response to psychosocial stress: Heart rate and self-report measures. Psychosomatic Medicine, 48, 324-337. Sinyor, D., Schwartz, S.G., Peronnet, F., Brisson, G. & Seraganian, P. (1983). Aerobic fitness level and reactivity to psychosocial stress: Physiological, biochemical, and subjective measures. Psychosomatic Medicine, 45, 205-217. Smith, G.R., Monson, R.A. & Ray, D.C. (1986). Patients with multiple unexplained symptoms. Their characteristics, functional health, and health care utilization. Archives of Internal Medicine, 146, 69-72. Smith, M.L. & Raven, P.B. (1986). Cardiovascular responses to lower body negative pressure in endurance and static exercise-trained men. Medicine and Science in Sports and Exercise, 18, 545550. 186 Literatur Smyth, H.S., Sleight, P. & Pickering, G.W. (1969). Reflex regulation of arterial pressure during sleep in man. A quantitative method of assessing baroreflex sensitivity. Circulation Research, 24, 109121. Somers, V.K., Conway, J., Johnston, J. & Sleight, P. (1991). Effects of endurance training on baroreflex sensitivity and blood pressure in borderline hypertension. The Lancet, 337, 1363-68. Spalding, T.W., Lyon, L.A., Steel, D.H. & Hatfield, B.D. (2004). Aerobic exercise training and cardiovascular reactivity to psychological stress in sedentary young normotensive men and women. Psychophysiology, 41, 552-562. Steptoe, A., Kearsley, N. & Walters, N. (1993). Cardiovascular activity during mental stress following vigorous exercise in sportsmen and inactive men. Psychophysiology, 30, 245-252. Stoney, C.M., Davis, M.C. & Matthews, K.A. (1987). Sex differences in physiological responses to stress and in coronary heart disease: A causal link? Psychophysiology, 24, 127-131. Summers, H., Lustyk, M.K., Heitkemper, M. & Jarrett, M.E. (1999). Effect of aerobic fitness on the psychological stress response in women. Biological research for nursing, 1, 48-56. Sundin, Ö., Öhman, A., Palm, T. & Ström, G. (1995). Cardiovascular reactivity, type A behavior, and coronary heart disease: Comparisons between myocardial infarction patients and controls during laboratory-induced stress. Psychophysiology, 32, 28-35. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology (1996). Heart rate variability. Standards of measurement, physiological interpretation, and clinical use. European Heart Journal, 17, 354-381. Taylor, C.B., King, R., Ehlers, A., Margraf, J., Clark, D., Hayward, C., Roth, W.T. & Agras, S. (1987). Treadmill exercise test and ambulatory measures in panic attacks. American Journal of Cardiology, 60, 48J-52J. Thews, G. & Vaupel, P. (2001). Vegetative Physiologie (4. überarbeitete und korrigierte Aufl.). Berlin: Springer. Tuck, M.L. (1992). Obesity, the sympathetic nervous system, and essential hypertension. Hypertension, 19 (Suppl. 1), 167-177. Tulppo, M.P., Makikallo, T.H., Seppanen, T., Laukkanen, R.T. & Hurikuri, H.V. (1998). Vagal modulation of heart rate during exercise: effects of age and physical fitness. American Journal of Physiology, 274, 424-429. Turner, J.R. (1994). Cardiovascular reactivity and stress: Patterns of physiological response. New York: Plenum Press. 187 Literatur Ueno, L.M., Hamada, T. & Moritani, T. (2002). Cardiac autonomic nervous activities and cardiorespiratory fitness in older men. The Journal of Gerontology. Series A, Biological Sciences and Medical Sciences, 57, M605-M 610. Uusitalo, A.L.T., Uusitalo, A.J. & Rusko, H.K. (1998). Endurance training, overtraining and baroreflex sensitivity in female athletes. Clinical Physiology, 18, 510-520. Vaitl, D. & Hamm, A.O. (1995). Angst und Bettruhe. Verhaltenstherapie, 5, 200-206. Van Ravenswaaij-Arts, C.M.A., Kollée, L.A.A., Hopman, J.C., Stoelinga, G.B.A. & van Geijn, H.P. (1993). Heart rate variability. Annals of Internal Medicine, 118, 436-447. Vögele, C. (1999). Psychophysiologische Reaktivität bei Personen mit essentieller Hypertonie. Verhaltenstherapie und Verhaltensmedizin, 20, 321-342. Vuori, I.M. (2001). Dose-response of physical activity and low back pain, osteoarthritis, and osteoporosis. Medicine and Science in Sports and Exercise, 33 (Suppl.), S551-S586. Watkins, L.L., Grossman, P., Krishnan, R. & Blumenthal, J.A. (1999). Anxiety reduces baroreflex cardiac control in older adults with major depression. Psychosomatic Medicine, 61, 334-340. Watkins, L.L., Grossman, P., Krishnan, R. & Sherwood, A. (1998). Anxiety and vagal control of heart rate. Psychosomatic Medicine, 60, 498-502. Weineck, J. (1994). Sportbiologie (4. Aufl.). Balingen: perimed-spitta Verlag. Weissman, M.M., Markowitz, J.S., Ouellette, R., Greenwald, S. & Kahn, J.P. (1990). Panic disorder and cardiovascular/cerebrovascular problems: results from a community survey. American Journal of Psychiatry, 147, 1504-1508. Wesseling, K.H. (1984). Non-invasive continuous blood pressure wave form: Measurement by the method of Peñaz. Scripta Medica, 57 (Suppl. 6), 321-334. Wesseling, K.H. (1991). Finapres, continous noninvasive finger arterial pressure based on the method of Peñaz. In H. Rüddel & I. Curio (Eds.), Non-Invasive continuous blood pressure measurement: Methods, evaluation and applications of the vascular unloading technique (Peñaz-method) (pp. 917). Frankfurt am Main: Lang. Weston, P.J., Panerai, R.B., McCullogh, A., James, M.A., Potter, J.F., Thurston, H. & Swales, J.D. (1996). Assessment of baroreceptor-cardiac reflex sensitivity using time domain analysis in patients with IDDM and the relation to left ventricular mass index. Diabetologica, 39, 1385-1391. Wigers, S.H., Stiles, T.C. & Vogel, P.A. (1996). Effects of aerobic exercise versus stress management treatment in fibromyalgia. Scandinavian Journal of Rheumatology, 25, 77-86. 188 Literatur Wittchen, H.-U., Müller, N. & Storz, S. (1998). Psychische Störungen: Häufigkeit, psychosoziale Beeinträchtigungen und Zusammenhänge mit körperlichen Erkrankungen. Gesundheitswesen, 60, Suppl. 2, S95-S100. Wittchen, H.-U., Müller, N., Pfister, H., Winter, S. & Schmidtkunz, B. (1999). Affektive, somatoforme und Angststörungen in Deutschland – Erste Ergebnisse des bundesweiten Zusatzsurveys „Psychische Störungen“. Gesundheitswesen, 61, Suppl. 2, S216-S222. Wittchen, H.-U. & Vossen (1996). Komorbiditätsstudien bei Angststörungen. In J. Margraf (Hrsg.), Lehrbuch der Verhaltenstherapie. Band I: Grundlagen – Diagnostik – Verfahren – Rahmenbedingungen (S. 217-233). Berlin: Springer. Wittling, W. (1998). Veränderte Hirnasymmetrie als Risikofaktor somatischer Störungen – ein neurobiologisches Pathogenesemodell. In G. Rudolf & P. Henningsen (Hrsg.), Somatoforme Störungen: theoretisches Verständnis und therapeutische Praxis (S. 221-234). Stuttgart: Schattauer. Wolfe, F., Hawley, D., Anderson, J. & Wichita, K.S. (1999). The long-term outcomes of fibromyalgia: rates and predictors of mortality in fibromyalgia after follow-up. Arthritis and Rheumatism, 42 (Suppl. 9), S395. Yamamoto, K., Miyachi, M., Saitoh, T., Yoshioka, A. & Onodera, S. (2001). Effects of endurance training on resting and post-exercise cardiac autonomic control. Medicine and Science in Sports and Exercise, 33, 1496-1502. Yamasaki, Y., Kodama, M., Matsuhisa, M., Kishimoto, M., Ozaki, H., Tani, A., Ueda, N., Ishida, Y. & Kamado, T. (1996). Diurnal heart rate variability in healthy subjects: effects of aging and sex difference. American Journal of Physiology, 271, H303-H310. Yeragani, V.K., Pohl, R., Balon, R., Ramesh, C., Glitz, D., Jung, I. & Sherwood, P. (1991). Heart rate variability in patients with major depression. Psychiatry research, 37, 35-46. Yeragani, V.K., Pohl, R., Berger, R., Balon, R., Ramesh, C., Glitz, D., Srinivasan, K. & Weinberg, P. (1993). Decreased heart rate variability in panic disorder patients: A study of power-spectral analysis of heart rate. Psychiatry Research, 46, 89-103. Yeragani, V.K., Sobolewski, E., Igel, G., Johnson, C., Jampala, V.C., Kay, J., Hillman, N., Yeragani, S. & Vempati, S. (1998). Decreased heart-period variability in patients with panic disorder: a study of Holter ECG records. Psychiatry Research, 78, 89-99. Yeung, R.R. (1996). The acute effects of exercise on mood state. Journal of Psychosomatic Research, 40, 123-141. Zahorska-Markiewicz, B., Kuagowska, E., Kucio, C. & Klin, M. (1993). Heart rate variability in obesity. International Journal of Obesity and Related Metabolic Disorders, 17, 21-23. 189 Literatur Zielke, M. (1998). Kosten-Nutzen-Aspekte somatoformer Störungen. In J. Margraf, S. Neumer & W. Rief (Hrsg.), Somatoforme Störungen. Ätiologie, Diagnose und Therapie (S. 69-94). Berlin: Springer. Zintl, F. (1994). Ausdauertraining: Grundlagen, Methoden, Trainingssteuerung. München: BLV. Zwiener, U., Hoyer, D., Wicher, C. & Hardraht, H. (2002). Autonome Funktionen beim Gesunden. Autonome Steuerung von Herzkreislauf- und Lungenfunktion und deren Koordination. Der Internist, 43, 1041-1054. 190 Danksagung Danksagung Zunächst gilt mein Dank allen Patienten, die durch ihre Bereitschaft, an der Studie teilzunehmen, sich im Training einzusetzen und sich auch der nicht angenehmen Blutlaktatbestimmung zu unterziehen, diese Arbeit erst ermöglichten. Herrn Prof. Dr. K. Schüle danke ich für die Unterstützung bei meinem Promotionsvorhaben und besonders für seine stets offene und freundliche Art, mich bei der Arbeit zu betreuen. Herrn Prof. Dr. H. Rüddel danke ich besonders für die Initiierung des Forschungsprojektes, für seine begeisterte Förderung meiner wissenschaftlichen Arbeit im klinischen Umfeld sowie für die Unterstützung bei der vorliegenden Arbeit. Herrn Dr. L. Mussgay danke ich dafür, dass er das Forschungsprojekt initiiert hat. Besonders danke ich für seine Betreuung und Unterstützung während der gesamten Durchführung des Projektes. Herrn E. Morad gilt ein Dank für seine Mitarbeit im Rahmen der Datenerhebung und Datenauswertung. Ein großer Dank gilt den Mitarbeitern des St. Franziska-Stift, besonders denen der Aufnahmestation unter der Leitung von Frau Dr. Grothgar für die zuverlässige Zuweisung entsprechender Patienten, Frau Alexandra Metzroth und Frau Anne LeisterPrunk für die stets freundliche Unterstützung bei der Dateneingabe und den Laborerhebungen, Herrn Ralph Jürgensen für die Lösung statistischer Probleme sowie Herrn Rainer Stock für seine unkomplizierte Art kollegialer Zusammenarbeit. Herzlich danken möchte ich meinem Studienfreund Thomas Abel dafür, dass er mir stets bei Fragen mit Rat und Tat zur Seite stand. Ein herzlicher Dank geht an meine Freundin Sonja Tonagel, die als zweifache und berufstätige Mutter sich die Zeit für die genaue Durchsicht der Arbeit genommen hat. Mein größtes Dankeschön möchte ich meinem Mann Peter und meiner Tochter Paula sowie meinen Eltern und Schwiegereltern aussprechen, die es mir ermöglicht haben, diese Arbeit zu vollenden. Ich bedanke mich aus ganzem Herzen für den Glauben an mich und meine Arbeit und die Zeit, die ich durch sie für die Arbeit erübrigen konnte. 191 Lebenslauf Lebenslauf Name: Frauke Brauer, geb. Schmidt Geburtsdatum: 05.04.1974 Geburtsort: Dannenberg/Elbe Eltern: Regina Schmidt, geb. Bönig Horst Schmidt Geschwister: Hauke Schmidt Familienstand: Verheiratet mit Peter Brauer Kinder: Paula Brauer, geb. 22.03.2004 Schulbesuch: 1980-1984 Grundschule, Dannenberg 1984-1986 Orientierungsstufe, Dannenberg 1986-1993 Fritz Reuter-Gymnasium, Dannenberg Studium: 1993-1999 Studium der Sportwissenschaft an der Deutschen Sporthochschule Köln, Abschluss: Diplom mit Schwerpunkt Rehabilitation und Behindertensport, 2003-2005 Promotionsstudium an der Deutschen Sporthochschule Köln Beruflicher Werdegang: Seit 2000 Anstellung als Sporttherapeutin in der Psychosomatischen Fachklinik St. Franziska-Stift, Bad Kreuznach, Seit 2001 Projektdurchführung „Autonome Dysregulation bei Patienten mit Angst- und somatoformen Störungen: Effekte eines aeroben Trainings“ vom Verband Deutscher Rentenversicherungsträger innerhalb des Förderschwerpunktes Rehabilitationswissenschaften im Forschungsverbund Freiburg/Bad Säckingen 192 Anhang ANHANG 1 Tabellen zu Kapitel 7 – Ergebnisse S. 194 2 Patienten-Information S. 202 3 Einverständniserklärung zur Teilnahme an der Studie S. 204 4 Freiburger Fragebogen zur körperlichen Aktivität FFKA S. 205 5 Auswertematrix FFKA S. 206 6 Hospital Anxiety and Depression Scale HADS S. 207 7 Symptom Checklist SCL90-R S. 208 8 Fragebogen zur Beurteilung der Rehabilitation FBReha S. 211 9 Fragebogen zum Gesundheitszustand SF-36 S. 213 193 Anhang ANHANG 1 Tabellen zu Kapitel 7 - Ergebnisse Tabelle A1. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der maximal erreichten Leistung bei der fahrradergometrischen Belastungsuntersuchung über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe (1) 1 85 3,54 ,063 Regulation (2) 1 85 1,86 ,176 Zeit (3) 2 172 17,49 ,000 12 1 85 ,24 ,627 13 2 172 4,58 ,001 23 2 172 2,46 ,088 123 2 172 ,90 ,103 Greenhouse/Geisser korrigierter p-Wert ,000 ** ,002 ** Tabelle A2. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der maximal erreichten Leistung bei der fahrradergometrischen Belastungsuntersuchung für die Experimental- und Kontrollgruppe über die drei Messzeitpunkte, Hauptfaktor: Gruppe Zeit. KG T1 KG T2 KG T3 EG T1 EG T2 EG T3 ,225 ,626 ,097 < ,001** < ,001** ,985 1,000 < ,001** < ,001** ,926 < ,001** < ,001** < ,001** < ,001** KG T1 KG T2 ,225 KG T3 ,626 ,985 EG T1 ,097 1,000 ,926 EG T2 < ,001** < ,001** < ,001** < ,001** EG T3 < ,001** < ,001** < ,001** < ,001** ,763 ,763 Tabelle A3. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der maximal erreichten Leistung bei der fahrradergometrischen Belastungsuntersuchung über die drei Messzeitpunkte, Haupteffekt: Zeit. p-Wert T1-T2 T1-T3 T2-T3 < ,001** < ,001** ,911 Tabelle A4. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Herzfrequenz bei 75, 100 und 125 Watt während der fahrradergometrischen Belastungsuntersuchung über drei Messzeitpunkte mit der Kovariable Alter. W 75 100 Effekt FG-Effekt FG-Fehler F-Wert p-Wert Gruppe (1) 1 83 1,31 ,255 Regulation (2) 1 83 5,89 ,017 * Zeit (3) 2 168 3,27 ,040 12 1 83 ,01 ,935 13 2 168 ,18 ,831 23 2 168 ,29 ,747 123 2 168 ,64 ,527 Gruppe (1) 1 79 1,00 ,319 Regulation (2) 1 79 9,09 ,004 ** Zeit (3) 2 160 7,37 < ,001 12 1 79 ,73 ,397 13 2 160 ,08 ,925 23 2 160 ,48 ,621 194 Greenhouse/Geisser korrigierter p-Wert ,041* < ,001 ** Anhang W Effekt FG-Effekt FG-Fehler F-Wert p-Wert 100 123 2 160 ,08 ,923 125 Gruppe (1) 1 55 1,59 ,212 Regulation (2) 1 55 3,88 ,054 Zeit (3) 2 112 7,27 ,001 12 1 55 ,67 ,417 13 2 112 ,16 ,850 23 2 112 ,19 ,830 123 2 112 ,02 ,980 Greenhouse/Geisser korrigierter p-Wert ,001 ** Tabelle A5. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der Herzfrequenz bei 75, 100 und 125 Watt während der fahrradergometrischen Belastungsuntersuchung über die drei Messzeitpunkte, Haupteffekt: Zeit. Watt T1-T2 T1-T3 T2-T3 75 p-Wert ,038 * ,861 ,131 100 p-Wert < ,001 ** ,526 ,020 * 125 p-Wert ,002 ** ,986 ,003 ** Tabelle A6. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Laktatwerte bei 75, 100 und 125 Watt während der fahrradergometrischen Belastungsuntersuchung über drei Messzeitpunkte mit der Kovariable Alter. W 75 100 125 Effekt FG-Effekt FG-Fehler F-Wert p-Wert Gruppe (1) 1 82 ,38 ,540 Regulation (2) 1 82 4,05 ,047 * Zeit (3) 2 166 3,94 ,022 12 1 82 ,23 ,630 13 2 166 ,09 ,913 23 2 166 1,12 ,330 123 2 166 ,26 ,772 Gruppe (1) 1 76 ,30 ,583 Regulation (2) 1 76 6,14 ,016 * Zeit (3) 2 154 5,24 ,006 12 1 76 ,43 ,515 13 2 154 1,99 ,140 23 2 154 ,49 ,615 123 2 154 1,37 ,257 Gruppe (1) 1 54 ,05 ,824 Regulation (2) 1 54 3,44 ,069 Zeit (3) 2 110 5,47 ,005 12 1 54 ,87 ,353 13 2 110 1,45 ,240 23 2 110 ,52 ,597 123 2 110 2,45 ,091 Greenhouse/Geisser korrigierter p-Wert ,022 * ,006 ** ,006 ** Tabelle A7. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich des Laktatwertes bei 75, 100 und 125 Watt während der fahrradergometrischen Belastungsuntersuchung über die drei Messzeitpunkte, Haupteffekt: Zeit. Watt T1-T2 T1-T3 T2-T3 75 p-Wert ,499 ,209 ,014 * 100 p-Wert ,013 * 1,000 ,013 * 125 p-Wert ,220 ,184 ,002 ** 195 Anhang Tabelle A8. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Gesamtherzratenvariabilität unter Ruhebedingungen und Stressbelastung über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt Ruhe Stress FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 47 1,53 ,223 Zeit 2 96 3,36 ,039 Gruppe Zeit 2 96 ,05 ,952 Gruppe 1 47 1,47 ,231 Zeit 2 96 ,37 ,689 Gruppe Zeit 2 96 ,49 ,613 Greenhouse/Geisser korrigierter p-Wert ,056 Tabelle A9. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der HRV im High frequency-Band unter Ruhebedingungen und Stressbelastung über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt Ruhe Stress FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 47 ,79 ,380 Zeit 2 96 4,21 ,018 Gruppe Zeit 2 96 ,18 ,833 Gruppe 1 47 1,00 ,322 Zeit 2 96 ,79 ,458 Gruppe Zeit 2 96 ,32 ,724 Greenhouse/Geisser korrigierter p-Wert ,025 * Tabelle A10. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der Herzratenvariabilität im High frequency-Band unter Ruhe über die drei Messzeitpunkte, Haupteffekt: Zeit. Ruhe T1-T2 T1-T3 T2-T3 ,034 * ,999 ,030 * Tabelle A11. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der HRV im Mid frequency-Band unter Ruhebedingungen und Stressbelastung über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt Ruhe Stress FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 47 3,02 ,089 Zeit 2 96 2,70 ,072 Gruppe Zeit 2 96 ,60 ,549 Gruppe 1 47 2,10 ,154 Zeit 2 96 1,79 ,173 Gruppe Zeit 2 96 1,27 ,286 Tabelle A12. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der HRV im Respiratorischen Band unter Ruhebedingungen und Stressbelastung über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Ergebnis der MANOVA: Übersicht der Effekte Gruppe, Zeit und Gruppe Zeit Effekt Ruhe Stress FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 47 ,01 ,926 Zeit 2 96 4,40 ,015 Gruppe Zeit 2 96 ,11 ,893 Gruppe 1 47 ,37 ,546 Zeit 2 96 1,85 ,162 Gruppe Zeit 2 96 ,15 ,862 196 Greenhouse/Geisser korrigierter p-Wert ,028 * Anhang Tabelle A13. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der HRV im Respiratorischen Band unter Ruhe über die drei Messzeitpunkte, Haupteffekt: Zeit. Ruhe T1-T2 T1-T3 T2-T3 ,017 * ,909 ,049 * Tabelle A14. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Baroreflexsensitivität unter Ruhebedingungen und Stressbelastung über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt Ruhe Stress FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 47 2,79 ,102 Zeit 2 96 8,09 ,001 Gruppe Zeit 2 96 ,56 ,575 Gruppe 1 47 ,55 ,462 Zeit 2 96 3,11 ,049 Gruppe Zeit 2 96 ,09 ,911 Greenhouse/Geisser korrigierter p-Wert ,001 ** ,050 Tabelle A15. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der der Baroreflexsensitivität unter Ruhe über die drei Messzeitpunkte, Haupteffekt: Zeit. Ruhe T1-T2 T1-T3 T2-T3 < ,001** ,011 * ,588 Tabelle A16. Ergebnisse des Median-Tests zum Gruppenvergleich hinsichtlich des Rehabilitationserfolges zum zweiten Messzeitpunkt, Items des klinikeigenen Fragebogens FBReha. Item H - Wert Chi² FG p-Wert Kontakte zu anderen Menschen (1,50) ,33 ,640 1 ,424 Körperliche Probleme (1,63) ,00 ,102 1 ,750 Seelische Probleme (1,69) 1,42 ,701 1 ,403 Alltäglicher Bereich (1,62) ,02 ,471 1 ,493 Beruflicher Bereich (1,57) 1,58 ,981 1 ,322 Freizeitbereich (1,63) 1,04 ,286 1 ,593 Tabelle A17. Ergebnisse der Varianzanalyse für die gesamte Untersuchungsgruppe hinsichtlich der Skalenwerte der Skalen in der SCL90-R über die drei Messzeitpunkte für die Haupteffekte Gruppe, Zeit, Gruppe Zeit mit der Kovariable Alter. Ergebnis der MANOVA: Effekt Gruppe (1), Zeit (2), Gruppe Zeit (12) Skala Somatisierung Zwanghaftigkeit Unsicherheit im Sozialkontakt Depressivität Ängstlichkeit Effekt FG Effekt FG Fehler F-Wert p-Wert 1 1 90 6,04 ,016 * 2 2 182 19,50 ,000 ** 12 2 182 ,22 ,806 1 1 90 2,16 ,145 2 2 182 27,85 ,000 ** 12 2 182 ,73 ,485 1 1 90 2,16 ,145 2 2 182 21,43 ,000 ** 12 2 182 1,10 ,335 1 1 90 1,44 ,234 2 2 182 29,88 ,000 ** 12 2 182 ,52 ,593 1 1 90 3,62 ,060 2 2 182 25,80 ,000 ** 12 2 182 ,28 ,753 197 Anhang Ergebnis der MANOVA: Effekt Gruppe (1), Zeit (2), Gruppe Zeit (12) Skala Aggressivität und Feindseligkeit Phobische Angst Paranoides Denken Psychotizismus Effekt FG Effekt FG Fehler F-Wert p-Wert 1 1 90 ,25 ,616 2 2 182 12,73 < ,001** 12 2 182 ,34 ,715 1 1 90 1,83 ,179 2 2 182 17,56 ,000 ** 12 2 182 1,26 ,288 1 1 90 ,81 ,372 2 2 182 12,75 < ,001** 12 2 182 ,83 ,438 1 1 90 ,28 ,600 2 2 182 17,28 ,000 ** 12 2 182 ,73 ,483 Tabelle A18. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der Skalenwerte der Skalen in der SCL90R für die gesamte Untersuchungsgruppe über die drei Messzeitpunkte, Haupteffekt: Zeit. Skala T1-T2 T1-T3 T2-T3 Somatisierung < ,001** < ,001** ,994 Zwanghaftigkeit < ,001** < ,001** ,682 Unsicherheit im Sozialkontakt < ,001** < ,001** ,882 Depressivität < ,001** < ,001** ,324 Ängstlichkeit < ,001** < ,001** ,976 Aggressivität und Feindseligkeit < ,001** ,003 ** ,191 Phobische Angst < ,001** < ,001** ,884 Paranoides Denken < ,001** < ,001** ,754 Psychotizismus < ,001** < ,001** ,900 Tabelle A19. Ergebnisse der Varianzanalyse für die gesamte Untersuchungsgruppe hinsichtlich der globalen Kennwerte in der SCL90-R über die drei Messzeitpunkte für die Haupteffekte Gruppe, Zeit, Gruppe Zeit mit der Kovariable Alter. Ergebnis der MANOVA: Effekt Gruppe (1), Zeit (2), Gruppe Zeit (12) Skala Grundsätzliche psychische Belastung (GSI) Anzahl der Symptome mit vorliegender Belastung (PST) Intensität der Antworten, Effekt FG Effekt FG Fehler F-Wert p-Wert 1 1 90 2,53 ,115 2 2 182 31,71 ,000 ** 12 2 182 ,85 ,428 1 1 90 2,68 ,105 2 2 182 27,77 ,000 ** 12 2 182 ,15 ,858 1 1 90 1,15 ,287 Stress-Index der Beschwer- 2 2 182 20,49 ,000 ** den (PSDI) 12 2 182 1,85 ,160 Tabelle A20. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der globalen Kennwerte in der SCL90-R für die gesamte Untersuchungsgruppe über die drei Messzeitpunkte, Haupteffekt: Zeit. Skala T1-T2 T1-T3 Grundsätzliche psychische Belastung (GSI) < ,001** < ,001** ,748 Anzahl der Symptome mit vorliegender Belastung (PST) < ,001** < ,001** ,580 Intensität der Antworten, Stress-Index der Beschwerden (PSDI) < ,001** < ,001** ,996 198 T2-T3 Anhang Tabelle A21. Ergebnisse der Varianzanalyse für die gesamte Untersuchungsgruppe hinsichtlich der Skalenwerte der Skalen im SF-36 über die drei Messzeitpunkte für die Haupteffekte Gruppe, Zeit, Gruppe/Zeit mit der Kovariable Alter. Ergebnis der MANOVA: Effekt Gruppe (1), Zeit (2), Gruppe Zeit (12) Skala Körperliche Funktionsfähigkeit Körperliche Rollenfunktion Körperliche Schmerzen Allgemeine Gesundheitswahrnehmung Vitalität Soziale Funktionsfähigkeit Emotionale Rollenfunktion Psychisches Wohlbefinden Effekt FG Effekt FG Fehler F-Wert p-Wert 1 1 90 1,86 ,176 2 2 182 13,55 < ,001** 12 2 182 1,79 ,170 1 1 90 2,09 ,152 2 2 182 12,38 < ,001** 12 2 182 ,056 ,945 1 1 90 7,59 ,007** 2 2 182 18,64 ,000** 12 2 182 2,11 ,125 1 1 90 5,02 ,028* 2 2 182 28,30 ,000** 12 2 182 ,49 ,614 1 1 90 5,37 ,023* 2 2 182 50,14 ,000** 12 2 182 1,84 ,162 1 1 90 1,81 ,182 2 2 182 14,62 < ,001** 12 2 182 2,89 ,058 1 1 90 1,42 ,237 2 2 182 15,33 < ,001** 12 2 182 ,15 ,858 1 1 90 2,10 ,151 2 2 182 43,72 ,000 ** 12 2 182 2,31 ,102 Tabelle A22. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der Skalenwerte der Skalen im SF-36 für die gesamte Untersuchungsgruppe über die drei Messzeitpunkte, Haupteffekt: Zeit. Tukeys HSD-Test mit dem Haupteffekt Zeit Skala T1-T2 T1-T3 T2-T3 Körperliche Funktionsfähigkeit < ,001** < ,001** ,751 Körperliche Rollenfunktion < ,001** < ,001** ,886 Körperliche Schmerzen < ,001** < ,001** ,233 Allgemeine Gesundheitswahrnehmung < ,001** < ,001** ,459 Vitalität < ,001** < ,001** < ,001** Soziale Funktionsfähigkeit < ,001** < ,001** ,999 Emotionale Rollenfunktion < ,001** < ,001** ,788 Psychisches Wohlbefinden < ,001** < ,001** ,129 Tabelle A23. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Summenwerte der Angstskala im HADS über die drei Messzeitpunkte unter Berücksichtigung des Alters als Kovariable. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 90 2,30 ,133 Zeit 2 182 40,81 ,000 Gruppe Zeit 2 182 ,77 ,465 199 Greenhouse/Geisser korrigierter p-Wert ,000 ** Anhang Tabelle A24. Wahrscheinlichkeiten im Post hoc-Test (Tukeys HSD-Test) hinsichtlich der Summenwerte der Angstskala im HADS über die drei Messzeitpunkte, Haupteffekt: Zeit. p-Wert T1-T2 T1-T3 T3 < ,001** < ,001** ,989 Tabelle A25. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der der Summenwerte der Depressionsskala im HADS über die drei Messzeitpunkte unter Berücksichtigung des Alters als Kovariable. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 90 1,28 ,261 Zeit 2 182 20,78 ,000 Gruppe Zeit 2 182 ,12 ,885 Greenhouse/Geisser korrigierter p-Wert ,000 ** Tabelle A26. Wahrscheinlichkeiten im Post hoc-Test (Tukeys HSD-Test) hinsichtlich der Summenwerte der Depressionsskala im HADS über die drei Messzeitpunkte, Haupteffekt: Zeit. p-Wert T1-T2 T1-T3 T3 < ,001** < ,001** ,981 Tabelle A27. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Reaktivität bezogen auf die Gesamtherzratenvariabilität über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 89 ,29 ,590 Zeit 2 180 3,44 ,034 Gruppe Zeit 2 180 1,03 ,359 Greenhouse/Geisser korrigierter p-Wert ,042 * Tabelle A28. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der Reaktivität bezogen auf die Gesamtherzratenvariabilität über die drei Messzeitpunkte, Haupteffekt: Zeit. p-Wert T1-T2 T1-T3 T2-T3 ,232 ,586 ,024 * Tabelle A29. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Reaktivität bezogen auf die HRV im High frequency-Band über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 89 1,04 ,312 Zeit 2 180 3,53 ,031 Gruppe Zeit 2 180 2,14 ,121 Greenhouse/Geisser korrigierter p-Wert ,041 * Tabelle A30. Wahrscheinlichkeiten im Post-hoc-Test (Tukeys HSD-Test) hinsichtlich der Reaktivität bezogen auf die Herzratenvariabilität im High frequency-Band über die drei Messzeitpunkte, Haupteffekt: Zeit. p-Wert T1-T2 T1-T3 T2-T3 ,336 ,412 ,020 * Tabelle A31. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Reaktivität bezogen auf die HRV im Mid frequency-Band über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 89 ,99 ,323 Zeit 2 180 3,13 ,046 Gruppe Zeit 2 180 ,95 ,387 200 Greenhouse/Geisser korrigierter p-Wert ,052 Anhang Tabelle A32. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Reaktivität bezogen auf die HRV im Respiratorischen Band über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 89 ,65 ,424 Zeit 2 180 1,12 ,330 Gruppe Zeit 2 180 ,58 ,563 Tabelle A33. Ergebnisse der Varianzanalyse für den Gruppenvergleich hinsichtlich der Reaktivität bezogen auf die Baroreflexsensibilität über drei Messzeitpunkte mit Berücksichtigung der Kovariable Alter. Effekt FG Effekt FG Fehler F-Wert p-Wert Gruppe 1 83 4,02 ,048 * Zeit 2 168 1,48 ,231 Gruppe Zeit 2 168 ,02 ,982 201 Anhang ANHANG 2 Patienten-Information "Autonome Dysregulation: Effekte eines aeroben Trainings“ Sehr geehrte Patientin, sehr geehrter Patient ! Sie stehen am Beginn einer stationären psychosomatischen Rehabilitationsbehandlung, die Sie dazu befähigen soll, den Anforderungen in Familie, Beruf und Alltag wieder besser gewachsen zu sein. Unsere Klinik befindet sich bzgl. der Behandlungsangebote in einem kontinuierlichen Verbesserungsprozess. Bevor neue Behandlungskomponenten standardmäßig eingeführt werden, müssen sie jedoch zuvor auf ihre Wirksamkeit hin überprüft werden. Gegenwärtig führen wir eine Studie durch, die besonders für Patienten Ihrer Krankheitsgruppe entworfen wurde. Im Rahmen Ihres Aufenthaltes hier am St. Franziska-Stift möchten wir Sie bitten, an dieser Studie teilzunehmen. Zu Ihrer Information und als Grundlage Ihrer Einwilligung sind nachfolgend alle relevanten Details aufgeführt. Was ist der Hintergrund der Studie? Die Studie wird vom Verband deutscher Rentenversicherungsträger (VDR) im Rahmen des rehabilitationswissenschaftlichen Forschungsverbundes Freiburg / Bad Säckingen gefördert. Die Studie ist eines von 18 Einzelprojekten dieses Forschungsverbundes, der durch diese Projekte bezweckt, zu einer verbesserten Zielorientierung in Diagnostik, Therapie und Ergebnismessung beizutragen. 1.) Die Untersuchung verfolgt mehrere Ziele: Als wichtigstes soll geprüft werden, ob bei Patienten mit der Diagnose einer somatoformen oder einer Angststörung ein aerobes Training förderliche Auswirkungen auf die autonome Regulation hat. Dies gilt bei beeinträchtigter und bei unbeeinträchtigter autonomer Regulation. Ferner wird geprüft, ob durch das Training der Rehabilitationserfolg insgesamt verbessert wird. 2.) Zur Abklärung dieser Fragen werden Patientinnen und Patienten mit den o.g. Diagnosen im Labor untersucht um ihren Regulationsstatus bestimmen zu können. Patienten mit einer Dysregulation und solche ohne werden gebeten an der weiteren Studie teilzunehmen. 3.) Um die positiven Effekte eines aeroben Trainings zu ermitteln, wird die Hälfte der Patienten zu einem systematischen Training eingeteilt, das während des gesamten Klinikaufenthaltes zusätzlich zur sonstigen Behandlung durchgeführt werden muss. Das körperliche Training wird mit Ihnen unter fachkundiger Leitung durch den Sporttherapeuten der Klinik durchgeführt. Er wird darauf achten, dass Sie sich einerseits nicht überlasten, aber andererseits einen ausreichenden Trainingszugewinn erzielen. Auch nach Entlassung sollte das Training im selben Umfang mindestens bis zur katamnestischen Abschlussuntersuchung weitergeführt werden. Monatliche Telefonanrufe sollen dies kontrollieren und helfen, eventuelle Probleme mit dem Training zu klären. Die anderen Patienten bilden die Vergleichsgruppe. Sie erhalten kein Training, lediglich die übliche Behandlung. Sie werden zufällig für eine der beiden Gruppen eingeteilt. 4.) Die Laboruntersuchung wird insgesamt 3mal stattfinden. Zu Beginn der Behandlung, nach vierwöchiger Behandlung und 6 Monate nach der Entlassung. Sie werden dazu wieder in die Klinik einbestellt. Unkosten und Verdienstausfall werden kompensiert. 5.) Positive Effekte des aeroben Trainings betreffen v.a. kardiovaskuläre Faktoren. Sie können über psychophysiologische Parameter abgebildet werden. Affektive Faktoren werden parallel dazu mit Hilfe von Fragebögen ermittelt. 6.) Jeweils vor der ersten Laborsitzung wird Ihnen das Labor vorgestellt und der gesamte Erhebungsablauf erklärt. 7.) Vor Beginn der Laborsitzung werden Ableitungselektroden am Körper und an der Hand angebracht. Damit werden verschiedene Aspekte der Herztätigkeit, des Blutdrucks und der Atmung registriert, um besser verstehen zu können, was während den Testsitzungen im Körper vor sich geht. 202 Anhang 8.) Um Ihre Ausdauerleistungsfähigkeit zu messen, wird ein Belastungstest auf einem Fahrradergometer durchgeführt, bei dem die Herzfrequenz und der Blutdruck gemessen werden. Alle zwei Minuten wird ein Tropfen Blut aus dem Ohrläppchen abgenommen, um den Blutlaktatwert zu bestimmen. 9.) Das Training kann eine Veränderung in der Körperzusammensetzung bewirken. Mittels einer Körperanalyse werden die Anteile an Körperfett und Wasser gemessen. Dafür werden Arbeitselektroden an der Hand und am Knöchel angelegt. 10.) Die Untersuchung ist nicht gefährlich oder belastend. Das, was Ihnen abverlangt wird, liegt in dem Bereich, den Sie auch sonst tagtäglich zu bewältigen haben. Sollten Sie dennoch zwischenzeitlich lieber aufhören wollen, können Sie jederzeit um Abbruch der Untersuchung bitten. 11.) Die Untersuchung hat eine hohe klinische Relevanz was die zukünftige Behandlung von Patienten mit autonomen Dysregulationen angeht. Mit den Daten ist es eventuell möglich die Effektivität nicht medikamentöser Behandlungsverfahren noch deutlich zu steigern. Es wird ausdrücklich versichert, dass die Studie nicht von Kostenträgern (z.B. BfA, LVA, Krankenkasse) oder sonstigen Dritten (z.B. Arbeitgeber) veranlasst wurde. Freiwilligkeit Die Teilnahme an der Studie ist freiwillig. Damit bestimmte Datenerhebungen stattfinden können, sind aus Gründen des Datenschutzes schriftliche Einverständniserklärungen durch die Patienten erforderlich. Durch die schriftliche Einverständniserklärung erklären Sie sich dazu bereit am oben skizzierten Erhebungsprogramm teilzunehmen. Sie können allerdings jederzeit - auch bei schon gegebener Einwilligung - aus der Studie ausscheiden. Wenn Sie die Teilnahme an der Studie ablehnen, erwachsen Ihnen hieraus keine Nachteile während Ihres Klinikaufenthalts. Muß ich als Patient irgendwelche Bedenken haben (z.B. Datenschutz)? ÆDer Studienantrag ist von einem internationalen Gutachtergremium geprüft worden. Die Studie wurde weiterhin von der Ethik-Kommission der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg, der Ethikkommission der Landesärztekammer sowie der Caritas Trägergesellschaft zustimmend beraten. Die Aufsichtsbehörden sind über dieses Projekt informiert. Zielsetzung, Planung, vorgeschlagene praktische Durchführung, Sicherungsmaßnahmen und Aufklärung entsprechen in vollem Maße den Anforderungen, die an ein solches Projekt zu stellen sind. ÆSie können sich ohne Einschränkung darauf verlassen, dass alle Ihre Angaben absolut vertraulich behandelt werden. Personengebundene Daten werden auf keinen Fall an Dritte weitergegeben. Alle erhobenen Informationen werden anonymisiert auf Datenträgern gespeichert. Alle statistischen Auswertungen erfolgen anonymisiert, d.h. ohne Angaben, die Rückschlüsse auf Ihre Person zulassen würden. Bei eventuellen Veröffentlichungen z.B. in Fachzeitschriften wird selbstverständlich kein Bezug zu Ihrer Person hergestellt. Die während der Studie erhobenen Daten werden gelöscht, sobald sie für die weitere wissenschaftliche Auswertung nicht mehr erforderlich sind. Wenn Sie an der Studie teilnehmen möchten, bitten wir Sie, die nachfolgenden Einverständniserklärungen zu unterschreiben. Jeweils ein Exemplar der Einverständniserklärungen verbleibt bei Ihnen, das andere geben Sie bitte unterschrieben zurück. Wir bitten Sie freundlich darum, an unserer Studie teilzunehmen! Wir bedanken uns im Voraus für Ihre Unterstützung und Mitarbeit. Mit freundlichen Grüßen und den besten Wünschen für Ihre psychosomatische Rehabilitation __________________________ _____________________________ Prof. Dr. Heinz Rüddel, Chefarzt Dr. Lutz Mussgay, Projektleiter 203 Anhang ANHANG 3 Einverständniserklärung zur Teilnahme an der Studie "Autonome Dysregulation: Effekte eines aeroben Trainings“ - gefördert vom VDR Name: _______________________________________ Vorname: _______________________________________ Geburtsdatum: ________________ PLZ /Wohnort: _______________________________________ Straße: _______________________________________ Telefon: ________________ Ich bin über Inhalt und Zweck der Studie „Autonome Dysregulation: Effekte eines aeroben Trainings“ informiert worden. Zu diesem Zweck wurde mir zusätzlich ein Merkblatt ("Patienten-Information") ausgehändigt. Mir wurde versichert -dass alle meine Angaben - ohne Einschränkung - absolut vertraulich behandelt werden, -dass personenbezogene Angaben in keinem Fall an Dritte weitergegeben werden, -dass die in der Studie erhobenen Daten gelöscht werden, sobald sie für die weitere wissenschaftliche Auswertung nicht mehr erforderlich sind. Ich bin darüber informiert, dass die Teilnahme an dieser Studie f r e i w i l l i g ist und mir keine Nachteile bei einer Nichtteilnahme entstehen. Mir ist bekannt, dass alle Auswertungen anonym und computergestützt, d.h. ohne Angaben, die Rückschlüsse auf meine Person zulassen, durchgeführt werden. Es wurde mir mitgeteilt, dass diese Studie lediglich Forschungszwecken dient. Hinsichtlich des Versicherungsschutzes wurde ich darauf hingewiesen, dass ich für Gesundheitsschäden oder sonstige Beeinträchtigungen, die bei mir im Zusammenhang mit der Teilnahme an der Untersuchung auftreten, ohne dass den Arzt oder seinen Erfüllungsgehilfen (z.B. Mitarbeiter) ein schuldhaftes Fehlverhalten trifft (z.B. auch für Wegunfälle), nicht versichert bin. Im Falle eines Schadens, der durch eine Haftpflichtversicherung gedeckt wird, ist geregelt, dass die Haftpflichtversicherung der Caritas Trägergesellschaft Trier (ctt) den Versicherungsschutz übernimmt. Einwilligung: □ unter den im Merkblatt ("Patienten-Information") genannten Voraussetzungen erkläre ich widerruflich meine Einwilligung für die Teilnahme an der Studie. □ unter den im Merkblatt ("Patienten-Information") genannten Voraussetzungen möchte ich nicht an der Studie teilnehmen. ____________ (Ort und Datum) ______________________________________ (Unterschrift) 204 Anhang ANHANG 4 Freiburger Fragebogen zur körperlichen Aktivität – Kurzform FFKA 1) Sind Sie berufstätig (auch Hausfrau) oder in Ausbildung? Ihre berufliche Tätigkeit beinhaltet hauptsächlich: sitzende Tätigkeiten (z.B.: Büro, Student...) mäßige Bewegung (z.B.: Handwerker, Hausmeister, Hausfrau...) intensive Bewegung (z.B.: Postzusteller, Wald- und Bauarbeiter...) nein ja 2 Waren Sie in der letzten Woche zu Fuß unterwegs, a)... auf dem Weg zur Arbeit oder zum Einkaufen usw.? nein ja Wenn ja, wie lange sind Sie dabei gegangen? insgesamt .............. Minuten/Stunden b) ... zum Spazierengehen? nein ja Wenn ja, wie lange waren Sie letzte Woche spazieren? insgesamt ........... Minuten/Stunden 3 Sind Sie in der letzten Woche Fahrrad gefahren, a) ... zur Arbeit oder zum Einkaufen usw.? nein ja Wenn ja, wie lange sind Sie dabei geradelt? insgesamt b) ... auf dem Heimtrainer bzw. auf Radtouren? nein Wenn ja, wie lange sind Sie dabei geradelt? insgesamt .......... Minuten/Stunden ja .......... Minuten/Stunden .......... Watt 4) Haben Sie einen Garten? nein ja Wenn ja, wieviel Stunden haben Sie letzte Woche in Ihrem Garten verbracht? ....... Stunden pro Woche. Davon waren ....... Stunden Gartenarbeit und ....... Stunden Ruhe und Erholung 5) Steigen Sie regelmäßig Treppen? 6) nein ja, .......Stockwerke,........ mal am Tag Sind Sie im letzten Monat geschwommen? nein ja, ca.......... Stunden im Monat (reine Schwimmzeit) 7) Haben Sie im letzten Monat Sport betrieben? (z.B.: Jogging, Fußball, Handball, Federball, Gymnastik, Tennis, Tischtennis ..............) nein ja wenn ja, welchen Sport Beispiel: …..1..Dauerlauf… ca..30. Minuten/Stunden pro Woche/Monat 1. ............................................ ca........ Minuten/Stunden pro Woche/Monat 2. ............................................ ……… Minuten/Stunden pro Woche/Monat 3. ............................................ ……… Minuten/Stunden pro Woche/Monat 4. ............................................ ……... Minuten/Stunden pro Woche/Monat 8) Gehen Sie zu Tanzveranstaltungen und/oder kegeln Sie? Tanzen: nein ja ......mal / Monat je: ....... Stunden Kegeln: nein ja ......mal / Monat je: ....... Stunden Vielen Dank 205 Anhang ANHANG 5 Auswertungsmatrix „Freiburger Fragebogen zur körperlichen Aktivität“ Ihre wöchentliche Aktivität Punkte für Aktivität 15 min 30 min 60 min Frage Punkte 2a Wege zu Fuß 0,7 1,5 3 2b Spaziergänge 0,9 1,7 3,5 3a Wege per Rad 1 2 4 3b Radtouren (16-20 km/h) 1,3 3 6 Ergometer: (75 Watt) 1 2 4 (100 Watt) 1,4 2,7 5,5 (150 Watt) 1,8 3,5 7 0,7 1,5 3 (Stockwerke xFrequenz/Tag) (4) (8) (10) (Punkte) 0,5 1 1,2 1,5 3 6 4 Gartenarbeit 5 Treppensteigen 6 Schwimmen 7 Walking (ca. 6,4 km/h) 1,3 2,5 5 Jogging (ca. 7 km/h) 1,8 3,5 7 S Dauerlauf (ca. 8 km/h) 2 4 8 P Gymnastik, Krafttraining 1,1 2,3 4,5 O Tennis 1,5 3 6 R Fußball, Handball 1,8 3,5 7 T Basketball 8 Volleyball 5 Skilanglauf (7 km/h) 8 0,7 Tanzen, Kegeln 1,5 Gesamtpunkte davon 3 ........................... Punkte „Sport“punkte: ............................ Punkte © Dr. rer.nat. I. Frey / Prof. Dr. med. A. Berg - Medizinische Universitätsklinik Freiburg, Abt. Rehabilitative und Präventive SportMedizin 206 Anhang ANHANG 6 Hospital Anxiety and Depression Scale HADS 207 Anhang ANHANG 7 Symptom Checklist SCL90-R Anleitung Sie finden auf den folgenden Seiten eine Liste von Problemen und Beschwerden, die man manchmal hat. Bitte lesen Sie jede Frage sorgfältig durch und entscheiden Sie, wie sehr Sie in den letzten sieben Tagen durch diese Beschwerden gestört oder bedrängt worden sind. Überlegen Sie bitte nicht erst, welche Antwort "den besten Eindruck" machen könnte, sondern antworten Sie so, wie es für Sie persönlich zutrifft. Machen Sie hinter jeder Frage nur ein Kreuz in das Kästchen mit der für Sie am besten zutreffenden Antwort. Streichen Sie versehentliche Antworten deutlich durch und kreuzen Sie danach das richtige Kästchen an. Die Zahlen bedeuten: 0 – überhaupt nicht, 1 – ein wenig, 2 – ziemlich, 3 – stark, 4 – sehr stark. Bitte beantworten Sie jede Frage! Wie sehr litten Sie in den letzten sieben Tagen unter ...? 0 1 2 3 4 1. Kopfschmerzen 0 1 2 3 4 2. Nervosität oder innerem Zittern 0 1 2 3 4 3. immer wieder auftauchenden unangenehmen Gedanken, Worten oder Ideen, die Ihnen nicht mehr aus dem Kopf gehen 0 1 2 3 4 4. Ohnmachts- oder Schwindelgefühlen 0 1 2 3 4 5. Verminderung Ihres Interesses oder Ihrer Freude an Sexualität 0 1 2 3 4 6. allzu kritischer Einstellung gegenüber anderen 0 1 2 3 4 7. der Idee, daß irgend jemand Macht über Ihrer Gedanken hat 0 1 2 3 4 8. dem Gefühl, daß andere an den meisten Ihrer Schwierigkeiten Schuld sind 0 1 2 3 4 9. Gedächtnisschwierigkeiten 0 1 2 3 4 10. Beunruhigung wegen Achtlosigkeit und Nachlässigkeit 0 1 2 3 4 11. dem Gefühl, leicht reizbar und verärgerbar zu sein 0 1 2 3 4 12. Herz- und Brustschmerzen 0 1 2 3 4 13. Furcht auf offenen Plätzen oder auf der Straße 0 1 2 3 4 14. Energielosigkeit oder Verlangsamung in den Bewegungen oder im Denken 0 1 2 3 4 15. Gedanken, sich das Leben zu nehmen 0 1 2 3 4 16. Hören von Stimmen, die sonst keiner hört 0 1 2 3 4 17. Zittern 0 1 2 3 4 18. dem Gefühl, daß man den meisten Menschen nicht trauen kann 0 1 2 3 4 19. schlechtem Appetit 0 1 2 3 4 20. Neigung zum Weinen 0 1 2 3 4 21. Schüchternheit oder Unbeholfenheit im Umgang mit dem anderen Geschlecht 0 1 2 3 4 22. der Befürchtung, ertappt oder erwischt zu werden 0 1 2 3 4 23. plötzlichem Erschrecken ohne Grund 0 1 2 3 4 24. Gefühlsausbrüchen, gegenüber denen Sie machtlos waren 0 1 2 3 4 25. Befürchtungen, wenn Sie alleine aus dem Haus gehen 0 1 2 3 4 26. Selbstvorwürfen über bestimmte Dinge 0 1 2 3 4 208 Anhang Wie sehr litten Sie in den letzten sieben Tagen unter ...? 0 1 2 3 4 27. Kreuzschmerzen 0 1 2 3 4 28. dem Gefühl, daß es Ihnen schwerfällt, etwas anzufangen 0 1 2 3 4 29. Einsamkeitsgefühlen 0 1 2 3 4 30. Schwermut 0 1 2 3 4 31. dem Gefühl, sich zu viele Sorgen zu machen 0 1 2 3 4 32. dem Gefühl, sich für nichts zu interessieren 0 1 2 3 4 33. Furchtsamkeit 0 1 2 3 4 34. Verletzlichkeit in Gefühlsdingen 0 1 2 3 4 35. der Idee, daß andere Leute von Ihren geheimsten Gedanken wissen 0 1 2 3 4 36. dem Gefühl, daß andere Sie nicht verstehen oder teilnahmslos sind 0 1 2 3 4 37. dem Gefühl, daß Leute unfreundlich sind oder Sie nicht leiden können 0 1 2 3 4 38. der Notwendigkeit, alles langsam zu tun, um sicher zu sein, daß alles richtig ist 0 1 2 3 4 39. Herzklopfen oder Herzjagen 0 1 2 3 4 40. Übelkeit oder Magenverstimmung 0 1 2 3 4 41. Minderwertigkeitsgefühlen gegenüber anderen 0 1 2 3 4 42. Muskelschmerzen (Muskelkater, Gliederschmerzen) 0 1 2 3 4 43. dem Gefühl, daß andere Sie beobachten oder über Sie reden 0 1 2 3 4 44. Einschlafschwierigkeiten 0 1 2 3 4 45. dem Zwang, wieder und wieder nachzukontrollieren, was Sie tun 0 1 2 3 4 46. Schwierigkeiten, sich zu entscheiden 0 1 2 3 4 47. Furcht vor Fahrten in Bus, Straßenbahn, U-Bahn oder Zug 0 1 2 3 4 48. Schwierigkeiten beim Atmen 0 1 2 3 4 49. Hitzewallungen und Kälteschauern 0 1 2 3 4 50. der Notwendigkeit, bestimmte Dinge, Orte oder Tätigkeiten zu meiden, weil Sie durch diese erschreckt werden 0 1 2 3 4 51. Leere im Kopf 0 1 2 3 4 52. Taubheit oder Kribbeln in einzelnen Körperteilen 0 1 2 3 4 53. dem Gefühl, einen Klumpen (Kloß) im Hals zu haben 0 1 2 3 4 54. einem Gefühl der Hoffnungslosigkeit angesichts der Zukunft 0 1 2 3 4 55. Konzentrationsschwierigkeiten 0 1 2 3 4 56. Schwächegefühl in einzelnen Körperteilen 0 1 2 3 4 57. dem Gefühl, gespannt oder aufgeregt zu sein 0 1 2 3 4 58. Schweregefühl in den Armen oder den Beinen 0 1 2 3 4 59. Gedanken an den Tod oder ans Sterben 0 1 2 3 4 60. dem Drang, sich zu überessen 0 1 2 3 4 61. einem unbehaglichen Gefühl, wenn Leute Sie beobachten oder über Sie reden 0 1 2 3 4 62. dem Auftauchen von Gedanken, die nicht Ihre eigenen sind 0 1 2 3 4 63. dem Drang, jemanden zu schlagen, zu verletzen oder ihm Schmerzen zuzufügen 0 1 2 3 4 209 Anhang Wie sehr litten Sie in den letzten sieben Tagen unter ...? 0 1 2 3 4 64. frühem erwachen am Morgen 0 1 2 3 4 65. zwanghafter Wiederholung derselben Tätigkeit wie Berühren, Zählen, Waschen 0 1 2 3 4 66. unruhigem oder gestörtem Schlaf 0 1 2 3 4 67. dem Drang, Dinge zu zerbrechen oder zu zerschmettern 0 1 2 3 4 68. Ideen oder Anschauungen, die andere nicht mit Ihnen teilen 0 1 2 3 4 69. starker Befangenheit im Umgang mit anderen 0 1 2 3 4 70. Abneigung gegen Menschenmengen, z.B. beim Einkaufen oder im Kino 0 1 2 3 4 71. einem Gefühl, daß alles sehr anstrengend ist 0 1 2 3 4 72. Schreck- und Panikanfällen 0 1 2 3 4 73. Unbehagen beim Essen oder Trinken in der Öffentlichkeit 0 1 2 3 4 74. der Neigung, immer wieder in Erörterungen oder Auseinandersetzungen zu geraten 0 1 2 3 4 75. Nervosität, wenn Sie alleine gelassen werden 0 1 2 3 4 76. mangelnder Anerkennung Ihrer Leistungen durch andere 0 1 2 3 4 77. Einsamkeitsgefühle, selbst wenn Sie in Gesellschaft sind 0 1 2 3 4 78. so starker Ruhelosigkeit, daß Sie nicht stillsitzen können 0 1 2 3 4 79. dem Gefühl, wertlos zu sein 0 1 2 3 4 80. dem Gefühl, daß Ihnen etwas Schlimmes passieren wird 0 1 2 3 4 81. dem Bedürfnis, laut zu schreien oder mit Gegenständen zu werfen 0 1 2 3 4 82. der Furcht, in der Öffentlichkeit in Ohnmacht zu fallen 0 1 2 3 4 83. dem Gefühl, daß die Leute Sie ausnutzten, wenn Sie es zulassen würden 0 1 2 3 4 84. sexuellen Vorstellungen, die ziemlich unangenehm für Sie sind 0 1 2 3 4 85. dem Gedanken, daß Sie für Ihre Sünden bestraft werden sollten 0 1 2 3 4 86. schreckenserregende Gedanken und Vorstellungen 0 1 2 3 4 87. dem Gedanken, daß etwas ernstlich mit Ihrem Körper nicht in Ordnung ist 0 1 2 3 4 88. dem Eindruck, sich einer anderen Person nie so richtig nahe fühlen zu können 0 1 2 3 4 89. Schuldgefühlen 0 1 2 3 4 90. dem Gedanken, daß irgend etwas mit Ihrem Verstand nicht in Ordnung ist 0 1 2 3 4 210 Anhang ANHANG 8 Fragebogen zur Beurteilung der Rehabilitation FBReha Jetzt würden wir gerne von Ihnen wissen, wie Ihre gesundheitlichen Beschwerden und seelischen Probleme im Beruf und Alltag eingeschränkt haben und ob sich durch die Rehabilitation eine Veränderung dieser Einschränkung ergeben hat. 1. Wenn Sie jetzt an Ihre Kontakte zu anderen Menschen vor der Rehabilitation denken - haben sich diese durch die Rehabilitation verändert? Kontakte zu anderen Menschen waren vor der Rehabilitation kein Problem für mich ja, stimmt 0 Wenn nein: Meine Kontakte zu anderen Menschen haben sich durch die Rehabilitation ... 2. stark gebessert etwas gebessert nicht verändert etwas verschlechtert stark verschlechtert 1 2 3 4 5 Wenn Sie jetzt an Ihre körperlichen Probleme und deren Auswirkungen auf Ihre beruflichen oder häuslichen Aufgaben vor der Rehabilitation denken - haben sich diese durch die Rehabilitation verändert? Körperliche Probleme und deren Auswirkungen auf häusliche Aufgaben waren vor der Rehabilitation kein Problem für mich ja, stimmt 0 Wenn nein: Meine körperlichen Probleme und deren Auswirkungen auf häusliche Aufgaben haben sich durch die Rehabilitation ... 3. stark gebessert etwas gebessert nicht verändert etwas verschlechtert stark verschlechtert 1 2 3 4 5 Wenn Sie jetzt an Ihre seelischen Probleme und deren Auswirkungen auf Ihre beruflichen oder häuslichen Aufgaben vor der Rehabilitation denken - haben sich diese durch die Rehabilitation verändert? Seelische Probleme und deren Auswirkungen auf häusliche Aufgaben waren vor der Rehabilitation kein Problem für mich ja, stimmt 0 Wenn nein: Meine seelischen Probleme und deren Auswirkungen auf häusliche Aufgaben haben sich durch die Rehabilitation ... stark gebessert etwas gebessert nicht verändert etwas verschlechtert stark verschlechtert 1 2 3 4 5 211 Anhang Wenn Sie jetzt noch einmal an Ihre gesundheitsbezogenen Einschränkungen bei alltäglichen Tätigkeiten, im Beruf und in der Freizeit vor der Rehabilitation denken - haben sich diese durch die Rehabilitation verändert? 4. Gesundheitliche Einschränkungen bei alltäglichen Tätigkeiten waren vor der Rehabilitation kein Problem für mich ja, stimmt 0 Wenn nein: Meine gesundheitlichen Einschränkungen bei alltäglichen Tätigkeiten haben sich durch die Rehabilitation ... 5. stark gebessert etwas gebessert nicht verändert etwas verschlechtert stark verschlechtert 1 2 3 4 5 Meine gesundheitlichen Einschränkungen im Beruf waren vor der Rehabilitation kein Problem für mich ja, stimmt 0 Wenn nein: Meine gesundheitlichen Einschränkungen im Beruf haben sich durch die Rehabilitation ... 6. stark gebessert etwas gebessert nicht verändert etwas verschlechtert stark verschlechtert 1 2 3 4 5 Meine gesundheitlichen Einschränkungen in der Freizeit waren vor der Rehabilitation kein Problem für mich ja, stimmt 0 Wenn nein: Meine gesundheitlichen Einschränkungen in der Freizeit haben sich durch die Rehabilitation ... stark gebessert etwas gebessert nicht verändert etwas verschlechtert stark verschlechtert 1 2 3 4 5 212 Anhang ANHANG 9 Fragebogen zum allgemeinen Gesundheitszustand SF-36 In diesem Fragebogen geht es um die Beurteilung Ihres Gesundheitszustandes. Der Bogen ermöglicht es, im Zeitverlauf nachzuvollziehen, wie Sie sich fühlen und wie Sie im Alltag zurechtkommen. Bitte beantworten Sie jede der Fragen, indem Sie bei den Antwortmöglichkeiten die Zahl ankreuzen, die am besten auf Sie zutrifft. 1. Ausgezeichnet Sehr gut Gut Weniger gut Schlecht 1 2 3 4 5 Wie würden Sie Ihren Gesundheitszustand im allgemeinen beschreiben? 2. Derzeit viel Derzeit etwas besser als vor besser als vor einer Woche einer Woche 1 2 Etwa wie vor einer Woche Derzeit etwas schlechter als vor einer Woche Derzeit viel schlechter als vor einer Woche Im Vergleich zur vergangenen Woche, wie würden Sie Ihren derzeitigen Gesund- 3 4 5 heitszustand beschreiben? Im folgenden sind einige Tätigkeiten beschrieben, die Sie vielleicht an einem normalen Tag ausüben. Sind Sie durch Ihren derzeitigen Gesundheitszustand bei diesen Tätigkeiten eingeschränkt? Wenn ja, wie stark? 3. a. b. Ja, Ja, Nein, überhaupt nicht stark eingeschränkt etwas eingeschränkt eingeschränkt 1 2 3 1 2 3 anstrengende Tätigkeiten, z.B. schnell laufen, schwere Gegenstände heben, anstrengenden Sport treiben. Mittelschwere Tätigkeiten, z. B. einen Tisch verschieben, Staubsaugen, Kegeln, Golf spielen. c. Einkaufstaschen heben oder tragen. 1 2 3 d. mehrere Treppenabsätze steigen. 1 2 3 e. einen Treppenabsatz steigen. 1 2 3 f. sich beugen, knien, bücken. 1 2 3 g. mehr als 1 Kilometer zu Fuß gehen 1 2 3 h. mehrere Straßenkreuzungen weit zu Fuß gehen 1 2 3 i. eine Straßenkreuzung weit zu Fuß gehen 1 2 3 j. sich baden oder anziehen. 1 2 3 Hatten Sie in der vergangenen Woche aufgrund Ihrer körperlichen Gesundheit irgendwelche Schwierigkeiten bei der Arbeit oder anderen alltäglichen Tätigkeiten im Beruf bzw. zu Hause? 4. Ja Nein a. Ich konnte nicht so lange wie üblich tätig sein 1 2 b. Ich habe weniger geschafft als ich wollte 1 2 c. Ich konnte nur bestimmte Dinge tun 1 2 d. Ich hatte Schwierigkeiten bei der Ausführung 1 2 Hatten Sie in der vergangenen Woche aufgrund seelischer Probleme irgendwelche Schwierigkeiten bei der Arbeit oder anderen alltäglichen Tätigkeiten im Beruf bzw. zu Hause (z.B. weil Sie sich niedergeschlagen oder ängstlich fühlten)? 5. Ja Nein a. Ich konnte nicht so lange wie üblich tätig sein 1 2 b. Ich habe weniger geschafft als ich wollte 1 2 c. Ich konnte nicht so sorgfältig wie üblich arbeiten 1 2 213 Anhang überhaupt 6. nicht etwas mäßig ziemlich sehr 2 3 4 5 Wie sehr haben Ihre körperliche Gesundheit oder seelische Probleme in der vergangenen Woche Ihre normalen Kontakte zu Familienangehöri- 1 gen, Freunden, Nachbarn oder zum Bekanntenkreis beeinträchtigt? 7. Wie stark waren Ihre Schmerzen in der vergangenen Woche? Keine Sehr leicht Leicht Mäßig stark Sehr stark 1 2 3 4 5 6 etwas mäßig ziemlich sehr 2 3 4 5 überhaupt 8. nicht Inwieweit haben die Schmerzen Sie in der vergangenen Woche bei der Ausübung Ihrer Alltagstätigkeiten zu Hau- 1 se und im Beruf behindert? In diesen Fragen geht es darum, wie Sie sich fühlen und wie es Ihnen in der vergangenen Woche gegangen ist. (Bitte kreuzen Sie in jeder Zeile die Zahl an, die Ihrem Befinden am besten entspricht). Wie oft waren Sie in der vergangenen Woche 9. Immer Meistens Ziemlich oft Manchmal Selten Nie a. ... Schwung? 1 2 3 4 5 6 b. ... sehr nervös? 1 2 3 4 5 6 c. ... so niedergeschlagen, dass Sie nichts aufheitern konnte? 1 2 3 4 5 6 d. ... ruhig und gelassen? 1 2 3 4 5 6 e. ... voller Energie? 1 2 3 4 5 6 f. ... entmutigt und traurig? 1 2 3 4 5 6 g. ... erschöpft? 1 2 3 4 5 6 h. ... glücklich? 1 2 3 4 5 6 i. ... müde? 1 2 3 4 5 6 10. Immer Meistens Manchmal Selten Nie 1 2 3 4 5 Wie häufig haben Ihre körperliche Gesundheit oder seelische Probleme in der vergangenen Woche Ihre Kontakte zu anderen Menschen (Besuche bei Freunden, Verwandten usw.) beeinträchtigt? Inwieweit trifft jede der folgenden Aussagen auf Sie zu? trifft 11. sehr zu trifft weitgehend zu weiß nicht trifft trifft weitgehend überhaupt nicht zu nicht zu a. Ich scheine etwas leichter als andere krank zu werden. 1 2 3 4 5 b. Ich bin genauso gesund wie alle anderen, die ich kenne. 1 2 3 4 5 c. Ich erwarte, dass meine Gesundheit nachlässt. 1 2 3 4 5 d. Ich erfreue mich ausgezeichneter Gesundheit. 1 2 3 4 5 214