Projekt 9 PDF
Werbung

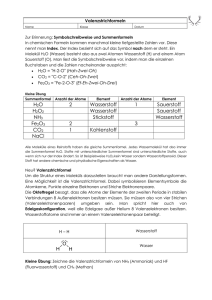
Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb „Jugend forscht in der Technik – Auf den Spuren des kleinen Albert“ teil! Titel der Projektarbeit: Solar - Wasserstoff - Kreislauf Fachgebiet: Umwelttechnik Projektbetreuer: Schulklasse: Stix Christian Fachbereich Elektrotechnik - 11 Schüler Name: Schule: Unterguggenbergerstraße 8 Straße: PTS Wörgl 6300 Wörgl 9.Schulstufe PLZ/Ort: Schulstufe: E-Mail: PLZ/Ort: [email protected] 0680 21 51 5 61 6300 Wörgl Telefon: Kleingruppe: Weitere Projektleiter (Vor-/Nachname) (Vor-/Nachname) Straße (Vor-/Nachname) PLZ/Ort (Vor-/Nachname) E-Mail (Vor-/Nachname) Telefon (Vor-/Nachname) Schule, Schulstufe (Vor-/Nachname) Gruppenmitglieder: Desiree Stofner und Marlene Hopfgartner | T 05 90 90 5 – DW 1231 und DW 1264 | M [email protected] u. [email protected] Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 2/2 wko.at/tirol/jufotech Kurzfassung unserer Arbeit: Wir wollen mit unserem Projekt aufzeigen, dass es Alternativen zu dem heute gängigen Energielieferanten wie z. B. Kohle, Erdgas und Erdöl gibt. Wir befassen uns mit einem Solar-Wasserstoff-Kreislauf. In unserem Projekt geht es darum, dass wir in einer Brennstoffzelle unseren selbst erzeugten Wasserstoff und Sauerstoff „verbrauchen“, um ein Gerät (z. B. einen Ventilator) mit elektrischem Strom zu versorgen. Wasserstoff soll dabei auch durch eine „saubere“ Energieform (z. B. solare Energie) erzeugt werden. Eine Aktion der Kooperationspartner: Wirtschaftskammer Tirol, Förderverein Technik Tirol Desiree Stofner und Marlene Hopfgartner | T 05 90 90 5 – DW 1231 und DW 1264 | M [email protected] u. [email protected] Solar‐Wasserstoff‐Kreislauf Sinn und Zweck unserer Forschung Wir verschmutzen die Erde seit gut einem Jahrhundert durch die Verbrennung von Kohle, Erdgas und Erdöl. Wir wollen mit unserem Projekt aufzeigen, dass es Alternativen zu dem heute gängigen Energielieferanten wie z.B. Kohle, Erdgas und Erdöl gibt. Wir befassen uns mit einem Solar-WasserstoffKreislauf. In unserem Projekt geht es darum, dass wir in einer Brennstoffzelle unseren selbst erzeugten Wasserstoff und Sauerstoff „verbrauchen“, um ein Gerät (z.B. einen Ventilator) mit elektrischem Strom zu versorgen. Wasserstoff soll dabei auch durch eine „saubere“ Energieform (z.B. solare Energie) erzeugt werden. Für unser Projekt haben wir folgende Bücher verwendet: Wasserstoff - Energie für morgen (ISBN 978-3-535161-05-3) Brennstoffzellen im Unterricht (ISBN 978-3937863-13-9) PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 1 Solar‐Wasserstoff‐Kreislauf Herstellung von Wasserstoff durch Elektrolyse Bei der Elektrolyse werden durch elektrischen Strom chemische Verbindungen zersetzt. Wasser (H20) kann in seine Bestandteile – 2 Teile Wasserstoff und 1 Teil Sauerstoff zerlegt werden. Eine Elektrolyse besteht aus … einer negativ geladenen Kathode einer positiv geladenen Anode einem Elektrolyten Elektrolyte können sein: Gelöste Elektrolyte Wir verwenden in unseren Versuchen destilliertes Wasser, in dem wir entweder Kochsalz, verdünnte Salzsäure oder verdünnte Schwefelsäure zugeben. Feste Elektrolyte Wir verwenden in unseren Versuchen eine Zelle, die aus einer mit Platin beschichteten Anode und Kathode besteht. Die Anode und Kathode sind durch eine Membran, die nur Protonen (Protonen sind Wasserstoffatome ohne Elektron) durchlässt, voneinander getrennt. PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 2 Solar‐Wasserstoff‐Kreislauf Unsere Versuche zur Wasserstoffproduktion - Elektrolyse ohne Elektrolyt Beim diesem Versuch haben wir keinen Elektrolyten verwendet. Der Versuch, ein Wassermolekül in Wasserstoff und Sauerstoff aufzuspalten, hat nicht funktioniert. Ohne Elektrolyt konnten wir keinen Wasserstoff produzieren. - Elektrolyse mit einem Elektrolyten Beim diesem Versuch verwendeten wir als Elektrolyten Kochsalz (NaCl). Bei der Elektrolyse konnten wir aus der Salz-Wasserlösung Wasserstoffgas (H2) und Chlorgas (Cl2) gewinnen. Für den Versuch verwendeten wir einen Glasbehälter, in den je ein Reagenzglas über eine Kohlenstoff-Kathode und eine Kohlenstoff-Anode gesetzt wurde. Als Spannungsversorgung verwendeten wir ein Labornetzgerät. Wir stellten eine Spannung von ca. 10 Volt ein. Es wäre aber durchaus möglich, anstelle des Netzgerätes eine Solarzelle als Spannungsversorgung zu verwenden. Das gleiche Ergebnis lieferte der Versuch mit verdünnter Salzsäure (HCl). Da für uns als unerwünschtes Nebenprodukt das giftige Chlorgas entstand, sind diese Elektrolyte für uns nicht interessant. PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 3 Solar‐Wasserstoff‐Kreislauf - Elektrolyse mit verdünnter Schwefelsäure (H2SO4) Wir haben 200 ml destilliertes Wasser mit 75 ml 20 prozentiger Schwefelsäure (ist unser Elektrolyt) vermengt. Die Lösung wurde in einem Hoffmannsche Zersetzungsapparat eingefüllt. Für den Versuch verwendeten wir zuerst Kohlenstoffelektroden. Es zeigte sich jedoch, dass Wasserstoff produziert wurde, aber der Sauerstoff mit dem Kohlenstoff eine Verbindung einging. Zudem wurde die Kohlenstoffelektrode zersetzt. Nach diesem Ergebnis verwendeten wir Platinelektroden. Dabei wurde am Minuspol (Kathode) Wasserstoff und am Pluspol (Anode) Sauerstoff im Verhältnis 2:1 produziert. Als Spannungsversorgung verwendeten wir wieder ein Labornetzgerät. Zusätzlich führten wir den Versuch im Freien durch. Dazu verwendeten wir eine Solarplatte, die uns eine Spannung von ca. 27 Volt bei vollem Sonnenschein lieferte. Um die Stromstärke und damit die Wasserstoffproduktion zu reduzieren, setzen wir Widerstände in die Schaltung ein. PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 4 Solar‐Wasserstoff‐Kreislauf - Elektrolyse mit festem Elektrolyt Dazu verwendeten wir einen sogenannten PEM-Elektrolyseur, wie auf der schematischen Abbildung dargestellt. Funktion unseres PEM‐Elektrolyseurs Unser echter Elektrolyseur Auch durch diese Elektrolyseart wird Sauerstoff und Wasserstoff im Verhältnis 2:1 gewonnen. Das Herzstück des Elektrolyseurs ist eine dünne Membrane, die nur Protonen durchlässt. Anode und Kathode sind mit Platin beschichtet. Die Platinbeschichtung wirkt wie ein Katalysator, er ermöglichte uns die Wasserzersetzung bei Raumtemperatur. Als Spannungsquelle verwendeten wir eine Photovoltaik-Anlage. Die Sonne wurde durch eine 120 Watt Lampe simuliert. Die Reaktionen beim Elektrolyseur sind: 4H + 4e- +O2 An der Anode: 2H2O An der Kathode: 4H + 4e- 2H2 Aus zwei Wassermolekülen (H2O) entstehen zwei H2 Moleküle und ein O2 Molekül PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 5 Solar‐Wasserstoff‐Kreislauf Die Brennstoffzelle Dazu verwendeten wir eine sogenannte PEM- Brennstoffzelle. Unsere Brennstoffzelle verwendet den gewonnen Wasserstoff und Sauerstoff um elektrischen Strom zu erzeugen. Sie besteht aus einem Wasserstoffeingang, einem Sauerstoffeingang (kann auch der Sauerstoff aus der Umgebungsluft sein), einer protonenleitenden Membran, einer Anode und einer Kathode. Die Brennstoffzelle wandelt chemische Energie in elektrische Energie um. Sauerstoffeingang Anode Wasserstoffeingang Kathode Unsere zerlegte Brennstoffzelle In diesem Bild sieht man, wie links die Wasserstoffmoleküle und rechts die Sauerstoffmoleküle zur Zelle kommen. Der Wasserstoff stößt auf die mit Platin beschichtete Anode. Hier wird der Wasserstoff in ein Elektron und in ein Proton aufgespalten. Die Anode ist mit Platin beschichtet, damit auch bei Raumtemperatur die Reaktion stattfinden kann (wirkt wie ein Katalysator bei einem Auto). Die gelb dargestellte Membran lässt nur die Protonen durch, die dann zum Sauerstoff gelangen. Die Elektronen können als elektrische Energie genutzt werden. Auf der Kathodenseite werden die Protonen und der Sauerstoff mit den Elektronen wieder zu einem Wassermolekül vereint. PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 6 Solar‐Wasserstoff‐Kreislauf Unser Versuchsaufbau Wir haben den im Elektrolyseur gewonnen Wasserstoff und Sauerstoff zur Betreibung der Wasserstoffzelle verwendet. Die Solaranlage versorgt den Elektrolyseur mit Strom. Der Elektrolyseur sorgt dafür, das Wasser in zwei H2-Moleküle und einem O2-Molekül aufgespalten wird. Die beiden H2- Moleküle und das O2-Molekül werden zur Brennstoffzelle geleitet und dort wieder in Strom umgewandelt. PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 7 Solar‐Wasserstoff‐Kreislauf Unsere Meinung zum Solar-Wasserstoff-Kreislauf Uns haben die Experimente sehr gut gefallen. Wir finden, es ist eine Möglichkeit für unsere Zukunft, Wasserstoff „sauber“ zu produzieren, ihn als Energiespeicher zu verwenden und ihn in elektrische Energie in einer Brennstoffzelle umzuwandeln. Toll daran ist, dass das einzige „Abfallprodukt“ Wasser ist. Die Wirtschaft muss in solche Technologien investieren um unsere Umwelt zu schützen. Gibt es bereits Umsetzungen in der Praxis? Ja! Hyundai entschloss sich ein Fahrzeug mit Brennstoffzellen-Antrieb zu bauen, da es sich um eine wegweisende Technologie handelt. Als Hauptabsatzmarkt sieht das Unternehmen Europa, weil es bei uns eine starke Umweltpolitik und der Wille für den Aufbau eines Wasserstoff Tankstellennetzes gibt. Das abgasfreie Fahrzeug (www.hyundai.de/Modelle/Alle-Modelle/ix35-FCEV.html) hat 136 PS und beschleunigt in 12,5 Sekunden von 0 auf 100 km/h und erreicht eine Reichweite von bis zu 594 Kilometer pro WasserstoffTankfüllung. Die Tanks sind an der Hinterachse positioniert und können mit 5,64 Kilogramm Wasserstoffgas bei 700 bar in circa drei Minuten betankt werden. Der Brennstoffzellenblock, der Elektromotor, der Akku und der Wasserstofftank sind die Hauptbestandteile des Autos. Wenn der Wasserstoff aus dem Tank in den Brennstoffzellenblock gelangt, wird er dort in Protonen und Elektronen zerlegt. Der Elektronenfluss, der in der Brennstoffzelle entsteht, liefert Energie, während die Protonen mit Sauerstoffmolekülen aus der Luft reagieren und dabei Wasser erzeugen. Die elektrische Energie aus der Brennstoffzelle wird im Motor in mechanische Energie umgewandelt (Antrieb der Räder). Als „Abgas“ bleibt reines Wasser übrig! PTS – Wörgl, Klasse D, Gruppe ‐ Elektrotechnik Seite 8