Text anzeigen
Werbung

Aufbauformen der festen Materie
Einkristalline Festkörper ( Silizium, Quarz, Bergkristall, Diamant, ...)
regelmäßige Nah- und Fernordnung der Atome / Moleküle im Gitter
Polykristalline Festkörper (fast alle Metalle, Mineralien, Poly - Si, ...)
regelmäßige Nahordnung in kleinen Kristalliten (Körner), die durch
Korngrenzen gebunden sind
Teilkristalline Festkörper (Kunststoffe,...)
Aufbau aus kristallinen und amorphen Bereichen
Amorphe Festkörper (Gläser, Harze, Kunststoffe,...)
isotrope Anordnung der Atome, Moleküle
gewisse Nahordnung entsprechend der Bindung, keine Fernordnung
Kristalle sind anisotrop, d.h. unterschiedliches Aussehen in verschiedenen Richtungen
Regelmäßige Nah- und Fernordnung der Atome / Moleküle auf Gitterplätzen
Kristalle sind homogene aber anisotrope Körper
Kristallaufbau, Gitterform sind abhängig von der chemischen Bindung
Physikalische, elektronische Eigenschaften resultieren aus dem Gitteraufbau
Ideale, defektfreie Kristalle existieren nur als Denkmodell;
Begrenzende Oberfläche (Siliziumstab, Si-Scheibe, ...)
Kristallfehler (Versetzungen, Punktdefekte, Verunreinigungen)
Anisotropie führt zu anisotropen Eigenschaften: Ätzraten, E-Modul, thermischer Ausdehnungskoeffizient,
piezoelektrischer Effekt (Quarz), piezoresistiver Effekt (Silizium), ...
Symmetrieoperationen an Kristallgittern
mögliche Symmetrieoperationen:
Spiegelungen an einer Ebene
Drehungen um eine Achse: 2, 3, 4, 6 - zählige Symmetrie entsprechend
180°, 120°, 90°, 60°
Inversion = Spiegelung an einem Punkt
Drehinversion = Drehung und Spiegelung an einem Punkt der Drehachse
7 verschiedene Kristallsysteme (Triklin, Monoklin, Rhombisch, Hexagonal,
Rhomboedrisch, Tetragonal und kubisch) sind ausreichend zur Beschreibung
aller Kristalle und
14 verschiedene Elementarzellen (Bravais - Gitter)
F
Vergleich der chemischen Bindungstypen
Bindungstyp
Beispiel
Bindungsen.
(eV/Atom)
Typische für
Stoffklasse
Bindungskräfte
1. Ionenbindung
NaCl
LiF
7,9
10,6
Alkalihalogenide
isotrop, lange
Reichweite
2. Kovalente Bindung
Diamant
Si
Ge
7,3
4,6
3,9
Halbleiter
anistrop, mittlere
Reichweite
2.a. Wasserstoffbrückenbindung
H2O(Eis)
HF
0,52
0,3
Wasserstoffverbindungen
(Sonderfall von 2.)
3. Metallbindung
Cu
Ag
3,5
3,0
Metalle
isotrop, kurze-mittlere
Reichweite
4. van der WaalsBindung
Ar
CH4
0,08
0,1
Edelgaskristalle
isotrop, sehr kurze
Reichweite
Beispiele für Ionengitter
CsCl (KZ = 8)
2 Kubisch primitive Gitter sind um eine
halbe Gitterperiode versetzt ineinander
gestellt
NaCl (KZ = 6)
2 Kubisch flächenzentrierte Gitter sind
um eine halbe Periode versetzt
ineinander gestellt
Siliziumgitter oder Diamantgitter (4 kovalente Bindungen)
• 2 kubisch flächenzentrierte
Gitter sind um 1/4 Periode
versetzt ineinander gestellt
• Jedes Si-Atom hat 4
Bindungen und 4 nächste
Nachbarn (KZ = 4)
• Si-Atom bildet mit
den 4 Nachbarn einen
Tetraeder
• Weitere Stoffe:
Si, Ge, Sn, Diamant, ...
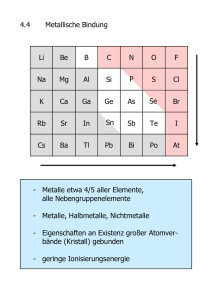
3. Metallbindung
Metallbindung
• Besonderheit von Metallen:
gute elektrische Leitfähigkeit, gute thermische Leitfähigkeit, Dehnbarkeit,
Deformierbarkeit, hohe Dichte, thermische Abgabe von Elektronen.
• Dichteste Kugelpackung:
Die meisten Metalle haben Gitter mit KZ = 12 und kubisch oder hexagonal
dichtester Kugelpackung (Füllgrad 74%). Es gibt zu wenige Valenzelektronen, um
zu allen 12 Nachbaratomen eine Bindung aufzubauen!
• Theorie von Pauling:
Pro Atom werden entsprechend der Valenzelektronen eine bestimmte Zahl von
Bindungen (<12) aufgebaut, die zwischen den Nachbarn fluktuieren. Deshalb
können sich die Valenzelektronen ohne Energieaufwand von einem zum anderen
Atom bewegen.
• Metallgittertypen:
Kubisch flächenzentrierte dichteste Kugelpackung (KZ = 12): Cu, Au, ...
Hexagonal dichteste Kugelpackung (KZ = 12): Be, Mg, Ti, Zn, Cd, Co, ...
Weitere Metalle: Kubisch raumzentriertes Gitter (KZ = 8): Fe, Cr, W, ...
Metallgitter mit KZ = 12
Hexagonal
dichteste
Kugelpackung
Schichtfolge:
ABAB ...
Kubisch
dichteste
Kugelpackung
Schichtfolge:
ABCABC ...
Wichtige Grundbegriffe der Kristallographie
Gitterpunkte m n p
Zahlentripel m n p in Einheiten der Achsen gemessen
Geraden / Richtungen [m n p]
Die zwei Punkte (0 0 0) und (m n p) definieren die Gerade [m n p]
Gleichwertige Richtungen <h k l>
Identische parallele Geraden oder durch Symmetrie verknüpfte Geraden
Netzebenen / Gitterebenen (h k l)
je zwei Geraden definieren eine Netzebene
je drei Punkte definieren eine Netzebene (AOO), (OBO), (OOC)
Netzebenen legen die Kristalloberfläche bei realen Kristallen fest
Millersche Indizes einer Ebene (h k l)
(h k l) = (f/A f/B f/C) bei orthogonalen Achsen, f ist die kleinste gemeinsame
Zahl
Wichtige Ebenen im kubischen Kristall und deren Bezeichnungen
z=c
x
x=a
A = 1, B = ∞, C = ∞
x
Die wichtigsten Ebenen des Siliziumkristalls in der Elementarzelle
Winkel zwischen den Kristallebenen:
∠{100},{100}: 0°, 90°
∠{100},{110}: 45°, 90°
∠{110},{111}: 35,26°
∠{110},{110}: 0°, 60°, 90°
∠{111},{111}: 0°, 70,53°
∠{100},{111}: 54,7°
Kristallwachstum
• Ionen nehmen energetisch günstigste
Position ein; Kristallwachstum:
Energie
wird frei; Kristallschmelzen: Energie
muss aufgewendet werden
• Beispiel des NaCl-Typ-Ionengitters:
Bindungsposition Energiegewinn
1 = Ebene
0,0662 e2 /r
2 = Kante
0,1807 e2 /r
3 = Ecke
0,8738 e2 /r
• Ecken werden zuerst gefüllt; Ebenen
wachsen als Ebenen weiter
Klassifizierung der Fehlstellen in Kristallen
Dimension
Bezeichnung
Fehlstellendichte
Beispiele
0
Atomare Fehlstellen
Punktfehler
Frenkel-Defekt
Schottky-Defekt
ρaF ≡ NaF/V in m-3
1022 hochreines Si < 1012/cm3
..
1027 technische Reinheitsgrade
Leerstellen,
Zwischengitteratome,
Fremdatome,
Mehrfachfehlstellen,...
1
Versetzungen
(Dislocations)
ρd ≡ Ld/V in m-2
103 „versetzungsfreies“ Si
..
1016 Metall, kalt gewalzt
gerade Versetzungen,
Versetzungsringe,
-Knäuel,...
2
Innere Grenzflächen
ρGF ≡ AGF/V in m-1
102 Einkristall (äußere Oberfläche)
..
109 nanokristalline Materialien,
Multischichtsysteme
Korngrenzen,
Phasengrenzflächen,
Stapelfehler,...
3
Ausscheidungen,
Einschlüsse,
(Partikel)
ρP ≡ VP/V in m0
10-8 Restausscheidungen in
hochreinem Si, Au.
..
0,5 Zweiphasige Legierungen
Ausscheidungen,
Hohlräume,
Gasbläschen,...
Atomare Fehlstellen in einem kubisch - flächenzentrierten Gitter
(a)
(b)
(c)
(d)
(e)
Leerstellen: Fehlen eines Atoms im regulären Gitter (a), Doppelleerstelle (b)
Substitutionelles Fremdatom: Sitzt auf regulärem Gitterplatz (c)→ Dotierung
Zwischengitteratome: Zusätzliches Gitteratom der gleichen Sorte (d)
Interstitielles Fremdatom: sitzt auf einem Zwischengitterplatz (e)
Fehlstellen haben Bedeutung für thermisches Fehlstellengleichgewicht,
Platzwechsel und Diffusion, Kinetik von Festkörperreaktionen,
Bestrahlungseffekte, Stöchiometrieabweichungen, Dotierung von
Halbleiterbauelementen, Lichterzeugung mit Laser.
Klassifizierung von Kristallfehlern
Schottky-Defekte (auch: Schottky-Fehlordnung) gehören zu den Gitterfehlern,
die in Kristallgittern vorkommen. Sie sind Punktdefekte. Schottky-Defekte
bezeichnen eine Variante, bei der Paare von Leerstellen in einem Ionengitter
auftreten. Im einfachsten Fall fehlt jeweils im Anionenteilgitter und im
Kationenteilgitter ein Ion. Die Fehlordnung ist nach Walter Schottky benannt.
Gelegentlich wird auch eine einzelne Leerstelle in einem Ionengitter schon als
Schottky-Defekt bezeichnet.
Die Schottky-Fehlordnung wir dadurch erzeugt, dass oberflächennahe Ionen
ihren Gitterplatz verlassen, an die Oberfläche des Kristalls abwandern und sich
dort anlagern. Die entstehenden Leerstellen können sich durch
Leerstellenwanderung im Kristall bewegen. Sie können daher wesentlich zum
Stofftransport und zur Reaktivität eines Festkörpers beitragen.
Schottky-Defekte sind eine natürliche Eigenschaft vieler Ionenkristalle, d.h. sie
liegen im chemischen Gleichgewicht vor. Beispiele für solche Kristalle sind die
Alkalihalogenide, wie Natriumchlorid und Kaliumchlorid.
Die Konzentration ("Defektkonzentration") der Leerstellen
kann formal über eine Art Massenwirkungsgesetz
beschrieben werden. Die Anzahl der Schottky-Defekte
nimmt mit steigender Temperatur zu, weil durch sie
die Entropie erhöht wird (energetisch sind sie ungünstig).
Klassifizierung von Kristallfehlern
Frenkel-Defekte (auch: Frenkel-Fehlordnung oder Frenkel-Paare) sind bestimmte, in
Kristallgittern vorkommende Punktfehler. Sie sind nach dem russischen Physiker Jakow
Iljitsch Frenkel benannt, der sie erstmals beschrieb.
Ein Frenkel-Defekt entsteht dadurch, dass ein Ion oder Atom seinen regulären Gitterplatz
verlässt und auf eine normalerweise nicht besetzte Position im Kristallgitter wandert.
Dadurch entsteht jeweils eine Leerstelle und ein Zwischengitteratom (bzw. ein
Zwischengitterion). Zwischen dem Zwischengitteratom und der Leerstelle besteht eine
anziehende Wechselwirkung. Gelegentlich wird der Begriff Frenkel-Defekt auch nur auf ein
Zwischengitter-Kation und die dazugehörige Leerstelle in Ionenkristallen bezogen, wo
dieser Defekt-Typ auch häufig anzutreffen ist. In diesem Zusammenhang ist auch der
Begriff Anti-Frenkel-Defekt zu verstehen, womit dann ein Anion auf einem
Zwischengitterplatz gemeint ist. Die Tatsache, dass solche Defekte fast ausschließlich bei
Kationen auftreten (daher auch der spezielle Name für anionische Fehlstellen) ist darauf
zurückzuführen, dass Anionen in einem Kristall aufgrund des zusätzlichen Elektrons
meistens die wesentlich größeren, raumfüllenderen Ionen sind. Damit sind Anionen auf
Zwischengitterplätzen energetisch ungünstiger und seltener als Kationen.
Frenkel-Defekte sind eine natürliche Eigenschaft vieler Ionenkristalle, das heißt, dass sie
schon im chemischen Gleichgewicht vorliegen. Beispiele für solche Kristalle sind die
Silberhalogenide wie Silberchlorid und Silberbromid, in denen Frenkelpaare die häufigsten
Punktfehler sind. Die Konzentration der Leerstellen kann formal über eine Art
Massenwirkungsgesetz beschrieben werden. Die Anzahl der Frenkel-Defekte nimmt mit
steigender Temperatur zu.
Klassifizierung von Kristallfehlern
Ein Stapelfehler ist ein 2-dimensionaler Gitterfehler in bestimmten
Kristallstrukturen. Er tritt z. B. in der kubisch-flächenzentrierten
Kristallstruktur auf, die als Stapelung von Kristallebenen mit der Abfolge
ABCABC... beschrieben werden kann. Wird diese Regelmäßigkeit unterbrochen
(z. B. ABCBCABC...) so liegt ein Stapelfehler vor. Der Stapelfehler ist ein
wichtiger Gitterfehler, da er zur Bildung von Korngrenzen führt und so die
Bildung von Einkristallen verhindert. Stapelfehler entstehen, wenn eine Partial
versetzung durch den Kristall läuft. Je kleiner die dazu nötige Energie
(Stapelfehlerenergie, stacking fault energy, SFE) ist, desto leichter lässt sich ein
Stapelfehler bilden. Silber hat eine niedrige SFE (20mJ/m²), Versetzungen
können sich deshalb leicht in Partialversetzungen aufspalten.
Schraubenversetzungen müssen dann zum Quergleiten unter Energieaufwand
wieder einschnüren, deswegen steigt die Festigkeit. Die SFE von Aluminium ist
sehr hoch (180mJ/m²), die Versetzungen spalten daher kaum auf. Das ist mit ein
Grund für die niedrige Festigkeit von Al.
Versetzungen in Einkristallen
Modellvorstellung:
1. Kristall entlang einer Netzebene einschneiden,
2. um den Translationsvektor
des Gitters b verschieben
und
3. wieder zusammenfügen
(a) Stufenversetzung durch Entfernen der Atome einer halben Netzebene
(b) Stufenversetzung durch Abscheren eines Kristallviertels
(c) Schraubenversetzung durch Abscheren des Kristalls entlang der Gleitebene
Versetzung haben Bedeutung für: plastische Verformung, Kriechen, Kristallwachstum
innere Spannungen, Quellen und Senken für atomare Fehlordnung, innere Reibung
Schematische Darstellung von Korngrenzen in Kristallen
Symmetrische
Drehkorngrenze
KleinwinkelKippDrehkornKorngrenze
grenze (Draufsicht)
Korngrenzen haben Bedeutung für Vielkristallverformung, Epitaxie,
Bruchvorgänge, Verbundwerkstoffe, Haftung von Schichten, Quellen und Senken
für atomare Fehlordnung, Stöchiometrieabweichungen.
evaporation source
(resistive/e-gun)
transfer tube
gate valve
rotary seal
rotary reaction flask
safety hood
cooling bath
(if required)
diffusion pump
mechanical pump
Festkörpersynthese unterhalb des Schmelzpunktes
shake ‘n bake
Weiter: Gasphase, Schmelze, Precursor
Diffusion in inerten Quarzglasampullen, Metallrohren, Monelampullen (Cu-Ni),
Einhaltung der Stöchiometrie, z.B. Spinell: MgO + Al2O3 → MgAl2O4
Freiberger Aufschluß: 2SnO2 + Na2CO3 + 9 S → 2Na2SnS3 + 3 SO2 + 2CO2
Zusatz von Flussmitteln erfordert die Kenntnis von Phasendiagrammen:
Hochtemperatursupraleiter EuBa2Cu3O7 oder La2-xMxCuO4 mit NaOH bei 320 °C
La2O3 + CuO → La2-xNaxCuO4
Chemische Transportreaktion (CVD)
Mondverfahren: 4CO + Ni → (CO)4Ni (80/200 °C), Halogenlampen
Keine Sublimation, die immer von heiß nach kalt verläuft
Precursoren: Fe oder Zn Oxalate oder von CH3SiCl3 zu SiC
Intercalation: C8K oder LixTiS2
Reduktive Intercalation zu Wolframbronzen:
x Li + WO3 → LixWO3 (0<x<1)
Ionenaustausch: Na2Si2O5 → Ag2Si2O5 (mit AgNO3)
Hochdruckreaktionen: Wasserstoffspeicher LaNi5 + 3H2 → LaNi5H6
Solvothermalsynthesen:
2LiBO2 + B2O3 → Li2B4O7 Piezokristalle (mit HCOOH)
Quarzkristelle aus alkalischer Lösung
Physical Vapour Deposition by Evaporation Methods
Torrovap TVP 800
resistive heating (300 A source)
electron gun (10.0 kW)
2 resitive evaporation sources
2 electron guns
co-evaporation possible
the amount of evaporated material can be monitored by a quartz microbalance
www.anjamudring.de
SFB 558 – B11
PVD
Physical Vapour Deposition: Evaporation Sources
resistive heating (300 A source)
electron gun (10.0 kW)
► 25-2000 °C
► alumina, tungsten container crucibles
► metals, sulfur, selenium, phosphor
and sulfides/selenides
► 1000-2500°C
► containerless method
► metal oxides, halides, carbides,
refractory metals
► kg/hrs
2 resitive sources
www.anjamudring.de
SFB 558 – B11
PVD