Lösung 4
Werbung

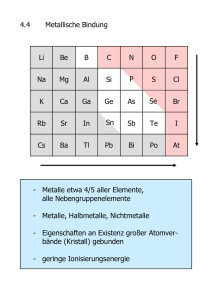
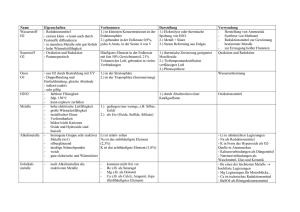
Übungen zur VL Chemie für Biologen und Humanbiologen 25.11.2011 Übung 4 Teil 1: Säuren und Basen 1. Was ist eine Säure und eine Base (nach Brønstedt)? Säure = Protonendonator Beispiel Salzsäure: Freie H+-Ionen treten in wässrigen Lösungen eigentlich nicht auf, sondern nur H3O+-Ionen. Trotzdem sind beide der folgenden Formulierungen zulässig. HCl + H2O → H3O+ + Cloder HCl → H+ + ClBase = Protonenakzeptor Beispiel Natronlauge: NaOH + H3O+ → Na+ + 2 H2O oder NaOH + H+ → Na+ + H2O 2. Wie ist der pH-Wert definiert (Formel)? Der pH-Wert ist der negative dekadische Logarithmus der Protonenkonzentration (bzw. Hydronium-Ionen). pH = -log(c(H+)) oder pH = -log(c(H3O+)) 3. Was bedeutet Mesomerie? Erklären Sie anhand eines Beispiels. Als Mesomerie wird das Phänomen bezeichnet, dass die Bindungsverhältnisse in einem Molekül, was auch ein mehratomiges Ion einschließt, nicht durch eine einzige Strukturformel dargestellt werden können, sondern nur durch mehrere Grenzformeln. Keine dieser Grenzformeln beschreibt die Bindungsverhältnisse und damit die Verteilung der Elektronen in ausreichender Weise. Die tatsächliche Elektronenverteilung im Molekül bzw. Ion liegt zwischen den von den Grenzformeln angegebenen Elektronenverteilungen. Man spricht davon, dass die Elektronen zwischen den am mesomeren System beteiligten Atomen delokalisiert sind. 4. Die Stärke einer Säure hängt hauptsächlich von zwei Kriterien ab: Stabilität des resultierenden Anions Polarität der X-H-Bindung (X = beliebiges Atom) Die Polarität der X-H-Bindung steigt mit steigender Elektronegativitätsdifferenz. Verbindungen (inklusive Anionen) sind umso stabiler, je mehr mesomere Grenzstrukturen beschrieben werden können. Ordnen Sie die folgenden Verbindungen nach Säurestärke: Begründung Schwefelsäure: Die Sauerstoff-Wasserstoff-Bindung ist aufgrund der Elektronegativitätsdifferenz (1,3) sehr polar. Das entstehende Anion nach Abgabe eines Protons kann zudem drei mesomere Grenzstrukturen einnehmen. Essigsäure: Die Sauerstoff-Wasserstoff-Bindung ist aufgrund der Elektronegativitätsdifferenz (1,3) sehr polar. Das entstehende Anion nach Abgabe eines Protons kann zudem zwei mesomere Grenzstrukturen einnehmen. Ethanol: Die Sauerstoff-Wasserstoff-Bindung ist aufgrund der Elektronegativitätsdifferenz (1,3) sehr polar. Mesomere Grenzstrukturen sind nicht formulierbar. Propen: Die Kohlenstoff-Wasserstoff-Bindung ist aufgrund der geringen Elektronegativitätsdifferenz (0,3) nicht sehr polar. Allerdings kann man zwei mesomere Grenzstruktur formulieren. Propan: Die Kohlenstoff-Wasserstoff-Bindung ist aufgrund der geringen Elektronegativitätsdifferenz (0,3) nicht sehr polar. Mesomere Grenzstrukturen sind auch nicht formulierbar. Teil 2: Aggregatszustände, Phasenübergänge 1. Was kennzeichnet einen Kristall? Ein Kristall ist ein Körper, dessen Atome oder Moleküle nicht zufällig, sondern regelmäßig in einem Kristallgitter angeordnet sind. Die charakteristische Eigenschaft eines Kristalls ist seine Fernordnung. Der Kristall ist dreidimensional periodisch aus gleichbleibenden Struktureinheiten aufgebaut. Diese Struktureinheit heißt Einheitszelle oder Elementarzelle. 2. Reine Metalle bilden sehr simple Kristallstrukturen. Wie heißen diese? Bis auf wenige Ausnahmen werden nur drei Kristallstrukturen gebildet. Die kubisch dichteste Kugelpackung, die hexagonal dichteste Kugelpackung und die kubisch raumzentrierte Kugelpackung. kubisch (links) und hexagonal (rechts) dichteste Kugelpackung Info: Falls Sie mit gleich großen Murmeln, Orangen oder Äpfeln versuchen eine große Kiste möglichst effektiv zu füllen, werden Sie auf die kubische oder hexagonal dichtiste Kugelpackung stoßen. Die Raumausfüllung der kubisch raumzentrierten Kugelpackung ist etwas schlechter. 3. Ionenverbindungen bilden unzählbar viele Varianten an Kristallstrukturen (siehe Beispiele in Abbildungen). Nennen Sie zwei Gründe dafür, dass Ionenverbindungen komplexere Kristallstrukturen bilden als reine Metalle. - die verschiedenen Ionen haben unterschiedliche Radien - die Ionen können unterschiedliche Ladungen tragen, was in unterschiedlichen Koordinationszahlen und Abständen resultiert - Ionenverbindungen können aus mehreren verschiedenen Elementen in einer Vielfalt von Zahlenverhältnissen bestehen CaTiO3 Al2O3 (Trivialname: Korund) Interessant: Rubine und Saphire sind nichts anderes als Al2O3 mit kleinsten Verunreinigungen an ChromIonen (rote Farbe bei Rubinen) oder Eisen-, Titan- oder Vanadium-Ionen (diverse Farben bei Saphiren). 4. Metalle sind duktil und Ionenverbindungen spröde. Wieso? Wirken Scherkräfte auf eine Ionenverbindung ein, sodass zwei Gitterebenen des Kristalls gegeneinander verschoben werden, kommt es zur Abstoßung zwischen gleich geladenen Ionentypen. Der Kristall bricht, d.h. das Material ist spröde. Metalle bestehen dagegen aus neuralen Atomen. Gitterebenen des Kristallgitters können so ohne Abstoßungsphänomene gegeneinander verschoben werden. Metalle sind daher duktil. Siehe Folien 105 und 106 der Vorlesung. 5. Können alle Verbindungen alle drei Aggregatszustände einnehmen? Ja. Natürlich können die Schmelz- und Siedepunkte extrem unterschiedlich sein. Beispiele: Wasser: Tm = 0 °C, TS = 100 °C Ethanol: Tm = -114 °C, TS = 78 °C Wasserstoff: Tm = -259 °C, TS = -253 °C Eisen: Tm = 1538 °C, TS = 2861 °C Wolfram: Tm = 3422 °C, TS = 5555 °C Eine Ausnahme bilden Substanzen, die sich zersetzen bevor sie den Phasenübergang vollziehen können. Beispiel: 6. Bilden alle Substanzen im festen Aggregatszustand ein Kristallgitter aus? Nein, es gibt Substanzen die teilweise oder vollständig amorph sind, d.h. über keine Fernordnung verfügen. Dies kommt beispielsweise Zustande, wenn eine Flüssigkeit extrem schnell abgekühlt wird. Die Beweglichkeit der Atome oder Moleküle ist dann so gering, dass keine geordnete Kristallstruktur ausgebildet werden kann. Polymere (extrem langkettige organische Moleküle, z.B. Kunstoffe) sind ebenfalls teilweise oder vollständig amorph, da es für die ineinander verschlungenen Molekülketten extrem schwierig ist geordnete Strukturen auszubilden. Auch bei langsamen Abkühlen der Schmelze kann kein vollständig kristallines Material erhalten werden. 7. Sie frieren 10 mL Wasser ein und bringen das Eis in eine Unterdruckkammer. Der Druck wird konstant auf nur 1 mbar (0.001 bar) gehalten. Danach wird die Unterdruckkammer auf 40 °C geheizt. Was passiert? (Tip: Nehmen Sie das Phasendiagramm von Wasser aus dem Vorlesungsskript zu Hilfe) Wie dem Phasendiagramm zu entnehmen ist, kann Eis bei einem Druck geringer als 6 mbar nicht mehr flüssig werden. Ein Erhöhen der Temperatur resultiert in der Sublimation. Das bedeutet, dass das Eis direkt in die Gasphase übergeht. 8. Welche Arten von zwischenmolekularen Wechselwirkungen kennen Sie? - ionische Wechselwirkungen - Dipol-Dipol Wechselwirkungen - Wasserstoffbrückenbindungen - Wechselwirkungen mit Beteiligung induzierter Dipolen (Van-der-Waals Wechselwirkungen) - Verschlaufungen von Makromolekülen 9. Ordnen Sie die folgenden Verbindungen nach der Höhe ihrer Schmelz- bzw. Siedepunkte und begründen Sie Ihre Entscheidung. Lösung: 10. Welche der folgenden Substanzen können Sie miteinander mischen? Lösung: Dies ist nur eine Übung. Die Grenzfälle waren schwer vorherzusagen und werden in der Klausur nicht abgefragt. 11. Was ist eine Lösung? Eine Lösung ein homogenes Gemisch, das aus mindestens zwei chemischen Stoffen besteht. Eine solche Lösung besteht dabei zum einen aus einem oder mehreren gelösten festen, flüssigen oder gasförmigen Stoffen (Solute), zum anderen aus dem in der Regel flüssigen und den größten Teil der Lösung ausmachenden flüssigen oder festen Lösungsmittel (Solvens).