Knobelfragen
Werbung

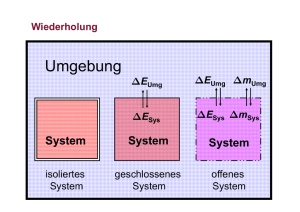
Knobelfragen Was unterscheidet die Knallgasreaktion (H2 + O2 --> 2 H2O) vom Rosten eines Fahrrads (2Fe + O2 + 2H2O --> 2FeO(OH))? Wenn beim Lösen eines Salzes ein Bodensatz übrig bleibt, ist dann die Reaktion AB --> A+(aq) + B-(aq) vollständig abgelaufen? Was passiert an der Oberfläche eines Salzkristalles im Bodensatz? Was muss bei einer chemischen Reaktion passieren, damit sie von sich aus (freiwillig) abläuft? Wie unterscheiden sich die Synthese und die Analyse von Silbersulfid? Das Wichtigste...! • Alle chemischen Stoffe besitzen eine innere Energie. Sie ist nicht bestimmbar und setzt sich aus der Bewegunsenergie der Teilchen und der gespeicherten chemischen Enerige zusammen. • Bei einer chemischen Reaktion wird die Energiedifferenz in Form von Wärme frei = Rekktionswärme. • Geschieht dies bei konstantem Druck (offenes System) so entspricht die Reaktionswärme der Enthalpiedifferenz ∆H. • In einem geschlossenen System müsste keine Volumenarbeit geleistet werden, was zu einer höheren Reaktionswärme führen würde. Reaktionsenthalpie und was noch... 2H2(g) + O2(g) --> 2 H2O(l) / ΔH = - 572kJ Angabe bei Reaktionsgleichung bezieht sich auf dieselbe, also auf tatsächlich umgesetzte Stoffmenge. Bei der Entstehung gasf. Wassers gilt: ΔH = - 484kJ Die Differenz von 44kJ ist die Verdampfungs- bzw. Kondensationsenthalpie. Schreibt man die Reaktion mit 1mol H2O so erhält man: H2(g) + 1/2O2(g) --> H2O(l) / ΔH0f = - 286kJ Dies ist die molare Standardbildungsenthalpie (aus den Elementen). Die hochgestellte 0 steht für die Bildung von 1mol bei Standardbedingungen (T=25°C; p=1013mbar), das f für formation, also Bildung. Nutzen der Bildungsenthalpien Bildungsenthalpien wurden gemessen und sind tabelliert. Mit ihrer Hilfe kann man unbekannte Reaktionsenthalpien berechnen z.B. solche die experimentell nicht bestimmbar sind. Es gilt: ΔH = Summe ΔH0f(Produkte) - Summe ΔH0f(Edukte) Beispiel: Verbrennung von Methan CH4 + 2O2 --> CO2 + 2H2O / ΔH = ? ΔH =[2*ΔH0f(H2O) + ΔH0f(CO2)]-[2*ΔH0f(O2) + ΔH0f(CH4)] ΔH = -2*286kJ/mol - 393kJ/mol - 0kJ/mol + 75kJ/mol = -890kJ/mol Werte siehe Tabelle im Buch S. 167 O2 ist ein Element und muss nicht gebildet werden. Satz von Hess Die Enthalpieänderung bei einer Reaktion ist unabhängig vom Reaktionsweg. Sie hängt nur vom Anfangs- und Endzustand ab. s. Bu. S. 166 Mit Hilfe dieses Satzes können Bildungsenthalpien berechnet werden. Beispiel: Bildung von Wasserstoffperoxid (H2O2), das bei der Verbrennung von Wasserstoff stets in geringen Mengen entsteht. Bekannt sind: ΔH0f(H2O) = -286kJ/mol und die Reaktionsenthalpie des Zerfalls von H2O2 in Wasser und Sauerstoff (2H2O2 --> 2H2O + O2) ΔH0zerf. = -196kJ/mol --> ΔH0f(H2O2) = ΔH0f(H2O) - ΔHzerf. = -90kJ/mol Zeichnung! Einstieg: Trinkvogel Ob eine chemische Reaktion von selbst abläuft, hängt, soweit wir wissen, davon ab, ob dabei Energie frei wird. Aber dies ist nicht der alleinige Grund. Bindungsenthalpien Ein weiterer Typ ist die 168/169). Bindungsenthalpie (Bu. S. - Schau dir die Tabelle auf S. 169 an. Welche Rolle spielt die Polarität einer Bindung für die Stabilität der Bindung (also die Enthalpie, die für die Spaltung der Bindung aufgebracht werden muss)? - Wir lesen den Text zu den Bindungsenthalpien und schauen uns das Beispiel auf S. 169 unten an. Berechne die Reaktionsenthalpie der Verbrennung von einem Mol Ethen (C2H4) mit Sauerstoff. Schreibe zunächst die Reaktionsgleichung. Was fangen wir mit der Enthalpie an? - Wir können entscheiden, ob bei einer Reaktion Energie in Form von Wärme frei wird. - Wir können als Reaktionsenthalpien messen oder sie berechnen. - Letzteres kann mit Hilfe tabellierter Standardbildungsenthalpien ΔH0f geschehen oder über den Satz von Hess mit Hilfe bekannter Reaktionsenthalpien. - Auch die Bindungsenthalpien können zur Berechnung von Reaktionsenthalpien genutzt werden. - Sie zeigen uns auch, dass Mehrfachbindungen stärker sind als Einfachbindungen und dass polare Bindungen stärker sind als unpolare Bindungen. Energetik/ Thermodynamik - Wann läuft eine Reaktion? - Neben der Energie gibt es eine zweite Triebkraft, die dazu führt, dass Reaktionen spontan ablaufen. Einführungsversuche in Gruppen Arbeitsblatt zum Thema Bildet 5er- oder 6er-Gruppen (es gibt vier Versuche) und begebt euch zum Experimentieren in den hinteren Teil des Klassenraumes. Bereitet den Raum (Tische...) fürs Experimentieren vor. Alternativ machen vier einzelne Schüler die Versuche am Tisch vorne. Entropie und Wärme Im Teilchenmodell bewegen sich die Teilchen aller Stoffe (Brownsche Bewegung). Die Stärke dieser Bewegung hängt mit der Temperatur des Stoffes zusammen. Je höher die Temperatur, desto schneller bewegen sich die Teilchen. Welche Auswirkung hat das auf die ENTROPIE? Merke dir! Die Entropie S ist ein Mass für die Unordnung eines Stoffes. In der Chemie ist sie eine Triebkraft für den Ablauf einer spontanen Reaktion. Solche Reaktionen streben nach grösstmöglicher Unordnung, also hoher Entropie. Wie auch bei der Enthalpie spielt aber das System und seine Umgebung eine grosse Rolle. Es müssen System- und Umgebungsentropie beachtet werden. Temperatur abhängige Standard- Entropiewerte Feststoffe: - Metalle: Al: 28 J/K*mol - Salze: MgCl2: 90 J/K*mol - Molekülkristalle: C: 6 J/K*mol Flüssigkeiten: - Alkohol (C2H5OH): 161 J/K*mol - Brom (Br2): 152 J/K*mol Gase: - Sauerstoff (O2): 205 J/K*mol - Wasserdampf (H2O): 169 J/K*mol Aquatisierte Ionen: - OH-(aq): -11 J/K*mol - Cl-(aq): 57 J/K*mol 0 S Die Trinkente Ein Entropie-getriebenes perpetuum mobile Der Vorgang des Verdunstens von Wasser ist endotherm. Der Vorgang läuft dennoch spontan ab. Er ist Entropie-getrieben. Insgesamt sagt man, er sei exergonisch. Dieses Wort benutzt man, wenn die freie Enthalpie <0 ist. Nach Gibbs-Helmholtz gilt: H2O(l) --> H2O(g) / ΔH > 0 ΔG = ΔH - T*ΔS Gibbs-Helmholtz Gleichung ΔG = ΔH - T*ΔS Die freie Enthalpie kann mit Hilfe der Enthalpie und der Entropie berechnet werden. Wie für die Enthalpie gibt es auch für die Entropie tabellierte Werte, die molare Standard Entropie S0. Je nach dem, wie groß die Werte der Gleichung sind, ergeben sich vier verschiedene Fälle. --> Warum gefriert Wasser bei 0°C ??? Weil dann die Unordnung im Gefrierfach insgesamt zunimmt Warum gefriert Wasser bei 0°C??? Das Gefrieren von Wasser ist eine exotherme Reaktion (∆H < 0). Allerdings werden die Wassermoleküle geordnet (∆S < 0). Die Entropie nimmt ab. Im Endeffekt spielt die Wärmeabgabe nur eine Mittlerrolle. Die Entropie ist wichtiger!!! Man könnte sagen: Wasser gefriert bei 0°C, weil erst bei dieser niedrigen Temperatur die Luftteilchen in der Umgebung durch die abgegebene Wärme ihre Bewegung stark genug erhöhen (was einer Entropiezunahme entspricht), dass dadurch die Entropieabnahme des Wassers ausgeglichen wird. Spontane Vorgänge 1. Exothermer Vorgang, Zunahme der Entropie: HΔ < 0 und ΔS > 0 Reaktion in jedem Fall spontan (Bsp.: Verbrennungen oder Explosionen fester oder flüssiger Stoffe). 2. Exothermer Vorgang, Abnahme der Entropie: HΔ < 0 und ΔS < 0 Reaktion nur spontan, wenn Umgebungsentropie durch abgegebene Wärme steigt (nur unterhalb best. Temp; z.B. Gefrieren von Eiswürfeln). Weitere Vorgänge 3. Endothermer Vorgang, Zunahme der Entropie: HΔ > 0 und ΔS > 0 Reaktion nur spontan, wenn Zunahme der Entropie gross genug ist bzw. Abnahme der Umgebungsentropie klein genug, was von der Temperatur der Reaktion abhängt (Bsp. Zersetzung von Ag2S oder Brennen von CaCO3). 4. Endothermer Vorgang, Abnahme der Entropie: HΔ > 0 und ΔS < 0 --> Reaktion nie spontan. Zum Abschluss... ...aus dem zuletzt gesagten kann für die Änderung der Entropie ∆S auch den Zusammenhang formulieren: Beispiel: Wärmemenge 100J ΔS = ΔQ T bei T = 100° --> ∆S = 1 bei T = 1°C --> ∆S = 100 folglich: Wärmeabgabe eine warmen Stoffes und Aufnahme eines kalten Stoffes ist besser als umgekehrt (∆S = 99 > ∆S = -99) Also ist ein Wärmeübertrag nur von einem heisseren auf einen kälteren Körper entropisch möglich. Und ganz zum Schluss: 2nd law of thermodynamics: Heat can‘t pass from the hotter to the cooler.