Hinweis
Werbung

Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen
des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das
eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die
Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen
Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html
eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und
Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Schriftliche Ausarbeitung
des Experimentalvortrags zum Thema
"Organische Elektrochemie"
Gehalten von:
Yvonne Walter
Dienbergstr.13
35305 Grünberg
am21.01.1998
Chemie in der Schule: www.chids.de
Inhaltsverzeichnis
1. Einleitung
2. Geschichte der Elektrochemie
3. Kolbe-Elektrolysen
3.1
Klassisches Kolbe-Schema
3.2
Elektrolyse einer Natrium-Acetat-Lösung (V1)
3.3
Elektrolyse einer Kalium-Propionat-Lösung (V2)
3.4
Die Acetat-Elektrolyse - eine Ausnahme?
4. Theorie elektrochemischer Umsetzungen
4.1
Einteilung der elektroorganischen Synthesen
4.2
Ladungsübertragung und Folgereaktionen
4.3
Das Schichtenmodell
5. Großtechnische Synthese
5.1
Arbeitsschritte der Synthese von Anisaldehyd durch Elektrooxidation
5.2
Zugehörige Reaktionsmechanismen
5.3
Nachweis per Dünnschichtchromatogramm (V3)
2
Chemie in der Schule: www.chids.de
6. Technische Anwendung
6.1
Brennstoffzellen
6.1.1 Allgemeines
6.1.2 Die Glucose-Brennstoffzelle ryS)
6.2
Leitfähige Polymere
6.2.1 Überblick
6.2.2 Polymerisation von Pyrrol (V4)
6.2.3 Bau eines Zink-Polypyrrol-Akkumulators ry6)
7. Vorteile der organischen Elektrochemie
8. Literaturverzeichnis
3
Chemie in der Schule: www.chids.de
1. Einleitung
Als Elektrochemie wird ein Teilgebiet der Physikalischen Chemie bezeichnet, das sich mit der gegenseitigen Umwandlung von chemischer
und elektrischer Energie auseinandersetzt. Dies umfaßt Vorgänge, bei
denen chemische Reaktionen mit der Wanderung von elektrischen Ladungen oder dem Auftreten von elektrischen Potentialen verbunden sind.
2. Geschichte der Elektrochemie
Bereits die alten Griechen entdeckten, daß geriebener Bernstein
(gr.: elektron) kleine Gegenstände anziehen kann. Der englische Physiker Gilbert stellte um 1600 fest, daß auch andere Materialien - wie z.B.
Glas-Gegenstände - anziehen können und bezeichnete diese Stoffe als
"elektrisch geladen". Charles Francois de Cisternay du Fay, ein französischer Chemiker, erkannte, daß es zwei Arten elektrischer Ladung gibt
und daß sich gleichgeladene Gegenstände abstoßen und entgegengesetzt geladene anziehen. Benjamin Franklin, bekannt als amerikanischer
Staatsmann, definierte die Glaselektrizität als positiv und die des Bernsteins als negativ.
Für das Gebiet, das man heute als Elektrochemie bezeichnet, wurde das
Interesse im Jahr 1789 geweckt, als Luigi Galvani einen Froschschenkel
eines gerade getöteten Frosches mit zwei verschiedenen Metallen berührte und Zuckungen beobachtete.
4
Chemie in der Schule: www.chids.de
1799 baute Graf Alessandro Volta die erste funktionierende Batterie.
Bald darauf elektrolysierten die englischen Chemiker Carlisle und
Nicholson erstmals verdünnte Schwefelsäure und erhielten an den Elektroden die Gase Wasserstoff und Sauerstoff.
Durch Michael Faraday wurden wichtige quantitative Gesetze für die
Elektrolyse entdeckt, und Begriffe eingeführt wie Ion, Anode, Kathode,
Anion, Kation und Elektrolyt.
Sir William Grove entwickelte 1839 die erste elektrochemische Zelle .
1849 wurden in Liebigs Annalen der Chemie und Pharmazie die "Untersuchungen über die Elektrolyse von organischen Verbindungen" von
Hermann Kolbe veröffentlicht. Hermann Kolbe lebte von 1818 bis 1884
und war Professor der Chemie an den Universitäten in Marburg und
später in Leipzig .
3. Kolbe-Elektrolysen
3.1
Klassisches Kolbe-Schema
Unter dem "klassischen Kolbe-Schema" ist die Elektrolyse konzentrierter
Lösungen der Salze der Carbonsäuren zu verstehen, die über einen radikalischen Mechanismus folgende Produkte ergibt:
Kathode (-):
Wasserstoff
Anode (+):
Kohlenstoffdioxid und ein geradzahliges Alkan.
5
Chemie in der Schule: www.chids.de
Der zugrundeliegende Mechanismus ist im folgenden dargestellt:
(Kathode)
(Anode)
...
2R·
+ 2e
R-R
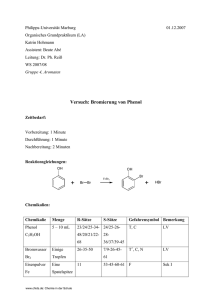
3.2 Elektrolyse einer Natrium-Acetat-Lösung
Versuch 1:
Geräte:
•
Hofmannscher Wasserzersetzungsapparat
•
Kurzes Glasrohr mit ausgezogener Spitze und etwas Glaswolle
bestückt
•
Einleitungsrohr
• 2 Reagenzgläser
•
Feuerzeug
•
Regelbare Spannungsquelle
•
3 Verbindungskabel
•
Stativmaterial
6
Chemie in der Schule: www.chids.de
Chemikalien:
• 200mI einer Lösung, die 23,6g NaAc und 40g Eisessig enthält
• gesättigte Ba(OHh-Lösung
Versuchsaufbau:
+
Durchführung:
Der Hofmannsche Zersetzungsapparat wird mit der Lösung aus
Natriumacetat und Eisessig bis knapp unter die Hähne der Schenkel gefüllt. Es wird dann eine Gleichspannung von 20V an die Platinelektroden angelegt.
Wenn sich genügend Gas in den Schenkeln gebildet hat, wird die
Reaktion gestoppt, und die Gase werden untersucht. Hierzu stülpt
man ein Reagenzglas über den Kathodenschenkel, läßt das Gas
hineinströmen, verschließt mit dem Daumen und entzündet das
Gas (Knallgasprobe). Das Gas im Anodenschenkel wird zu einem
kleinen Teil über ein Einleitungsrohr in ein mit gesättigter Barium7
Chemie in der Schule: www.chids.de
hydroxid-Lösung gefülltes Reagenzglas eingeführt. Der Rest des
Anodengases wird an der Spitze des ausgezogenen Glasrohres
verbrannt.
Reaktionen:
Kathode:
2 H3 0
+(aq)
+ 2 e-
Nachweisreaktionen :
(1) Untersuchung des Kathodengases: (Knallgasprobe)
(2) Untersuchung des Anodengases:
a) Einleiten von Anodengas in gesättigte Ba(OHh-Lsg.:
BaC0 3 .J..(S) + H20
(weißer Nd.)
b) Brennbarkeit des Anodengases:
2 CH~H3(g) + 70 2(g)
Ergebnis:
Bei der durchgeführten Elektrolyse sind wie nach dem klassischen
Kolbe-Schema erwartet an der Kathode Wasserstoff und an der
Anode Kohlendioxid sowie ein geradzahliges Alkan (Ethan) entstanden.
8
Chemie in der Schule: www.chids.de
3.2
Elektrolyse einer Kalium-Propionat-Lösung
Nimmt man nun für die folgende Elektrolyse einer Kalium-PropionatLösung die Produkte nach dem klassischen Kolbe-Schema an, so müßten demnach im Kathodenraum Kohlenstoffdioxid und n-Butan entstehen.
Versuch 2:
Geräte :
• 250ml Becherglas
•
Polyethylenflasche (100ml) ohne Boden
• Gebogenes Edelstahlblech (7cm x 10cm)
•
Blanke Platinelektrode
• 2-fach durchbohrter Gummistopfen
• Winkelrohr mit kurzem Schlauchstück
•
Kolbenprober mit 3-Wegehahn und Halterung
• 2 Krokodilklemmen
• regelbare Spannungsquelle
• Amperemeter
• 3 Strippen
• Stativmaterial
• Magnetrührer mit Rührfisch
• 2 Reagenzgläser
Chemikalien:
• 200ml Kalium-Propionat-Lösung
• wäßrige KMn04-Lösung
9
Chemie in der Schule: www.chids.de
Versuchsaufbau: Becherglas mit "Glocke"
Durchführung:
Die Apparatur wird entsprechend der Abbildung aufgebaut und die
Kalium-Propionat-Lösung in das Becherglas eingefüllt. Das Experiment wird gestartet, indem die Spannungsquelle auf etwa 10-12V
eingestellt wird, wobei sich eine Stromstärke von 2A ergeben sollte. Der Kolbenprober wird vorsichtig immer soweit bewegt, daß
keine Lösung in den Kolbenprober gelangt. Die Spannungsquelle
wird abgestellt, wenn sich 100ml Gas entwickelt haben. Das entstandene Gas kann nun über den 3-Wegehahn in ein mit wäßriger
KMn04-Lösung gefülltes Reagenzglas eingeleitet werden.
10
Chemie in der Schule: www.chids.de
Reaktionen:
Kathode:
2 H30+(aq) + 2 e
Anode:
H3C-CHz------COO -(aq)
Nachweisreaktion :
---.:;Einleiten in wäßrige KMn04-Lsg. => Farbänderung
/-~ 8
/ 0-\\ /C)/ +
Mn +7
l
l o-~ ~o
-
0
---~
/f"'\
H C/-\+5/'"
2 1
Mn
HC
/~
2
"0
-
0
8
I
+ H20
- Mn03-
H2C-OH
1
H2C-OH
Dial
cyclischer
Mangan(V)säureester
Mn03- kann ein weiteres Alken-Molekül oxidieren
~
~
+4
Mn02 als stabiles
Endprodukt
Ergebnis:
Es ist anders als erwartet nicht n-Butan sondern das Alken Ethen
entstanden . Der erste Reaktionsschritt sind in den Versuchen 1und
2 gleich, zur Ethenbildung ist die Abspaltung eines Protons nötig.
Im Anodenraum ist tatsächlich eine saure Reaktion nachzuweisen.
11
Chemie in der Schule: www.chids.de
(Die Tendenz der Produktbildung wird im nächsten Abschnitt erläutert.)
3.3
Die Acetat-Elektrolyse - eine Ausnahme?
Tendenz der Produktbildung in Abhängigkeit
von der Carbonsäure
100%
80%
60%
H+
DA
; DA
DA
40%
20%
0%
Formiat
Acetat
Propionat Butyrat
C1Dimeres Alkan (DA)
OMonocarbonsäuren (MA)
OH+
Valerat
Capronat Enanthat
Dimere Alkane u. Ester/Alkohole (E/A)
Olefine
Beim Betrachten der obigen Abbildung fällt auf, daß die Olefin-Bildung
bei der Elektrolyse von der Propionsäure hin zu längerkettigen Carbonsäuren abnimmt. Eine Erklärung dafür könnte sein, daß längerkettige
Radikale schwächer an die Elektrodenoberfläche adsorbiert sind und
somit eine größere Chance haben mit anderren Radikalen zu dimerisieren. Laut dieser Interpretation müßte bei der Acetat - Elektrolyse die
Olefinbildung in noch stärkerem Ausmaß stattfinden als bei höheren
Carbonsäu resalz-Lösu ngen.
12
Chemie in der Schule: www.chids.de
Dann:
CHr
• CH2:
+ H+
Entsprechend der Olefin-Synthese käme es so zur MethylenDiradikalbildung, dessen Energieaufwand allerdings zu hoch ist, so daß
das System zur Bildung eines "dimeren Alkans" ausweicht.
Hiermit wurde gezeigt, daß die weitbekannte Elektrolyse einer AcetatLösung ("Kolbe-Elektrolyse") eigentlich eine Ausnahme unter vergleichbaren Elektrolysen darstellt.
13
Chemie in der Schule: www.chids.de
4. Theorie elektrochemischer Umsetzunro!Q
4.1 Einteilung der elektroorganischen Synthesen
Die elektroorganischen Synthesen werden folgendermaßen eingeteilt
bzw. unterschieden:
•
Direkte Elektrosynthese:
Hier findet an der Elektrode, welche rein die Funktion einer
Elektronenquelle oder -senke ausübt, ein Elektronenentransfer
zum oder vom organischen Substratmolekül statt. An der Kathode entsteht also z.B. aus einem neutralen Molekül ein Radikalanion.
•
Elektrokatalytische Synthese:
Die Elektrode weist hier lediglich katalytische Eigenschaften auf.
Mindestens einer der Reaktionspartner tritt in starke Wechselwirkung mit der Katalysatorelektrode, um aus dem adsorbierten
Zustand heraus zu reagieren.
•
Indirekte Elektrosynthese:
In der Zelle wird hierbei ein meist anorganisches Reduktionsoder Oxidationsmittel hergestellt.
•
Elektrochemische initiierte Reaktionen:
Um die gewünschte Reaktion in Gang zu setzen, genügen katalytische Strommengen.
14
Chemie in der Schule: www.chids.de
4.2 Ladungsübertragung und Folgereaktionen
Im ersten Schritt einer elektrochemischen Umsetzung, dem sogenannten
Prlrnärprozeß, kommt es in der Regel lediglich zum Austausch eines
einzigen Elektrons zwischen der Elektrode und dem organischen Substratmolekül. So entstehen aus neutralen Molekülen Radikal-Ionen aus
I
Anionen durch Oxidation und aus Kationen durch Reduktion Radikale:
e
A
A
e
+
B
C+
e
e
A-+
A--
<3
..
B·
8
.
C-
e
+
..
..
e
Nach diesem Ladungsübertritt sind Spezies entstanden, die eine wesentlich höhere freie Enthalpie als die Ausgangssubstanzen besitzen.
Diese Spezies sind sehr reaktiv und weisen teilweise eine sehr kurze
Lebensdauer auf. So reagieren diese meist unmittelbar vor der Elektrode
oder bereits auf der Elektrodenoberfläche weiter zu intermediären Radikalen, Carbanionen und Carbkationen.
In der Regel folgt diesem chemischen Folgeschritt ein weiterer
elektrochemischer Schritt.
Entsprechend der Reihenfolge der elektrochemischen ( E ) und chemischen ( C ) Einzelschritte charakterisiert man die Reaktionssequenzen.
15
Chemie in der Schule: www.chids.de
4.3 Das Schichtenmodell
Zur Verdeutlichung der Vorgänge an der Phasengrenze dient die folgende Abbildung.
~i X:" k .. p
~l~
c:
Cl>
>-
...
:;c
0
s:
.~
~
s:
...
LJ..I
'-'
\Il
Cl>
\Il
\Il
c:
::>
E
~
0>
...
Q,l
...
QJ
:0
c:
..s
V>
e
~
LJ..I
\Il
Cl>
~
\Il
...
Cl>
Cl>
c:
.s
lp
mm
'.~-----...--. E l e k t ro IYl ---------
Dargestellt ist ein nach Zudiffusion des Substrats X kathodisch erzeugtes
Radikalanion X·- in einer Reaktionsschicht vor der Elektrode, das vor
der Elektrode zum Produkt P abreagiert und wieder nach außen diffundiert.
Chemie in der Schule: www.chids.de
16
5. Großtechnische Synthese
Auch in der Industrie ist man teilweise dazu übergegangen, die elektrochemischen Möglichkeiten für die organische Chemie zu nutzen.
So wird z.B. Adiponitril, das als Ausgangsprodukt zur Nylondarstellung
benötigt wird, elektrochemisch dargestellt.
Im folgenden wird hier ein Verfahren zur Synthese von Anisaldehyd vorgestellt, das 1979 von BASF entwickelt wurde.
5.1 Arbeitsschritte der Synthese von Anisaldehyd durch Elektrooxidation
Dokumentation:
Geräte:
•
100ml Becherglas
• 2 Kohleelektroden
• 2 Krokodilklemmen
•
regelbarer Widerstand (330, 2,4A)
• Voltmeter (Meßbereich 10V)
• Amperemeter (Meßbereich O,5A)
•
Regelbare Spannungsquelle
• 6 Verbindungskabel
• Magnetrührer mit Rührfisch
• 500ml Scheidetrichter
•
Rotationsverdampfer
• Magnetrührer mit Rührfisch
17
Chemie in der Schule: www.chids.de
• Trichter mit Filter
•
Destillationsapparatur
Chemikalien:
•
BOml Methanol-Essigsäure-Mischung (9:1 bzw. 72ml:Bml)
•
19 Tetrabutylammoniumbromid
• 2,6ml (O,02mol) 4-Methylanisol (frisch destilliert)
•
100ml gesättigte NaCI-Lösung
•
2x (3x 50ml) Diethylether
•
100ml 1O%ige Schwefelsäure
•
10%ige NaHC0 3-Lösung
• Calciumchlorid (wasserfrei)
Versuchsaufbau:
Spanmmgc;queUe
Voltmeter
Amperemeter
n-t--Graphitelektrode
-t--
Elektrolyt
~:=:§~:!:::; ROhrfisch
1 0 DD 0
Chemie in der Schule: www.chids.de
18
r~
Durchführung:
In die Elektrolysezelle werden das Lösungsmittel, das Leitsalz, das
Edukt gegeben und unter Rühren gelöst. Es folgt eine Elektrolyse
über 11Stunden an den Graphit-Elektroden bei einer konstanten
Stromstärke 1= 200mA und einer Spannung U = 7,6V.
Danach wird das Elektrolyseprodukt in einem 500ml Scheidetrichter mit einer gesättigten NaCI-Lösung versetzt und durchmischt.
Durch 3maliges Ausethern wird die organische Phase von der
wäßrigen getrennt. Am Rotationsverdampfer kann das Lösungsmittel entfernt werden. Der Rückstand wird mit 1O%iger Schwefelsäure versetzt und 3 Stunden gerührt. Es folgt ein erneutes
3maliges Ausethern mit Diethylether und ein Waschen der etherischen Lösung mit 1O%iger NaHC0 3-Lösung. Vor dem Abzug des
Lösungsmittels wird die Lösung über Nacht über Calciumchlorid
getrocknet.
Das so entstandene Rohprodukt wird zur Reinigung einer Destillation unter vermindertem Druck unterzogen.
5.2 Zugehörige Reaktionsmechanismen
a) Anodische Oxidation von 4-Methylanisol
b) Saure Hydrolyse des Zwischenprodukts Anisaldehyddimethylacetals
19
Chemie in der Schule: www.chids.de
a) Anodische Oxidation von 4-Methylanisol:
Hc-0-o'
3
_
CH3
!-
E
e-
r C-O-( ·~ CH3 .
•
H3
!_
C
H+
H3C -O-( ) = CH2 -+--+-
E
H3
c-o-o'~H "
1:
c-o-O' C-H
_
2
..
H+
CH30H
p-CH 3
H3
_
I
-
H
erneuter ECE-Mechanismus
..
..
H3 C-O
_
\
-0
~
r;
-
1J~CH3
/j 0:J
CI
H
Anisaldehyddimethylacetal
20
Chemie in der Schule: www.chids.de
...
b) Saure Hydrolyse des Zwischenprodukts Anisaldehyddimethylacetals:
H3C
10/CH 3
10
H3C
\
I
+H+
I
- HOCI-I;,
C-H
/
C<±l
10
\0\
~ 'CH 3
/0"
CH3
H
I
/.,
H
C-O C:B
I '
,0
H
-'CH 3
-H
+
H
/
C@
\
/
H
C
~@
10-H
10-H
/
H
c
~
~/
Anisaldehyd
21
Chemie in der Schule: www.chids.de
H
+ H20
5.3 Nachweis per Dünnschichtchromatogramm (V3)
Geräte:
•
DC-Mikrokammer
•
Sprüher
•
Fön
•
Bleistift und Lineal
Chemikalien:
• Synthetisiertes Anisaldehyd (+ Vergleichssubstanz)
• O,4%ige Lösung von 2,4-Dinitrophenylhydrazin in Salzsäure
(c =2mol/l)
• Aceton (Fließmittel)
•
DC-Mikrokarte mit Kieselgelschicht
Durchführung:
Auf die mit Bleistift gezogene Startlinie auf der DC-Mikrokarte werden punktförmig Proben des synthetisierten Anisaldehyds und der
Reinsubstanz aus der Chemikaliensammlung aufgetragen.
Fünf Minuten nach Befüllen der DC-Kammer mit Aceton (ca. O,7cm
hoch) wird die DC-Karte in die Kammer gestellt. Nachdem die
Fließmitteifront den oberen Rand der Karte fast erreicht hat, diese
aus der Kammer entfernt und getrocknet wurde, besprüht man die
Karte mit dem Detektionsreagenz.
Ergebnis:
Das entstandene Hydrazon ist als orangeroter Fleck erkennbar.
22
Chemie in der Schule: www.chids.de
Reaktionmechanismus:
H3C
\
/
\q.,
H
°2 N
C
~
über
,,0 /
~+H+J
H3C
\
/
\q.,
-
HN-N
2H
H
N0 2
..
C~"\
Q-iH
~+
°2 N
H
H3C
I
0
C-N-N
H2 H
I
10-H
\
\q.,
1~
N0 2
-H+
°2 N
H
H3C
\
I
\~
1l :
~~O
r-,-
-
C-N-N
H H
\)
10-H
,0
H
N0 2
°2 N
H
H 3C
I
\
C
\q"
N-N
H
Entstandenes Hydrazon
23
Chemie in der Schule: www.chids.de
N0 2
6. Technische Anwendung
6.1 Brennstoffzellen
6.1.1 Allgemeines
Unter Brennstoffzellen versteht man Geräte, die zur elektrochemischen
Stromerzeugung dienen. Die Erzeugung von elektrischer Energie in dieser Form erfolgt nahezu wärmeverlustfrei.
Charakteristisch für Brennstoffzellen ist das kontinuierliche Zuführen des
Brennstoffs und des Oxidationsmittels. Die Kapazität wird durch die
mögliche Speichermenge der Betriebsstoffe bestimmt.
Im Gegensatz zu den Elektroden in Batterien erfahren die Elektroden in
Brennstoffzellen keine Veränderungen, da sie hier lediglich als Katalysatoren fungieren und nicht in den stromliefernden Vorgang eingreifen.
Anzumerken ist, daß die Zersetzungsprodukte anders als die Ausgangsstoffe (z.B. Methanol) umweltfreundlich sind.
6.1.2 Die Glucose-Brennstoffzelle
Geräte :
• Tondiaphragma
• 600ml Becherglas
• versilberte Graphit-Elektrode
•
platinierte Platin-Elektrode
• 2 Krokodilklemmen
• Verbindungskabel
24
Chemie in der Schule: www.chids.de
•
Kleiner Elektromotor
• Magnetrührer mit Rührfisch
Chemikalien:
•
180ml Kalilauge (c
=5mol/l)
•
60ml wäßrige Glucose-Lösung (c = 1mol/I)
•
50ml Wasserstoffperoxid-Lösung (w
=0,3)
Versuchsaufbau:
_
7önd/aflhr~~
~tt---;;---r--:~
I/~- KOf!- LSJo
versiiberk.
i:a.phit. Ele.ktroolc
UOJ!-LsJ-
~ I,
~I
D- ' -----
J!u.cose - Ls~-
-f
pJaiinie.rle
21ati/1 - aeJdrodl!..
flagne..truuhra:
Durchführung:
Das in Kalilauge gewässerte Diaphragma wird mit 30ml Kalilauge
.und 60ml wäßriger Glucose-Lösung befüllt. Die Tonzelle stellt den
nun abgetrennten Anodenraum dar, in den die platinierte PlatinElektrode eintaucht.
Die restliche Kalilauge wird in das Becherglas gegeben, in dem
',,~~
sich auch die Tonzelle befindet. Hier taucht die versilberte GraphitElektrode ein.
Chemie in der Schule: www.chids.de
25
Die Elektroden werden über Verbindungskabel und den Elektromotor miteinander verbunden.
Über einen Tropftrichter werden nun langsam 50ml Wasserstoffperoxid hinzugetropft.
Ergebnis:
Bei den hier verwendeten Mengen wird der Elektromotor länger als
45 Minuten betrieben.
Elektrodenvorgänge:
An den Elektroden verlaufen formal folgende Umsätze:
~.n.Q~tEr (u.a.)
H", ~O
C
HO", 0
~
C
--i--OH
HO-+---
OH
•
+ 20H
HO
+ 2
--i--OH
OH
--i--OH
OH
CH20H
CH20H
(Stark vereinfacht!!!)
26
Chemie in der Schule: www.chids.de
e
+~
Anmerkung:
Aldosen und Ketosen sind enolisierbare Carbonylverbindungen, die
im alkalischen Medium nicht beständig sind.
Die Epimere Glucose und Mannose werden ebenso wie Fructose
unter a-Inversion tautomerisiert.
In konzenmtrierten Alkalihydroxid-Lösungen kommt es gar zur
Spaltung der Aldosen und Ketosen in kleinere Moleküle
(z.B. Fructose in Dihydroxyaceton und Glycerinaldehyd, dieses
wiederum in Glycolaldehyd und Formaldehyd):
H
V
O
OH
HO
OH
OH
CH20H
D-Glucose
3%
H
-, ~O
C~
H
-, /OH
C
I
HO
HO
CH20H
OH
HO
0
HO
OH
OH
OH
OH
OH
OH
CH20H
CH20H
CH20H
D-Mannose
ENDIOl
D-Fructose
37 0/c3
27
28 %
Chemie in der Schule: www.chids.de
6.2 Leitfähige Polymere
6.2.1 Überblick
Zum Erhalt eines leitfähigen Polymers sind zunächst einmal folgende
Schritte unerläßlich:
•
Polymerisation des Monomeren
•
Oxidation bzw. Reduktion des Polymeren
•
Einlagerung von Ionen des Trägerelektrolyten
Unter Oxidation versteht man im vorliegenden Fall die Entfernung von
Elektronen aus dem Valenzband und unter einer Reduktion die Elektroneneinschleusung ins bis dahin leere Leitungsband, wenn man das Bändermodell auf die leitfähigen Polymere anwendet.
6.2.2 Polymerisation von Pyrrol (V4)
Geräte:
• 400ml Becherglas
• Magnetrührer mit Rührfisch
• 2 Edelstahlbleche
• 5 Verbindungskabel
• 2 Krokodilklemmen
•
Stativmaterial
•
Klammer nach Kaufmann
• regelbare Spannungsquelle
• Amperemeter
28
Chemie in der Schule: www.chids.de
• Voltmeter
Chemikalien:
• 5g KCI0 4
• 200m I Wasser
• 2ml Pyrrol
Versuchsaufbau :
(i)-
+
~
v-
.
~
1
,
r
Stahlbl eche ~
._..--.--"-' --.
_. ._.. ......
._
.-._._.-._.
VS"'OW",,""
..
_..
iriA
~
•
•
_
. _
__
-'
_
2 ml Pyrrol
_.
0
- _._._. ._ .
:- 5:::j: ::=i
-
Durchführung:
Die angegebene Menge Leitsalz wird im Wasser - soweit möglichgelöst, der Rest wird abfiltriert. Nach Zugabe des Pyrrols wird 1-2
Minuten gerührt, bevor die Elektrolyse gestartet wird . Es wird bei
2
einer Stromdichte von maximal 20mAlcm elektrolysiert, dieser
Wert ergibt sich hier bei einer angelegten Spannung von ca. 3,5V
und einer Stromstärke von 300mA. Nach 1 minütiger Elektrolyse
wird das Anodenblech umgedreht. Nach weiteren 10-15 Minuten
wird die Elektrolyse vollständig beendet.
Chemie in der Schule: www.chids.de
29
',,~~
Das Edelstahlblech wird vorsichtig mit Wasser abgespült und kann
nun entweder als Pluspol eines Akkumulators geschaltet werden
oder die Schicht kann mit Hilfe einer Rasierklinge entfernt werden.
Ergebnis:
Das Anodenblech ist nun mit einem schwarzen Film von Polypyrrol
überzogen.
Reaktionsmechanismus:
• Anodische Oxidation des Pyrrols zum Radikal-Kation:
)eS
N
0
+
~
~­
-e
..
.
..
N
N
H
H
~~
H
• C-C-Verknüpfungen:
~.
~
){~~
N
JUd:i
N
H
H
R
f:L{
L.».
+ :Z~~
N
N
H
JUJS
N
H
H
30
Chemie in der Schule: www.chids.de
N
H
N
H
~ciJ~
N
H
• Abspaltung positiver Ladung:
)JJ::i
N
H
N
H
)JJS
N
H
N
H
Die Polymerisation wird eingeleitet durch direkte anodische Oxidation
des Pyrrols zu einem Radikalkation. Aufgrund der mesomeren Grenzstruktur sollte das Radikal in 2-Stellung am stabilsten sein, weshalb die
folgende C-C-Verknüpfung auch in 2-Stellung erfolgt. So gebildete Dimere bilden bald Trimere, diese werden bei niedrigeren Potentialen zu Radikalkationen oxidiert als Pyrrol. So kommt es zur raschen Bildung von
Polymerketten.
Als Nebenreaktion ist die Abspaltung positiver Ladung durch Reaktion
mit kathodisch gebildeten Hydroxid-Ionen zu sehen.
Die Polymerkette besteht aus neutralen und positiven Pyrrolmolekülen
im Verhältnis 3:1. Die geladenen Polypyrrolketten bilden positive
Schichten, in deren Zwischenräumen die Ionen des Trägerelektrolyten
zum Ladungsausgleich eingelagert sind.
31
Chemie in der Schule: www.chids.de
6.2.3 Bau eines Zink-Polypyrrol-Akkumulators
Geräte.
• 250ml Becherglas (hohe Form)
• Zink-Blech
•
Edelstahlelektrode mit Polypyrrolüberzug
•
2 Krokodilklemmen
•
2 Verbindungskabel
• Stativmaterial
•
Klammer nach Kaufmann
•
2 halbe größere Gummistopfen mit je 2 Ritzen zum Befestigen
der Bleche
• Spannungsquelle
• Voltmeter
• Amperemeter
•
Kleiner Elektromotor
Chemikalien:
• 5g Zinksulfat
•
200ml Wasser
Versuchsaufbau :
Zinkbl ech
ZinksuttatLösung
Chemie in der Schule: www.chids.de
Polypyrrol-Folie
aul Stahlblech
32
Durchführung:
Das Zinksulfat wird im Wasser gelöst. Das Becherglas wird mit
Hilfe einer Kaufmann-Klammer an einem Stativ befestigt. Die beiden Elektroden werden in den Gummistopfen eingesetzt und in das
Becherglas eingetaucht. Für den Ladevorgang werden zunächst
die Geräte wie im Versuchsaufbau beschrieben geschaltet. Der
Akkumulator wird 2 Minuten bei einer Stromdichte von ca.
30mAlcm 2 geladen (hier: ca.3,5V und 200mA). Danach trennt man
die Zelle von der Spannungsquelle und schaltet stattdessen einen
kleinen Spielzeugmotor zwischen die beiden Elektroden.
Der Versuch läßt sich beliebig oft wiederholen.
Entladereaktionen an den Elektroden:
Kathode: Zn ~ Zn2+ +
ze
Beim Entladen wandern also die Anionen in Lösung, so daß folglich im Ladevorgang die Anionen als Gegenionen in die Polymermatrix eingebaut werden .
33
Chemie in der Schule: www.chids.de
7. Vorteile der organischen Elektrochemie
Obwohl die Elektrochemie auch der Organischen Chemie die Möglichkeiten zu eleganten Synthesewegen bietet, ist sie hier wenig populär.
Einer der Gründe dafür mag sein, daß die Kenntnisse und die nötige
Ausrüstung wenig verbreitet sind. Auch muß zugegeben werden, daß die
Wege der Organischen Elektrochemie nicht unbedingt besser "gehen".
Dennoch sind einige Vorteile zu nennen, so entfallen z.B. bei der elektrolytischen Oxidation die kostenträchtige Entsorgung von Schwermetallabfällen. Des Weiteren sind der umweltfreundliche Einsatz und die verhältnismäßig niedrigen Investitionskosten nicht zu vergessen, wie auch
die Möglichkeit zur Energieersparnis.
Am Bedeutensten ist jedoch, daß die Pozesse unter milden Bedingungen durchgeführt werden können (Normaldruck und Zimmertemperatur)
und man durch Variation der Spannung, der Stromdichte, der Diffusionsschichtdicke sowie auch der Zusammensetzung der Elektrolyten die Reaktion gelenkt / beeinflußt werden kann, was einer unglaublichen Variationsbreite entspricht.
Außerdem lassen sich auf diese Weise (elektrochemisch) relativ leicht
Radikale und Radikal-Ionen bilden noch dazu schnell und vor allem in
relativ hoher Konzentration.
34
Chemie in der Schule: www.chids.de
8. Literaturverzeichnis
Beck, F. Elekroorganische Chemie, Weinheim, 1974.
Butenuth, Dr. J.; Netsch, K.P. und Steuber, Prof. Dr. F.W.. Lehrerfortbildung "Einführung in die Elektrochemief/ Fachbereich Chemie der Phil-
ipps-Universität Marburg, Februar 1986.
Flintjer, B. und Jansen, W .. .Polypyrro' und Polypyrrol-Batterien".
In: PdN-Ch. 3/38. Jg. 1989.
Falbe, J., Regitz, M. (Hrsg.). CD Rörnpp Chemie Lexikon - Version 1.0,
StuttgartlNew York: Georg Thieme Verlag}1995.
Flintjer, B. und Jansen, W .. "Der Polypyrrol-Akkumulator mit wäßrigen
Elektrolyten". In: PdN-Ch . 7/39. Jg.1990.
Jansen, W., Kenn, M. ; Flintjer, B.; Peper, R.. "Elektrochemie", AulisKolleg Chemie, Aulis Verlag Deubner & CO KG Köln, 1985.
Menig, J.; Flintjer, B.; Bader, H.J.. "Versuche zur elektroorganischen
Chemie (Kolbe-Elektrolyse) im Chemieunterricht Teill."(erschienen 03SEP-1996 im Internet), Institut dür Didaktik der Chemie, J.W.GoetheUniversität Frankfurt, ChemKon im Druck.
Menke, K. und Roth, S., "Metallisch leitfähige Polymere I".
In: ChiuZ, 20. Jahrg. 1986, Nr.1.
35
Chemie in der Schule: www.chids.de
Menke, K. und Roth, S., "Metallisch leitfähige Polymere 11".
In: ChiuZ, 20. Jahrg. 1986, Nr.2.
Schmidt, J., "Brennstoffzellen für Flüssigkeiten und Gase".
In: PdN-Ch. 3/38.Jg. 1989.
Schmidt, J., "Ein Kunststoffakku". In: PdN-Ch. 3/38. 1989.
Troll, Prof. Dr. Th., "Elektrochemie als Werkzeug in der Organischen
Chemie - Grundlagen, Analytik, Anwendung". In: MNU 43/1 (15.1.1990)
Seiten 6-11, © Ferd. Dümmler Verlag Bonn.
Vorschrift "Herstellung von Anisaldehyd durch Elektrooxidation- Ein Beispiel für die technische Synthese eines Riechstoffes" unveröffentlicht,
Quelle unbekannt.
Wendt, H., "Organische Elektrochemie". In: ChiuZ 1 19.Jahrg. 19851
Nr.5, © VCH Verlagsgesellschaft mbH, Weinheim, 1985.
36
Chemie in der Schule: www.chids.de