Factsheet 1 Das Wassermolekül
Werbung
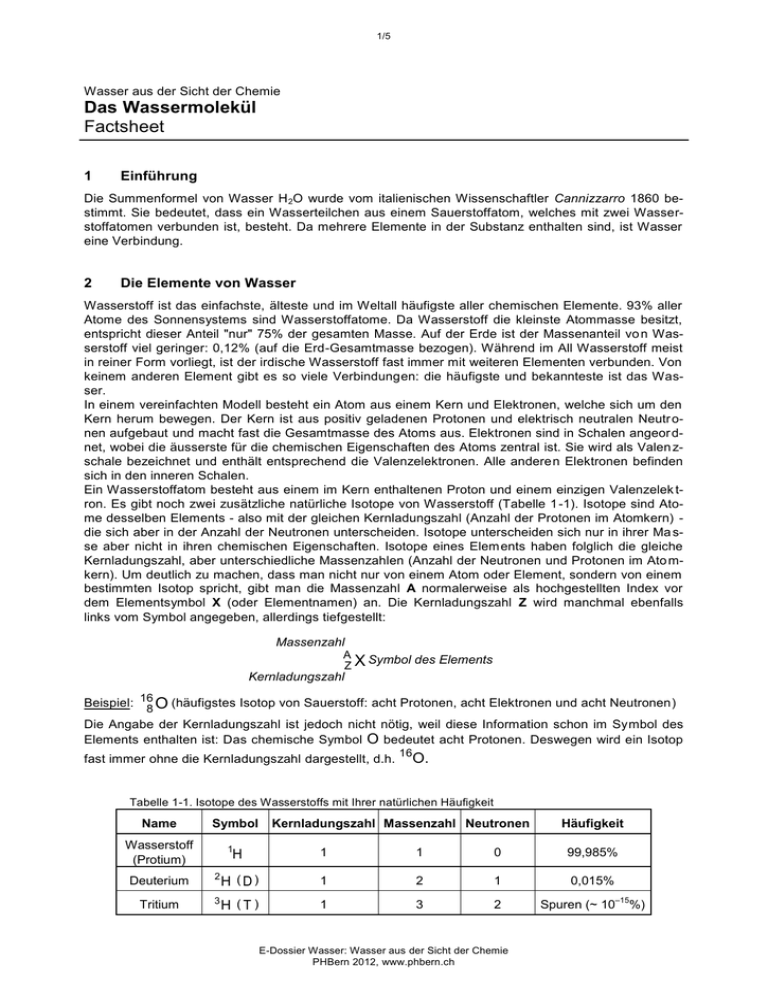
1/5 Wasser aus der Sicht der Chemie Das Wassermolekül Factsheet 1 Einführung Die Summenformel von Wasser H 2O wurde vom italienischen Wissenschaftler Cannizzarro 1860 bestimmt. Sie bedeutet, dass ein Wasserteilchen aus einem Sauerstoffatom, welches mit zwei Wasserstoffatomen verbunden ist, besteht. Da mehrere Elemente in der Substanz enthalten sind, ist Wasser eine Verbindung. 2 Die Elemente von Wasser Wasserstoff ist das einfachste, älteste und im Weltall häufigste aller chemischen Elemente. 93% aller Atome des Sonnensystems sind Wasserstoffatome. Da Wasserstoff die kleinste Atommasse besitzt, entspricht dieser Anteil "nur" 75% der gesamten Masse. Auf der Erde ist der Massenanteil vo n Wasserstoff viel geringer: 0,12% (auf die Erd-Gesamtmasse bezogen). Während im All Wasserstoff meist in reiner Form vorliegt, ist der irdische Wasserstoff fast immer mit weiteren Elementen verbunden. Von keinem anderen Element gibt es so viele Verbindungen: die häufigste und bekannteste ist das Wasser. In einem vereinfachten Modell besteht ein Atom aus einem Kern und Elektronen, welche sich um den Kern herum bewegen. Der Kern ist aus positiv geladenen Protonen und elektrisch neutralen Neutr onen aufgebaut und macht fast die Gesamtmasse des Atoms aus. Elektronen sind in Schalen angeor dnet, wobei die äusserste für die chemischen Eigenschaften des Atoms zentral ist. Sie wird als Valen zschale bezeichnet und enthält entsprechend die Valenzelektronen. Alle anderen Elektronen befinden sich in den inneren Schalen. Ein Wasserstoffatom besteht aus einem im Kern enthaltenen Proton und einem einzigen Valenzelek tron. Es gibt noch zwei zusätzliche natürliche Isotope von Wasserstoff (Tabelle 1 -1). Isotope sind Atome desselben Elements - also mit der gleichen Kernladungszahl (Anzahl der Protonen im Atomkern) die sich aber in der Anzahl der Neutronen unterscheiden. Isotope unterscheiden sich nur in ihrer Ma sse aber nicht in ihren chemischen Eigenschaften. Isotope eines Elem ents haben folglich die gleiche Kernladungszahl, aber unterschiedliche Massenzahlen (Anzahl der Neutronen und Protonen im Ato mkern). Um deutlich zu machen, dass man nicht nur von einem Atom oder Element, sondern von einem bestimmten Isotop spricht, gibt man die Massenzahl A normalerweise als hochgestellten Index vor dem Elementsymbol X (oder Elementnamen) an. Die Kernladungszahl Z wird manchmal ebenfalls links vom Symbol angegeben, allerdings tiefgestellt: Massenzahl A Symbol des Elements ZX Kernladungszahl Beispiel: 16 (häufigstes Isotop von Sauerstoff: acht Protonen, acht Elektronen und acht Neutronen) 8O Die Angabe der Kernladungszahl ist jedoch nicht nötig, weil diese Information schon im Symbol des Elements enthalten ist: Das chemische Symbol O bedeutet acht Protonen. Deswegen wird ein Isotop fast immer ohne die Kernladungszahl dargestellt, d.h. 16 O. Tabelle 1-1. Isotope des Wasserstoffs mit Ihrer natürlichen Häufigkeit Name Symbol Wasserstoff (Protium) 1 Kernladungszahl Massenzahl Neutronen Häufigkeit H 1 1 0 99,985% Deuterium 2 H (D) 1 2 1 0,015% Tritium 3 H (T) 1 3 2 Spuren (~ 10 E-Dossier Wasser: Wasser aus der Sicht der Chemie PHBern 2012, www.phbern.ch –15 %) 2/5 Die Lewis-Struktur des Wasserstoffatoms lautet: H· In einer Lewis-Struktur werden die Valenzelektronen entweder durch einen Punkt (für ein ungepaartes Elektron) oder durch einen Strich (für ein Elektronenpaar) sinnbildlich dargestellt. Mit dem chemischen Symbol werden alle weiteren Teilchen (Protonen, Neutronen und innere Elektronen) in der Lewis Struktur symbolisiert. Auf der Erde ist Sauerstoff mit einem Massenanteil von 50,5% das häufigste Element der Erdhülle, im Synthese Weltall hat es "nur" 0,8%, damit ist es aber immer noch das dritthäufigste Element. Wie für Wasserstoff gibt es drei stabile natürliche Isotope des Sauerstoffs (Tabelle 1-2). Tabelle 1-2. Isotope des Sauerstoffs mit Ihrer natürlichen Häufigkeit Symbol Kernladungszahl Massenzahl Neutronen Häufigkeit 16 O 8 16 8 99,76% 17 O 8 17 9 0,037% 18 O 8 18 10 0,20% Mit zwei Elektronenpaaren und zwei freien Elektronen sieht die Lewis-Struktur eines Sauerstoffatoms wie folgt aus: ·O· 3 Die Bindungen im Wasser Im Gegensatz zu Helium- oder Neonatomen, sind Einzelatome von Wasserstoff und Sauerstoff nicht stabil. Helium und Synthese Neon gehören zu den Edelgasen und sind dank ihrer vollständigen Valenzschale sehr reaktionsträge. Um stabiler zu werden, neigen andere Elemente dazu, die Elektronenkonfiguration eines Edelgases anzustreben. Diese Regel ist als Oktett- oder Edelgasregel bekannt. Um dieses Ziel zu erreichen, binden sich Nichtmetalle (wie Wasserstoff und Sauerstoff) zusammen und teilen ihre Elektronen: Jedes freie Elektron des Sauerstoffatoms bildet ein bindendes Elektronenpaar mit dem freien Elektron eines Wasserstoffatoms. Diese Elektronenpaare verknüpfen die Atome miteinander und werden daher als Bindungen bezeichnet, was mit einem Strich in der Lewis -Struktur des Wassermoleküls dargestellt wird: H· ·O· ·H O H H Bindungen Synthese Die Elektronen der Bindungen werden von den beiden Atomen geteilt und werden daher den beiden Synthese zugeordnet. Aus diesem Grund werden solche Bindungen als "kovalent" bezeichnet. Synthese Synthese In einem Wassermolekül hat Sauerstoff mit vier Elektronenpaaren - zwei bindenden und zwei nicht bindenden - die gleiche Elektronenkonfiguration wie Neon (acht Elektronen in der Valenzschale). J edes Wasserstoffatom verfügt über ein Elektronenpaar und besitzt somit die gleiche Elektronenkonfig uration wie Helium (zwei Elektronen in der Valenzschale). Die Summenformel von Wasser H 2O kann jetzt erklärt werden: mit dieser Zusammensetzung haben beide Elemente die Elektronenkonfiguration eines Edelgases erreicht und sind folglich sehr stabil geworden. E-Dossier Wasser: Wasser aus der Sicht der Chemie PHBern 2012, www.phbern.ch 3/5 4 Die Struktur des Wassermoleküls Um die genaue Geometrie eines Wassermoleküls zu erklären, werden Elektronenpaare der Vereinf achung halber als negativ geladene Elektronenwolken betrachtet. Zwei gleich geladene Teilchen sto ssen sich ab. Entsprechend stossen sich Elektronenwolken ab. Im Sauerstoffatom müssen sich vier solcher Elektronenwolken - zwei bindende und zwei nicht bindende – in der Valenzschale anordnen. Um die Abstossungskräfte zu minimieren sollen diese vier Elek tronenwolken mit dem grössten Abstand zueinander angeordnet sein. Welche geometrische Anordnung ergibt sich daraus (Abb. 1-1)? Abb. 1-1. Geometrische Anordnung der vier Elektronenwolken um das Sauerstoffatom. In Abbildung 1-1 ist die Geometrie angegeben, die den grössten Abstand der vier Elektronenwolken zueinander erlaubt: Jede Elektronenwolke befindet sich auf der Spitze eines Tetraeders mit dem Atomkern genau im Zentrum. Zwei Elektronenwolken sind nicht bindend (freie Elektronenpaare) und zwei bindend (kovalente Bindungen): Jedes Wasserstoffatom befindet sich auf einer Spitze des Tetr aeders: Die gewinkelte Struktur resultiert aus der tetraedrischen Anordnung der vier Elektronenpaare. Die A nwesenheit der beiden freien Elektronenpaare ist für die Struk tur des Wassermoleküls entscheidend: Ohne diese wäre das Molekül linear, was dem Wasser ganz andere physikalische und chemische Eigenschaften verschaffen würde! Die Abstossungskräfte zwischen zwei freien Elektronenpaaren sind grösser als zwischen einem freien Elektronenpaar und einem bindenden Elektronenpaar, die selber grösser als zwischen zwei bindenden Elektronenpaaren sind. Aus diesem Grund ist der Bindungswinkel im Wasser mit 104,5° leicht kleiner als in einem regulären Tetraeder (109,5°): 5 Die Polarität des Wassermoleküls Im Wasser sind Atome durch kovalente Bindungen verknüpft. Die zwei Elektronen der Bindungen gehören sowohl dem Wasserstoffatom als auch dem Sauerstoffatom, jedoch nicht zu gleichen Teilen. Manche Elemente ziehen Elektronen stärker an sich als andere. Die Fähigkeit, Elektronen in einer Verbindung an sich zu ziehen, wird mit der Elektronegativität (EN abgekürzt) beschrieben. Ein Element mit einer hohen Elektronegativität verfügt über eine starke Anziehungskraft auf Elektronen, während ein Element mit geringer Elektronegativität leicht Elektronen an andere, elektronegativere Atome a bgibt. Ausser den Edelgasen, besitzt jedes Element eine bestimmte Elektronegativität (Abb. 1-2). E-Dossier Wasser: Wasser aus der Sicht der Chemie PHBern 2012, www.phbern.ch 4/5 H He 2,1 Li Be B C N O F 1,0 1,6 2,0 2,6 3,0 3,5 4,0 Na Mg Al Si P S Cl 0,93 1,3 1,6 1,9 2,2 2,6 3,2 K Ca Sc Ti V 1,5 1,6 Y Zr Nb Mo Tc 0,82 0,95 1,2 1,3 1,6 0,82 1,0 Rb Sr 1,4 Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br 1,7 1,9 1,9 3,0 1,6 2,2 1,9 1,8 1,7 1,8 2,0 Ru Rh Pd Ag Cd In Sn Sb Te I 2,2 1,8 2,0 2,4 2,0 2,7 Cs Ba La Hf Ta W Re Os 0,79 0,89 1,1 1,3 1,5 2,4 1,9 Fr 1,9 2,2 2,3 2,2 2,6 2,2 1,9 Ir Pt Au Hg Tl Pb Bi Po At 2,2 2,3 2,5 2,0 2,3 2,0 2,0 2,2 1,7 2,0 Ne Ar Kr Xe Rn Ra Ac Unq Unp Unh 0,70 0,90 1,1 Abb. 1-2. Elektronegativität der Elemente (nach Pauling). Im Periodensystem steigt die Elektronegativität von links nach rechts, und von unten nach oben. Mit einem Wert von 4,0 besitzt Fluor (oben rechts) die grösste Elektronegativität, mit 0,70 besitzt Francium (unten links) die kleinste. Die Elektronegativität eines Elements ist grundsätzlich eine Kombination drei seiner Eigenschaften: 1. Die Atomgrösse (Atomradius): Innerhalb einer Gruppe (von oben nach unten) werden die Atome immer grösser, weil sie immer mehr Elektronenschale besitzen. Innerhalb einer Periode (von links nach rechts) werden die Atome immer kleiner, weil die positive Ladung im Kern z unimmt und daher eine grössere Anziehungskraft auf die Elektronenschalen ausübt, was eine Kontraktion der Schalen in Richtung des Kerns zur Folge hat. 2. Die Ionisierungenergie: Diese Grösse gibt an, wie viel Energie nötig ist, um ein Elektron "e -" aus dem Element "E" zu entfernen: E → E + + eElemente, welche sich links und unten im Periodensystem befinden, können am leichtesten i onisiert werden; Oben rechts befinden sich die Elemente, die sich am schwersten ionisieren lassen. 3. Die Elektronenaffinität: Diese Grösse gibt an, wie viel Energie gebraucht oder freigesetzt wird, um ein Elektron "e-" zum Element "E" hinzuzufügen: E + e- → EElemente, welche sich rechts und oben im Periodensystem befinden, nehmen am leichtes ten ein zusätzliches Elektron auf; Unten links befinden sich die Elemente, die am schwersten ein zusätzliches Elektron annehmen. Da die Elektronegativität eine Kombination dieser drei Eigenschaften ist, versteht man warum Fluor (oben rechts) die grösste Elektronegativität hat: Fluor ist klein, lässt sich schwer ionisieren aber nimmt gerne ein zusätzliches Elektron auf. Wenn zwei Atome gleicher Elektronegativität eine Bindung bilden, verteilen sich die Elektronen regelmässig (homogen) zwischen den beiden Atomen: H H unpolare Bindung Wenn zwei Atome unterschiedlicher Elektronegativität (EN) eine Bindung bilden, verteilen sich die Elektronen unregelmässig (heterogen) zwischen den beiden Atomen: Die Delokalisierung der Elektronen - was als Polarisation bezeichnet wird - in Richtung des Sauerstoffs führt zu Partialladungen: Eine negative (mit - sinnbildlich dargestellt) auf dem Atom mit der grössten Elektronegativität und eine positive (+) auf dem Atom mit der kleinsten Elektronegativität. In einem Wassermolekül sind zwei solche polarisierten Bindungen beinhaltet. Die partiellen Ladungen sehen folgenderweise aus: E-Dossier Wasser: Wasser aus der Sicht der Chemie PHBern 2012, www.phbern.ch 5/5 + - O H + H Damit ein ganzes Molekül selber polar ist, ist die Anwesenheit einer (mehrerer) polarer (polaren) Bindung(en) notwendig. Diese Bedingung(en) allein(e) reicht (reichen) jedoch nicht aus! Ein Molekül wird im Ganzen nur polar sein, wenn die Partialladungen sich nicht ausgleichen. Auch wenn der Begriff "Schwerpunkt" fachlich falsch ist, kann man vereinfacht sagen, dass sich in einem polaren Molekül der "Schwerpunkt" der positiven Partialladungen nicht am gleichen Ort befinden darf, wie jener der negat iven Partialladungen. Sonst ist das Molekül unpolar, wie zum Beispiel in der Verbindung Be rylliumchlorid BeCl2. Dieses Molekül enthält zwei polare Bindungen. Im Gegensatz zu Sauerstoff besitzt das Berylliumatom kein freies Elektronenpaar. Die beste Anordnung der zwei Elektronenpaare (Bindungen) um ihre Abstossungskräfte zu minimieren, ist ein 180° Bindungswinkel, was eine lineare Struktur des Moleküls zur Folge hat: - ++ - Cl Be Cl 180° Wegen der linearen Struktur befindet sich der Schwerpunkt der positiven Partialladungen genau am gleichen Ort, wie der der negativen Partialladungen (auf dem Berylliumatom). Weil das Wassermolekül eine gewinkelte Struktur hat, befindet sich der Schwerpunkt der positiven Partialladungen (zwischen den beiden Wasserstoffatomen) nicht am gleichen Ort, wie jener der neg ativen Partialladungen (auf dem Sauerstoffatom): Folglich ist eine Seite des Wassermoleküls ständig negativ und die andere positiv geladen, was als Dipol bezeichnet wird. Schematisch wird ein Dipol wie ein Wassermolekül durch ein Oval mit zwei entgegengesetzten Partialladungen dargestellt (Siehe oben). E-Dossier Wasser: Wasser aus der Sicht der Chemie PHBern 2012, www.phbern.ch