Leseprobe - STARK Verlag
Werbung

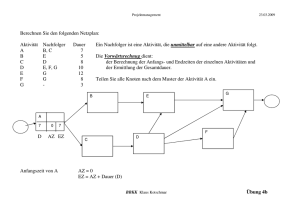
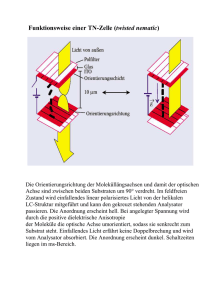
2 Naturstoffe 1 Kohlenhydrate und optische Aktivität In der Natur werden Kohlenhydrate aus dem Kohlenstoffdioxid der Luft und aus Wasser mithilfe des Sonnenlichts über die physikalisch-chemischen Prozesse der Fotosynthese hergestellt. Ein Teil der Energie des Sonnenlichts wird von den Pflanzen so in einer chemisch verwertbaren Form festgelegt. Der Name „Kohlenhydrate“ ist historisch zu erklären und leitet sich von der allgemeinen Summenformel Cn(H2O)n dieser Verbindungen ab. In der systematischen chemischen Nomenklatur tragen die Namen vieler Vertreter der Kohlenhydrate die Endung „-ose“, wie etwa bei Glucose oder Fructose. 1.1 Molekülchiralität und optische Aktivität Die Moleküle verschiedener chemischer Verbindungen wie Glycerinaldehyd oder Milchsäure kommen in zwei verschiedenen Formen vor, die sich wie unsere Hände verhalten: wie Bild und Spiegelbild. Man kann Modelle dieser Moleküle drehen und wenden, stets stellt man fest, dass sie sich nicht zur Deckung bringen lassen. Dieses Phänomen bezeichnet man mit dem Begriff Chiralität („Händigkeit“) oder Spiegelbildisomerie. Moleküle, die sich wie Bild und Spiegelbild verhalten, bezeichnet man als Enantiomere1 oder optische Isomere. Sie drehen die Ebene linear polarisierten Lichtes. Die Spiegelbildisomerie der Milchsäure erklärt sich aus der Tatsache, dass am Kohlenstoffatom C 2 vier verschiedene Substituenten tetraedrisch angeordnet sind: D(–)-Milchsäure L(+)-Milchsäure OH O C H C* H C OH O C OH HO H H C* H H C H H Spiegelebene Abb. 1: Enantiomere des Milchsäuremoleküls Dieses Kohlenstoffatom wird asymmetrisches Kohlenstoffatom genannt und mit (*) gekennzeichnet. Es bildet das Chiralitätszentrum des Moleküls. 1 von griech. enantios: entgegengesetzt Kohlenhydrate und optische Aktivität 3 Um die unterschiedlichen räumlichen Strukturen chiraler Moleküle darzustellen, wendet man die Projektionsformel-Schreibweise nach FISCHER an. Zur Erstellung solcher Projektionen müssen folgende Regeln beachtet werden: • Die Kohlenstoffkette wird senkrecht angeordnet. • Das höchstoxidierte Kohlenstoffatom steht dabei oben. • Das asymmetrische Kohlenstoffatom liegt in der Papierebene. • Nach oben und unten verlaufende Bindungen liegen hinter, nach links und rechts weisende Bindungen liegen vor der Papierebene. Projiziert man nun alle vier Substituenten in die Papierebene, so erhält man im Fall des Milchsäuremoleküls für die C – C-Bindungen senkrechte, für die C – H- und C – OH-Bindung jeweils einen waagrechten Bindungsstrich. Die beiden chiralen Moleküle unterscheiden sich in der Stellung der Hydroxylgruppe: H O C H C OH CH3 Spiegelebene HO H O O C OH C* HO Papierebene H3 C O HO OH O C C C* H C* H3C H OH C OH CH3 D-Milchsäure HO C* H CH3 L-Milchsäure Mit D-Milchsäure bezeichnet man die Verbindung, bei der die OH-Gruppe in der Fischer-Projektion rechts steht (lat.: dexter: rechts). Bei L-Milchsäure ist die OH-Gruppe dementsprechend links (lat.: laevus: links) angeordnet. Wenn eine Verbindung mehrere asymmetrische Kohlenstoffatome aufweist, bezieht sich die D- bzw. L-Bezeichnung auf die Stellung des Substituenten am asymmetrischen Kohlenstoffatom, das am weitesten von der höchstoxidierten Gruppe entfernt liegt. Untersucht man Verbindungen mit n asymmetrischen Kohlenstoffatomen, so existieren von diesen 2n Stereoisomere. Bei gleicher Strukturformel (Konstitutionsformel), bei gleicher Reihenfolge und gleicher Verknüpfung der Atome bzw. Atomgruppen im Molekül also, weisen Stereoisomere eine unterschiedliche räumliche Anordnung dieser Atome bzw. Atomgruppen auf. Solche räumlichen Anordnungen werden als Konfigurationen bezeichnet. Die Stereochemie befasst sich mit der Untersuchung und Charakterisierung dieser Konfigurationen. 4 Naturstoffe Stereoisomere, die sich wie Bild und Spiegelbild verhalten, die also nicht zur Deckung gebracht werden können, nennt man Enantiomere. Stereoisomere, die sich nicht spiegelbildisomer zueinander verhalten, bezeichnet man als Diastereomere2. Polarisiertes Licht und die Messung der optischen Aktivität Einige Eigenschaften von Licht lassen sich dadurch erklären, dass man annimmt, Licht sei eine transversale Welle, deren Schwingungsrichtung senkrecht zur Ausbreitungsrichtung steht. Normalerweise sind alle möglichen Schwingungsrichtungen existent, die senkrecht zur Ausbreitungsrichtung stehen. Es gibt jedoch Filter, die aus dieser Vielzahl von Schwingungsrichtungen nur eine einzige hindurchtreten lassen und den Rest abschwächen. Das Licht, das aus einem solchen Polarisator austritt, nennt man linear polarisiertes Licht. Unser Auge kann dieses Licht von normalem Licht nicht unterscheiden. Wird aber ein zweiter Polarisationsfilter (Analysator) in den Strahlengang gebracht, kann der Unterschied erkennbar gemacht werden. Ein Polarimeter dient der Analyse der optischen Aktivität von Verbindungen. Als Lichtquelle wird eine Natriumdampflampe verwendet, die monochromatisches Licht der Wellenlänge λ = 589 nm erzeugt, das durch ein drehbares Filter, den Polarisator tritt. Damit werden nur die Schwingungsebenen durchgelassen, die der Gitterrichtung des Polarisators entsprechen. Das auf diese Weise linear polarisierte Licht wird nun durch einen zweiten, ebenfalls drehbaren Filter, den Analysator, betrachtet. Stimmen die Gitterrichtungen beider Filter überein, tritt das polarisierte Licht aus und kann beobachtet werden. Dreht man den Analysator so, dass die Gitterrichtung des Analysators senkrecht zu der des Polarisators steht, so wird der Durchtritt des linear polarisierten Lichts verhindert, es herrscht Dunkelheit. Abb. 2: Schematischer Aufbau eines Polarimeters 2 von griech. dia: jenseits Kohlenhydrate und optische Aktivität 5 Optische Aktivität Wenn man eine Probe eines der beiden Enantiomere der Milchsäure in den Strahlengang zwischen Polarisator und Analysator bringt, kann man eine Aufhellung erkennen. Um wieder völlige Dunkelheit zu erreichen, muss der Analysator um einen bestimmten Winkel α gedreht werden. Beim Durchtritt durch die Lösung wurde die Schwingungsrichtung des linear polarisierten Lichts um eben diesen Winkel α gedreht. Bei D-Milchsäure muss der Analysator gegen den Uhrzeigersinn gedreht werden, sie ist linksdrehend. Bei L-Milchsäure muss der Analysator entgegengesetzt verdreht werden, sie ist die rechtsdrehende Form. Stoffe, die die Schwingungsrichtung von linear polarisiertem Licht beeinflussen, bezeichnet man als optisch aktiv und kennzeichnet die rechtsdrehende Form mit (+), die linksdrehende mit (–). Spezifische Drehung Der gemessene Drehwinkel α ist proportional zur Massenkonzentration β in [g ⋅ mL–1] und zur Schichtdicke A in [dm] der Lösung: α = [ α ]D20 ⋅β⋅ A grd ⋅ mL [ α ]D20 : Stoffkonstante g ⋅ dm D: D-Linie des Natriums 20 : Temperatur des Lösungsmittels bei 20 °C Im Lösungsmittel Wasser gelten bei 20 °C folgende spezifische Werte: –1 –1 • D-Milchsäure: [α] 20 D = – 3,8° ⋅ mL ⋅ g ⋅ dm • D-Glucose: –1 –1 [α] 20 D = + 52,7° ⋅ mL ⋅ g ⋅ dm • D-Fructose: –1 –1 [α] 20 D = – 92,4° ⋅ mL ⋅ g ⋅ dm Stimmen Lösungsmittel, Temperatur und Wellenlänge mit den Bedingungen der Tabellenwerte für die spezifische Drehung überein, so kann man bei gegebener Schichtdicke aus der Bestimmung des Drehwinkels α die Konzentration der untersuchten Verbindung ermitteln. Enantiomere und optische Aktivität Alle chiralen Verbindungen zeigen optische Aktivität. Die jeweiligen Enantiomeren lassen sich durch ihre unterschiedliche spezifische Drehung unterscheiden, die entweder mit oder gegen den Uhrzeigersinn verläuft.