Optische Aktivität Enantiomerenreinheit
Werbung

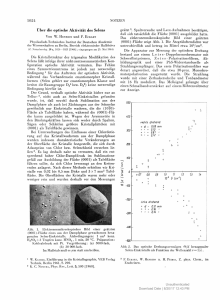
Molekülsymmetrie und Kristallographie Optische Aktivität Wie schon im Skriptum 5 erwähnt ist es nicht einfach, aus experimentellen Daten auf die Absolutkonfiguration einer chiralen Verbindung zu schließen. In den meisten Fällen verwendet man dazu Relativmethoden. Die älteste dieser Methoden, die auch heute noch sehr weit verbreitet ist, ist die Messung der optischen Aktivität. Damit ist gemeint, dass chirale Verbindungen bei Durchgang von linear polarisiertem Licht die Schwingebene des elektrischen Lichtvektors drehen. Man erinnere sich, dass linear polarisiertes Licht ausschließlich aus Lichtwellen mit paralleler Schwingebene besteht, während in natürlichem Licht sämtliche Schwingrichtungen (also unendliche viele) vertreten sind. Die Existenz optischer Aktivität war bereits im frühen 19. Jahrhundert bekannt und ist bei Quarz [(SiO2)x] nachgewiesen worden. Quarz bildet chirale Kristalle; die Chiralität ist hier also keine Molekül-, sondern eine Kristalleigenschaft. Zur Messung optischer Aktivität verwendet man ein sog. Polarimeter. Linear polarisiertes Licht (erzeugt mit Hilfe eines doppelbrechenden Kristalls oder eines Polarisationsfilters; Polarisator) wird durch die Substanzprobe (meist eine Lösung der chiralen Verbindung) geleitet. Die dadurch resultierende Drehung α wird mit Hilfe eines zweiten Polarisationsfilters (Analysator) registriert. 8 – Optische Aktivität 1 Molekülsymmetrie und Kristallographie Schematische Darstellung eines Polarimeters Der Drehwert α hängt außer von der Substanz selbst auch noch von einigen anderen Parametern ab. Wenn also Drehwerte von mehreren Verbindungen verglichen oder archiviert werden sollen, müssen diese Parameter beachtet werden. Zunächst gibt es natürlich rein experimentell-apparative Parameter, die durch Umformung in den spezifischen Drehwert [α]DT eliminiert werden können: T α = [α] D . l . c l = Schichtdicke der Substanzküvette in dm c = Substanzkonzentration in g/ml T = Temperatur der Messlösung in 0C; α ist temperaturabhängig (siehe unten). 8 – Optische Aktivität 2 Molekülsymmetrie und Kristallographie Das Superskript „D“ bezieht sich auf die meist verwendete Wellenlänge des linear polarisisierten Lichts aus Natrium-Dampflampen, nämlich λ = 589.3 nm (Natrium-DT Linie; Fraunhofers D-Linie). Dies ist wichtig, weil der Drehwinkel [α] D wellenlängenabhängig ist. Diese Abhängigkeit nennt man „normale optische Rotationsdispersion“ (ORD), deren Kurvenverläufe, je nach vermessenem Enantiomer, wie unten abgebildet aussehen („schlichte Kurven“). Existiert in diesem Wellenlängenbereich eine UV-Absorption, wird der „schlichten“ Kurve ein S-förmiger Anteil, der sog. Cotton-Effekt (oder Circulardichroismus, CD), überlagert. Diese Cotton-Effekte haben für die Enantiomere unterschiedliche Vorzeichen und stellen damit die einzige direkte spektroskopische Methode zur Bestimmung von Absolutkonfigurationen dar. 8 – Optische Aktivität 3 Molekülsymmetrie und Kristallographie Enantiomere haben den gleichen Drehwert, aber unterschiedliche Vorzeichen von [α] TD. Es ist nicht unmittelbar ableitbar oder intuitiv vorhersagbar, welches Vorzeichen mit welcher Absolutkonfiguration verknüpft ist! Allerdings gibt es neuerdings Rechenmethoden, die diese Verknüpfung mit hoher Wahrscheinlichkeit vorhersagen können. Diese sind aber sehr aufwendig und erfordern begleitende alternative spektroskopische Experimente (Vibrations-CD, VCD). Man beachte den Unterschied der Begriffe: Chiralität ist eine Molekül-(Kristall-)eigenschaft, während optische Aktivität eine Substanzeigenschaft ist. So besteht z.B. ein Racemat ausschließlich aus chiralen Molekülen, ist aber optisch inaktiv! Bestimmung der optischen Reinheit p: T Ist für die zu untersuchende Substanz der Drehwert [α] D.bekannt, kann man über den experimentellen Drehwert α die optische Reinheit p, also das Enantiomerenverhältnis ermitteln: p = α / [α] DT . 100 [in %] 8 – Optische Aktivität 4 Molekülsymmetrie und Kristallographie Leider ist die optische Reinheit quantitativ kein sehr zuverlässiges Maß für das Enantiomerenverhältnis, weil in Lösung intermolekulare Wechselwirkungen zwischen Solut-Molekülen existieren, die zum einen die Abhängigkeit des Drehwertes von der Konzentration nichtlinear machen können. Zum anderen können sich solche Wechselwirkungen und ihre Auswirkungen auf α unterscheiden, je nachdem ob gleiche oder unterschiedliche Enantiomere wechselwirken. Man zieht daher heute den Begriff des Enantiomerenüberschusses ee („enantiomeric excess“) dem der optische Reinheit vor, zumal die Mengen von Enantiomeren in Gemischen heute relativ leicht durch Chromatographie oder NMR-Spektroskopie bestimmt werden können. E+ - Eee = x 100 [in %] + E + E E+ und E- sind so definiert, dass E+ das mengenmäßig überwiegende (nicht das rechtsdrehende!) und E- das im Unterschuss vorliegende Enantiomer ist. Diese Definition stellt sicher, dass „ee“ die wirklichen Mengenverhältnisse wiedergibt. Beispiel: Liegt ein nicht-racemisches Gemisch aus 90% E+ und 10% E- vor, ist ee = 80%. 8 – Optische Aktivität 5