Pressemitteilung
Werbung
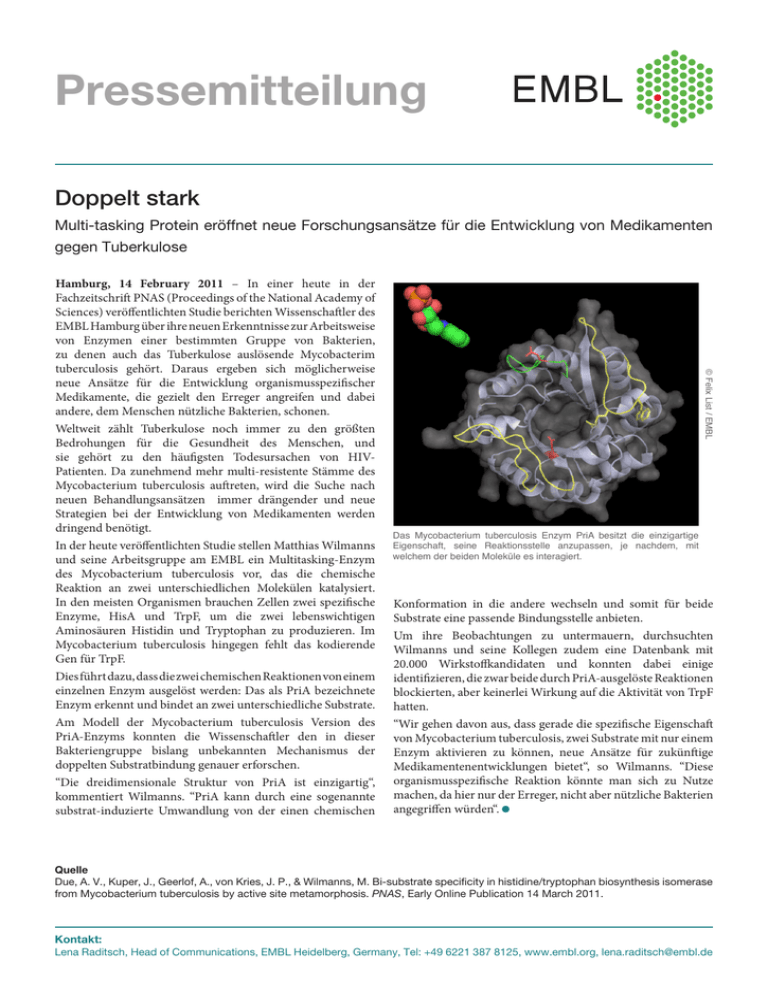
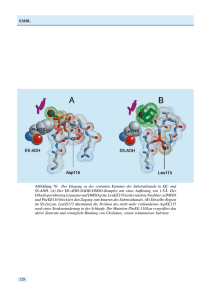
Pressemitteilung Doppelt stark Multi-tasking Protein eröffnet neue Forschungsansätze für die Entwicklung von Medikamenten gegen Tuberkulose © Felix List / EMBL Hamburg, 14 February 2011 – In einer heute in der Fachzeitschrift PNAS (Proceedings of the National Academy of Sciences) veröffentlichten Studie berichten Wissenschaftler des EMBL Hamburg über ihre neuen Erkenntnisse zur Arbeitsweise von Enzymen einer bestimmten Gruppe von Bakterien, zu denen auch das Tuberkulose auslösende Mycobacterim tuberculosis gehört. Daraus ergeben sich möglicherweise neue Ansätze für die Entwicklung organismusspezifischer Medikamente, die gezielt den Erreger angreifen und dabei andere, dem Menschen nützliche Bakterien, schonen. Weltweit zählt Tuberkulose noch immer zu den größten Bedrohungen für die Gesundheit des Menschen, und sie gehört zu den häufigsten Todesursachen von HIVPatienten. Da zunehmend mehr multi-resistente Stämme des Mycobacterium tuberculosis auftreten, wird die Suche nach neuen Behandlungsansätzen immer drängender und neue Strategien bei der Entwicklung von Medikamenten werden dringend benötigt. In der heute veröffentlichten Studie stellen Matthias Wilmanns und seine Arbeitsgruppe am EMBL ein Multitasking-Enzym des Mycobacterium tuberculosis vor, das die chemische Reaktion an zwei unterschiedlichen Molekülen katalysiert. In den meisten Organismen brauchen Zellen zwei spezifische Enzyme, HisA und TrpF, um die zwei lebenswichtigen Aminosäuren Histidin und Tryptophan zu produzieren. Im Mycobacterium tuberculosis hingegen fehlt das kodierende Gen für TrpF. Dies führt dazu, dass die zwei chemischen Reaktionen von einem einzelnen Enzym ausgelöst werden: Das als PriA bezeichnete Enzym erkennt und bindet an zwei unterschiedliche Substrate. Am Modell der Mycobacterium tuberculosis Version des PriA-Enzyms konnten die Wissenschaftler den in dieser Bakteriengruppe bislang unbekannten Mechanismus der doppelten Substratbindung genauer erforschen. “Die dreidimensionale Struktur von PriA ist einzigartig“, kommentiert Wilmanns. “PriA kann durch eine sogenannte substrat-induzierte Umwandlung von der einen chemischen Das Mycobacterium tuberculosis Enzym PriA besitzt die einzigartige Eigenschaft, seine Reaktionsstelle anzupassen, je nachdem, mit welchem der beiden Moleküle es interagiert. Konformation in die andere wechseln und somit für beide Substrate eine passende Bindungsstelle anbieten. Um ihre Beobachtungen zu untermauern, durchsuchten Wilmanns und seine Kollegen zudem eine Datenbank mit 20.000 Wirkstoffkandidaten und konnten dabei einige identifizieren, die zwar beide durch PriA-ausgelöste Reaktionen blockierten, aber keinerlei Wirkung auf die Aktivität von TrpF hatten. “Wir gehen davon aus, dass gerade die spezifische Eigenschaft von Mycobacterium tuberculosis, zwei Substrate mit nur einem Enzym aktivieren zu können, neue Ansätze für zukünftige Medikamentenentwicklungen bietet“, so Wilmanns. “Diese organismusspezifische Reaktion könnte man sich zu Nutze machen, da hier nur der Erreger, nicht aber nützliche Bakterien angegriffen würden“. Quelle Due, A. V., Kuper, J., Geerlof, A., von Kries, J. P., & Wilmanns, M. Bi-substrate specificity in histidine/tryptophan biosynthesis isomerase from Mycobacterium tuberculosis by active site metamorphosis. PNAS, Early Online Publication 14 March 2011. Kontakt: Lena Raditsch, Head of Communications, EMBL Heidelberg, Germany, Tel: +49 6221 387 8125, www.embl.org, [email protected] Über EMBL Das Europäische Laboratorium für Molekularbiologie (EMBL) ist ein Grundlagenforschungsinstitut, das sich über öffentliche Forschungsgelder aus 20 Mitgliedstaaten und Australien als assoziiertem Mitglied finanziert (Belgien, Dänemark, Deutschland, Finnland, Frankreich, Griechenland, Großbritannien, Irland, Island, Israel, Italien, Kroatien, Luxemburg, Niederlande, Norwegen, Österreich, Portugal, Schweden, Schweiz und Spanien). Etwa 85 unabhängige Forschungsgruppen arbeiten am EMBL zu Themen des gesamten Spektrums der Molekularbiologie. Das Institut ist in fünf Einheiten gegliedert: das Hauptlaboratorium in Heidelberg (900 Mitarbeiter) sowie Außenstellen in Hinxton (Europäisches Bioinformatik-Institut) (400 Mitarbeiter), Grenoble (70 Mitarbeiter), Hamburg (100 Mitarbeiter) und Monterotondo bei Rom (65 Mitarbeiter). Die Kernaufgaben des EMBL sind: molekularbiologische Grundlagenforschung; Ausbildung von Studenten, Wissenschaftlern und Gastwissenschaftlern; Serviceleistungen für Wissenschaftler in den Mitgliedstaaten; Entwicklung neuer Instrumente und Methoden für die Biowissenschaften sowie aktiver Technologietransfer. Im internationalen Doktorandenprogramm des EMBL forschen rund 190 Studenten. Darüber hinaus fördert das Institut den Austausch mit der Öffentlichkeit durch Vortragsreihen, Besucherprogramme und aktive Wissenschaftskommunikation. Policy regarding use EMBL press and picture releases including photographs, graphics, movies and videos are copyrighted by EMBL. They may be freely reprinted and distributed for non-commercial use via print, broadcast and electronic media, provided that proper attribution to authors, photographers and designers is made. High-resolution copies of the images can be downloaded from the EMBL web site: www.embl.org