Hinweis
Werbung

Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen
des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das
eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die
Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen
Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html
eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und
Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Seminar: Übungen im Experimentalvortrag
Leiter: E. Gerstner, J. Butenuth, H. Perst
Vortrag vom 7.5.'97
von Peter-Daniel Münch
schr iftliche Fassung (Protokoll)
Thema: Ester
Gliederung:
1. Allgemeines
2. Vorkommen
3. Darstellung
(Versuche 1und 2)
4. Hydrolyse von Estern
(Versuche 3, 4 und 5)
5. sehr eH - acide Ester
(Versuch 6)
6. Anwendungen der Ester
(Versuch 7)
7.Literatur
Chemie in der Schule: www.chids.de
Marburg, den11.7.'97
1. Allgemeines:
Die Bezeichnung Ester wurde 1850 von Gmelin aus Essigä!her für eine Gruppe von
Carbonsäurederivaten gebildet.
Definition: Ester werden durch (formale) Kondensation aus Carbonsäure oder
anorganischer Säure und Alkohol unter Wasserabspaltung gebildet.
r:
allgemeine Formel :
!
f ,Q_ {r
I
"'
I
!
/
~ "
0/
i -:
-
0" _"r. I
\
""'
-
<~
R
"""'(9
/~
f
'
-L\.
@
~O· -
R'
Eigenschaften: Ester haben meistens osmorphischen Charakter, d.h. sie sind
geruchsintensiv.
I
--.
Nomenklatur: An den Alkyl- oder Arylrest des Alkohols wird das Säure-Anion
(entsprechend anorganischer Salze) angehängt (z.B. Ethylacetat) oder an die Säure
wird der Alkyl -I Arylrest des Alkohols mit der Endung -ester gehängt, z.B.
Essigsäureethylester
2. Vorkommen:
Ester kommen als Fette und fette Öle, Wachse, Lecitine und als Riechstoffe in
Blüten und Pflanzen in der Natur vor. Einige Riechstoffe (z.B. Essigsäureisoamylester und Salicylsäuremethylester) kann man auf Filterpapier getropft herumreichen.
Allgemeine Formeln:
..
2t-0-CO-R
H
Fette und fette Oie: Hp-O-CO-R' k,R' und R': langkettige Kohlenwasserstoffe, C ~ 4
H2C-0-CO-R"
Wachse: R-CO-O-R' ,
Rund R': langkettige Kohlenwasserstoffe, C > 16
Phosphatide,
z.B. Lecitin:
Riechstoffe: R-CO-O-R'
Rund R': Aryl- oder kurzkettige Alkylreste, C < 6
2
Chemie in der Schule: www.chids.de
3. Darstellung:
Die wichtigste Methode in Labor und Techn ik ist die durch Säuren katalysierte
Umsetzung von Carbonsäuren mit Alkoholen:
Der
Mechanismus
der
Reaktion
ist
meist
der
AAc2 -Mechanismus,
d.h.
säurekatalysierte Acyl-Sauerstoffspaltung, bimolekular.
r
'01
f'
R- .... "QI-j
~+I+
lOH
/QH .
R- r +
R~H ...
R-(-OH
-')"0
H
r
R~O(
I
~
~-- -
I
'lccH.,jSOt"\
Htt-R1
H
I
1
..--..
1J,
C~
R- V u-R'
""
-J.r*'
7
_
/~H
R-qo_p;
lOH
~-H20
?
. R-C.ctJ<H
'"-
,- H
OR.'
Die Acyl-Sauerstoffspaltung wurde bei primären und sekundären Alkoholen mittels
Isotopenmarkierung nachgewiesen, indem der Sauerstoff im Methanol von Roberts
und Urey radioaktiv markiert wurde und im entstehenden
.r
.
Wasser
1I ie-h+
gefunden wurde , d.h. der radioakt ive Sauerstoff stammte aus dem Alkohol :
Es gibt jedoch auch andere Mechanismen der Esterbildung aus Alkohol und Säure,
die jedoch viel weniger vorkommen :
Die wichtigsten Ausnahmen sind: 1. Bei Herstellung von Estern tertiärer Alkohole,
weil diese ziemlich stabile Carben iumionen bilden, läuft die Reaktion nach dem
AAL
1-Mechanismus (säurekatalysierte Alkyl-Sauerstoffspaltung, monomolekular~ z. Bi:
3
Chemie in der Schule: www.chids.de
2. Bei sehr voluminösen Säurerest wird bei sterischer Hinderung des AAc2Mechanismus der AAC1- Mechanismus (särekatalysierte Acyl-Sauerstoffspaltung,
monomolekular) angewandt, z.B.: (ic.c1~d... ~"r
suuys tu/Hdl<./ so« sI 1'·l<.de-1,·
k.
tdiesl!.#(
1fc.U~ k:.Cl~e 1/4/ß:.Iu~ ~~ItJ:
~:c~C
UO'CrO
l« s~lr.,. s~,.J ;eJ&i>ioa<c/~ Ld-
Pt
ff~~H~ ~ ~~~~H~
He.
11e-
hr.
1;1
R-O,
r/:.
0
He~I1G .JI;
l'~ + R-.QH
-
R-O~
0
'<:?
H:Y$fNI'-
~e-
He..
Wegen seiner überragenden Bedeutung wird jedoch nur ein Versuch zum AAC2Mechanismus gezeigt:
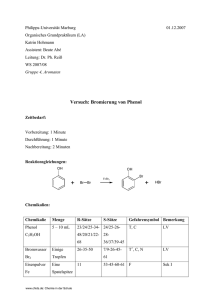
Versuch 1: Herstellung von Essigsäure-n-butylester mit einem
Ionenaustauscher als Katalysator
Reaktionsgleichung:
CH 3-CH2-CH2-CH20H + CH 3COOH
~
CH3-CH2-CH2-CH2-0-CO-CH3 + H 20t
(AAc2-Mechanismus)
Chemikalien : 3 g Ionenaustauscher Lewatit R, n-Butanol (46ml), Essigsäure (28 ml)
4
Chemie in der Schule: www.chids.de
Versuchsaufbau: 250 ml Zweihalskolben mit aufgesetztem Wasserabscheider mit
Rückflußkühler in Heizpilz oder Ölbad, angetrieben von Magnetrührer (siehe Abb .1)
Abb. 1:Versuchsaufbau:
Kühler
Quelle: Bukatsch , F. und W. Glöckner, 1974, S.184.
Versuchsvorschrift: n-Butanol und Essigsäure (rein) in Meßzylinder füllen und
anschließend mit Trichter in den Kolben, in den zuvor ein wenig Lewatit R (trocken)
vorgelegt wurde, gießen . Apparatur mit Hahn schließen und Gemisch ca. 2 min.
kochen, bis der Wasserabscheider vollgelaufen ist. Ein paar Tropfen der Flüssigkeit
aus dem Kolben nach Abkühlen mit der Tropfpipette auf ein Filterpapier geben und
Puplikum nechen lassen.
Von allen Substanzen im Reaktionsgleichgewicht ist Wasser am niedrigsten siedend
und geht folglich schnell in den Wasserabscheider über, neben etwas Essigsäure
und wenig Butanol , das darüber schwimmt. Es entsteht Essigsäure-n-butylester, der
im Kolben wegen des höchsten Siedepunkts (126,9°C) der beteiligten Komponenten
neben Butanol (Kp: 11rC) und Essigsäre (Kp: 118°C) zurückbleibt und am
charakteristischen obstartigen Geruch von Essigsäure und Butanol zu unterscheiden
ist.
Die Reaktion ist eine Gleichgewichtsreaktion, weshalb das Wasser als ein Produkt
aus dem Gleichgewicht entfernt werden muß, um es zu den Produkten hin zu
5
Chemie in der Schule: www.chids.de
verschieben. Die Reaktion wird durch Lewatit R als stark saurem Ionenaustauscher
katalysiert, sonst würde sie autokatalysiert durch Essigsäure trotz Entfernung des
Wassers aus dem Gleichgewicht wahrscheinlich Tage dauern oder gar nicht
stattfinden, denn reine Essigsäure ist praktisch nicht protolysiert.
Struktur von Lewatit R. (stark sauer und trocken):
5~H
Der eigentliche Katalysator wird zu Beginn der Reaktion mit sehr wenig Wasser
gebildet, zu dessen Bildung katalysiert wahrscheinlich wirklich eine
Sulfonsäuregruppe:
nH 20
R-S03H + nH 20
) R-S03 - + H30+
nH 20
Nun kann das Hydronium-Ion im
AAC2
-Mechanismus wie oben dargestellt als
Katalysator wirken.
/'""'
Ionenaustauscher sind als Katalysatoren umweltfreundlich, weil sie ohne
Aufbereitung mehrmals für die gleiche Reaktion verwandt werden können, bis eine
Regenerierung erforderlich ist. Schwefelsäure beispielsweise muß dagegen nach
jedem Reaktionszyklus wiederaufbereitet oder mindestens aufkonzentriert werden.
Verfahren zur Herstellung von Estern aus Alkoholen und Carbonsäuren in der
Technik:
Zur Verschiebung des Gleichgewichts auf die Seite der Produkte gibt es im
wesentlichen 3 Destillations-Verfahren, die sich nach dem Siedepunkt des Esters
richten:
6
Chemie in der Schule: www.chids.de
- Destillation des Esters mit dem Alkohol, wenn der Sdp. des Esters unter dem des
Wassers liegt, z.B. zur Herstellung von Methylacetat.
- bei mit Wasser ähnlichem Sdp. des Esters: Destillation von Ester und Wasser,
meist azeotrop und als Wasserdampfdestillation, (und Alkohol bei einem tenären
Azeotrop), wobei anschließend das Wasser (und der Alkohol in der wässrigen
Phase) leicht abgeschieden werden kann (z.8. bei der Herstellung von secButylacetat)
- Destillation des Wassers, häufig azeotrop mit Alkohol, wenn der Sdp. des Esters
höher als der des Wassers liegt; der Alkohol kann meist anschließend als
organische Phase abgeschieden und in den Prozeß zurückgeführt werden, z.B. bei
Herstellung von n-Dibutylphthalat
J
Dazu werden häufig Schleppmittel für Wasser (Flüssigkeiten die nicht mit dem
Reaktionsgemisch reagieren, aber ein Azeotrop mit Wasser bilden) (z.8. Toluol)
verwandt, um den Sdp. des Wassers zu senken. Nach derKondensation können
sie abeschieden und zurückgeführt werden.
häufige Katalysatoren in Labor und Technik bei der Herstellung von Estern aus
Carbonsäuren und Alkoholen:
-Mineralsäuren, z.8.: Schwefelsäure, Phosphorsäure, p-Toluensulfonsäure
-Ionenaustauscher, z.8.: sulfonierte Polystyrole, Zeolithe
-Lewis-Säuren, z.8.: BF3 + ROH
)
andere wichtige Darstellungsmethoden von Estern:
-Umesterung, z.B. basekatalysiert:
·/ÖJ
I
A
_
r(fi(
1/'01
R-f -Q-R' ~ R-eZ VR,
fOR"
- Tischtschenko-Reaktion, z.B. bei Herstellung von Essigsäure:
Chemie in der Schule: www.chids.de
-
+
R-Qf-
-Acylierung von Anhydriden: z.B. säurekatalysiert:
-Acylierung von Säurehalogeniden, z.B. Versuch 2:
Versuch 2: Herstellung von Phenylbenzoat
Chemikalien: Natronlauge, Phenol, Benzoylchlorid
Versuchsvorschritt: Im Abzug: Etwas Phenol wird im Rql. in Natronlauge gelöst und
die Lösung so lange zu Benzoylchlorid (im Rgl.)
Geruch verschwindet.
gegeben, bis der stechende
Danach wird mittels Wasserbad gelinde erwärmt und
anschließend im Eisbad gekühlt.
Phenylbenzoat fällt weiß
aus, wobei
die
Niederschlagsbildung durch Reibung mit einem Glasstab beschleunigt werden kann.
3,5-Dinitrobenzoylchlorid
wird
in
analogen
Reaktionen
(Schotten-Baumann-
Reaktion) mit verschiedenen empfindlichen Alkoholen zur Identifizierung dieser über
die Schmelzpunktbestimmung der 3,5-Dinitrobenzoesäureester verwandt.
4. Hydrolyse von Estern:
Ester können in Umkehrung ihrer Bildung mit Wasser und Katalysatoren in Alkohol
und Säure, bzw. deren Salze gespalten werden.
Mechanismen: Man unterscheidet grundsätzliche Acyl- und Alkylsauerstoffspaltung.
8
Chemie in der Schule: www.chids.de
Welcher von
beiden Grund-Mechanismen abläuft, kann durch 180-markierte
Verbindungen oder einen Alkoholteil mit assymetrischem Kohlenstoffatom an
Sauerstoff gebunden erkannt werden, wie Abbildung 2 zeigt:
Abb.2:
~O
R-C <,
A~cy-sauerstoffSpaltung
0H
Ö
R-C
~
+
H 2 180
}
18 0
.
+
R' OH
oder
, 'OR'
,
R-C
~
o
+
R'_180H
'OH
-:pO
A~I-Sa.
uerstoffR-C,
+ HO-C,'-" b
Spaltung
'OH
·~C
o
~
R-C,
/3
/a
+
H 20
Retention
oder
O-C ....b
\:
~O
R-C'
i
+ HO-C-h
'OH
cI
Racemisierung
oder Inversion
Quelle: Lowry, T.H./Richardson, K.S., 1980, S. 466.
Die Acylsauerstoffspaltung bei der Esterhydrolyse und -bildung sol1 bei folgendem
Versuch nachgewiesen werden, sie ist viel häufiger als die Alkylsauerstoffspaltung:
Versuch 3: halbquantitativer Nachweis von Lactiden in 5 (+) -Milchsäure
mittels Polarimetrie
Reaktionsgleichung:
H3 C- CHOI-I
I
C.OOJ-l
+
COOH
I
HOI-IC-C~~
Chemikalien: handelsübliche 85 % ige S (+)-Milchsäure~
1
S (+)-Milchsäure wird meist nach älterer Nomenklatur als L (+)-Milchsäure bezeichnet
9
Chemie in der Schule: www.chids.de
Versuchsvorschrift:
Milchsäure
wird
in
Vorführküvette
gefüllt
und
mittels
Vorführpolarimeter mit Hilfe eines Overheadprojektors die optische Drehung
gemessen. Vor dem Versuch
wird die optische Drehung mit verschieden
konzentrierter Milchsäure, die man durch Verdünnen mit H20 erhält, mit einem
Polarimeter gemessen, und daraus der spezifische Drehwinkel nach folgender
Formel berechnetund in ein Diagramm eingetragen, das ebenso mindestens einen
Literaturwert enthält (es wird jedoch erst nach der Versuchsdurchführung gezeigt):
optische Aktivität:
a
a
=[«] x c x d
~
[n]
=
cxd
a = gemessener Drehwinkel
[alT". =spezifischer Drehwinkel
bei bestimmter Wellenlänge und Temperatur
c = Konzentration in g/ml (Lösung)
d
=Schichtdicke in dm
Diagramm mit Kurve aus nach eigenen Messungen ermittelten spezifischen
Drehwerten von 85%iger S (+) -Milchsäure in Wasser und Literaturwert:
"lU-lZO
&~
A
-3"~1
--
I
{,
q
~
Z
0
Literaturwert
I
X
i
zo
30
'IV
50
60
~t>
8'0 !iO
-l
-'-f
.6"
-8
-~J
-1f
. n . . . . .'. '
-1b
10
Chemie in der Schule: www.chids.de
. / ~ ....; ( ""'\ \ I
1\
Ergebnis der Messung im Vortrag:
85%ige S (+)-Milchsäure (unverd.): a = -15 0
;
Pmilchs.
= 1,209 g/ml, d = 1 => [al = -15
0
Dies stimmt mit den Werten von den vorangegangenen Messungen gut überein,
obwohl hier diese bei 546,1 nm gemessen wurden, und hier im gesamten sichtbaren
Bereich. Eigentlich müßten die Werte der Kurve auf einer Geraden parallel zu
Abzisse liegen, also gleiche spezifische Drehwinkel ergeben. Dies ist jedoch wegen
intermolekularen Wechselwirkungen nie der Fall, da sie von der Konzentration
abhängen; die spezifischen Werte gelten nur für ideal verdünnte Lösungen. Alle
errechneten Werte weichen jedoch vom Literaturwert [a]21 546 ,l = +2,6 0 (Wasser; p2
=
8) deutlich ab und sind negativ, obwohl S (+)-Milchsäure verwandt wurde. Dieser
Fehler muß also an den nach obiger Gleichung teilweise entstehenden Lactiden,
den Dieestern der Milchsäure, liegen . Der Literaturwert 'v on (-) -Lactid beträgt: [a]22 D
=-29r (Benzol; c = 1,2). Daraus folgt, daß (-) -Lactid enthalten sein muß.
räumliche Struktur der S (+) -Milchsäure und des (-) -Lactids:
"
~CCf-!
t,O+H
Cl-~
5 (+) -Milchsäure
~S'(-)-46-Dimethyl-1,4-dioxan-2,5-dion
Aus der Struktur ergibt sich eine Retention bei der Lactidbildung und dessen
Hydrolyse als Rückreaktion, die wegen der nur geringen negativen Drehung im
r>.
Vergleich zu (-)-Lactid gleichzeitig stattfinden muß, es sich also
um eine
Gleichgewichtsreaktion mit Schwerpunkt auf Seiten der Edukte handeln muß.
So wird die Acylsauerstoffspaltung bei der Lactidbildung und dessen Zerfall, der
Esterhydrolyse, bewiesen. Würde nämlich bei der Rückreaktion, der Esterhydrolyse,
racemische Milchsäure, wie bei der Alkylsauerstoffspaltung entstehen, würde mit der
Zeit , über mehrmalige Hin- und Rückreaktionen, egal nach welchem Mechanismus,
racemische Milchsäure mit racemischem Lactid entstehen, so daß keine optische
Aktivität mehr meßbar wäre. Das gleiche Ergebnis wäre auch nach Gleichgewichtseinstellung bei Inversion bei der Hydrolyse zu erwarten.
2
p: Prozentgehalt der Lösung in g aktiver Substanz in lOOg Lösung
Chemie in der Schule: www.chids.de
11
Mechanismus der S (-) Lactidbildung und -hydrolyse aus Milchsäure:
häufigste Mechanismen der Esterhydrolyse unter Acylsauerstoffspaltung:
AAC2 Rückreaktion der gleichnamigen Esterbildung (siehe oben u. V. 4)
BAC2 : siehe Versuch 5
Der Additions-Eliminierungsmechanismus wurde von Bender durch den Nachweis
der Zwischenstufe mittels Isotopenmarkierung des Carboxylsauerstoffs bei der
Hydrolyse (auch alkalische) einiger Ester begründet:
R
r--"...
'c=O~8
,
-r
1-1:1. 0
R'-O'
R 4108
'C/
1(·0/
'Of-h.
~
R -18OH
'C/ l.
R-O/
'cf
R ,1be
"
"
~lttgJL,
•
"
,
'c/
R'- 0/ " Bf-I~
R 113/-1
'C/ <.
«-o: 'Oe
~
-
R,
C=o + H1'O
R!.-O/
12
Chemie in der Schule: www.chids.de
andere Mechanismen:
und
AAl1
AAC1
(Bedingungen wie bei der Esterbildung),
E~~e:
<,
~e
/' C'C==O ----) RO- +
RO/
Versuch 4: saure Hydrolyse von Essigester
Reaktionsgleichung:
J)
,
CH3 C.... O-CH2CH3 + H20 ::=,,====~
Molverhältnis der Edukte
~
1:2
Chemikalien: 125ml Essigsäureethylester, Wasser, ca. 150m1 Dioxan, 1ami H 2 S0 4 ,
eine Spatelspitze Azobenzol
versucnseuibeu: 2mal: 250ml Zweihalskolben mit Rückflußkühler, dazu Heizpilz mit
Magnetrührer (siehe Abb. 3), außerdem 2 große Standzylinder:
Abb. 3: Aufbau zur Hydrolyse von Essigsäureethylester:
2.
m«].
--------
Quelle: eigene Darstellung
Versuch s vorschrift: Die abbgebildete Apparatur wird aufgebaut und daneben 2
große Standzylinder gestellt und mit etwas Wasser und je einem Körnchen
Azobenzol
gefüllt.
In
ein
Becherglas
werden
zu
dem
abgemessenen
Essigsäureethylester und SOmt Wasser langsam unter Rühren soviel Dioxan
gegeben, bis eine homogene Phase entsteht, und mit Hilfe eines Trichters auf die 2
Kolben verteilt. Zu einem Kolben gibt man noch 1Dml H2 S0 4
.
Nun läßt man beide
13
Chemie in der Schule: www.chids.de
Mischungen 15 min sieden. Anschließend gießt man sie in jeweils einen
StandzyJinder.
Beobachtung: Im nicht angesäuerten Kolben blieben
~
Phasen erhalten, wobei die
organische stark gelb von Azobenzol gefärbt ist, im angesäuerten sieht man
dagegen nur eine schwach gelbe wässrige Phase.
Die wässrige Phase aus dem Kolben ohne H2S04 enthält neben Wasser
wahrscheinlich
auch Dioxan, die oqanische Phase Essigsäureethylester mit
Azobenzol gefärbt, die Lösung mit H2S0 4 nur eine leicht von Essigsäureethylester
verunreinigte und deshalb leicht von Azobenzol getbgefärbte wässrige Phase aus
Ethanol und Essigsäure (und Wasser) sowie Dioxan.
Strukturformel von Azobenzo/:
Azobenzol löst sich, weil es wenig polar und aprotisch ist, nämlich nur in wenig
polaren Lösungsmitteln.
Die
Verunreinigung
der
sauren
Lösung
liegt
daran,
daß
selbst
nach
Gleichgewichtseinstellung der Esterhydrolyse Ester übrig bleibt, trotz Überschuss an
Wasser im Verhältnis >2:1 wegen der kleinen Gleichgewichtskonstante von K= 1/4.
Offensichtlich findet also die Esterhydrolyse nur unter Zusatz eines Katalysators
statt, hier Schwefelsäure, statt und zwar nach dem Ä-Ac1 -Mechanismus, der wie bei
der Esterbildung normalerweise bei saurer Katalyse vorzufinden ist (primärer oder
sekundärer Alkoholteil des Esters) keine sterische Hinderung der Caboxylgruppe):
+'
;Q
CH C ~
~ H ,
:5 'O-CU-O-J
P
~
~
'~ 3
--
1)
eH -c-f ~
3
'OH
+
HO-CH
-CJ-I
2- 3
1l
J6-H
c~k1 t.y9" c~~Cf!J
(
J..I-OI H
14
Chemie in der Schule: www.chids.de
Die alkalische Verseifung ist auch sehr häufig und im Gegensatz zur sauren
Hydrolyse von Estern irreversibel wie der folgende Versuch zeigt:
Versuch 5: Nachweis der Irreversibilität der alkalischen Verseifung:
ReaktionsgJeichung:
0-
~O
,0-CH
+
CH 3-C
NaOH(aq)
~
/
CH3-C~
3
o (aq)
Na
+
(aq)
+ HOCH 3
.
Chemikalien: 50 ml 2 N NaOH, 7,8 ml Essigsäuremethylester( Molverhältnis 1:1 mit
ganz geringem Überschuß Essigsäuremethylester, weil ein Teil gasförmig in
Apparatur bleibt) , Thymolblau
Versuchsaufbau: Zweihalskolben (100 ml) mit aufgesetzem Rückflußkühler, sowie
·4
Wasserbad und Magnetrührer (siehe Abb.)
Abb.4:
Quelle : eigene Darstellung
Versuchsvorschrift: Die angegebene Menge NaOH wird frisch hergestellt und mit
etwas Thymolblaulsg. versetzt in den Kolben der Apparatur vorgelegt.
Die
abgemessene Menge Essigsäuremethylester wird in den Kolben durch einen
Trichter gegeben und der Kolben verschlossen. Unter Rückflußkühlung wird die
Mischung im Wasserbad bei ca. 60°C gerührt.
Beobachtung: Nach einiger Zeit verändert sich die Indikatorfarbe von blau über grün
nach gelb.
15
Chemie in der Schule: www.chids.de
Umschlag des Indikators Thymolblau bei pH 9,6 - 8:
·OH
+
CH..3
C
l'
I';1
/~'
~
so3
ß
Da der Umschlagsbereich des Indikators bei pH 8 - 9,6 liegt, wird der gelbe
Farbbereich um pH 8 gerade bei vollständiger Umsetzung der Edukte zu Methanol
und Natriumacetat erreicht, da Natriumacetat in der entstehenden Konzentration
durch Hydrolyse in Wasser (aus der Natronlauge) einen pH-Wert> 8 bildet:
NaAc + H20 ~
Na+ + HAc + OH-
Die Reaktion ist also im Gegensatz zur sauren Hydrolyse irreversibel:
Reaktionsmechanismus (B Ac 2.[
eH -c-:!~
~ J'~
IfOI
-(9
~-C't
e~
+/Q-C~
Die Irreversibilität liegt an der Stabilität des entstehenden Carboxylat-Anions durch
Mesomerie, so daß es praktisch nicht mehr von Alkoholen angegriffen werden kann.
Außerdem .abstranfert das primär entstehende Alkoholat-Anion viel schneller das
Proton der entstehenden Säure, als diese erneut anzugreifen.
16
Chemie in der Schule: www.chids.de
crt~
5. sehr CH- acide Ester:
Sehr CH-acide Ester verdanken ihre Eigenschaft meist einer Mesomeriestabilisierung des gebildeten Anions durch elektronenziehende CO- Gruppen in ß-Stellung:
JO}
101
n
"
R/C'CI-t(C~-R'
Hy->,
J-{
Versuch 6: Addition von Brom an Acetessigsäureethylester:
Reaktionsgleichung:
CH 3COCH 2COOCH 2CH 3 + Br2
Chemikalien: 0,5ml Acetessigsäureethylester, 200 ml H20(dest.), Bromwasser,
gesättigte wässr. Natriumdithionit- Lösung für eventuelle Bromverätzungen
Versuchsvorschrift: Die angegebene Menge destilliertes Wasser wird in ein 250ml-
Becherglas gefüllt und mit O,5ml Acetessigester mit einer Tropfpipette versetzt.
Daneben wird eine Blindprobe mit 200 ml Wasser in einem Becherglas gestellt. Mit
einer Spritze wird nun je 10 ml Bromwasser in beide Bechergläser gegeben. Vorher
wird noch ein Becherglas mit Natriumdithionit-Lösung bereitgestellt.
Beobachtung: Das Wasser in beiden Gläsern färbt sich beim Zugeben des (gelben)
Bromwassers gelb. Jedoch nur das ein wenig Acetessiqester enthaltende Wasser
entfärbt sich nach kurzer Zeit wieder.
17
Chemie in der Schule: www.chids.de
.
Die Entfärbung liegt an der Addition von Brom an den Acetessigester. Da solche
Additionen gewöhnlich auf C-C -Doppelbindungen hinweisen, an die Brom elektophil
addiert werden kann, ist auch dies ein Hinweis auf solche im Ester. Tatsächlich liegt
Acetessigester zu ca. 7% in der Enolform in wässriger Lösung vor, die eine C-C Doppelbindung enthält, an die elektrophii angegriffen wird:
Mechanismus der Reaktion:
. 0/1 H JOI
'11
I
Cf~-CIC-C-Q-CtHS"~
(gyl
...J-
,,~
IBvi
............
a- Bromacetessigsäureethylester
Nur
an
das
Methylen-C-Atom wird
elektophil
Brom
addiert,
weil
das
n-
Elektronenpaar der Doppelbindung teilweise auch zum C-Atom der Estergruppe
reicht (siehe oben) und es deshalb eine höhere Elektronendichte aufweist.
Danach efoigt keine nukleophile Addition des entstandenen Bromidions, da sich das
Carbeniurnion schnell durch Abspaltung eines Protons der Hydroxyl-Gruppe und
.""-""'"
Bildung einer Carbonylgruppe stabilisiert.
Es entsteht der farblose a-Brom-
acetessigsäureethylester.
6. Anwendungen der Ester:
0
Ester werden vielseitig angewandt:
11
O-C--CH
- als Arzneimittel (z.8. Acetylsalicylat:
(§X.
O
3)
C-ON«
"
0
o
- als Weichmacher (z.B. Phthalsäurediester:
"
~O C-O... R
~,
)
C-O-R
o"
Chemie in der Schule: www.chids.de
R =- k 0 kielt was5ers fo({e
mif C< 1·0
18
- als Lösungsmittel (z.B. Essigsäureethylester)
- als Tenside ( z.B. Fettalkoholsulfate: CnH2n+1 O(S02)0 CmH2m+1
H2C-0-CO-R
I
Fette (zur Herstellung von Seife): Hy-O-CO-R
H2C-0-CO-R
Hydroxyethylester: ~'O-O-CH[CHl--
f
)
l<.::. F~+I!:tt<.u"ey~st-
(kl'd.4 io...lsd..e 'rl-ksL"de)
- Kunststoffe (z.B. Polyester:
OH
o
-Jf
0
Il../?\\.- 11
Ch l-J2.tt- O- C
\91'
1
C~
Polyvinylacetat (u.a. zur
---fCH2-CH~
Herstellung von Polyvinylalkohol):
0-~0-CH3J n
L
- Aroma- und Duftstoffe (z.B. Essigsäureisobutylester, Essigsäurecedrylester)
C-ON0 2
I
- Sprengstoff (z.B. Nitroglycerin: P-ON0 2
)
C-ON0 2
~
.
?
- Kraftstoffe (z.B. .Bicdiesel" = Rapsmethylester: R-C-0-CH 3 )
o
- Konservierungsstoffe (z.B. PHB-Ester:
J-(o-1Y-c~
~. '0-
.,R
/O-{O}NO.)
'" CJIs°" P~
- Insektizide (z.B. Phosphorsäureeste~ s. D.:
Cl f../yO/
S
PCi. r C<. f fz..; tot?.
.Jt
Chemiebic.c:l'h,\"si;u.",elA-/
in der Schule: www.chids.de
CiHdve
w;~ ~.~. Ad;p;H.~dt<,,( k8~ (;lJ-4.ck f~r fbly~~/e;o
'verlV~-I- wt:-lo-de.~/ ~'e.Ji~I4~6:-<u<rc i.sij.ctdcd... ~ ge~'/~
19
- Zwischenprodukte in der chemischen Industrie (z.B. Ameisensäureethylester zur
Vit. B1 -Synthese)
Versuch 7: Herstellung von Polyvinylalkohol
Reaktionsgleichung:
lCH2-?H~+
O-CO-CH 3
NaOCH3
)
HOCH 3
t
CH2- CH! + CH30-CO-CH3
n
OH
n
Chemikalien: Methanol, Potyvinylacetat, Natrium
Versuchsvorschrift: Zuerst wird in ein Regenzglas mit etwas Methanol ein Stückehen
Natrium gegeben, um Natriummethanolat darzustellen. Danach wird in einem
,r-,
anderen Reagenzglas etwas Methanol auf dem Wasserbad auf über 50°C erwärmt
und darin eine Spatelspitze Polivinylacetat gelöst. Schließlich wird das hergestellte
Methanolat hinzugegeben.
Beobachtung: Nach einigen Sekunden fällt ein weißer Niederschlag aus.
Es entsteht durch Umesterung nach dem BAC 2- Mechanismus aus Polyvinylacetat
Polivinylalkohol, der in Methanol unlöslich ist und deshalb ausfällt:
CH--+
CI-lz -
,
IOr
l~
f
I
I
-~
I;
Iv-C-OCH
....... I --3
L
l
r .
r
CH2 - eH
CHz-CI-!
I
I
011
/01
--
h
+
n CH
~
C~
1)
-C~ 'Y
20
Chemie in der Schule: www.chids.de
'O-CH
--
3
Die Herstellung von Polivinylalkohol erfolgt auch in der Technik über den Umweg
der Umesterung des Polyvinylacetats, da das Monomere wegen Keto-EnolTautomerie instabil ist:
)
Polivinylalkohol wird wegen seiner stärkeähnlichen Eigenschaften in der
Textilindustrie und als Haftvermittler für die lichtempfindliche Schicht der
Farbfernsehröhre eingesetzt. Außerdem dient er als Schutzkolloid.
7. Literatur:
Beilsteins Institut für literatur der organischen Chemie (Hrsg.)(1961): Beilstein.
Handbuch der organischen Chemie. 3. Ergänzungswerk, Bd. 3,Teil1, S. 440ff.
Beilsteins Institut für Literatur der organischen Chemie (Hrsg.)(1988): Beilstein.
Handbook of Organic Chemistry, 5.Ergänzungswerk, Bd. 19, Teil 5, S. 10.
Beyer, H. und W. Walter (1991): Lehrbuch der organischen Chemie. 22. Auf!.
Stuttgart.
Bender, M.L. (1951): Oxygen Exchange as Evidence for the Existance of an
Intermediate in Ester Hydrolysis, In: Journal of American Chemical Society, Jg. 73,
.~.
S. 1626-1629.
Blume, R. und H. Bader(1989): Umweltchemie im Experiment. Frankfurt a.M.
Bukatsch, F. und W. Glöckner (1974): Experimentelle Schulchemie, Bd. 6/1. Köln .
Butenuth, J. (1992): Scriptum zum organisch-chemischen Praktikum. Lehramt.
Marburg
Butenuth, J. (1992): Versuchsanleitungen zum organisch-chemischen Praktikum.
Lehramt. Marburg.
D'Ans, J. und E. lax (1970): Taschenbuch für Chemiker und Physiker. 3. Auf!.
Berlin - Heidelberg.
Falbe, J. und M. Regnitz (Hrsg.) (1989-92): Römpp. Chemie Lexikon. Stuttgart.
Chemie in der Schule: www.chids.de
21
Fachbereich Chemie der Uni Marburg (19??): Sammlung von Vorfürversuchen für
Experimental-Vorlesungen.
Gerhartz, W. et al, (1987): Ullmanns Enzyclopedia of Industriat Chemistry. 5. Aufl.
Bd. Ag. Weinheim.
Gerstner, E. (1989): Scriptum zum Anorganisch-Chemischen Praktikum für
Lehramtskandidaten. Teil 1 und 2,3. Aufl. Marburg.
Lowry, T.H. und K.S.Richardson (1980): Mechanismen und Theorie der
organischen Chemie. Weinheim.
Lüdtke, N. (1993): Synopse unterrichtsrelevanter Hilfsmittel zum Thema Ester, In:
Praxis der Naturwissenschaften - Chemie, Jg. 42, Nr. 3, S.23-30.
Merck (Hrsg.)(1996): Chemikalien-Katalog. Darmstadt.
Otto, E. (1975): Organische Chemie in Kurzversuchen. (= Praxis - Schriftenreihe,
Abteilung Chemie, Bd. 17) Köln.
Roberts, I. und H.C. Urey (1938): A Study of the Esterification of Benzoic Acid with
Methyl Alcohol Using Isotopic Oxygen, In: Journal of American Chemical Society, Jg.
60, S. 2391.
Sykes, P. (1988): Reaktionsmechanismen der organischen Chemie. 9. Aufl.
Weinheim.
Vollhardt, K.P.C. (1988): Organische Chemie. Weinheim.
22
Chemie in der Schule: www.chids.de