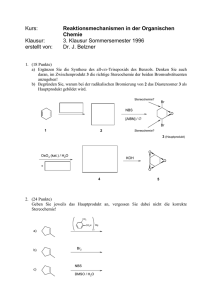
Vorlesung Stereochemie – Prof. G. Hilt – WS 2007/08
Werbung

Vorlesung Stereochemie – Prof. G. Hilt – WS 2007/08 Dienstag und Donnerstag 9:15 – 10:00 Uhr HS C 1. Literaturhinweise 1. Basic Organic Stereochemistry, Eliel, Wilen, Doyle, Wiley, 2001. 2. Grundlagen der Organischen Stereochemie, Testa, VCH, 1983. 3. Asymmetric Catalysis in Organic Synthesis, Noyori, Wiley, 1994. 4. Comprehensive Asymmetric Catalysis I-III, Jacobsen, Pfaltz, Yamamoto, Springer, 1999. 5. Organische Chemie Carey, Sundberg, VCH, 1995 6. Modern Methods in Organic Synthesis, Carruthers, Coldham, Cambridge Press, 2004. 2. Definitionen für Statische und Dynamische Stereochemie 1. Symmetrieoperationen/Symmetrieelemente/Punktgruppen 2. Isomerie(-arten) 3. Nomenklatur (E/Z, cis/trans, syn/anti, R/S , endo/exo etc.) 4. Arten der Chiralität 3. Konformationsanalysen 1. Alkane (VD) 2. syn-Pentan Wechselwirkung 3. Cycloalkane (VD) aber 1C4 und 4C1 4. Allylsysteme (VD) 5. 1,3-Diene 6. Ester, Amide 7. Arylamide/Arylester – Yamagushi-Methode 8. Anomerer Effekt bei Acetalen / Benzyl-Derivaten 9. Thorpe-Ingold-Effekt 4. Geschichtlicher Hintergrund 1. Historische Aspekte - Enzyme / moderne Katalysatoren 2. Katalysatortypen und wichtige Katalysatorparameter 5. Bestimmung der relativen und absoluten Stereochemie 1. Überführung Abbau/Umbau in bekannte Verbindungen 2. NMR-Methoden 3. Shift-Reagenzien 4. Mosher-Ester-Methode 5. Nomale Röntgenbeugung 6. Anomale Röntgenbeugung 7. Kristallisationsmethode nach Meir Lahar 8. Chiroptische Methoden ORD / CD 9. Drehwertbestimmung 6. Trennung von Stereoisomeren 1. Physikalische Trennung 2. Chirale GC/HPLC 3. Racematspaltung über diastereomere Salze 4. Racematspaltung über kovalente Diastereomere, Oxalester 5. Enantiomerenanreicherung an achiraler Phase 6. Kinetische Racematspaltung 7. Dynamische kinetische Racematspaltung 7. Topizität und Prochiralität 8. Stereoselektive Doppelbindungssynthesen 1. Übersicht über Doppelbindungssynthesen: β-Eliminierungen; Wittig-Reaktion; Additionen an Alkine; Pericyclische Reaktionen; Kreuzkupplungen; Grubbs-Metathese etc. 2. Carbopalladierung von Dreifachbindungen 3. CH-aktivierung von Doppelbindungen 9. Kinetik 1. Katalyse vs. Hintergrundreaktion 2. Kinetik stereoselektiver Reaktionen 3. Stereoselektive Synthesen 1. Diastereoselektive Synthese 2. Enantioselektive Synthese 3. Doppelte Stereodifferenzierung 4. Chiralitätstransfer 5. Selbstreproduktion von Chiralität 10. Nukleophile Addition an Carbonyle 1. cyclisch: Zimmermann-Traxler-ÜZ 2. acyclisch: Felkin-Anh / Cram-Modell 3. Cyclisierungen und Baldwin-Regeln 11. Aktivierung von Elektrophilen 1. Carbonyl- und Enon-Aktivierung 2. Lewis-Säuren 3. Struktur der Lewis-Säure-Aggregate 4. Struktur von ÜZ 12. Asymmetrische Diels-Alder-Reaktionen 1. Corey´s erste Aluminium- und Bor-Lewis-Säuren 2. Oxazaborilidin-Katalysatoren 3. Einschub: Kontrollelemente bei Einfachkoordinierung 4. Alkyldichlorboran-Katalysatoren 5. Titan-Taddol-Katalysatoren 6. Evans-Bisoxazolin-Katalysatoren 7. Jacobsen´s asymmetrische Hetero-Diels-Alder-Reaktionen 8. Inverse-Hetero-Diels-Alder-Reaktionen 9. Aza-Diels-Alder-Reaktionen 10. Asymmetrische Alder-En-Reaktionen 11. Photochemische [2+29-Cycloadditionen 12. Exkurs: Palladium-katalysierte Synthese carbocyclischer 5-Ringe 13. Synthese kleiner Ringe 1. Cyclopropanierungen 2. Aziridinierungen 3. Sharpless-Epoxidierungen 4. Jacobsen-Epoxidierung 5. 6. 7. 8. Shi-Epoxidierung Epoxidierung über Schwefel-Ylide Enders-Epoxiderung Asymmetrische Darzens-Glcidestersynthese 14. Asymmetrische Hydrierungen / Reduktionen 1. Hydrierungen mit dem Wilkinson-Katalysator 2. Enantioselektive Hydrierungen von Dehydroaminosäuren 3. Enantioselektive Hydrierungen von α,β-unges. Carbonsäuren 4. Enantioselektive Hydrierungen von unges. Allylalkoholen 5. Enantioselektive Hydrierungen von Ketocarbonylverbindungen 6. Enantioselektive Hydrierungen einfacher Ketone 7. Enantioselektive Transferhydrierungen 8. CBS-Reduktionen von carbonylbverbindungen 9. Reduktionen mit Hefe 10. Hydrierung offenkettiger Imine 11. Hydrierung einfacher Alkene 15. Duale Aktivierung 1. CBS-Reduktion (vgl. 14.8) 2. Corey-Cyanhydrin-Synthese 3. Jacobsen- / Nugent-Epoxidöffnung 4. Corey-Alkinylierung von Aldehyden 5. Dialkylzink-Addition an Aldehyde 6. Diphenylzink-Addition an Ketone 16. Weitere Funktionalisierungen von Doppelbindungen 1. Sharpless-Dihydroxylierung 2. Sharpless-Aminohydroxylierung 3. Diamineriung von Alkenen 4. Dihydroxylierung von Aromaten 5. Asymmetrische Heck-Reaktion 6. Asymmetrische Cuprat-1,4-Addition 7. Asymmetrische Isomerisierung von Doppelbindungen 17. Nicht-lineare Effekte (NLE) 1. (+)-NLE – Dialkylzink-Addition 2. (–)-NLE – Cuprataddition an makrocyclische Enone 3. (+) und (–)-NLE – Sharpless-Oxidation von Sulfiden 18. Asymmetrische Nukleophile Katalyse 1. Fu-kinet. Racematspaltung 2°-Alkohole 2. Fu´s Staudinger Synthese von β-Lactamen 19. Selbstorganisierte zweizähnige Liganden 1. Breit-Hydroformylierung 20. Synthese chiraler Essigsäure 1. Floss-Synthese