3. Klausur Sommersemester 1996 erstellt von: Dr. J. Belzner
Werbung

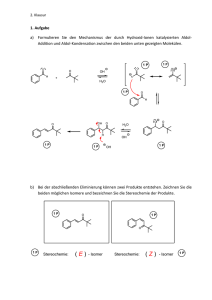
Kurs: Klausur: erstellt von: Reaktionsmechanismen in der Organischen Chemie 3. Klausur Sommersemester 1996 Dr. J. Belzner 1. (18 Punkte) a) Ergänzen Sie die Synthese des all-cis-Trisepoxids des Benzols. Denken Sie auch daran, im Zwischenprodukt 3 die richtige Stereochemie der beiden Bromsubstituenten anzugeben! b) Begründen Sie, warum bei der radikalischen Bromierung von 2 das Diastereomer 3 als Hauptprodukt gebildet wird. Stereochemie? Br NBS O [AlBN] / ∆ Br 1 2 Stereochemie? 3 (Hauptprodukt) O OsO4 (kat.) / H2O KOH O + O 4 5 2. (24 Punkte) Geben Sie jeweils das Hauptprodukt an, vergessen Sie dabei nicht die korrekte Stereochemie! CO2 Mg CO3H 2 a) b) Br2 NBS c) DMSO / H2O 1) 9-BBN d) 2) H2O2 / NaOH DBr e) D2 f) [(Ph3P)3RhCl] 3. (16 Punkte) Achtung: Reaktionsmechanismen oder die Formeln eventueller Zwischenprodukte sind in den folgenden Aufgaben a) und b) nicht gefragt; geben Sie jeweils nur die Reagenzien und die Strukturen der Endprodukte an. a) Wie können Sie Cyclohexen einmal in das cis-Diol, das andere mal in das trans-Diol überführen? cis-Diol trans-Diol b) Wie würden Sie vorgehen, um 1-Penten in das Markownikow- bzw. das antiMarkownikow-Produkt der Wasseraddition an die Doppelbindung zu überführen? n-C3H7 Markownikow n-C3H7 anti-Markownikow 4. (8 Punkte) Das Carboxylat 4 wird in Acetonitril mit einem Äquivalent I2 umgesetzt. Man isoliert eine Verbindung mit der Summenformel C9H13IO2. Welche Struktur hat das Produkt? Schlagen Sie einen Mechanismus vor (ohne Übergangszustände). CH2CO2Na Me I2 CH3CN