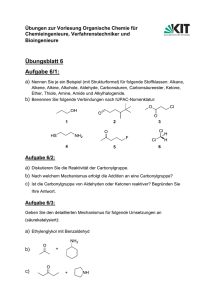
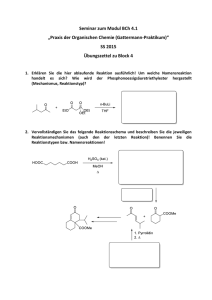
Synthesemethoden in der Organischen Chemie im WS 2008/2009
Werbung

Prof. Dr. Ulf Diederichsen Klausur: Karsten Meyenberg Institut für Organische und Biomolekulare Chemie Do, 09.04.2009, 10.00 Uhr -12.00 Uhr, HS I (MN 27) Wiederholungs-Klausur zur Vorlesung: Synthesemethoden in der Organischen Chemie im WS 2008/2009 Vor- u. Zuname: Matr.-Nr.: Geburtsdatum: Geburtsort: Aufgabe mögl. Punkte 1 11 2 10 3 10 4 15 5 10 6 8 7 10 8 11 9 9 10 6 Σ 100 erreichte Punkte Hinweise: Bitte schreiben Sie nicht mit Bleistift oder Rot. Die Rückseite kann verwendet werden, machen Sie bitte den Bezug zur Aufgabe deutlich. Sofern explizit ein Mechanismus verlangt wird, schreiben Sie bitte alle relevanten Schritte auf. Vergessen Sie die Pfeile nicht. Verdeutlichen Sie, wenn Produkte als racemische Gemische entstehen. Kontrollieren Sie bitte vor Beginn, ob Sie alle Blätter erhalten haben. Viel Erfolg! 1 1. Thiaminpyrophosphat (TPP) ist ein Coenzym des Vitamin B 1 und kommt im menschlichen Körper vor. Das sogenannte Stetter-Reagenz ist ein an das TPP angelehntes Derivat, welches das gleiche Reaktionsverhalten zeigt. Welche Aufgabe hat das Reagenz in der Reaktion? Zeigen Sie den Mechanismus anhand der Umsetzung eines Aldehyds mit einem beliebigen Elektrophil unter basischen Bedingungen. Welchem Synthon entspricht das Addukt aus Stetter-Reagenz und Aldehyd? (11 Punkte) H N S OH Stetter-Reagenz 2 2. Zerlegen Sie retrosynthetisch sinnvoll. Geben Sie anschließend eine Synthese aus kommerziell erhältlichen Bausteinen an. (10 Punkte) a) H N F O b) O HOOC 3 3. Geben Sie an, wie man ausgehend von 2-Methylcyclohexanon selektiv zum thermodynamisch-bevorzugten Enolat bzw. zum Enolat unter kinetischen Reaktionsbedingungen gelangt. (Reaktionsgleichungen). (10 Punkte) 4 4. Vervollständigen Sie den Katalyse-Zyklus der nachfolgenden Sonogashira-Kupplung. Benennen Sie die einzelnen Schritte und machen Sie auch die elektronische Situation am Palladium deutlich. (13 Punkte) a) R-X + b) H R` In der Sonogashira-Kupplung wird normalerweise Kupferhalogenid zugesetzt. Welchem Zweck dient es? Läuft die Reaktion auch ohne Kupfer ab? (2 Punkte) 5 5. Oxidation/ Reduktion: (10 Punkte) a) Zeichnen Sie den Mechanismus cyclohexanon. der Saegusa-Oxidation an 3-Methyl- b) Zeigen Sie den Mechanismus der Luche-Reduktion an 3-Methyl-cyclohexanon-2en. Welche Aufgaben haben die zugesetzten Reagenzien? 6 6. Bilden Sie aus den dargestellten Verbindungen reaktive Diels-Alder-Paare und formulieren Sie die Produkte mit Übergangszuständen, Regio- und Stereochemie! (8 Punkte) OMe MeO2C NO2 O Me3SiO 1 2 Diene A B Dienophile 7 7. a. Welche Produkte erhält man bei folgenden Reaktionen und wie nennt man diesen Reaktionstyp? Beachten Sie die relative Stereochemie. (10 Punkte) EtO2C H3C CH3 + CH2N2 CO2Et N b. CH2Cl2 O MeO2C + CO2Me O2N Benzol Nitriloxid Reaktionstyp: c. Wie stellt man Nitrone her? 8 8. Vervollständigen Sie folgendes Syntheseschema. (11 Punkte) O O + Cl H N H3C O Ph Et3N 1. 1.0 Äq. Bu2BOTf, iPr2NEt 2. 1.0 Äq. Bu2BOTf PhCHO 1. 1.0 Äq. Bu2BOTf, iPr2NEt 2. PhCHO Günstigster Übergangszustand Günstigster Übergangszustand Produkte 9 9. Führen Sie bei einem der Produkte aus Aufgabe 8 eine Abspaltung des Auxiliars zu den folgenden Funktionalitäten durch und geben Sie die Reagenzien an. (9 Punkte) a) Säure b) Alkohol c) Ester 10 10. Bei der folgenden Reaktion entstehen zwei Isomere Produkte. Zeichen Sie die Produkte sowie ein Beispiel für einen Katalysator. (6 Punkte) OMe O O 2 Mol% Grubbs-Kat. MeO 11