Viel Erfolg!
Werbung
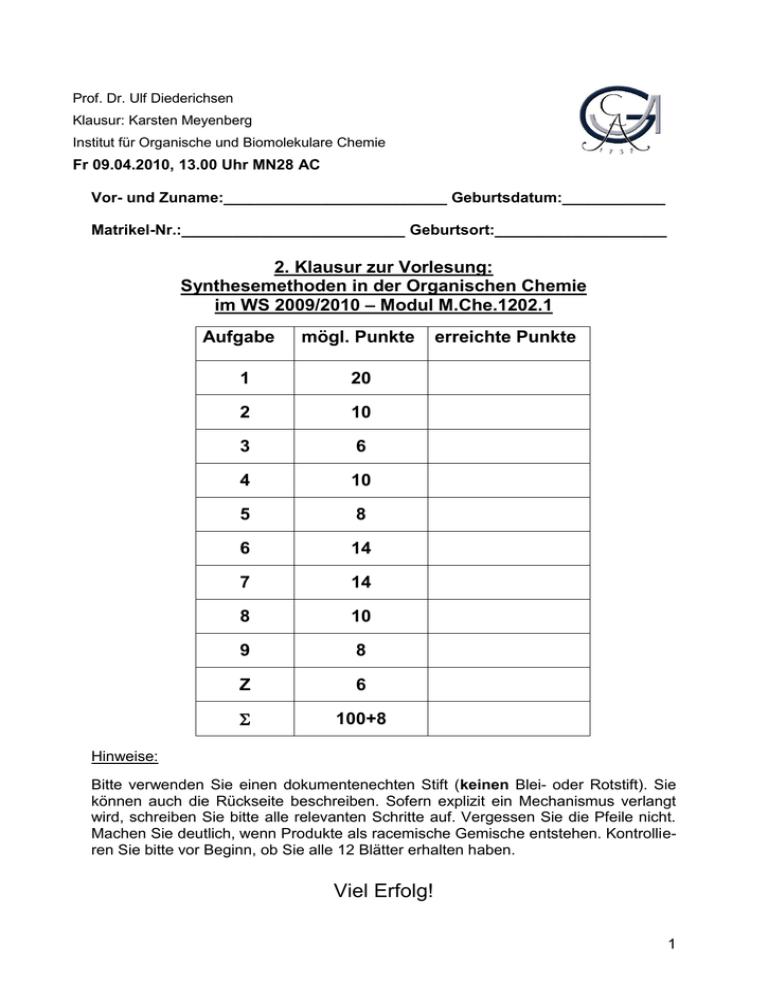
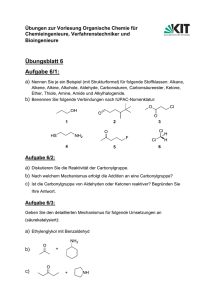
Prof. Dr. Ulf Diederichsen Klausur: Karsten Meyenberg Institut für Organische und Biomolekulare Chemie Fr 09.04.2010, 13.00 Uhr MN28 AC Vor- und Zuname:__________________________ Geburtsdatum:____________ Matrikel-Nr.:__________________________ Geburtsort:____________________ 2. Klausur zur Vorlesung: Synthesemethoden in der Organischen Chemie im WS 2009/2010 – Modul M.Che.1202.1 Aufgabe mögl. Punkte 1 20 2 10 3 6 4 10 5 8 6 14 7 14 8 10 9 8 Z 6 100+8 erreichte Punkte Hinweise: Bitte verwenden Sie einen dokumentenechten Stift (keinen Blei- oder Rotstift). Sie können auch die Rückseite beschreiben. Sofern explizit ein Mechanismus verlangt wird, schreiben Sie bitte alle relevanten Schritte auf. Vergessen Sie die Pfeile nicht. Machen Sie deutlich, wenn Produkte als racemische Gemische entstehen. Kontrollieren Sie bitte vor Beginn, ob Sie alle 12 Blätter erhalten haben. Viel Erfolg! 1 1.) Zerlegen Sie die folgenden Moleküle retrosynthetisch sinnvoll. Schlagen Sie anschließend einen Mechanismus für die Synthese vor. (20 Punkte) 1. a) ausgehend von Aceton 1. b) 2 1. c) ausgehend von Ethanal 1. d) ausgehend von Benzaldehyd 3 2.) Geben Sie einen Mechanismus für die folgende Reaktion an. Entscheiden Sie für das undefinierte Stereozentrum, welches Diastereomer bevorzugt gebildet wird. (Hinweis: Wenn Sie den 6-Ring in der Sessel-Form darstellen, lässt sich die Stereochemie leichter ermitteln.) (10 Punkte) 4 3.) Geben Sie an, wie man ausgehend von 2,4,4-Trimethylcyclohexanon selektiv zum thermodynamisch-bevorzugten Enolat bzw. zum Enolat unter kinetischen Reaktionsbedingungen gelangt. (Reaktionsgleichungen). (6 Punkte) 5 4.) Nachfolgend sind Orbitalkoeffizienten für zwei 1,3-Dipole sowie für zwei unterschiedlich substituierte Alkene gezeigt. Des Weiteren sind die geschätzten HOMO/LUMO-Energien angegeben. (Hinweis: in Klammern-stehende Zahlenangaben der Darstellung sind in eV angegeben.) Bestimmen Sie für jede Substratpaarung das bevorzugt gebildete Regioisomer. Berechnen Sie die Energiedifferenz E für alle möglichen Paarungen und entscheiden Sie, welches absolut gesehen die reaktivste Substratpaarung ist. (10 Punkte) 6 5.) Vervollständigen Sie das nachfolgend gezeigte Reaktionsschema. Beachten Sie die Stereochemie. Muss die Ringöffnung unter diesen Bedingungen kon- oder disrotatorisch erfolgen? (8 Punkte) 7 6.) Iodbenzol und Cyclenhexen sollen in einer Heck-Reaktion umgesetzt werden. Zeigen Sie den Mechanismus anhand eines detaillierten Katalysezyklus (6 Schritte). Wie könnte man bei der Reaktion eine Enantioselektivität erreichen ohne die Substrate zu verändern. (14 Punkte) 8 7.) Stellen Sie das gezeigte Substrat über 3 Stufen her und zeigen Sie einen detaillierten Mechanismus. Zeichnen Sie anschließend das gebildete Bor-Enolat. (8 Punkte) Zeichnen Sie die Zimmerman-Traxler-Übergangszustände für die Reaktion des erhaltene Bor-Derivats mit einem beliebigen Aldehyd RHO (Bitte zeichnen Sie zwei ÜZ, einen re- und einen si-Angriff auf den Aldehyd). Entscheiden Sie, welches der günstige Übergangszustand ist und zeichnen Sie das daraus erhaltene Produkt. (6 Punkte) 9 8.) In einer aktuellen Publikation (Angew. Chem. 2010, 122, 2661) berichten Micouin et.al. über eine Erweiterung einer bekannten Cycloaddition. Durch die Verwendung von Aluminiumsalzen werden die Reaktivität und Selektivität gesteigert. Schlagen Sie einen Mechanismus für die gezeigte Reaktion vor (Zyklus mit mindestens drei Intermediaten). Setzen Sie das Produkt der Reaktion anschließend mit Chlorameisensäurebenzylester um. Um welche Art von Cycloaddition handelt es sich? (10 Punkte) 10 9.) Formulieren Sie den Mechanismus der Oxidation von 2,3-Butandiol mit dem gezeigten Derivat. (8 Punkte) 11 Z.) Schätzen Sie relative Reaktionsgeschwindigkeiten für die nachfolgend gezeigten Diels-Alder-Reaktionen ab und zeichnen Sie die Produkte. Erklären Sie die unterschiedlichen Reaktivitäten. (6 Punkte) a) b) Geben Sie eine Möglichkeit an, mit deren Hilfe die Diels-Alder-Reaktion enantioselektiv abläuft. (2 Punkte) 12