Update zur Tuberkulose im Kindesalter
Werbung

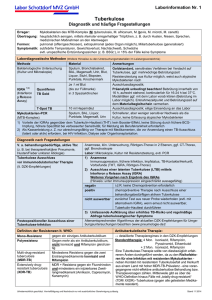
Pulmologie © Schattauer 2012 Update zur Tuberkulose im Kindesalter Alte Krankheit − neue Herausforderungen F. Brinkmann1; S. Thee2, 3; K. Magdorf3 1Klinik für Pädiatrische Pneumologie, Allergologie und Neonatologie, Medizinische Hochschule Hannover; 2Kinderklinik, DRK Kliniken Berlin/Westend; 3Klinik für Pädiatrie m. S. Pädiatrische Pneumologie und Immunologie, Charité − Campus Virchow Klinikum, Berlin Schlüsselwörter Keywords Tuberkulose, Resistenzen Tuberculosis, drug resistance Zusammenfassung Summary Die Tuberkulose ist eine der am längsten bekannten Infektionskrankheiten. Nichtsdestotrotz stellen Diagnostik und adäquate Therapie im Kindesalter immer noch eine Herausforderung dar. Aufgrund der speziellen immunologischen Situation sind Kinder, insbesondere Kleinkinder, in höherem Maße als Erwachsene gefährdet an Tuberkulose zu erkranken. Neue Diagnostikmethoden wie die Interferon Gamma Release Assays sind zwar spezifischer als der Tuberkulin-Hauttest, im Säuglingsalter und bei disseminierter Erkrankung sind jedoch beide Tests nicht immer ausreichend sensitiv. Eine resistogrammgerechte Therapie wird durch seltenen Erregernachweis bei meist paucibacillärer Erkrankung erschwert. Ein zunehmender Anteil resistenter Erreger bereitet zusätzliche Probleme. Aufgrund der im Vergleich zu Erwachsenen variablen Metabolisierung verschiedener Antituberkulotika in verschiedenen Altergruppen sind diese in der Therapie der Tuberkulose im Kindesalter häufig nicht ausreichend effizient. Außerdem können unerwünschte Nebenwirkungen die Therapie komplizieren. Neue Impfstoffe sind in der Erprobung, jedoch momentan noch nicht verfügbar. Childhood tuberculosis has been described for centuries. Nevertheless correct and timely diagnosis as well as adequate treatment remain a challenge. Due to the special immunological conditions in childhood especially young children are at much higher risk of infection with tuberculosis than adults. New diagnostic tests like interferon release assays are more specific but show a lack of sensitivity in infants or miliary disease. Targeted therapeutic intervention is difficult due to often negative cultures in paucibacilliary disease. Increasing numbers of resistant strains cause multiple problems. In addition to this, children metabolize drugs differently and therefore require child specific dosages. Otherwise either sub therapeutic levels or increased side effects can occur. New vaccination strategies are under investigation but have not been approved for clinical use yet. Korrespondenzadresse Dr. med. Folke Brinkmann Klinik für Pädiatrische Pneumologie, Allergologie und Neonatologie Medizinische Hochschule Hannover Carl-Neuberg-Straße 1, 30625 Hannover Tel.: 0511 532–3220, Fax: –9474 E-Mail: [email protected] Update on childhood tuberculosis Old disease − new challenges Kinder- und Jugendmedizin 2012; 12: 87–94 Eingereicht am: 3. Januar 2012; angenommen am: 23. Januar 2012 Einleitung Die Tuberkulose ist eine der weltweit am längsten bekannten Infektionserkrankungen. Schon im Zeitalter der ägyptischen Hochkulturen waren Infektionen durch Mycobacterium tuberculosis (M. tb.) verbreitet und führten zu einer erheblichen Morbidität und Mortalität. In der heutigen Zeit gehört die Tuberkulose weltweit weiterhin zu den häufigsten Infektionserkrankungen. In Deutschland ist sie jedoch aufgrund deutlich verbesserter hygienischer Verhältnisse, besserer Gesundheitsversorgung und besserer Therapiemöglichkeiten in weiten Teilen der Bevölkerung sehr selten geworden – und dadurch weniger präsent. Dies verzögert manchmal vor allem auch bei Kindern eine zeitnahe Diagnostik und Therapie. Epidemiologie Weltweit traten im Jahr 2010 laut WHO ca. 8,8 Millionen Neuerkrankungen auf, von denen 10–15 % Kinder sind (ca. 5 % in Niedriginzidenz-Ländern, ca. 40 % in Hochinzidenz-Ländern) (19, 21). Deutschland wird mit 4444 Erkrankten im Jahr 2009 (Inzidenz 5,4/100 000) zu den Ländern mit niedriger Inzidenz gezählt (씰Abb. 1) (10). Im Jahr 2010 wurde in Deutschland bei 160 Kindern (Inzidenz: 1,3/100 000 Kinder) eine Tuberkulose diagnostiziert. Zumeist sind Kinder unter 5 Jahren betroffen. Kinder mit Migrationshintergrund haben ein ca. siebenfach erhöhtes Risiko an Tuberkulose zu erkranken (10). In den letzten Jahren ist die Zahl der Tuberkuloseinfektionen mit multiresistenten Erregern, d. h. Resistenz gegen Isoniazid Kinder- und Jugendmedizin 2/2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 87 88 F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter Abb. 1 Bericht zur Epidemiologie der Tuberkulose in Deutschland 2009: Inzidenz der Tuberkulose getrennt nach Kindern und Erwachsenen 2001–2009 (10) (Abbildung mit freundlicher Genehmigung des RKI) (INH) und Rifampicin (RMP), weltweit stetig angestiegen (650 000 aller Fälle im Jahr 2010) (10). In Deutschland sind es 2,1 % aller Fälle. Im Jahr 2009 wurde dem RKI auch ein Fall einer bakteriologisch nachgewiesenen MDR-Tuberkulose bei einem Kind gemeldet. Klinisches Krankheitsbild Eine Übertragung der langsam wachsenden Erreger des M. tb. findet hauptsächlich aerogen von Mensch zu Mensch statt. Die Erreger werden zumeist beim Aushusten kleinster Aerosolpartikel auf eine Kontaktperson übertragen. Es kommt dann zunächst zur Aufnahme des Erregers in die Alveolarmakrophagen mit nachfolgender spezifischer T-Zell-Aktivierung. Dieses erste Infektionsstadium verläuft zumeist ohne klinische Symptome und wird als latente Tuberkuloseinfektion (LTBI) bezeichnet, d. h. es handelt sich um eine tuberkulöse Primärinfektion ohne nachweisbaren Organbefund. Bei den meisten Infizierten persistieren die Erreger in den Endosomen der Alveolarmakrophagen. Es entwickelt sich ein nur schwer nachweisbarer kleinster granulomatöser Herd, der eine Balance zwischen Replikation des Erregers und spezifischer T- Zell-Antwort darstellt. Im Laufe der einer Primärinfektion folgenden zwei Jahre ist das Risiko der Pro- gression zu einer aktiven Primärtuberkulose am höchsten. Bei Säuglingen und Kleinkindern liegt es bei 30–40 %, bei älteren Kindern bei ca. 10 % (3). Auch Kinder mit Immundefekten oder unter immunsuppressiver Therapie, z. B. mit TNF-alpha-Antagonisten, haben ein erhöhtes Erkrankungsrisiko (15). Tuberkuloseerkrankungen im Kindesalter sind oft symptomarm oder gehen mit unspezifischen Zeichen einher. Bei persistierendem Husten über einen Zeitraum von mehr als 2 Wochen, Abgeschlagenheit, Gewichtsverlust und vermehrtem nächtlichem Schwitzen sollte vor allem bei Kindern aus Hochrisikoländern oder mit Immundefekten neben anderen Differenzialdiagnosen auch an eine Tuberkulose gedacht werden (8). Die häufigste Manifestationsform ist eine unkomlizierte Primärtuberkulose mit Befall eines lokalen Lymphknotens und einem pulmonalen Parenchymherd (Ghon'scher Herd). Lokale Komplikationen wie durch Lymphknoteneinbruch verursachte Belüftungsstörungen, Pleuritis (in bis zu 40 % der Fälle) oder selten Perikarditis (1–2 % der Fälle) definieren eine komplizierte Primärtuberkulose. Durch lymphogene oder hämatogene Streuung können extrapulmonale Erkrankungsformen bei bis zu 20 % aller Kinder auftreten (10). Am häufigsten ist die periphere Lymphknotentuberkulose. Die Lymphadenopathie zeigt sich klinisch meist als einseitige, langsam progrediente weiche und schmerzlose Schwellung. Interferon Gamma Release Assays (IGRAs) erlauben eine Abgrenzung zur Mehrzahl der hierzulande viel häufigeren Infektionen mit nicht tuberkulösen Mykobakterien (NTM). Ein mikrobiologischer Nachweis von M. tb. aus einem betroffenen Lymphknoten sichert im Zweifels fall die Diagnose. Deutlich seltener ist der Befall abdomineller Organe oder der Haut. Schwere primäre Erkrankungsformen infolge einer hämatogenen Streuung sind die vor allem im Säuglingsalter und bei Immunsupprimierten auftretende Miliartuberkulose und die tuberkulöse Meningitits. Bei diesen schweren Erkrankungsformen ist der Tuberkulintest in bis zu 40 % negativ, auch eine radiologische Diagnostik erbringt bei ca. 50 % der Kinder mit Meningitis keinen pathologischen Befund (14). Tuberkulöse Meningitis Diese tritt in 1–2 % aller unbehandelten Tuberkulosen bei Kindern auf (11). Die Erkrankung beginnt oft schleichend mit Fieber und Kopfschmerzen über 1–2 Wochen. Nachfolgend treten im zweiten Stadium Zeichen einer akuten Meningitis z. T. auch schon mit fokaler Symptomatik und Krampfanfällen auf. Unbehandelt kommt es dann im finalen Stadium zu Bewusst- Kinder- und Jugendmedizin 2/2012 © Schattauer 2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter seinsverlust, progressiven Paresen und Koma. Durch einen Befall der basalen zerebralen Regionen treten bei dieser Form der Meningitis häufig Hirnnervenausfälle auf. Außerdem kann sich infolge einer endokrinen Störung (ADH) eine ausgeprägte Hyponatriämie und nachfolgend ein Hirnödem entwickeln. Eine vemehrte Liquorbildung durch eine Chorioiditis oder auch eine Abflussstörung kann zur Entwicklung eines Hydrozephalus beitragen (11). Miliartuberkulose Eine Miliartuberkulose geht mit einem sepsisartigen generalisierten Organbefall und disseminierter Bildung kleinster Granulome im gesamten Körper einher. Diese sind z. B. im Röntgenbild des Thorax gut zu sehen und können sowohl in den ersten Wochen nach einer Infektion als auch im weiteren Verlauf auftreten. Der Verlauf ist variabel, aber mit einer deutlich erhöhten Letalität von 20–40 % behaftet (4). Bei ca. einem Drittel liegt im Rahmen der disseminierten Erkrankung zusätzlich eine tuberkulöse Meningitits vor. Zumeist durch Reaktivierung einer Tuberkuloseerkrankung kann es zu den im Kindesalter seltenen postprimären Krankheitsbildern wie einer parenchymatösen Lungentuberkulose, Knochen- oder Urogenitaltuberkulose kommen. Eine seltene Variante ist die konnatale Tuberkulose, die über die Plazenta oder den Urogenitaltrakt der Mutter übertragen wird und zumeist mit einem Primärkomplex in der Leber des Neugeborenen einhergeht. Fragen zur Infektionsanamnese (mod. nach [6]) 1. Hat Ihr Kind Kontakt zu Tuberkulose gehabt? 2. Ist jemand aus Ihrer Familie, Ihr Kind eingeschlossen, in einem Land mit hoher Tbc-Häufigkeit geboren oder hat sich (innerhalb der letzten 2 Jahre) für längere Zeit in einem solchen Land aufgehalten? 3. Hat Ihr Kind regelmäßig Kontakt mit Erwachsenen, die ein hohes Tbc-Risiko haben (z. B. Obdachlose, Drogenkonsumenten)? 4. Hat Ihr Kind einen Immundefekt/eine HIV-Infektion? Raum als cut-off für ein relevantes Infektionsrisiko angesehen (3). Bei Kindern reicht sicher eine geringere Zeit für eine Übertragung von einem Erwachsenen aus. Bei Kindern liegt hingegen häufig eine paucibacilläre Erkrankung vor, sodass die Erreger im Direktpräparat nicht nachgewiesen werden können. Außerdem ist im Alter unter 10 Jahren der Hustenstoß zur Übertragung des Erregers oft nicht ausreichend stark. Nur bei ca.15 % der an pulmonaler Tuberkulose erkrankten Kinder unter 10 Jahren wird M. tb. mikroskopisch aus Sputum oder Magensaft nachgewiesen (2, 3, 10, 12). Eine kulturelle Anzüchtung von M. tb aus Sputum oder Magensaft gelang in 30–40 %, bei Jugendlichen mit ka- Tab. 1 Infektiosität und Erkrankungsrisiko Erwachsene Erkrankte stellen das Reservoir für Tuberkuloseinfektionen dar. Bei ca. 60 % der an pulmonaler Tuberkulose erkrankten Erwachsenen liegt eine offene Tuberkulose (d. h. mit mikroskopischem Erregernachweis aus dem Atemwegssekret) vor. Für eine Umgebungsuntersuchung wird für Erwachsene eine Kontaktzeit von 8 Stunden und mehr in einem geschlossenen ● ● ● ● ● ● Diagnostik Gezielte Anamnese Zusätzlich zur Infektionsanamnese zeigt ein standardisierter Fragenkatalog eine sehr gute Sensitivität und Spezifität von über 85 % hinsichtlich einer weiteren Abklärung einer Tuberkulose (씰Kasten: „Fragen zur Infektionsanamnese“) (9). Ein Tuberkulintest sollte erfolgen, wenn eine oder mehrere Fragen positiv beantwortet werden (negativ prädiktiver Wert 99 %) Bei Kindern, die Kontakt zu einer an Tuberkulose erkrankten Person hatten, ist eine gezielte weitere Diagnostik erforderlich. Momentan unterscheidet jedoch keiner der verfügbaren Tests zwischen einer latenten und einer aktiven Tuberkulose. Die Diagnostik sollte zeitnah durchgeführt und bei initial unauffälligem Ergebnis nach drei Monaten wiederholt werden. Tuberkulinhauttest (THT) Der Tuberkulinhauttest wird mit 0,1 ml (entsprechend 2 Tuberkulin-Einheiten) des Präparates RT 23 (Statens Serum Institut, Kopenhagen) streng intrakutan an der volaren Seite des Unterarms durchgeführt und nach 72 Stunden abgelesen. Dabei ist der Durchmesser der Induration, nicht der Diagnostik der Tuberkulose mittels Tuberkulinhauttest (THT) (modifiziert nach [1]) Population ● vernösen Veränderungen jedoch in bis zu 70 % der Fälle (2, 3, 10, 12). Interventions-Cut-Off Auswertung aktueller Kontakt zu Induration >5 mm infektiöser Tbc Immunsupression oder Immundefekt Induration >10 mm häufiger Kontakt zu Risikopopulationen dokumentierte Konversion <2 Jahren Kinder <4 Jahre ohne Kontakt zu Tbc richtig: Induration falsch: Erythem BCG-geimpfte Kinder Induration >15 mm Kinder >4 Jahre ohne Kontakt zu Tbc © Schattauer 2012 Kinder- und Jugendmedizin 2/2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 89 90 F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter und Belüftungsstörungen durch Bronchuskompression dar. Größere Infiltrate und nachfolgende Kavernenbildung v. a. in den Oberlappen spielen erst im Jugendalter eine Rolle. Kulturelle Untersuchung Abb. 2 Rechtsseitige hiläre Lymphadenopathie bei Primärtuberkulose umgebenden Hautrötung ausschlaggebend (씰Tab. 1). Interferon Gamma Release Assays (IGRA) Momentan sind zwei Assays kommerziell verfügbar: Quantiferon Gold in Tube® (Cellestis) und T-Spot®.TB (Oxford Immunotec). Diese Tests messen im Vollblut die Interferon-Gamma-Antwort von T-Lymphozyten nach „over night“-Stimulation durch M. tb.-spezifische Proteine (ESAT 6, CFP-10, TB 7.7), die auf der RD-1-Region des M. tb.-Genoms kodiert sind. Diese Proteine kommen außer im M. tb.-Komplex nur in wenigen der nicht tuberkulösen Mykobakterien vor (M. kansaii, M. marinum, M. flavescens und M. szulgai). Hingegen fehlt M.bovis-BCG diese genetische Region. Daher ist es mit IGRAs möglich, einen nach BCG-Impfung (M. bovis-BCG) positiven Hauttest zu differenzieren. Aus dem gleichen Grunde helfen die IGRAs bei der Diskriminierung einer Infektion mit fast allen nicht tuberkulösen Mykobakterien und einer Infektion mit M. tb. Der Hauttest ist bei dieser Fragestellung aufgrund der möglichen Kreuzreaktivität zu unspezifisch. Ein aktueller Review vergleicht in 32 Studien Sensitivität und Spezifität beider Tests mit der des Tuberkulinhauttests (THT) bei Kindern mit aktiver Tuberkulose. Im Mittel wurde eine Sensitivität von ca. 85 % für den THT und Quantiferon- und 75 % für den T-Spot-Test ermittelt. Die Spezifität der IGRAs liegt bei über 95 %, die des THT je nach Impfstatus und Exposition gegenüber nicht tuberkulösen Mykobakterien (NTMs) bei 14–100 % (7). Die aktuellen Leitlinien des deutschen Zentralkomitees zur Bekämpfung der Tuberkulose empfehlen bei Kindern unter 5 Jahren beide Tests, bei ungeimpften Kindern über 5 Jahre zunächst den THT, bei positivem Ergebnis ist dann der IGRA als Bestätigungstest durchzuführen (3). Sowohl die IGRAs als auch der THT können bei Kinder mit primären oder sekundären Immundefekten, unter immunsuppressiver Therapie, nach schweren oder akuten Virusinfekten und einige Wochen nach Lebendimpfungen falsch negativ ausfallen. Bei klinischem Verdacht sollte ungeachtet der Testergebnisse eine weitere Diagnostik erfolgen. Radiologische Untersuchung Bei positivem THT und/oder IGRA oder bei Kindern unter 5 Jahren sollte immer eine Röntgenaufnahme des Thorax durchgeführt werden. Eine weitere seitliche Aufnahme kann in bestimmten Fällen erforderlich sein. Aufgrund des oft fehlenden kulturellen Nachweises kommt dem Röntgenbild des Thorax in der Diagnostik der Tuberkulose eine große Bedeutung zu (씰Abb. 2). Eine Computertomographie- oder Magnetresonanztomographie-Untersuchung wird momentan nur bei besonderen Fragestellungen empfohlen. Die häufigsten radiologischen Veränderungen stellen hiläre Lymphadenopathien Der kulturelle Nachweis von M.tb. sichert die Diagnose einer manifesten Tuberkulose und ist daher nach wie vor der Goldstandard der Diagnostik (2, 3). Bei Kleinkindern und Säuglingen wird zur Gewinnung des Magensaftes eine morgendliche Entnahme an drei Tagen durchgeführt. Die Proben müssen vor Versand gepuffert werden. Bei größeren Kindern wird an drei aufeinanderfolgenden Tagen morgendlich entnommenes induziertes Sputum nach Inhalation von Salbutamol und nachfolgend hypertoner Kochsalzlösung (5,85 %) gewonnen. Im Ausnahmefall kommt eine bronchoalveoläre Lavage in Betracht. Bei Kindern mit Verdacht auf eine tuberkulöse Meningitis sollte, nach Ausschluss von Hirndruckzeichen, eine Lumbalpunktion durchgeführt werden. Hier zeigt sich typischerweise eine lymphozytäre Pleozytose mit erhöhten Liquoreiweisskonzentrationen und erniedrigten Liquorglukosewerten. M. tb. kann sehr selten im Liquor im Direktpräparat, durch eine spezifische PCR oder in der Kultur nachgewiesen werden. Ein Direktnachweis von M. tb. aus verschiedenen Materialien (Blut, Liquor, Punktat, Biopsien) kann auch mit einer spezifischen PCR erfolgen. Traditionelle Kulturmethoden benötigen ca. 8 Wochen für die Anzucht und weitere 4 Wochen zur Resistenzbestimmung des Erregers. Flüssigkulturmedien (z. B. Bactec, MGIT 960) können die Zeit zumindest auf 14 Tage verkürzen. Noch schneller sind sogenannte Nukleinsäure-Amplifikationsmethoden (NAT) mit Chiptechniken, die innerhalb von Stunden bei vergleichbarer Sensitivität durch Amplifikation spezifischer erregertypischer Sequenzen eine Identifizierung und gleichzeitig Resistenztestung z. B. gegenüber INH und RMP erlauben (u. a. auch z. B. mittels GeneXpert®). Kinder- und Jugendmedizin 2/2012 © Schattauer 2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter Abb. 3 Diagnostik der Tuberkulose (modifiziert nach [3]; rote Pfeile: pathologisches Testergebnis, blaue Pfeile: unauffälliges Testergebnis, *bei pathologischem Röntgenbild aktive Tuberkuloseinfektion möglich; weitere Diagnostik u. ggf. Rücksprache mit einem pädiatrisch infektiologischen Zentrum empfohlen) Prävention Isolierung und Meldepflicht Expositionschemoprophylaxe Impfung Eine Isolierung ist bei Kindern ohne offene Tuberkulose (d. h. ohne mikroskopischen Nachweis von M. tb.) nicht notwendig. Wenn mikroskopisch säurefeste Stäbchen in Sputum oder Magensaft nachgewiesen werden können, sollte eine Isolierung 2–3 Wochen nach Beginn einer resistogrammgerechten Therapie durchgeführt werden. Jugendliche, bei denen sich postprimäre Tuberkuloseformen z. B. mit pulmonaler Kavernenbildung entwickeln können, sind ggf. länger infektiös. In Deutschland sind behandlungsbedürftige Tuberkuloseerkrankungen, der Tod an Tuberkulose oder ein Abbruch der Behandlung nach dem Infektionsschutzgesetz meldepflichtig (3). Bei gesicherter Tuberkulose-Exposition sollten Kinder unter 5 Jahren in jedem Fall eine chemoprophylaktische Therapie mit INH erhalten, auch wenn der initiale THT oder der IGRA negativ ausfallen (3, 6). Bei Kindern zwischen 5 und 15 Jahren kann eine Expositionsprophylaxe je nach Risikoprofil in Erwägung gezogen werden. Nach 3 Monaten sollten der THT/IGRA wiederholt werden, um eine Infektion mit M. tb. auszuschließen. Fallen diese negativ aus, so kann die INH-Gabe beendet werden. Sollten diese jedoch positiv sein (Konversion), ist die INH-Gabe nach Ausschluss einer aktiven Tuberkulose entsprechend der Chemoprävention der LTBI für weitere 6 Monate fortzuführen (insgesamt 9 Monate). Eine wirksame Impfung zum Infektionsschutz vor Tuberkulose gibt es bislang nicht. Seit 1998 ist die BCG-Impfung in Deutschland aufgrund der ungünstigen Nutzen-Risiko-Analyse gänzlich ausgesetzt worden (STIKO) (17). Die postnatale Impfung wird jedoch für Länder mit hoher Tuberkuloseinzidenz von der WHO empfohlen (2, 3). Neue Impfstoffe u. a. mit viralen Vektoren sind weltweit in klinischer Erprobung, jedoch noch nicht zugelassen. © Schattauer 2012 Kinder- und Jugendmedizin 2/2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 91 92 F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter Tab. 2 Therapie verschiedener Manifestationsformen der Tuberkulose bei pansensiblem Erreger (modifiziert nach [2, 5, 23]) Erkrankungsform Therapie- Medikamente Ini- Medikamente Er- Zusätzliche dauer tialphase (Monate) haltungsphase Therapie (Monate) Unkomplizierte Primärtuberkulose 6 Monate Komplizierte Primärtuberkulose 9 Monate 2 INH/RMP/PZA 7 INH/RMP (alternativ (2 INH/RMP/PZA/EMB) 4 INH/RMP 6 Monate) Periphere Lymphknoten- 6 Monate Tbc 2 INH/RMP/PZA 2 INH/RMP/PZA 4 INH/RMP 4 INH/RMP Extrapulmonale Tuberkulose, Knochen- und Gelenkstuberkulose 7 INH/RMP 9 Monate 2 INH/RMP/PZA (alternativ 6 Monate) (2 INH/RMP/PZA/EMB) 4 INH/RMP Miliartuberkulose 9 Monate 2 INH/RMP/PZA/EMB 7 INH/RMP Tuberkulöse Meningitis 9–12 Monate 2–3 INH/RMP/PZA/ EMB (statt EMB auch PTH möglich: bessere Liquorgängigkeit) 7–9 INH/RMP Konnatale Tbc 9–12 Monate 2–3 INH/RMP/PZA/ EMB in seltenen Fällen Prednisolon 2mg/kg KG/d über 2–4 Wochen , bei tuberkulöser Perikarditis obligat über 8–12 Wochen bei Abszessen ggf. chirurgische Drainage Dexamethason 0,6 mg/kg KG/d; Prednisolon 2mg/kg KG/d über mindestens 6 Wochen Hydrozephalus: Therapieversuch mit Furesemid oder Acetoazolamid sinnvoll 7–9 INH/RMP EMB = Ethambutol, INH = Isoniazid, PTH = Prothionamid, PZA = Pyrazinamid, RMP = Rifampicin Therapie Allgemeine Therapieempfehlungen Therapie der latenten TuberkuloseInfektion (LTBI): Chemoprävention Die Therapie der LTBI (Chemoprävention) soll nach Infektion das Voranschreiten zur Erkrankung verhindern. In Industrieländern wird die Gabe von INH über 9 Monate empfohlen (6). Alternativ können auch INH und RMP über 3–4 Monate gegeben werden (16). Folgeuntersuchungen, inklu- sive einer Thoraxröntgenaufnahme, sollten nach 3 Monaten, zum Ende der Chemoprävention sowie 1 und 2 Jahre nach Beendigung der Chemoprävention stattfinden (씰Abb. 3). Chemotherapie der Tuberkulose Die sogenannten „first-line“ Medikamente INH, RMP, Pyrazinamid (PZA) und Ethambutol (EMB) sowie Streptomycin (SM) stehen zur Therapie der medikamentensensiblen Tuberkulose zur Verfügung. Gelingt ein kultureller Nachweis bei Kin- dern nicht und dementsprechend auch keine Resistenztestung, muss gewiss sein, dass der Indexfall an einer Tuberkulose mit pansensiblen Erregern erkrankt ist (bei Medikamentenresistenz verändert und verlängert sich die Therapie). Dauer und Anzahl der Medikamente richten sich nach der Art und Schwere der Erkrankung. Die Therapiedauer verlängert sich auch bei Immundefizienz, z. B. HIV-Koinfektion. Die Therapie besteht bei voll sensiblen Keimen aus einer zweimonatigen Initialphase mit INH, RMP und PZA und bei komplizierten Formen oder bei hoher Bakterienlast zusätzlich mit EMB oder SM (nur parenterale Gabe möglich). In der Fortsetzungsphase wird mit INH und RMP weiterbehandelt. Die Empfehlungen zur Dauer der Anschlussbehandlung unterscheiden sich in den nationalen und internationalen Empfehlungen. In Deutschland lauten die Empfehlungen, die unkomplizierte pulmonale Tuberkulose für weitere 4 Monate zu therapieren (씰Tab. 2). Spezifische Therapie verschiedener klinischer Tuberkulosemanifestationen Komplizierte Primärtuberkulose Bei Atemwegsobstruktion durch vergrößerte mediastinale Lymphknoten verlängert sich die Anschlussbehandlung auf 7 Monate (Therapiedauer insgesamt 9 Monate). Zusätzlich kann initial in seltenen Fällen mit Prednisolon behandelt werden. Die Effektivität ist in Studien jedoch nur unzureichend belegt (4). Bei unzureichendem Therapieerfolg oder schwerer Obstruktion ist eine bronchoskopische Intervention zur mechanischen Entfernung des Granulomgewebes notwendig. Bei der tuberkulösen Perikarditis ist obligat eine systemische Therapie mit Kortikosteroiden über 6–12 Wochen empfohlen (18). Tuberkulöse Meningitis Bei der Meningitis tuberculosa ist ein möglichst frühzeitiger Therapiebeginn entscheidend. Aufgrund der besseren Liquorgängigkeit sollte EMB durch Prothionamid Kinder- und Jugendmedizin 2/2012 © Schattauer 2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter Tab. 3 Dosierung der first-line Antituberkulotika im Kindesalter (WHO-Dosierung z. T. höher) Wirkstoff Dosis Isoniazid (INH) 200 mg/2m KO entspricht ca.: ● 0–5 Jahre ● 6–9 Jahre ● 10–14 Jahre ● 15–18 Jahre Rifampicin (RMP) Pyrazinamid (PZA) Ethambutol (EMB) Streptomycin (SM) ersetzt werden. Liegt ein nicht kommunizierender Hydrozephalus vor, ist notfallmäßig ein ventrikuloperitonealer Shunt einzulegen. Bei kommunizierendem Hydrozephalus kann eine medikamentöse diuretische Therapie den intrakraniellen Druck innerhalb von 2 Wochen normalisieren, ansonsten sollte ebenfalls ein ventrikuloperitonealer Shunt eingelegt werden. Als Immunmodulatoren sollten zusätzlich zur Chemotherapie von Anfang an Steroide gegeben werden, deren Nutzen in der Initialphase der Meningitis tuberculosa belegt ist. Aufgrund der guten Liquorgängigkeit empfiehlt sich die Gabe von Dexamethason, ansonsten auch Prednisolon. Die empfohlene Behandlungsdauer unterschiedlicher Manifestationsformen der Tuberkulose im Kindesalter ist in 씰Tabelle 2 zusammengefasst. Dosierung der Antituberkulotika im Kindesalter Während des Wachstums machen Kinder eine ganze Reihe von Veränderungen durch: Sie nehmen an Größe und Gewicht zu und die Verhältnisse ihrer Körperkompartimente zueinander verändern sich. Außerdem unterliegen die Metabolisierung und die Exkretion Reifungsprozessen. Dies Tab. 4 Medikamentengruppen für die Behandlung der resistenten Tuberkulose (22) max. TD 300 mg 8–10 mg/kg KG 7–8 mg/kg KG 6–7 mg/kg KG 5–6 mg/kg KG 350 mg/m2 KO entspricht ca.: ● 0–5 Jahre ● 6–9 Jahre ● 10–14 Jahre ● 15–18 Jahre max. TD 600 mg 30 mg/kg KG/Tag max. TD 2,0 g (>70 kg) Gruppenname first-line Antituberkulotika 1 15 mg/kg KG 12 mg/kg KG 10 mg/kg KG 10 mg/kg KG 850 mg/m2 KO entspricht ca.: ● 0–5Jahre ● >5 Jahre max. TD 1,75 g 20 mg/kg KG/Tag i. m. oder i. v. max. TD 0,75 g Medikament First-line orale Antituberkulotika Injizierbare Medikamente ● Isoniazid Rifampicin Ethambutol Pyrazinamid ● Streptomycin* ● ● ● second-line Medikamente 2 Injizierbare Medikamente ● ● ● 30 mg/kg KG 25 mg/kg KG führt dazu, dass eine gleiche mg/kg KGDosierung vieler Antituberkulotika bei Kindern zu niedrigeren Serumspiegeln führt als bei Erwachsenen(13, 20). Eine Dosierung anhand der Körperoberfläche ist häufig exakter (씰Tab. 3), wird jedoch aus Praktikabilitätsgründen leider kaum verwendet. Für die first-line Medikamente liegen wenige Daten zur Pharmakokinetik und damit zur Dosisfindung bei Kindern vor, für die second-line Medikamente fehlen diese Studien größtenteils und man lehnt sich entsprechend an die Erwachsenendosen an. Die wichtigsten Nebenwirkungen Im Allgemeinen vertragen Kinder die Antituberkulotika viel besser als Erwachsene und Nebenwirkungen treten deutlich seltener auf. Sowohl INH, RMP als auch PZA können hepatotoxische Nebenwirkungen haben, die am häufigsten in den ersten 2–6 Wochen auftreten. Ein engmaschiges Monitoring der Transaminasen ist notwendig. Bei Anstieg der Transaminasen über das 3-Fache der Norm müssen INH, RMP und PZA bis zur Normalisierung der Leberfunktion abgesetzt werden. Danach ist ein langsames Einschleichen von einem Medikament nach dem anderen möglich. INH 3 Fluorchinolone ● ● ● 4 5 Orale, bakteriostatisch wirkende secondline Medikamente ● Medikamente mit unklarer Effektivität ● ● ● ● ● ● ● ● ● ● ● Kanamycin** Amikacin Capreomycin Moxifloxacin Levofloxacin Ofloxacin Ethionamid** Prothionamid Cycloserine Terizidone Para-Aminosalicylsäure Clofazemin Linezolid Amoxicillin-Clavulansäure Thiacetazon** Imipenem/Cilastatin Isoniazid in hoher Dosis (20 mg/kg KG) Clarithromycin *Bei WHO/ATS/IDSA zählt Streptomycin zu den second-line Medikamenten. ** in Deutschland nicht zugelassen kann des Weiteren eine periphere Neuropathie hervorrufen, vorwiegend bei Erwachsenen, der durch Gabe von Pyridoxin (Vit B6) entgegengewirkt werden kann. RMP verfärbt Körperflüssigkeiten orange, worauf die Patienten und Eltern hingewiesen werden sollten. Bei der Therapie mit PZA treten relativ häufig eine asymptomatische, nicht behandlungsbedürftige Hyperurikämie und gelegentlich Gelenkschmerzen zu Beginn der Behandlung auf. Regelmäßige augenärztliche Untersuchungen, mit besonderem Augenmerk auf das Rot-Gün-Sehen und die Sehschärfe, müssen bei der Anwendung von EMB durchgeführt werden, da EMB in sehr seltenen Fällen (0,05 %) zu einer Optikusneuritis füh- © Schattauer 2012 Kinder- und Jugendmedizin 2/2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 93 94 F. Brinkmann; S. Thee; K. Magdorf: Update zur Tuberkulose im Kindesalter Fazit für die Praxis Tuberkulose im Kindesalter ist eine seltene, jedoch diagnostisch und therapeutisch oft anspruchsvolle Erkrankung. Eine Impfung zum sicheren Schutz vor einer Erkrankung ist momentan nicht verfügbar. Bei Exposition sollte aufgrund des hohen Infektionsrisikos die Diagnostik gerade bei jungen Kindern unverzüglich und umfassend (THT, IGRA und ggf. Röntgen) erfolgen. Eine prophylaktische Therapie (Chemoprophylaxe) sollte auch bei negativer Initialdiagnostik über mindestens 3 Monate mit INH durchgeführt werden. Eine latente Tuberkuloseinfektion (LTBI) liegt vor, wenn THT und IGRA positiv ausfallen, Röntgen und Klinik aber unauffällig sind. In solchen Fällen wird eine Chemoprävention mit INH über 9 Monate empfohlen. Bei aktiver Tuberkulose ist es wichtig, einen Erregernachweis des Kindes und/oder der Indexperson zu erhalten, um eine antibiogrammgerechte Therapie zu ermöglichen. Kinder sind selbst selten infektiös und müssen nur bei positivem mikroskopischem Nachweis des Erregers aus Magensaft oder Sputum isoliert werden. Alterspezifische Dosierungen sind für die effektive Behandlung entscheidend und sollten, soweit evaluiert, unbedingt verwendet werden. Die Behandlung multiresistenter Erreger, extrapulmonaler oder disseminierter Erkrankungen ist komplex und sollte daher an einem Zentrum erfolgen. ren kann. Aufgrund der potenziellen Ototoxizität von SM ist eine audiologische Testung vor, während und nach der Therapie notwendig. Therapie bei resistenten Erregern Für die Therapie und Chemoprävention der resistenten Tuberkulose im Kindesalter gibt es wenig valide Daten. Generell sollte sich die Therapie nach dem Resistogramm des Kindes oder nach dem des Indexfalles richten. Als Faustregel gilt, dass mindestens (3-)4 Medikamente, gegen die die Myko- bakterien sicher sensibel sind, genutzt werden sollen. Drei dieser Medikamente sollten vorher nicht zur Therapie verwendet worden sein. Außerdem wird international empfohlen, dass die Therapie ein injizierbares Antituberkulotikum und ein Fluorochinolon enthalten sollte sowie 2 Medikamente mit bakterizider Aktivität. Meist müssen second-line Medikamente appliziert werden, die eine geringere Effektivität und meist ein deutlich höheres Nebenwirkungsrisiko als die first-line Medikamente haben. Ein Teil dieser Medikamente ist für Kinder in Deutschland nicht zugelassen (씰Tab. 4). Eine tägliche Gabe der Medikamente sowie eine ausführliche Beratung der Eltern/Sorgeberechtigten sind unbedingt notwendig, um eine ausreichende Therapiecompliance zu gewährleisten. Ein regelmäßiges Follow-up zur Therapieevaluation sowie zur Überwachung möglicher Nebenwirkungen ist notwendig. Die Dauer der Therapie hängt u. a. vom Ausmaß der Erkrankung ab, beträgt jedoch mind. 12–18 Monate nach Erhalt der ersten negativen Kultur. Die Therapie einer multiresistenten Tuberkulose sollte auf jeden Fall einem entsprechenden Zentrum überlassen werden. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Literatur 1. American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America: treatment of tuberculosis. Am J Respir Crit Care Med 2003; 167: 603–662. 2. Detjen AK, Magdorf K. Besonderheiten der Kindertuberkulose. Pneumologie 2009; 63: 207–218. 3. Diel R, Loytved G, Nienhaus A et al. New recommendations for contact tracing in tuberculosis. German Central Committee against Tuberculosis. Pneumologie 2011; 65: 359–378. 4. Dooley DP, Carpenter JL, Rademacher S. Adjunctive corticosteroid therapy for tuberculosis: a critical reappraisal of the literature. Clin Infect Dis 1997; 25: 872–888. 5. Graham S. Treatment of paediatric TB: revised WHO guidelines. Paediatric Respiratory Reviews 2011; 12: 22–26. 6. Magdorf K, Detjen AK. Proposed management of childhood tuberculosis in low-incidence countries. Eur J Pediatr 2008; 167: 927–938. 7. Mandalakas AM, Detjen AK, Hesseling AC et al. Interferon-gamma release assays and childhood tu- 18. 19. 20. 21. 22. 23. berculosis: systematic review and meta-analysis. Int J Tuberc Lung Dis 2011; 15: 1018–1032. Marais B, Gie R, Hesseling AC et al. A Refined Symptom-Based Approach to Diagnose Pulmonary Tuberculosis in Children. Pediatrics 2006; 118; e1350. Ozuah PO, Ozuah TP, Stein RE et al. Evaluation of a risk assessment questionnaire used to target tuberculin skin testing in children. JAMA 2001; 285: 451–453. Robert Koch-Institut. Bericht zur Epidemiologie der Tuberkulose in Deutschland 2009. Berlin: Robert Koch-Institut 2011; 19–37. Rock RB, Olin M, Baker CA et al. Central nervous system tuberculosis: pathogenesis and clinical aspects. Clin Microbiol Rev 2008; 21: 243–261. Sandgren A et al. Childhood tuberculosis in the European Union – European Economic Area 2000–2009; http: www.eurosurveillance.org. Schaaf HS, Willemse M, Cilliers K et al. Rifampin pharmacokinetics in children, with and without human immunodeficiency virus infection, hospitalized for the management of severe forms of tuberculosis. BMC Med 2009; 7: 19. Sharma SK, Mohan A, Sharma A et al. Miliary Tuberculosis: New Insights Into an Old Disease. Lancet Infect Dis 2005; 5: 415–430. Solovic I, Sester M, Gomez-Reino JJ et al. The risk of tuberculosis related totumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur Respir J 2010; 36: 1185–1206. Spyridis NP, Spyridis PG, Gelesme A et al. The effectiveness of a 9-month regimen of isoniazidalone versus 3- and 4-month regimens of isoniazid plus rifampin for treatment of latent tuberculosis infection in children: results of an 11-year randomized study. Clin Infect Dis 2007; 45: 715–722. Ständige Impfkommission (STIKO). Impfempfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut; Stand: Juli 2011; 13 Strang J, Nunn AJ. Management of tuberculous constrictive pericarditis and tuberculous pericardial effusion in Transkei: results at 10 years followup. Q J Med 2004; 97: 525–535. Swaminathan S, Rekha B. Pediatric tuberculosis: global overview and challenges. Clin Infect Dis 2010; 50 (Suppl 3): 184–194. Thee S, Detjen AA, Wahn U, Magdorf K. Isoniazid pharmacokinetic studies of the 1960s: considering a higher isoniazid dose in childhood tuberculosis. Scand J Infect Dis 2010; 42: 294–298. World Health Organisation. 2011/2012 Tuberculosis Global Facts; S. 1. www.who.int/tb. World Health Organisation, Geneva, Switzerland. Guidlelines for the programmatic management of drug-resistant tuberculosis – Emergency update 2008 (WHO/HTM/TB/2008.402). World Health Organization. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2006 (WHO/HTM/ TB/2006.371). Kinder- und Jugendmedizin 2/2012 © Schattauer 2012 Downloaded from www.kinder-und-jugendmedizin-online.de on 2017-06-06 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved.