Zur Berechnung der Kräfte zwischen Molekülen
Werbung

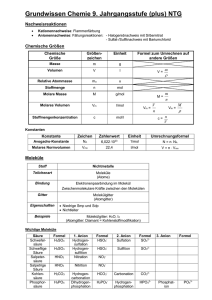
0.5 setgray0 0.5 setgray1 Zur Berechnung der Kräfte zwischen Molekülen Georg Jansen [email protected] Universität Duisburg-Essen Fachbereich Chemie AK Wissenschaftliches Rechnen – p.1 Qualitativ ist alles klar! Wenn wir von den Kräften der chemischen Verwandtschaft absehen, und nur solche Molecüle betrachten, die chemisch indifferent sind, so glaube ich, daß man noch zwei Kräfte unterscheiden muß, daß nämlich bei der Annäherung zweier Molecüle zuerst eine Anziehungskraft wirkt, welche schon in einiger Entfernung anfängt merkbar zu werden, und mit Abnahme der Entfernung wächst; daß dann aber, wenn die Molecüle in unmittelbare Nähe zu einander gelangt sind, eine Kraft eintritt, welche sie wieder auseinander zu treiben sucht. Rudolf Julius Emanuel Clausius, 1858, in den Annalen der Physik AK Wissenschaftliches Rechnen – p.2 Kraft und Wechselwirkungsenergie Energie Kraft Potentialkurve Wechselwirkungsenergie Gleichgewichtsabstand Abstand zwischen Molekuelen AK Wissenschaftliches Rechnen – p.3 Ohne Kräfte zwischen Molekülen keine Flüssigkeiten . . . AK Wissenschaftliches Rechnen – p.4 Ohne Kräfte zwischen Molekülen keine Flüssigkeiten . . . AK Wissenschaftliches Rechnen – p.4 Ohne Kräfte zwischen Molekülen keine Flüssigkeiten . . . AK Wissenschaftliches Rechnen – p.4 . . . keine molekularen Festkörper . . . AK Wissenschaftliches Rechnen – p.5 . . . und auch keine Erbinformation! AK Wissenschaftliches Rechnen – p.6 Kräfte zwischen Molekülen sind schwach! AK Wissenschaftliches Rechnen – p.7 Kräfte zwischen Molekülen sind schwach! Dissoziationsenergien chemischer Bindungen: CO : 1076 kJ/mol = ˆ 11.15 eV 44 kJ/mol = ˆ 0.456 eV Cs2 : AK Wissenschaftliches Rechnen – p.7 Kräfte zwischen Molekülen sind schwach! Dissoziationsenergien chemischer Bindungen: CO : 1076 kJ/mol = ˆ 11.15 eV 44 kJ/mol = ˆ 0.456 eV Cs2 : Wechselwirkungsenergien molekularer Aggregate: 22 kJ/mol = ˆ 228 meV (H2 O)2 : : 0.09 kJ/mol = ˆ 0.93 meV He2 AK Wissenschaftliches Rechnen – p.7 Die Summe macht’s · · · AK Wissenschaftliches Rechnen – p.8 Zustandekommen von Kräften zwischen Molekülen Anziehung Atomkerne - Elektronen ⇔ Quantenmechanik ⇓ "Elektronenwolke" um ein oder mehrere Atomkerne (Molekül) AK Wissenschaftliches Rechnen – p.9 Zustandekommen von Kräften zwischen Molekülen Anziehung Atomkerne - Elektronen ⇔ Quantenmechanik ⇓ "Elektronenwolke" um ein oder mehrere Atomkerne (Molekül) Unvollständige Abschirmung der Kernladung Korrelation von Elektronenbewegungen Austausch von Elektronen zwischen den Molekülen AK Wissenschaftliches Rechnen – p.9 Zustandekommen von Kräften zwischen Molekülen Anziehung Atomkerne - Elektronen ⇔ Quantenmechanik ⇓ "Elektronenwolke" um ein oder mehrere Atomkerne (Molekül) Unvollständige Abschirmung der Kernladung Korrelation von Elektronenbewegungen Austausch von Elektronen zwischen den Molekülen ⇒ "Restwechselwirkungen" mit anderen Molekülen AK Wissenschaftliches Rechnen – p.9 Dispersion: immer anziehend Ursache: Korrelation der Bewegungen von Elektronen in getrennten Molekülen Dispersionskraft stets vorhanden stets anziehend nimmt rasch mit Abstand ab (1/R7 ) AK Wissenschaftliches Rechnen – p.10 Polare und unpolare Moleküle Elektrisches Potential mal Null, mal negativ, mal positiv - je nach Elektronenverteilung Wasser AK Wissenschaftliches Rechnen – p.11 Polare und unpolare Moleküle Elektrisches Potential mal Null, mal negativ, mal positiv - je nach Elektronenverteilung Wasser Ammoniak AK Wissenschaftliches Rechnen – p.11 Polare und unpolare Moleküle Elektrisches Potential mal Null, mal negativ, mal positiv - je nach Elektronenverteilung Wasser Ammoniak Acetylen AK Wissenschaftliches Rechnen – p.11 Polare und unpolare Moleküle Elektrisches Potential mal Null, mal negativ, mal positiv - je nach Elektronenverteilung Wasser Ammoniak Acetylen Methan AK Wissenschaftliches Rechnen – p.11 Coulomb-Kräfte: mal positiv, mal negativ Ursache: Elektrostatische Wechselwirkungen der mittleren molekularen Ladungsverteilungen Coulomb-Kraft wichtig für polare Moleküle mal anziehend, mal abstoßend nimmt langsam mit dem Abstand ab (1/R) AK Wissenschaftliches Rechnen – p.12 Induktion: kann auch wichtig werden Ursache: Polarisierung der mittleren molekularen Ladungsverteilungen Induktionskraft wichtig für polare Moleküle stets anziehend nimmt nicht so rasch mit Abstand ab (1/R4 ) AK Wissenschaftliches Rechnen – p.13 Quantitativ aber noch lange nicht alles klar! Warum kombinieren einige Molekülsorten zu Kokristallen, andere nicht? AK Wissenschaftliches Rechnen – p.14 Quantitativ aber noch lange nicht alles klar! Warum kombinieren einige Molekülsorten zu Kokristallen, andere nicht? Welche Wechselwirkungen sind im Kristall entscheidend? AK Wissenschaftliches Rechnen – p.14 Quantitativ aber noch lange nicht alles klar! Warum kombinieren einige Molekülsorten zu Kokristallen, andere nicht? Welche Wechselwirkungen sind im Kristall entscheidend? Findet man Ausschnitte der Kristallstruktur in kleinen Aggregaten wieder? AK Wissenschaftliches Rechnen – p.14 Quantitativ aber noch lange nicht alles klar! Warum kombinieren einige Molekülsorten zu Kokristallen, andere nicht? Welche Wechselwirkungen sind im Kristall entscheidend? Findet man Ausschnitte der Kristallstruktur in kleinen Aggregaten wieder? Wie groß sind die Wechselwirkungsenergien? AK Wissenschaftliches Rechnen – p.14 Beispiel: Acetylen-Benzol-Wechselwirkungen Modellsystem für CH-π- und π-π-Kontakte Ausschnitt der Potentialfläche R=4.91 Å θ1=60.0° φ1=0.0° θ2=90.0° φ2=0.0° R=4.16 Å θ1=0.0° φ1=0.0° θ2=0.0° φ2=0.0° Z Θ2 Z Θ1 Y Φ2 R X R=4.89 Å θ1=90.0° φ1=0.0° θ2=0.0° φ2=0.0° E int [kJ/mol] 0 -2 Y 0 -2 -4 -4 -6 -6 -8 -8 -10 -10 -12 -12 Φ1 X 150 90 120 q2 90 60 30 30 0 0 60 q1 Berechnungen für 693 symmetrie-verschiedene Geometrien AK Wissenschaftliches Rechnen – p.15 Acetylen-(Hetero-)Aromaten: Rechenbedarf 2GHz Opteron, 2 IDE-Platten im RAID0 (< 8GB benutzt), Speicher < 1.4 GB Ausführungszeiten (CPU-Zeiten 5-10% kleiner) Ac-Fu GTOs Ac-Py Ac-Bz t [h] GTOs t [h] GTOs t [h] aug-cc-pVDZ 215 0.6 247 1.0 256 1.0 aug-cc-pVTZ 460 3.0 529 4.8 552 5.2 aug-cc-pVQZ 836 16.2 962 26.1 1008 28.1 693 symmetrie-verschiedene Geometrien für Ac-Bz 1925 für Ac-Fu, 2175 für Ac-Py AK Wissenschaftliches Rechnen – p.16 Fazit Ideal für Rechnen von zwischenmolekularen Kräften: eine Geometrie pro Knoten ⇒ viele identische Knoten schnelle CPU schneller Platten-IO (RAID0) nicht zu wenig Plattenplatz pro Knoten (250 GB) mind. 4GB Hauptspeicher pro Knoten kaum Datenaustausch zwischen Knoten AK Wissenschaftliches Rechnen – p.17