Funktionelle ionische Fluessigkeiten - Ruhr
Werbung
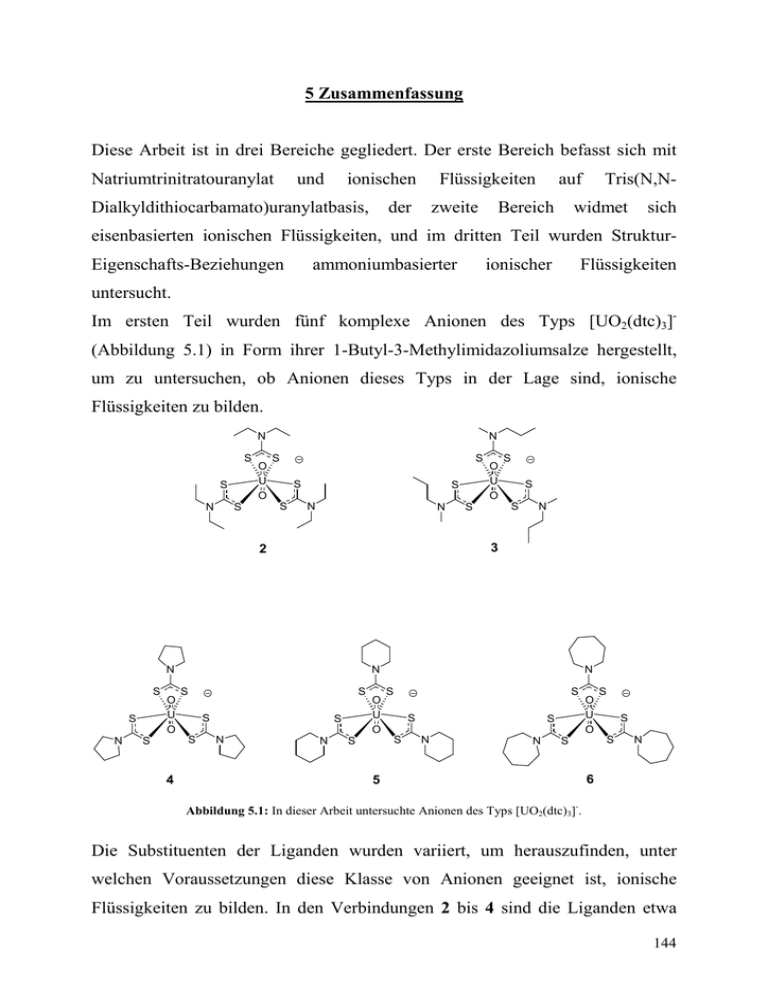
5 Zusammenfassung Diese Arbeit ist in drei Bereiche gegliedert. Der erste Bereich befasst sich mit Natriumtrinitratouranylat und ionischen Dialkyldithiocarbamato)uranylatbasis, Flüssigkeiten der zweite auf Bereich Tris(N,N- widmet sich eisenbasierten ionischen Flüssigkeiten, und im dritten Teil wurden StrukturEigenschafts-Beziehungen ammoniumbasierter ionischer Flüssigkeiten untersucht. Im ersten Teil wurden fünf komplexe Anionen des Typs [UO2(dtc)3](Abbildung 5.1) in Form ihrer 1-Butyl-3-Methylimidazoliumsalze hergestellt, um zu untersuchen, ob Anionen dieses Typs in der Lage sind, ionische Flüssigkeiten zu bilden. N S S N O U O N S S S S S S N N N S N O U O 4 S S S N N S S S S S S 3 2 S O U O S N N O U O N S S S S S S N N O U O S S S 5 S N 6 Abbildung 5.1: In dieser Arbeit untersuchte Anionen des Typs [UO2(dtc)3]-. Die Substituenten der Liganden wurden variiert, um herauszufinden, unter welchen Voraussetzungen diese Klasse von Anionen geeignet ist, ionische Flüssigkeiten zu bilden. In den Verbindungen 2 bis 4 sind die Liganden etwa 144 gleich groß (gleiche Anzahl an C-Atomen in den Substituenten), es wurde jedoch variiert zwischen zyklischem (4) und offenkettigem Liganden (2 und 3), wobei sich die beiden offenkettigen Kiganden in der Symmetrie ihrer Substitutionsmuster unterscheiden. In der Reihe 4 bis 6 schließlich wurde die Ringgröße vergrößert. Einkristallstrukturanalysen gaben einen Einblick in die intermolekularen Wechselwirkungen in den Verbindungen. Thermische Untersuchungen zeigten, dass unter den Anionen dieses Typs auch Vertreter zu finden sind, die zum Bilden ionischer Flüssigkeiten geeignet sind. 1-Butyl-3Methylimidazolium-tris(N-methyl-N-propyldithiocarbamato)uranylat (3) schmilzt bei 121 °C, bildet jedoch eine unterkühlte Schmelze und liegt so sogar bei Raumtemperatur noch als Flüssigkeit vor. Es wurde gezeigt, dass solche Anionen mit offenkettigen Substituenten und asymmetrischer Substitution zur Bildung ionischer Flüssigkeiten geeignet sind. Des Weiteren wurden die Verbindungen spektroskopisch und elektrochemisch untersucht. Hierbei konnten die charakteristischen Absorptionen der Verbindungen bei 415 nm und 468 nm sowie die typischen Schwingungen der Uranylzentren in diesen Verbindungen zwischen 877 cm-1 und 895 cm-1 beobachtet werden. Cyclovoltammetrische Untersuchungen zeigten quasireversible Reduktion zu UVO2+-Verbindungen bei -0,79 V, die pentavalenten Uranylverbindungen wurden durch spektroelektrochemische Messungen identifiziert. Im zweiten Teil wurden eisenbasierte ionische Flüssigkeiten untersucht, die unterschiedliche magnetische Eigenschaften aufweisen. Zum einen wurde mit der Verbindung [emim][FeCl4] eine paramagnetische ionische Flüssigkeit beschrieben, dessen tetaedrisches Anion durch Einkristallstrukturanalysen nachgewiesen und wurde und dessen Vorliegen in Lösung und in der Schmelze schwingungs- und UV/Vis-spektroskopisch untermauert wurde. DSC- Untersuchungen zeigten, dass diese Verbindung zwei feste Phasen ausbildet, deren Übergang bei -12 °C stattfindet, bevor die Verbindung bei 16 °C schmilzt. 145 Die Festkörperstruktur beider Polymorphe konnte durch Röntgenbeugung gelöst werden. Die typische Ramanschwingung des tetraedrischen Anions konnte bei 334 cm-1 beobachtet werden, die Absorptionen dieser Verbindung wurden bei 515 nm, 533 nm, 575 nm, 602 nm, 687 nm und 737 nm beobachtet. Suszeptibilitätsmessungen zeigten das Verhalten einer paramagnetischen Verbindung. Die Curie-Weiss-Konstante wurde zu 9,8 K bestimmt. Die geringe Curie-Weiss-Konstante zeigt das Eintreten magnetischer Ordnung geringer Ausprägung. Wärmekapazitäts- und Entropiemessungen deuten auf einen superparamagnetischen Zustand hin. Die Identifizierung des magnetischen Grundzustandes bleibt weiterhin Gegenstand aktueller Forschung. Bei 3,9 K tritt bei Magnetfeldstärken unterhalb der Sättigung eine Erstarrung der Spins in zufälliger Ausrichtung auf. Zum anderen wurde mit der Verbindung [emim]2[Cl3FeOFeCl3] eine antiferromagnetische ionische Flüssigkeit charakterisiert, wobei der verbrückende Oxoligand die antiferromagnetische Wechselwirkung beider Eisen(III)-Zentren vermittelt. Die Struktur im Festkörper konnte durch Einkristallstrukturanalyse gelöst werden. Die Untersuchung des thermischen Verhaltens erfolgte mit Hilfe der DSC und TG und bestätigte die Klassifizierung der Verbindung als ionische Flüssigkeit mit einem Schmelzpunkt von 34,6 °C und einer Zersetzungstemperatur von 320 °C. IR-Spektroskopie des Feststoffs untermauerte das in der bis(trichloroferrat)(III)-Anion Einkristallstrukturanalyse durch die gefundene antisymmetrische µ-OxoFe-O-Fe- Streckschwingung, die bei 852 cm-1 beobachtet wurde. UV/Vis-Spektroskopie in Acetonitril zeigte die typischen Absorptionen des tetraedrisch umgebenen Fe(III) bei 491 nm, 512 nm, 539 nm und 561 nm. Untersuchungen der magnetischen Eigenschaften dieser ionischen Flüssigkeit rundeten die Charakterisierung ab. Durch Evans-NMR-Experimente konnte gezeigt werden, dass das magnetische Moment bei Raumtemperatur mit 3,32 µB geringfügig 146 höher war. In der Literatur wurden Werte um 1,7 µB berichtet, die realistisch sind für die bisher beobachteten antiferromagnetischen Kopplungskonstanten von ca. -100 cm-1. Die antiferromagnetische Kopplung des Anions in Lösung muß also etwas geringer sein als im Festkörper, bedingt durch die fehlenden Packungseffekte des Festkörpers. Messungen der magnetischen Suszeptibilität durch Oliver Breunig und Martin Valldor der Universität Köln zeigen ein Verhalten, das mit den in der Literatur gefundenen Kopplungskonstanten im Einklang steht. Der temperaturabhängige Verlauf der magnetischen Suszeptibilität von [emim]2[Cl3FeOFeCl3] deutet auf eine Kopplungskonstante von -128 cm-1 bis -138 cm-1 hin, und somit eine antiferromagnetische Kopplung vergleichbarer Stärke wie die bisher in der Literatur veröffentlichten Befunde. Mit Betainchlorid-Tetrachloroferrat wurde eine Verbindung kristallisiert, deren Kristallstruktur maßgeblich vom Pearson-Konzept bestimmt wird. Die Kationen dieser Verbindung tragen neben der Carboxylgruppe, die als harter Wasserstoffbrückendonor gilt, auch aktivierte Methylgruppen in Nachbarschaft zum kationischen Zentrum, dem quartären Stickstoffatom. Diese fungieren als weiche Wasserstoffbrückendonoren. Mit den zwei unterschiedlichen Anionen des Salzes, nämlich Chlorid und Tetrachloroferrat, stehen zwei unterschiedlich harte Wasserstoffbrückenakzeptoren zur Verfügung. So wurde gezeigt, dass die harte Carboxylgruppe bevorzugt eine Wasserstoffbrücke zum harten ChloridAnion ausbildet, während die weichen Methylgruppen ihre Wasserstoffbrücken zum weicheren Akzeptor, nämlich zum Tetrachloroferrat-Anion, ausbilden. Diese Verbindung stellt also ein gutes Beispiel für einen Pearson-Kristall dar. Im dritten Teil wurden die Struktur-Eigenschafts-Beziehungen von ammoniumbasierten ionischen Flüssigkeiten untersucht. Hierzu wurde ein Satz ausgewählter ionischer Flüssigkeiten hergestellt und charakterisiert, in denen systematisch einzelne Strukturelemente sowie Kombinationen hieraus variiert wurden. Der Satz untersuchter Verbindungen enthält hierbei Formiat-basierte 147 und Bis(triflyl)amid-basierte ionische Flüssigkeiten zur Untersuchung des Anioneneinflusses, primäre Alkylammoniumsalze und quartäre Trimethylalkylammoniumsalze zur Untersuchung des Einflusses protischer Ammoniumgruppen, Ammoniumsalze mit unterschiedlich langen Alkylgruppen und solche mit und ohne Hydroxygruppe. Hauptaugenmerk wurde hierbei auf das Phasenübergangsverhalten, speziell auf Schmelz- und Glasübergangspunkte, gelegt. Im Rahmen dieser Arbeit konnte ein Einblick in den Einfluß der unterschiedlichen Faktoren auf das Verhalten der jeweiligen ionischen Flüssigkeit gewonnen werden. So konnte gezeigt werden, dass im Falle der Formiate die primären Verbindungen niedrigere Erstarrungstemperaturen zeigen als die quartären Ammoniumverbindungen. Ein Vergleich der Kristallstrukturen von Propylammoniumformiat und Trimethylpentylammoniumformiat gibt einen Einblick in die Strukturmerkmale, die diesen Unterschied bedingen. So wurden in Propylammoniumformiat starke Wasserstoffbrücken zwischen NH3-Gruppe und Formiat-Anion beobachtet, während in Trimethylpentylammoniumformiat schwächere Wasserstoffbrücken zwischen CH3-Gruppen und Formiat-Anionen vorherrschen. In Propylammoniumformiat stellen die Wasserstoffbrücken jedoch einen intermediären Zustand der Protonierung des Amins durch die Ameisensäure dar, die flüssigen Edukte sind sozusagen im Wasserstoffbrückennetzwerk maskiert und bewirken dadurch einen geringeren Schmelzpunkt als in Trimethlpentylammoniumformiat. Hydroxygruppen führen bei primären Ammoniumformiaten zu einer Absenkung der Erstarrungstemperatur, während in quartären Ammoniumformiaten durch Hydroxyfunktionalisierung eine Erhöhung der Erstarrungstemperatur beobachtet wird. Die Erhöhung des Schmelzpunktes quartärer Ammoniumformiate durch das Einbringen einer Hydroxygruppe kann durch den Vergleich der Kristallstrukturen von Trimethylpentylammoniumformiat und Trimethyl-3Hydroxypropylammoniumformiat erklärt werden. Wie bereits beschrieben, werden in Trimethylpentylammoniumformiat ausschließlich schwache 148 Wasserstoffbrücken beobachtet. Trimethyl-3-Hydroxypropylammoniumformiat zeigt jedoch auch eine starke Wasserstoffbrücke zwischen Hydroxygruppe und Formiat-Anion. Diese starke Wechselwirkung erhöht den Schmelzpunkt. Für die Bis(triflyl)amid-Salze konnte gezeigt werden, dass die quartären Ammoniumverbindungen fast ausnahmslos bei niedrigeren Temperaturen erstarren als die entsprechenden primären Bis(triflyl)amide. Hydroxyfunktionalisierung führt in den protischen Ammoniumsalzen fast ausnahmslos zur Erhöhung der Erstarrungstemperatur, während in den quartären Ammoniumsalzen durch OH-Funktionalisierung eine Verringerung der Erstarrungstemperatur beobachtet wurde. Eine Verlängerung der Alkylkette führt fast ausnahmslos zu einer Senkung des Schmelzpunktes. Die Ausnahme bilden hierbei die primären, hydroxyfunktionalisierten Ammoniumformiate, die keinen Trend, der auf die Kettenlänge zurückführbar ist, erkenne lassen. Die quartären Verbindungen zeigen eine niedrigere Erstarrungstemperatur für Bis(triflyl)amidsalze als für Formiatsalze. Der Vergleich zwischen Trimethyl-3Hydroxypropylammoniumformiat und Trimethyl-2-Hydroxyethylammoniumbis(triflyl)amid (Cholin- bis(triflyl)amid) zeigt, dass die Wasserstoffbrücke in Cholin- bis(triflyl)amid, auch wenn sie geringfügig länger, d.h. schwächer ist als im zum Vergleich herangezogenen Formiatsalz, von ähnlicher Stärke ist. Der herausragende Unterschied besteht in Größe und Symmetrie des Anions. Formiat-Anionen sind von geringer Größe und hoher Symmetrie. Ihre planare Gestalt ermöglicht sehr gut das Ausbilden von geordneten Kristallpackungen. Das Bis(triflyl)amid-Anion hingegen erschwert durch seine Größe sowie durch die Möglichkeit zur Bildung mehrerer Konformere die Kristallpackung. Salze mit diesem Anion weisen dementsprechend einen geringen Schmelzpunkt auf. Für die protischen Verbindungen konnte gezeigt werden, dass hydroxyfunktionalisierte Formiate durch H-Brückenfrustration bei niedrigeren Temperaturen erstarren als die entsprechenden Bis(triflyl)amide. Für die 149 primären, unfunktionalisierten ionischen Flüssigkeiten konnte kein eindeutiger Trend in Bezug auf die Anionen gefunden werden. Für die Struktur-Eigenschaftsbeziehungen in ammoniumbasierten ionischen Flüssigkeiten konnte somit ein wertvoller Einblick gewonnen werden. 150











