E7 – Elektrolyse - Physikprotokolle
Werbung
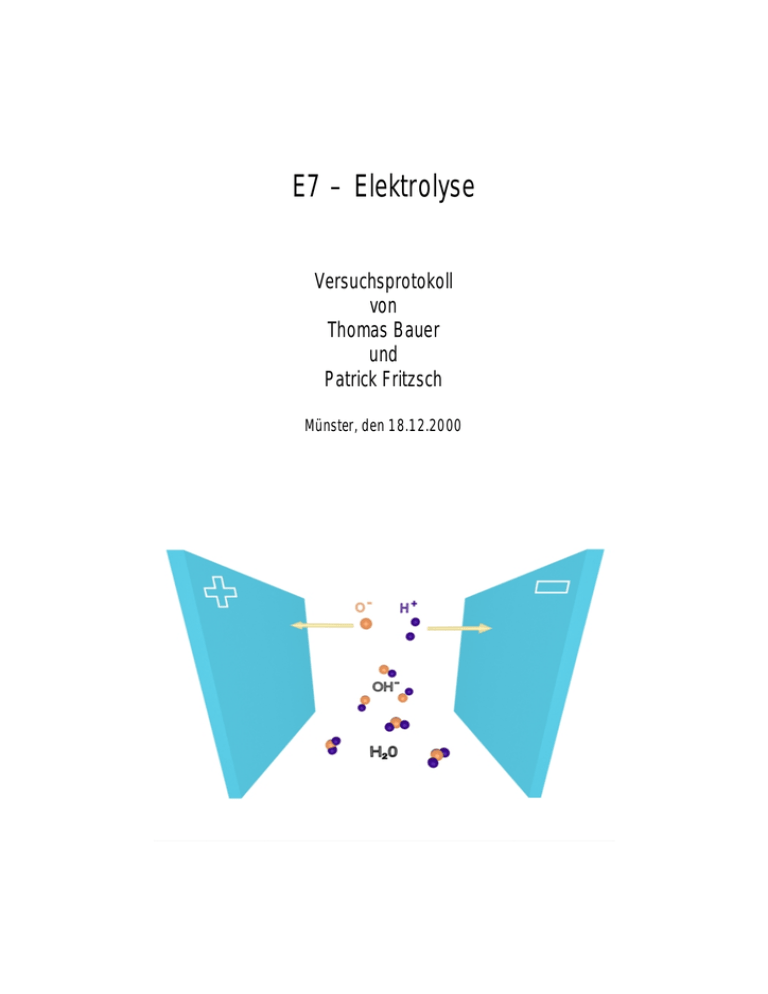
E7 – Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der Elektrolyse 2.3 Elektrolytische Leitfähigkeit 2.4 Äquivalentleitfähigkeit 3. Beschreibung der Apparatur 3.1 Zubehör 3.2 Meßaufbau 3.3 Beschreibung des Versuches 4. Meßdurchführung 4.1 Meßreihe des Wasserzersetzungsapparates 4.2 Messung der Strom-Spannungs-Kennlinien 5. Meßauswertung 5.1 Bestimmung der Faraday-Konstante F 5.2 Bestimmung der Äquivalent- und der spezifischen Leitfähigkeiten 6. Diskussion 7. Anlagen Diagramme I bis VIII Original Meßprotokoll 1. Einleitung Den Vorgang der Ionenwanderung in einer Flüssigkeit, hervorgerufen durch ein elektrisches Feld, und die damit verbundenen stofflichen Veränderungen bezeichnet man als Elektrolyse. Im Elektrolyten findet eine Stromleitung statt, dessen Leitfähigkeit stark von seiner Konzentration und seinem Dissoziationsgrad abhängt. Durch die Ionenwanderung setzen sich an den Elektroden Zersetzungsprodukte ab. Dabei ist die geflossene Ladung der Zersetzungsprodukte proportional zu deren Masse. 2. Theoretische Grundlagen 2.1 Elektrolyse Der Strom in einem Elektrolyten entspricht der Wanderung von Ionen zwischen den Elektroden. Er tritt auf, wenn an den Elektroden eine elektrische Spannung und somit ein elektr. Feld anliegt. Man bezeichnet hierbei die pos. Elektrode als Anode (zu ihr wandern die Kationen), die neg. als Kathode (zu ihr wandern die Anionen). Unter Dissoziation versteht man das Trennung von Molekülen (in Kationen und Anionen) als Reaktion mit einem Lösungsmittel (z.B. Wasser). Man kann zum Beispiel Natronlauge NaOH in Wasser H2O lösen. In der Lösung liegen also folgende Ionen vor: Na+ und OH- sowie H+ , OH- und H2O . Somit scheidet sich an der Kathiode Wasserstoff ab: 4 H2O + 4 e- ⇒ 4 OH- + 2 H2 ⇒ 2 H2O + und an der Anode entsteht Sauerstoff: 4 OH- + 4 e- O2 Somit bleibt die Natronlauge in Lösung und nur das Wasser wird zersetzt. 2.2 Die FARADAYschen Gesetze der Elektrolyse Erstes Faradaysches Gesetz Die an der Elektrode abgeschiedenen Masse m eines Stoffes ist der durch den Elektrolyten fließenden Ladung Q proportional: m~Q ⇔ m~It oder: m = A⋅Q = A⋅ I ⋅t , mit den „elektrochemischen Äquivalent A“. Zweites Faradaysche Gesetz Unabhängig von der chemischen Natur eines aus einem Elektrolyten abgeschiedenen Z -wertigen Stoffes wird bei Ausscheidung der Stoffmenge n an Q = n⋅ Z ⋅ F = einer Elektrode die Ladung m Z ⋅F M abgegeben oder aufgenommen, mit der FARADAY-Konstante F=96485 C/mol. Z ist die Wertigkeit eines Ions, also wie viel Elementarladung e=1,6022 10-16 C er trägt. Die Faraday-Konstante gibt somit an, wie viel Elementarladung minimal (Z=1) pro Mol Teilchen F = NA ⋅e vorkommt, nämlich , mit AVOGADRO-Konstante NA. Eine experimentelle Bestimmung der Faraday-Konstante ergibt sich nun aus dem zweiten Faradayschen Gesetz mit Q = I ⋅ t zu: F= M ⋅ I ⋅t m⋅Z und mit m = ρ ⋅ V , F= M ⋅ I ⋅t ρ ⋅V ⋅ Z In einem HOFMANNschen Wasserzersetzungsapparat (s.u.) kann man das Volumen der abgeschiedenen Gase ( H2 und O2 ) in Abhängigkeit der Zeit ermitteln, um dann über die folgende Formel die Faraday-Konstante zu bestimmen: F= M I ρ ⋅ Z ( ∆V ∆t ) 2.3 Elektrolytische Leitfähigkeit Das homogene elektrische Feld in einem hinreichend großen Kondensator ist E = U l . Als Elektroden sollen die Kondensatorplatten dienen. Ein Z –wertiges Ion erfährt in diesem Feld die Kraft F = Q ⋅ E = Z ⋅ e ⋅ U l . Da in einer Flüssigkeit geschwindigkeitsproportionale Reibungskräfte auftreten, findet im Mittel eine gleichförmige Bewegung der Ionen statt, wodurch ein konstanter Stromfluss entsteht. Man definiert nun die elektrolytische Leitfähigkeit σ als Quotient von Stromdichte j und dem angelegten Feld E zu σ= j E Ist A die Querschnittsfläche der Elektrolysezelle (hier Fläche der Plattenkondesatoren) und l ihre Länge, so gilt für den ohmschen Widerstand der Zelle: R= 1 l σ A 2.4 Äquivalentleitfähigkeit Als Konzentration c eines Stoffes versteht man dessen Stoffmenge n pro Volumen V: c= n V ⇔ c= m 1 MV Die sogenannte Äquivalentleitfähigkeit Λ ist definiert als Quotient der elektrolytischen Leitfähigkeit σ und der Äquivalentkonzentration c ä = c ⋅ Z , dem Produkt von Konzentration und Wertigkeit eines Stoffes, also: Λ= σ . c⋅Z Die Äquivalentleitfähigkeit Λ stellt eine Leitfähigkeit pro Ionenpaar dar und ist ein Maß für die Leitfähigkeit unabhängig von der Anzahl der Ladungsträger. Man ermittelt die Äquivalentleitfähigkeit am besten durch Messung des Widerstandes R einer Elektrolytzelle und durch Verwendung der folgenden Formel: Λ= mit R = U I . 1 1 l , c⋅Z R A 3. Versuchsaufbau 3.1 Zubehör - 1 Hoffmanscher Wasserzersetzungsapparat - 1 Elektrolysegefäß mit Kupferelektronen - 1 Voltmeter 30 V= - 2 Vielfachinstrumente - 1 Amperemeter 1 A~ - 2 Schiebwiderstände 55 Ω - 2 Schalter - 1 Schieblehre - 1 Stoppuhr - Natronlauge - Kupfersulfatlösungen verschiedener Konzentrationen 3.2 Meßaufbau Abbildung 1: Wasserzersetzungsapparat und seine Schaltung Abbildung 2: Leitfähigkeitszelle und ihre Schaltung 3.3 Beschreibung des Versuches 3.3.1 Man füllt den Hofmannschen Wasserzersetungsapparat auf beiden Seiten mit Natronlauge bis zur Markierung. Danach wird die Schaltung entsprechend Abbildung 1 aufgebaut. Sobald der Strom eingeschaltet ist, mißt man das Volumen des entstehenden Gases auf der rechten und linken Seite zu jeder vollen Minute. Es ist zu beachten, daß das mit Natronlauge gefüllte Gefäß vor dem Ablesen immer auf etwa die Höhe des Natronlaugenspiegels der beiden Röhren des Hofmannschen Wasserzersetzungapparates gebracht wird, um bei Atmosphärendruck zu messen. Um die Meßergebnisse auf Normalbedingungen umrechnen zu können, mißt man noch die Temperatur und den Luftdruck. Ziel dieser Messungen ist es, die Faraday-Konstante zu bestimmen. 3.3.2 Die Schaltung wird entsprechend Abbildung 2 aufgebaut. Man vermißt den Abstand der Kupferelektronen und ihre Maße mit einer Schieblehre. Die Leitfähigkeitszelle wird nacheinander mit fünf verschiedenen Kupfersulfatlösungen verschiedener Konzentrationen gefüllt. Für jede Kupfersulfatlösung bestimmt man die StromSpannungs-Kennlinie indem man eine Meßreihe über den Strom und die Spannung anlegt. Ziel dieser Messung ist die Bestimmung der Äquivalenzleitfähigkeit für alle fünf Kupfersulfatlösungen. 4. Meßdurchführung 4.1 Meßreihe des Wasserzersetzungsapparates Nach Versuchsbeginn wird jede Minute das Gasvolumen des Wasserstoffes und des Sauerstoffes notiert: Zeit (s) Volumen H2 (ml) Volumen O2 (ml) 60 1,2 0,1 120 2,2 0,3 180 3,2 0,5 240 4,0 1,2 300 5,0 1,9 360 6,0 2,1 420 6,3 2,4 480 7,1 2,9 540 8,2 3,4 600 9,0 3,8 660 9,8 4,0 720 10,6 4,4 780 11,4 4,8 840 12,2 5,2 900 13,2 5,6 960 14,0 6,0 1020 14,8 6,4 1080 15,8 6,8 1140 16,6 7,4 1200 17,6 7,8 Tabelle 1: Volumenentwicklung beim Wasserzersetzungsapparat Dabei schätzt man für die Zeit einen absoluten Fehler von 5 Sekunden und für das Volumen von H2 und O2 einen absoluten Fehler von 0,2ml. Der Strom beträgt die ganze Messung hindurch I=0,1A. Auf dem Meßgerät ist ein relativer Fehler von 2,5% notiert. Die Temperatur beträgt: T=20,5OC. Für den Luftdruck mißt man: p=1009,7 hPa 4.2 Messung der Strom-Spannungs-Kennlinie Jede Kupferelektrode hat eine Fläche von A= 64,6mm x 81,3mm = 5251,98mm2. Der Abstand beider Elektroden ist l= 47,75mm. Für alle drei Messungen wird, bedingt durch die Schieblehre, ein absoluter Fehler von 0,05mm geschätzt. Für die fünf Meßreihen des Stromes und der Spannung erhält man folgende Daten: c= 3g/l I (A) 0,04 0,08 0,12 0,16 0,20 0,24 0,28 0,32 0,37 0,40 0,44 0,49 0,52 c= 6g/l U (V) 1,5 3,2 5,1 6,8 8,6 10,2 12,1 13,9 15,7 17,2 18,7 20,5 21,9 I (A) 0,06 0,13 0,20 0,26 0,33 0,39 0,47 0,53 0,61 0,69 0,77 c= 40g/l I (A) 1,97 1,66 1,43 1,21 1,08 0,86 0,63 0,48 0,37 0,27 0,16 0,06 U (V) 14,0 11,9 10,3 8,9 7,8 6,4 4,6 3,5 2,6 1,9 1,0 0,2 c=15g/l U (V) 1,6 3,6 5,6 7,6 9,6 11,5 13,5 15,5 17,4 19,2 21,3 I (A) 0,13 0,25 0,38 0,49 0,57 0,66 0,79 0,93 1,14 1,31 1,46 c= 150g/l I (A) U (V) 1,93 6,1 1,72 5,5 1,52 4,9 1,31 4,3 1,11 3,7 0,98 3,3 0,82 2,8 0,64 2,1 0,41 1,3 0,20 0,5 0,05 0,1 Tabelle 2: Strom- und Spannungsverlauf einer Elektrolysezelle für verschiedene Konzentrationen von Kupfersulfatlösungen U (V) 2,2 4,3 6,1 7,7 8,7 10,0 11,4 13,6 16,3 18,4 20,0 5. Meßauswertung Alle Fehler werden nach dem Größtfehler-Prnzip berechnet. 5.1 Bestimmung der Farraday-Konstante F Zur Bestimmung der Faraday-Konstante wird die in den theoretischen Grundlagen hergeleitete Formel F = M I benutzt. M ist die molare Masse des Stoffes, ρ ρ ⋅ Z ( ∆V ∆t ) dessen Dichte und Z die Wertigkeit der Ionen. I ist der konstant gehaltene Stromfluß und der Term (∆V ∆t ) die konstante Volumenänderung, abzulesen als Steigung eines V-tDiagramms. Für Wasserstoff ist die Molare Masse : M = 1 g/mol , die Wertigkeit : Z=1 , die Dichte : ρ = 0,084 g/l und für Sauerstoff ist die Molare Masse : (Normalbed.) , M = 16 g/mol , die Wertigkeit : Z =2 und die Dichte : ρ = 1,33 g/l (Normalbed.) Da die Dichte ρ für Normalbedingungen ( p0=1013hPa, T0=273,15K ) gelten, muß man die bei p=1009,7hPa und T=20,5°C gemessenen Volumina V wie folgt zu V0 umrechnen: V0 = pT0 ⋅ V ≈ 0.921 ⋅ V p 0T Man trägt nun V0 gegen t auf und ermittelt die Steigung (siehe Anhang, Diagramm I und II). Der absolute Größtfehler wird dabei graphisch aus dem Diagramm bestimmt. Man erhält somit aus Diagramm I für Wasserstoff : ∆V = 1,35 (1 ± 0,31) x 10-2 ml / s ∆t und aus Diagramm II für den Sauerstoff : ∆V = 5,77 (1 ± 2,44) x 10-3 ml / s ∆t Setzt man nun alle vorhandenen Werte in die Formel für die Faraday-Konstante F ein, so ergibt sich die Konstante für Wasserstoff zu F= 82682 (1 ± 21053) C/mol und für Sauerstoff zu F= 97153 (1 ± 43512) C/mol . 5.2 Bestimmung der Äquivalent- und der spezifischen Leitfähigkeiten Zuerst soll der ohmsche Widerstand einer Leitfähigkeitszelle bei verschiedenen Konzentrationen (3 g/l, 6 g/l, 15 g/l, 40 g/l, 150 g/l) einer Kupfersulfatlösung bestimmt werden. Dazu wurde die Spannung U und der Strom I an der Zelle gemessen. In einem U-IDiagramm liest man dann den Widerstand als Steigung der Geraden ab. Über die Formel σ = 1 l ist dann die spezifische Leitfähigkeit σ zu bestimmen. Aus σ lässt sich dann R A wiederum die Äquivalentleitfähigkeit Λ über Λ = σ bestimmen. Dies ergibt folgende c⋅Z Werte: a) Konzentration c= 3g/l (Diagramm III) Widerstand : R = 42,49 (1 ± 5%) Ω sp. Leitfähigkeit : σ = 0,21 (1 ± 5,24%) Ω -1m-1 Äquivalentleitfähigkeit: Λ = 88,99 (1 ± 5,24%) cm2 Ω -1mol-1 b) Konzentration c= 6g/l (Diagramm IV) Widerstand : R = 28,00 (1 ± 5%) Ω sp. Leitfähigkeit : σ = 0,325 (1 ± 5,24%) Ω -1m-1 Äquivalentleitfähigkeit: Λ = 67,52 (1 ± 5,24%) cm2 Ω -1mol-1 c) Konzentration c= 15g/l (Diagramm V) Widerstand : R = 13,54 (1 ± 5%) Ω sp. Leitfähigkeit : σ = 0,672 (1 ± 5,24%) Ω -1m-1 Äquivalentleitfähigkeit: Λ = 55,87 (1 ± 5,24%) cm2 Ω -1mol-1 d) Konzentration c= 40g/l (Diagramm VI) Widerstand : R = 7,23 (1 ± 5%) Ω sp. Leitfähigkeit : σ = 1,26 (1 ± 5,24%) Ω -1m-1 Äquivalentleitfähigkeit: Λ = 39,21 (1 ± 5,24%) cm2 Ω -1mol-1 e) Konzentration c= 150g/l (Diagramm VII) Widerstand : R = 3,23 (1 ± 5%) Ω sp. Leitfähigkeit : σ = 2,81 (1 ± 5,24%) Ω -1m-1 Äquivalentleitfähigkeit: Λ = 23,39 (1 ± 5,24%) cm2 Ω -1mol-1 Der Fehler von R ist mit folgender Begründung auf 5% geschätzt: Man liest den Wert für R aus dem Diagramm U gegen I ab. Da auf beiden Meßgeräten ein relativer Fehler von 2,5% angenommen wird, ergibt sich der Fehler für R zu 5%. Aus dem Diagramm VIII ( Λ gegen 1/c) kann leider kein ordentlicher Wert für Λ ∞ bestimmt werden, da der betrachtete Bereich der Kurve keinen asymptotischen Charakter zeigt. Über den weiteren Verlauf der Kurve kann nur spekuliert werden, solange keine weiteren Messungen bei sehr viel kleineren Konzentrationen vorliegen. 6. Diskussion Die beiden ermittelten Werte für die Faraday-Konstante F stimmen beide im Rahmen der Meßunsicherheit überein, was bei relativen Fehlern von 25% und 42% nicht schwer zu verfehlen ist. Diese enormen relativen Fehler resultieren einzig aus den ersten fünf Messungen. Dennoch ist es verwunderlich, dass der durch die Volumenmessung von Wasserstoff erhaltene Wert für F so stark von dem für Sauerstoff (fast 100%tige Übereinstimmung zum bekannten F ) abweicht. Eine Erklärung dafür konnte von uns nicht gefunden werden. Über die Äquivalentleitfähigkeiten kann leider keine Aussage getroffen werden, weil uns keine Vergleichswerte aus der Literatur oder anderen Medien vorliegen. I II III IV V VI VII VII