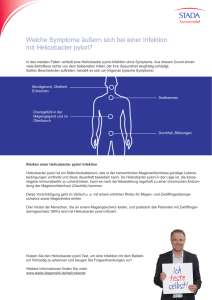
Untersuchung von genetischen und sozioökonomischen
Werbung

Aus der Medizinischen Universitätsklinik des Knappschaftskrankenhauses Bochum-Langendreer Direktor: Prof. Dr. med. W. Schmiegel der Ruhr-Universität Bochum Untersuchung von genetischen und sozioökonomischen Einflußgrößen auf die Infektion mit Helicobacter pylori und deren assoziierte Erkrankungen. Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Ercan Elitok aus Maden/Türkei 2000 Dekan: Prof. Dr. med. Gert Muhr Referent: Prof. Dr. med. W. Schmiegel Koreferent: Tag der mündlichen Prüfung 2 Inhaltsverzeichnis 1 2 Einleitung ...................................................................................................8 1.1 Der Erreger Helicobacter pylori...........................................................8 1.2 Epidemiologie ...................................................................................10 1.3 Nutritive Faktoren .............................................................................11 1.4 Genetische und immunologische Assoziationen ..............................12 1.5 Aspekte der Immunologie in der Pathogenese der H. pylori-Infektion13 1.6 Zielsetzung .......................................................................................14 Material und Methoden ............................................................................15 2.1 Studienaufbau ..................................................................................15 2.2 Anamneseerhebung und Untersuchungsbefunde ............................16 2.2.1 Sozialer Status ..........................................................................16 2.2.2 Körpergewicht............................................................................16 2.2.3 Ethnische Herkunft ....................................................................17 2.2.4 Vorerkrankungen .......................................................................17 2.2.5 Ernährungsgewohnheiten..........................................................17 2.2.6 Ösophagogastroduodenoskopie................................................17 2.2.7 Histologische Befunde...............................................................17 2.2.8 Drogen- und Medikamenteneinnahme ......................................18 2.3 Materialien ........................................................................................18 2.4 DNA – Isolierung und Analyse ..........................................................21 2.4.1 DNA – Isolierung .......................................................................21 2.4.2 Mikrosatellitenanalyse ...............................................................21 2.5 2.5.1 DNA – Isolierung .......................................................................25 2.5.2 Mikrosatellitenanalyse ...............................................................25 2.6 3 Methoden..........................................................................................25 Statistik .............................................................................................27 Ergebnisse ...............................................................................................29 3.1 Patientenkollektiv..............................................................................29 3.2 Einzelassoziationen ..........................................................................29 3.2.1 Genetische Einflußgrößen .........................................................29 3.2.2 Physiologische Einflußgrößen ...................................................32 3.2.3 Anamnestische Einflußgrößen ..................................................37 3.2.4 Einflußgröße Ernährung ............................................................38 3 3.2.5 ÖGD-Befunde und H. pylori-Infektion ........................................40 3.2.6 Histologie-Befunde und H. pylori ...............................................42 3.2.7 Einflußgröße 'URJH.................................................................44 3.3 4 Vergleich der Risiken der verschiedenen Einflußfaktoren ................45 Diskussion ...............................................................................................46 4.1 Mikrosatellitenanalyse ......................................................................46 4.1.1 T-Zell-Rezeptorgene..................................................................46 4.1.2 TNFa..........................................................................................48 4.1.3 CD3D, FGF1A, IFNA, IL2, IL5RA ..............................................48 4.2 Physiologische Einflußgrößen ..........................................................49 4.2.1 Geschlecht.................................................................................49 4.2.2 Alter ...........................................................................................49 4.2.3 Geschwisteranzahl ....................................................................50 4.2.4 Sozialer Status ..........................................................................50 4.2.5 Body-Mass-Index.......................................................................51 4.2.6 Ethnik.........................................................................................52 4.3 Anamnestische Einflußgrößen..........................................................52 4.3.1 Diabetes mellitus .......................................................................52 4.3.2 Herzkreislauferkrankungen........................................................52 4.4 Ernährungsfaktoren ..........................................................................53 4.4.1 Salzkonsum ...............................................................................53 4.4.2 Nitritkonsum...............................................................................53 4.4.3 Fleischkonsum...........................................................................54 4.4.4 Obst- und Gemüsekonsum........................................................54 4.4.5 Kommentar zur Beobachtungsgröße Ernährung .......................54 4.5 ÖGD / Histologie...............................................................................55 4.6 Drogenkonsum .................................................................................56 4.7 Zusammenfassung ...........................................................................57 5 Literatur....................................................................................................58 6 Anhang: Datentabellen ............................................................................70 4 Abkürzungen [32P]-dCTP Mit radioaktivem Phosphor markiertes Desoxycytidin-Triphosphat A Antrum AB Antibiotika APS Ammoniumpersulfat C Corpus CD3D Cluster of Differentiation 3 delta C-Gastritis Chemisch-toxisch induzierte chronische Gastritis chron chronisch CLO Campylobacter Like Organism = Helicobacter pylori DMSO Dimethylsulfoxid DNA Desoxyribonukleinsäure ELISA Enzyme-Linked Immunosorbent-Assay EDTA Ethylen-Diamin-Tetra-Azetat FCS Fötales Kälberserum FGF1A Fibroblast-Growth-Factor-1A h hochgradig H. pylori Helicobacter pylori IFNA Interferon Alpha IFNG Interferon Gamma g geringgradig Ig Immunglobulin IL Interleukin IL2 Interleukin-2 IL5RA Interleukin-5-Rezeptor m mittelgradig Magen-Ca Magenkarzinom MALT´om Mukosa assoziiertes Lymphom MHC-II Major Histocompatibility Complex Class II = Haupthistokompatibilitäts-Komplex Klasse II n Eine natürliche Zahl NP 40 Nonidet P-40 NSAR Nicht-steroidale Antirheumatika 5 o.B. Ohne pathologischen Befund ÖGD Ösophagogastroduodenoskopie OR Odds-ratio PAA Polyacrylamidgel PBS Phospat buffered saline PCR Polymerase Kettenreaktion RPMI Roswell Park Memorial Institute Medium für Zellkuturen SDS Natriumdodecylsulfat TBE Tris-Borat-EDTA TCR T-Zell-Rezeptor TCRBV6S1 T-Zell-Rezeptor Beta-Kettenelement variabel 6S1 TCRBV6S3 T-Zell-Rezeptor Beta-Kettenelement variabel 6S3 TCRBV6S7 T-Zell-Rezeptor Beta-Kettenelement variabel 6S7 TCRDVAJ T-Zell-Rezeptor Delta-Kettenelement variabel AJ TE Tris-EDTA TEMED N,N,N´N´-Tetramethyl-ethyldiamin TEN Tris-EDTA-NaCl TNF Tumor-Nekrose-Faktor UTR Untranslatierte Region 6 Abstract Elitok Ercan Untersuchung von genetischen und sozioökonomischen Einflußgrößen auf die Infektion mit Helicobacter pylori und deren assoziierte Erkrankungen. Die Infektion mit H. pylori stellt ein multifaktorielles Geschehen dar. In dieser Studie wird der Zusammenhang zwischen den sozioökonomischen, klinischen und genetischen Wirtsfaktoren und der Prävalenz des H. pylori-Status untersucht. In diese Studienauswertung wurden insgesamt 418 Patienten (198 H. pylorinegativ und 220 H. pylori-positiv; Alter 17 - 92 Jahre) eingeschlossen. Bei ihnen wurde eine ÖGD durchgeführt und Biopsien für die Histologie, Bakterienkultur und den CLO-Test entnommen. Anamnestisch wurden Daten über Eßgewohnheiten (Konsum von Salz, Obst, Gemüse, Fleisch, Wurst/Geräuchertes [nitrithaltig], Alkohol, Zigaretten und Medikamente), Beruf und Anzahl der Geschwister zur Bestimmung des sozioökonomischen Status, der physiologischen Daten (Alter, Geschlecht, Größe und Gewicht) und die ethnische Herkunft erfragt. Mittels Immunoprinting wurden genetische Marker (die Mikrosatelliten IL2, IL5RA, TNFa, TCRBV6S1, TCRBV6S3, TCRBV6S7, TCRDVAJ, CD3D, IFNa und FGF1A) analysiert und mit dem H. pylori-Status korreliert. Wesentliche Ergebnisse dieser Studie sind der Nachweis, daß die Mikrosatellitenallele TCRBV6S1-Allel (GT)13, TCRBV6S3-Allel (GT)11, der exonische Polymorphismus TCRBV6S1A, Übergewicht sowie asiatisch-arabische Herkunft signifikant mit dem positiven H. pylori-Status assoziiert und TCRBV6S1-Allel (GT)9 mit dem negativen H. pylori-Status assoziiert sind. 7 1 Einleitung 1.1 Der Erreger Helicobacter pylori Das bis 1979 in Vergessenheit geratene Bakterium Helicobacter pylori wurde von dem Pathologen J. Robbin Warren auf Magenschleimhautbiopsien wiederentdeckt. In Zusammenarbeit mit Barry Marshall wurde der Erreger isoliert, kultiviert und zunächst als Campylobacter pylori identifiziert (Warren et al., 1983). Der Erreger wurde 1989 wegen seiner besonderen Charakteristika als neues Genus – Helicobacter – aus der Campylobacter-Gattung ausgegliedert. Helicobacter pylori ist ein gramnegatives, nicht sporenbildendes, 0,5-1 µm x 2,5-3 µm messendes, gebogen bis spiralig gewundenes, lophotrich begeißeltes Bakterium (Abbildung 1). Es wächst unter mikroaerophilen Bedingungen, bei Temperaturen von 35-37 °C und in mit Blut angereicherten Medien. H. pylori produziert u.a. die Enzyme Urease (Spaltung von Harnstoff in Ammoniak und Kohlendioxid), Katalase (Antioxidans), Alkalische Phosphatase (Hydrolase) und Adhäsine (fibrilläres Hämagglutinin, lipidspezifisches Adhäsin). Diese verleihen dem Bakterium säureneutralisierende, lytische und zelladhäsive Eigenschaften, welche die Besiedlung der Magenschleimhaut ermöglichen und den Erreger selbst schützen. Abbildung 1: Helicobacter pylori ist ein spiralig gewundenes und lophotrich begeißeltes Bakterium, das sich durch spiralige Bewegungen vorwärts bewegt. Erregernachweisverfahren Es gibt verschiedene Nachweisverfahren für eine H. pylori-Infektion (Tabelle 1). Diese sind im einzelnen: 8 Histologie: Mikroskopischer Nachweis des Bakteriums in Formalin fixiertem Biopsiematerial des Magens nach Giemsaoder Warthin-Starry-Silberfärbung. Kultur: Anzucht des Erregers aus Biopsiematerial, Speichel oder Magensaft auf Festkulturmedium. Serologie: Mittels ELISA lassen sich spezifische Immunglobuline (IgA, IgM und IgG) gegen bakterielle Antigene von H. pylori nachweisen, auch bis zu 2 Jahren nach antibiotischer Eradikation. CLO-Test: Indirekter H. pylori-Nachweis durch Messen der Ureaseaktivität aus dem Biopsiematerial. 13 C-Atemtest: Wie beim CLO-Test wird H. pylori indirekt nachgewiesen, in dem 13 CO2 in der ausgeatmeten Luft bestimmt wird. nach oraler Gabe von 13 CO2 entsteht 13 C-markiertem Harnstoff, der durch die Urease von H. pylori gespalten wird. Tabelle 1: Eine Übersicht der Nachweisverfahren (modifiziert nach Meryn et al., 1994) mit Darstellung der Sensitivität, Spezifität und des Einsatzes des jeweiligen Nachweisverfahrens in der Erstdiagnose und bei der Verlaufskontrolle einer H. pylori-Infektion. Testverfahren ELISA Sensitivtät % 92-97 Spezifität % 95 Hauptanwendung Basistiter, langfristiger Titerverlauf (bis zu 2 Jahren), epidemiol. Fragestellung 13 C-Atemtest 90-100 95 Verlaufsuntersuchung, Kontrolle nach Eradikationstherapie CLO-Test 89-97 98 Endoskopisch Methode der Wahl Histologie 93-99 98 Goldstandard Kultur 77-92 99 Bes. bei AB-Resistenzen 9 1.2 Epidemiologie Die Infektion mit H. pylori weist eine hohe Prävalenz auf, allerdings zeigen verschiedene Studien, daß die Durchseuchung ethnische und geographische Unterschiede aufweist (Tabelle 2). So zeigen sich höhere Infektionsraten mit dem Bakterium bei Menschen in südlicheren Ländern und bei nicht Weißen. In dieser Gruppe ist der soziokulturelle Status im Vergleich zu nördlicheren Ländern und Weißen niedriger (s.u.). Eine Geschlechtsabhängigkeit der Infektionsrate konnte nicht gezeigt werden (The EUROGAST Study Group, 1993; Mbengue et al., 1997; Babus et al., 1998; Kawasaki et al., 1998). Tabelle 2: Prävalenzen von H. pylori-positiven Individuen in verschiedenen Ländern. Die Länder sind gemäß ansteigender Prävalenz sortiert (Zunahme von Nord nach Süd). Land Prävalenz n Referenz Dänemark 33,9 % 3589 Andersen, L.P. et al., 1996 Irland 43,0 % 1000 Buckley, M.J. et al., 1998 Spanien 43,0 % 332 Senra-Varela, A. et al., 1998 Deutschland 52,6 % 418 Eigene Daten 48,0-53,0 % 456 Babus, V. et al., 1998 Nepal 56,8 % 1142 Kawasaki, M. et al., 1998 Thailand 65,7 % 257 Yali, Z. et al., 1998 Mexico 66,0 % 11605 Torres, J. et al., 1998 Weiße 40,0 % 169 Louw, J.A. et al., 1993 Kroatien Süd Afrika Farbige 71,0 % Korea 75,0 % 413 Malaty, H.M. et al., 1996 Brasilien 83,3 % 204 Souto, F.J. et al., 1998 Jordanien 90,0 % 220 Shennak, M.M. et al., 1998 Bangladesh 92,0 % 181 Ahmad, M.M. et al., 1997 Kenia 80,0-100,0 % 120 Ogutu, E.O. et al., 1998 Senegal 82,0-100,0 % 134 Mbengue, M. et al., 1997 10 Auch die sozialen und ökonomischen Umstände, in denen ein Mensch aufwächst, stellen unterschiedlich starke Risikofaktoren für eine Infektion mit H. pylori dar. Menschen mit niedrigerem Bildungsstand und geringem Einkommen zeigen eine höhere Durchseuchungsrate als die anderen Gruppen (Malaty et al., 1996; Rosenstock et al., 1997). Innerhalb einer sozialen Schicht ist die Prävalenz der mit H. pylori infizierten Kinder kleiner als die der Erwachsenen (Youn et al., 1988). Ein deutliche Alterskorrelation konnte durch mehrere Arbeitsgruppen nachgewiesen werden (Asaka et al., 1996; Souto et al., 1998, Torres et al., 1998). Diese Differenz der Prävalenzen wird über die Jahre zunehmend kleiner. Die Ursache wird in der Verbesserung der sozioökonomischen Verhältnisse in Verbindung mit dem Kohorteneffekt, d.h. der H. pyloripositive bzw. H. pylori-negative Status, der in der Kindheit bestand bzw. erworben wurde, bleibt lebenslang bestehen (Cullen et al., 1993; Roosendaal et al., 1997; Rodrigo Saez et al., 1997) gesehen. Eine Infektion ist jedoch, insbesondere bei erhöhter Exposition, auch im Erwachsenenalter möglich. Hierfür sprechen Studienergebnisse, in denen nachgewiesen wurde, daß bei Endoskopikern und Endoskopieschwestern eine höhere Prävalenz vorherrscht als in vergleichbaren Kontrollgruppen (Matysiak-Budnik et al., 1996 & 1997; Lu et al., 1997). Die Reinfektionsraten werden nach Eradikation auf 1-6 % geschätzt (Mitchell et al., 1998; Kato et al., 1998; Fraser et al., 1998). Es werden sowohl oral-orale (Li, C. et al., 1996; Hazell et al., 1994) als auch fäkal-orale (Thomas et al., 1992; Kelly et al., 1994) Übertragungswege für H. pylori diskutiert. 1.3 Nutritive Faktoren Der Einfluß von Nahrungsbestandteilen und Genußmitteln bei der Besiedlung mit H. pylori wurde von verschiedenen Gruppen untersucht. Diese haben festgestellt, daß der Genuß von Nikotin und Alkohol in keinem Zusammenhang mit dem H. pylori-Status der Konsumenten steht (Tsugane et al., 1994; Shinchi et al., 1997). Die Aufnahme von Obst und Gemüse und damit von Vitamin C wird als Schutzfaktor gegen die Infektion mit H. pylori angesehen (Shinchi et al., 1997; Goodman et al., 1998). Andere Studien zeigen, daß zwischen von Kindheit an als Vegetarier lebenden Menschen und nicht Vegetariern kein Unter- 11 schied bezüglich der H. pylori-Infektion besteht (Hopkins. et al., 1990; Webberley et al., 1992). Der zusätzliche Fleischkonsum verändert somit nicht das Risiko für eine H. pylori-Infektion. Als besondere Risikofaktoren werden der Verzehr von salzigen, geräucherten und gepökelten (nitrithaltigen) Nahrungsmitteln diskutiert (Tsugane et al., 1994; Chang-Claude et al., 1995). 1.4 Genetische und immunologische Assoziationen Neben diesen Umweltfaktoren beeinflussen auch immungenetische Faktoren eine H. pylori-Infektion. Besondere Bedeutung kommt der Immunologie bei chronischen Entzündungen infolge Infektionen zu, bei denen keine Erregerelimination durch Aktivierung des Immunsystems eintritt, sondern eine ständige, im Gleichgewicht bleibende Wechselbeziehung zwischen Erreger und Immunsystem besteht. Zusätzliche Einflüsse wie Umweltfaktoren und genetisch bedingte Wirtsfaktoren, können dieses Gleichgewicht beeinflussen. Der Ablauf einer zellulären Immunantwort ist eine Kombination von unspezifischer und spezifischer Abwehr. Zunächst werden Fremdantigene unspezifisch als fremd erkannt, in Makrophagen aufgenommen und prozessiert. Danach wird das Antigen an der Zelloberfläche mittels membranständigen MHC-II-Rezeptor den T-Lymphozyten präsentiert. Die T-Helferzelle erkennt das Antigen über die spezifischen variablen Regionen (V-Regionen) der .- und -Ketten des T-Zell-Rezeptors, der mit dem MHC-II-Rezeptor der antigenpräsentierenden Zelle interagiert. Die Interaktion kann aber nur mit Hilfe von MHC-II-Rezeptor benachbarten Adhäsionsmolekülen CD4 und CD3 erfolgen (Classen et al., 1994-c). Nach der Antigen-Präsentation sezernieren T-Helferzellen Lymphokine und stimulieren damit andere T-Lymphozyten und B-Lymphozyten. Diese proliferieren und tragen ebenfalls zur Elimination des Fremdantigens bei (Janeway et al., 1995). Der Vorgang der Antigenpräsentation durch antigenpräsentierende Zellen und die spezifische Erkennung des Antigens über den TCR des T-Lymphozyten wird wesentlich beeinflußt durch die Allele der .- und -Untereinheiten des T-Zell-Rezeptors ab (Pullen et al., 1990; Kappler et al., 1987; Gahm et al., 1991). 12 In einer Studie (Malaty et al., 1994), bei der ein- und zweieiige Zwilligspaare untersucht wurden, die als Kind entweder miteinander oder getrennt lebend aufgewachsen sind, konnte der genetische Einfluß auf die Empfänglichkeit für Helicobacter pylori gezeigt werden. Zusätzlich zu dem Einfluß der Umweltfaktoren war die Konkordanz des H. pylori-Status bei den eineiigen Zwillingen statistisch signifikant größer als bei den zweieiigen, unabhängig davon, ob sie zusammen oder getrennt aufgewachsen sind. Genetische Faktoren, die die Suszeptibiltät für die Infektion mit H. pylori beeinflussen konnten auch auf molekularer Ebene nachgewiesen werden (Azuma et al., 1995 und 1998, Kunstmann et al., 1999). Weiterhin konnte der Zusammenhang von H. pyloriassoziierten Erkrankungen und HLA-DQA1 von Azuma et al. (1995) dargestellt werden. 1.5 Aspekte der Immunologie in der Pathogenese der H. pylori-Infektion Die Pathogenese der H. pylori-Infektion ist in ihrer Komplexität bisher nicht ganz verstanden. Jedoch sind Erkenntnisse bezüglich einzelner Aspekte der Magenschleimhautbesiedlung durch H. pylori beschrieben, welche im folgenden dargestellt werden. H. pylori bindet mittels Adhäsine an die Epithelzelle der Magenschleimhaut (Yoshida et al., 1993) und aktiviert diese. Als Folge der Aktivierung kommt es zu einer ehöhten Produktion von IL8 (Crabtree et al., 1994). Die Erhöhung von IL8 aktiviert Mononukleäre Zellen, die danach gesteigert Zytokine (IL1, IL6, IL8, TNFα, IFNγ) produzieren (Strieter et al., 1992). Die Wirkung der Mediatoren entfaltet sich als Neutophilenanlockung mit Transmigration des Epithels, Steigerung der MHC-II Expression mit Antigenpräsentation der Epithelzelle (Valnes et al., 1990) und Initiierung von Entzündung durch Aktivierung von T-, B-, NK-Zellen und Makrophagen. Das pathologisch mikroskopische Bild stellt sich als Gastritis-Typ B dar. Die Ergebnisse von weiteren Studien, in denen der Einfluß von Zytokinen auf die H. pylori-Infektion untersucht wurde zeigten Erhöhung von TNF-alpha (Bodger et al., 1997), Erhöhung von IL1, IL6, IL8 (Yamaoka et al., 1996) und Erniedrigung von IL2 (Dey et al., 1998) bei positivem H. pylori-Status. Diese Befunde weisen darauf hin, daß die Immunantwort bei der Pathogenese der H. 13 pylori-Infektion einen wesentlichen Faktor darstellt (Crabtree et al., 1996; Bodger et al., 1997), d.h. ob eine Infektion mit H. pylori chronisch verläuft oder ob sich auf dem Boden einer chronischen Infektion mit H. pylori eine weitere assoziierte Erkrankung manifestiert. Die Bedeutung von Immunmechanismen für die H. pylori-Infektion konnte auch im Mausmodell gezeigt werden (van Doorn et al., 1999). Hierbei wurde ein Anstieg der IL-5 sezernierenden Zellen im entzündlichen Infiltrat gezeigt. 1.6 Zielsetzung Die oben erwähnten Studien zeigen, daß die Infektion mit H. pylori ein multifaktorielles Geschehen darstellt. In diesem Konzept spielen sozioökonomische, aber auch insbesondere genetische Wirtsfaktoren eine große Rolle. Um den Einfluß verschiedener Größen (Eßgewohnheiten, Zigaretten-, Alkohol-, Medikamentenkonsum, Beruf, Geschwisteranzahl, physiologische Daten, ethnische Herkunft und genetische Marker des Immunsystems (Mikrosatelliten IL2, IL5RA, TNFa, TCRBV6S1, TCRBV6S3, TCRBV6S7, TCRDVAJ, CD3D, IFNa und FGF1A)) auf die Prävalenz des H. pylori-Status zu untersuchen, führten wir diese Studie durch. 14 2 Material und Methoden 2.1 Studienaufbau Insgesamt wurden in die Studienauswertung 418 Patienten eingeschlossen, von denen 198 Helicobacter pylori-negativ und 220 H. pylori-positiv waren. Sie waren zwischen 17 - 92 Jahre alt, wobei der Mittelwert bei 58,7 Jahren (Median: 60 Jahre) und die Standardabweichung bei 17,8 Jahren lag. Diese Patienten wurden in der Medizinischen Universitätsklinik des KnappschaftsKrankenhauses Bochum-Langendreer und der Medizinischen Klinik des Elisabeth-Krankenhauses Essen rekrutiert. Einschlußkriterium war die aus medizinischer Indikation heraus durchgeführte Ösophago-gastro-duodenoskopie, Alter größer 18 Jahre und die Einwilligungsfähigkeit des Patienten. Ausschlußkriterien waren immunsupprimierte oder an einem Malignom erkrankte Patienten. Für die Bestimmung des H. pylori-Status und die Beurteilung der Magenmucosa des Patienten wurden Schleimhautbiopsien für die Histologie, die Bakterienkultur und den CLO-Test entnommen. Weiterhin wurde Serum gewonnen für den Nachweis von Antikörpern gegen H. pylori-Antigene mit Hilfe eines ELISA´s. Der H. pylori-Status wurde als positiv angesehen, wenn mindestens 2 der 4 eben genannten H. pylori-Nachweisverfahren positiv waren, sonst als negativ. Umwelt- und Sozialfaktoren der Patienten wurden durch Anamneseerhebung über die Ernährungsgewohnheiten, Drogen- und Medikamenteneinnahme sowie die Bestimmung soziodemographischer Faktoren ermittelt. Für die DNA-Isolierung wurde dem Patienten 10 ml peripher-venöses Vollblut entnommen. Mittels Immunoprinting wurde die DNA anschließend in der Abteilung für Humangenetik der Ruhr-Universität Bochum, Direktor: Prof. Dr. med. J. T. Epplen, analysiert. Die Allelfrequenzen der Mikrosatelliten wurden mit dem H. pylori-Status korreliert. Mit dem Chi2-Test wurden die Korrelationen auf ihre statistische Signifikanz überprüft. Die errechneten p-Werte wurden nach Bonferoni gemäß der Anzahl gemachter Vergleiche korrigiert. Die Patienten wurden vor Aufnahme in diese Studie über den Inhalt aufgeklärt und darüber informiert, daß sie jederzeit das Recht haben ihr Einverständnis ohne Nachteile zu widerrufen. Weiterhin wurde ihnen die Einhaltung der Datenschutzbestimmungen zugesichert. 15 Diese Studie ist durch die Ethikkommission der Ruhr-Universität Bochum genehmigt. 2.2 Anamneseerhebung und Untersuchungsbefunde Für die Dokumentation der Patientendaten wurde ein standardisierter Fragebogen entwickelt. Die Daten wurden sowohl durch direkte Patientenbefragung als auch durch Einsicht in die Patientenakte semiquantitativ erfasst. Hierbei wurden Umwelt- und Sozialfaktoren der Patienten bezüglich ihrer Ernährungsgewohnheiten (Konsum von Salz, Obst, Gemüse, Fleisch, Wurst/Geräuchertes (nitrithaltig), Genuß von Alkohol und Zigaretten sowie die Einnahme von Medikamenten), Bestimmung soziodemographischer Faktoren (ethnischen Herkunft, Beruf, Anzahl der Geschwister, Alter, Geschlecht, Größe und Körpergewicht) ermittelt. Die Befunde von der ÖGD und der histolopathologischen Begutachtung der Magenmucosa wurden ebenfalls dokumentiert. Die Einteilung der jeweiligen Daten erfolgte nach folgendem Schema: 2.2.1 Sozialer Status Die Personen wurden entsprechend ihren Berufen in drei verschiedene Bildungsgruppen zugeordnet. Die Kriterien hierfür waren: Ohne Ausbildung: Für den ausgeübten Beruf ist keine Ausbildung notwendig; Mit Ausbildung: Für den ausgeübten Beruf ist eine Ausbildung notwendig; Mit Hochschulbildung: Für den ausgeübten Beruf ist eine Hochschulausbildung notwendig; Hausfrauen : wurden einer eigenen Gruppe zugeordnet, da sie den anderen 3 Gruppen nicht sicher zugeordnet werden konnten. 2.2.2 Körpergewicht Das Körpergewicht wurde mit Hilfe der Körpergröße in den Body-Mass-Index (= Körpergewicht [kg]/(Körpergröße [m])2) umgerechnet. War der Index bei den Männern >27,8 kgm-2 oder bei den Frauen >27,3 kgm-2, so wurden sie als übergewichtig (Classen, M. et al., 1994-a), ansonsten als normalgewichtig eingestuft. 16 2.2.3 Ethnische Herkunft Die ethnische Herkunft der Personen wurde danach festgelegt in welchem Land sie als Kind (< 7 Jahre) gelebt haben. Die Herkunft wurde in zwei Gruppen aufgeteilt. Den europäischen Ländern (ohne Türkei) wurden die asiatischarabischen (mit Türkei) gegenübergestellt. 2.2.4 Vorerkrankungen Die Vorerkrankungen der Patienten wurden folgendermaßen eingeteilt: • Diabetes mellitus: Diabetes mellitus Typ II; • Herzkreislauferkrankungen: Koronare Herzerkrankung (KHK), Kardiomyopathien, Myokardinfarkt, Herzklappeninsuffizienz, -stenose, arterielle Hypertonie, - Hypotonie etc. Andere Erkrankungen wurden bei der Auswertung nicht berücksichtigt. 2.2.5 Ernährungsgewohnheiten Anamnestisch erhobene Daten über Ernährungsgewohnheiten bezüglich des Konsums von Obst, Gemüse, Fleisch, Salz und nitrithaltigen Lebensmittel wurden nach der Häufigkeit des Verzehrs untersucht. Bis auf den Salzkonsum waren die Kriterien für die Unterteilung die Anzahl der Tage in einer Woche, an denen die Nahrungsart aufgenommen wurde, d.h. wenig (an 0-2 d/Woche), normal (an 3-5 d/Woche) und viel (an 6-7 d/Woche). Beim Salzkonsum wurde nach der subjektiven Einschätzung gefragt, ob sie sich salzarm (wenig), normal oder salzig (viel) im Vergleich zu Angehörigen bzw. Bekannten ernähren. 2.2.6 Ösophagogastroduodenoskopie Bei der ÖGD makroskopisch erhobene Befunde des Magens wurden in die Gruppen o.B., Schleimhauterythem, erosives Schleimhauterythem und Ulcus ventriculi eingeteilt. Die Befunde des Duodenums wurden in die Einteilung o.B., Schleimhauterythem, erosives Schleimhauterythem und Ulcus duodeni zugeordnet. 2.2.7 Histologische Befunde Die histologischen Befunde wurden der Sydney-Klassifikation der Gastritis (Riede et al., 1993) angelehnt in o.B., chron nicht aktiv, g chron g aktiv, g chron 17 m aktiv, g chron h aktiv, m chron g aktiv, m chron m aktiv, m chron h aktiv, h chron g aktiv, h chron m aktiv, h chron h aktiv, C-Gastritis, MALT´om, Magenkarzinom aufgeteilt, getrennt nach Antrum und Corpus Biopsien. 2.2.8 Drogen- und Medikamenteneinnahme Die Daten über Alkohol- und Nikotingenuß (bis vor 1 Jahr) sowie Medikamenteneinnahme wurden folgendermaßen gruppiert: Die durchschnittliche täglich eingenommene Alkoholmenge wurde als oberhalb bzw. unterhalb der Organschädigungsgrenze (OSG) liegend festgesetzt, wobei die OSG überschritten war bei Männern > 80 g/d und Frauen > 60 g/d (Classen, M. et al., 1994-b). Um den Zigarettenkonsum zu erfassen, wurden die Gruppen 0-7, 8-15 und >15 Zigaretten/d gebildet. Bei den Medikamenten wurde die Einnahme von Antibiotika (in den letzten 14 d unabhängig vom Präparat), von Nicht-steroidalen Antirheumatika (in den letzten 7 d unabhängig vom Präparat) betrachtet. 2.3 Materialien Die für die DNA- und Lymphozytenisolierung und für die Mikrosatellitenanalyse notwendigen Materialien mit Nennung des Herstellers sind in Tabelle 3 und Tabelle 4 aufgeführt. 18 Tabelle 3: Eine Auflistung der Materialien (mit Angabe des jeweiligen Herstellers), die für die Mikrosatellitenanalyse notwendig sind. Material Hersteller Werkbank Heraeus Mikrotiterplatte Costar Terasakiplatte Sarstedt Mehrkanalpipette Bibi Dunn Mikroliterpipetten (1 ml, 200 µl, 20 µl) Gilson Sterile Pipettenspitzen Greiner Tris-HCl, pH 8.3 MERCK dNTP MBI Fermantas, Gene Craft Primer Metabion MgCl2, KCl MERCK Taq Polymerase Gene Craft [. -32P]-dCTP Amersham Mineral-Öl SIGMA Thermocycler biometra Harnstoff MERCK TEMED Riedel-de-Haen Nichtadhärierendes Silan MERCK Fuselfreie Papiertücher Kleenex Glasplatten Stratagene Sequenzier-Kammer Stratagene Netzgeräte Stratagene & Farmacia Biotec Products Hofer Gel-Trockner Biorad Röntgenfilme Fuji 19 Tabelle 4: Eine Auflistung der Materialien (mit Angabe des jeweiligen Herstellers), die für die DNA- und Lymphozytenisolierung notwendig sind. Material Hersteller Ethylalkohol (70 %) MERCK NaCl, TRIS, EDTA, NaCl Baker Analysed Reagent SDS BioMol Ultrapur Kühlschränke (4 °C), (20 °C) Bosch 1,5 ml Reaktionsgefäße Eppendorf 15 ml, 50 ml Reaktionsröhrchen Falcon Pipetten Falcon Sterile Werkbank Gelaire Flow Laboratories RPMI, Glutamin, Penicillin-Streptom. GIBCO BRL Mikroliterpipette Gilson Pipettierhilfe Pipetus-Standard 1,5 ml Einfriergefäße Greiner Labor Technik Zentrifuge Heraeus sepatech-varifuge 20 rs Gefrierschrank (-80 °C) Kryotech, -86C Freezer Ficoll Lymphoprep von Nycomed DMSO, NaH2PO4, Na2HPO4 MERCK Destillator Peter oehmen 2012 Ethylalkohol (100 %) Riedel-de Haen FCS (hitzeinaktiviert) Seromed Nonidet P-40, Proteinase K SIGMA Photometer Kontron 20 2.4 DNA – Isolierung und Analyse 2.4.1 DNA – Isolierung DNA wurde aus polymorphkernigen Zellen (Granulozyten) gewonnen. Hierfür wurde den Patienten jeweils 10 ml peripher venöses Blut entnommen. Mit Hilfe eines Ficollgradienten wurden die mononucleären Zellen von den Erythrozyten und Granulozyten getrennt. Die mononucleären Zellen wurden für Zusatzuntersuchungen nach Zugabe von Einfriermedium in flüssigem Stickstoff gelagert. Nach Hämolyse der Erythrozyten mit Aqua dest. wurde aus den Granulozyten die DNA nach der Methode von Miller et al. (1988) isoliert. Dieser Vorschrift entsprechend wurden die Zell- und Zellkernwände der Granulozyten mit 20-30 ml NP40 (0,1 %) lysiert. Über Nacht wurden bei 55 °C die Proteine von der DNA durch einen Proteinase K-Verdau getrennt. Nach Abkühlen der Proben auf 4 °C wurde 1 ml gesättigte NaCl-Lösung hinzugegeben und 10-15 min bei 2500 g und 4 °C zentrifugiert. Aus dem Überstand wurde die DNA mit Ethylalkohol (100 %) gefällt, in 70 %´igem Ethylalkohol gewaschen (6000 g für 8 min), in 200 µl TE in Lösung gebracht (ca. 1Woche bei Raumtemperatur), und bei 4 °C aufbewahrt. Die DNA-Menge wurde bei 200-facher Verdünnung bei der Wellenlänge 260 nm mit einem Photometer gemessen. Dabei berechnete sich die DNA-Konzentration [ng/µl] = ((Optische Dichte bei 260 nm) x 200 (Verdünnungsfaktor) x 50 ng/µl (Doppelstrang-DNA-Extinktionskoeffizient)). Die DNAKonzentration wurde auf 100 ng/µl eingestellt, damit die weitere Verarbeitung erleichtert war. 2.4.2 Mikrosatellitenanalyse Hierbei werden für die Immunantwort relevante Gen-Loci indirekt anhand von polymorphen Mikrosatelliten analysiert. 21 Mikrosatelliten Mikrosatelliten-DNA besteht aus 1-50 Kopien von Folgen aus 1-6 Basenpaaren, die in Tandemstellung hintereinander gereiht sind. Ein Beispiel für einen solchen Mikrosatellit ist auch im Gen-Locus von IFNG auf dem Chromosom 12q24.12 mit der Sequenz (CA)n im Intron 1 (Tabelle 5) vorzufinden. Mikrosatelliten mit CA-Dinucleotid-Folgen kommen im Genom verteilt - durchschnittlich einmal pro 30 kb-Genomabschnitt vor – und können zwischen Genen oder in intronischen Bereichen des Gens liegen. Diese Sequenzen werden nach Mendel´schen Gesetzen vererbt. Die Anzahl der wiederholten Untereinheiten, z.B. (CA), kann hoch polymorph sein, d.h. verschiedene Individuen zeigen hohe Variablität in der Anzahl der wiederholten Untereinheiten. (modifiziert nach Knippers, 1995) In dieser Studie wurden Mikrosatelliten (Tabelle 5) mittels PCR (z.T. auch 2 Mikrosatellitenloci im gleichen PCR-Ansatz) untersucht. Für die PCR wurde mit radioaktivem Phosphor [32P] markiertes Nucleotid (dCTP) verwendet. Tabelle 5: Eine Übersicht der in dieser Studie untersuchten Mikrosatelliten mit Angabe der Lokalisation im Genom und der Anzahl der verschiedenen Allele im jeweiligen Untersuchungskollektiv. Locus Chromosomen- Mikrosatelliten- Allele lokalisation lokalisation (in n Chromosomen) IL2 4q26-27 (CA)n, 3`flank 19 (582) IL5RA 3p24-26 (GA)n, 3`UTR 15 (780) FGF1A 5q31 (GT)n, 5`UTR 7 (310) TNFa 6p21.3 (GT)n, flank TCRBV6S1 7q35 (GT)n, Intron 1 5 (804) TCRBV6S3 7q35 (GT)n, Intron 1 5 (804) TCRBV6S7 7q35 (GT)n, Intron 1 10 (296) IFNA 9p22 (CA)n, Intron 1 4 (318) CD3D 11q23 (CA)n, Intron 7 (200) TCRDVAJ 14q11.2 (GT)n, flank 8 (306) 14 (818) (UTR: Untranslatierte Region, flank: den Genabschitt flankierend) 22 Die Allelverteilung der Mikrosatelliten IL2, IL5RA, TNFa, TCRBV6S1, TCRBV6S3, TCRBV6S7, CD3D, TCRDVAJ wurde untersucht. Die PCR-Bedingungen wurden adaptiert nach Gomolka et al. (1995), IFNa nach Kwiatkowski & Diaz (1992) und FGF1A nach Protokollen von Li et al. (1992). Folgende Primer wurden für die PCR verwendet: Tabelle 6: Primersequenzen und Referenzliteratur für die bei dieser Studie untersuchten Mikrosatelliten. Locus Primer Vorwärts Literatur-Referenzen Primer Rückwärts IL2 5´-AAAGAGACCTGCTAACACA- 3´ Epplen et al., 1994 5´-CCTATGTTGGAGATGTTTAT- 3´ IL5RA 5´-AATGATCTTTTTCTAGGTAGA- 3´ Epplen et al., 1994 5´-CCTCTGGAGCTTGAGATA- 3´ FGF1A 5´-CAGCACTGAGCGAGTGTGG- 3´ Li et al., 1992 5´-GTAGCATTACATTTGCACTTGG- 3´ TNFa 5´-CCTCTAGATTTCATCCAGCCACA- 3´ Udalova et al., 1993 5´-CTCTCTCCCCTGCAACACACA- 3´ TCRBV6S1 5´-CATCCTGCCCTGACTCTGTC- 3´ Charmley et al., 1993 5´-GACACAAGTTGAGAACAGGATG- 3´ TCRBV6S3 5´-CAGGCTCCTCTTCTGGGTGG- 3´ Gomolka et al., 1994 5´-TTTGCGACTTTGTACCTAGGGG- 3´ TCRBV6S7 5´-CAGGCTCCTCTTCTGGGTGG- 3´ Gomolka et al., 1995 5´-TCTACATCCTTTCCCTTCTCTGT- 3´ IFNA CD3D 5´-TGCGCGTTAAGTTAATTGGTT- 3´ Kwiatkowski et al., 5´-GTAAGGTGGAAACCCCCACT- 3´ 1992 5´-CTTTGCTGGACATGAGACTGGA- 3´ Weber et al., 1990 5´-TAGCTGGTGCATAAGCTCAC- 3´ TCRDVAJ 5´-TGCCACCCATAACCAACCTCA- 3´ Cornélis et al., 1992 5´-AGATAAGCTCCCTGCCCTCATA- 3´ Nach der Amplifikation der Mikrosatellitenallele durch PCR mit radioaktiv markiertem [. -32P]-dCTP (siehe unten) wurden 4 µl des Produktes mit 6 µl Lade- 23 puffer gemischt und 2 Minuten bei 96°C denaturiert. Davon wurden 3 µl von etwa 50-60 Proben gleichzeitig auf einem Polyacrylamidgel (6 %), das mit TBE gepuffert wurde, aufgetragen und 4-5 h elektrischem Gleichstrom (60 Watt) ausgesetzt. Die an der Kathode aufgetragenen Proben wurden in Richtung Anode wandernd elektrophoretisch aufgetrennt. Die Auftrennung der Amplifikate erfolgte der Größe entsprechend. Nach der Elektrophorese wurde das Gel auf Whatman-Papier übertragen, auf diesem 1-2 h mit einem Gel-Trockner fixiert und anschließend eine Autoradiographie angefertigt. Ein Beispiel des Autoradiogramms nach elektrophoretischer Auftrennung der Mikrosatellitenallele von TCRBV6S1 sieht man in Abbildung 2. Abbildung 2: Auftrennung der Mikrosatellitenallele von TCRBV6S1 nach ihrer Größe (Anzahl der Wiederholungen von der GT-Sequenz). Je kürzer die Allele, um so weiter ist ihre Wanderstrecke und näher ihre Position zur Anode (unten in der Abbildung). Vertikal ausgerichtete Abkürzungen bezeichnen PatientenDNA´s. 24 2.5 Methoden 2.5.1 DNA – Isolierung • 500 ml PBS-Puffer (pH 7,4): 1,96 ml NaH2PO4 (1 M) + 8,04 ml Na2HPO4 (1 M) + 39,93 ml NaCl (gesättigt; 6,13M) + 350 ml H2O; • Einfriermedium: 50 % RPMI (einschließlich 10 % FCS + Glutamin + Penicillin-Streptomycin) + 40 % FCS (hitzeinaktiviert) + 10 % DMSO (sterilgefiltert); • 500 ml TEN (pH 8,2): 5 ml TRIS/HCl (1 M; pH 8,0) + 2 ml EDTA (0,5 M; pH 8,2) + 40 ml NaCl (1,5M), auf 500 ml mit H2O auffüllen; • 500 ml TE: 5 ml TRIS/HCl (1 M; pH 8,0) + 1 ml EDTA (0,5 M, pH 8,2), auf 500 ml mit H2O auffüllen; • Proteinase K-Verdau: 3 ml TEN (pH 8,2) + 200 µl SDS (10 %) + 100 µl Proteinase K (10 mg/ml). 2.5.2 Mikrosatellitenanalyse • TBE: 89 mM Tris, 89 mM Borsäure, 2 mM EDTA (pH 8,3); • PAA (40 %): 380 g Acrylamid + 20 g Bisacrylamid + 5 g AG (Ionentauscher) + H2O auf 1 l, danach filtrieren; • Denaturierendes Polyacrylamidgel (6 %): 100 ml 10x TBE + 150 ml PAA (40 %) + 480 g Harnstoff + H2O auf 1 l; • Ladepuffer: 95 ml Formamid + 4 ml EDTA (0,5 M) + 0,05 g Bromphenol Blau + 0,05 g Xylene Cyanol FF; • PCR-Puffer: 160 mM NH2SO4 + 670 mM Tris-HCL (pH 8,3) + 0,1% Tween20; • [. -32P]-dCTP: 2 µCi [. -32P]-dCTP in 25µl Probenansatz; • Silanisierungslösung: 95 ml Chloroform + 5 ml Nichtadhärierendes Silan; 25 • Tabelle 7: Zusammensetzung des PCR-Ansatzes. DNA 20 ng/µl 10,0 µl PCR-Puffer (10 x konzentriert) 2,5 µl dNTP 2 mMol 2,5 µl Primer1 25 µM 2,0 µl Primer2 25 µM 2,0 µl H2O 4,7 µl MgCl2 2 mMol 1,0 µl Taq Polymerase (5 U/µl) 0,2 µl [. -32P]-dCTP 0,1 µl Gesamt 25,0 µl Bei der Multiplex-PCR von 2 Mikrosatelliten wurden 1µl je Primer und Probe angesetzt und entsprechend auf 25 µl mit H2O aufgefüllt. Es wurden gleichzeitig 96 Proben in 96´er Mikrotiterplatten verarbeitet. Der PCR-Ansatz wurde mit Mineralöl überschichtet um Verdunstung zu verhindern. 26 Tabelle 8: Thermocycler-Programme für die Amplifikation der Mikrosatelliten IFNA FGF1A Temp. CD3D TNFa Temperatur IL5RA IL2 Temperatur TCRDVAJ TCRBV6S7 TCRBV6S3 TCRBV6S1 Temperatur Dauer [min] Schleifen der Anzahl mittels PCR. 3 94 °C 94 °C 94 °C 94 °C 1 94 °C 94 °C 94 °C 94 °C 1 66 °C 54 °C 60 °C 64 °C 1 72 °C 72 °C 72 °C 72 °C 1 94 °C 94 °C 94 °C 94 °C 1 63 °C 51 °C 57 °C 61 °C 1 72 °C 72 °C 72 °C 72 °C 0,5 94 °C 94 °C 94 °C 94 °C 1 60 °C 47 °C 54 °C 58 °C 1 72 °C 72 °C 72 °C 72 °C 1 5 72 °C 72 °C 72 °C 72 °C 1 endlos 4 °C 4 °C 4 °C 4 °C 1 1 1 30 endlos = bis zur Weiterverarbeitung 2.6 Statistik Mit dem Programm GENEPOP Version 3.1c (Version 1.2 beschrieben in Raymond & Rousset,1995) wurde die Genfrequenz von homozygoten und hetrozygoten Mikrosatellitenallelen in der Studien-Population auf HardyWeinberg-Gleichgewicht getestet, um methodische Artefakte auszuschließen (Metzler, 1988). Aufgrund der kleinen Populationsgröße von insgesamt 418 Individuen wurden Haplotypenfrequenzen der Mikrosatellitenallele kleiner 1 % aus der Testung herausgenommen. Die gewonnen Daten wurden mit dem Statistikprogramm Stata Intercooled (Stata inc.) bearbeitet. Mit dem Chi²-Test wurde die Abhängigkeit zwischen dem H. pylori-Status und den jeweiligen Daten über die sozialen, medizinischen, nutritiven und genetischen Faktoren untersucht. War die erwartete Häufigkeit eines Feldes der Vierfeldertafel <5, so wurde der Fisher´s exact test 27 durchgeführt. Beim Vergleich von Variablen mit mehr als zwei Merkmalausprägungen wurde der mit dem Chi²-Test (bzw. Fisher´s exact test) errechnete pWert nach Bonferoni korrigiert (pc=1-(1-p)Anzahl der möglichen Vergleiche der Merkmale). Aufgrund des eher explorativen Charakters dieser Studie wurde bei der Adjustierung der p-Werte nach Bonferoni der Korrektur-Faktor nur auf die Anzahl der Tests der jeweiligen Beobachtungsgröße bezogen und nicht auf die Gesamtanzahl der Tests in dieser Studie. Die statistische Signifikanz wurde nach den in Tabelle 9 aufgelisteten Kriterien bewertet. Tabelle 9: Eine Übersicht der bei der Datenauswertung dieser Studie benutzten Grenzen für die Bestimmung der statistischen Signifikanz in Bezug auf den nach Bonferoni korrigierten p-Wert (pc). pc-Wert Signifikanz-Niveau Nicht signifikant 0,05 < pc Signifikant 0,01 < pc ≤ 0,05 0,001 < pc ≤ 0,01 Sehr signifikant pc ≤ 0,001 Hoch signifikant Als Maß für das Risikopotential der beobachteten Variablen wurde die Oddsratio verwendet (Tabelle 10). Tabelle 10: Die Bedeutung des Odds Ratio ist hier dargestellt. Die Größe des Betrages der Abweichung des Odds-ratio von dem Wert 1 gibt die Stärke des Risikos oder des Schutzes wieder. Odds-ratio < 1 Schutzfaktor Odds-ratio = 1 Kein Einfluß Odds-ratio > 1 Risikofaktor Diese Arbeit wurde mit dem Textverarbeitungsprogramm MS Word 2000 (Microsoft corporation) editiert. 28 3 Ergebnisse Die Auswertungen der gesammelten Daten der Studie ergaben folgende Ergebnisse: 3.1 Patientenkollektiv In diese Studienauswertung wurden 418 Patienten eingeschlossen. Davon waren 198 Helicobacter pylori-negativ (männlich: 104, weiblich: 93) und 220 H. pylori-positiv (männlich: 101, weiblich: 119). Die Patienten waren 17 bis 92 Jahre alt (Mittelwert: 58,7 Jahre, Median: 60 Jahre und die Standardabweichung: 17,8 Jahre). Die Verteilung der Patientendaten der Beobachtungsgrößen gehen aus den Tabellen und Abbildungen der Abschnitte 3.2 und 110. hervor. 3.2 Einzelassoziationen 3.2.1 Genetische Einflußgrößen Die in dieser Studie untersuchten Mikrosatellitenallele von FGF1A, TCRBV6S1, TCRBV6S3, IFNA, CD3D, IL2, TCRDVAJ liegen im Hardy-WeinbergGleichgewicht und TCRBV6S7, TNFa sowie IL5RA nicht (Tabelle 11). Möglicherweise ist die untersuchte Populationsgröße der Mikrosatelliten TCRBV6S7, TNFa und IL5RA bei der hohen Anzahl der jeweiligen Allelpolymorphismen nicht ausreichend. 29 Tabelle 11: Mikrosatelliten mit P-Werten > 0,1 sind im Hardy-Weinberg-Gleichgewicht. Locus p-Wert TCRBV6S3 0,82 CD3D 0,77 TCRBV6S1 0,47 IFNA 0,41 FGF1A 0,41 IL2 0,14 TCRDVAJ 0,13 TNFa 0,05 TCRBV6S7 0,03 IL5RA <0,0009 Betrachtet man die relative Verteilung der jeweiligen Mikrosatellitenallele in Bezug auf den H. pylori-Status, so zeigt sich bei den Mikrosatelliten, welche die Gene TNFa (Tabelle 25), IFNA (Tabelle 27), IL5RA (Tabelle 26), IL2 (Tabelle 28), FGF1A (Tabelle 29), TCRBV6S7 (Tabelle 24), CD3D (Tabelle 31) charakterisieren, keine signifikante Assoziation. Eine Häufung des TCRDVAJ-Allels (GT)25 (p=0,009; pc=0,070; OR=3,33) findet sich bei H. pylori-positiven Patienten (Tabelle 12, Tabelle 30). Die Analyse im T-Zell-Rezeptor Beta-Ketten Variablenregion zeigt statistisch signifikante Assoziationen zwischen dem H. pylori-Status und der relativen Verteilung der folgenden Mikrosatellitenallele TCRBV6S1 (Abbildung 3, Tabelle 22) und TCRBV6S3 (Abbildung 4, Tabelle 23), siehe auch Tabelle 12. Mit erhöhtem Risiko für den positiven H. pylori-Status sind TCRBV6S1-Allel (GT)13 (p=0,003; pc=0,018; OR=2,27) und TCRBV6S3-Allel (GT)11 (p=0,012; pc=0,047; OR=2,23) verknüpft. Als Schutzfaktor stellt sich TCRBV6S1-Allel (GT)9 (p=0,002; pc=0,012; OR=0,26) dar. Die Untersuchung der exonischen Polymorphismen TCRBV6S1A und TCRBV6S1B zeigt, daß der exonische Polymorphismus TCRBV6S1A, im Kopplungsgleichgewicht mit (GT)9-11, sich als Schutzfaktor vor der H. pylori-Infektion (p=0,004, pc=0,024; OR=0,26) und 30 TCRBV6S1B, im Kopplungsgleichgewicht mit (GT)12-14, als Risikofaktor (p=0,055, pc=0,29; OR=1,56) darstellt. Tabelle 12: Mikrosatellitenallele, die mit dem jeweiligen H. pylori-Status korrelieren. Die weniger stark assoziierten Mikrosatellitenallele sind nicht aufgeführt. Test-Paar CHI² H. pylori-Status & Mikrosatellit (p) pc Odds Ratio TCRBV6S1 Allel (GT)13 0,003 0,018 2,27 TCRBV6S1 Allel (GT)9 0,002 0,012 0,26 TCRBV6S3 Allel (GT)11 0,012 0,047 2,23 TCRDVAJ Allel (GT)25 0,009 0,070 3,33 TCRBV6S3 Allel (GT)8 0,021 0,081 0,42 TCRBV6S7 Allel (GT)23 0,053 0,420 0,42 TCRDVAJ Allel (GT)24 0,012 0,092 0,44 TNFa 0,114 0,816 2,16 Allel (GT)18 Abbildung 3: Graphische Darstellung der Phänotypfrequenzen der Allele des Mikrosatelliten TCRBV6S1 in Bezug auf den H. pylori-Status Phänotypenfrequenz [%] Mikrosatellit TCR-BV6S1 & Hp-Status 100 90 80 70 60 50 40 30 20 10 0 Hp-neg (n=187) Hp-pos (n=215) 13 12 11 Allele (GT)n 10 9 31 Abbildung 4: Graphische Darstellung der Phänotypfrequenzen der Allele des Mikrosatelliten TCRBV6S3 in Bezug auf den H. pylori-Status Phänotypenfrequenz [%] Mikrosatellit TCR-BV6S3 & Hp-Status 100 90 80 70 60 50 40 30 20 10 0 Hp-neg (n=187) Hp-pos (n=157) 13 12 11 Allele (GT) n 8 3.2.2 Physiologische Einflußgrößen 3.2.2.1 Geschlecht Das Geschlecht der untersuchten Patienten hat keine statistisch signifikante Assoziation zum H. pylori-Status. Absolute Werte der Häufigkeiten der Geschlechtsverteilung bei den H. pylori-positiven und H. pylori-negativen Patienten sind in Tabelle 13 zusammengestellt. Tabelle 13: Absolute und relative Häufigkeiten der Geschlechtsverteilung in Abhängigkeit vom H. pylori-Status H. Pylori-Status Männlich Weiblich Summe negativ 104 93 197 positiv 101 119 220 negativ [%] 52,8% 47,2% 100,0% positiv [%] 45,9% 54,1% 100,0% 32 3.2.2.2 Alter Die Graphik der Altersverteilung (Abbildung 5) zeigt, daß die Durchseuchungsrate der jungen Menschen (18 bis 40 Jahre) geringer ist als die der älteren (>40 Jahre). Auffällig ist auch, daß sich bei Patienten, die älter als 80 Jahre sind das Verhältnis H. pylori-positiv/negativ angleicht. Individuen älter als 40 Jahre waren (Tabelle 32, Abbildung 5) häufiger mit H. pylori infiziert (p=0,036; pc=0,16; OR=1,71; Tabelle 14) als Personen die 18-40 Jahre alt waren p=0,036; pc=0,16; OR=0,58). Abbildung 5: Relative Häufigkeiten der Patienten in den jeweiligen Altersgruppen in Abhängigkeit vom H. pylori-Status Relative Häufigkeit [%] Altersverteilung & Hp-Status 45 40 35 30 25 20 15 10 5 0 Hp-neg (n=195) Hp-pos (n=220) 18-40 J 41-60 J 61-80 J > 80 J Altersgruppen 3.2.2.3 Geschwisterzahl Betrachtet man die Anzahl der Geschwister (Tabelle 33,Abbildung 6), so zeigt sich erst ab einer Größe von 5 (Anzahl der Geschwister setzt sich zusammen aus dem Patienten selbst, den genetischen sowie den Stief- und Adoptiv-Geschwistern) eine deutliche Assoziation der Geschwisterzahl zur Infektion mit H. pylori (p= 0,021; pc=0,100; OR=1,69; Tabelle 14). 33 Abbildung 6: Relative Häufigkeiten der Geschwisteranzahl in Abhängigkeit vom H. pylori-Status Geschwisteranzahl & Hp-Status Relative Häufigkeit [%] 40 Hp-neg (n=180) 35 30 Hp-pos (n=195) 25 20 15 10 5 0 1 2 3 4 >4 Anzahl-Geschwister 3.2.2.4 Sozialer Status Die Personen wurden entsprechend ihren Berufen in drei verschiedene Bildungsgruppen zugeordnet (Tabelle 34), aufgeteilt in ohne Ausbildung, mit Ausbildung und mit Hochschulausbildung sowie Hausfrauen. Bei Berechnung der Korrelationen zum H. pylori-Status zeigt sich in der Gruppe der Hausfrauen eine statistische Assoziation (Tabelle 14) zum positiven H. pylori-Status (p=0,019; pc=0,074; OR=2,15). Es zeigt sich aber auch, daß die Gruppe ohne Ausbildung gegenüber der Pit Ausbildung und mit Hochschulausbildung eher mit H. pylori infiziert ist (Abbildung 7). 3.2.2.5 Body-Mass-Index Die Patienten wurde anhand des Body-Mass-Index in übergewichtig bzw. normalgewichtig eingestuft. Es findet sich eine statistisch signifikante Assoziation von Übergewicht mit dem positivem H. pylori-Status (p=pc=0,046; OR=1,58; Tabelle 35, Abbildung 18). Entsprechend ist Normalgewicht mit dem negativem H. pylori-Status assoziiiert. 34 Abbildung 7: Relative Häufigkeiten des Ausbildungsstandes der Patienten in Abhängigkeit vom H. pylori-Status Sozialer Status & Hp-Status Relative Häufigkeit [%] 60 Hp-neg (n=180) 50 Hp-pos (n=196) 40 30 20 10 0 Ohne Schul- Hochschul- Hausfrau Ausbildung Abbildung 8: Relative Häufigkeiten der Patienten in den Gruppen normal- bzw übergewichtig in Abhängigkeit vom H. pylori-Status %R %RGG\0 0DDVV VV,QGH[ +S6WDWXV 5HOHODDW L Y H +ÕX I LJLJNNH L W >> +SQHJ Q +SSRV Q 1R U PD PDOJH OJHZZL F K W ÍE H U J H ZL F KW 3.2.2.6 Ethnik Bei der Korrelation des H. pylori-Status mit der ursprünglichen geographischen Herkunft der Patienten (Tabelle 14) wurden europäische den asiatisch-arabischen Ländern gegenübergestellt (Tabelle 36, Abbildung 9). Hierbei zeigt sich, daß die asiatisch-arabische Herkunft einen starken Risikofaktor für die H. pylori-Besiedlung darstellt (pc=0,001; OR=6,14). 35 Abbildung 9: Relative Häufigkeiten der Patienten aus Europa und Asien in Abhängigkeit vom H. pylori-Status Relative Häufigkeit [%] Ethnik & Hp-Status 100 90 80 70 60 50 40 30 20 10 0 Hp-neg (n=198) Hp-pos (n=220) Europa Asien+TR In der Tabelle 14 sind die Faktoren nach der Stärke der Korrelation mit dem H. pylori-Status aufgelistet. Die stärkste Assoziationen haben die ethnische Herkunft, das Alter und das Körpergewicht der Patienten. Die weniger stark assoziierten soziologische Faktoren sind nicht aufgeführt. Tabelle 14: Korrelation soziologischer Faktoren mit dem H. pylori-Status Test-Paar H. pylori-Status CHI² & soziologischer Faktor (p) pc Odds Ratio Asiatisch-arabisch+TR 0,001 0,001 6,14 Body-Mass-Index 0,046 0,046 1,58 Hausfrau 0,019 0,074 2,15 Geschwister>4 0,021 0,100 1,69 Geschwister>2 0,034 0,159 1,56 Geschwister>3 0,034 0,159 1,56 Alter 18 bis 40 Jahre 0,036 0,16 0,58 Alter > 40 Jahre 0,036 0,16 1,71 36 3.2.3 Anamnestische Einflußgrößen Aus der Vorgeschichte der Patienten bekannte Vorerkrankungen (Diabetes mellitus Typ I, kardiovaskuläre Erkrankungen) wurden mit dem H. pylori-Status korreliert. Bei der Gruppe Herzkreislauferkrankungen (Tabelle 38) zeigt sich keine Assoziation zum H. pylori-Status (p=pc=0,69; OR=1,01). Statistisch (Tabelle 15) untersucht wird bei Diabetes mellitus (pc=p=0,063; OR=1,63) eine Assoziation zur Infektion mit H. pylori deutlich. Die Datenverteilung sind in der Tabelle 37 und Abbildung 10 dargestellt. Abbildung 10: Relative Häufigkeiten der Patienten mit und ohne Diabetes mellitus in Abhängigkeit vom H. pylori-Status Relative Häufigkeit [%] Diabetes mellitus & Hp-Status 90 80 70 60 50 40 30 20 10 0 Hp-neg (n=198) Hp-pos (n=202) neg pos Diabetes mellitus Typ II Tabelle 15: Anamnestisch bekannte Vorerkrankung, die am stärksten mit dem jeweiligen H. pylori-Status korreliert. Test-Paar CHI² H. pylori-Status & Anamnese (p) Diabetes mellitus 0,063 pc Odds Ratio 0,063 1,63 37 3.2.4 Einflußgröße Ernährung Anamnestisch erhobene Daten über Ernährungsgewohnheiten bezüglich des Konsums von Obst, Gemüse, Fleisch, Salz und nitrithaltigen Lebensmittel wurden nach der Häufigkeit des Verzehrs untersucht. Bei der Untersuchung der Häufigkeiten des Salz- (Tabelle 43), Fleisch- (Tabelle 42) und Obstkonsums (Tabelle 39, Abbildung 11) in Bezug auf den H. pyloriStatus ergaben sich keine statistisch signifikanten Assoziationen. Abbildung 11: Relative Häufigkeiten der Patienten die wenig, normal oder viel Obst konsumieren in Abhängigkeit vom H. pylori-Status 2EVWNRQVXP+S6WDWXV 5HOHODDWLWLYY H +ÕX ILJ ILJNNHLHLWW > @ +SQHJ Q +SSRV Q Z H Q LJ Q R U PDO 2EVWNRQV NRQVXXP Y LHO Statistisch signifikante Risikofaktoren für eine H. pylori-Besiedlung stellen der normalhäufige Gemüsekonsum (Tabelle 40, Abbildung 12; pc=0,047; OR=1,71) und der seltenere Genuß von besonders nitrithaltigen Lebensmitteln (gepökeltes Fleisch, Wurst, Geräuchertes usw; Tabelle 41, Abbildung 13; pc=0,035; OR=1,89) dar. Wie man sowohl in der Graphik (Abbildung 12) als auch in der Tabelle 16 sieht, scheinen der viel häufigere Verzehr der beiden vorgenannten Lebensmittelgruppen eher protektiv bezüglich H. pylori-Infektion zu wirken – jedoch ist dieser Zusammenhang statistisch nicht signifikant. 38 Abbildung 12: Relative Häufigkeiten der Patienten die wenig, normal oder viel Gemüse konsumieren in Abhängigkeit vom H. pylori-Status Gemüsekonsum & Hp-Status Relative Häufigkeit [%] 70 Hp-neg (n=182) 60 50 Hp-pos (n=201) 40 30 20 10 0 wenig normal viel Gemüsekonsum Abbildung 13: Relative Häufigkeiten der Patienten die wenig, normal oder viel nitrithaltige Lebensmitteln konsumieren in Abhängigkeit vom H. pylori-Status Nitritkonsum & Hp-Status Relative Häufigkeit [%] 80 Hp-neg (n=134) 70 60 Hp-pos (n=171) 50 40 30 20 10 0 wenig normal viel Nitritkonsum Zusammenfassend fand sich bei der Untersuchung des Einflusses von verschiedenen Ernährungsfaktoren, daß vornehmlich die Menge an zugeführtem Gemüse und Nitrit am stärksten mit dem H. pylori-Status korreliert. Tabelle 16 zeigt die Stärke der Assoziationen. Die weniger stark assoziierten Ernährungsfaktoren sind nicht aufgeführt. 39 Tabelle 16: Assoziation von Gemüse-, Nitrit-Konsum mit dem H. pylori-Status Test-Paar CHI² H. pylori-Status & Ernährung (p) pc Odds Ratio Gemüse (normal) 0,016 0,047 1,71 Nitrit (wenig) 0,012 0,035 1,84 Gemüse (viel) 0,044 0,126 0,66 Nitrit (viel) 0,042 0,121 0,70 3.2.5 ÖGD-Befunde und H. pylori-Infektion Bei der ÖGD makroskopisch erhobene Befunde des Magens und des Duodenums wurden mit dem H. pylori-Status korreliert. 3.2.5.1 Gastroskopie Aus der Auswertung der makroskopischen Gastroskopie-Befunde der jeweiligen Untersucher lassen sich keine signifikanten Korrelationen zum H. pyloriStatus entnehmen. Für den Magen sind die entsprechenden Befunde und ihre Häufigkeiten in Abbildung 14 und Tabelle 44 dargestellt. Abbildung 14: Relative Häufigkeiten der verschiedenen Gastroskopiebefunde in Abhängigkeit vom H. pylori-Status; Erosiv= erosives Schleimhauterythem, Ulcus = Ulcus ventriculi. Relative Häufigkeit [%] Gastroskopie & Hp-Status 70 Hp-neg (n=167) 60 50 Hp-pos (n=177) 40 30 20 10 0 o.B. Mukosaerythem Erosiv Ulcus Magenbefund 40 3.2.5.2 Duodenoskopie Im Gegensatz zu den Gastroskopiebefunden wurde eine statistisch sehr signifikante Assoziation zwischen dem positiven H. pylori-Status und Ulcus duodeni gefunden (p=0,002; pc=0,008; OR=4,03), (Tabelle 17, Abbildung 15). Die anderen Daten (Tabelle 45) aus der Duodenoskopie sind nicht signifikant. Abbildung 15: Relative Häufigkeiten der verschiedenen Duodenoskopiebefunde in Abhängigkeit vom H. pylori-Status; Erosiv = erosives Schleimhauterythem, Ulcus = Ulcus duodeni. Relative Häufigkeit [%] Duodenoskopie & Hp-Status 90 80 70 60 50 40 30 20 10 0 Hp-neg (n=169) Hp-pos (n=179) o.B. Mukosaerythem Erosiv Ulcus Duodenalbefund Tabelle 17: Die am stärksten mit dem jeweiligen H. pylori-Status korrelierenden Oesophagogastroduodenoskopie-Befunde. Weniger stark assoziierte Befunde sind nicht aufgeführt. Test-Paar CHI² H. pylori-Status & ÖGD-Befund (p) pc Odds Ratio Ulcus duodeni 0,002 0,008 4,03 Erosives Schleimhauterythem 0,052 0,192 0,59 41 3.2.6 Histologie-Befunde und H. pylori Die histologischen Befunde wurden der Sydney-Klassifikation der Gastritis (Riede et al., 1993) angelehnt, getrennt nach Antrum- (Tabelle 46) und Corpus(Tabelle 47) Biopsien. Die statistische Auswertung zeigt, daß die Assoziationen zwischen dem Status H. pylori-negativ und den histologischen Normalbefunden (o.B.) für Antrum und Corpus hoch signifikant sind (Tabelle 18, p ≤ 0,0009; pc ≤ 0,001; OR=0,03). Besonders anhand der graphischen Darstellung (Abbildung 16, Abbildung 17) wird deutlich, daß zunehmender Aktivitätsgrad der Gastritis mit einer H. pyloriInfektion assoziiert ist (für Antrum: pc ≤ 0,0009; OR=2,290; für Corpus: pc ≤ 0,0009; OR=2,330; Tabelle 18). Die C-Gastritis ist mit negativem H. pylori-Status assoziert (für Antrum: p ≤ 0,0009; pc ≤ 0,001; OR=0,03). Insgesamt zeigen sich gute Übereinstimmungen zwischen den histologischen Befunden für Antrum und Corpus in Bezug auf den H. pylori-Status, abgesehen von dem niedrigeren Aktivitätsgrad der H. pylori-assoziierten chronischen Gastritis im Corpusbereich – gut sichtbar in Abbildung 16 und Abbildung 17. Abbildung 16 Relative Häufigkeiten der verschiedenen Histologiebefunde des Antrums in Abhängigkeit vom H. pylori-Status Relative Häufigkeit [%] Antrum-Histologie & Hp-Status 40 35 30 25 20 15 10 5 0 Hp-neg (n=129) g ch ro n ni c h c h o .B t g r o ak ch n g t iv m r o n ak c h m t iv m r o ak c h n g t iv m r o n ak c h m t iv h r o n akt c h h iv h r o ak ch n ti ro g a v h n k c h m t iv r o ak n t h iv C- ak G a s t iv M a g M A t r it e n LT is ka ´ o rz m in om Hp-pos (n=186) Antrum-Histologie 42 Abbildung 17: Relative Häufigkeiten der verschiedenen Histologiebefunde des Corpus in Abhängigkeit vom H. pylori-Status Corpus-Histologie & Hp-Status Hp-neg (n=125) Hp-pos (n=180) ch ro n g n ic o c h . g hr o t a B. ch n kt g i g r o n ak v ch m t i m ro a v c n kt m h r o h a iv ch n kt m r o g a iv ch n m kt i h r o n ak v ch ti h ro h a v ch n kt g iv h r o n ak ch m t i ro a v n kt C- h a iv G kt a s iv M ag M t r i e n AL tis ka T´o rz m in om Relative Häufigkeit [%] 50 45 40 35 30 25 20 15 10 5 0 Corpus-Histologie Tabelle 18: Histologiebefunde, die am stärksten mit dem jeweiligen H. pyloriStatus korrelieren. Die weniger stark assoziierten Histologiebefunde sind nicht aufgeführt. Test-Paar CHI² (p) pc Odds Ratio H. pylori-Status & Histologie C-Gastritis (A) ≤ 0,0009 ≤ 0,001 0,03 chron nicht aktiv(A) ≤ 0,0009 ≤ 0,001 0,19 o.B.(A) ≤ 0,0009 ≤ 0,001 <<1 o.B.(C) ≤ 0,0009 ≤ 0,001 0,03 g chron g aktiv(C) ≤ 0,0009 ≤ 0,001 7,64 m chron m aktiv(A) ≤ 0,0009 ≤ 0,001 22,0 m chron m aktiv(C) ≤ 0,0009 ≤ 0,001 8,64 h chron m aktiv(A) ≤ 0,0009 ≤ 0,001 >>1 chron nicht aktiv(C) 0,001 0,014 0,41 m chron g aktiv(A) 0,002 0,026 3,38 m chron g aktiv(C) 0,002 0,028 7,69 C-Gastritis(C) 0,003 0,041 <<1 43 3.2.7 Einflußgröße Droge Anamnestisch erhobene Daten über Alkohol- und Nikotingenuß sowie Medikamenteneinnahme wurden mit dem H. pylori-Status korreliert. Die Auswertung ergibt für Alkohol- (Tabelle 49), Nikotinkonsum (Tabelle 48, Abbildung 18), Antibiotika (Tabelle 51), NSAR (Tabelle 50) keine statistisch signifikante Häufung mit dem positiven bzw. negativen H. pylori-Status (Tabelle 19). Abbildung 18: Relative Häufigkeiten der Patienten die 0 bis 7, 8 bis 15 oder mehr als 15 Zigaretten pro Tag rauchen in Abhängigkeit vom H. pylori-Status Zigarettenkonsum & Hp-Status Relative Häufigkeit [%] 80 Hp-neg (n=186) 70 60 Hp-pos (n=205) 50 40 30 20 10 0 0-7 8 - 15 > 15 Zigaretten/d Tabelle 19: Drogeneinflüsse, die am stärksten mit dem jeweiligen H. pyloriStatus korrelieren. Die weniger stark assoziierten Drogeneinflüsse sind nicht aufgeführt. Test-Paar CHI² H. pylori-Status & Drogen (p) pc Odds Ratio 8-15 Zigaretten/d 0,053 0,151 2,01 >15 Zigaretten/d 0,083 0,229 0,66 44 3.3 Vergleich der Risiken der verschiedenen Einflußfaktoren Um die Stärke des Einflusses der verschiedenen Faktoren wie die der Genetik, physiologischen Daten, Vorerkrankungen und Ernährung in Bezug auf die Prävalenz des positiven H. pylori-Status zu untersuchen, betrachten wir die Oddsratio-Werte als Parameter für das Risiko- bzw. Schutzpotential der statistisch signifikanten Merkmale. Die Größe der Odds-ratios gibt die Stärke für das Risiko- bzw. Schutzpotential wieder. In Tabelle 20 sind die Odds-ratios der untersuchten statistisch signifikanten Beobachtungsgrößen in Bezug auf den positiven H. pylori-Status der Patienten des Studienkollektivs aufgeführt. Tabelle 20: Odds-ratios der untersuchten statistisch signifikanten Beobachtungsgrößen in Bezug auf den positiven H. pylori-Status Odds-ratio Variable Merkmal Genetik TCRBV6S1 Allel (GT)13 2,27 TCRBV6S3 Allel (GT)11 2,23 TCRBV6S1 Allel (GT)9 0,26 Physiologische Daten Asiatisch-arabisch+TR 6,14 Ernährung Body-Mass-Index 1,58 Gemüse (normal) 1,71 Nitrit (wenig) 1,84 Unter anderem fand sich bei den Beobachtungsgrößen Geschlecht, Herzkreislauferkrankungen, Salzkonsum, Fleischkonsum, Alkoholeinnahme, kein bis niedriger Zigarettenkonsum, Mikrosatellitenallelverteilung bei TNFa, IFNA, IL5RA, IL2, FGF1A, TCRBV6S7 und CD3D keine Assoziation zum H. pyloriStatus der Patienten. 45 4 Diskussion Die Infektion mit H. pylori ist ein multifaktorielles Geschehen. In dieser Studie wurden verschiedene mögliche Ursachen, warum diese Infektion nur bei bestimmten Personen zur Infektion mit H. pylori führt und bei anderen nicht, untersucht. Als besondere Einflußgrößen auf den H. pylori-Status fanden wir folgende: 4.1 Mikrosatellitenanalyse Für die intakte Immunantwort des Körpers sind Cytokine, Immunmediatoren und -Rezeptoren unabdingbar. Insbesondere kommt bei einer chronischen Infektion, wie bei der Besiedlung der Magenmucosa mit H. pylori, dem Zusammenspiel der einzelnen Immunfaktoren eine besondere Rolle zu. 4.1.1 T-Zell-Rezeptorgene In dieser Studie wurden die Allele der bekannten polymorphen Mikrosatelliten TCRBV6S1, TCRBV6S3, TCRBV6S7, TCRDVAJ (s.o.) im T-Zell-Rezeptorgenbereich untersucht. Die Stärke der Expression des TCR´s auf den peripheren T-Lymphozyten wird durch Polymorphismen in den TCRBV-Genabschnitten beeinflußt (Vissinga et al., 1994). Wie Charmley et al. (1994) zeigen konnte, korrelieren Längenunterschiede des im ersten Intron gelegenen TCRBV6S1-Mikrosatelliten mit dem funktionellen und nicht funktinellen Allelel des exonischen Polymorphismus, dem TCRBV6S1A und –B. Der Polymorphismus im TCRBV6S1-Gen ist durch die Substitution fünf einzelner Basenpaare im codierenden Abschnitt und zwei im Promotorbereich charakterisiert und resultiert jeweils in Aminosäureaustausch im translatierten Produkt. Das TCRBV6S1A-Allel ist im Kopplungsgleichgewicht mit den Mikrosatellitenallelen (GT)9-11 und TCRBV6S1B mit (GT)12-14 (Gomolka et al., 1994). Wie Luyrink et al. (1993) zeigen konnten, ist bei den Individuen, die homozygot für das Allel TCRBV6S1B sind, keine TCRBV6S1B mRNA - Expression in den peripheren Lymphozyten nachweisbar. Die Erklärung hierfür liegt darin, daß nicht produktive TCR-Anordnungen 46 zum vorzeitigen Tod der T-Zelle führen. In der eigenen Studie haben wir gezeigt, daß TCRBV6S1 Allel (GT)13 ein Risikofaktor für die Infektion mit H. pylori darstellt (p=0,003; pc=0,018; OR=2,27), wahrscheinlich als eine Folge der insuffizienten TCR-Funktion und damit der abgeschwächten Stimulation der zellulären Immunantwort. In Gegensatz dazu ist das TCRBV6S1-Allel (GT)9 im Kopplungsungleichgewicht mit TCRBV6S1A und protektiv (p=0,002; pc=0,012; OR=0,26). Der exonische Polymorphismus TCRBV6S1A, im Kopplungsungleichgewicht mit (GT)9-11, zeigt sich als Schutzfaktor vor der H. pylori-Infektion (p=0,004; pc=0,024; OR=0,26) und TCRBV6S1B, im Kopplungsungleichgewicht mit (GT)12-14, als Risikofaktor (p=0,29; pc=0,055; OR=1,56). Biallelischer exonischer Polymorphismus TCRBV6S7A und TCRBV6S7B des kodierenden TCRBV6S7-Genabschnitts, die im Kopplungsungleichgewicht mit dem intronischen Mikrosatelliten (GT)n stehen [(GT)13-17 bei Allel A und (GT)18-28 bei Allel B)] wurden bereits von Li et al. (1990) und Gomolka et al. (1994) beschrieben. Jedoch sind die Auswirkungen dieses Polymorphismus auf die Erkennung der MHC-II gekoppelten Antigenerkennung bisher nicht geklärt. Exonische Polymorphismen, wie sie bei TCRBV6S1 und TCRBV6S7 beschriebenen wurden, konnten für das Gensegment TCRBV6S3 bisher nicht nachgewiesen werden. In dieser Studie konnte das TCRBV6S3 Allel (GT)11 (p=0,012; pc=0,047; OR=2,23) als protektiver Faktor bezüglich einer H. pylori-Infektion nachgewiesen werden und damit wäre ebenfalls eine funktionelle Bedeutung des Mikrosatellitenallels zu fordern. Mit dieser Arbeit konnte die wesentliche Bedeutung, der im Intron gelegenen TCR-Mikrosatellitenallele, in Bezug auf eine H. pylori-Infektion weiter untermauert werden. T-Zellen mit dem / -TCR befinden sich bei einer chronischen Infektion bzw. Entzündung in veränderter Anzahl und Zusammensetzung im Entzündungsbereich. In der bronchoalveolären Lavage von mit Tuberkulose infizierten Patienten sind die /-T-Zellen gegenüber gesunden Menschen vermindert (Li, B. et al., 1996). Bei Patienten mit chronisch entzündlichen Darm- und Magenerkrankungen sind sie vermehrt (Mc Vay et al., 1997; Engstrand et al., 1991), jeweils in veränderter Komposition der Allele. In dieser Studie zeig das TCRDVAJ Allel (GT)25 (p=0,009; pc=0,070; OR=3,33) eine Häufung bei dem positiven H. pylori-Status. Dieser Befund wirft die Frage auf ob T-Zellen mit 47 dem /-TCR funktionelle Unterschiede aufweisen und damit eine mögliche Bedeutung in der Chronifizierung einer H. pylori-Infektion des Magens besitzen. 4.1.2 TNFa Wie oben dargestellt, ist die Immunantwort abhängig von der Interaktion zwischen TCR, Antigen und MHC-II Molekül. Neben den Allelen des TCR bestimmen auch die Allele des MHC-II die Stärke der Abwehrstimulation (Pociot et al., 1993). Die gleiche Arbeitsgruppe konnte sowohl die Assoziation zwischen den Allelen des MHC-II und einigen Mikrosatellitenallelen der HLARegion zeigen als auch die gesteigerte Sekretion von TNF-α bei bestimmten Allelen des Mikrosatelliten TNFa. Kunstmann et al. (1999) konnten nachweisen, daß das Allel TNF1/TNF1 des Promoterpolymorphismus TNF-308 des TNF-.Gens einen Risikofaktor für H. pylori-positive weibliche Patienten darstellt, ein Ulcus duodeni zu entwickeln. Jedoch kann in der eigenen Studie keine Assoziation zwischen den TNFa-Mikrosatellitenallelen und dem positiven bzw. negativen H. pylori-Status der untersuchten Individuen nachgewiesen werden. Die stärkste, jedoch statistisch nicht signifikante Häufung, findet sich bei TNFaAllel (GT)18 und dem postivem H. pylori-Status (p=0,114; pc=0,816; OR=2,16). Bei 14 verschiedenen TNFa-Allelen, die in dieser Studie nachgewiesen wurden, liegt die Erklärung für die Schwäche der Assoziationen zu dem H. pylori-Status möglicherweise an der für genetische Untersuchungen zu kleinen Größe des Patientenkollektivs. 4.1.3 CD3D, FGF1A, IFNA, IL2, IL5RA Nach der Datenlage dieser Studie zeigt kein Allelel der Mikrosatelliten CD3D, FGF1A, IFNA, IL2 und IL5RA eine Assoziation zur Infektion mit H. pylori. Andere Studien, die ebenfalls diese Fragestellung untersucht haben gibt es nicht. Möglicherweise stehen diese Mikrosatelliten nicht in einem funktionellen Zusammenhang in Bezug auf eine Immunreaktion und wären somit auch nicht mit dem H. pylori-Status assoziiert. 48 4.2 Physiologische Einflußgrößen 4.2.1 Geschlecht Wie bereits in der Einleitung dargestellt, sind bisher in der Literatur keine geschlechtsgebundenen Assoziationen mit dem H. pylori-Status beschrieben. Auch in dieser Studie ist die Verteilung des H. pylori-Status (postiv/negativ) zwischen männlichen und weiblichen Patienten gleichmäßig und zeigt keine statistisch signifikanten Auffälligkeiten. Jedoch konnte von Kunstmann et al. (1999) gezeigt werden, daß bei der Entstehung des H. pylori-assozierten Ulcus duodeni das weibliche Geschlecht in Verbindung mit den Genotyp TNF1/TNF1 des Promoterpolymorphismus TNF-308 des TNF-.-Gens einen Risikofaktor darstellt. Somit wird deutlich, daß das Geschlecht nicht mit einem bestimmten H. pylori-Status korreliert. Jedoch kann nach erfolgter Infektion mit H. pylori und dem Vorliegen des oben genannten Genotyp des TNF-.-Gens das weiblichen Geschlecht einen Ulcus doudeni begünstigen. Diese Feststellung unterstreicht den multifaktoriellen Charakter der H. pylori-assoziierten Erkrankung Ulcus duodeni. 4.2.2 Alter Die Korrelation zwischen dem H. pylori-Status und der Zugehörigkeit zu einer bestimmten Altersgruppe zeigt eine Zunahme der Prävalenz der H. pylori-Infektion mit steigendem Alter des Menschen (Youn et al., 1988). In der eigenen Studie wird ebenfalls deutlich, daß Individuen älter als 40 Jahre im Vergleich zu jünger als 40 Jahre häufiger mit H. pylori infiziert sind (p=0,036; pc=0,16; OR=1,71. Betrachtet man die Atersverteilung in Bezug auf den H. pylori-Status der Personen älter als 40 Jahre (Abbildung 5), so zeigt sich ein zunehmendes Angleichen der Anzahl der H. pylori-positiven und -negativen Personen. Ab dem Alter von 80 Jahren findet sich kein Unterschied mehr in der Anzahl der Personen mit dem positiven bzw. negativen H. pylori-Status. Die Erklärung des häufigeren negativen H. pylori-Nachweises mag darin liegen, daß mit zunehmendem Alter die Magensäureproduktion abnimmt (Korkushko et al., 1992). Daraus folgender pH-Anstieg begünstigt die Besiedlung der Magenmukosa mit anderen Bakterien (Stockbruegger, 1985), wodurch sowohl die Besiedlung mit H. pylori abnimmt als auch dessen Nachweis erschwert ist. 49 4.2.3 Geschwisteranzahl In unserer Studie bestätigten sich die bisher in der Literatur beschriebenen Beobachtungen, daß zunehmende Geschwisteranzahl und damit auch der Familiengröße mit dem positiven H. pylori-Status korreliert (Elitsur, Y. et al., 1998). Durch die Größe der Familie und den engen Kontakt der Familienangehörigen miteinander findet leichter eine Mensch-zu-Mensch Ausbreitung von H. pylori statt (Oderda et al., 1997). Die Abnahme der Familiengröße in der BRD (Statistisches Bundesamt, 1950 - 1997) und die Abnahme der Kinderzahl je Elternpaar in Vergleich zu Anfang des Jahrhunderts (Nave-Herz, 1994) wäre auch eine mögliche Erklärung für die Zunahme der Prävalenz der H. pylori-Infektion mit steigendem Alter. 4.2.4 Sozialer Status Bei der Untersuchung des sozialen Status ist die hohe H. pylori-Besiedlung der Hausfrauen besonders auffällig (pc=0,074; OR=2,15) und kann im Zusammenhang stehen mit den Schlußfolgerungen der Studie von Oderda et al. (1997), daß das Bakterium von Mensch zu Mensch (fäkal-oral und/oder oral-oral) übertragen wird. Die Gruppe der Hausfrauen, die durch ihre Tätigkeiten wie Kochen, Spülen, Putzen, Wäschewaschen usw. sehr engen Kontakt mit Körpersekreten bzw. Exkrementen der im gleichen Haushalt lebenden Menschen haben, sind sicherlich dadurch stärker als Menschen, bei denen dies nicht der Fall ist, den Erregern ausgesezt, so daß, wie bei Endoskopikern nachzuweisen ist (Matysiak-Budnik et al., 1996 & 1997; Lu et al., 1997), eine erhöhte Prävalenz durch eine Neuinfektion auch im höheren Alter entstehen kann. Wie bereits in der Einleitung dargestellt (Abbildung 4) und auch in dieser Studie nachgewiesen wurde, ist die Prävalenz der H. pylori-Infektion besonders bei Menschen aus dem Mittelmeerraum und den Entwicklungsländern hoch. Möglicherweise ist dies auch auf die besondere Rolle der Frauen, die in diesen Kulturen häufig den Haushalt führen, zurückzuführen. Diese sind der Mittelpunkt einer zumeist großen Familie mit zahlreichen Kindern, die häufig mit anderen Kindern Umgang haben und somit verschiedenen Übertragungsmöglichkeiten ausgesetzt sind. Zusätzlich muß bedacht werden, daß aufgrund mangelhafter hygienischer Bedingungen bei der Nahrungsmittelzubereitung (Begue et al., 1998) und im 50 Haushalt allgemein, z.B. wenig Wasser, essen aus dem gleichen Teller, geringe Benutzung von Besteck, fehlende Spül- und Waschmaschinen etc., eine höhere Übertragungswahrscheinlichkeit von H. pylori besteht. In diesem Zusammenhang ergibt sich die Notwendigkeit für die Durchführung neuer Studien bezüglich der Gruppe der Hausfrauen als hochexponierte und damit auch mögliche Erregerquelle für die Verbreitung von H. pylori. Hierbei könnte z.B. in einem größeren Kollektiv von Hausfrauen die Haushaltsausstattung sowie die Familiengröße in Bezug auf den H. pylori-Status untersucht werden und ggf. zusätzlich mit einer Kontrollgruppe von berufstätigen Frauen verglichen werden. Die Patienten ohne Ausbildung sind gegenüber denen mit Ausbildung bzw. Hochschulausbildung eher H. pylori-positiv (Abbildung 7). Diese Befunde stimmen mit den Studienergebnissen von Malaty et al. (1996) und Rosenstock et al. (1997) gut überein. Eine Erklärung für diesen Umstand könnte darin liegen, daß die Familien mit höherem Bildungsniveau eher kleiner sind und die hygienischen Verhältnisse besser sind. 4.2.5 Body-Mass-Index In dieser Studie konnte ebenfalls gezeigt werden, daß neben diesen Faktoren der körperliche Zustand des Wirtes auch eine wichtige Rolle spielt. Die Übergewichtigen sind statistisch signifikant (pc=0,046; OR=1,58) häufiger als die normalgewichtigen Menschen mit H. pylori infiziert. Dieser Befund bestätigt das Untersuchungsergebnis der Studie von The EUROGAST Study Group, welcher 1993 veröffentlicht wurde. Diese Assoziation kann möglicherweise unter anderem darauf zurückgeführt werden, daß in unserer untersuchten Patientengruppe die Übergewichtigen häufig Diabetiker (pc≤0,0009; OR=2,79; 95% Conf. Interval: 1,64-4,73) sind. In einer Studie konnte Persico et al. (1996) zeigen, daß Diabetiker (Diabetes mellitus Typ II) und autonomer Neuropathie des Magens mit konsekutiver Magenmotilitätsstörung eine viel höhere Prävalenz einer H. pylori-Infektion besitzen als ohne autonome Neuropathie. Zum gleichen Ergebnis kommen auch Perdichizzi et al. (1996) in ihrer Studie, in der sie bei übergewichtigen Diabetikern eine Assoziation mit dem positiven H. pyloriStatus nachgewiesen haben. Auch sie sehen in der eingeschränkten Magenmotilität einen wichtigen fehlenden Schutzmechanimus des Magens. 51 4.2.6 Ethnik Wie bereits in der Einleitung dargestellt (Tabelle 2), spielt die Herkunft einer Person eine wichtige Rolle bezüglich der Pävalenz einer H. pylori-Infektion. In unserer Studie konnte bestätigt werden, daß die Menschen aus dem Mittelmeerraum und Entwicklungsländern gegenüber den anderen Ländern einem höheren Risiko ausgesetzt sind, mit H. pylori infiziert zu sein. Hierbei zeigt sich, daß die asiatisch-arabische Herkunft einen starken Risikofaktor für die H. pylori-Besiedlung darstellt (pc=0,001; OR=6,14). 4.3 Anamnestische Einflußgrößen Neben den physiologischen Daten finden sich bei den Vorerkrankungen ebenso Assoziationen, die den Aspekt einer multifaktoriellen Erkrankung unterstreichen. 4.3.1 Diabetes mellitus Bei der Auswertung der anamnestisch gewonnenen Daten dieser Studie bestätigt sich, was die Arbeitsgruppe Oldenburg et al. (1996) für beide DiabetesHaupttypen festgestellt hatte: positiver H. pylori-Status kommt bei Diabetikern häufiger vor (pc=0,063; OR=1,63). Wie bereits oben dargestellt, konnte in verschieden Studien (Persico et al., 1996; Perdichizzi et al., 1996; Gentile et al., 1998) der Nachweis erbracht werden, daß die Hauptursache für diese Korrelation die Schädigung des autonomen Nervensystems (Classen et al., 1994-d) ist. Die Alteration der gastralen Innervation verursacht eine Magenentleerungsstörung, wodurch möglicherweise die Besiedlung mit H. pylori begünstigt wird. 4.3.2 Herzkreislauferkrankungen In der Literatur wird die Rolle von H. pylori in Bezug auf koronare Herzerkrankung (KHK) und arterielle Hypertonie kontrovers diskutiert. Die meisten Studien konnten einen Zusammenhang mit einer H. pylori-Infektion nicht nachweisen (Strachan et al., 1998; Ossewaarde et al., 1998). Die Datenlage der eigenen Studie zeigt ebenfalls, daß der H. pylori-Status in Bezug auf Herzkreislauferkrankungen (pc=0,69; OR=1,01) keine Assoziation zeigt. 52 4.4 Ernährungsfaktoren In dieser Studie wurden einige nutritive Einflußfaktoren untersucht, um deren Bedeutung für die Besiedlung der Magenschleimhaut mit H. pylori zu betrachten. 4.4.1 Salzkonsum Wie in der Literatur dargestellt wird, mißt man dem Salzkonsum eine Bedeutung in Hinsicht auf den H. pylori-Status bei. Verzehr von salzigem Essen wird mit erhöhtem Risiko einer H. pylori-Infektion in Verbindung gebracht (Tsugane et al., 1994, Chang-Claude et al., 1995). Eine andere Arbeitsgruppe (Shinchi et al., 1997) sowie die Datenlage in unserer Studie zeigen jedoch keine Assoziation zwischen dem Salzkonsum und dem H. pylori-Status. Mögliche Erklärung der unterschiedlichen Studienergebnisse mag darin liegen, daß die Ernährungsgewohnheiten nach verschiedenen Protokollen erfaßt wurden. Weiterhin muß man berücksichtigen, daß ein anamnestisch erhobener Befund subjektiver Beurteilung entspricht und damit sehr fehleranfällig ist. 4.4.2 Nitritkonsum Mit geräucherten und gepökelten Lebensmitteln nimmt man eine erhöhte Menge von Nitriten zu sich. In verschiedenen Studien wird neben anderen die Nitriteinnahme als fördernder Faktor bei der Entstehung von Magenkarzinom besprochen (Sierra et al., 1991; Palli et al., 1997). Der Zusammenhang von Nitritkonsum und H. pylori-Status ist in den bisher veröffentlichten Studien nicht besprochen. In dieser Studie finden wir im Gegensatz zur Entstehung des Magenkarzinoms eine inverse Assoziation von Nitritkonsum und positivem H. pylori-Status. Hieraus ist eine unterschiedlicher Einfluß auf die Pathogenese des Magenkarzinoms und der H. pylori-Infektion zu fordern. Wie bereits in der Literatur dargestellt, wird oral aufgenommenes Nitrit im Magen in Verbindung mit sekundären Aminen und Amiden in Nitrosamine umgewandelt (Choi et al., 1987). Nitrosamine stellen einen Risikofaktor für die Entstehung des Magenkarzinoms dar (La Vecchia et al., 1995). Der erhöhte Konsum von Nitrit, z.B. in Form von gepökeltem Fleisch kann ebenfalls zu Verringerung der H. pyloriBesiedlung führen, da Nitrit im sauren Mileu des Magens auch bakterizide Wirkung besitzt (Klebanoff et al., 1993). 53 4.4.3 Fleischkonsum Es besteht kein Zusammenhang zwischen der verzehrten Fleischmenge und dem H. pylori-Status (Webberley et al., 1992). Andere Untersuchungen sind konform mit dem eigenen Studienergebnis. Fleischkonsum stellt keinen Risikofaktor für eine H. pylori-Besiedlung dar. Eine mögliche Erklärung für fehlende Korrelation des Fleischkonsums zum H. pylori-Status könnte die Verwendung von Pökelsalz (Natriumnitrit) in der Fleischindustrie sein. Das als Konservierungsmittel und Lebensmittel-Farbstoff verwendete Pökelsalz könnte wie oben dargestellt im Magen keimreduzierende Wirkung besitzen und somit die H. pylori-Besiedlung eher verhindern. Da nicht alle Fleischprodukte gepökelt sind, entsteht somit bei erhöhtem Fleischkonsum auch nicht zwingenderweise ein protektiver Effekt in Bezug auf eine H. pylori-Besiedlung. 4.4.4 Obst- und Gemüsekonsum Die protektive Wirkung des häufigen Verzehrs von Gemüse (Abbildung 12) und Obst vor der H. pylori-Infektion (Goodman et al., 1997) stellt sich auch in den Daten dieser Studie dar. Die normal-häufige Aufnahme von Obst (Abbildung 11) und Gemüse (Abbildung 12, pc=0,047; OR=1,71) stellt eher einen Risikofaktor bezüglich des positiven H. pylori-Status dar. Wie Goodmann et al. (1997) bereits nachweisen konnten, liegt die mögliche Ursache der Protektion des Gemüse- und Obstkonsums vor einer H. pylori-Infektion in der Aufnahme von Vitamin C und Beta-Carotin. 4.4.5 Kommentar zur Beobachtungsgröße Ernährung Die unterschiedlichen Aussagen der verschiedenen Studien über die nutritiven Faktoren verdeutlichen die Problematik der Erfassung und Standardisierung der Daten und damit das Fehlen einer starken Aussagefähigkeit. Die Kriterien, die Einteilungen der Variablen und die Zeitspanne der Datenerfassung sind je nach Arbeitsgruppe sehr unterschiedlich. Auch die Ergebnisse dieser Studie sind daher mit Vorsicht zu bewerten. Die Datenerfassung beruht letztendlich auf der Aussage eines Menschen und ist damit stark subjektiv. Objektiver, wenngleich auch abhängig vom Untersucher, sind Befunderhebungen bei einer 54 Oesophagogastroduodenoskopie oder Beurteilung von histologischen Präparaten. 4.5 ÖGD / Histologie In der Literatur sind Verbindungen zwischen der H. pylori-Infektion und Erkrankungen des oberen Magendarmtraktes, z.B. Gastritis, Ulcus ventriculi und Ulcus duodeni, dargestellt. Die Stärke der Assoziationen sind in der Tabelle 21 dargestellt. Eine ausreichende Anzahl von Patienten mit MALT-Lymphom und Magenkarzinom sind in dem eigenen Patientenkollektiv für eine Auswertung nicht vorhanden. Tabelle 21: Eine Übersicht über die Stärke der Assoziation von gastroduodenalen Erkrankungen mit H. pylori-Infektion – Vergleich von Literatur mit eigenen Daten. Diagnose H. pylori Referenz -positiv Histologisch chronisch aktive Gastritis Ulcus ventriculi Ulcus duodeni Histologisch oB (Antrum & Corpus: oB) 96,6 % Kang et al., 1991 63,6 % Li et al., 1991 61,7 % Ayyagari et al., 1990 86,6 % Eigene Daten 76,9 % Kang et al., 1991 71,9 % Li et al., 1991 84,6 % Ayyagari et al., 1990 65,4 % Eigene Daten 100,0 % Kang et al., 1991 73,1 % Li et al., 1991 82,8 % Ayyagari et al., 1990 79,3 % Eigene Daten 6,3 % Kang et al., 1991 8,2 % Li et al., 1991 0,0 % Eigene Daten 55 In der Zusammenstellung wird deutlich, daß es keine großen Unterschiede zwischen den jeweiligen Studien-Kollektiven gibt. Diese Übereinstimmungen verdeutlichen eine Mitverursachung der jeweiligen Erkrankungen durch H. pylori, wenn auch in unterschiedlichem Ausmaß. Weiterhin ist der insgesamt stärkere Entzündungsgrad in der Antrum- gegenüber der Corpusmucosa auffällig (Abbildung 16, Abbildung 17). 4.6 Drogenkonsum Die statistischen Auswertungen zeigen keine Abhängigkeit des H. pylori-Status von der Menge der Alkoholeinnahme, wie auch durch andere Arbeitsgruppen bereits nachgewiesen worden ist (Tsugane et al., 1994; Shinchi et al., 1997), im Gegensatz zu der Arbeitsgruppe Brenner et al. (1997), die eine protektive Wirkung des Alkoholkonsums in Bezug auf eine Infektion mit H. pylori nachweisen konnte. In der Literatur dominiert die Auffassung, daß zwischen dem positiven H. pyloriStatus und Rauchen kein Zusammenhang existiert (Lin et al., 1998; Cilla et al., 1997). In dieser Studie sieht man eine deutliche, statistisch jedoch nicht signifikante Abhängigkeit zwischen der konsumierten Nikotinmenge und dem H. pylori-Status (Tabelle 19). Diese Feststellung könnte ihre Erklärung in der mannigfaltigen Wirkung von Nikotin auf die Magenschleimhaut finden. So kann eine mittelstarke Nikotinbelastung zu verminderten Durchblutung der Magenschleimhaut führen, die Schutzfunktionen beeinträchtigen und die Körperabwehr reduzieren. So können Schleimhautläsionen leichter entstehen (Classen et al., 1994-e) und dadurch eher eine Besiedlung mit H. pylori ermöglichen. Im Zigarettenrauch sind neben Nikotin auch andere toxische Substanzen wie polyzklische Alkohole und Phenole (Classen et al., 1994-e) enthalten, die bakterizid sind (Mutschler et al., 1991). Sowohl durch das verschlucken von Zigarettenrauch als auch vom Sputum, welches durch das Flimmerepithel aus den Bronchen befördert wird, gelangen diese toxischen Inhaltsstoffe in den Magen. Bei starkem Zigarettenkonsum könnte die Konzentration dieser Substanzen ausreichen, um die Besiedlung der Magenmucosa mit H. pylori zu reduzieren. 56 4.7 Zusammenfassung In dieser Studie wurde der Einfluß verschiedener Größen (Eßgewohnheiten, Zigaretten-, Alkohol-, Medikamentenkonsum, Beruf, Geschwisteranzahl, physiologische Daten, ethnische Herkunft und genetische Marker des Immunsystems) auf die Prävalenz des H. pylori-Status zu untersucht. Hierbei zeigte sich insbesondere, daß die Mikrosatellitenallele TCRBV6S1-Allel (GT)13, TCRBV6S3-Allel (GT)11, der exonische Polymorphismus TCRBV6S1A, Ulcus duodeni, Übergewicht, asiatisch-arabische Herkunft, niedrige Nitritaufnahme und normal häufiger Gemüsekonsum statistisch signifikant mit positivem H. pylori-Status assoziiert sind. Eine statistisch signifikante Assoziation mit negativem H. pylori-Status konnte dargestellt werden bei dem TCRBV6S1-Allel (GT)9, der nicht aktiven chronischen Gastritis und dem unauffälligen histologischer Biopsiebefund des Magens. Eine Assoziation, jedoch ohne statistische Signifikanz zeigte sich zwischen dem positiven H. pylori-Status und der großen Geschwisteranzahl, dem Alter > 40 Jahre, dem Hausfrauen-Status, einem niedrigen Bildungsgrad, einer Erkrankung an Diabetes mellitus, niedriger oder mittlerer Nitritaufnahme, normalhäufigem Obstverzehr, mittelstarkem Nikotinkonsum und dem Vorhandensein des TCRDVAJ-Allels (GT)25 und des TCRBV6S3-Allels (GT)11. Ebenso ohne statistische Signifikanz konnte eine Assoziation zwischen dem negativen H. pylori-Status und einem Alter zwischen 18 und 40 Jahren, Schul- und Hochschulausbildung, hoher Nitritaufnahme, häufigem Gemüse- und Obstverzehr, starkem Nikotinkonsum und dem exonischen Polymorphismus TCRBV6S1B nachgewiesen weden. Unter anderem fehlte bei den Beobachtungsgrößen Geschlecht, Herzkreislauferkrankungen, Salz-, Fleisch-, Alkohol- sowie dem fehlenden bis niedrigen Zigarettenkonsum und der Allelverteilung der Mikrosatelliten TNFa, IFNA, IL5RA, IL2, FGF1A, TCRBV6S7, CD3D der Zusammenhang mit dem H. pyloriStatus der Patienten. Somit konnte in dieser Studie die Infektion mit H. pylori als ein multifaktorielles Geschehen dargestellt werden. 57 5 Literatur 1. Ahmad, M.M., Rahman, M., Rumi, A.K., Islam, S., Huq, F., Chowdhury, M.F., Jinnah, F., Morshed, M.G., Hassan, M.S., Khan, A.K., Hasan, M. Prevalence of Helicobacter pylori in asymptomatic population--a pilot serological study in Bangladesh. J Epidemiol 1997;7:251-4 2. Andersen, L.P., Rosenstock, S.J., Bonnevie, O., Jorgensen, T. Seroprevalence of immunoglobulin G., M., and A antibodies to Helicobacter pylori in an unselected Danish population. Am-JEpidemiol. 1996; 143: 1157-64 3. Asaka, M., Kato, M., Kudo, M., Katagiri, M., Nishikawa, K., Koshiyama, H., Takeda, H., Yoshida, J., Graham, D.Y. Atrophic changes of gastric mucosa are caused by Helicobacter pylori infection rather than aging: studies in asymptomatic Japanese adults. Helicobacter 1996;1:52-6 4. Ayyagari, A., Ray, P., Kochhar, R., Bhasin, D., Siddeshi, E.R., Singh, K., Malik, A.K., Mehta, S.K. Evaluation of different methods for detection of Helicobacter pylori in patients with gastric disease. Indian J Med Res 1990;91:126-8 5. Azuma, T., Ito, S., Sato, F., Yamazaki, Y., Miyaji, H., Ito, Y., Suto, H., Kuriyama, M., Kato, T., Kohli, Y. The role of the HLA-DQA1 gene in resistance to atrophic gastritis and gastric adenocarcinoma induced by Helicobacter pylori infection. Cancer 1998;82:1013-8 6. Azuma, T., Konishi, J., Ito, Y., Hirai, M., Tanaka, Y., Ito, S., Kato, T., Kohli, Y. Genetic differences between duodenal ulcer patients who were positive or negative for Helicobacter pylori. J Clin Gastroenterol 1995;21 Suppl 1:S151-4 7. Babus, V., Strnad, M., Presecki, V., Katicic, M., Kalinic, S., Balija, M. Helicobacter pylori and gastric cancer in Croatia. Cancer Lett 1998;125:9-15 8. Begue, R.E., Gonzales, J.L., Correa-Gracian, H., Tang, S.C. Dietary risk factors associated with the transmission of Helicobacter pylori in Lima., Peru. Am J Trop Med Hyg 1998;59:637-40 9. Bodger, K., Wyatt, J.I., Heatley, R.V. Gastric mucosal secretion of interleukin-10: relations to histopathology, Helicobacter pylori status, and tumour necrosis factor-alpha secretion. Gut 1997;40:739-44 10. Brenner, H., Rothenbacher, D., Bode, G., Adler, G. Relation of smoking and alcohol and coffee consumption to active Helicobacter pylori infection: cross sectional study. BMJ 1997;315:1489-92 11. Buckley, M.J., O'Shea, J., Grace, A., English, L., Keane, C., Hourihan, D., O'Morain, C.A. A community-based study of the epidemiology of Helicobacter pylori infection and associated asymptomatic gastroduodenal pathology. Eur J Gastroenterol Hepatol 1998;10:375-9 12. Chang-Claude, J., Raedsch, R., Waldherr, R., von-Wulffen, H., Crespi, M., Yang, G.R., Qui, S.L., Munoz, N., Correa, P., Wahrendorf, J. Prevalence of Helicobacter pylori infection and gastritis among young adults in China. Eur-J-Cancer-Prev. 1995;4: 73-9 13. Charmley, E., Trenholm, H.L., Thompson, B.K., Vudathala, D., Nicholson, J.W., Prelusky, D.B., Charmley, L.L. Influence of level of deoxynivalenol in the diet of dairy cows on feed intake, milk production, and its composition. J Dairy Sci 1993;76:3580-7 14. Charmley, P., Nepom, B.S., Concannon, P. HLA and T cell receptor chain DNA polymorphisms identify a distinct subset of patients with pauciarticular-onset juvenile rheumatoid arthritis. Arthritis Rheum 1994;37:695-701 15. Choi, N.W., Miller, A.B., Fodor, J.G., Jain, M., Howe, G.R., Risch, H.A., Ruder, A.M. Consumption of precursors of N-nitroso compounds and human gastric cancer. IARC Sci Publ 1987;4:492-6 16. Cilla, G., Perez-Trallero, E., Garcia-Bengoechea, M., Marimon, J.M., Arenas JI. Helicobacter pylori infection: a seroepidemiological study in Gipuzkoa, Basque Country, Spain. Eur J Epidemiol 1997;13:945-9 17. Classen, M., Diehl, V., Kochsiek, K. Innere Medizin, 3.Auflage, München-Wien-Baltimore: Urban & Schwarzenberg,1994-a, Seite 750 18. Classen, M., Diehl, V., Kochsiek, K. Innere Medizin, 3.Auflage, München-Wien-Baltimore: Urban & Schwarzenberg,1994-b, Seite 1008 59 19. Classen, M., Diehl, V., Kochsiek, K. Innere Medizin, 3.Auflage, München-Wien-Baltimore: Urban & Schwarzenberg,1994-c, Seite 460 20. Classen, M., Diehl, V., Kochsiek, K. Innere Medizin, 3.Auflage, München-Wien-Baltimore: Urban & Schwarzenberg,1994-d, Seite 871 21. Classen, M., Diehl, V., Kochsiek, K. Innere Medizin, 3.Auflage, München-Wien-Baltimore: Urban & Schwarzenberg,1994-e, Seite 1017 22. Cornélis, F., Hashimoto, L., Loveridge, J., MacCarthy, A., Buckle, V., Julier, C., Bell, J. Identification of a CA repeat at the TCRA locus using yeast artificial chromosomes: a general method for generating highly polymorphic markers at chosen loci. Genomics 1992;13:820-5 23. Crabtree JE, Lindley IJ Mucosal interleukin-8 and Helicobacter pyloriassociated gastroduodenal disease. Eur J Gastroenterol Hepatol 1994;6 Suppl 1:S33-8 24. Crabtree, J.E. Gastric mucosal inflammatory responses to Helicobacter pylori. Aliment Pharmacol Ther 1996;10 Suppl 1:29-37 25. Cullen, D.J., Collins, B.J., Christiansen, K.J., Epis, J., Warren, J.R., Surveyor, I., Cullen, K.J. When is Helicobacter pylori infection acquired? Gut 1993;34:1681-2 26. Dey, A., Yokota, K., Kobayashi, K., Oguma, K., Hirai, Y., Akagi, T. Antibody and cytokine responses in Helicobacter pylori-infected various mouse strains. Acta Med Okayama 1998;52:41-8 27. Elitsur, Y., Short, J.P., Neace, C. Prevalence of Helicobacter pylori infection in children from urban and rural West Virginia. Dig Dis Sci 1998;43:773-8 28. Engstrand, L., Scheynius, A., Pahlson, C. An increased number of gamma/delta T-cells and gastric epithelial cell expression of the groEL stress-protein homologuein Helicobacter pylori-associated chronic gastritis of the antrum. Am J Gastroenterol 1991;86:976-80 29. Epplen, C., Frank, G., Gomolka, M., Nagy, M., Nurnberg, P., Epplen, J.T. Dinucleotide repeat polymorphism in the IL2 and IL5RA genes. Hum Mol Genet 1994;3:679 60 30. Fraser, A.G., Schreuder, V., Chua, L.E., Moore, L. Follow up after successful eradication of Helicobacter pylori: symptoms and reinfection. J Gastroenterol Hepatol 1998;13:555-9 31. Gahm, S.J., Fowlkes, B.J., Jameson, S.C., Gascoigne, N.R., Cotterman MM., Kanagawa O., Schwartz RH., Matis LA. Profound alteration in an alpha beta T-cell antigen receptor repertoire due to polymorphism in the first complementarity-determining region of the beta chain. Proc Natl Acad Sci U S A 1991;88:10267-71 32. Gentile, S., Turco, S., Oliviero, B., Torella, R. The role of autonomic neuropathy as a risk factor of Helicobacter pylori infection in dyspeptic patients with type 2 diabetes mellitus. Diabetes Res Clin Pract 1998;42:41-8 33. Gomolka, M., Hundrieser, J., Nurnberg, P., Roewer, L., Epplen, J.T., Epplen, C. Selected di- and tetranucleotide microsatellites from chromosomes 7, 12, 14, and Y in various Eurasian populations. Hum Genet 1994;93:592-6 34. Gomolka, M., Menninger, H., Saal, J.E., Lemmel, E.M., Albert, E.D., Niwa, O., Epplen, J.T., Epplen, C. Immunoprinting: various genes are associated with increased risk to develop rheumatoid arthritis in different groups of adult patients. J Mol Med 1995;73:19-29 35. Goodman, K.J., Correa, P., Tengana Aux, H.J., DeLany, J.P., Collazos, T. Nutritional factors and Helicobacter pylori infection in Colombian children. J Pediatr Gastroenterol Nutr 1997;25:507-15 36. Hazell, S.L., Mitchell, H.M., Hedges, M., Shi, X., Hu, P.J., Li, Y.Y., Lee, A., Reiss-Levy, E. Hepatitis A and evidence against the community dissemination of Helicobacter pylori via feces. J Infect Dis 1994;170:686-9 37. Hopkins, R.J., Russell, R.G., O'Donnoghue, J.M., Wasserman, S.S., Lefkowitz, A., Morris, J.G. Jr. Seroprevalence of Helicobacter pylori in Seventh-Day Adventists and other groups in Maryland. Lack of association with diet. Arch Intern Med 1990;150:2347-8 38. Janeway, C.A., Travers P. Immunologie, Heidelberg: Spektrum Akademischer Verlag, 1995 61 39. Kang, J.K., Kim, E., Kim, K.H., Oh, S.H. Association of Helicobacter pylori with gastritis and peptic ulcer diseases. Yonsei Med J 1991;32:157-68 40. Kappler, J.W., Wade, T., White, J., Kushnir, E., Blackman, M., Bill, J., Roehm, N., Marrack, P. A T cell receptor V beta segment that imparts reactivity to a class II major histocompatibility complex product. Cell 1987;49:263-71 41. Kato, S., Abukawa, D., Furuyama, N., Iinuma, K. Helicobacter pylori reinfection rates in children after eradication therapy. J Pediatr Gastroenterol Nutr 1998;27:543-6 42. Kawasaki, M., Kawasaki, T., Ogaki, T., Itoh, K., Kobayashi, S., Yoshimizu, Y., Aoyagi, K., Iwakawa, A., Takahashi, S., Sharma, S., Acharya, G.P. Seroprevalence of Helicobacter pylori infection in Nepal: low prevalence in an isolated rural village. Eur J Gastroenterol Hepatol 1998;10:47-50 43. Kelly, S.M., Pitcher, M.C., Farmery, S.M., Gibson, G.R. Isolation of Helicobacter pylori from feces of patients with dyspepsia in the United Kingdom. Gastroenterology 1994;107:1671-4 44. Klebanoff, S.J. Reactive nitrogen intermediates and antimicrobial activity: role of nitrite. Free Radic Biol Med 1993 Apr;14:351-60 45. Knippers, R. Molekulare Genetik, 6.Auflage, Stuttgart; New York: Thieme,1995, Seite 432 46. Korkushko, O.B., Hrihorov, I.u.H., Dzizins'ka, O.O. [Aging-related characteristics of the secretory response of the stomach to stimulation of its mechanoreceptors]. Fiziol Zh 1992;38:53-9 47. Kunstmann, E., Epplen, C., Elitok, E., Harder, M., Suerbaum, S., Peitz, U., Schmiegel, W., Epplen, J.T. Helicobacter pylori infection and polymorphisms in the tumor necrosis factor region. Electrophoresis 1999;20:1756-61 48. Kwiatkowski, D.J., Diaz, M.O. Dinucleotide repeat polymorphism at the IFNA locus (9p22). Hum Mol Genet 1992;1:658 49. Laster, S.M., Wood, J.G., Gooding, L.R. Tumor necrosis factor can induce both apoptic and necrotic forms of cell lysis. J Immunol;141:2629-34 62 50. La Vecchia, C., D'Avanzo, B., Airoldi, L., Braga, C., Decarli, A. Nitrosamine intake and gastric cancer risk. Eur J Cancer Prev 1995;4:469-74 51. Li, B., Rossman, M.D., Imir, T., Oner-Eyuboglu, A.F., Lee, C.W., Biancaniello, R., Carding, S.R. Disease-specific changes in gammadelta T cell repertoire and function in patients with pulmonary tuberculosis. J Immunol 1996;157:4222-9 52. Li, C., Ha, T., Ferguson, D.A. Jr., Chi, D.S., Zhao, R., Patel, N.R., Krishnaswamy, G., Thomas, E. A newly developed PCR assay of H. pylori in gastric biopsy, saliva, and feces. Evidence of high prevalence of H. pylori in saliva supports oral transmission. Dig Dis Sci 1996;41:2142-9 53. Li, X., Jaye, M., Crumley, G., Jabs, E.W. Dinucleotide repeat polymorphism in the human fibroblast growth factor acidic (FGFA) gene on chromosome 5. Hum Mol Genet 1992;1:216 54. Li, Y., Szabo, P., Robinson, M.A., Dong, B., Posnett, D.N. Allelic variation in the human T cell receptor V6.7 gene products. J Exp Med 1990;171:221-230 55. Li, Y.Y., Hu, P.J., Du, G.G., Hazell, S.L. The prevalence of Helicobacter pylori infection in the Peoples Republic of China. Am J Gastroenterol 1991;86:446-9 56. Lin, S.K., Lambert, J.R., Nicholson, L., Lukito, W., Wahlqvist, M. Prevalence of Helicobacter pylori in a representative Anglo-Celtic population of urban Melbourne. J Gastroenterol Hepatol 1998;13:50510 57. Louw, J.A., Jaskiewicz, K., Girdwood, A.H., Zak, J., Trey, G., Lucke, W., Truter, H., Kotze, T.J. Helicobacter pylori prevalence in non-ulcer dyspepsia--ethnic and socio-economic differences. S Afr Med J 1993;83:169-71 58. Lu, Y.K., Wang, G.L., Wang, L. [Prevalence of Helicobacter pylori(Hp) infection in the department of gastroenterology staff members in Nanjing]. Chung Hua Liu Hsing Ping Hsueh Tsa Chih 1997;18:70-2 63 59. Luyrink, L., Gabriel, C.A., Thompson, S.D., Grom, A.A., Maksymowych, W.P., Choi, D., Glass, D.N. Reduced expression of a human V6.1 T-cell receptor allele. Proc Natl Acad Sci USA 1993;90:4369-4373 60. Malaty, H.M., Engstrand, L., Pedersen, N.L., Graham, D.Y. Helicobacter pylori infection: genetic and environmental influences. A study of twins. Ann Intern Med 1994;120:982-6 61. Malaty, H.M., Kim, J.G., Kim, S.D., Graham, D.Y. Prevalence of Helicobacter pylori infection in Korean children: inverse relation to socioeconomic status despite a uniformly high prevalence in adults. Am-J-Epidemiol. 1996;143: 257-62 62. Matysiak-Budnik, T., Knapik, Z., Megraud, F., Lubczynska-Kowalska, W., Gosciniak, G., Bouchard, S., Przondo-Mordarska, A., Poniewierka, E., Helemejko, M., Klempous, J. Helicobacter pylori infection in Eastern Europe: seroprevalence in the Polish population of Lower Silesia. Am J Gastroenterol 1996;91:2513-5 63. Matysiak-Budnik, T., Megraud, F. Epidemiology of Helicobacter pylori infection with special reference to professional risk. J Physiol Pharmacol 1997;48 Suppl 4:3-17 64. Mbengue, M., Diouf, M.L., Dangou, J.M., Ka, M.M., Ba-Seck, A., Ndiaye, M.F., Moreira-Diop, T., Ndiaye, P.D., Bao, O. [Frequency of Helicobacter pylori infection in symptomatic patients in Senegal]. Med Trop (Mars) 1997;57:256-8 65. McVay, L.D., Li, B., Biancaniello, R., Creighton, M.A., Bachwich, D., Lichtenstein, G., Rombeau, J.L., Carding, S.R. Changes in human mucosal gamma delta T cell repertoire and function associated with the disease process in inflammatory bowel disease. Mol Med 1997;3:183-203 66. Meryn, S. Diagnostik der Helicobacter pylori-Infektion. Wien Klin Wochenschr 1994;106/17: 559-562 67. Metzler, J.B. Linder Biologie, 19. Auflage, Stuttgart J.B. Metzlersche Verlagsbuchhandlung und Carl Ernst Poeschel Verlag GmbH,1988, Seite 315 ff. 64 68. Miller, S.A., Dykes, D.D., Polesky, H.F. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res 1988;16:1215 69. Mitchell, H.M., Hu, P., Chi, Y., Chen, M.H., Li, Y.Y., Hazell, S.L. A low rate of reinfection following effective therapy against Helicobacter pylori in a developing nation (China). Gastroenterology 1998;114:25661 70. Mutschler, E. Arzneimittelwirkungen, 6. Auflage, Stuttgart: Wiis. Verl.Ges.,1991, Seite 563 71. Nave-Herz, R. Kinderlose Ehen. Eine empirische Studie über die Lebenssituation kinderloser Ehepaare und die Gründe für ihre Kinderlosigkeit. Weinheim: Juventa., 1988 72. Oderda, G., Ponzetto, A., Boero, M., Bellis, D., Forni, M., Vaira, D., Ansaldi, N. Family treatment of symptomatic children with Helicobacter pylori infection. Ital J Gastroenterol Hepatol 1997;29:509-14 73. Ogutu, E.O., Kang'ethe, S.K., Nyabola, L., Nyong'o, A. Endoscopic findings and prevalence of Helicobacter pylori in Kenyan patients with dyspepsia. East Afr Med J 1998;75:85-9 74. Oldenburg, B., Diepersloot, R.J., Hoekstra, J.B. High seroprevalence of Helicobacter pylori in diabetes mellitus patients. Dig-Dis-Sci. 1996;41:458-61 75. Ossewaarde, J.M., Feskens, E.J., De Vries, A., Vallinga, C.E., Kromhout, D. Chlamydia pneumoniae is a risk factor for coronary heart disease in symptom-free elderly men, but Helicobacter pylori and cytomegalovirus are not. Epidemiol Infect 1998;120:93-9 76. Palli, D., Caporaso, N.E., Shiao, Y.H., Sapeva, C., Amorosi, A., Masala, G., Rice, J.M., Fraumeni, J.F Jr. Diet, Helicobacter pylori, and p53 mutations in gastric cancer: a molecular epidemiology study in Italy. Cancer Epidemiol Biomarkers Prev 1997;6:1065-9 77. Perdichizzi, G., Bottari, M., Pallio, S., Fera, M.T., Carbone, M., Barresi, G. Gastric infection by Helicobacter pylori and antral gastritis in hyperglycemic obese and in diabetic subjects. New Microbiol 1996;19:149-54 65 78. Persico, M., Suozzo, R., De-Seta, M., Montella, F., Torella, R., Gentile, S. Non-ulcer dyspepsia and Helicobacter pylori in type 2 diabetic patients: association with autonomic neuropathy. Diabetes-Res-ClinPract. 1996;31:87-92 79. Pociot, F., Briant, L., Jongeneel, C.V., Molvig, J., Worsaae, H., Abbal, M., Thomsen, M., Nerup, J., Cambon-Thomsen, A. Association of tumor necrosis factor (TNF) and class II major histocompatibility complex alleles with the secretion of TNF-alpha and TNF-beta by human mononuclear cells: a possible link to insulin-dependent diabetes mellitus. Eur J Immunol 1993;23:224-31 80. Pullen, A.M., Wade, T., Marrack, P., Kappler, J.W. Identification of the region of T cell receptor beta chain that interacts with the selfsuperantigen MIs-1a. Cell 1990;61:1365-74 81. Raymond, M. & Rousset, F., 1995. GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism. J. Heredity 1995;86:248-249 82. Riede, U.N., Schäfer, H.E. Allgemeine und spezielle Pathologie, 3. Auflage, Stuttgart; New York: Thieme,1993, Seite 697 83. Rodrigo Saez, L., Riestra Menendez, S., Fernandez Rodriguez, E., Fernandez Velazquez, M.R., Garcia Alonso, S., Lauret Brana, M.E. Epidemiological study of the prevalence of Helicobacter pylori infection inthe general population in Asturias, Spain. Rev Esp Enferm Dig 1997;89:511-22 84. Roosendaal, R., Kuipers, E.J., Buitenwerf, J., van Uffelen, C., Meuwissen, S.G., van Kamp, G.J., Vandenbroucke-Grauls, C.M. Helicobacter pylori and the birth cohort effect: evidence of a continuous decrease of infection rates in childhood. Am J Gastroenterol 1997;92:1480-2 85. Rosenstock, S.J., Andersen, L.P., Rosenstock, C.V., Bonnevie, O., Jorgensen, T. [Helicobacter pylori infection and socioeconomic factors among adult Danes]. Ugeskr Laeger 1998;160:2109-15 86. Senra-Varela, A., Lopez-Saez, J.B., Gomez-Biondi, V. Prevalence of Helicobacter pylori infection in two Spanish regions with different incidence of gastric cancer. Eur J Epidemiol 1998;14:491-4 66 87. Shennak, M.M., Kilani, A.F. Helicobacter pylori in dyspeptic Jordanian patients. Trop Gastroenterol 1998;19:15-8 88. Shinchi, K., Ishii, H., Imanishi, K., Kono, S. Relationship of cigarette smoking, alcohol use, and dietary habits with Helicobacter pylori infection in Japanese men. Scand J Gastroenterol 1997;32:651-5 89. Sierra, R., Ohshima, H., Munoz, N., Teuchmann, S., Pena, A.S., Malaveille, C., Pignatelli, B., Chinnock, A., el Ghissassi, F., Chen, C., et al. Exposure to N-nitrosamines and other risk factors for gastric cancer in Costa Rican children. IARC Sci Publ 1991;105:162-7 90. Souto, F.J., Fontes, C.J., Rocha, G,A., de Oliveira, A.M., Mendes, E.N., Queiroz, D.M. Prevalence of Helicobacter pylori infection in a rural area of the state of Mato Grosso, Brazil. Mem Inst Oswaldo Cruz 1998;93:171-4 91. Statistisches Bundesamt (Hrsg.). Statistisches Jahrbuch für die Bundesrepublik Deutschland. Wiesbaden: Metzler-Poeschel (bis 1991 Stuttgart:Kohlhammer), 1950-1997 92. Stockbruegger, R.W. Bacterial overgrowth as a consequence of reduced gastric acidity. Scand J Gastroenterol Suppl 1985;111:7-16 93. Strachan, D.P., Mendall, M.A., Carrington, D., Butland, B.K., Yarnell, J.W., Sweetnam, P.M., Elwood, P.C. Relation of Helicobacter pylori infection to 13-year mortality and incident ischemic heart disease in the caerphilly prospective heart disease study. Circulation 1998;98:1286-90 94. Strieter, R.M., Kasahara, K., Allen, R.M., Standiford, T.J., Rolfe, M.W., Becker, F.S., Chensue, S.W., Kunkel, S.L. Cytokine-induced neutrophil-derived interleukin-8. Am J Pathol 1992;141:397-407 95. The EUROGAST Study Group. Epidemiology of, and risk factors for, Helicobacter pylori infection among 3194 asymptomatic subjects in 17 populations. GUT 1993;34:1672-1676 96. Thomas, J.E., Gibson, G.R., Darboe, M.K., Dale, A., Weaver, L.T. Isolation of Helicobacter pylori from human faeces. Lancet 1992;340:1194-5 67 97. Torres, J., Leal-Herrera, Y., Perez-Perez, G., Gomez, A., CamorlingaPonce, M., Cedillo-Rivera, R., Tapia-Conyer, R., Munoz, O. A community-based seroepidemiologic study of Helicobacter pylori infection in Mexico. J Infect Dis 1998;178:1089-94 98. Tsugane, S., Tei, Y., Takahashi, T., Watanabe, S., Sugano, K. Salty food intake and risk of Helicobacter pylori infection. Jpn J Cancer Res 1994;85:474-8 99. Udalova, I.A., Nedospasov, S.A., Webb, G.C., Chaplin, D.D., Turetskaya, R.L. Highly informative typing of the human TNF locus using six adjacent polymorphic markers. Genomics 1993;16:180-6 100. Valnes, K., Huitfeldt, H.S., Brandtzaeg, P. Relation between T cell number and epithelial HLA class II expression quantified by image analysis in normal and inflamed human gastric mucosa. Gut 1990;31:647-52 101. van Doorn, N.E., van Rees, E.P., Namavar, F., Ghiara, P., Vandenbrouckegrauls, C.M., de Graaff, J. The inflammatory response in CD1 mice shortly after infection with a CagA+/VacA+ Helicobacter pylori strain. Clin Exp Immunol 1999;115:421-7 102. Vissinga, C.S., Charmley, P., Concannon, P. Influence of coding region polymorphism on the peripheral expression of a human TCR V beta gene. J Immunol 1994;152:1222-7 103. Warren, J.R., Marshall, B.J. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983;1:1273-1275 104. Webberley, M.J., Webberley, J.M., Newell, D.G., Lowe, P., Melikian, V. Seroepidemiology of Helicobacter pylori infection in vegans and meat-eaters. Epidemiol Infect 1992;108:457-62 105. Weber, J.L., Kwitek, A.E., May, P.E. Dinucleotide repeat polymorphisms at the D11S419 and CD3D loci. Nucleic Acids Res 1990;18:4036 106. Yali, Z., Yamada, N., Wen, M., Matsuhisa, T., Miki, M. Gastrospirillum hominis and Helicobacter pylori infection in Thai individuals: comparison of histopathological changes of gastric mucosa. Pathol Int 1998;48:507-11 68 107. Yamaoka, Y., Kita, M., Kodama, T., Sawai, N., Imanishi, J. Helicobacter pylori cagA gene and expression of cytokine messenger RNA in gastric mucosa. Gastroenterology 1996;110:1744-52 108. Yoshida, N., Granger, D.N., Evans, D.J. Jr., Evans, D.G., Graham, D.Y., Anderson, D.C., Wolf, R.E., Kvietys, P.R. Mechanisms involved in Helicobacter pylori-induced inflammation. Gastroenterology 1993;105:1431-40 109. Youn, H.S., Baik, S.C., Cho, Y.K., Woo, H.O., Ahn, Y.O., Kim, K., Cho, M.J., Lee, W.K., Ko, G.H., Okada, K., Ueda. K., Rhee, K.H. Comparison of Helicobacter pylori infection between Fukuoka, Japan and Chinju, Korea. Helicobacter 1998;3:9-14 69 110. Anhang: Datentabellen Tabelle 22: Absolute und relative Häufigkeiten der Allelverteilung des Mikrosatelliten TCRBV6S1 in Bezug auf den H. pylori-Status TCRBV6S1-Allele (GT)n H. pylori-Status 13 12 11 10 9 Summe negativ 21 59 3 1 181 187 positiv 48 78 2 1 191 215 negativ [%] 11,2 31,6 1,6 0,5 96,8 100,0 positiv [%] 22,3 36,3 0,9 0,5 88,8 100,0 Tabelle 23: Absolute und relative Häufigkeiten der Allelverteilung des Mikrosatelliten TCRBV6S3 in Bezug auf den H. pylori-Status TCRBV6S3-Allele (GT)n H. pylori-Status 13 12 11 8 Summe negativ 3 27 15 184 187 positiv 3 39 35 207 157 negativ [%] 1,6 14,4 8,0 98,4 100,0 positiv [%] 1,9 24,8 22,3 131,8 100,0 Tabelle 24: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten TCRBV6S7 a in Abhängigkeit vom H. pylori-Status TCRBV6S7-Allele (GT)n H. pylori- 29 26 25 24 23 22 21 20 16 15 Summe negativ 1 2 19 22 18 26 11 4 4 34 77 positiv 0 2 19 22 8 18 17 4 4 37 71 Status negativ [%] 1,3 2,6 24,7 28,6 23,4 33,8 14,3 5,2 5,2 44,2 100,0 positiv [%] 0,0 2,8 26,8 31,0 11,3 25,4 23,9 5,6 5,6 52,1 100,0 70 Tabelle 25: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten TNF-a in Abhängigkeit vom H. pylori-Status TNFa-Allele (GT)n H. pylori-Status 19 18 17 16 15 14 13 12 11 10 9 8 7 6 Summe negativ 1 6 1 58 47 10 5 33 50 21 30 5 92 4 193 negativ [%] 0 14 3 61 59 9 5 30 47 23 28 2 107 3 216 positiv [%] 0,5 3,1 0,5 30,1 24,4 5,2 2,6 17,1 25,9 10,9 15,5 2,6 47,7 2,1 100,0 positiv 0,0 6,5 1,4 28,2 27,3 4,2 2,3 13,9 21,8 10,6 13,0 0,9 49,5 1,4 100,0 Tabelle 26: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten IL5RA a in Abhängigkeit vom H. pylori-Status IL5RA -Allele (GA)n H. pylori-Status 23 22 21 20 19 18 17 16 15 14 13 12 11 10 4 Summe neg 1 1 1 2 6 87 16 69 91 61 3 1 1 1 1 180 pos 1 0 4 2 14 90 17 79 102 74 8 1 0 0 0 210 negativ [%] 0,6 0,6 0,6 1,1 3,3 48,3 8,9 38,3 50,6 33,9 1,7 0,6 0,6 0,6 0,6 100,0 positiv [%] 0,5 0,0 1,9 1,0 6,7 42,9 8,1 37,6 48,6 35,2 3,8 0,5 0,0 0,0 0,0 100,0 Tabelle 27: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten IFNA a in Abhängigkeit vom H. pylori-Status IFNA -Allele (CA)n H. pylori-Status 25 24 23 22 Summe negativ 2 5 30 41 52 positiv 5 2 33 34 48 negativ [%] 3,8 9,6 57,7 78,8 100,0 positiv [%] 10,4 4,2 68,8 70,8 100,0 Tabelle 28: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten IL2 a in Abhängigkeit vom H. pylori-Status IL2-Allele (CA)n H. pylori- 45 43 42 41 40 39 38 37 36 35 34 33 32 31 30 29 28 27 26 Summe negativ 1 6 20 25 30 32 25 37 27 32 8 8 2 1 1 1 14 1 0 143 positiv 0 5 14 25 23 46 21 52 22 37 5 6 3 0 0 0 19 0 1 148 9,8 0,7 0,0 100,0 16,9 15,5 31,1 14,2 35,1 14,9 25,0 3,4 4,1 2,0 0,0 0,0 0,0 12,8 0,0 0,7 100,0 Status negativ [%] 0,7 4,2 14,0 17,5 21,0 22,4 17,5 25,9 18,9 22,4 5,6 5,6 1,4 0,7 0,7 0,7 positiv [%] 0,0 3,4 9,5 Tabelle 29: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten FGF1A a in Abhängigkeit vom H. pylori-Status FGF1A -Allele (GT)n H. pylori-Status 18 17 16 15 14 13 12 Summe negativ 1 21 10 71 1 7 1 77 positiv 0 22 14 74 2 8 0 78 negativ [%] 1,3 27,3 13,0 92,2 1,3 9,1 1,3 100,0 positiv [%] 0,0 28,2 17,9 94,9 2,6 10,3 0,0 100,0 Tabelle 30: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten DVAJ a in Abhängigkeit vom H. pylori-Status DVAJ -Allele (GT)n H. pylori-Status 26 25 24 23 22 21 20 19 Summe negativ 3 7 50 20 17 40 4 2 77 positiv 4 19 34 28 10 39 1 3 76 negativ [%] 3,9 9,1 64,9 26,0 22,1 51,9 5,2 2,6 100,0 positiv [%] 5,3 25,0 44,7 36,8 13,2 51,3 1,3 3,9 100,0 Tabelle 31: Absolute und relative Häufigkeiten der Allele des Mikrosatelliten CD3D a in Abhängigkeit vom H. pylori-Status CD3D-Allele (GT)n H. pylori-Status 21 20 19 18 17 16 15 Summe negativ 0 20 51 7 44 19 4 83 positiv 2 18 43 4 47 20 3 77 negativ [%] 0,0 24,1 61,4 8,4 53,0 22,9 4,8 100,0 positiv [%] 2,6 23,4 55,8 5,2 61,0 26,0 3,9 100,0 Tabelle 32: Absolute und relative Häufigkeiten der Patienten in den jeweiligen Altersgruppen in Abhängigkeit vom H. pylori-Status H. pylori-Status 18-40 J > 40 J 41-60 J 61-80 J > 80 J Summe negativ 44 151 56 72 23 195 positiv 32 188 73 88 27 220 negativ [%] 22,6 77,4 28,7 36,9 11,8 100,0 positiv [%] 14,5 85,5 33,2 40,0 12,3 100,0 Tabelle 33: Absolute und relative Häufigkeiten der Geschwisteranzahl der Patienten in Abhängigkeit vom H. pylori-Status Geschwisteranzahl H. pylori-Status 1 2 3 4 >4 Summe negativ 14 49 48 25 44 180 positiv 17 38 44 27 69 195 negativ [%] 7,8 27,2 26,7 13,9 24,4 100,0 positiv [%] 8,7 19,5 22,6 13,8 35,4 100,0 Tabelle 34: Absolute und relative Häufigkeiten der Anzahl der Patienten ohne, mit Ausbildung sowie Hochschulausbildung und der Gruppe der Hausfrauen in Abhängigkeit vom H. pylori-Status Ausbildung Schul- Hochschul- H. pylori-Status Ohne Hausfrau Summe negativ 56 96 13 15 180 positiv 66 87 11 32 196 negativ [%] 31,1 53,3 7,2 8,3 100,0 positiv [%] 33,7 44,4 5,6 16,3 100,0 74 Tabelle 35: Absolute und relative Häufigkeiten der Patienten in den Gruppen normal- bzw übergewichtig in Abhängigkeit vom H. pylori-Status H. pylori-Status Normalgewicht Übergewicht Summe negativ 136 43 179 positiv 134 67 201 negativ [%] 76,0 24,0 100,0 positiv [%] 66,7 33,3 100,0 Tabelle 36: Absolute und relative Häufigkeiten der Patienten aus Europa und Asien (einschließlich Türkei) in Abhängigkeit vom H. pylori-Status H. pylori-Status Europa Asien+TR Summe negativ 195 3 198 positiv 201 19 220 negativ [%] 98,5 1,5 100,0 positiv [%] 91,4 8,6 100,0 Tabelle 37: Absolute und relative Häufigkeiten der Patienten mit und ohne Diabetes mellitus in Abhängigkeit vom H. pylori-Status Diabetes mellitus H. pylori-Status neg pos Summe negativ 155 28 183 positiv 156 46 202 negativ [%] 84,7 15,3 100,0 positiv [%] 77,2 22,8 100,0 75 Tabelle 38: Absolute und relative Häufigkeiten der Patienten mit und ohne Herz-Kreislauferkrankungen in Abhängigkeit vom H. pylori-Status Herz-Kreislauferkrankung H. pylori-Status neg pos Summe negativ 140 43 183 positiv 151 51 202 negativ [%] 76,5 23,5 100,0 positiv [%] 74,8 25,2 100,0 Tabelle 39: Absolute und relative Häufigkeiten der Patienten die wenig, normal oder viel Obst konsumieren in Abhängigkeit vom H. pylori-Status Obstkonsum H. pylori-Status wenig normal viel Summe negativ 37 38 100 175 positiv 32 53 110 195 negativ [%] 21,1 21,7 57,1 100,0 positiv [%] 16,4 27,2 56,4 100,0 Tabelle 40: Absolute und relative Häufigkeiten der Patienten die wenig, normal oder viel Gemüse konsumieren in Abhängigkeit vom H. pylori-Status Gemüsekonsum H. pylori-Status wenig normal viel Summe negativ 17 47 118 182 positiv 16 75 110 201 negativ [%] 9,3 25,8 64,8 100,0 positiv [%] 8,0 37,3 54,7 100,0 76 Tabelle 41: Absolute und relative Häufigkeiten der Patienten die wenig, normal oder viel nitrithaltige Lebensmitteln konsumieren in Abhängigkeit vom H. pyloriStatus Nitritkonsum H. pylori-Status wenig normal viel Summe negativ 78 35 21 135 positiv 123 34 14 171 negativ [%] 57,8 25,9 15,6 100,0 positiv [%] 71,9 19,9 8,2 100,0 Tabelle 42: Absolute und relative Häufigkeiten der Patienten die wenig, normal oder viel Fleisch konsumieren in Abhängigkeit vom H. pylori-Status Fleischkonsum H. pylori-Status wenig normal viel Summe negativ 61 78 43 182 positiv 64 96 42 202 negativ [%] 33,5 42,9 23,6 100,0 positiv [%] 31,7 47,5 20,8 100,0 Tabelle 43: Absolute und relative Häufigkeiten der Patienten die wenig, normal oder viel Salz konsumieren in Abhängigkeit vom H. pylori-Status NaCl-Konsum H. pylori-Status wenig normal viel Summe negativ 55 107 19 182 positiv 54 127 21 202 negativ [%] 30,2 58,8 10,4 100,0 positiv [%] 26,7 62,9 10,4 100,0 77 Tabelle 44: Absolute und relative Häufigkeiten der verschiedenen Gastroskopiebefunde in Abhängigkeit vom H. pylori-Status; Erosiv = erosives Schleimhauterythem, Ulcus = Ulcus ventriculi. Gastroskopiebefund H. pylori-Status o.B. Schleimhauterythem Erosiv Ulcus Summe negativ 93 23 42 9 167 positiv 112 19 29 17 177 negativ [%] 55,7 13,8 25,1 5,4 100,0 positiv [%] 63,3 10,7 16,4 9,6 100,0 Tabelle 45: Absolute und relative Häufigkeiten der verschiedenen Duodenoskopiebefunde in Abhängigkeit vom H. pylori-Status; Erosiv = erosives Schleimhauterythem, Ulcus = Ulcus duodeni. Duodenoskopiebefund H. pylori-Status o.B. Schleimhauterythem Erosiv Ulcus Summe negativ 142 8 13 6 169 positiv 138 4 14 23 179 negativ [%] 84,0 4,7 7,7 3,6 100,0 positiv [%] 77,1 2,2 7,8 12,8 100,0 78 Tabelle 46: Absolute und relative Häufigkeiten der der verschiedenen Histologiebefunde des Antrums in Abhängigkeit vom H. pyloriStatus 19 0 1 129 positiv 0 17 24 4 34 64 8 4 27 2 1 1 0 186 negativ [%] 31,0 34,1 10,9 0,0 6,2 2,3 0,0 0,0 0,0 0,0 14,7 0,0 0,8 0,0 positiv [%] 0,0 9,1 12,9 2,2 18,3 34,4 4,3 2,2 14,5 1,1 0,5 0,5 0,0 0,0 Magenkarzinom Summe 0 MALT´om 0 h chron h aktiv 0 h chron m aktiv 0 h chron g aktiv 3 m chron h aktiv 8 m chron m aktiv 0 m chron g aktiv 14 g chron m aktiv g chron g aktiv 44 o.B 40 Status negativ H. pylori- chron nicht aktiv C-Gastritis Befund der Antrumhistologie Tabelle 47: Absolute und relative Häufigkeiten der der verschiedenen Histologiebefunde des Corpus in Abhängigkeit vom H. pyloriStatus Summe Magenkarzinom MALT´om C-Gastritis h chron h aktiv h chron m aktiv h chron g aktiv m chron h aktiv m chron m aktiv m chron g aktiv g chron h aktiv g chron m aktiv g chron g aktiv chron nicht aktiv o.B Status H. pylori- Befund der Corpushistologie negativ 59 43 9 0 0 2 4 1 0 0 0 6 0 1 125 positiv 5 32 67 1 3 20 40 4 1 5 1 0 1 0 180 negativ [%] 47,2 34,4 7,2 0,0 0,0 1,6 3,2 0,8 0,0 0,0 0,0 4,8 0,0 0,8 0,0 positiv [%] 2,8 17,8 37,2 0,6 1,7 11,1 22,2 2,2 0,6 2,8 0,6 0,0 0,6 0,0 0,0 80 Tabelle 48: Absolute und relative Häufigkeiten der Patienten die 0 bis 7, 8 bis 15 oder mehr als 15 Zigaretten pro Tag rauchen in Abhängigkeit vom H. pyloriStatus Zigarettenkonsum/d H. pylori-Status 0-7 8 - 15 > 15 Summe negativ 125 12 49 186 positiv 141 25 39 205 negativ [%] 67,2 6,5 26,3 100,0 positiv [%] 68,8 12,2 19,0 100,0 Tabelle 49: Absolute und relative Häufigkeiten der Patienten die Alkohol unterund oberhalb der OSG konsumieren in Abhängigkeit vom H. pylori-Status Alkoholkonsum H. pylori-Status Unter OSG über OSG Summe negativ 169 15 184 positiv 188 16 204 negativ [%] 91,8 8,2 100,0 positiv [%] 92,2 7,8 100,0 Tabelle 50: Absolute und relative Häufigkeiten der Patienten mit und ohne Einnahme von nicht-steroidalen Antirheumatika in Abhängigkeit vom H. pyloriStatus NSAR H. pylori-Status Keine Einnahme Summe negativ 125 57 182 positiv 135 66 201 negativ [%] 68,7 31,3 100,0 positiv [%] 67,2 32,8 100,0 Tabelle 51: Absolute und relative Häufigkeiten der Patienten mit und ohne Einnahme von Antibiotika in Abhängigkeit vom H. pylori-Status Antibiose H. pylori-Status Keine Zustand nach Summe negativ 165 17 182 positiv 184 17 201 negativ [%] 90,7 9,3 100,0 positiv [%] 91,5 8,5 100,0 82 Danksagung Ich danke Herrn Universitätsprofessor Dr. med. W. Schmiegel und Herrn Prof. Dr. med. Jörg T. Epplen dafür, daß sie mir die Durchführung dieser Arbeit ermöglicht haben. Mein besonders herzlicher Dank gilt Frau Dr. med. E. Kunstmann für die Überlassung des Themas, die freundliche Unterstützung und für die unermüdliche engagierte Betreuung. Außerdem danke ich Frau Dr. med. C. Epplen für ihre hilfreichen Diskussionen und Anregungen und auch den Kollegen, dem Pflegepersonal, den Mitarbeitern im Labor und Klinik der Medizinischen Universitätsklinik des Knappschafts-Krankenhauses sowie der Abteilung für Humangenetik der Ruhr-Universität Bochum. Weiterhin danke ich Frau Dipl. math. G. Freitag für die Statistikberatung und Frau Dr. med. A. Pader für die Durchsicht der Arbeit und die anregenden Vorschläge. Lebenslauf Name: Ercan Elitok Geburtsdatum /-ort: 04.04.1972 in Maden / Türkei Anschrift: Johannes-Mynsinger-Weg 29, 89075 Ulm )DPLOLHQVWDQG OHGLJ Nationalität: türkisch Schulbildung: 1977 – 1979 1.+ 2. Klasse Grundschule Tekevler und Elazig in der Türkei September 1979 1979 - 1982 2.- 4. Klasse Grundschule Bad Laasphe, NRW 1982 - 1991 Städtisches Gymnasium Bad Laasphe, NRW Juni 1991 Hochschul- Umzug nach BR Deutschland Oktober 1991 Allgemeine Hochschulreife Beginn des Medizinstudiums an der Ruhr-Universität Bochum ausbildung: August 1993 Ärztliche Vorprüfung August 1994 Erster Abschnitt der Ärztlichen Prüfung August 1996 Zweiter Abschnitt der Ärztlichen Prüfung Juni-Sept. 1997 PJ-Tertial an der University of South Alabama in Mobile, AL, USA November 1997 Arzt im 01.01.1998 30.06.1999 Praktikum Ärztliche Prüfung Abteilung Neurologie, Universitätsklinikum Göttingen, Prof. Dr. K. Felgenhauer Assistenzarzt 01.07.1999 30.06.2000 Abteilung Nuklearmedizin, Universitätsklinikum Ulm, Prof. Dr. S. N. Reske 01.07.2000 - Neurologische Klinik der Universität Ulm, Prof. Dr. A. C. Ludolph Ulm, den 30. Juni 2001