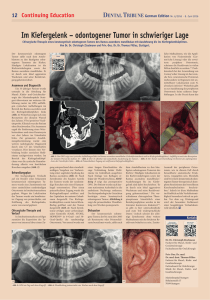
Der keratozystisch odontogene Tumor (KZOT)
Werbung

Aus der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover Direktor: Univ.-Prof. Dr. Dr. N.-C. Gellrich Der keratozystisch odontogene Tumor (KZOT) Eine retrospektive Auswertung des Hannoveraner Patientenguts von 1991 bis 2010 Dissertation zur Erlangung des Doktorgrades der Zahnheilkunde in der Medizinischen Hochschule Hannover vorgelegt von Marcia Katharina Kirn aus Marburg an der Lahn Hannover 2014 Angenommen vom Senat der Medizinischen Hochschule Hannover am 22.04.2015 Gedruckt mit Genehmigung der Medizinischen Hochschule Hannover Präsident: Prof. Dr. med. Christopher Baum Betreuer der Arbeit: Prof. Dr. Dr. Horst Kokemüller Zweitbetreuer: PD Dr. Kai-Hendrik Bormann Referent: Prof. Dr. med. Dr. med. dent. André Eckardt Korreferent: Prof. Dr. med. Tobias Hüfner Tag der mündlichen Prüfung: 22.04.2015 Promotionsausschussmitglieder: Prof. Dr. med. dent. Harald Tschernitschek Prof. Dr. med. Matthias Fink PD Dr. med. Björn Jüttner Inhaltsverzeichnis Inhaltsverzeichnis Abkürzungsverzeichnis: .................................................................................................... IV 1. Einleitung ................................................................................................................. 1 1.1. Einführung ............................................................................................................................ 1 1.2. Definition ............................................................................................................................... 2 1.2.1. Die „Keratozyste“: Wissenschaftshistorie des keratozystisch odontogenen Tumors ........ 2 1.2.2. Klassifikation und Epidemiologie der Kieferzysten ............................................................ 3 1.3. Ätiologie ................................................................................................................................ 5 1.3.1. Embryogenese ................................................................................................................... 5 1.4. Pathogenese/ Wachstumskinetik ....................................................................................... 7 1.5. Gorlin-Goltz-Syndrom .......................................................................................................... 8 1.6. Klinik ...................................................................................................................................... 9 1.7. Diagnostik ........................................................................................................................... 10 1.8. Differentialdiagnosen ......................................................................................................... 12 1.9. Histologie ............................................................................................................................ 13 1.10. Genetik ................................................................................................................................ 15 1.11. Therapiemethoden von Zysten ......................................................................................... 16 1.11.1. Zystostomie (ZO) ............................................................................................................. 16 1.11.2. Zystektomie (ZE) .............................................................................................................. 17 1.12. Augmentationsmaterial ..................................................................................................... 19 1.12.1. Autogene Knochentransplantate...................................................................................... 19 1.12.2. Allogene Knochentransplantate ....................................................................................... 20 1.12.3. Xenogenen Knochentransplantate .................................................................................. 21 1.12.4. Alloplastische Knochentransplantate ............................................................................... 21 1.13. Hohe Rezidivinzidenz ......................................................................................................... 22 1.14. Fragestellung ...................................................................................................................... 24 2. Material und Auswertungsmethoden.....................................................................25 2.1. Studiendesign ..................................................................................................................... 25 2.2. Auswertungsmethoden ..................................................................................................... 27 I Inhaltsverzeichnis 2.3. Alter/ Geschlecht ................................................................................................................ 27 2.4. Radiologische und klinische Auswertungen................................................................... 27 2.5. Operative Therapiemethoden............................................................................................ 28 2.6. Postoperative Nachsorge .................................................................................................. 29 2.7. Rezidive ............................................................................................................................... 29 2.8. Histologische Gewebebegutachtung der Pathologie ..................................................... 29 2.9. Statistiken ........................................................................................................................... 30 2.9.1. Beschreibende Statistik ................................................................................................... 30 2.9.2. Auswertende Statistik ...................................................................................................... 31 3. Ergebnisse ..............................................................................................................32 3.1. Epidemiologische Auswertung ......................................................................................... 32 3.2. Geschlechter- und Altersverteilung ................................................................................. 32 3.3. Radiologische Auswertung ............................................................................................... 34 3.3.1. Lokalisation des keratozystisch odontogenen Tumors .................................................... 34 3.3.2. Größe des keratozystisch odontogenen Tumors ............................................................. 36 3.3.3. Zahnbeziehung ................................................................................................................ 36 3.4. Operationsmethoden ......................................................................................................... 38 3.5. Augmentationsverfahren ................................................................................................... 38 3.6. Analyse des Rezidivverhaltens anhand des Gesamtkollektivs (n = 111) ..................... 42 3.6.1. Lokalisationsverteilung der 41 Rezidive .......................................................................... 43 3.6.2. Gruppenvergleich bezüglich des Alters / des Geschlechts und dem Rezidivauftreten ... 44 3.6.3. Vergleich zwischen den Operationsmethoden und dem Auftreten eines Rezidivs ......... 49 3.7. Analysezeitraum des Rezidivauftretens von den Patienten mit einem Nachkontrollzeitraum von mindestens einem Jahr (n = 71) .......................................... 54 3.7.1. Gruppenvergleich bezüglich des Alters / des Geschlechts und dem Rezidivauftreten ... 55 3.7.2. Vergleich zwischen den Operationsmethoden und dem Auftreten eines Rezidivs ......... 57 3.8. Analysezeitraum des Rezidivauftretens von den Patienten mit einem Nachkontrollzeitraum von mindestens drei Jahren (n = 45) .......................................... 59 3.8.1. Vergleich zwischen den Operationsmethoden und dem Auftreten eines Rezidivs ......... 61 3.9. Analyse der an dem Gorlin-Goltz-Syndrom (GGS)/ Basalzellnävus-Syndrom (NBCCS) erkrankten Patienten.......................................................................................... 63 3.10. Ausgewählte Patientenfälle ............................................................................................... 64 3.10.1. Patientenfälle ohne Rezidiv ............................................................................................. 64 3.10.2. Patientenfälle mit Rezidiv................................................................................................. 68 3.10.3. Patientenfälle mit Gorlin-Goltz-Syndrom ......................................................................... 70 II Inhaltsverzeichnis 3.10.4. Aktuelles Beispiel aus 2013 ............................................................................................. 73 4. Diskussion...............................................................................................................83 4.1. Diskussion der Materialien und der Auswertungsmethoden ........................................ 83 4.2. Diskussion der Ergebnisse ............................................................................................... 84 4.2.1. 4.3. Rezidivverhalten .............................................................................................................. 86 Schlussfolgerung ............................................................................................................... 92 4.3.1. Ausblick ............................................................................................................................ 94 5. Zusammenfassung .................................................................................................95 6. Literaturverzeichnis ................................................................................................98 7. Tabellenverzeichnis ..............................................................................................111 8. Abbildungsverzeichnis .........................................................................................112 9. Anhang ..................................................................................................................116 9.1. Beispieltabelle der Datenerhebung ................................................................................ 116 Danksagung ......................................................................................................................118 Lebenslauf ........................................................................................................................119 Erklärung nach §2 Abs. 2 Nrn. 6 und 7 der Promotionsordnung ..................................120 III Abkürzungsverzeichnis Abkürzungsverzeichnis: KZOT OKC GGS NBCCS ZE ZO ZE+CS TR WSR CT DVT OPG/OPT NaCl PCNA SMO - Keratozystisch odontogener Tumor Orthokeratinisierter keratozystisch odontogener Tumor Gorlin-Goltz-Syndrom Basalzellnävus-Syndrom Zystektomie (Partsch I) Zystostomie (Partsch II) Zystektomie mit Carnoyscher Lösung Teilresektion Wurzelspitzenresektion Computertomographie Digitale Volumentomographie Orthopantomographie, Panoramaschichtaufnahme Natrium Chlorid, Kochsalz Proliferating Cell Nuclear Antigen Smoothened Protein TNF MHH WHO DKG DGMKG - Tumor Nekrose Faktor Medizinische Hochschule Hannover Weltgesundheitsorganisation Deutsche Krebsgesellschaft Deutsche Gesellschaft für Mund-, Kiefer- und Gesichtschirurgie IV Einleitung 1. Einleitung 1.1. Einführung Auf dem Gebiet der odontogenen Kiefererkrankungen nimmt der keratozystisch odontogene Tumor (KZOT) eine Sonderstellung ein. Dieser vereinigt die klinisch-pathologischen Eigenschaften eines benignen odontogenen Tumors sowie einer Kieferzyste. Mit 35% stellt der KZOT den zweithäufigsten odontogenen Tumor und mit bis zu 11% die dritthäufigste Kieferzyste dar. Zudem ist er als Symptom im Rahmen des Gorlin-Goltz-Syndrom (GGS) zu finden [2, 8, 10, 13, 18, 36, 43, 49, 68, 88, 109]. Schon seit der Erstbeschreibung von Philipsen [94] im Jahre 1956 wird über die Klassifikation und die bis heute unklare Ätiologie des KZOT kontrovers diskutiert [20, 36, 94]. 2005 änderte die Weltgesundheitsorganisation (WHO) zum vierten Mal (nach 1971/ 1997/ 2002) die Klassifikation der odontogenen Tumore und klassifizierte aufgrund neuer pathogenetischer Erkenntnisse die „Keratozyste“ zu einem benignen odontogenen Tumor, dem keratozystisch odontogenen Tumor (ICD-0 Code 9270/0) [10]. Bereits 1963 beschrieb Pindborg [96] die Fähigkeit des KZOT zur Bildung von Satellitenzysten und das damit in Verbindung zu bringende häufige Vorkommen (2-62%) von Rezidiven [1, 10, 36, 42, 49, 68]. Nichtsdestotrotz weist der KZOT auch die für die meisten odontogenen Kieferzysten geltenden klinisch-radiologischen Eigenschaften auf. Er stellt sich radiologisch als eine scharf begrenzte Raumforderung dar und weist ein klinisch symptomlos-verdrängendes Wachstum auf. Dieses symptomlose Wachstum und die klinisch-radiologischen Ähnlichkeiten zu den odontogenen Kieferzysten erschweren die Diagnostik und erfordern, neben den klinischen und radiologischen Befunden, einen pathohistologischen Befund zur Sicherung der Diagnose des KZOT [6]. Trotz einer fortlaufenden Weiterentwicklung neuer Diagnostikverfahren und der Anwendung moderneren medizinischer Therapien, wie chirurgische in Verbindung mit chemischkauterisierende Methoden, konnte bis heute noch keine überzeugende effektive und einheitliche therapeutische Behandlung des KZOT im Hinblick auf die Rezidivrate gefunden werden [18, 20, 22]. 1 Einleitung Das Ziel der vorliegenden retrospektiven Arbeit ist es, ein besseres Verständnis der Ätiopathogenese des KZOT zu schaffen und die Rezidivinzidenz des KZOT nach unterschiedlichen Operationsmethoden zu analysieren, um Behandlungsempfehlungen aussprechen zu können. Dazu werden die fünf gängigsten Operationsmethoden vorgestellt und deren Rezidivrate anhand unterschiedlicher Kriterien bewertet. 1.2. Definition Der Begriff Zyste leitet sich von dem griechischen Wort „Kystis“ ab, das übersetzt Blase bedeutet. Definitionsgemäß handelt es sich daher bei einer Zyste um einen Hohlraum, der von Epithel ausgekleidet und mit Flüssigkeit oder Gas gefüllt ist [8, 16, 47, 88]. Die seröse Flüssigkeit ist cholesterinhaltig und kann zu einem Cholesterinbrei angedickt sein [32, 43, 47, 66, 88]. Eine benigne Neoplasie ist eine Neubildung von Körpergewebe, welches gut von der Umgebung abgrenzbar ist. Sie ist gekennzeichnet durch ein langsames, expansivverdrängendes Wachstum und hat nur mechanische Rückwirkung auf den Allgemeinzustand [100]. Die odontogenen Tumore entwickeln sich aus odontogenem Epithel mit oder ohne Ektomesenchym [99]. 1.2.1. Die „Keratozyste“: Wissenschaftshistorie des keratozystisch odontogenen Tumors Die Nomenklatur der „Keratozyste“ oder des keratozystisch odontogenen Tumors hat sich aufgrund neuer wissenschaftlicher Untersuchungsmethoden und neuen Erkenntnissen fortlaufend verändert [36, 40, 94, 95]. Scultetus schrieb 1654 erstmals über zystische Schwellungen im Kiefer [125]. Von Malessez (1885) sowie Partsch (1892) wurde dieses Krankheitsbild weiter verfolgt und ausgearbeitet [124, 125]. Turner publizierte 1898 Zusammenhänge zwischen der Zahn- und der Zystenentstehung und integrierte die Zysten vollständig als „dentale Zysten“ [125]. Eine Differenzierung der unterschiedlichen Zysten erfolgte erst 1926 durch James und Counsell [125]. Den Begriff „odontogene Keratozyste“ führte Philipsen 1956 [94] ein und 1960/62 stellten Shear [113] sowie Pindborg, Philipsen und Henriksen [96] die pathohistologischen Kriterien für diese keratinisierte Zyste auf [20, 21, 43, 66, 112]. 2 Einleitung Obige Erkenntnisse über die Entstehung der „Keratozyste“ aus Anteilen der embryonalen Zahnleiste, ebenso wie die hohe Rezidivrate, fanden 1971 Eingang in die Klassifikation der Weltgesundheitsorganisation (WHO) [66, 125]. Im selben Jahr wurden die Begriffe „odontogene Keratozyste“ und „Primordialzyste“ als Synonyme von der Weltgesundheitsorganisation (WHO) anerkannt [66, 68, 90]. Zwanzig Jahre später, 1992, erarbeiteten die Oralpathologen Pindborg, Shear und Kramer eine Klassifikation zur „Pathology and Genetics of Head and Neck Tumors“ und differenzierten zwischen Zysten, die ihren Ursprung aus odontogenen und aus nichtodontogenen Epithelzellresten nehmen. In dieser Klassifikation wurde die „Keratozyste“ zu den entwicklungsbedingten, odontogenen, epithelialen Zysten gezählt [66]. Erst 2005 wurden die neuen Ergebnisse über die vereinten Eigenschaften eines benignen Tumors sowie die einer Zyste des keratozystisch odontogenen Tumors in der „revised classification of Head and Neck Tumors“ veröffentlicht. Seitdem wird dieser Tumor offiziell als keratozystisch odontogener Tumor benannt und als benigner uni- oder multilokulärer, intraossärer Tumor odontogenen Ursprungs eingestuft [10]. Die Re- Klassifizierung beruht auf der Basis neuer Ergebnisse durch immunhistologische Untersuchungen in Bezug auf das Wachstum des Tumors sowie auch im Vergleich mit dem als Symptom des Gorlin-Goltz-Syndroms (GGS/ NBCCS) auftretenden Tumoren [10, 49]. 1.2.2. Klassifikation und Epidemiologie der Kieferzysten In der von Barnes, Eveson, Reichart und Sidransky 2005 verfassten Re-Klassifikation der „Head and Neck Tumors“ der WHO wird zwischen den malignen, den benignen und anderen Tumoren im Kopf und Halsbereich unterschieden [10]. Danach werden die benignen Tumore gemäß ihrer Herkunft gruppiert in: o „Tumore aus odontogenem Epithel ohne odontogenes Ektomesenchym“ o „Odontogene epitheliale Tumore mit odontogenem Ektomesenchym, mit oder ohne Hartsubstanzbildung“ o „Odontogene ektomesenchymale Tumore mit oder ohne Einschluss von odontogenem Epithel“ o „Läsionen in Assoziation mit Knochen“ Nach dieser Gruppierung fällt der keratozystisch odontogene Tumor (9270/0) unter die Tumore aus odontogenem Epithel ohne odontogenes Ektomesenchym und muss mitunter 3 Einleitung von dem Ameloblastom, den verkalkenden, epithelialen odontogenen Tumoren sowie dem adenomatoiden odontogenen Tumor differenziert werden [10 36]. Nach der ICD-10-WHO Version von 2013 fällt der keratozystisch odontogene Tumor (K09.0) unter die entwicklungsbedingten odontogenen Zysten [33]. Der keratozystisch odontogene Tumor stellt mit 35% den zweithäufigsten odontogenen Tumor nach dem Ameloblastom und mit 3-11% die dritthäufigste „Kieferzyste“ nach der radikulären und follikulären Zyste dar [8, 13, 18, 36, 88, 109]. Weiter können die odontogenen Zysten in entzündungsbedingte und entwicklungsbedingte Zysten unterteilt werden [47, 109]. Bis 2005 wurde der keratozystisch odontogene Tumor (die „Keratozyste“) zu den odontogenen Zysten gezählt [66]. Auch die rädikuläre, die follikuläre, die gingival und die Parodontalzyste gehören ebenso wie die Residual- und die Pulpazyste zu den odontogenen Zysten [47]. Sie nehmen ihren Ursprung alle in Anteilen der Zahnbildungsorgane [47, 57]. Zu den nicht- odontogenen Zysten zählen die nasoalveolären, die globulomaxillären und die nasopalatinalen Zysten, genauso wie die mediane Gaumen- und Unterkieferzyste. Sie haben ihren Ursprung in den Epithelzellresten entlang der Fusionslinien von embryonal angelegten Fortsätzen [13, 47, 109]. Darüber hinaus gibt es Weichteilzysten und sogenannte Pseudozysten. Die Pseudozysten weisen keine zystenspezifische epitheliale Wandauskleidung auf [13, 47, 109]. Die entzündungsbedingt entstandene radikuläre Zyste macht circa 56% der odontogenen Zysten aus [47, 119]. Sie ist die Folge eines unbehandelten Wurzelspitzengranuloms oder eines marktoten Zahnes, welcher durch eine tiefe Karies oder eine parodontale Läsion entsteht [47, 57, 109]. Auch eine insuffiziente Wurzelkanalbehandlung kann als Ursache genannt werden [36]. Diese Entzündungsreize initiieren die Bildung von Granulationsgewebe und regen die Proliferation der Malessez- Epithelreste an, welche entwicklungsbedingt im Kiefer zurückgeblieben sind. Die Malessez- Epithelreste sind für die Entstehung einer apikalen, radikulären Zyste verantwortlich [47, 88, 109]. Radikuläre Zysten treten bevorzugt zwischen dem 20. und 30. Lebensjahr auf und sind meistens im anterioren Kieferbereich lokalisiert [47, 88, 109]. Follikuläre Zysten lokalisieren sich um die Krone von retinierten, verlagerten Zähnen. Häufig betroffen sind die oberen Eckzähne, die Prämolaren, die Weisheitszähne sowie noch nicht durchgebrochene, verlagerte oder ankyloisierte Milchzähne. Sie entstehen zwischen dem reduzierten und dem inneren Schmelzepithel der Zahnkrone [47, 66, 88, 109]. Radiologisch ist die follikuläre Zyste nicht immer eindeutig von dem keratozystisch 4 Einleitung odontogenen Tumor abgrenzbar. Histologisch lässt sie sich jedoch eindeutig von dem keratozystisch odontogenen Tumor differenzieren [6, 88]. Residualzysten entstehen aus zurückgelassenen Zystengewebsresten nach Entfernung einer Zyste [47, 88]. 1.3. Ätiologie 1.3.1. Embryogenese Beim Menschen beginnt die Zahnentwicklung in der fünften Schwangerschaftswoche [85, 108, 111]. Nachdem die Bildung der primären Mundhöhle abgeschossen ist, wächst das Epithel der Gesichtsfortsätze, welche die Mundhöhle begrenzen, in die Tiefe und bildet die Epithelleiste [67]. Diese Epithelleiste proliferiert über das Knospen- zum Glockenstadium und bildet bis zur 12. Schwangerschaftswoche zehn Zahnanlagen [67, 85, 108, 111]. Parallel zu der Entwicklung der Milchzahnanlagen entwickelt sich ab der achten Schwangerschaftswoche die laterale Zahnleiste für die Zuwachszähne [85, 108, 111]. Bis zum fünften Entwicklungsmonat bildet sich die Zahnleiste zurück, wobei Reste davon, auch Serres- Körper genannt, oder Malassez- Epithelreste aus der Zahnwurzelscheide zurückbleiben und für die Zystenbildung mitverantwortlich sein können [18, 85, 108]. Der für die Entstehung des keratozystisch odontogenen Tumors mitverantwortliche Reiz ist bisher unbekannt [18]. Nach derzeitigen Erkenntnissen spielen entzündliche Prozesse keine Rolle [13, 36]. Ätiopathogenetisch sind odontogene Zysten auf Epithelzellreste zurückzuführen, die während der Odontogenese im Kiefer zurückgeblieben sind [13, 57, 109]. Von ihrem Entstehungsort abhängig weist jede Zyste eine unterschiedliche Ursache für ihre Entstehung auf. Man findet spezifische sowie unspezifische oder entzündliche Reize [47, 109]. Zysten kommen häufig im Knochen, seltener im Weichgewebe, vor. Sie sind histologisch gutartig, haben jedoch meist ein expansives, nicht infiltratives Wachstum, wodurch sie die umliegenden Hart- sowie Weichteilgewebe verdrängen können [47, 66, 88, 109]. 5 Einleitung Abbildung 1: Schematische Darstellung der Entstehung einer odontogenen Zyste: Ruhende Epithelkeime der Zahnleiste/ Proliferierende Epithelzellnester durch einen Reiz ausgelöst/ Epithelzellnester umfassen einen Hohlraum/ Größenzunahme der odontogenen Zyste (Skizze eigenständig angefertigt) Demgegenüber entstehen benigne Tumore reizunabhängig und weisen ein autonomes, langsam-verdrängendes Wachstum auf [16, 100]. Durch vermehrtes Zellwachstum kommt es zu Verdrängung und Kompression des umgebenen Gewebes mit Ausbildung einer Druckatrophie [16]. Benigne Tumore weisen radiologisch eine klare Begrenzung und histologisch, im Vergleich zu malignen Tumoren, einen hohen Differenzierungsgrad auf [16]. Der keratozystisch odontogene Tumor wird ätiologisch auf Reste der embryonalen Zahnleiste sowie auf Basalzellschichtanteile der Mundschleimhaut mit mesenchymaler Herkunft zurückgeführt [1, 10, 68]. Die Klassifikation der WHO von 2005 erweiterte die entwicklungsbedingte Ätiologie, wie sie 1992 festgehalten wurde, mit der Aussage, dass die „Keratozyste“ einem benignen, neoplastischen Wachstumsverhalten unterliegt [10, 66]. Dieses neoplastische Verhalten wird mit dem Vorliegen einer Mutation des PTCH-Gens, welches entscheidenden Einfluss auf den Hedgehog-Signalweg und somit auf die Regulation des Zellzyklus hat, in Zusammenhang gebracht [2, 10, 36, 43, 52, 70, 88]. Mendes et al. [83] stellten mit Hilfe der Proliferationsmarker (Ki-67, p53) eine hohe Zellaktivität der Epithelzellen fest und legten damit immunhistochemische Beweise für das neoplastische Verhalten der „Zyste“ vor [2, 82, 83]. 6 Einleitung 1.4. Pathogenese/ Wachstumskinetik Der keratozystisch odontogene Tumor folgt der Wachstumskinetik von Kieferzysten und weist zudem aktive epitheliale Wachstumsprozesse auf, die ihn zu den benignen Kiefertumoren zählen lassen [18, 44, 53, 91, 131]. Zysten weisen ein sehr spezielles Wachstumsmuster auf. Dieses ist auf die komplexen Wechselbeziehungen zwischen osmotischer Druckdifferenz, entzündlichen Prozessen und einer mangelnden Lymphdrainage zurückzuführen und durch den speziellen pathohistologischen Aufbau der Zysten gekennzeichnet [68, 88, 107, 122]. Die Ansammlung von Entzündungsmediatoren und Detritus bewirkt eine Verschiebung des osmotischen Gleichgewichtes zwischen dem Zystenlumen und seiner Umgebung. Zum Ausgleich strömt extrazelluläre Flüssigkeit durch die Zystenmembran in das Lumen ein und die Zyste nimmt an Volumen zu. Hierbei fungiert das Zystenepithel als semipermeable Membran [68, 88]. Abbildung 2: Schematische Darstellung des Zystenwachstums; Das Zystenepithel fungiert als eine semipermeable Membran, Flüssigkeit strömt in das Lumen (Pfeile), es erfolgt eine Volumenzunahme und eine dadurch bedingte Osteolyse des Knochens (Skizze eigenständig angefertigt) Der Anstieg des osmotischen Drucks führt zu einer volumenbedingten Osteolyse des umgebenen Knochens sowie zu einer Verdrängung des Weichgewebes [68, 88, 107]. Durch die erhöhte Zellumsatzrate des keratozystisch odontogenen Tumors verläuft der Wachstumsprozess hier schneller, gelegentlich schubweise oder auch kontinuierlich [107, 113, 115]. Eine Entzündung des Zystenbalges kann das Wachstum zudem beschleunigen [61, 122]. Die aktiven epithelialen Wachstumsprozesse des keratozystisch odontogenen Tumors werden durch das Vorliegen einer erhöhten Expression von Ki-67 und dem Epidermal Growth Factor (EGF) beschrieben [44, 53, 83, 115, 131]. Weiter haben molekularbiologische Untersuchungen gezeigt, dass spezielle Proteine im Epithel des keratozystisch odontogenen 7 Einleitung Tumors das aktive Wachstum fördern. Zum Beispiel konnte Interleukin 1 nachgewiesen werden, welches die Osteoklasten und somit die Osteolyse stimuliert. Auch Interleukin 6, was die Epithelproliferation anregt, wurde ermittelt [17, 28, 68]. In der Arbeit von Li [71] wird auf die verstärkte Exprimierung des Proliferating Cell Nuclear Antigen (PCNA) hingewiesen, was als weiterer Beweis für eine hohe Mitoserate in dem keratozystisch odontogenen Tumor herangezogen werden kann [17, 83]. Beachtet man das Verhältnis zwischen der Apoptose an den oberen Zellschichten und der Zellproliferation in den basalen Zellschichten des keratozystisch odontogenen Tumors, stellt man fest, dass diese in einem relativen Gleichgewicht stehen und das Potential zur Entartung dadurch minimiert wird [7, 20, 83]. 1.5. Gorlin-Goltz-Syndrom Das Gorlin-Goltz-Syndrom (GGS), auch als Basalzellnävus-Syndrom (GGS/ NBCCS) bekannt, ist ein autosomal- dominant vererbtes Syndrom [52, 112, 129, 132]. Es tritt häufig im frühen Alter während der ersten oder zweiten Lebensdekade auf [3]. Männer und Frauen sind gleichermaßen betroffen. Die Inzidenz liegt bei 1: 60 000, kann regional jedoch variieren [3, 63, 129]. Erste Anzeichen sind multiple im Kiefer auftretende keratozystisch odontogene Tumore. Oft werden diese Symptome des Syndroms während einer routinemäßigen Röntgenkontrolle vom Zahnarzt als Verdachtsdiagnose festgestellt [63, 91, 129]. Als weitere Symptome innerhalb dieses Syndroms zählen multiple Basalzellkarzinome, Skelettanomalien, besonders der Rippen, grübchenförmige Hornschichtdefekte an Händen und Füßen sowie die Verkalkung der Falx ceribri [3, 52, 58, 91, 112, 129]. Das Gorlin-Goltz-Syndrom wurde erstmals im Jahr 1894 von Jarisch und White beschrieben und von Gorlin und Goltz als eigene Erkrankung erkannt [3, 63]. Als eine Ursache für das Gorlin-Goltz-Syndrom findet sich eine Mutation des PTCH-Gens, was als das menschliche Homolog zu dem „Drosophila Patched Gen“ gilt, auf der 9q22-31 Region des 9. Chromosoms [18, 52, 78, 91, 129, 138]. Die PTCH1-Mutation folgt dem „two-hit“ Modell oder der Haploinsuffizienz-Theorie. Diese Theorie geht davon aus, dass die erste Mutation, eine Keimbahn-Mutation, während der Embryogenese und die zweite Mutation, eine somatische Mutation, während der frühen Entwicklung des Individuums auftritt [53, 70, 78, 129]. Das PTCH1 ist ein transmembranärer Rezeptor, der während der epithelialen, mesenchymalen Interaktionen in der HedgehogSignalkette eine entscheidende Rolle spielt [60]. Durch Andocken des Hedgehog-Proteins wird die Blockade, welche PTCH normalerweise auf das SMO-Protein (Smoothened Protein) auswirkt, inaktiviert. Der PTCH1/ SMO-Komplex setzt SMO frei und aktiviert im Weiteren 8 Einleitung Transkriptionsfaktoren (z.B. Gli-1 Zinkfingerproteine). Diese Transkriptionsfaktoren regen die Genexpression im Zellkern an [14, 129]. Eine Mutation des PTCH-Gens führt somit, wie oben aufgeführt, zu schwerwiegenden Fehlbildungen [18, 91, 129]. Zwischen den Syndrom-assoziierten und den nicht Syndrom-assoziierten keratozystisch odontogenen Tumoren gibt es im histologischen Aufbau keinen Unterschied. Jedoch sind die mitotische Aktivität und die Zahl der Satellitenzellen bei Syndrom-assoziierten KZOT erhöht [3, 18, 91]. Dies wird durch den Nachweis von Ki-67 in den Syndrom-assoziierten keratozystisch odontogenen Tumoren untermauert [73]. Li et al. stellen in ihrer Studie die Verbindung zwischen Ki-67 und PTCH-Mutationen in dem Epithel des Tumors dar [73]. Ki-67 ist ein Antigen, welches während der G2-Phase der Interphase des Zellzyklus gebildet, aber sehr schnell wieder abgebaut wird. Dieses Antigen ermöglicht es, die erhöhte Zellaktivitiät in keratozystisch odontogenen Tumoren nachzuweisen [53]. Der Ki-67 Index in keratozystisch odontogenen Tumoren mit PTCH1-Mutation lag in der Studie von Li et al. deutlich höher als bei keratozystisch odontogenen Tumoren ohne diese Mutation [53, 73]. Nach Li et al. leiden 4-5% der an multiplen keratozystisch odontogenen Tumoren erkrankten Patienten an dem Gorlin-Goltz-Syndrom (GGS/ NBCCS) [91, 129]. 1.6. Klinik Die meisten keratozystisch odontogenen Tumore stellen Zufallsbefunde dar [112]. Das Wachstum des keratozystisch odontogenen Tumors verläuft zu Beginn symptomlos [40]. Er wächst intraspongiös und beschränkt sein Wachstum in der Regel auf eine anteriorposteriore Richtung im Unterkieferknochen [24, 43]. Erst im Verlauf der Größenzunahme können Zahnlockerungen, Wurzelspitzenresorptionen und Zahnwanderungen sowie ein unspezifisches Druckgefühl auftreten. Der keratozystisch odontogene Tumor ist in der Lage, die Knochenkompakta zu perforieren und das umliegende Weichteilgewebe zu verdrängen [8, 36, 90, 112]. Dies kann zu Schmerzen, Schwellungen, gelegentlich zu spontaner Pusentleerung und selten bei Verdrängung des Nervus alveolaris inferior auch zu Sensibilitätsstörungen in dem betroffenen Quadranten führen [29, 43, 90, 109]. 9 Einleitung Abbildung 3:Schematische Darstellung eines KZOT mit anterior-posteriorer Ausbreitung im Unterkiefer, beginnender Wurzelresorption und Bildung von Satellitenzysten (Skizze eigenständig angefertigt) Der Tumor kann in allen Altersgruppen auftreten. Vermehrt findet man ihn zwischen der 2. und 4. Lebensdekade [8, 10, 18, 24, 38, 43, 52, 86]. Er tritt häufiger bei Männern als bei Frauen auf [8, 10, 86, 90]. Grundsätzlich kann der keratozystisch odontogene Tumor überall im Kiefer auftreten. Wesentlich häufiger kommt er jedoch im Unterkiefer als im Oberkiefer vor [76]. Im Unterkiefer lokalisiert sich der Tumor üblicherweise in der Region des Kieferwinkels und des aufsteigenden Unterkieferastes [10, 22, 52, 86, 90]. Bei nur 4-5% der Patienten tritt der keratozystisch odontogene Tumor in Assoziation mit dem autosomal dominant vererbten Gorlin-Goltz-Syndrom (GGS/ NBCCS) auf [3]. Im Zusammenhang mit diesem Syndrom kommt der Tumor multilokulär vor [3, 58]. Selten manifestiert er sich auch als multilokulärer oder mehrkammeriger Defekt, ohne dass die Betroffenen an dem oben genannten Syndrom erkrankt sind. Bei diesen Fällen lassen sich dann radiologisch zwei zystische Prozesse feststellen, die an unterschiedlichen Lokalisationen auftreten oder sich als ein großer zystischer Prozess, getrennt durch ein intraluminales Knochenseptum, zeigen [117]. In der Regel tritt der keratozystisch odontogenen Tumor jedoch als unilokulärer Defekt im Kiefer auf [36, 90, 130]. Das Auftreten eines Rezidivs liegt bei 2- 60% [4, 10, 52, 47, 68, 86] und wird innerhalb der ersten drei bis zehn Jahre postoperativ an derselben Lokalisation wie die erste Läsion beobachtet [18]. Rezidive werden meistens während einer radiologischen Kontrolluntersuchung festgestellt, ohne dass der Patient Symptome äußert [90]. Das häufige Auftreten eines Rezidivs macht strenge Nachkontrollen des Tumors notwendig [29]. 1.7. Diagnostik Zu den diagnostischen Untersuchungen gehört eine ausführliche allgemeine sowie spezifische Anamnese, eine klinische intra10 sowie extraorale Untersuchung mit Einleitung Sensibilitätsprüfung der Zähne des betroffenen Quadranten. Des Weiteren sind eine röntgenologische Untersuchung sowie eine Probeentnahme mit histopathologischer Abklärung erforderlich [17, 29, 43, 49, 76, 124]. Zu den standartmäßig angewendeten bildgebenden Diagnostikverfahren gehört die Panoramaschichtaufnahme (OPT/OPG). Mit dieser Methode werden die meisten keratozystisch odontogenen Tumore als Zufallsbefund mit schon fortgeschrittener Größe entdeckt [12, 18, 43, 103]. Zur besseren Darstellung von knöchernen Strukturen ist eine Computertomographie (CT) oder eine, in erster Linie zur Darstellung ossären, dento- maxillo- fazialen Strukturen, Digitale Volumentomographie (DVT) zur Diagnostik erforderlich. Nur eine dreidimensionale Aufnahme ermöglicht die exaktere Bestimmung der Ausdehnung des Tumors und dessen Invasionstiefen in angrenzende anatomische Strukturen [36, 43, 75, 91, 113, 119, 139]. Zur weiteren präoperativen Diagnostik gehört neben den klinischen und radiologischen Verfahren auch eine Probebiopsie [49]. Hierfür werden nach Literaturangaben zwei unterschiedliche Biopsiemethoden angewendet [49, 134]: Bei der Aspirationsbiopsie werden mit einer feinen Biopsienadel Zellbündel und Zysteninhalt entnommen und zur Untersuchung verschickt [32, 58, 64, 98]. Mit Hilfe der Aspirationsbiopsie kann neben der Gewebsuntersuchung auch der Zysteninhalt analysiert werden. Dieser wird auf die unterschiedlichen Konzentrationen von Zytokinen, Interleukinen sowie Tumor Nekrose Fakoren (TNF) untersucht, welche sich zwischen einem KZOT, einem Ameloblastom und odontogenen Zysten differenzieren sollen [64]. Der Vorteil der Aspirationsbiopsie ist, dass es ein kurzer, minimalinvasiver und unter Lokalanästhesie durchzuführender Eingriff ist. Als Nachteil dieser Methode gilt, dass nur kleine Materialproben entnommen werden können und die Differenzierung dadurch für den Pathologen erschwert ist [30, 32]. Die Inzisionsbiopsie bietet die Möglichkeit, größere Gewebsproben zu entnehmen. Hier wird ein Skalpellschnitt durchgeführt und eine Probe entnommen [58, 134]. Dies kann sowohl in Lokalanästhesie als auch unter allgemeiner Narkose erfolgen. Generell stellt die aussagekräftigere Inzisionsbiopsie eine größere Belastung für den Patienten dar. Als Nachteilig gilt jedoch, dass es zu einer Infektion im Entnahmebereich kommen kann, welche die weitere Therapie beeinträchtigen kann [57]. 11 Einleitung 1.8. Differentialdiagnosen Als Differentialdiagnose müssen unter anderem eine Residualzyste, eine verhornte odontogene Zyste, eine laterale radikuläre Zyste ohne Parodontalspaltbildung, eine solitäre Knochenzyste, ein ameloblastisches Fibrom, ein odontogenes Myxofibrom, ein Ameloblastom, ein osteolytisches Sarkom sowie ein maligner Knochentumor in Betracht gezogen werden [6, 24, 58, 77, 116]. Die klinischen Symptome sind unspezifisch. So lassen sich eine anfängliche Beschwerdefreiheit, eine eventuell gering vorhandene knöcherne Auftreibung und nervale Störungen nur schwer als differentialdiagnostische Kriterien gegenüber entzündlichen Prozessen (z.B. Osteomyelitis) oder malignen Tumoren erfassen [8, 17, 18]. Klinisch können das Auseinanderweichen von Zähnen, deren Lockerung oder Wurzelresorptionen als erste Anzeichen eines „zystischen Prozesses“ interpretiert werden [28, 68, 88]. In einem fortgeschrittenen Stadium können bei Palpation Geräusche wie „Pergamentpapierknistern“ durch die Auftreibungen des Knochens vorkommen. Sogar Spontanfrakturen des Kieferknochens werden in der Literatur angeführt. Alle diese Symptome können zwar als charakteristisch angesehen werden, gelten jedoch nicht ausschließlich für den keratozystisch odontogenen Tumor [18, 40]. Radiologisch muss der benigne keratozystisch odontogene Tumor differentialdiagnostisch auch von den radikulären Zysten, den lateralen Parodontalzysten und follikularen Zysten sowie dem Ameloblastom und dem Plattenepithelkarzinom abgegrenzt werden [18, 24, 28, 44, 89, 116, 136]. Auf dem Röntgenbild zeigt der keratozystisch odontogene Tumor eine rundlich-ovale Aufhellung mit definiertem, gewelltem Rand. Er ist dabei nur schwer von anderen Kieferzysten zu unterscheiden [17, 90, 116, 117, 130]. Im Oberkiefer vorkommende keratozystisch odontogene Tumore sind radiologisch noch schwerer zu differenzieren, da hier die Überlagerung der Kieferhöhlenwände erhebliche Schwierigkeiten bereitet [18, 43, 81, 98, 117]. In 20-40% der Röntgenbilder steht der keratozystisch odontogene Tumor in direktem Bezug zu einem retinierten, verlagerten Zahn und kann radiologisch an eine follikuläre oder radikuläre Zyste denken lassen [18]. Entwicklungsbedingt entspringt diese „Zyste“ dennoch häufiger aus primären Anteilen der Zahnleiste, was sich nur durch eine histologische Untersuchung des auskleidenden Epithels klären lässt [6, 20, 116]. Diese nach Altini et al. [6] beschriebene „follikuläre Primordialzyste“ entsteht, indem der verlagerte Zahn in das Lumen 12 Einleitung der schon vorhandenen „Zyste“ einbricht und dabei das Zystenepithel mit dem Zahnfollikelepithel fusioniert [6]. Mehrkammerige zystische Veränderungen in der Region der dritten Molaren und in den aufsteigenden Ästen des Unterkiefers können radiologisch als keratozystisch odontogener Tumor bewertet werden, da dieser dort häufiger als die follikuläre sowie radikuläre Zyste und die Ameloblastome vorkommt [18, 81, 116]. Die histopathologische Differenzialdiagnose beruht auf dem im Vergleich zu anderen Zysten schon oben angesprochenen besonderen Wandaufbau des keratozystisch odontogenen Tumors und ist unabdingbar für eine sichere Diagnose [76]. Wird die Zellumsatzrate des keratozystisch odontogenen Tumors durch immunhistochemische Messungen des epidermal growth factors (EGF) mit den von Ameloblastomen verglichen, stellt man fest, dass diese in beiden Neoplasien im Gegensatz zu den odontogenen Zysten erhöht ist [83, 131]. Mendes et al. [83] fanden in den Basalzellen des keratozystisch odontogenen Tumors einen mit Ameloblastomen vergleichbar hohen Proliferationsindex vor [83]. Darüber hinaus variiert die Markierung mit Proliferationsmarkern wie Ki-67, Proliferations Cell Nuclear Antigen (PCNA) und p53 deutlich [65, 82, 83]. p53 ist ein Phosphorprotein, das eine Schlüsselrolle bei der Überwachung des Zellzyklus zwischen der M- und S- Phase einnimmt und für die Apoptose mitverantwortlich ist [18]. 88,2% der KZOT-Zellen in einer Studie von Wagner et al. [131] reagierten p53-positiv in der immunhistochemischen Analyse der p53-Proteinexpression. Die im Vergleich untersuchten radikulären sowie follikulären Zysten hingegen fielen negativ aus [131]. 1.9. Histologie In den ersten beiden Klassifikationen der WHO zu Kieferzysten aus den Jahren 1971 und 1992 wird der keratozystisch odontogene Tumor histologisch als „parakeratinisierte odontogene Keratozyste“ beschrieben, welche auch mit orthokeratinisiertem Epithel auftreten kann [61, 77]. In der Klassifikation der WHO von 2005 wird, anlehnend an die unterschiedlichen Eigenschaften der orthokeratinisierten und parakeratinisierten Form, die orthokeratinisierte Form als eigenständige „Zyste“ beziehungsweise orthokeratinisierter keratozystischer Tumor (OKC) kategorisiert [3, 18, 20, 21, 32]. Histologisch ist der parakeratinisierte keratozystisch odontogene Tumor von der verhornenden odontogenen Zyste, von der nicht verhornenden Epithelzyste sowie von der follikulären Zyste und der radikulären Zyste abzugrenzen [36]. Die epithelialen odontogenen 13 Einleitung Zysten weisen histologisch eine dicke, nicht verhornte Epithelschicht, umgeben von einer bindegewebigen Kapsel, welche zusammen den Zystenbalg darstellen, auf. In dem umgebenen Bindegewebe findet man häufig Anzeichen einer Entzündung wie zum Beispiel die Ansammlung von Makrophagen, Mastzellen, Granulozyten und Lymphozyten [8, 20]. Im histologischen Vergleich zu diesen Zysten weist der parakeratinisierte keratozystisch odontogene Tumor eine sechs- bis acht- lagige parakeratinisierte Plattenepithelschicht mit flacher, klar definierter Basalzellschicht ohne Anzeichen von Reteleisten auf. Angrenzend befindet sich die bindegewebige Zystenkapsel. Der Zystenbalg ist dünner als bei den epithelialen, unverhornten Zysten [2, 8, 18, 20, 36, 74]. Abbildung 4: Das Epithel eines KZOT zeigt die typische prominente Basalzellschicht, etwa 5-6 Zellschichten, eine Parakeratose; Reteleisten sind nur angedeutet zu erkennen (x400). Die Abbildung wurde durch das Institut für Pathologie der Medizinischen Hochschule Hannover, Direktor: Prof. Dr. H.-H. Kreipe, zur Verfügung gestellt. Das entscheidende Merkmal zur histologischen Differenzialdiagnose für den keratozystisch odontogenen Tumor sind die flach verlaufenden, palisadenförmig angeordneten Basalzellen des Stratum basale, welche stark basophil anfärbbar und durch einen hypochromen, zentral gelegenen Zellkern gekennzeichnet sind. Zusätzlich werden vermehrte Mitoseraten in den suprabasalen Zellschichten gefunden [18, 20, 74, 131]. Ein Stratum spinosum sowie ein Stratum granulosum findet sich selten oder fehlt in der Regel vollständig. Eine dünne, oft gewellte Parakeratinschicht prägt das Stratum corneum. Zudem können intrazelluläre Ödeme in den Zellen des Stratum spinosum festgestellt werden [20, 21, 74]. Durch die fehlenden oder nur spärlich vorkommenden Reteleisten ist die Verbindung des bindegewebigen Zystenbalges und des Zystenepithels nur schwach bis gar nicht ausgebildet [18, 20, 21, 36]. Grundsätzlich weisen keratozystisch odontogene Tumore keine Entzündungszeichen auf [40]. Kommt es jedoch zu einer Entzündung des keratozystisch odontogenen Tumors, weist 14 Einleitung dieser stark veränderte histologische Merkmale auf, was die histopathologische Differenzialdiagnose zwischen einer entzündeten follikulären- oder radikulären Zyste und dem Tumor erschwert [40, 54, 61, 118, 131]. In dem umgebenen Weichteilgewebe finden sich oftmals Mikrozysten, sogenannte Satellitenzysten, bei denen es sich um selbständige Zysten oder Ausläufer der Hauptzyste handelt. Sie sind unter anderem für das häufige Auftreten von Rezidiven des Tumors verantwortlich [20, 32]. Die Satellitenzysten können über Zellstränge mit der Mutterzyste in Verbindung stehen [107]. Der orthokeratinisierte keratozystisch odontogene Tumor (OKC) weist einen anderen epithelialen Wandaufbau auf als die parakeratinisierte Form, sowie ein langsameres, minder verdrängendes Wachstum [18, 20, 32, 74, 137]. Der orthokeratinisierte Typ ist durch eine dünnere Plattenepithelzellschicht gekennzeichnet. Im Gegensatz zu der parakeratinisierten Form ist die Orthokeratinschicht ausgeprägt und nicht gewellt [18, 20, 74]. Lichtmikroskopisch findet man ein ausgeprägtes Stratum granulosum und flache bis kubische, nicht polarisierte Basalzellen [18, 20]. Radiologisch hat die orthokeratinisierte Form einen klar definierten, nicht gewellten Rand. Sie ist häufiger in Assoziation mit einem retinierten Zahn zu finden [74]. Gemäß der vorliegenden Literatur tritt der parakeratinisierte keratozystisch odontogene Tumor häufiger (80%) auf als die orthokeratinisierte Läsion [74]. Wie auch die parakeratinisierte- ist die orthokeratinisierte Form bei Männern vermehrt zu finden, zeigt allerdings ein weniger aggressives Verhalten und eine geringere Neigung zur Rezidivbildung [18, 32, 74]. Ebenso wie bei den odontogenen Zysten gibt es auch bei den keratozystisch odontogenen Tumoren Fälle, in welchen eine maligne Entartung beobachtet wurde [20, 131]. 1.10.Genetik Neben einer erhöhten Zellproliferationsrate in den keratozystisch odontogenen Tumoren wurde eine Genmutation für das Auftreten des keratozystisch odontogenen Tumors verantwortlich gemacht [36]. Dies wurde durch vergleichende immunhistologische Untersuchungen zwischen den Tumoren mit und ohne Assoziation zu dem Gorlin-GoltzSyndrom (GGS/ NBCCS) ausfindig gemacht [36, 51, 129, 132]. Verantwortlich für das GorlinGoltz-Syndrom ist, wie bereits erwähnt, die Mutation des PTCH-Gens auf der 9q22-31 Region des 9. Chromosoms [2, 10, 51, 52, 138]. Unterschiedliche Studien konnten diese Mutation mit dem Verlust der Heterozygotie in Patienten ohne Gorlin-Goltz-Syndrom 15 Einleitung feststellen [2, 36, 58]. Die keratozystisch odontogenen Tumore weisen deshalb nicht nur einen entwicklungsbedingten Hintergrund auf, sondern vielmehr spielt die Genetik der erkrankten Patienten eine große Rolle [2, 36, 58, 138]. 1.11.Therapiemethoden von Zysten Keratozystisch odontogene Tumore müssen operativ entfernt und histologisch untersucht werden, um eine sichere Diagnose stellen und eine maligne Entartung ausschließen zu können [46, 109]. Es gibt grundsätzlich zwei Formen der allgemeinen Zystenbehandlung (beschrieben nach dem Erstanwender Partsch): Die Zystostomie (Partsch I) und die Zystektomie (Partsch II) [1, 19, 47]. 1.11.1. Zystostomie (ZO) Bei der Zystostomie handelt es sich um einen weniger radikalen operativen Eingriff, bei dem das Zystenlumen von intraoral eröffnet, der Zystenbalg an der oralen Mukosa fixiert und so das Zystenlumen zu einer Nebenbucht der Mundhöhle geformt wird [1, 13, 47, 68, 88, 109]. Diese Methode führt zur Druckentlastung im Zystenhohlraum. Der intraluminale Stimulus zum weiteren Wachstum der Zyste wird aufgehoben. Durch appositionelles Knochenwachstum kommt es langsam zur Defektauffüllung [1, 75]. Abbildung 5: Schematische Darstellung einer Zystostomie: Apikale Zyste um Zahnwurzel mit paramarginaler Schnittführung; Anlegen des Zystenfenster und Wurzelspitzenresektion + Einschlagen des Mukoperiostlappens ins Lumen/ Einbringen der Obturatorprothese zur Offenhaltung des Lumens (Skizze eigenständig angefertigt) 16 Einleitung Um eine sekundäre Wundinfektion zu vermeiden und eine Verkleinerung des Lumens basal zu stimulieren, wird die Wunde mit einem Obturator offen gehalten und regelmäßig mit Kochsalz (0,9% NaCl) gespült. Der Obturator wird bei jeder Kontrolluntersuchung an den Heilungsprozess angepasst [1]. Die Zystostomie wird vorwiegend bei sehr großen Zysten angewendet, um eine Schädigung anatomischer Strukturen wie dem Nervus alveolaris inferior, der Zähne oder den Kieferhöhlen zu vermeiden [39, 75]. Zudem ist es für ältere, nicht belastungsfähige Patienten eine schonende Operationsmethode [75]. Nachteilhaft ist, dass diese Methode eine gute Compliance des Patienten voraussetzt [1, 17, 47, 68]. Sekundär kann nach Verkleinerung des Lumens an die Zystostomie eine Zystektomie angeschlossen werden [1, 79]. Als alleinige Operationsmethode eines keratozystisch odontogenen Tumors kommt die Anwendung der Zystostomie nicht mehr in Betracht, da dieser Tumor eine komplette Entfernung des Zystenepithels erfordert, um ein Wiederauftreten zu minimieren [43]. 1.11.2. Zystektomie (ZE) Unter Zystektomie versteht man die vollständige Entfernung der Zyste einschließlich des Zystenbalgs. Nach speicheldichtem Wundverschluss entsteht bei kleineren Zysten die knöcherne Regeneration durch die Re-Organisation des intraluminalen Bindegewebes in knöchernes Gewebe [1, 47, 68, 109]. Abbildung 6: Schematische Darstellung einer Zystektomie: zystischer Prozess apikal eines Zahnes/ Entfernung der Zyste und des Zystenbalges mit anschließender WSR/ Speicheldichter Wundverschluss (Skizze eigenständig angefertigt) Die Zystektomie wird als Operationsmethode der Wahl bei dem keratozystisch odontogenen Tumor angewendet. Sie minimiert die postoperative Entzündungsgefahr durch den 17 Einleitung speicheldichten Wundverschluss [1, 126]. Die Zystektomie stellt postoperativ in der Regel eine geringe Belastung für den Patienten dar [1, 47]. Im Laufe der letzten Jahrzehnte wurden unterschiedliche Variationen und Erweiterungen der Zystektomie zur Entfernung des keratozystisch odontogenen Tumors entwickelt [1, 126]. Diese Entwicklungen beruhen auf dem histologischen Aufbau des Tumors. Da das auskleidende Epithel des Tumors im Vergleich zu anderen Zysten relativ dünn und schwer zu entfernen ist, steigt hierbei die Gefahr, Epithelanteile und Satellitenzysten zurückzulassen [1, 42]. Gerade diese Epithelreste werden von vielen Autoren für das hohe Wiederauftreten des keratozystisch odontogenen Tumors verantwortlich gemacht [1, 10, 43]. Als Beispiel einer erweiterten Zystektomie kann die Anwendung von der Carnoyschen Lösung angeführt werden. Die Lösung setzt sich aus 1g Eisen-(III)-Chlorid, 1ml Eisessigsäure, 3ml Chloroform und 6ml Ethylalkohol zusammen und wird für drei bis fünf Minuten in das Zystenlumen eingebracht, entweder bevor oder nachdem der Zystenbalg komplett entfernt wurde. Die Carnoysche Lösung wirkt durch Denaturierung von Proteinen, Nukleinsäuren und fast allen anderen organischen Molekülen [1, 29, 42, 52, 86, 106, 118]. Wird die Carnoysche Lösung vor Entfernung des Zystenbalgs eingebracht, ermöglicht sie durch die Fixierung des Zystenbalgs eine zuverlässigere Entfernung des Zystenbalgs durch den Operateur [42, 118]. Das Ziel dieser Methode ist es nach möglichst vollständiger Entfernung des Zystenbalgs auch Satellitenzysten und/oder eventuell zurückbleibende Zellen abzutöten und dadurch das Entstehen eines Rezidivs zu verhindern [1, 29, 42, 52]. Sie sollte nur verwendet werden, wenn der Nervus alverolaris inferior und die angrenzenden Zahnwurzeln dadurch nicht geschädigt werden [42, 106]. Als weitere erfolgversprechende Therapieoptionen werden in der Literatur die Kyrotherapie oder die Elektrokauterie anschließend an die Zystektomie zur Behandlung des Zystenlumens angeführt. Auch diese Methoden haben zum Ziel, die Satellitenzysten in der Zystenumgebung zu eliminieren [1, 15, 17, 41, 42, 98, 118, 126, 127]. Neben dem Ausfräsen des Zystenlumens wird als Ultima Ratio bei großen Tumoren die Teiloder sogar Kontinuitätsresektion des Kiefers herangezogen [1, 52]. Dabei wird so viel Knochensubstanz und Weichgewebe entfernt, wie es der Tumor erfordert. Die entstandene Schwächung des betroffenen Kieferabschnittes kann durch Miniplattenosteosynthese stabilisiert oder im Falle eines Kontinuitätsverlustes durch eine Rekonstruktionsplatte überbrückt werden [1, 109]. 18 Einleitung Zusammenfassend lässt sich auf eine Vielzahl möglicher Operationsmethoden blicken. Dies ist besonders auf die Schwierigkeit, das Zystenepithel vollständig zu entfernen, zurückzuführen. Das Ziel aller Operationsmethoden ist es, das Zystenepithel und die Satellitenzysten vollständig zu entfernen und dabei gleichzeitig möglichst schonend für das umliegende Gewebe und den Patienten vorzugehen. 1.12.Augmentationsmaterial Ist der entstandene Defekt nach dem operativen Eingriff so groß, dass eine Stabilität des Kieferknochens nicht mehr gewährleistet ist, muss, um diese wiederherzustellen und um die körpereigene Knochenregeneration zu unterstützen, eine Defektauffüllung durchgeführt werden. Größerer Zystenlumina dienen diese Verfahren auch der Infektionsprophylaxe [35, 57, 91, 104, 135]. Um den Defekt sicher aufzufüllen und eine gute postoperative Heilung zu gewährleisten, stehen diverse Knochentransplantate und Knochenersatzmaterialien zur Verfügung [35, 57, 101, 135]: o autogene (früher: autologe) Knochentransplantate o allogene Knochentransplantate o xenogene Knochentransplantate o alloplastische Knochentransplantate 1.12.1. Autogene Knochentransplantate Unter autogenen Knochentransplantaten versteht man körpereigenen Knochen, welcher von einer Region in eine andere Region desselben Organismus transplantiert wird [45, 57, 91, 104]. Die Transplantation von autogenem Knochen erweist sich als sicherste Methode, da hier keine Abstoßungsreaktionen auftreten [27, 93, 57, 91, 104]. Innerhalb der autogenen Knochentransplantate kann man zwischen avaskulären sowie mikrovaskulär-anastomosierten Knochentransplantaten unterscheiden [9, 35]. In der Mund-, Kiefer- und Gesichtschirurgie wird bei kleineren Kieferdefekten Knochen aus der lokalen Umgebung, zum Beispiel der Kinn- oder Korpusregion des Unterkiefers, transplantiert. Bei größeren Defekten können avaskuläre Blocktransplantate aus extraoralen Regionen wie der Schädelkalotte und dem Beckenkamm entnommen und transplantiert werden [35, 57, 91, 93, 135]. Je nach Entnahmeregion und Menge des benötigten Knochens wird dieser mit Hilfe 19 Einleitung von Knochenmeißeln, Knochenstanzen, Knochensägen oder dem relativ neu entwickelten „Bone- Scraper“ zum Erhalt von Knochenspänen gewonnen [57, 91, 135]. Avaskuläre Knochentransplantate wirken osteoinduktiv. Sie regen die Knochenneubildung mit Hilfe von Wachstumsfaktoren (BMP) an. Weiter fungieren sie osteokonduktiv als Leitschiene für den neugebildeten Knochen. Das eingebrachte avaskuläre Knochenmaterial wird langsam durch Osteoklasten abgebaut und sukzessiv durch den neugebildeten Knochen ersetzt [57]. Bei großen Defekten mit Gesichtschirurgie zur Kontinuitätsverlust Rekonstruktion des dienen in Unterkiefers der Mund-, Kiefer- und mikrovaskulär-anastomosierte Knochentransplantate, wie zum Beispiel in Form eines Fibula- oder Skapulatransplantats [9, 37, 69, 128]. Hierbei werden zusätzlich zum transplantierten Knochen die versorgenden Gefäße entnommen und im Empfängergebiet angeschlossen. Durch die operativ hergestellten Anastomosen gewährleistet diese Methode eine direkte Blutversorgung des Transplantats und ermöglicht somit, große Kontinuitätsverluste mit autogenem Knochen zu rekonstruieren [9, 93, 57, 128]. Zur knöchernen Einheilung, welche analog einer Frakturheilung abläuft, müssen die mirkovaskulär verpflanzten Transplantate durch Osteosynthese fixiert werden. Bei Bedarf kann neben dem Knochen auch Weichgewebe gehoben werden, welches der Wiederherstellung von enoraler Schleimhaut dient [61]. Als Nachteil der autogenen Knochentransplantation ist der zusätzliche operative Eingriff mit einem Stabilitätsverlust im Entnahmebereich zu nennen, welcher mit einer erhöhten Frakturgefahr einhergeht. Weiter muss die schnelle, unkontrollierbare Resorption des autogenen Materials in der Einheilphase als Nachteil genannt werden [57, 101, 104]. Außerdem gilt es, die Gefahr einer Wundinfektion sowie die Wundheilungsstörung der Empfängerregion zu beachten. Ergänzend muss angemerkt werden, dass autogenes Knochenmaterial nicht unbegrenzt verfügbar ist [57, 101, 104]. 1.12.2. Allogene Knochentransplantate Allogene Knochentransplantate sind Knochentransplantate, welche von einem Organismus auf einen anderen Organismus derselben Spezies verpflanzt werden (z.B. von Mensch zu Mensch) [57]. Die allogenen Knochentransplantate wirken sowohl osteokonduktiv als auch in Abhängigkeit von dem Aufbereitungsprozess in gewisser Weise osteoinduktiv [91, 104]. Um die Übertragung von Infektionskrankheiten auszuschließen werden die allogenen Transplantate (z.B. Tutoplast®) durch 20 bestimmte Konservierungs- und Einleitung Sterilisationsverfahren behandelt, sodass sie ihre antigenen Eigenschaften verlieren und jegliche Infektionserreger (Bakterien/ Viren) eliminiert werden [34]. Die streng kontrollierte Prozessierung dieser Gewebe macht es heute nicht mehr erforderlich, eventuelle Abstoßungsreaktion mit Hilfe von Medikamenten zu unterdrücken. Ein Restrisiko ist jedoch nicht gänzlich auszuschließen [91, 104]. 1.12.3. Xenogenen Knochentransplantate Bei xenogenen Transplantaten (z.B. deproteinized bovine bone substitute Bio-Oss® (BO, Geistlich, Wolhusen, Suisse)) werden Knochentransplantate von einer Spezies auf eine andere Spezies übertragen (z.B. von Tier zu Mensch) [35, 48, 57]. Sie haben lediglich eine osteokonduktive Wirkung [57]. Dieser Knochen muss vor der Transplantation aufwändig aufbereitet werden, um eine Abstoßungsreaktion des Empfängerorganismus zu verhindern und um übertragbare Krankheitserreger zu eliminieren [57]. Diese Knochentransplantate dienen nur zur Defektauffüllung und als Baugerüst für den körpereigenen Knochen [57]. Für kleinere Knochendefekte wird vermehrt Kollagenvlies (z.B. KOLLAGEN resorbTM von Resorba; equine native Kollagenfibrillen (Achillessehnen des Pferdes)) verwendet. 1.12.4. Alloplastische Knochentransplantate Die alloplastischen Transplantate sind synthetisch hergestellte Knochenmaterialien, welche zur Defektauffüllung genutzt werden. Es stehen unterschiedliche Materialien zur Verfügung [91, 104]. In der Mund-, Kiefer- und Gesichtschirurgie am häufigsten zum Einsatz kommende Materialien sind Keramiken (z.B. nicht resorbierbar: Hydroxylapatit (z.B. nanocrystalline hydroxyapatite bone substitute NanoBone (NB); resorbierbar: Trikalziumphosphate (TCP)) [48, 57, 91, 120]. Durch ihre osteokonduktive Eigenschaft dienen sie als Leitschiene für den neugebildeten Knochen und haben sich bei kleineren Knochendefekten als nutzbar erwiesen [104]. Sie sind stets verfügbar und erfordern keinen zusätzlichen Eingriff am Patienten [91]. 21 Einleitung 1.13.Hohe Rezidivinzidenz Die Rate der Rezidive des keratozystisch odontogenen Tumors stellt immer noch ein ungelöstes und viel diskutiertes Problem in Bezug auf die Anwendung der wirksamsten Behandlung des Tumors dar [97]. Die Rezidivrate beträgt nach Angaben der Literatur zwischen 2 und 62% [4, 8, 10, 38, 41, 43, 78, 86, 112, 123, 130]. Autor (Jahr/ Land) Voorsmith et al. [130] Anzahl der Nachkontroll- Rezidive Patienten zeit 92 1-21 Jahre 8,6% 82 1-25 Jahre 10,9% 65 >1 Jahr 29,2% 27 >6 Monate 62% 45 >5 Jahre 27% 87 >5 Jahre 28,7% 21 2 Monate – 29% (1981/Niederlande) Stolinga et al. [117] (2001/Niederlande) Tinichin et al. [123] (2012/South Africa) Pindborg und Hansen [96] (1963, Dänemark) Patridge et al.[90] (1987/England) ElHaji et al. [38] (1996/Schweden) Madras et al. [78] (2008/England) Morgan et al. [86] 7 Jahre 40 1-24 Jahre 22,5% (2005/USA) Tabelle 1: Übersicht einzelner Studienergebnisse im Bezug auf die Rezidive, der Kontrollzeit und untersuchter Fallzahl Nach Literaturangaben können Rezidive fünf bis 17 Jahren nach der Erstoperation auftreten und werden in der Regel röntgenologisch bei den Kontrolluntersuchungen entdeckt [8, 17, 41]. Eine mögliche Ursache scheint das dünne Zystenepithel des keratozystisch odontogenen Tumors zu sein, welches aufgrund von fehlenden Reteleisten nur leicht oder gar nicht mit der Bindegewebskapsel verwachsen ist [41, 112]. Dadurch zerreißt es beim Exkavieren der Zyste häufig und Epithelreste verbleiben im Kieferknochen. Diese entwickeln sich postoperativ erneut zu einem Tumor und bilden das Rezidiv [8, 112]. Weiter können von dem 22 Einleitung Zystenepithel Zellstränge in die Spongiosaräume des umgebenden Knochens oder in die benachbarten Weichteile wachsen und für die hohe Rate (bis zu 50%) von Satellitenzysten in dem umgebenen Gewebe verantwortlich sein [18, 31]. Die gebildeten Satellitenzysten werden oft nur teilweise oder gar nicht entfernt und begünstigen das Auftreten eines Rezidivs [68]. Trotz vielfältiger Operationsmethoden konnte das Auftreten der hohen Rezidivrate bislang nicht gelöst werden [8]. 23 Einleitung 1.14. Fragestellung Der keratozystisch odontogene Tumor wird seit 2005 von der Weltgesundheitsorganisation (WHO) in der „revised classification of Head and Neck Tumors“ als benigner uni- oder multilokulärer, intraossärer Tumor odontogenen Ursprungs eingestuft [10]. Diese Einstufung beruht auf den besonderen klinischen sowie histopathologischen Merkmalen, wie zum Beispiel die Fähigkeit zur Bildung von Satellitenzysten und die damit verbundenen hohen Rezidivinzidenzen. Trotz zahlreicher Studien liegt bis heute kein einheitlicher Konsens zu einer effektiven therapeutischen Behandlung der keratozystisch odontogenen Tumore vor. Das primäre Ziel der vorliegenden retrospektiven Arbeit war es, die Rezidivinzidenz des keratozystisch odontogenen Tumors (KZOT) nach unterschiedlichen Operationsmethoden anhand eines ausgewählten Patientenkollektivs der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover in einem Zeitraum von 20 Jahren (01.01.1991 bis 31.12.2010) wissenschaftlich zu erfassen und zu analysieren. Darüber hinaus sollte ein besseres Verständnis der Ätiopathogenese des KZOT geschaffen, das klinische Verhalten ausgewertet und in den Gesamtkontext der Fachliteratur eingeordnet werden. Zum Erreichen obiger Ziele sollen folgende Fragen beantwortet werden: 1) In welchem Alter wurde der KZOT erstmals bei den Patienten diagnostiziert? 2) Waren Männer und Frauen gleichhäufig von dem KZOT betroffen? 3) Wo lokalisierte sich der KZOT am häufigsten? 4) Welche Größe wies der KZOT auf? 5) Wurde der KZOT durch bestimmte klinische Symptome auffällig oder als Zufallsbefund diagnostiziert? 6) Wie viele und welche Art der Therapiemethoden kamen zum Einsatz? 7) Welche Art der Defektauffüllung wurde genutzt und wie häufig kam dies zur Anwendung? 8) Wie lange waren die Nachuntersuchungszeiträume? 9) Wie häufig wurden Rezidive diagnostiziert? 10) Wie lange war der Zeitraum zwischen der Primäroperation und dem Auftreten von Rezidiven? 11) Ist das Rezidivverhalten des KZOTs geschlechts- oder altersabhängig? 12) Lässt sich für aggressive Operationsmethoden ein Vorteil hinsichtlich einer geringeren Rezidivrate statistisch nachweisen? 24 Material und Auswertungsmethoden 2. Material und Auswertungsmethoden 2.1. Studiendesign Grundlage der vorliegenden retrospektiven Arbeit über das klinische Verhalten des keratozystisch odontogenen Tumors (KZOT) waren insgesamt 405 Akten von Patienten, die in dem Zeitraum von 1991 bis 2010 an der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover operativ therapiert wurden. Nach der vorgegebenen Stichwortsuche: „Keratozyste, odontogene Keratozyste oder keratozystisch odontogener Tumor“ wurden von dem Institut für Pathologie der Medizinischen Hochschule Hannover, Direktor: Prof. Dr. H.-H. Kreipe, 405 Patientenakten ausgewählt und für die Auswertung zur Verfügung gestellt. Diese 405 Patientenakten stellten das Ausgangsmaterial dieser Arbeit dar. Von diesen 405 Patientenakten wurden 291 Akten aus dem Patientenkollektiv für diese Studie aussortiert. Der Grund hierfür war, dass bei 131 Patientenakten die Verdachtsdiagnose nicht bestätigt werden konnte, sondern der endgültige Befund „odontogene“, „follikuläre“, „radikuläre“ oder „nasoalveoläre Zyste“ lautete. Als endgültiger Befund lagen hier 40 radikuläre Zysten, 51 follikuläre Zysten, 18 nicht näher spezifizierte odontogene Zysten und 22 andere Zysten (z.B. nasolabiale Zysten, solitäre Knochenzysten, Kieferhöhlenzysten) vor. Aufgrund der Überschreitung der Aufbewahrungspflicht von zehn Jahren1 lagen 123 Akten nicht mehr im Patientenarchiv der Medizinischen Hochschule Hannover vor und konnten daher nicht mehr in die Studie einbezogen werden [11, 25]. Bei 151 Patienten lag ein durch das Institut für Pathologie der Medizinischen Hochschule Hannover gesicherter histopathologischer Befund „Keratozyste, odontogene Keratozyste oder keratozystisch odontogener Tumor“ vor. Von diesen 151 Patienten wiesen 114 Patienten einen Nachkontrollzeitraum von zwei Monaten bis zu 20 Jahren auf. Bei 37 Patienten betrug der Nachkontrollzeitraum weniger als zwei Monate, weshalb sie aus der Studie ausgeschlossen wurden. 1 (nach der LÄK-Berufsordnungen § 10 Dokumentationspflicht (3) Ärztliche Aufzeichnungen sind für die Dauer von zehn Jahren nach Abschluss der Behandlung aufzubewahren, soweit nicht nach gesetzlichen Vorschriften eine längere Aufbewahrungspflicht besteht.) 25 Material und Auswertungsmethoden Drei Patienten des Untersuchungskollektivs litten an dem Gorlin-Goltz-Syndrom. Diese Patienten wurden in dieser Arbeit separat untersucht und aufgelistet. 405 Patienten 291 Patienten wurden ausgeschlossen 114 mit endgültigem Befund "KZOT" und Kontrollzeitraum von mind. 2 Monaten 37 Patienten wiesen einen Beobachtungszeitraum von weniger als 2 Monaten auf und wurden somit ausgeschlossen 3 Patienten litten an dem Gorlin-Goltz-Syndrom und wurden in dieser Arbeit separat untersucht und aufgelistet 131 mit anderem endgültigem Befund (z.B.:„odontogene“, „follikuläre“, „radikuläre“ oder „nasoalveoläre Zyste“ 123 Patienten konnten aufgrund Überschreitung der Aufbewahrungsfrist (10 Jahre) nicht mehr ausfindig gemacht werden Abbildung 7: Veranschaulichung der Auswahl der Patienten 26 Material und Auswertungsmethoden 2.2. Auswertungsmethoden Die Datenerhebung aus den 114 stationären und ambulanten Krankenakten erfolgte nach folgenden Kriterien (siehe auch Tabelle 14): o Geburtsdatum/ Geschlecht o Alter des Patienten bei Erstdiagnose des keratozystisch odontogenen Tumors o medizinische Anamnese (Vorliegen des Gorlin-Goltz-Syndroms) o klinische Symptome o Lokalisation o Lagebeziehung der Zyste zu Nachbarzähnen/ zum Nervus alveolaris inferior o Ausdehnung nach radiologischen Kriterien o Operative Therapieform o Anzahl und Art der Rezidive o postoperativer Zeitraum bis zum ersten Rezidiv o gesamter Beobachtungszeitraum in Monaten/ Jahren 2.3. Alter/ Geschlecht Es wurde die Alters- und Geschlechtsverteilung anhand von Graphiken aufgelistet. 2.4. Radiologische und klinische Auswertungen Die klinische Auswertung erfolgte durch die vorliegenden Patientenakten. Die radiologische Auswertung erfolgte anhand von analogen oder digitalen Panoramaschichtaufnahmen (OPG), gegebenenfalls auch anhand Digitaler Computertomographie (CT) nach folgenden Kriterien: 1) Lokalisation o 1.- 4. Quadrant o Anteriore/ Posteriore Oberkieferregion o Anteriore/ Posteriore Unterkieferregion o Aufsteigender Unterkieferast o Unterkieferwinkel 27 Volumentomographie (DVT) oder Material und Auswertungsmethoden 2) Solitäres oder multiples Auftreten 3) Gekammerte oder nicht gekammerte Raumforderung 4) Ausdehnung in cm in mesio-distaler als auch in kranio-kaudaler Richtung; es wurde die Länge (mesio-distal) mit der Breite (kranio-kaudal) multipliziert, um die Werte mit der Literatur vergleichen zu können 5) Räumliche Beziehung zu Nachbarstrukturen wie den Zähnen, dem Nervus alveolaris inferior, den Kieferhöhlen 6) Kieferknochenperforationen 2.5. Operative Therapiemethoden An der Medizinischen Hochschule Hannover werden zur Behandlung KZOT fünf Operationsmethoden unterschieden: 1) Zystostomie (nach Partsch I) 2) Zystektomie (nach Partsch II) 3) Zystektomie mit Carnoyscher Lösung 4) Zystektomie mit dem Ausfräsen des Lumens 5) Unterkieferteilresektion Zur Defektauffüllung wurden folgende Verfahren angewendet: 1) Einlage von Kollagenvlies. 2) Einbringung von Knochenmaterial, welches mittels „Bone - Scraper“ aus der nahen Umgebung (Kieferbereich) gewonnen wurde. 3) Knochenaugmentation mit autogener Spongiosa (mittels Stanze aus der Crista iliaca gewonnen). 4) Augmentation von autogenem Knochen und Einlage von Kollagenvlies. 5) Einbringung von mono- oder bikortikalen, avaskulären Knochenstücken, welche aus dem Becken entnommen wurden. 28 Material und Auswertungsmethoden 2.6. Postoperative Nachsorge Retrospektiv wurden die Patientenakten nach ihren postoperativen Verlaufskontrollen ausgewertet. Diese mussten sowohl klinische als auch röntgenologische Informationen über den postoperativen Verlauf von mindestens zwei Monaten aufweisen. Die radiologischen Kontrollen wurden mittels einer Panoramaschichtaufnahme (OPG) erfasst. Bei ausgedehnten Raumforderungen wurde die Computertomographie (CT) oder die Digitale Volumentomographie (DVT) zur Beurteilung herangezogen. In einem ersten Schritt wurden alle Patienten in die Auswertung eingeschlossen, die ein Follow-Up von mindestens zwei Monaten aufwiesen (n = 111). In einem zweiten Schritt wurden nur Patienten mit einem Follow-Up von mindestens einem Jahr erfasst (n = 71). In einem dritten Schritt wurden nur Patienten mit einem Follow-Up von mindestens drei Jahren berücksichtigt (n = 45). 2.7. Rezidive Als Rezidiv wurde ein Wiederauftreten des keratozystisch odontogenen Tumors im gleichen Quadranten, in dem sich die primäre Läsion manifestierte, definiert. Weiter wurde das Auftreten eines Rezidivs differenziert nach: o der Zeitspanne zwischen der ersten Operation und dem ersten Rezidiv o dem Alter des Patienten und dem Auftreten eines Rezidivs o dem Geschlecht und dem Auftreten eines Rezidivs o der angewandten Operationsmethode und dem Auftreten eines Rezidivs o der Lokalisation und dem Auftreten eines Rezidivs o dem Vorliegen einer primären Entzündung 2.8. Histologische Gewebebegutachtung der Pathologie Die Formalin-fixierten Operationsgewebe wurden in das Institut für Pathologie der Medizinischen Hochschule Hannover, Direktor: Prof. Dr. H.-H. Kreipe, zur Routinebegutachtung eingesandt. Nach Präparation und Einbettung in Paraffin wurden die Gewebsproben histologisch aufgearbeitet (Hämatoxylin-Eosin-Färbung) und begutachtet. Die Diagnosekriterien richteten sich nach der WHO-Klassifikation für Kopf/ Hals-Tumoren: 29 Material und Auswertungsmethoden o Mehrschichtiges Plattenepithel mit oberflächlicher Verhornung liegt vor. o Reteleisten sind nur angedeutet ausgebildet. o Epithelbreite beträgt etwa fünf bis acht Zellreihen. o Gut abgrenzbare Basalzellschicht ist hochprismatisch ausgebildet. o Basalzellen weisen hyperchromatisch-basophile, elongierte Kerne auf, die zentral bis apikal innerhalb der Basalzellen gelagert sind. o Über der Basalzellschicht liegende Zellen sind leicht elongiert bis kubisch und zeigen superfizial eine Parakeratose mit hypereosinophilen flachen und kernhaltigen Zellen. Die histologischen Abbildungen in Kapitel 1.9. sowie 3.9. wurden mit einer DP71-Kamera (Olympus, Hamburg) auf einem Axiophot-Mikroskop mit 10×/0.30 und 20×/0.50 PlanNeofluar-Objektiven (Zeiss, Jena) angefertigt. Die Präparate wurden freundlicherweise von Priv.-Doz. Dr. med. K. Hussein aus dem Institut für Pathologie der Medizinischen Hochschule Hannover zur Verfügung gestellt. 2.9. Statistiken 2.9.1. Beschreibende Statistik Die gesammelten Daten der Erfassungsbögen wurden in eine elektronische Datenbank unter Zuhilfenahme des Tabellenkalkulationsprogramms Microsoft Excel 2010 übertragen und anonymisiert. Es wurden ausschließlich numerische Felder und Felder mit Datum geschaffen, spezielle Informationen wurden in Textfelder eingetragen. Die erfassten Daten wurden in das Statistikprogramm SPSS für Windows Version 21.0 (SPSS Inc., USA) übertragen und mit diesem ausgewertet. Die Darstellung der kontinuierlichen Variablen erfolgte als Median-/Mittelwerte, während als Streumaße die Standardabweichungen und Standardfehler gewählt wurden. Es erfolgte eine zweiseitige Signifikanzüberprüfung für alle durchgeführten Tests, wobei für alle statistischen Tests ein p-Wert < 0,05 als statistisch signifikant angenommen wurde. Die explorative Datenanalyse wurde zur deskriptiven Auswertung und zur Überprüfung besonderer Auffälligkeiten der Daten angewandt. 30 Material und Auswertungsmethoden 2.9.2. Auswertende Statistik Bei Vorliegen intervallskalierter Daten wurde der T-Test für unabhängige Stichproben berechnet, um zu prüfen, ob die erhobenen Variablen sich signifikant voneinander unterscheiden. Im Fall von ordinalskalierten Daten wurde der Unterschied zwischen den Variablen anhand des Chi- Quadrat-Tests berechnet. Es wurden ausschließlich Gruppen mit einer Fallzahl n ≥ 10 ausgewertet. Die Kaplan-Meier-Analyse kam zur Anwendung, um die Zeit bis zum Auftreten eines Rezidivs in Bezug auf die unterschiedlichen Operationsmethoden und das Geschlecht sowie das Alter zu beurteilen und Signifikanzen festzustellen. Die Berechnungen werden anhand graphischer Darstellungen in Form der Überlebenszeitkurven veranschaulicht. Für die univariate Analyse prognostischer Faktoren wurde das Patientenkollektiv jeweils anhand einer Variablen in unterschiedliche Gruppen eingeteilt und mit Hilfe der Kaplan-Meier-Analyse und des Log Rank-Tests auf signifikante Unterschiede hinsichtlich des Überlebens untersucht. In den graphischen Darstellungen, die mit Excel erstellt wurden, wurden zur Veranschaulichung der kategorisierten Daten Balkendiagramme, Kreisdiagramme und Histogramme verwendet. 31 Ergebnisse 3. Ergebnisse 3.1. Epidemiologische Auswertung Die vorliegende Auswertung umfasst eine Gesamtzahl von 114 Patienten, bei denen im Zeitraum von 1991 bis 2010 an der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover eine „Keratozyste“, eine „odontogene Keratozyste“ oder ein „keratozystisch odontogener Tumor“ diagnostiziert und operativ therapiert wurde. Das sogenannte Gorlin-Goltz-Syndrom (GGS), bekannt auch als Basalzellnävus-Syndrom (NBCCS), kam bei drei Patienten (2,6%) dieses Kollektivs vor. Diese drei Patienten wurden in den Untersuchungen als gesonderte Gruppe aufgeführt und analysiert, da sich der Verlauf der bei diesen Patienten auftretenden keratozystisch odontogenen Tumoren von den nichtsyndromalen Tumoren unterscheidet. 3.2. Geschlechter- und Altersverteilung In dem untersuchten Kollektiv waren die Männer mit 66,7% (74 / 111) gegenüber den Frauen mit 33,3% (37 / 111) im Verhältnis 2:1 doppelt so häufig von dem Auftreten der Tumore betroffen (Abbildung 8). Die Häufigkeitsverteilung des Alters bei der Erstdiagnose des keratozystisch odontogenen Tumors folgte nahezu einer Gauß`schen Normalverteilung mit einem Median von 42 Jahren (Mittelwert bei 43,3 Jahren) (Abbildung 9). Mit einem Medianwert von 41 Jahren (Mittelwert = 40,22 Jahre) lag das Alter der Frauen bei der Erstdiagnose drei Jahre unter dem Medianwert des Alters der Männer mit 44 Jahren (Mittelwert = 44,68 Jahre). Mit 37,8% (42 / 111) stellte die Altersgruppe der 31-50-Jährigen den größten Anteil dar, gefolgt von den Altersgruppen der bis zu 30-Jährigen und der über 51-Jährigen, wohingegen sich bei den über 70-Jährigen mit 8,1% (9 / 111) nur selten Tumore fanden. Die Altersverteilung zum Zeitpunkt der Erstdiagnose erstreckte sich über eine Altersspanne von 12 bis 90 Jahren. 32 Ergebnisse Geschlechterverteilung 33,33% weiblich männlich 66,67% Abbildung 8: Geschlechterverteilung n=111 in Prozentangaben [%] Abbildung 9: Altersverteilung bei Erstdiagnose, x-Achse gibt die Altersintervalle bei Erstdiagnose wieder; y-Achse die Häufigkeitsdichte (n=111) 33 Ergebnisse 3.3. Radiologische Auswertung 3.3.1. Lokalisation des keratozystisch odontogenen Tumors In dem untersuchten Kollektiv von 111 Patienten traten insgesamt 113 zystische Läsionen auf. Bei 66 Patienten (59,5%) wurde der KZOT als Zufallsbefund während einer radiologischen Routineuntersuchung festgestellt. Im überwiegenden Anteil von 98,2% (109 / 111) trat der odontogene Tumor unizystisch auf. Zwei Patienten (1,8%) wiesen jeweils zwei keratozystisch odontogene Tumore im Unterkiefer auf, ohne dass diese Patienten an dem Gorlin-Goltz-Syndrom erkrankt waren. Bei 102 Patienten (91,9%) lokalisierte sich der keratozystisch odontogene Tumor signifikant häufiger im Unterkiefer (p<0.001), bei nur 9 Patienten (8,1%) trat dieser bei Erstmanifestation im Oberkiefer auf. Im Unterkiefer wurde eine Verteilung der insgesamt 104 Läsionen mit 53,8% (56 / 104) im linken und mit 46,2% (48 / 104) im rechten Unterkieferbereich eruiert (Abbildung 11). Der Kieferwinkel und der aufsteigende Unterkieferast traten vermehrt als Manifestationsorte auf. Hier fanden sich 68,3% (71 / 104) der Zysten. Lediglich 31,7% (33 / 104) der Zysten traten in der Seitenzahnregion des linken oder rechten Unterkiefers (Regio 36-38 bzw. 46-48) auf. Im Oberkiefer zeigte sich eine Verteilung von 44,4% (4 / 9) im rechten Oberkieferanteil und 55,5% (5 / 9) im linken Oberkieferanteil. Dabei verteilte sich der Tumor mit 77,7% (7 / 9) häufiger in der anterioren (Regio 15-25) als in der posterioren Oberkieferregion (Regio 16-18 bzw. 26-28) 22,2% (2 / 9) (Abbildung 10). Auffällig war, dass bei keinem der Patienten eine Manifestation in der anterioren Unterkieferregion zu verzeichnen war. 34 Ergebnisse 22,2 % 77,7 % 68,3 % 31,7 % Abbildung 10: Die Skizze zeigt die Häufigkeitsverteilung (in %) der insgesamt aufgetretenden KZOT (n=113) im Bezug auf die Lokalisation im Unterkiefer und Oberkiefer (Kieferseiten sind willkürlich gewählt) (Skizze eigenständig angefertigt) 60% Zystenlokalisation 48,65% 50% 41,44% Prozent 40% 30% 20% 10% 3,60% 4,51% 1. Quadrat 2. Quadrat 1,80% 0% 3. Quadrat 4. Quadrat 3. & 4. Quadrat Lokalisation Abbildung 11: Zystenlokalisation (x-Achse; Aufgeteilt nach den Quadranten) in Bezug auf die Gesamtzahl der Patienten (n=111; y-Achse) Häufigkeiten der Zysten in Prozent [%] 35 Ergebnisse 3.3.2. Größe des keratozystisch odontogenen Tumors Die radiologische Ausmessung der Zystengröße gelang bei 41 Patienten (36,9%) anhand von Orthopantomogramm-Aufnahmen (OPG). Die rund bis ovalen zystischen Raumforderungen, meist mit definiertem Rand, wiesen bei zweidimensionaler Messung (mesio-distale x kranio-kaudale Messung) eine durchschnittliche Fläche von 5,5 cm² auf. Diese zweidimensionale Aufnahme ermöglichte eine Abschätzung der Größe und insbesondere der Lokalisation zu den umliegenden Strukturen im Kiefer. Auffällig war, dass dabei fast jede fünfte Zyste (17,1%) eine gekammerte Struktur aufwies. Von allen 111 Patienten lagen schriftlich dargelegte Befunde vor, 41 davon wurden zusätzlich durch Röntgenbilder unterstützt. Bei den übrigen 70 Patienten wurden die präoperativen Röntgenbilder vom Hauszahnarzt durchgeführt und lagen somit nicht zur Einsicht vor. Hinzu kam, dass ein Großteil der Röntgenaufnahmen bereits vernichtet waren, da die Aufbewahrungsfrist2 von 10 Jahren innerhalb des Studienzeitraumes von 20 Jahren abgelaufen war. 3.3.3. Zahnbeziehung Eine direkte räumliche Beziehung zu einem oder mehreren Zähnen wiesen die Läsionen von 36 Patienten (32,4%) auf, wobei die Zähne des linken Unterkiefers häufiger betroffen waren (Abbildung 12). Diese keratozystisch odontogenen Tumore lagen mit ihren Zystenkapseln derart eng an den Zahnwurzeln oder den Zahnkronen impaktierter Zähne, dass diese, um die Gefahr eines Rezidivs zu minimieren, nicht erhalten werden konnten. Um das vorrangige Therapieziel der kompletten Entfernung des keratozystisch odontogenen Tumors zu erreichen, musste in diesen Fällen ein Zahnerhalt zurückstehen. Keine räumlichanatomische Beziehung zwischen dem Tumor und einem Zahn lag bei 75 Läsionen (67,6%) vor. 2 Röntgenbilder müssen laut § 28 Abs. 3 aus Richtlinie zu Aufzeichnungspflichten nach den §§ 18,27,28 und 36 der Röntgenverordnung und Bekanntmachung zum Röntgenpass 10 Jahre aufbewahrt werden. 36 Ergebnisse Zahnbeziehung 32,43% nein ja 67,57% Abbildung 12: Prozentualer Anteil der keratozystisch odontogenen Tumore mit und ohne enger Zahnbeziehung (n=111) 37 Ergebnisse 3.4. Operationsmethoden In dem untersuchten Patientenkollektiv kamen die folgenden Methoden zum Einsatz: 1) Die Zystostomie (ZO) 2) Die Zystektomie (ZE) 3) Die Zystektomie vor/ nach drei bis fünf minütigem Einwirken von Carnoyscher Lösung im Zystenlumen (ZE + CS) 4) Die Zystektomie mit zusätzlichem Ausfräsen des Lumens (ZE + Ausfräsen des Lumens) 5) Die Teilresektion des Unterkiefers (TR) Bei fünf Patienten (4,5%) erfolgte die Zystostomie. 70 Patienten (63,1%) wurden mit alleiniger Zystektomie und 25 Patienten wurden mit der Zystektomie und dem anschließenden Einwirken von Carnoyscher Lösung (22,5%) therapiert. Bei weiteren acht Patienten (7,2%) wurde die Zystektomie mit dem Ausfräsen des angrenzenden Knochens ergänzt. Unumgänglich war eine Teilresektion des Unterkiefers bei drei Patienten (2,7%) (Tabelle 2). Häufigkeit Prozent (N) (%) ZO 5 4,5 ZE 70 63,1 ZE + CS 25 22,5 ZE mit anschließendem Ausfräsen 8 7,2 Teilresektion Unterkiefer 3 2,7 Gesamt 111 100,0 Tabelle 2: Häufigkeit der angewandten Operationsmethoden (n=111) 3.5. Augmentationsverfahren Bei der Mehrzahl der operierten Patienten (n = 60; 54,1%) konnte der nach Gewebsentfernung entstandene Knochendefekt ohne Auffüllung der Knochenhöhle belassen werden und heilte nach chirurgischem, speicheldichten Verschluss des Defektes aus. Bei 51 Patienten (45,9%) war ein Augmentationsverfahren erforderlich. Dabei kamen fünf Methoden zur Anwendung: 1) Einlage von Kollagenvlies. 38 Ergebnisse 2) Einbringung von Knochenmaterial, welches mittels „Bone - Scraper“ aus der nahen Umgebung (Kieferbereich) gewonnen wurde. 3) Knochenaugmentation mit autogener Spongiosa (mittels Stanze aus der Crista iliaca gewonnen). 4) Augmentation von autogenem Knochen und Einlage von Kollagenvlies. 5) Einbringung von mono- oder bikortikalen, avaskulären Knochenstücken, welche aus dem Becken entnommen wurden. Bei zwei Patienten (1,8%) des Patientenkollektivs war die Einlage von Kollagenvlies einmal nach Zystektomie und einmal nach Zystektomie mit dem Ausfräsen des Knochendefektes erforderlich, um die Defektheilung zu unterstützen. Die Auffüllung mit autogenem Knochen, welcher mittels „Bone - Scraper“ aus der direkten, enoralen Umgebung gewonnen wurde, erfolgte lediglich bei einem Patienten (0,9%) des gesamten Kollektivs nach einer Zystektomie. Eine Defektauffüllung mit autogenem, spongiösem Knochenmaterial aus dem Beckenkamm (Crista iliaca anterior superior) erfolgte nach der Entfernung des keratozystisch odontogenen Tumors bei 37 Patienten (n = 37 / 111; 33,3%) und stellt damit die am häufigsten angewandte Augmentationsmethode innerhalb dieser Studie dar (Abbildung 13). Erforderlich war diese Art der Augmentation nach der Zystektomie in 26 Fällen (n = 26 / 70; 37,1%), wobei zusätzlich bei zwei dieser Patienten eine stabilisierende Osteosynthese eingebracht wurden. Nach der Zystektomie mit der Anwendung von Carnoyscher Lösung wurde bei zehn Patienten (n = 10 / 25; 40,0%) autogenes Knochenmaterial aus dem Beckenkamm augmentiert. Bei einem dieser Patienten wurde dies zusätzlich mit einer stabilisierenden Osteosynthese kombiniert. Spongiöses Knochenmaterial aus dem anterioren Beckenkamm kam zur Defektbehandlung einmal nach der Zystektomie mit anschließendem Ausfräsen des Lumens (n = 1 / 25; 4%) zur Anwendung. Zweimal wurden autogener, spongiöser Knochen und zusätzlich Kollagenvlies zur Auffüllung des entstandenen Knochendefekts verwendet, jedes Mal nach einer Zystektomie (n = 2 / 70; 2,8%). Bei einem dieser Patienten war es zusätzlich erforderlich die Läsion mit einer stabilisierenden Osteosynthese zu unterstützen (Tabelle 3). Mit avaskulärem, mono- oder bikortikalem Knochen erfolgte die Auffüllung in neun Fällen (n= 9 / 111, 8,1%) und zwar viermal nach alleiniger Zystektomie (n = 4 / 70; 5,7%), zweimal nach Zystektomie mit anschließendem Ausfräsen des Lumens (n = 2 / 8, 25%) und drei weitere Male nach der Unterkieferteilresektion (n = 3 / 3; 100%). Jedes avaskuläre, mono- oder bikortikale Knochentransplantat wurde mit einer stabilisierenden Osteosynthese kombiniert (n=9). 39 Ergebnisse Nach der Zystostomie wurde in selbst erklärender Weise keine Defektauffüllung durchgeführt. Die Auffüllung der Zystenhöhle mit eigenem Knochenmaterial erfolgte in allen Fällen im direkten Anschluss an die Entfernung des keratozystisch odontogenen Tumors. Hierfür erfolgte die Entnahme des Knochens aus der jeweils gewählten Spenderregion per Knochenmeißel, Knochenstanze oder „Bone - Scraper“. Nach entsprechender Aufbereitung wurde der Knochen in den Defekt eingebracht. Augmentationsverfahren Knochen keine Defektbehandlung aus Kollagen Kieferregion -vlies Spongiosa aus (gewonnen C. iliaca via „Bone- (Stanze) Scraper“) Autogener Knochen + Kollagenvlies mono-, bikortikale Gesamt Knochenstücke ZO 5 0 0 0 0 0 5 ZE 36 1 1 26 (2) 2 (1) 4 (4) 70 ZE + CS 15 0 0 10 (1) 0 0 25 4 1 0 1 0 2 (2) 8 0 0 0 0 0 3 (3) 3 60 2 1 37 2 9 111 OP- ZE + Methode Ausfräsen Teilresektion UK Gesamt Tabelle 3: Häufigkeitsverteilung der unterschiedlichen Operations- und Augmentationsverfahren. In Klammern wird die Häufigkeit in Kombination mit einer stabilisierenden Osteosynthese (n=13) nach jeweiliger OP/ Augmentationsmethode angegeben. 40 Ergebnisse 60% 54,05% 50% Prozent 40% 33,33% 30% 20% 8,10% 10% 1,80% 0,90% 1,80% 0% keine Defektbehandlung Kollagenvlies Knochen aus Spongiosa aus C. Kieferregion iliaca (gewonnen via „Bone-Scraper“) Autogener Knochen+ Kollagenvlies mono-, bikortikale Knochenstücke Augmentationsmethode Abbildung 13: Prozentuale Häufigkeitsangaben (y-Achse) der unterschiedlichen Augmentationsmethoden bezogen auf das gesamte Kollektiv (n=111) (x-Achse) 41 Ergebnisse 3.6. Analyse des Rezidivverhaltens anhand des Gesamtkollektivs (n = 111) Die postoperative Nachuntersuchung des Patientenkollektivs stützt sich auf die Dokumentation der klinischen Untersuchungen und den radiologischen Befund. Die von den Patienten postoperativ wahrgenommene Verlaufsbeobachtung umfasst einen Zeitraum von minimal zwei Monaten bis maximal 17 Jahren (204 Monate) (Abbildung 14). Der Mittelwert der Nachuntersuchungszeit lag bei 41, 9 Monaten (3,5 Jahre), der Medianwert bei 24 Monaten (zwei Jahre). 70 Patienten (63,1%) blieben innerhalb der Studienzeit von 20 Jahren rezidivfrei. Bei 41 Patienten trat innerhalb dieses Zeitraumes ein Rezidiv auf. Die Rezidivinzidenz lag bei 36,9% (Tabelle 4). 14,0 12,6 11,7 12,0 10,8 Prozent [%] 10,0 8,1 8,1 8,0 7,2 5,4 6,0 4,5 3,6 4,0 2,0 4,5 2,7 1,8 2,7 1,8 1,8 1,8 0,9 1,8 1,8 0,9 0,9 1,8 0,9 0,9 0,9 2 3 4 5 6 7 8 10 11 12 18 24 36 48 60 72 84 96 108 120 132 144 168 180 204 0,0 postoperative Beobachtungszeit [Monate] Abbildung 14: Darstellung des postoperativen Kontrollzeitraumes in Patientenkollektivs (n=111) mit prozentualen Häufigkeitsangaben (y-Achse) Häufigkeit (N) Prozent (%) nein 70 63,1 ja 41 36,9 Gesamt 111 100,0 Tabelle 4: Häufigkeiten der Rezidive (n=111) 42 Monaten (x-Achse) des Ergebnisse Bei 27 (65,8%) der 41 Patienten mit einem Rezidiv traten - mit fallender Tendenz - die Rezidive in den ersten vier postoperativen Jahren auf. Ab dem fünften postoperativem Jahr wurden noch bei 14 Patienten (34,1%) Rezidive diagnostiziert (Abbildung 15). Bei zwei Patienten wurde postoperativ nach 12 Jahren (144 Monate) ein Rezidiv diagnostiziert. Der Medianwert zeigt, dass die Rezidive vermehrt in einem Zeitraum von 36 Monaten (Mittelwert = 46,2 Monaten) auftraten. zeitliches Auftreten der Rezidive 30% 26,83% 24,39% 25% Prozent 20% 15% 12,20% 10% 7,32% 7,32% 7,22% 4,88% 5% 2,44% 4,88% 2,44% 0% 12 24 36 48 60 72 84 96 108 144 Monate Abbildung 15: Häufigkeit des Auftretens der 41 Rezidive in Prozent (y-Achse) nach Monaten (x-Achse) 3.6.1. Lokalisationsverteilung der 41 Rezidive In Betracht auf die Lokalisation traten die meisten Rezidive einseitig im vierten (n = 23) oder im dritten (n = 16) Quadranten auf. Im Oberkiefer fanden sich nur zwei Rezidive. Auch zeitlich unterschied sich das Rezidivauftreten im Oberkiefer verglichen mit dem im Unterkiefer. Im Oberkiefer traten die Rezidive im Median nach 18 Monaten (1,5 Jahre), im Unterkiefer nach 36 Monaten (drei Jahre) postoperativ auf, sodass eine Differenz von 18 Monaten (1,5 Jahre) vorlag. 43 Ergebnisse 3.6.2. Gruppenvergleich bezüglich des Alters / des Geschlechts und dem Rezidivauftreten Das durchschnittliche Alter beim Auftreten eines Rezidivs lag bei 44 Jahren. Am häufigsten von Rezidiven betroffen war die Gruppe der 31-50-Jährigen mit 43,9%, gefolgt von der Altersgruppe der 51-70-Jährigen (29,2%) (Abbildung 16). Die Kaplan-Meier-Analyse verdeutlicht, dass die kumulierte Wahrscheinlichkeit der Rezidivfreiheit für 50% der 31-50-Jährigen Patienten innerhalb von 36 Monaten (drei Jahre) lag. In der Gruppe der 51-70-Jährigen lag dieser Wert bei 72 Monaten (sechs Jahre). Eine Signifikanz zwischen dem zeitlichen Auftreten eines Rezidivs nach der ersten Operation und einer bestimmten Altersgruppe ließ sich nicht nachweisen (p = 0,674). 50% 43,90% 45% 40% Prozent 35% 29,27% 30% 25% 21,95% 20% 15% 10% 4,88% 5% 0% 11-30 Jahre 31-50 Jahre 51-70 Jahre 71-90 Jahre Altersgruppe Abbildung 16: Häufigkeitsverteilung der Rezidive (n=41) in Prozent (y-Achse) innerhalb der Altersgruppen (x-Achse) 44 Ergebnisse Abbildung 17: Kaplan-Meier-Analyse für die kumulierte Wahrscheinlichkeit der Rezidivfreiheit innerhalb der unterschiedlichen Altersgruppen (n=111, p-Wert = 0,674) 45 Ergebnisse Innerhalb der Gesamtzahl der 41 Rezidive lag die Geschlechterverteilung bei 18 Frauen (43,9%) und 23 Männern (56,1%)(Abbildung 18). Geschlechtsspezifisch erhielten 48,6% der Frauen (18 / 37) und 31,1% der Männer (23 / 74) ein Rezidiv innerhalb der untersuchten Studienzeit. Mittels Chi-Quadrattest konnte hier statistisch kein signifikanter Zusammenhang (p = 0,071) zwischen dem Auftreten eines Rezidivs und dem Geschlecht festgestellt werden (Tabelle 5). T-Test Alter, Mittel ± sd Anzahl % innerhalb von männlich Geschlecht % innerhalb von Rezidiv: Ja-Nein Rezidiv Kein Rezidiv n= 41 n= 70 44,22 ± 17,593 42,79 ±19,886 23 51 31,1% 68,9% 56,1 % 72,9% p-Wert 0.703 Kreuztabelle + Chi-Quadrat nach % der Gesamtzahl 20,7% 45,9% Pearson Anzahl 18 19 48,6% 51,4% 43,9% 27,1% 16,2% 17,1% % innerhalb von weiblich Geschlecht % innerhalb von Rezidiv: Ja-Nein % der Gesamtzahl 0.071 Tabelle 5: Zusammenfassung der Rezidivhäufigkeiten in Abhängigkeit von Alter und Geschlecht; nach TTest; Kreuztabelle + Chi-Quadrat nach Pearson mit Zeilenprozenten (n=111); (statistisch bei p=0,05 als signifikant und p=0,01 als sehr signifikant angenommen) Die mediane rezidivfreie postoperative Lebenszeit, nach der 50% des Frauenanteils ein Rezidiv entwickelten, lag gemäß der Kaplan-Meier-Analyse innerhalb der Studienzeit bei 36 Monaten (drei Jahre). Vergleichend dazu entwickelten 50% der Männer im Median nach 72 Monaten (sechs Jahre) ein Rezidiv. Diese Werte zeigen einen zeitlichen Unterschied von 36 Monaten (drei Jahre) zwischen dem Wiederauftreten des Tumors und den Geschlechtern (Abbildung 19). Die Kaplan-Meier-Analyse ergab hier einen p-Wert von 0,126, welcher die Unterschiede statistisch nicht unterstützt. Differenziert man das Alter der Frauen bei Erstdiagnose mittels explorativer Datenanalyse, zeigt sich bei den 18 Frauen mit Rezidiv, dass der keratozystisch odontogene Tumor elf Jahre (Altersmedian = 47 Jahre) später diagnostiziert wurde als bei den Frauen (n = 19), bei denen es zu keinem Rezidiv kam (Altersmedian = 36 Jahre) (Tabelle 6). Bei den Männern betrug diese Differenz vier Jahre (Tabelle 6). 46 Ergebnisse 60 51 50 Anzahl 40 30 20 23 19 18 10 0 weiblich männlich Geschlecht Rezidiv nicht aufgetreten Rezidiv aufgetreten Abbildung 18: Gegenüberstellung der Anzahl von Frauen/ Männern mit und ohne Rezidiv (n=111) Abbildung 19: Kaplan-Meier-Analyse für die kumulierte Wahrscheinlichkeit der Rezidivfreiheit innerhalb der Geschlechter (n=111, p-Wert = 0,126) 47 Ergebnisse Frauen Männer Rezidiv Nein Ja Mittelwert 36,47 Jahre 44,17 Jahre Median 36 Jahre 47 Jahre Mittelwert 45,14 Jahre 44,26 Jahre Median 42 Jahre 46 Jahre Tabelle 6: Vergleiche der Altersverteilung von Frauen/ Männern bei Erstmanifestation des KZOT mit/ ohne Erhalt eines Rezidivs (n=111) 48 Ergebnisse 3.6.3. Vergleich zwischen den Auftreten eines Rezidivs Operationsmethoden und dem Innerhalb des Gesamtkollektivs von 111 Patienten betrug die höchste Rezidivinzidenz 18% nach Zystektomie (20 / 111), gefolgt von 12,6% nach der Zystektomie mit Carnoyscher Lösung (14 / 111) und 4,5% nach der Zystektomie mit Ausfräsen des Lumens (5 / 111). Die Teilresektion (1 / 111) sowie die Zystostomie (1 / 111) zeigten mit 0,9% die geringste Rezidivrate (Tabelle 7). Innerhalb der einzelnen Operationsmethoden ergaben sich in Bezug auf das Auftreten von den 41 Rezidiven folgende Unterschiede: Nach Zystostomie trat bei einem von fünf Patienten (20%) ein Rezidiv auf. Bei den 70 mit Zystektomie operierten Patienten kam es bei 20 Patienten (28,6%) zu einem Rezidiv. Nach Zystektomie mit zusätzlicher Anwendung der Carnoyschen Lösung entwickelte sich bei 14 (56%) von den 25 so therapierten Patienten ein Rezidiv. Die Rezidiventwicklung nach Zystektomie mit anschließendem Ausfräsen des Lumens (n = 8) lag bei fünf Patienten (62,5%) und nach Unterkieferteilresektion (n = 3) entwickelte sich bei einem Patient (33,3%) ein Rezidiv (Tabelle 7). In Bezug auf die Gesamtzahl der Rezidive (n = 41) betrug das Rezidivauftreten nach Zystektomie mit Carnoyscher Lösung 34,1% (14 / 41), nach Zystektomie 48,8% (20 / 41), nach Zystektomie und zusätzlicher Ausfräsung des Knochens 12,2% (5 / 41). Nach Zystostomie (1 / 41) wie auch nach der Unterkiefer Teilresektion (1 / 41) betrug die Rezidivhäufigkeit 2,4% (Tabelle 7). 49 Ergebnisse Angewandte Operationsmethode ZO nein 3 2 70 % der Gesamtzahl 3,6% 45,0% 9,9% 2,7% 1,8% 63,1% 80,0% 71,4% 44,0% 37,5% 66,7% 63,1% 5,7% 71,4% 15,7% 4,3% 2,9% 100,0% Anzahl 1 20 14 5 1 41 % der Gesamtzahl 0,9% 18,0% 12,6% 4,5% 0,9% 36,9% 20,0% 28,6% 56,0% 62,5% 33,3% 36,9% 2,4% 48,8% 34,1% 12,2% 2,4% 100,0% Anzahl 5 70 25 8 3 111 % der Gesamtzahl 4,5% 63,1% 22,5% 7,2% 2,7% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 4,5% 63,1% 22,5% 7,2% 2,7% 100,0% % innerhalb von OP- % innerhalb von OP- % innerhalb von Rezidiv: Ja-Nein % innerhalb von OPMethode % innerhalb von Rezidiv: Ja-Nein 7: UK 11 Methode Tabelle Gesamt 50 Rezidiv: Ja-Nein Gesamt Ausfräsen resektion 4 % innerhalb von ja ZE + CS Teil- Anzahl Methode Rezidiv ZE ZE mit Häufigkeiten der angewandten Operationsmethoden mit prozentualer Angabe der Rezidivhäufigkeit (innerhalb der Gesamtzahl/ innerhalb der Operationsmethoden/ innerhalb der Rezidive) Mit Hilfe des Chi-Quadrat-Tests wurde weiterführend geprüft, ob sich zwischen den unterschiedlichen Operationsmethoden und dem Auftreten eines Rezidivs ein signifikanter Unterschied feststellen lässt. Aufgrund geringer Fallzahlen (n < 10) wurden für die auswertende Statistik die Unterkieferteilresektion und die Zystektomie mit Ausfräsen des Lumens in einer Gruppe (n = 11) zusammenfassend dargestellt. Die Zystostomie (n = 5) wurde aufgrund von zu geringer Fallzahl komplett aus dieser Auswertung genommen, sodass mit einer Gesamtmenge von 106 Patienten gerechnet wurde. Der Vergleich zwischen der Zystektomie und der Zystektomie in Kombination mit Carnoyscher Lösung sowie den übrigen Operationsmethoden (ZE + Ausfräsen/ TR) ließ im Chi-Quadrattest eine Signifikanz erkennen (p = 0,025 mit ᵡ²=7.374 (df=2)) (Abbildung 20). Um diese Signifikanz den einzelnen Operationsmethoden zuzuordnen, wurden jeweils zwei Operationsmethoden miteinander verglichen. Diese Vergleiche zeigen einen signifikanten Unterschied zwischen dem Rezidivauftreten nach Zystektomie und dem Rezidivauftreten nach Zystektomie mit Carnoyscher Lösung (p = 0,027 mit ᵡ²=6,031 (df=1)) (Tabelle 8). Demnach konnte für die additive Verwendung der Carnoyschen Lösung statistisch kein positiver Effekt zur Rezidivvermeidung nachgewiesen werden. 50 Ergebnisse Von den insgesamt 70 mit Zystektomie therapierten Patienten entwickelte sich bei 28,6% (n = 20) ein Rezidiv, wohingegen nach der Zystektomie mit der Carnoyschen Lösung 56,0% (n = 14) der insgesamt 25 so operierten Patienten ein Rezidiv entwickelten. Zwischen den anderen Operationsmethoden (ZE vs. TR/ ZE + Ausfräsen oder ZE + CS vs. TR/ ZE + Ausfräsen) konnte statistisch kein signifikanter Zusammenhang dargestellt werden. 60 50 50 Anzahl 40 30 20 20 14 11 10 6 5 0 nein ja Rezidiv nein/ja ZE+CS ZE andere (TR+ZE und Ausfräsen) Abbildung 20: Rezidivauftreten nach den jeweiligen Operationsmethoden (bei n=106, ZO wurde nicht mit einbezogen), Chi-Quadrat-Test (p= 0,025) Operationsmethode nein Gesamt ZE+CS ZE Anzahl 11 50 61 % innerhalb von der 44,0% 71,4% 64,2% Rezidiv: Operationsmethode Ja/Nein Anzahl 14 20 34 % innerhalb von der 56,0% 28,6% 35,8% Anzahl 25 70 95 % innerhalb von der 100,0% 100,0% 100,0% ja Operationsmethode Gesamt Operationsmethode Tabelle 8: Vergleich der ZE / ZE+CS mit Häufigkeits- und Prozentangaben der Rezidive (p=0,027 mit ᵡ²=6,031 (df=1) (Kreuztabelle zum Chi-Quadrattest) 51 Ergebnisse 60 50 50 40 30 20 20 14 11 10 0 nein ja ZE+CS ZE Abbildung 21: Rezidivauftreten nach der Zystektomie und nach der Zstektomie mit Carnoyscher Lösung, (p=0,027 mit ᵡ²=6,031 (df=1) 52 Ergebnisse Die Kaplan-Meier Analyse differenziert die Rezidivfreiheit (in Monaten) in Bezug auf die unterschiedlichen Operationsmethoden. So trat bei 50% der mit Zystektomie therapierten Patienten im Median nach 96 Monaten (acht Jahre) ein Rezidiv auf (Abbildung 22). Die mediane Rezidivfreiheit der mit Zystektomie und dem zusätzlichen Ausspülen des Lumens mit Carnoyscher Lösung therapierten Patienten betrug 84 Monate (sieben Jahre). 36 Monate betrug die mediane rezidivfreie Zeit für 50% der Patienten, welche mit einer der aggressiveren Methoden (TR/ ZE + Ausfräsen) therapiert wurden. Es konnte kein signifikanter Unterschied zwischen der postoperativen rezidivfreien Zeit und der angewendeten Operationsmethode gezeigt werden (p = 0,088). Abbildung 22: Graphische Darstellung der kumulativen Wahrscheinlichkeit der Rezidivfreiheit nach den unterschiedlichen Operationsmethoden (n=106, p-Wert = 0,088) 53 Ergebnisse 3.7. Analysezeitraum des Rezidivauftretens von den Patienten mit einem Nachkontrollzeitraum mindestens einem Jahr (n = 71) von Im Folgenden wurden nur die Patienten erfasst, welche noch nach einem Zeitraum von mindestens 12 Monaten oder länger die Kontrolluntersuchung in der Klinik für Mund-, Kieferund Gesichtschirurgie der Medizinischen Hochschule Hannover wahrgenommen haben. Durch die Beschränkung des Auswertungszeitraumes auf 12 Monate bis 20 Jahre wird geprüft, ob sich die Aussagen über das Rezidivverhalten innerhalb eines definierteren Beobachtungszeitraumes präzisieren lassen oder verändern. Von den 111 Patienten des Gesamtkollektivs erschienen postoperativ im Zeitraum von 12 Monaten bis 20 Jahren noch 71 Patienten (63,9%) zu der Nachuntersuchung des keratozystisch odontogenen Tumors (Abbildung 23). Dabei wurden 41 Rezidive diagnostiziert. Die meisten Rezidive traten mit einem Medianwert von 36 Monaten (Mittelwert = 47,4 Monaten) nach der ersten Operation auf. Die Rezidivinzidenz dieser Patientengruppe lag bei 57,7% (Tabelle 9). 18 17 16 14 13 Häufigkeit 12 10 9 8 8 6 5 4 4 3 3 2 2 2 1 1 1 1 1 0 12 24 36 48 60 72 84 96 108 120 132 144 168 180 204 Beobachtungszeit [Monate] Abbildung 23: Häufigkeitsverteilung (y-Achse) der postoperativen Nachkontrollen in Monaten (x-Achse) (n=71) 54 Ergebnisse Häufigkeit (N) Prozent (%) kein Rezidiv 30 42,3 Rezidiv erhalten 41 57,7 Gesamt 71 100,0 Tabelle 9: Häufigkeit des Auftretens eines Rezidivs innerhalb der n=71 Patienten 3.7.1. Gruppenvergleich bezüglich des Alters / des Geschlechts und dem Rezidivauftreten Innerhalb dieser Patientengruppe (n = 71) befanden sich 29 Frauen (40,8%) und 42 Männer (59,2%). Das durchschnittliche Alter bei Erstmanifestation des Tumors der Patienten, welche an einem Rezidiv erkrankten, lag bei 44,2 Jahren. Zwischen dem Alter und der Manifestation eines Rezidivs konnte mittels T-Test (p = 0,692) keine signifikante Relation ermittelt werden (Tabelle 10). Auch im Hinblick auf die zeitliche Rezidivfreiheit nach Erstoperation und den Altersgruppen ergab sich keine Signifikanz (p-Wert = 0,590). In der Altersgruppe der 31- 50Jährigen erhielten nach 36 Monaten 50% der Patienten ein Rezidiv. Bei den 51-70-Jährigen lag der Wert bei 60 Monaten. Im Durchschnitt lebten die Patienten aller Altersgruppen 48 Monate (4 Jahre) ohne Rezidiv. Bei Frauen traten innerhalb der Gesamtmenge der Rezidive (n = 41) mit 51,2% (21 / 41) häufiger Rezidive auf als bei Männern mit 48,8% (20 / 41). Eine Signifikanz zwischen dem Geschlecht und dem Auftreten eines Rezidivs in der Gruppe der 71 Patienten wurde mit dem Chi-Quadrat-Test festgestellt (p = 0,038 mit ᵡ²=4.43 (df=1)) (Tabelle 10). Der Anteil innerhalb der weiblichen Gruppe (21 / 29) beträgt 72,4%. Innerhalb der männlichen Gruppe (20 / 42) wird ein Wert von 47,6% ermittelt. T-Test Chi-Quadrat Rezidiv n=41 Kein Rezidiv n=30 p-Wert Alter, Mittel± sd 44,22 ± 17,59 45,97 ± 19,14 0.692 Männlich 20 (48,8%) 22 (73,33%) Weiblich 21 (51,2%) 8 (26,7%) 0.038 Tabelle 10: Zusammenfassung der Ergebnisse des Chi-Quadrat und des T-Test für unabhängige Variablen; Gruppenvergleich [Alter/ Geschlecht] (n=71) Differenziert man die zeitliche Rezidivfreiheit mit der Kaplan-Meier-Analyse weiter, zeigt sich, dass nach 36 Monaten bei 50% der Frauen ein Rezidiv auftrat, bei 50% der Männer im Vergleich dazu erst nach 72 Monaten (Abbildung 24). Hier wird eine signifikante Beziehung zwischen dem Zeitraum des Auftretens des ersten Rezidivs und dem Geschlecht (p = 0,036 mit ᵡ²=4.40 (df=1)) deutlich. Frauen erhalten demzufolge früher ein Rezidiv des keratozystisch odontogenen Tumors als Männer. 55 Ergebnisse Abbildung 24: Kumulierte Wahrscheinlichkeit der Rezidivfreiheit innerhalb der Geschlechter (n=71, pWert=0.036) 56 Ergebnisse 3.7.2. Vergleich zwischen den Auftreten eines Rezidivs Operationsmethoden und dem Innerhalb der Gesamtzahl der 71 Patienten lag die Rezidivquote nach Zystostomie bei 1,4% (1 / 71), nach Zystektomie bei 28,2% (20 / 71) und nach der Zystektomie mit Carnoyscher Lösung bei 19,7% (14 / 71). Nach der Zystektomie mit zusätzlichem Ausfräsen des Lumens betrug die Rezidivquote 7% (5 / 71) und nach Unterkiefer Teilresektion 1,4% (1 / 71) (Tabelle 11). Im Hinblick auf die jeweilige Operationsmethode entstand nach einfacher Zystostomie bei einem von insgesamt drei so therapierten Patienten (33,3%) ein Rezidiv. Nach Zystektomie wurde bei 20 von 40 (50,0%) Patienten ein Rezidiv diagnostiziert und nach Zystektomie mit anschließender Ausspülung durch die Carnoysche Lösung wurde bei 14 von 20 Patienten (70,0%) ein Rezidiv festgestellt. Bei allen fünf Patienten (100%) kam es nach Zystektomie und dem zusätzlichen Ausfräsen des umgebenen Knochens zu einem Rezidiv und selbst nach einer Teilresektion des Unterkiefers erlitt einer von drei Patienten (33,3%) ein Rezidiv (Tabelle 11). In Bezug auf die Gesamtzahl der Rezidive (n = 41) betrug das Rezidivauftreten nach Zystostomie 2,4% (1 / 41), nach Zystektomie 48,8% (20 / 41) sowie nach Zystektomie mit Carnoyscher Lösung 34,1% (14 / 41). Nach der Zystektomie mit zusätzlicher Ausfräsung des Lumens betrug das Rezidivauftreten 12,2% (5 / 41) und nach der Unterkiefer Teilresektion 2,4% (1 / 41) (Tabelle 11). 57 Ergebnisse Operationsmethode ZO Anzahl ZE ZE + CS ZE + UK-Teil- Ausfräsen resektion Gesamt 2 20 6 0 2 30 % der Gesamtzahl 2,8% 28,2% 8,5% 0,0% 2,8% 42,3% % innerhalb von OP-Methode 66,7% 50,0% 30,0% 0,0% 66,7% 42,3% % innerhalb von Rezidiv: 6,7% 66,7% 20,0% 0,0% 6,7% 100,0% 1 20 14 5 1 41 % der Gesamtzahl 1,4% 28,2% 19,7% 7,0% 1,4% 57,7% % innerhalb von OP-Methode 33,3% 50,0% 70,0% 100,0% 33,3% 57,7% % innerhalb von Rezidiv: 2,4% 48,8% 34,1% 12,2% 2,4% 100,0% 3 40 20 5 3 71 4,2% 56,3% 28,2% 7,0% 4,2% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 4,2% 56,3% 28,2% 7,0% 4,2% 100,0% Nein Ja/Nein Rezidiv Anzahl Ja Ja/Nein Anzahl % der Gesamtzahl Gesamt % innerhalb von OP-Methode % innerhalb von Rezidiv: Ja/Nein Tabelle 11: Häufigkeitsverteilung der Rezidive nach angewandter Operationsmethoden und prozentuale Angaben der Rezidivhäufigkeit (innerhalb der Gesamtzahl/ innerhalb der Operationsmethoden/ innerhalb der Rezidive) (n=71) Mit Hilfe des Chi-Quadrat-Tests wurde zudem geprüft, ob sich zwischen den unterschiedlichen Operationsmethoden und dem Auftreten eines Rezidivs ein signifikanter Unterschied feststellen lässt. Auch in dieser Gruppe wurden zur Analyse die Teilresektion sowie die Zystektomie mit Ausfräsen des Lumens in einer Gruppe (n = 8) zusammengefasst und die Zystostomie (n = 3) komplett aus der Analyse entfernt, sodass mit einer Gruppe von n = 68 gerechnet wurde. Der Chi- Quadrat- Test ergab keine Signifikanz (p-Wert = 0,204) im Hinblick auf das Auftreten eines Rezidivs und der angewandten Operationsmethode. 58 Ergebnisse 3.8. Analysezeitraum des Rezidivauftretens von den Patienten mit einem Nachkontrollzeitraum mindestens drei Jahren (n = 45) von Zur Analyse des Zeitraumes, in dem die Rezidive am häufigsten diagnostiziert wurden, werden im folgenden Abschnitt nur die Patienten aus dem Gesamtkollektiv erfasst, welche noch nach einem Kontrolluntersuchung Zeitraum in der von Klinik mindestens für Mund-, drei Jahren Kiefer- und oder länger die Gesichtschirurgie der Medizinischen Hochschule Hannover wahrgenommen haben. Von den 111 erfassten Patienten erschienen postoperativ nach mindestens drei Jahren zu der Nachuntersuchung des keratozystisch odontogenen Tumors (Abbildung 25) noch 45 Patienten (40,5%), davon waren 16 Frauen (35,6%) und 29 Männer (64,4%). Innerhalb dieses Nachuntersuchungszeitraumes wurde in 32 Fällen ein Rezidiv diagnostiziert. Davon entwickelten sich 13 bei Frauen und 19 bei Männern. Das Alter bei Erstmanifestation des Tumors der Patienten, welche an einem Rezidiv erkrankten, lag im Durchschnitt bei 43,22 Jahren. Die meisten Rezidive traten mit einem Medianwert von 36 Monaten (Mittelwert = 41,71 Monaten) nach der ersten Operation auf (Abbildung 26). Die Rezidivinzidenz dieser Patientengruppe liegt bei 71,1%. 9 8 8 7 7 6 Häufigkeit 6 5 4 4 4 3 3 2 2 2 2 1 1 1 1 180 204 1 0 36 48 60 72 84 96 108 120 132 144 168 Beobachtungszeit (Monate) Abbildung 25: Häufigkeitsverteilung der wahrgenommenen, postoperativen Nachkontrollen (y-Achse) in Monaten (x-Achse) ab einem Beobachtungszeitraum von 36 Monaten (n=45) 59 Ergebnisse Häufigkeit (N) Prozent (%) kein Rezidiv 13 28,9 Rezidiv erhalten 32 71,1 Gesamt 45 100,0 Tabelle 12: Häufigkeit des Auftretens eines Rezidivs innerhalb der n= 45 Patienten 14 13 12 10 Häufigkeit 10 8 6 4 4 3 3 3 3 2 2 1 2 1 0 0 12 24 36 48 60 72 84 96 108 144 erstes Rezidiv postoperativ (Monate) Abbildung 26: Häufigkeitsverteilung (y-Achse) des postoperativen Rezidivauftretens in Monaten (x-Achse) (n=45) 60 Ergebnisse 3.8.1. Vergleich zwischen den Operationsmethoden und dem Auftreten eines Rezidivs Innerhalb der Gesamtzahl der Patienten (n = 45) lag die Rezidivinzidenz nach Zystostomie bei 2,2%, nach Zystektomie bei 33,3% und nach Zystektomie mit Carnoyscher Lösung bei 26,7%. Nach der Zystektomie mit zusätzlichem Ausfräsen des Lumens lag sie bei 8,9%. Bei keinem Patienten wurde innerhalb dieser Gruppe (n = 45) eine Teilresektion des Unterkiefers durchgeführt (Tabelle 13). In Relation zur jeweiligen Operationsmethode zeigte sich nach der Zystostomie bei einem von drei Patienten (33,3%), nach der Zystektomie bei 15 von 25 (60,0%) Patienten ein Rezidiv. Nach der Zystektomie und anschließender Ausspülung mit Carnoyscher Lösung entwickelte sich bei 12 von 13 Patienten (92,3%) ein Rezidiv. Alle vier Patienten (100%) erhielten nach Zystektomie und dem zusätzlichen Ausfräsen des umgebenen Knochens ein Rezidiv (Tabelle 13). In Bezug auf die Gesamtzahl der Rezidive (n = 32) beträgt die Rezidivinzidenz nach Zystostomie 3,1%, nach Zystektomie 46,9%, nach Zystektomie mit Carnoyscher Lösung 37,5% und nach Zystektomie und zusätzlicher Ausfräsung des Knochens 12,5% (Tabelle 13). 61 Ergebnisse Angewandte Operationsmethode ZO nein Gesamt UK 10 1 0 0 13 % der Gesamtzahl 4,4% 22,2% 2,2% 0,0% 0,0% 28,9% 66,7% 40,0% 7,7% 0,0% 0,0% 28,9% 15, 4% 76,9% 7,7% 0,0% 0,0% 100,0% Anzahl 1 15 12 4 0 32 % der Gesamtzahl 2,2% 33,3% 26,7% 8,9% 0,0% 71,1% 33,3% 60,0% 92,3% 100,0% 0,0% 71,1% 3,1% 46,9% 37,5% 12,5% 0,0% 100,0% Anzahl 3 25 13 4 0 45 % der Gesamtzahl 6,7% 55,6% 28,9% 8,9% 0,0% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 100,0% 6,7% 55,6% 28,9% 8,9% 0,0% 100,0% % innerhalb von OP- Rezidiv: Ja-Nein % innerhalb von OPMethode % innerhalb von Rezidiv: Ja-Nein Gesamt Ausfräsen resektion 2 % innerhalb von ja ZE + CS Teil- Anzahl Methode Rezidiv ZE ZE mit % innerhalb von OPMethode % innerhalb von Rezidiv: Ja-Nein Tabelle 13: Häufigkeitsverteilung der Rezidive nach angewandter Operationsmethoden und prozentuale Angaben der Rezidivhäufigkeit innerhalb unterschiedlicher Gruppen (n=45) 62 Ergebnisse 3.9. Analyse der an dem Gorlin-Goltz-Syndrom (GGS)/ Basalzellnävus-Syndrom Patienten (NBCCS) erkrankten In dem Gesamtkollektiv von 114 Patienten befanden sich drei Patienten, die an dem GorlinGoltz- Syndrom (GGS/ NBCCS) erkrankt waren. Bei diesen drei Patienten handelte es sich ausschließlich um weibliche Personen. Der Mittelwert des Alters bei der ersten Operation des keratozystisch odontogenen Tumors lag bei 22 Jahren (Median = 18 Jahre). Die Beobachtungszeit bei den Patientinnen lag im Mittel bei 80 Monaten (= 6,7 Jahre). Alle drei betroffenen Patientinnen wiesen multiple Läsionen auf. Diese Läsionen traten sowohl im Unter- als auch im Oberkiefer auf. Bei allen Patientinnen fand man Tumore in der Region des linken beziehungsweise rechten Unterkieferwinkels beziehungsweise aufsteigenden Astes und zudem bei zwei der Patientinnen noch in der anterioren Oberkieferregion (Region 15-25). Als Operationsmethoden wurden die Zystektomie und einmal die Zystostomie angewandt. Bei einer Patientin wurde der Defekt mit eigenem Knochenmaterial und zusätzlich mit Kollagenvlies stabilisiert. Alle drei Patientinnen entwickelten im weiteren Verlauf multiple Rezidive. Anhand von Abbildung 27 lässt sich feststellen, dass diese Patientinnen deutlich früher erkrankten als die nicht-syndromalen Patienten dieser Studie (Abbildung 27). Eine detaillierte Fallbeschreibung folgt unter 3.10.3. 100 90 Alter bei Erstdiagnose 80 70 60 50 40 30 20 10 0 mit Gorlin-Goltz-Syndrom non-syndromale Patienten Abbildung 27: Altersvergleich zwischen GGS/ non-syndromalen Patienten 63 Ergebnisse 3.10.Ausgewählte Patientenfälle 3.10.1. Patientenfälle ohne Rezidiv III) R.F. (m), 27.11.28* SPSS No.: 10559 Anhand eines Fallbeispiels von 1995 soll der Verlauf eines rezidivfreien KZOTs demonstriert werden. Aufgrund eines zystischen Prozesses linksseitig wurde der Patient stationär in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der MHH aufgenommen. Der Röntgenbefund zeigte eine kirschgroße zystische Veränderung histopathologische Untersuchung der im linken Unterkieferbereich. Die „Keratozyste“ mit Probebiopsie ergab eine mehrschichtigem Plattenepithel und teilweiser parakeratotischer Verhornung (Abbildung 28). Durch eine Zystektomie mit intraoperativer Fixierung des Zystenbalgs durch Carnoysche Lösung erfolgte im Oktober 1995 die Entfernung der „Keratozyste“. In derselben Operation wurde aufgrund der großen Ausdehnung der Zyste der Zahn 33 entfernt. Es erfolgte ein speicheldichter Wundverschluss ohne Defektauffüllung. Vier Monate später stellte sich der Patient zur postoperativen Nachuntersuchung mit klinisch unauffälligem Befund und ohne einen Sensibilitätsausfall vor. Das Röntgenbild zeigte einen guten Knochenanbau ohne den Anhalt auf ein Rezidiv. Abbildung 28: Exemplarische histopathologische Bilder des KZOT zu dem Patientenbeispiel (#III) R.F., 27.11.28*;(A) Originalvergrößerung x100, (B) Vergrößerung x400 Abbildung A) zeigt die typische Histomorphologie des KZOTs mit mehrschichtigem Plattenepithel und oberflächlicher Verhornung. Reteleisten sind nur angedeutet ausgebildet und in den übrigen Anteilen des Operationspräparates noch weniger prominent. Im darunter 64 Ergebnisse liegenden Gewebe findet sich eine chronisch-fibrosierende Entzündung mit teils lymphoplasmazellulärer chronischer Entzündung. Der Patient lebt ohne Rezidiv. Die höhere Vergrößerung in Abbildung B) zeigt die gut abgrenzbare Basalzellschicht, die hier hochprismatisch ausgebildet ist und hyperchromatisch-basophile, elongierte Kerne aufweist, die typischerweise zentral bis gering nach apikal innerhalb der Basalzellen gelagert sind. Die darüber liegenden Zellen sind leicht elongiert und überwiegend kubisch. Superfiziell zeigt sich eine Parakeratose mit hypereosinophilen flachen und kernhaltigen Zellen. Die Epithelbreite ist unregelmäßig und beträgt etwa fünf bis acht Zellreihen. Selten finden sich basale und sehr selten suprabasale Mitosen. Schwerwiegende Atypien beziehungsweise ein invasives Wachstum lassen sich nicht nachweisen. IV) P.C. (m), 26.09.92* SPSS No.:33873 Aufgrund einer bestehenden Raumforderung des linken Unterkiefers wurde der Patient von seiner Hauszahnärztin 2009 in die Klinik für Mund-, Kiefer- und Gesichtschirurgie der MHH überwiesen. Der klinische Befund ergab eine leichte Druckdolenz links. Beide Kiefergelenke waren frei, die Mundöffnung nicht eingeschränkt. Der Visus sowie die Augenmotilität zeigten sich unauffällig. Intraoral wurde ein erhöhter Lockerungsgrad des Zahnes 37 (L°III) festgestellt. Der Röntgenbefund vom 28.08.2009 zeigte einen zystischen Prozess von circa 2-3 cm in mesio-distaler Richtung in der linken posterioren Unterkieferregion (36-38) sowie eine beginnende Wurzelresorption des Zahnes 37. Der histopathologische Befund der Probebiopsie im August 2009 ergab einen keratozystisch odontogenen Tumor mit kleinherdiger Verhornung ohne Hinweis auf Malignität. Im September desselben Jahres erfolgte unter Allgemeinanästhesie die Zystektomie des keratozystisch odontogenen Tumors unter vollständigem Erhalt des Nervus alveolaris inferior. Zusätzlich fand die Entfernung des Zahnes 37 und des retinierten und verlagerten Weisheitszahnes 38 statt. In der gleichen Operation erfolgte die Entnahme von kortikospongiösem Kochen aus dem rechten Beckenkamm mittels Knochenstanze zur Rekonstruktion des entstandenen Kieferdefektes. Die radiologische Kontrolle im selben Monat zeigte eine gute Einheilung des autogenen Knochentransplantates. Der Patient war beschwerdefrei und wies keine Entzündungszeichen auf. Die radiologischen Kontrollen sechs und 12 Monate postoperativ zeigten eine gute knöcherne Konsolidierung ohne Anzeichen für ein Rezidiv. Die folgenden jährlichen röntgenologischen Kontrollaufnahmen fanden beim Hauszahnarzt des Patienten statt. 65 Ergebnisse Röntgenbilder des keratozystisch odontogenen Tumors zu dem Patientenbeispiel (IV) P.C. (m), 26.09.92*: Abbildung 29: Präoperativer Zustand mit Raumforderung Regio 37/38 (Pfeile) (28.08.2009) Abbildung 30: Postoperativer Zustand mit beginnender Knochenkonsolidierung (Pfeile) (08.09.2009) 66 Ergebnisse Abbildung 31: Postoperativer Zustand mit guter Knochenkonsolidierung (Pfeile) (29.03.2010) Abbildung 32: Postoperativer Zustand ohne Anzeichen auf ein Rezidiv (Pfeile) (18.10.2010) 67 Ergebnisse 3.10.2. Patientenfälle mit Rezidiv I) B.O. (m), 10.01.55* SPSS-Nr.: 20099 Der Patient wurde aufgrund von zunehmenden Mundöffnungsbeschwerden und einer extraoralen Schwellung im Januar 1994 stationär in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der MHH aufgenommen. Die extraorale Schwellung erwies sich als perimandibulärer Abszess und wurde zunächst entsprechend therapiert. Der radiologische Befund ergab zudem einen Walnuss-großen (circa 1,5 cm²) zystischen Prozess im Bereich des rechten aufsteigenden Unterkieferastes. Der histologische Befund ergab eine „Keratozyste“, ausgekleidet mit einem mehrreihigen Epithel, welches eine prominente Basalschicht mit Parakeratose sowie Verkalkungen aufwies. Im umgebenen Bindegewebe wurden Entzündungszellen nachgewiesen (Abbildung 33). Es erfolgte zunächst die Zystostomie mit anschließender Eingliederung einer Obturatorprothese zum Offenhalten des Lumens. Drei Monate postoperativ wurde nach Verkleinerung des Lumens eine Zystektomie mit Anwendung der Carnoyschen Lösung vorgenommen. Die Wunde wurde speicheldicht verschlossen. Mit guten Wundverhältnissen und ohne Sensibilitätsausfälle stellte sich der Patient zwei Wochen postoperativ vor. Nach jährlichen klinischen und röntgenologischen Kontrolluntersuchungen wurde im August 2006, 12 Jahre nach Manifestation des ersten keratozystisch odontogenen Tumors, ein Rezidiv festgestellt. Dieses wurde erneut operativ mit einer Zystektomie in Lokalanästhesie entfernt. Weitere drei Jahre postoperativ stellte sich der Patient mit einer guten knöchernen Konsolidierung in dem Defektgebiet ohne Anzeichen auf einen erneuten zystischen Prozess vor. 68 Ergebnisse Abbildung 33: Exemplarische histopathologische Bilder des KZOT zu dem Patientenbeispiel (#I) B.O., 10.01.55*, (C) Vergrößerung x100, (D) Vergrößerung x400, (E) Vergrößerung x100 Abbildung C) zeigt ebenfalls das histologische Bild eines keratozystisch odontogenen Tumors. In Abbildung D) weist das Epithel die typische prominente Basalzellschicht, etwa fünf bis sechs Zellschichten und eine Parakeratose auf. Abbildung E) zeigt das Rezidiv, welches 12 Jahre postoperativ auftrat. Das Blutextravasat in der subepithelialen Fibrosa ist operationsbedingt. II) P. M. (w), 18.04.34* SPSS No.: 12527 Durch Überweisung ihres Hauszahnarztes stellte sich die Patientin im Juli 1992 zur chirurgischen Entfernung einer zystischen Veränderung im Bereich des Kieferwinkels rechts in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover vor. Die klinischen und röntgenologischen Voruntersuchungen gaben Hinweise auf eine „Keratozyste“ im Bereich des rechten Kieferwinkels mit zusätzlicher Retention des Zahnes 48. Es erfolgte die Behandlung der „Keratozyste“ durch eine Zystostomie mit gleichzeitiger Entfernung des retinierten Zahnes 48. Acht Monate später erfolgte die sekundäre Zystektomie mit Ausfräsung des Lumens und speicheldichtem Wundverschluss mit der Einlage von Kollagenvlies. Die 69 histopathologische Aufbereitung des Ergebnisse Operationspräparates bestätigte die klinische Verdachtsdiagnose einer „Keratozyste“. Diese wies ein mehrschichtiges Plattenepithel und eine gut anfärbbare Basalzellschicht auf. Das Epithel wurde von kollagen-fibrösem Bindegewebe umgeben. Durch regelmäßige Kontrolluntersuchungen in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der MHH wurde bei der Patientin 2001, neun Jahre postoperativ, erneut ein zystischer Prozess im rechten Kieferwinkelbereich diagnostiziert. Die histopathologische Untersuchung bestätigte den klinischen Verdacht eines Rezidivs der Keratozyste. Dieses wurde mittels einer Zystektomie entfernt. 3.10.3. Patientenfälle mit Gorlin-Goltz-Syndrom V) R.E. (w), 14.06.77* SPSS No.: 28290 Die Patientin stellte sich mit multiplen Zysten im Ober- und Unterkiefer und dem Verdacht auf das Gorlin-Goltz-Syndrom im Juni 2003 in der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der MHH vor. Eine umfangreiche klinische und radiologische Untersuchung bestätigte die Verdachtsdiagnose eines keratozystisch odontogenen Tumors als Symptom des Gorlin-Goltz-Syndroms. Die histopathologische Auswertung des gewonnenen Gewebematerials ergab das Vorliegen von multiplen keratozystisch odontogenen Tumoren ohne Anzeichen auf maligne Veränderungen oder ein Ameloblastom. Bei der Patientin wurden unter Intubationsnarkose alle Tumore durch eine Zystektomie entfernt. Die Defekte im Unterkiefer wurden mit autogenem Knochen aus dem Beckenkamm gefüllt. In der Region 48 wurde die „Zyste“ zuerst mit einer Zystostomie und einer zeitlich versetzten sekundären Zystektomie therapiert. Die Zystostomie erforderte das Einlegen einer Jodoform-Tamponade und das Anfertigen einer Obturatorprothese. Die Patientin entwickelte zwei Jahren postoperativ erneute keratozystisch odontogene Tumore in mehreren Lokalisationen. VI) L.C. (w) 01.05.79* SPSS No.: 28976 Die Patientin stellte sich 2004 mit einer Überweisung ihres Hauszahnarztes aufgrund des Verdachts auf multiple, zystische Läsionen in beiden Kieferwinkeln sowie im Oberkiefer rechts in der MHH vor. Anhand der Anamnese war das Vorliegen des Gorlin-Goltz-Syndroms bereits bekannt, was die Verdachtsdiagnose von rezidivierenden keratozystisch odontogenen Tumoren sofort aufkommen ließ. Auch die radiologische Untersuchung unterstrich diese Verdachtsdiagnose. Es konnten mehrere auffällige zystische Prozesse in beiden Kieferwinkelbereichen sowie im Oberkiefer rechts festgestellt werden. Klinisch wies 70 Ergebnisse die Patientin keine auffälligen Symptome auf. Der histopathologische Befund unterstützte die Verdachtsdiagnose von multiplen keratozystisch odontogenen Tumoren. Die „Zysten“ des Unterkiefers wurden durch eine Zystostomie entfernt. Im Oberkiefer erfolgte nach Zystektomie Wundheilung die Defektauffüllung erfolgte durch komplikationslos einen und Bichat’schen Wangenfettpfropf. auch die jährlichen Die radiologischen Kontrolluntersuchungen von 2004 bis 2010 zeigten keinen Anhalt auf erneute Rezidive. 2010 zog die Patientin nach Berlin, wodurch keine Informationen über den weiteren Verlauf bekannt sind. Röntgenbilder des keratozystisch odontogenen Tumors zu dem Patientenbeispiel (V) R.E. (w), 14.06.77*: Abbildung 34: Präoperativer Zustand mit multiplen Zysten (Pfeile) im Ober- und Unterkiefer (19.11.2004) 71 Ergebnisse Abbildung 35: Postoperativer Zustand mit guter Knochenkonsolidierung (Pfeile) (31.03.2005) Abbildung 36: Kein Anhalt auf Rezidive (Pfeile) (02.10.2007) 72 Ergebnisse Abbildung 37: Weiterhin keine Anzeichen für neue Rezidive (Pfeile) (07.04.2010) 3.10.4. Aktuelles Beispiel aus 2013 VII) M. L. (m) 04.08.72* Anhand dieses Patientenfalls soll ein aktueller Verlauf der Therapie eines ausgedehnten KZOTs an der Mund-, Kiefer- und Gesichtschirurgie der MHH dargestellt werden. Aufgrund einer Raumforderung von circa 5,5 cm im anterioren Unterkiefer wurde der Patient von seinem Hauszahnarzt im Dezember 2012 zur weiteren Abklärung und Behandlung an die MHH überwiesen. Das OPG zeigte eine 5,5 x 2 cm große zystische Veränderung mit definierten, gewellten Rändern im Unterkiefer von Regio 33 bis Regio 46. Die Kortikalis war zum Teil vorgewölbt und ausgedünnt. Zusätzlich fand sich Regio 46 eine weitere zystische Läsion mit einer Größe von circa 1 cm. Die histopathologische Auswertung der Probebiopsie vom 09.01.2013 ergab eindeutig das Vorliegen eines keratozystisch odontogenen Tumors. Der Tumor wies die typische palisadenartig aufgestellte Basalzellschicht und Hornlamellen auf. Das Plattenepithel war ausgedünnt und teilweise mit Granulationsgewebe ersetzt worden. Außerdem war es von myxoidem Bindegewebe umgeben. In dem weiteren Umfeld lag ein Rundzellinfiltrat ohne Atypien vor. Einen Monat später erfolgte die Entfernung des Tumors durch eine Unterkieferkastenresektion von Regio 33-46 unter dem Erhalt des Nervus alveolaris inferior. In der abschließenden histopathologischen Beurteilung ergab sich die Resektion Regio 34 als „non in sano“, sodass sechs Wochen später der Zahn 34 einschließlich seiner knöchernen Alveole im Rahmen einer Nachresektion entfernt wurde. Bereits im ersten Eingriff wurde eine vorgefertigte, computerassistierte, alloplastische 73 Ergebnisse Rekonstruktionsplatte (CAD-CAM-Implantat) zur Rekonstruktion und zur Stabilisierung des Unterkiefers eingebracht. Die Einheilung erfolgte ohne Komplikationen. Sechs Monate später wurde der Defekt mit einem mikrovaskulär-anastomosierten Fibulatransplantat rekonstruiert. Nach bisher rezidivfreiem Verlauf steht schlussendlich die Versorgung mit dentalen Implantaten aus. Dreidimensionale Bilder (CT) des keratozystisch odontogenen Tumors prä-/ postoperativ des Patienten M. L. (m) 04.08.72* Abbildung 38: Präoperatives 3D-Bild (CT) mit Darstellung der Weichgewebe, des Knochens sowie Hervorhebung des KZOT Regio 33 bis 46 (blau) 74 Ergebnisse Abbildung 39: Präoperatives Schnittbild des Unterkiefers aus der axialen Ebene mit Markierung des KZOT (blau) Regio 33 bis 46 und Abmessung seiner maximalen Ausdehnung in dieser Ebene (mesiodistal=51.1mm; vestibulo-lingual=14.9mm) 75 Ergebnisse Abbildung 40: Präoperatives Schnittbild des Unterkiefers aus der coronalen Ebene mit Markierung (blau) des KZOT Regio 33 bis 46 und Abmessung seiner maximalen Ausdehnung in dieser Ebene (mesiodistal=38.5mm; kranio-kaudal=16.9mm) 76 Ergebnisse Abbildung 41: Präoperatives Schnittbild des Unterkiefers aus der sagittalen Ebene mit Markierung (blau) des KZOT und Abmessung seiner maximalen Ausdehnung in dieser Ebene (vestibulo-lingual=19.5mm; kranio-kaudal=21.4mm) 77 Ergebnisse Abbildung 42: Postoperatives 3D-Bild (CT) nach Teilresektion und Rekonstruktion; Darstellung der Weichgewebe, des Knochens sowie der alloplastischen Rekonstruktion durch ein Patienten-spezifisches individualisiertes CAD-CAM Implantat; der KZOT wurde im Bezug auf die Resektionsgrenzen schematisch eingefügt (blau) 78 Ergebnisse Abbildung 43: 3D Volumenberechnung (CT) des KZOT aus der axialen Ebene, Volumen: 12.599cm³, Bone HU=898 79 Ergebnisse Zweidimensionale Bilder (OPG) des keratozystisch odontogenen Tumors prä-/ postoperativ des Patienten M. L. (m) 04.08.72*: Abbildung 44: Präoperativer Zustand mit einer Raumforderung von 33 bis 46 (Pfeile) und intraluminalen Knochensepten (13.02.2013) Abbildung 45: Postoperativer Zustand nach Unterkieferteilresektion mit alloplastischer Rekonstruktion (Pfeile) durch ein Patienten-spezifisches individualisiertes CAD-CAM Implantat (18.02.2013) 80 Ergebnisse Abbildung 46: Zustand nach Entfernung des Zahnes 34 (Pfeil) (09.04.2013) Abbildung 47: Postoperativer Zustand vom 30.07.2013 81 Ergebnisse Abbildung 48: Postoperativer Zustand nach Rekonstruktion durch einen mikrovaskulär-anastomosiertes Fibulatransplantat (Pfeile) (06.08.2013) 82 Diskussion 4. Diskussion 4.1. Diskussion der Materialien und der Auswertungsmethoden In die Auswertung des vorliegenden Materials wurden ausschließlich Patienten einbezogen, bei welchen gesicherte histopathologische Befunde mit den Diagnosen „Keratozyste“, „odontogene Keratozyste“ oder „keratozystisch odontogener Tumor“ vorlagen. Bei allen 114 Patienten erfolgte die Primäroperation in den Jahren zwischen 1991 und 2010 in der Abteilung für Mund-, Kiefer- und Gesichtschirurgie der MHH. Es muss bedacht werden, dass die „Keratozyste“ während der sich über zwei Jahrzehnte hinziehenden Untersuchungsspanne von 1991 bis 2010 anfangs noch als dysontogenetische Zyste und nach 2005 als Neoplasie eines tumorösen Vorgangs angesehen und behandelt wurde [10]. Allgemeinerkrankungen der Patienten wurden, soweit diese Erkrankungen einen operativen Eingriff zuließen, unter der Annahme, dass diese keinen Einfluss auf das Wachstum der Tumore haben, nicht weiter berücksichtigt. Drei Patienten mit dem selten auftretenden, malignen Gorlin-Goltz-Syndrom wurden aufgrund der besonderen Ätiopathogenese nicht in die statistischen Berechnungen einbezogen, da es sich um eine eigenständige Erkrankung handelt, welche sich schon im Kindesalter manifestieren kann [3, 18, 52, 58, 132]. Innerhalb des retrospektiven Untersuchungszeitraumes wurden im Wesentlichen fünf unterschiedliche Behandlungsmethoden angewandt, wie bereits in Kapitel 2. 5. beschrieben. Die Zystostomie (Partsch I) und die Zystektomie (Partsch II), etabliert durch Partsch, gelten bis heute als maßgebende Methoden in der Zystentherapie (siehe Kap.1.11.) und werden routinemäßig als solche in der Mund-, Kiefer- und Gesichtschirurgie der MHH angewandt [19, 124]. Angesichts der ausgeprägten Rezidivneigung wurde versucht, mit Hilfe erweiterter Behandlungsmethoden wie der Anwendung der chemischen Kauterisation durch die Carnoysche Lösung, der Anwendung von Kryotherapie oder dem Ausfräsen des Lumens, die Rezidivrate zu senken [87, 91, 107]. 83 Diskussion Das Fehlen von Studien mit höherer Evidenzklasse, welche die wissenschaftliche Basis verbreitern würden, führt zu individuellen Behandlungs- und Operationsentscheidungen der jeweiligen Institution beziehungsweise der Operateure [43]. Ebenso erschweren zum Teil unterschiedliche und unvollständige Dokumentationsweisen sowie unterschiedliche Untersuchungszeiten die Vergleiche der Ergebnisse. Statistisch wurden in dieser Arbeit deshalb nur die Gruppen mit ausreichend großer Fallzahl ausgewertet. Kleinere Stichproben wurden deskriptiv behandelt. Insgesamt ist die Datenlage im Hinblick auf das optimale therapeutische Vorgehen der keratozystisch odontogenen Tumore weiterhin unbefriedigend, obwohl viele zum Teil kleine, retrospektive Kohortenstudien vorliegen [43]. 4.2. Diskussion der Ergebnisse Die im Jahr 2005 den neuen pathogenetischen Erkenntnissen über den KZOT als tumoröses Geschehen gerecht werdende Klassifikation der WHO hat zu keiner erkennbaren Veränderung der Behandlungsweise geführt [10]. Auch ist es nicht gelungen, die enorme Rezidivinzidenz von 2-62% nachweislich zu senken, was auch das Ergebnis der vorliegenden Auswertung mit einer mittleren Rezidivinzidenz von 36,9% bestätigt [24, 84, 136]. Deshalb scheint es entscheidend, neben einem besseren Verständnis der Ätiopathogenese, auch die Einflussfaktoren auf das Rezidivverhalten sowie prognostisch relevante Einflussfaktoren zu erfassen, um effektive, rezidivarme Therapien für die Patienten entwickeln zu können. Mit einem Median von 42 Jahren (Median Frauen = 41 J. / Median Männer = 44 J.) erstreckt sich die Altersspanne von zwölf bis 90 Jahren und steht damit in Übereinstimmung mit einem Großteil der Literatur [2, 8, 17, 24, 71]. Die große Standardabweichung von 19 Jahren spricht für eine weitgehend altersunabhängige Entstehung der keratozystisch odontogenen Tumore [5, 18, 38, 112, 113]. Treten jedoch mit einem wesentlich jüngeren Altersmedian von 20 Jahren gleichzeitig mehrere Zysten auf, muss unter anderem an das Vorliegen eines sogenannten Gorlin-Goltz-Syndroms gedacht und dieses differenzialdiagnostisch über eine erweiterte Stufendiagnostik durch den Oralchirurgen mit anschließend histopathologischer Beurteilung abgeklärt werden [56]. Zusätzlich sind auch ein dermatologisches Screening mit der Frage nach Basalzell-Karzinomen und Röntgenthorax-Aufnahmen zur Abklärung möglicher Skelettdeformationen (Rippen/ Wirbelsäule) erforderlich. Erhärtet sich der Verdacht auf ein GGS, kann eine genetische Abklärung die Verdachtsdiagnose verifizieren [3, 18, 55, 58, 91]. Im vorliegenden Kollektiv war dies bei drei jungen Patientinnen mit einem 84 Diskussion Altersmedian von 18 Jahren der Fall. Sie wiesen multiple keratozystisch odontogene Tumore als Teil des Gorlin-Goltz-Syndroms auf, mit einer erhöhten Inzidenz an Rezidiven. In Übereinstimmung mit der Literatur sprechen diese Beobachtungen dafür, dass der KZOT auch als Symptom innerhalb eines Gorlin-Goltz-Syndroms in Form multilokulärer zystischer Läsionen mit hoher Rezidivinzidenz vermehrt bei jüngeren Patienten auftreten kann [58, 123, 132]. Andererseits wiesen zwei jüngere Patienten (1,8%) mit einem Altersdurchschnitt von 34 Jahren in der vorliegenden Studie ebenfalls multilokuläre KZOT auf, ohne dass ein GorlinGoltz-Syndrom nachgewiesen werden konnte [17, 22, 23, 74, 90, 105, 113]. Männer waren gegenüber Frauen in einem Verhältnis von 2:1 doppelt so häufig von dem KZOT betroffen. Dies gleicht den in der Literatur beschriebenen Ergebnissen [4, 17, 38, 44, 86, 112, 114]. Das seltenere Auftreten bei Frauen führen Dammer et al. auf einen schützenden Einfluss weiblicher Hormone zurück [29]. Die Tumore fanden sich signifikant häufiger (p<0,001) im Unterkiefer (91,9%) als im Oberkiefer (8,1%). Diese auffällige Häufigkeit und die Prädilektionsstelle im posterioren Unterkieferwinkelbereich mit 68,3% stimmen weitgehend mit der aktuellen Literatur überein [17, 22, 24, 52, 71, 78, 114, 117, 123]. Dass die Tumore aus entwicklungsbedingten Residuen der Mallessez‘schen und der Serres’schen Epithelreste entstehen, kann die oben erwähnte Prädilektion im Unterkiefer erklären, da diese Zellreste bei der Odontogenese häufig im posterioren Bereich des Unterkiefers zurückbleiben [91, 117, 136]. Die überwiegende Mehrzahl der Tumore, 59,5%, wurde als symptomloser Zufallsbefund im Rahmen einer röntgenologischen Routine-Diagnostik festgestellt [17, 30]. Der recht hohe Anteil an asymptomatischen keratozystisch odontogenen Tumoren dieser Studie ist mit einer geringen radiologischen Durchschnittsgröße von 5,5 cm² im Vergleich zu den in der Literatur angegebenen Werten von bis zu 19 cm² zu begründen [30, 52, 78, 81, 123]. Der Zusammenhang zwischen der Größe und den recht spät auftretenden Beschwerden lässt sich im Unterkiefer durch die anterior-posteriore Wachstumsrichtung im Bereich der Spongiosa verdeutlichen. Dadurch ist es dem Tumor möglich, eine beträchtliche Größe anzunehmen, bevor er durch das Perforieren der Knochenkompakta Beschwerden verursacht [1, 18, 24, 44, 91, 117]. Die Größenangaben anderer Autoren von bis zu 19 cm² können deren höhere Werte an symptomatisch diagnostizierten Läsionen erklären [30, 52, 78, 81, 123]. Aufgrund der Prädilektionsstelle im zahnlosen Bereich des posterioren Unterkiefers wiesen nur 32,4% der untersuchten Fälle eine enge räumliche Beziehung zu einem oder mehreren Zähnen auf. 67,6% zeigten keine Beziehung zu einem Zahn. In der Literatur weichen diese Angaben korrelierend mit der Größe von den Werten der 85 Diskussion vorliegenden Arbeit ab [80, 81, 123]. Wie auch in der Literatur traten die KZOT zu 98,2% unilokulär auf [17, 22, 23, 74, 90, 105, 113]. Große oder multiple keratozystisch odontogene Tumore erfordern ein erweitertes radiologisches Diagnostikverfahren wie ein Computertomogramm (CT) oder eine digitale Volumentomographie (DVT), um die topographisch-räumliche Ausdehnung genauer zu bestimmen und um therapeutische Maßnahmen gezielter planen zu können [53, 58, 91, 119]. Bei 45,9% der Patienten (n = 51) wurde ein Augmentationsverfahren erforderlich, um die Funktionsstabilität des Kiefers wiederherzustellen. Am häufigsten (n = 38) wurde dafür autogener (autologer) Knochen aus dem Beckenkamm der Crista iliaca anterior superior entnommen und zur Defektauffüllung genutzt. Dies bedeutet einen zusätzlichen Eingriff zur Gewinnung von Knochenmaterial. Klinische Studien zeigen jedoch, dass autogene Knochentransplantate unverändert den „Goldstandard“ in der Augmentationstechnik darstellen [27, 91, 101, 104]. Bei ausgedehnten Knochendefekten können zusätzlich Osteosyntheseplatten zur Stabilität erforderlich werden, um eine zeitnahe Belastung gewährleisten zu können [93]. 4.2.1. Rezidivverhalten Im vorliegenden Untersuchungszeitraum von zwei bis 204 Monaten (Mittelwert = 3,5 Jahre) kam es kumulativ zu einer mittleren Rezidivhäufigkeit von 36,9%, was mit den Angaben in der Literatur von 2% bis 62% übereinstimmt [24, 84, 136]. Die von zahlreichen Autoren vorgelegten Ergebnisse beziehen sich oft auf kleine Fallzahlen und auf unterschiedliche Beobachtungszeiträume, welche den statistischen Vergleich erschweren [17]. Die meisten Rezidive (27 / 41) wurden innerhalb der ersten vier Jahre nach der Primäroperation festgestellt. Bei zwei Patienten konnte noch nach 12 Jahren ein Rezidiv diagnostiziert werden, was Resultaten der Literatur entspricht [5, 18, 20, 21, 24, 41, 52, 82, 117]. Dieses späte Auftreten kann durch unzureichende Behandlungsmethoden sowie auf das charakteristische, meist symptomlose Tumorwachstum und eventuell dem Versäumnis regelmäßiger Kontrollen erklärt werden [18, 84]. Wie die Ätiopathogenese vermuten lässt, manifestierten sich auch die Rezidive überwiegend im Unterkiefer (95,1%), im Median innerhalb eines Zeitraumes von 36 Monaten [17, 22, 38, 40]. Seltener und früher (n = 2; Median = 18 Monate) zeigten sie sich im Oberkiefer. Das lässt sich mit der komplexeren Anatomie des Oberkiefers und den dadurch bedingten erschwerten operativen Zugängen begründen [22, 98]. 86 Diskussion Tendenziell wurden die Rezidive bei Frauen häufiger 48,6% (18 / 37; p = 0,071) und auch früher (p = 0,126) diagnostiziert. Im Schnitt wurden sie bei Frauen schon nach drei Jahren, hingegen bei Männern 31% (23 / 74) erst nach sechs Jahren festgestellt. Diese Tatsache lässt an dem von Dammer et al. [10] erwähnten schützenden Einfluss weiblicher Hormone zweifeln und ist möglicherweise Ausdruck eines verstärkten Gesundheitsbewusstseins bei Frauen. Zahlreiche Autoren diskutieren diese geschlechtsspezifischen Unterschiede kontrovers [4, 22, 30, 38, 123]. Zur Klärung, ob die weiblichen Hormone hierauf einen Einfluss haben, wäre in weiteren Untersuchungen zu klären. Wie bereits die Primärtumore traten die Rezidive altersunabhängig auf. Der Einfluss des Alters auf das Rezidivverhalten wird in der Literatur allerdings kontrovers diskutiert. Forsell et al. [41] sehen eine Disposition des Kinder- und Jugendalters, ElHaji [38] hingegen betont eine Disposition bei 50-60-Jährigen und Titindi [123] sieht eine Bevorzugung sowohl bei 20Jährigen wie auch bei 80-Jährigen. Andere Autoren wiederum schließen, deckend zu den Ergebnissen dieser Studie, ebenfalls eine Altersabhängigkeit aus [49, 52]. Im Hinblick auf das Rezidivverhalten nach den unterschiedlichen Operationsmethoden ist die Datenlage in der Literatur widersprüchlich [38, 98, 130]. Frerich et al. merken zur nicht mehr gültigen Leitlinie von 2007 an, dass angesichts meist retrospektiver Kohortenstudien die Datenlage unzureichend ist [43]. Die Leitlinie konnte letztlich nur vorläufige Therapieempfehlungen aussprechen und empfahl die erweiterte Enukleation in Kombination von Zusatzbehandlungen mit dem Ziel, verbliebene Tumorreste und Mikrozysten zu eliminieren [43]. Diese Leitlinie wurde 2007 im Auftrag der Deutschen Krebsgesellschaft und im Konsens mit der Deutschen Gesellschaft für Mund-, Kiefer- und Gesichtschirurgie in Auftrag gegeben und vom Vorstand der DGMKG unter interdisziplinierter Abstimmung verabschiedet [43]. In der vorliegenden Arbeit konnte gezeigt werden, dass es im Hinblick auf die angewandten Operationsmethoden (ZE/ ZE + CS/ den übrigen Methoden) und die postoperative Häufigkeit eines Rezidivs signifikante Unterschiede gibt (p= 0,025 mit ᵡ²=7.372 (df=2)) (Abbildung 20). Diese Signifikanz wurde durch direkte Vergleiche von jeweils zwei Operationsmethoden mittels Chi-Quadrattest spezifiziert und ergab einen signifikanten Vorteil der Zystektomie gegenüber der Zystektomie mit Carnoyscher Lösung (p= 0,027 mit ᵡ²=6,031 (df=1)) (Abbildung 21). Die Zystektomie (Partsch II) zeigte innerhalb einer durchschnittlichen Nachbeobachtungszeit von 3,3 Jahren mit einer Rezidivinzidenz von 28,6% (n = 20 / 70) das günstigste Behandlungsergebnis. Auch Brøndum et al. [22] finden nach Zystektomie innerhalb einer Nachbeobachtungszeit von sieben bis 17 Jahren eine Rezidivrate von 25% 87 Diskussion (n = 8 / 32). Ähnliche Daten sind auch in der Literatur publiziert [26, 38, 98, 123]. Hingegen beschreiben Forssell et al. [41] bei Nachkontrollen von bis zu 17 Jahren eine Häufigkeit von 40,5% (n = 28 / 69). Sie differenzieren dabei zwischen einem in mehreren Stücken oder einem in toto entfernten Zystenbalg und erhielten nach dem Entfernen in toto, allerdings bei kleiner Fallzahl (n = 5), eine geringere Rezidivrate von 18% im Vergleich zu der teilweisen Entfernung (n = 23; 56%) [41]. Dieses Ergebnis spricht dafür, dass zurückbleibende Zellen ursächlich für die Rezidive sein können und dass die Art und Weise des chirurgischen Vorgehens wesentlich an der Rezidiventstehung beteiligt ist [41]. Die Zystektomie in Kombination mit der Carnoyschen Lösung (n = 25) ergab innerhalb der angewandten Operationsmethoden und eines durchschnittlichen Nachbeobachtungszeitraumes von 4,3 Jahren ein wesentlich höheres Rezidivaufteten von 56% (n = 14). Ebenso wenig verbesserte sich die Rezidivrate bei Morgan et al. [86] und auch nicht bei Chirapathomsakul et al. [26] durch eine Kombination von Zystektomie und chemischer Kauterisierung durch die Carnoysche Lösung. Tendenziell ergab die vorliegende Auswertung mit Blick auf die jeweils angewandten Operationsmethoden für die alleinige Zystektomie ohne weitere Maßnahmen eine geringere Rezidivinzidenz (p = 0,027 mit ᵡ²=6,031 (df=1)) und eine längere Rezidivfreiheit gegenüber der zusätzlichen Behandlung mit Carnoyscher Lösung. Bei 50% mit alleiniger Zystektomie therapierten Patienten traten nach acht Jahren (96 Monaten) einzelne Rezidive auf, bei zusätzlicher Nutzung der Carnoyschen Lösung traten sie nach sieben Jahren (84 Monaten) auf (p-Wert = 0,088) (Abbildung 22). Die alleinige Zystektomie hat den Vorteil, dass sie durch sorgfältiges Abpräparieren des Zystenbalges in der Regel keine Affektion des Kieferknochens bewirkt und dadurch auch ein geringeres Risiko der Nervenschädigung darstellt [109]. In Abhängigkeit von der Expositionszeit konnte eine toxische Wirkung der Carnoyschen Lösung auf den Nervus alveolaris inferior sowie möglicherweise auch auf umliegende Blutgefäße tierexperimentell nachgewiesen werden [42, 106]. Auch klinische Studien belegen eine potenziell gewebsschädigende und neurotoxische Wirkung der Lösung mit vermehrten Wunddehiszenzen und Wundinfektionen [40, 43, 59, 126]. Das relativ schonende Vorgehen der Zystektomie und die geringen postoperativen Komplikationen können eventuell erklären, warum weniger Rezidive auftraten. Da die Toxizität der Carnoyschen Lösung nur eine kurze Einwirkzeit der Lösung zulässt, kann diese nicht tief genug in das Gewebe dringen, um Satellitenzellen zu erreichen, womit sich die hohe Rezidivrate erklären ließe. In Gegensatz hierzu gaben Gosau et al. [52] nach 88 Diskussion Anwendung der Carnoyschen Lösung (n = 14) eine Minderung der Rezidivrate, verglichen mit der alleinigen Zystektomie (n = 22), von 50% auf 14,3% an [52]. Allerdings ist, wie Gosau selbst anmerkt, die Nachbeobachtungszeit von nur ein bis zwei Jahren zu kurz, um zu einer zuverlässigen Bewertung zu kommen, da wie zahlreiche Autoren berichten, auch nach 12 Jahren Rezidive zu beobachten sind [18, 31, 52, 110]. Zwar beschrieben auch Voorsmit et al. [130] schon 1981 eine Minderung der Rezidive durch die Anwendung von Carnoyscher Lösung, diese Reduktion erzielten sie allerdings in Verbindung mit zusätzlicher Entfernung der angrenzenden Mukosa. Diese positive Wirkung der Entfernung von angrenzender Mukosa erklären Voorsmith et al. mit dem histologischen Nachweis von Mikrozysten, die sie in den nach alleiniger Zystektomie entstandenen Rezidiven (n = 53) fanden [130]. Die positive Wirkung der Mukosaentfernung auf das Rezidivverhalten wird von anderen Autoren bestätigt [38]. Tendenziell stellt die Carnoysche Lösung, wenn das Rezidivauftreten gegen die postoperativen Risiken abgewogen wird, keine zielführende Maßnahme dar [86]. Junior et al. [59] werten die Kombination der peripheren Osteotomie mit dem Einwirken der Carnoyschen Lösung als erfolgversprechende Methode. Sie weisen allerdings auf die bedenkenswerten postoperativen Risiken hin, wie z.B. Neuropathien, die sowohl durch die Lösung als auch durch den rotierenden Bohrer zur Knochenabtragung entstehen können [59]. Aufgrund geringer Fallzahlen wurden die Zystektomie mit anschließendem Ausfräsen des Lumens (n = 8) und die Unterkieferteilresektion (n = 3) als radikalere chirurgische Verfahren in einer Gruppe zusammengefasst und statistisch ausgewertet, ohne dass eine statistische Signifikanz gegenüber der anderen Operationsmethoden herausgestellt werden konnte. Die Zystostomie (Partsch I) ließ sich aufgrund kleiner Fallzahl (n = 5) nur deskriptiv bewerten. Diese drei Operationsmethoden werden im Hinblick auf das Rezidivverhalten bei kleinen Fallzahlen sowie mit widersprüchlichen Ergebnissen diskutiert, ohne dass sich daraus ein zielführendes therapeutisches Handeln ableiten ließe [15, 26, 29, 38, 79]. Selbst ein Vorgehen mit radikalem Ausfräsen des Lumens nach Zystektomie (n = 8) kann mit einer Rezidivinzidenz von 62,5% (5 / 8) das Rezidivauftreten nicht überzeugend vermindern. Die nicht klar definierte Tiefe der erforderlichen Knochenabtragung und die schwer erhältliche Information über die Lokalisation und die Anzahl versprengter Tumorzellen können ursächlich dafür sein [18]. Möglicherweise führt gerade das Ausfräsen dazu, dass pathogene Zellen tiefer in den Knochen gepresst werden, die für spätere Rezidive verantwortlich sind [126]. Gegensätzlich hierzu berichten Autoren [30, 86] mit dieser Methode eine Minimierung der Rezidive, die jedoch oft mit einem höheren postoperativen 89 Diskussion Behandlungsbedarf aufgrund von ödematösen Schwellungen verbunden sein kann [30]. Nachteilig ist zusätzlich die statische Schwächung des Knochens mit der postoperativen Gefahr einer Knochenfraktur und möglicherweise erheblichen postoperativen Belastungen mit hohen Anforderungen an die Compliance im Hinblick auf den Therapieerfolg [18, 43]. Die Zystostomie (Patsch I) gilt unter einigen Autoren lediglich als vorbereitende Maßnahme bei großen Läsionen [22, 87, 98, 110]. Die Dekompression des Lumens führe zu einer Zunahme der Epithelschicht mit radiologisch nachweisbarer Zunahme der Knochendichte sowie Masse. Daraus resultiert eine Verkleinerung des Lumens [75, 79, 87, 98, 139], wodurch der Zystenbalg in der sekundären Zystektomie einfacher entfernbar sein soll und Rezidive vermieden werden [18, 22, 75, 79, 87, 110, 112, 139]. Das Entfernen des Epithels erscheint in Anbetracht einer zwar seltenen, aber potentiellen malignen Entartung essentiell [40, 46]. Bei einem von fünf mit dieser Methode therapierten Patienten trat nach 12 Monaten ein Rezidiv auf. Für den Erfolg der Zystostomie ist das Offenhalten des Lumens für mehrere Monate erforderlich [17, 18, 75]. Die dabei geforderte und erforderliche Compliance des Patienten schränkt das Anwenden dieser Methode deutlich ein [110]. Bei ausgedehnten keratozystisch odontogenen Tumoren muss in seltenen Fällen die Unterkieferteilresektion mit entsprechenden Rekonstruktionsmaßnahmen angewendet werden. Nach dieser Methode wurde wiederholt von einer Rezidivfreiheit berichtet, weshalb sie von einigen Autoren weiterhin als die aus rezidivprophylaktischer Sicht zuverlässigste Therapie angesehen wird [90, 123]. Allerdings kann dies eine erhebliche Funktionseinschränkung der Kiefer mit zusätzlich erhöhten Komplikationsraten für den Patienten bedeuten [1, 15, 17, 29, 43, 59, 72, 126, 138]. Selbst bei einem dieser drei derart behandelten Patienten dieser Studie wurde 24 Monate postoperativ in dem autogenen Knochentransplantat ein Rezidiv diagnostiziert [31, 66, 77, 92]. Versprengte Zellen in der aufliegenden Mukosa können für Rezidive selbst innerhalb der Transplantate verantwortlich sein, weshalb diese immer mit entfernt werden sollte [24, 31, 43, 44, 107, 118]. Um zu aussagekräftigeren Ergebnissen zu kommen, wurde der Versuch gemacht, im Hinblick auf die statistischen Schwierigkeiten und angesichts unterschiedlicher sowie zum Teil kleiner Fallzahlen, das Rezidivverhalten in drei verschiedenen Zeitabschnitten auszuwerten und darzustellen. Die erste Gruppe umfasste das Gesamtkollektiv (n = 111) mit einem postoperativen Kontrollzeitraum von mindestens zwei Monaten. In der zweiten Gruppe (n = 71) wurden nur die Patienten mit einem postoperativen Kontrollzeitraum von mindestens einem Jahr erfasst und analysiert. In der dritten Gruppe (n = 45) wurden alle Patienten mit einem postoperativen 90 Diskussion Kontrollzeitraum von mindestens drei Jahren analysiert. Diese drei Zeitintervalle wurden gewählt, um eventuell zusätzliche Aspekte oder bereits erhaltene Ansätze über das Rezidivverhalten innerhalb eines definierteren Beobachtungszeitraumes herauszuarbeiten oder zu verdeutlichen. Diese zeitliche Fokussierung bestätigte die zuvor schon festgestellten Unterschiede zwischen dem Geschlecht und dem Auftreten eines Rezidivs mit einem statistisch signifikanten Ergebnis (p = 0,038 mit ᵡ²=4.43 (df=1)). Allerdings lassen sich hieraus derzeit noch keine zusätzlichen therapeutischen Konsequenzen ableiten. 91 Diskussion 4.3. Schlussfolgerung Es lässt sich feststellen, dass die Therapie der KZOT weiterhin zahlreiche Fragen aufwirft. Der KZOT tritt primär vermehrt bei Männern auf, jedoch kommt es bei Frauen tendenziell häufiger zu Rezidiven. Das vermehrte Vorkommen im Unterkiefer scheint im Zusammenhang mit den dort entwicklungsgeschichtlich häufiger zurückbleibenden Epithelzellresten zu stehen. In Bezug auf die angewandten Operationsmethoden und das postoperative Rezidivauftreten wies die Zystektomie das beste Ergebnis auf, konnte jedoch das Auftreten von Rezidiven auch nicht sicher verhindern. In vielen Fällen scheint die alleinige Zystektomie als Therapie der Wahl geeignet zu sein, da sie die Rezidivrate minimiert, die rezidivfreie postoperative Zeit tendenziell verlängert und sich für den Patienten als schonende Maßnahme darstellt. Auch weitere Autoren schätzen die Zystektomie als eine geeignete Operationsmethode zur Behandlung der keratozystisch odontogenen Tumore [1, 29, 39, 126]. Bei der Wahl der Operationsmethode sollte nach Ansicht vieler Autoren das Wohlergehen und die Lebensqualität des Patienten auch in den Vordergrund gestellt und in das therapeutische Vorgehen einbezogen werden [29, 49, 126, 130]. Jedoch ist eine Rezidivrate von 36,9% innerhalb des Gesamtkollektivs (n = 111) bei weitem nicht zufriedenstellend und zeigt, dass den erweiterten und radikaleren Operationsmethoden bei der Therapieentscheidung mehr Gewicht zugesprochen werden sollte, um im Einzelfall die prognostisch günstigere Methode wählen zu können. Auch trägt die Eingruppierung der „Keratozyste“ durch die WHO 2005 zu den benignen odontogenen Tumoren der Tatsache einer hohen Rezidivrate Rechnung. Zukünftig sollte somit bei der Wahl der Therapiemethode diese Re-Klassifizierung bei der Therapieentscheidung berücksichtigt werden, damit der KZOT weniger als „Zyste“ sondern vielmehr als Tumor therapiert wird. Um evidenzbasierte Therapieempfehlungen geben zu können, fehlen derzeit unter randomisierten Bedingungen gewonnene Behandlungsergebnisse. Dies verdeutlicht die Notwendigkeit einer Erweiterung der heute nicht mehr gültigen Behandlungsleitlinie von 2007 auf eine höhere Evidenzklasse [43]. Regelmäßige, zum Beispiel jährliche klinische und röntgenologische Kontrollen des betroffenen Kieferabschnittes mittels dreidimensionaler Bildgebung (z.B. DVT/CT) sollten zumindest drei Jahre postoperativ durchgeführt werden, da die vorliegende Untersuchung wie auch weitere Studien aufzeigen, dass dies das Zeitfenster mit den häufigsten Rezidiven darstellt [26]. Ab dem vierten postoperativen Jahr scheint eine zweidimensionale radiologische Kontrolle (z.B. OPG) im Abstand von zwei Jahren ausreichend zu sein. 92 Diskussion Grundsätzlich sind sehr langfristige klinische sowie radiologische Nachuntersuchungen erforderlich, da Rezidive auch noch 12 Jahre postoperativ auftreten können, wie die vorliegende Studie zeigte. 93 Diskussion 4.3.1. Ausblick Die noch weitgehend ungeklärte Ursache für den geschlechtlichen Unterschied im Auftreten des keratozystisch odontogenen Tumors sowie weiterhin die Frage nach einer kausalen, effektiven und nachhaltigen Therapiemethode für Patienten mit einem KZOT können Ansätze zukünftiger Untersuchungen sein. Schon die in 2007 erstellte Leitlinie der DKG/ DGMKG [43] sprach nur vorläufige Therapieempfehlungen aus, da die Datenlage aufgrund fehlender randomisierten Therapiestudien nicht ausreichend war, um Therapieempfehlungen auf gesicherter Datenlage abzugeben. Um die Leitlinie auf ein höheres Evidenzlevel weiterentwickeln zu können, sind multizentrische randomisierte Studien mit ausreichend hohen Fallzahlen erforderlich. Innerhalb der Fachliteratur wird der keratozystisch odontogene Tumor häufig noch als „Keratozyste“ beschrieben sowie behandelt und somit die Weiterentwicklung der aktuellen Klassifikation der WHO 2005 nicht berücksichtigt, was das tumoröse Verhalten in den Hintergrund treten lässt. In dieser Klassifikation wird besonders auf einen genetischen Ursprung des KZOT und seinem damit verbundenen neoplastischen Verhalten hingewiesen [10]. Mangels kausaler Therapieverfahren stellen molekulargenetische Ansätze zukünftig erfolgversprechende Behandlungsmöglichkeiten dar. Diese Therapieansätze fokussieren auf die durch eine Mutation von PTCH1 ausgelöste Fehlregulation des Hedgehog-Signalwegs und das damit im Zusammenhang stehende Auftreten des keratozystisch odontogenen Tumors als Syndrom-assoziierte und sporadisch auftretende Läsionen [10, 105, 138]. Die PTCH1-Mutationen konnten von Sun et al. [121] sowohl auf sporadischen als auch Syndromassoziierten (GGS) keratozystisch odontogenen Tumoren nachgewiesen werden. Gezielt versuchen die molekulargentischen Therapieansätze, in die Fehlregulation des PTCH1Rezeptors und des SHH-Pathways einzugreifen [14, 68, 138]. Hierzu wurden Cyclopamine (z.B. CUR61414) untersucht, die sich als Antagonist an den SMO binden und dadurch als Anti-Proliferations-Agent wirken können [138]. Wie die verschiedenen molekulargenetischen Ansätze zeigen [50, 87, 133, 138], scheint es erfolgversprechend zu sein, insbesondere im Hinblick auf die Assoziation mit dem GGS/ NBCCS Syndrom, diese Ansätze weiter zu verfolgen [50, 133]. 94 Zusammenfassung 5. Zusammenfassung Die vorliegende retrospektive Arbeit umfasst 114 Patienten der Medizinischen Hochschule Hannover, die in dem Zeitraum von 1991 bis 2010 aufgrund eines histologisch gesicherten keratozystisch odontogenen Tumors (KZOT) behandelt wurden. Die vorliegenden Daten dieser Patienten wurden insbesondere mit Blick auf die angewandten Operationsmethoden und dem Rezidivverhalten ausgewertet und analysiert. Darüber hinaus wurde zum besseren Verständnis der Ätiopathogenese das klinische Verhalten der KZOT ausgewertet. Bei 56,5% der Betroffenen wurde der Tumor während einer Routineuntersuchung als symptomloser Zufallsbefund diagnostiziert. Das Alter bei Erstdiagnose lag im Median bei 42 Jahren. Der jüngste Patient war 12 Jahre alt, der älteste Patient war 90 Jahre alt. Mit 37,8% war die Altersgruppe der 31-50-Jährigen am häufigsten betroffen. Insgesamt konnte bei den Auswertungen jedoch kein sowie ein altersabhängiges Auftreten des KZOT festgestellt werden. Dagegen konnten durch diese Studie ein geschlechtsspezifisches lokalisationsspezifisches Auftreten des KZOT festgestellt werden. Im Verhältnis von 2:1 trat der KZOT vermehrt bei Männern (66,7%) auf und lokalisierte sich mit 91,9% (p<0.001) signifikant häufiger im Unterkiefer. Zu 98,2% stellte er sich als unizystischer Prozess dar und zeigte bei 32,4% der Patienten eine Beziehung zu einem Zahn. Die Auswertung der zweidimensionalen Röntgenbilder ergab eine durchschnittliche Projektionsfläche von 5,5 cm². Von den fünf untersuchten Operationsmethoden war die Zystektomie mit 63,1% die am häufigsten angewandte Operationsmethode, gefolgt von der Zystektomie und zusätzlichem Einwirken der Carnoyschen Lösung (22,5%). Selten wurden die Zystektomie mit anschließendem Ausfräsen des Lumens (7,2%), die Zystostomie (4,5%) sowie die Teilresektion des Unterkiefers (2,7%) durchgeführt. Nach operativer Entfernung des KZOT wurde bei 51 Patienten (45,9%) eine Augmentation autologen Knochenmaterials erforderlich, wobei die Augmentation von Spongiosa aus dem Beckenkamm mit 72,5% (n = 37) die häufigste Methode darstellte. 95 Zusammenfassung Die postoperative klinische und röntgenologische Nachuntersuchungszeit lag im Mittel bei 41,9 Monaten (3,5 Jahre) und erstreckte sich über einen Zeitraum von zwei Monaten bis zu 17 Jahren (204 Monate). Innerhalb dieses Untersuchungszeitraumes kam es bei 41 Patienten zu einem Rezidiv, was einer Rezidivinzidenz von 36,9% entspricht. Im Median wurden die Rezidive nach drei Jahren (36 Monaten) diagnostiziert. Im Bezug auf das Alter traten die Rezidive am häufigsten (43,9 %) in der Altersgruppe der 31-50-Jährigen auf. Hinsichtlich der Lokalisation entwickelten sich die Rezidive zu 95,1% signifikant häufiger im Unterkiefer. Geschlechtsspezifische Unterschiede im Rezidivauftreten stellten sich zu Ungunsten der Frauen dar. Bei diesen wurden Rezidive tendenziell häufiger (Frauen = 48,6%, Männer = 31,1%) und etwa drei Jahre früher diagnostiziert als bei den Männern (p = 0,126). Diese Tendenz konnte durch einen weiteren Analyseteil, welcher nur Patienten einbezog, die eine postoperative Nachuntersuchungszeit von mindestens einem Jahr aufwiesen (n = 71), statistisch bestätigt werden. Innerhalb dieser Gruppe (n = 71) zeigte sich ein signifikanter Unterschied im Hinblick auf das Rezidivauftreten und dem Geschlecht. Frauen entwickelten mit 51,2% häufiger (p = 0,038 mit ᵡ²=4.43 (df=1)) und drei Jahre früher (p = 0,036 mit ᵡ²=4.40 (df=1)) ein Rezidiv als die Männer (Tabelle 10). Desweiteren konnte in dieser Studie ein Zusammenhang zwischen der angewandten Operationsmethode und der Rezidivhäufigkeit aufgezeigt werden (p= 0,025 mit ᵡ²=7,374 (df=2). Die Zystektomie war mit einer Rezidivquote von 28,6% der Zystektomie mit anschließendem chemischem Kauterisieren durch die Carnoyschen Lösung (56,05%) signifikant überlegen (Abbildung 21). Obwohl diese Studie nicht zeigen konnte, dass aufwändige und zum Teil radikale Operationsmethoden die Rezidivquote statistisch nachweislich reduzierten, sollte diesen Verfahren angesichts der insgesamt hohen Rezidivrate und der neuen Re-Klassifizierung der WHO von 2005 eine größere Aufmerksamkeit gewidmet werden. Desweiteren sind multizentrische, prospektive und randomisierte Untersuchungen erforderlich, um die Leitlinie von 2007 auf ein statistisch höheres Evidenzlevel für evidenzbasierte Therapieempfehlungen zu führen. Die Zahl der Patienten, welche nach mindestens drei Jahren noch zur postoperativen Nachuntersuchung erschienen, lag bei 40,5% (n = 45). Davon waren 35,6% Frauen und 64,4% Männer. Die Rezidivinzidenz dieser 45 Patienten lag bei 71,1%. 96 Zusammenfassung In Anbetracht des Rezidivverhaltens der KZOT mit gehäuftem Auftreten der Rezidive in den ersten drei postoperativen Jahren sind jährliche Nachuntersuchungen inklusive dreidimensionaler Bildgebung (z.B. DVT / CT) indiziert. Diese moderne Technik ermöglicht, durch Eingrenzung des Zielvolumens die Strahlenbelastung des Patienten zu minimieren. Ab dem dritten postoperativen Jahr kann erwogen werden, die radiologische Kontrolle auf eine zweidimensionale Aufnahme (z.B. OPG) in zweijährigem Abstand zu reduzieren. Um eine zuverlässige Teilnahme an den Nachuntersuchungen zu erreichen, empfiehlt es sich, den Patienten darüber aufzuklären, dass es sich bei dem KZOT um einen benignen Tumor handelt, welcher einem neoplastischen Wachstumsmuster folgt und eine hohe Rezidivinzidenz aufweist. 97 Literaturverzeichnis 6. Literaturverzeichnis 1. Abdullah WA. Surgical treatment of keratocystic odontogenic tumour: A review article. The Saudi Dental Journal (2011) 23, 61-65. 2. Agaram NP, Collins BM, Barnes L, Loago D, Aldeeb D, Swalsyk P, Finkelstein S. Molecular Analysis to Demonstrate That Odontogenic Keratocysts Are Neoplastic. Arch Pathol Lab Med. 2004; 128:313-317. 3. Agrawal A, Murari A, Vutukuri S. A Case Report Gorlin-Goltz Syndrome: Case Report of a Rare Hereditary Disorder. Hindawi Publishing Corporation, Case Rep Dent. 2012; 2012:475439. 4. Ahlfors E, Larsson A, Sjörgen S. The Odontogenic Keratocyst: A Benign Cystic Tumor? J Oral Maxillofac Surg 1984, 42:10-19. 5. Ali M, Baughman RA. Maxillary odontogenic keratocyst A common and serious clinical misdiagnosis. J Am Dent Assoc. 2003 Jul;134(7):877-83. 6. Altini M, Cohen M. The follicular primordial cyst – odontogenic keratocyst. Int J Oral Surg 1982: 11: 175-182. 7. Amaral FR, Mateus GCP, Bonisson LA, Andrade BAB, Mesquita RA, Horta MCR et al. Cell Proliferation and Apoptosis in Ameloblastomas and Keratocystic Odontogenic Tumors. Braz Dent J (2012) 23(2): 91-96. 8. Anniko M, Anneroth G, Bergstedt H, Ramström G. Jaw Cyst with Special Regard to Keratocyst Recurrrence A Long-term Follow-up. Arch Otorhinolaryngol (1981) 233: 261-269. 9. Bai XF, Wushou A, Zheng J, Li G. An alternative approach for mandible reconstruction. J Craniofac Surg. 2013 Mar; 24(2):e195-8. 10. Barnes L, Eveson JW, Reichart P, Sidransky D (Eds.). World Health Organisation, Classification of Tumors, Pathology and Genetics of Head and Neck Tumors. IARC Press Lyon, 2005, p.306-307. 11. Becker J, Pawelzik J. Anamnese, Befunderhebung, Dokumentation. In: Reichart PA, Hausamen J-E, Becker J, Neukam W, Schliephake H, Schmelzeisen R, 98 Literaturverzeichnis editors. Zahn-, Mund- und Gesichtschirurgie, Curriculum-Chirurgie Band II. Quintessenz Verlags-GmbH, Berlin, 2002, p.25-33. 12. Becker J, Schawacht M. Bildgebende Untersuchungsverfahren in der Zahn-, Mund- und Kieferheilkunde. In: Reichart PA, Hausamen J-E, Becker J, Neukam W, Schliephake H, Schmelzeisen R, editors. Zahn-, Mund- und Kieferkrankheiten, Curriculum-Chirurgie Band II, Quintessenz Verlags-GmbH, Berlin, 2002, p.37-53. 13. Becker J. Epitheliale Zysten. In: Reichart PA,. Hausamen J-E, Becker J, Neukam W, Schliephake H, Schmelzeisen R, editors. Zahn-, Mund- und Kieferkrankheiten, Curriculum-Chirurgie Band II, Quintessenz Verlags-GmbH, Berlin, 2002, p.115131. 14. Berman DM, Sunil S, Karhadkar SS, Hallahan AR, Pritchard JI, Eberhart CG, Watkins DN. Medulloblastoma Growth Inhibition by Hedgehog Pathway Blockade. Science (2002); 297, 1559. 15. Blanas N, Freund B, Schwartz M, Furst IM. Systematic review of the treatment and prognosis of the odontogenic keratocyst. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90: 553-8. 16. Böcker W, Kleihues P, Höfler KP, Lax S, Poremba C, Moll R. Allgemeine Tumorpathologie. In: Böcker W, Denk H, Heitz PhU,editors. Pathologie, 3. Auflage, München-Jena, Urban & Fischer Verlag, 2004, p.169-217. 17. Boffano P, Ruga E, Gllesio C. Keratocystic Odontogenic Tumor (Odontogenic Keratocyst): Preliminary Retrospective Review of Epidemiologic , Clinical, and Radiologic Features of 261 Lesions From University of Turin. American Association of Oral and Maxillofacial Surgeons, J Oral Maxillo fac Surg 2010 Dec; 68 (12):2994-9. 18. Bornstein MM, Filippi A, Altermatt HJ, Lambrecht JT, Buser D. Die odontogene Keratozyste – odontogene Zyste oder benigner Tumor? Schweiz Monatsschr Zahnmed, 2005, Vol 115 :2. 19. Bramley PA. Odontogenic Cysts Treatments of cysts in the jaw: Proc R Soc Med 64(5):547-550. 20. Brannon RB. The odontogenic keratocyst. A clinicopathologic study of 312 cases. Part I. Histologic features Oral Surg Oral Med Oral Pathol. July 1976; 42(1). 21. Brannon RB. The odontogenic keratocyst. A clinicopathologic study of 312 cases. Part II. Histologic features. Oral Surg Oral Med Oral Pathol, 1977 Feb; 43(2):23355. 99 Literaturverzeichnis 22. Brøndum N, Jensen VJ. Recurrence of keratocyts and decompression treatment. Oral Surg Oral Med Oral Pathol 1991; 72: 265-9. 23. Browne RM. The odontogenic keratocyst. Histological features and their correlation with clinical behaviour. Br Dent J. 1971 Sep 21; 131 (6):249-59. 24. Browne RM. Per [cyst]ent growth: the odontogenic keratocyst 40 years on. Ann R Coll Surg Engl 1994; 76: 426-433. 25. Bundesärztekammer. Available from: URL: http://www.bundesaerztekammer.de/page.asp?his=2.49.1758&all=true 26. Chirapathomsakul D, Sastravaha P, Jansisyanont P. A review of odontogenic keratocysts and the behavior of recurrences. Oral Surg Oral Med Oral Pathl Pral Radio Endod 2006; 101:5-9. 27. Cieslik– Bielecka A, Tomasz Bielecki T, Gazdzik TS, Cieslik T, Szczepanski T. Improved treatment of mandibular odontogenic cysts with platelet-rich gel. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105:423-9. 28. Cristerna BIC, Flores DSH, Guillen ASA. Healing of external root resorption associated with odontogenic keratocyst: case report. RSBO Revista Sul-Brasileira de Odontologia, 2009, vol. 6, núm. 1, pp. 100-103. 29. Dammer R, Niederdellmann H, Dammer P, Nuebler-Moritz M. Conservative treatment of keratocysts: a retrospective review. British Journal of Oral and Maxillofacial Surgery (1997) 35, 46-48. 30. Dauter K. Der keratozystisch odontogene Tumor (Keratozyste)- klinische, therapeutische und immunhistochemische Parameter, (Dissertation) Klinik für Mund-, Kiefer- und Gesichtschirurgie Klinische Navigation und Robotik der Medizinischen Fakultät Charité- Universitätsmedizin Berlin, 2008. 31. DeGould MD, Goldberg JS. Recurrence of an odontogenic keratocyst in a bone graft. Report of a case. Int J Oral Maxillofac Surg 1991; 20: 9-11. 32. Dereci Ö; Öztürk A; Günhan Ö. The Efficacy of Fine Needle Aspiration Cytology in the Preoperative Evaluation of Parakeratotic Odontognic Keratocysts. Acta Cytologica 2011; 55:131-134. 33. Deutsches Institut für Medizinische Dokumentation und Information; Kapitel XI, Avalable from: URL: http://www.dimdi.de/static/de/klassi/icd-10- who/kodesuche/onlinefassungen/htmlamtl2013/block-k00-k14.htm. 100 Literaturverzeichnis 34. Deutsches Institut für Zell- und Gewebeersatz (DIZG) Available from: UR: http://www.dizg.de/de/gewebetransplantate/sicherheit-und-qualitaet.html 35. Draenert FG, Hützen D. Knochenaugmentation komplexer Defekte Eine aktualisierende und ergänzende Übersicht. Oralchirurgie Journal 2/2013. Available from: URL: http://www.zwp- online.info/archiv/pub/sim/oj/2013/oj0213/oj0213_06_18_draenert.pdf 36. Ebhardt H, Reichart P. Zysten im Kiefer- und Gesichtsbereich. In: Ebhardt H, Reichart P, editors. Spezielle Pathologie für Zahnmediziner,1.Auflage, Berlin, Quintessenz Verlags-GmbH, Berlin 2009. p.103-118. 37. Eckhardt A, Fokas K. Microsurgical reconstruction in the head and neck region: an 8-year experience with 500 consecutive cases. Journal of Cranio- Maxillofacial Surgery (2003) 31, 197-201. 38. EI-Hajj G, Anneroth G. Odontogenic keratocysts-a retrospective clinical and histologic study. Int J Oral Maxillofac Surg 1996; 25: 124-129. 39. Eyre J, Zakrzewska JM. The conservative management of large odontogenic keratocysts. Br J Oral Maxillofac Surg. 1985 Jun; 23(3):195-203. 40. Finkelstein MW, Hellstein JW, Lake KS, Vincent SD. Keratocystic odontogenic tumor: A retrospective analysis of genetic, immunohistochemical and therapeutic features. Proposal of a multicenter clinical survey tool. Oral Surg Oral Med Oral Pathol Oral Radiol 2013;-:1-9. 41. Forssell K, Forssel H, Kahnberg K-E. Recurrence of keratocysts- A long-term follow- up study. Int J Oral Maxillofac Surg. 1988; 17: 25- 28. 42. Frerich B, Corneius C-P, Wiethölter H. Critical Time of Exposure of the Rabbit Inferior Alveolar Nerve to Carnoy’s Solution. J Oral Maxillofac Surg. 1994. 52:599606. 43. Frerich B, Driemel O, Feyer P, et al. Keratozystischer odontogenerTumor (KZOT). Deutsche Krebsgesellschaft Avalable from: URL: http://www.krebsgesellschaft.de/download/ll_b_05.pdf 44. Garlock JA, Pringle GA, Hicks ML. The odontogenic keratocyst: A potential endodontic misdiagnosis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998; 85:452-6. 101 Literaturverzeichnis 45. Gellrich NC, Schramm A, Hammer B, Rojas S, Cufi D, Lagrèze W, Schmelzeisen R. Computer-assisted secondary reconstruction of unilateral posttraumatic orbital deformity. Plast Reconstr Surg. 2002 Nov; 110(6):1417-29. 46. Geng N, Lv D, Chen Q-m, Zhu Z-Y, Wu R-Q, He Z-X, Chen Y. Solid variant of keratocystic odontogenic tumor with ameloblastomatous transformation: a case report and review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; 114:223-229. 47. Gerlach U, Schramm A, Gutwald R. Zysten, Pseudozysten und Keratozystisch odontogener Tumor. In: Gutwald R, Gellrich N-C, Schmelzeisen R. editors. Einführung in die zahnärztliche Chirurgie und Implantologie. 2.Auflage, Köln, Deutscher Zahnärzte Verlag, 2010. p. 303-322. 48. Ghanaati S, Barbeck M, Lorenz J, Stuebinger S, Seitz O, Landes C, Kovács AF, Kirkpatrick CJ. Synthetic bone substitute material comparable with xenogeneic material for bone tissue regeneration in oral cancer patients: First and preliminary histological, histomorphometrical and clinical results. Ann Maxillofac Surg 2013 JulDec; 3(2): 126–138. 49. Godhi SS, Kukreja P. Keratozystic odontogenic tumor: a review. J Maxillofac Oral Surg 8(2):127-131. 50. Goldberg LH, Landau JM, BS, Moody, Kazakevich N, Holzer AM, Myers A. Resolution of Odontogenic Keratocysts of the Jaw in Basal Cell Nevus Syndrome With GDC-0449. Arch Dermatol. March 21, 2011. 51. Gomes CC, Giniz MG, Gomez RS. Review of the molecular pathogenesis of the odontogenic keratocyst. Oral Oncology 45 (2009) 1011-1014. 52. Gosau M, Draenert FG, Müller S, Frerich B, Brügers R, Reichert TE, Driemel O. Two modifications in the treatment of keratocystic odontogenic tumors (KCOT) and the use of Carnoy’s Solution (CS) - a retrospective study lasting between 2 and 10 years. Clin Oral Invest (2010) 14:27-34. 53. Grasmuck EA, Nelson BL. Keratocystic Odontogenic Tumor. Head and Neck Pathol (2010) 4:94–96. 54. Güler N, Çomunğlu, Cabbar F. Ki-67 and MCM-2 in Dental Follicle and Odontogenic Cysts: The Effects of Inflammation on Proliferative Markers. Scientific World Journal. 2012; 2012: 946060. Published online 2012 June 18 55. Gundlach KKH, Kiehn M. Multiple Basal Cell Carcinomas and Keratocysts- the Gorlin and Goltz Syndrome. J max-fac Surg 7 (1979) 299-307. 102 Literaturverzeichnis 56. Habibi A, Saghravanian N, Habibi M, Mellati E, Habibi M. Keratocystic odontogenic tumor: a 10-year retrospective study of 83 cases in an Iranian population. J Oral Sci. 2007 Sep; 49(3):229-35. 57. Horch HH. Zysten der Kiefer und der umgebenden Weichteile, In: Horch HH, editor. Zahnärztliche Chirurgie. 4. Auflage. München-Jena: Elsevier Urban & Fischer 2003. p.294-340. 58. Jeyaraj P, Naresh N, Srinivas V. Case report on multiple keratocystic odontogenic tumors of jaws: Comparison of a non-syndromic case versus a case of Gorlin Goltz Syndrome. Journal of Oral and Maxillofacial Surgery, Medicine and Pathology 2013. 59. Junior R, Borba AM, Alves CAF, de Gouveia MM, Coracin FL, Guimara˜es Junior J. Keratocystic odontogenic tumors and Carnoy’s solution: results and complications assessment. Oral Diseases (2012) 18, 548–557. 60. Kadlub N, Coudert A, Gatibelza M-E, Houmami NE, Soufir N, Ruhin-Poncet B, L'Hermine AC, Berdal A, Vazquez M-P, Descroix V, Picard A. PTCH1 mutation and local aggressiveness of odontogenic keratocystic tumors in children: is there a relationship? Human Pathology (2013) 44, 1071–1078. 61. Kaplan I, Hirshberg A. The correlation between epithelial cell proliferation and inflammation in odontogenic keratocyst. Oral Oncology (2004) 40, 985–991. 62. Kinard BE, Chuang S-K, August M, Dodson T. How Well Do We Manage the Odontogenic Keratocyst? American Association of Oral and Maxillofacial Surgeons 2013, 71:1353-1358. 63. Kiran NK, Tilak Raj TN, Mukunda KS, Rajashekar Reddy V. Nevoid basal cell carcinoma syndrome (Gorlin- Goltz syndrome). Contemp Clin Dent. 2012 Oct-Dec; 3(4): 514–518. 64. Kolokythas A, Karas M, Sarna T, Flick W, Miloro M. Does Cytokine Profiling of Aspirate From Jaw Cysts and Tumors Have a Role in Diagnosis? American Association of Oral and Maxillofacial Surgeons Oral Maxillofac Surg. 2012. 70:1070-1080. 65. Kolokythas A, Fernandes RP, Pazoki A, Robert A. Odontogenic Keratocyst: To Decompression or Not to Decompress? A Comparative Study of Decompression and Enucleation Versus Resection/Peripheral Osteotomy. J Oral Maxillofac Surg 2007. 65:640-644. 103 Literaturverzeichnis 66. Kramer IRH, Pindborg J, Shear M. Histological typing of Odontogenic Tumour. 2nd Edition. WHO. Berlin Heidelberg Springer-Verlag 1992. 67. Lehmann KL, Hellwig E. Aufbau der Zähne und der Zahnreihen. In: Lehmann KL, Hellwig E. editors. Zahnärztliche Propädeutik. 10.Auflage. München, Elsevier Urban & Fischer, 2005. p.43-44. 68. Lehner B, Neukam FW. Chirurgie großer Zysten- Weichteilzysten. In: Hausamen JE, Becker J, Neukam W, Reichart PA, Schliephake H, Schmelzeisen R: Zahn-, Mund- und Gesichtschirurgie, Curriculum- Chirurgie Band III, Quintessenz VerlagsGmbH, Berlin, 2003, p. 117-145. 69. Lethaus B, Kessler P, Boeckman R, Poort LJ, Tolba R. Reconstruction of a maxillary defect with a fibula graft and titanium mesh using CAD/CAM techniques. Head Face Med. 2010 Jul 19; 6:16. 70. Levanat S, Gorlin R, Fallet S, Johnson DR, Fanastia JE, Bale AE. A two-hit model for developmental defects in Gorlin syndrome. Nature Publishing Group. 1996. 71. Li TJ. The odontogenic keratocyst A Cyst or a Cystic Neoplasm? J Dent Res. 2011 Feb; 90(2):133-42. 72. Li TJ, Browne RM, Matthews JB. Expression of epidermal growth factor receptors by odontogenic jaw cysts. Virchows Arch A Pathol Anat Histopathol. 1993; 423(2):137-44. 73. Li TJ, Browne RM, Matthews JB. Epithelial cell proliferation in odontogenic keratocysts: a comparative immunocytochemical study of Ki67 in simple, recurrent and basal cell naevus syndrome (BCNS)-associated lesions. J Oral Pathol Med 1995. 24 (5): 221-6. 74. Li TJ, Kitano M, Chen XM, Itoh T, Kawashima K, Sugihara K, Nozoe E, Mimura T. Orthokeratinized odontogenic cyst: a clinicopathological and immunocytochemical study of 15 cases. Histopathology. 1998 Mar; 32(3):242-51. 75. Lizio G, Sterrantino AF, Ragazzini S, Marchetti C. Volume reduction of cystic lesions after surgical decompression: a computerized three-dimensional computed tomographic evaluation. Clin Oral Invest. Springer-Verlag Berlin Heidelberg 2012. 76. Lund V. Odontogenic Keratocyst Of The Maxilla: A Case Report. British Journal of Oral and Maxillofacial Surgery (1985) 23, 21@215. 77. MacDonald-Jankowski DS. Orthokeratinized odontogenic cyst: a systematic review. Dentmaxillofacial Radiology (2010) 39 455-467. 104 Literaturverzeichnis 78. Madras J, Lapointe H. Keratocystic Odontogenic Tumour: Reclassification of the Odontogenic Keratocyst from Cyst to Tumour. JCDA March 2008, Vol. 74, No. 2. 79. Marker P, Brøndum N, Clausen PP, Lehmann Bastian H. Treatment of large odontogenic keratocysts by decompression and later cystektomy. Oral Surg Oral Med Oral Pathol Oral Ednod 1996; 82; 22-31. 80. Maurette PE, Jorge J, de Moraes M. Conservative treatment Protocol of Odontogenic Keratocyst: A Preliminary Study. 2006 J Oral Maxillofac Surg 64:379383. 81. McIvor J. The Radiological Features of Odontogenic Keratocysts. Br J Oral Surg. 1972 Nov;10(2):116-25. 82. Mendes RA, Carvalho JFC, Waal Ivd. Characterization and management of the KOT in relation to its histopathologial and biological features. Elsevier: Oral Oncology 46 (2010) 219-225. 83. Mendes RA, Carvalho JFC, Waal Ivd. Biological pathways involved in the aggressive behavior of the keratocystic odontogenic tumor and possible implications for molecular oriented treatment - An overview. Oral Oncology Elsevier 46 (2010) 19-24. 84. Mojsa I, Kaczmarzyk T. Keratocystic odontogenic tumor versus odontogenic keratocyst- the issue of adequate nomenclature. Department of Oral Surgery Jagionian University Med College Krakow, Poland; 2010. 85. Moll KJ, Moll M. Kopf In: Moll KJ, Moll M, editors. Kurzlehrbuch Anatomie, 16.Auflage. München –Jena, Urban & Fischer; 2000. p. 301-304 86. Morgan TA, Burton CC, Qian F. A Retrospective Review of Treatment of the Odontogenic Keratocyst. J Oral Maxillofac Surg. 2005 May; 63 (5):635-9. 87. Nakamura N, Mitsuyasu T, Mitsuyasu Y, Taketomi T, Higuchi Y, Ohishi M. Marsupialization for odontogenic keratocysts: Long-term follow-up analysis of the effects and changes in growth characteristics. Oral Surg Oral Med Oral Pathol Oral Ednod 2002; 94:543-53. 88. Neukamm FW, Becker T. Zysten des Kiefers und der Weichteile. In: Schwenzer N, Ehrenfeld M, editors. Zahnärztliche Chirurgie; Band 3, 3. Auflage Thieme Verlag. 2000. p.89-103. 89. Nohl et al. Odontogenic keratocyst as periradicular radiolucency in the anterior mandible. Med oral Pathol Radiolndod 1996; 81:103-9. 105 Literaturverzeichnis 90. Partridge M, Towers JF. The primordial cyst (odontogenic Keratocyst): Its tumorlike- characteristics and behavior. British Journal of Oral and Maxillofacial Surgery (1987) 271-279. 91. Pazdera J, Kolar Z, Zboril V, Tvrdy P., Pink R. Odontogenic keratocysts/keratocystic odontogenic tumours: biological characteristics, clinical manifestation and treatment. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2012; 156: XX. 92. Persson G. Remarkabe recurrence of a keratocyst in a bone-graft. Int J Oral Surg.1973:2:69-76. 93. Persson G, Astrand P, Lundgren A, Stenström S. Mandibular reconstruction with bone crafts. Int J Oral Surg 1978: 7: 512-522. 94. Philipsen HP. On keratocyst in the jaws. Tandlaegebladet 1956; 60:963-80. 95. Philipsen HP, Reichart PA. Revision of the 1992-edition of the WHO histological typing of odontogenic tumours. A suggestion. J Oral Pathol Med 2002: 31: 253–8. 96. Pindborg JJ, Hansen J. Studies in odontogenic cyst epithelium. 2. Clinical and roentgenological aspects of odontogenic keratocysts. Acta Pathol Mircobiol Scand 1963; 58:283-94. 97. Pitak- Arnnop P. Enucleation of keratocystic odontogenic tumours: study interpretation, technical refinement and future research. Clin Oral Invest (2010) 14:719–721. 98. Pogrel MA. The Keratocystic Odontogenic Tumor. Oral Maxillofacial Surg Clin N Am 25 (2013) 21–304. 99. Reichart PA. Odontogene Tumoren und andere Kieferläsionen. In: Reichart PA, Hausamen J-E, Becker J, Neukam W, Schliephake H, Schmelzeisen R, editors. Zahn-, Mund- und Kieferkrankheiten, Curriculum-Chirurgie Band II, Quintessenz Verlags-GmbH, Berlin, 2002, p.379-409. 100. Roche Lexikon Medizin, 5. Auflage. München-Jena. Urban & Fischer 2003. Neoplasma, p.1302. 101. Rueger M. Bone substitutes. State of art and: what lies ahead? Unfallchirurg. 1996 Mar; 99(3):228-36. 102. Rueger M. Bone substitution materials: Current status and prospects; Orthopade. 1998 Feb; 27(2):72-9. 106 Literaturverzeichnis 103. Rupprecht S, Neukam FW. Bildgebende Verfahren. In: Hausamen J-E, Becker J, Neukam W, Reichart PA, Schliephake H, Schmelzeisen R, editors. Zahn-, Mundund Gesichtschirurgie, Curriculum-Chirurgie Band III, Quintessenz Verlags-GmbH, Berlin, 2003, p.23-54. 104. Sammarco VJ, Chang L. Modern issues in bone graft substitutes and advances in bone tissue technology. Foot Ankle Clin. 2002 Mar; 7(1):19-41. 105. Sansare K, Raghav M, Mupparapu M. Keratocystic odontogenic tumor: systematic review with analysis of 72 additional cases from Mumbai India (2013). Oral Surg Oral Med Oral Patho Oral Radiol 2012; 115:128-139. 106. Saulacic N, Stajcic Z, Stajcic S Lj, Piattelli A, Iizuka T, Lombardi T. Effects of Carnoy’s solution on blood vessels of the axillary fossa of rats. Int. J. Oral Maxillofac. Surg. 2009; 38: 876–879. 107. Scharffetter K, Balz-Herrmann C, Lagrange W, Koberg W, Mittermayer C. Proliferation Kinetics- Study of the Growth of Keratocysts Morpho-functional Explanation for Recurrences. J Cranio Maxillo Fac Surg 1989 Jul; 17(5):226-33. 108. Schiebler TH. Kopf und Hals. In: Schiebler TH. editor, Anatomie, 9.Auflage, BerlinHeidelberg-New York. Springer Verlag 2005, p. 397-403. 109. Schierle HP. Zystenoperationen. In: Reichart PA, Hausamen J-E, Becker J, Neukam W, Schliephake H, Schmelzeisen R, editors. Zahnärztliche Chirurgie. Curriculum-Chirurgie Band I. Quintessenz Verlags-GmbH, Berlin, 2002. p.341- 367. 110. Schultz CB, Pajarola GF, Grätz KW. Therapie und Verlauf der rezidivierenden odontogenen Keratozyste. Schweiz Monatsschr Zahnmed, 2005. Vol 11 5:6. 111. Schumacher G-H. Repetitorium Anatomie für Zahnmediziner. München; Wien; Baltimore: Urban & Schwerzenberg 1996. 112. Sharif FNJ, Oliver R, Sweet C, Sharif MO. Interventions for the treatment of keratocystic odontogenic tumours (KCOT, odontogenic keratocysts (OKC)) (Review). Cochrane Database Syst Rev. 2010 Sep 8 ;( 9):CD008464. 113. Shear M. Developmental odontogenic cysts. An update. J Oral Pathol Med 1994 23:1-1. 114. Simiyu BN, Butt F, Dimba E, Wagaiyu EG, Awange DO, Guthua SW, Slootweg PJ. Keratocystic odontogenic tumors of the jaws and associated pathologies: A 10 year clinicopathologic audit in a referral teaching hospital in Kenya. Journal of CranioMaxillo- Facial Surgery xxx Elsevier (2012) 1-5. 107 Literaturverzeichnis 115. Slootweg PJ. p53 protein and Ki-67 reactivity in epithelial odontogenic lesions. An immunohistochemical study. J Oral Pathol Med 1995; 24: 393-7. 116. Stajci Z, Paljm. Keratinization of radicular cyst epithelial lining or occurrence of odontogenic keratocyst in the periapical region? Int J Oral Maxillofac Surg. 1987: 16:593-595. 117. Stoelinga PJW. Long-term follow-up on keratocysts treated according to a defined protocol. Int J Oral Maxillofac Surg. 2001; 30: 14–25. 118. Stoelinga PJ, Bronkhorst FB. The incidence, multiple presentation and recurrence of aggressive cysts of the jaws. J Craniomaxillofac Surg. 1988 May; 16 (4):184-95. 119. Stoetzer M, Nickel F, Rana M, Lemound J, Wenzel D, von See C, Gellrich N-C. Advances in assessing the volume of odontogenic cysts and tumors in the mandible: a retrospective clinical trial. Head & Face Medicine 2013, 9:14. 120. Stoetzer M, Rana M, von See C, Eckardt AM, Gellrich N-C. Reconstruction of defects of maxillary sinus wall after removal of a huge odontogenic lesion using prebended 3D titanium-mesh and CAD/CAM technique. Head Face Med. 2011 Nov 9; 7:21. 121. Sun L-S, Li X-F, Li T-J. PTCH1 and SMO Gene Alterations in Keratocyst Odontogenic Tumors. J Dent Res 2008. 87(6):575-579. 122. Suzuki M. A Study of Biological Chemistry on the Nature of Jaw Cysts. J max-fac Surg. 3(1975) 106-118. 123. Titinchi F, Nortje CJ. Keratocystic odontogenic tumor: a recurrence analysis of clinical and radiographic parameters. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; 114:136-142. 124. Toller PA. Newer concepts of odontogenic cysts. Int J oral Surg 1972: I: 3-16. 125. Toller PA. Origin and growth of cysts of the jaws. Ann R Coll Surg Engl. 1967 May;40(5):306-36. 126. Tolstunov L, Treasure T. Surgical Treatment Algorithm for Odontogenic Keratocyst: Combined Treatment of Odontogenic Keratocyst and Mandibular Defect With Marsupialization, Enuceation, Iliac Creast Bone Graft, and Dental Implants. J Oral Maxillofac Surg 2008. 66:1025-10361. 127. Tonietto L, Borges HO, Martins CA, Silva DN, Sant'Ana Filho M. Enucleation and liquid nitrogen cryotherapy in the treatment of keratocystic odontogenic tumors: a case series. J Oral Maxillofac Surg. 2011 Jun; 69(6):e112-7. 108 Literaturverzeichnis 128. van Gemert JT, van Es RJ, Rosenberg AJ, van der Bilt A, Koole R, Van Cann EM. Free vascularized flaps for reconstruction of the mandible: complications, success, and dental rehabilitation. J Oral Maxillofac Surg. 2012 Jul; 70(7):1692-8. 129. Vered M, Peleg O, Taicher S, Buchner A. The immunoprofile of odontogenic keratocyst (keratocystic odontogenic tumor) that includes expression of PTCH, SMO, GLI-1 and bcl-2 is similar to ameloblastoma but different from odontogenic cysts. J Oral Pathol Med (2009) 38: 597–604. 130. Voorsmit RA, Stoelinga PJ, van Haelst UJ. The management of keratocysts: J Maxillofac Surg. 1981 Nov; 9 (4):228-36. 131. Wagner Y, Filippi A, Kirschner H, Dreyer T. Zytokeratin- und p53- Expression odontogener Zysten. Mund Kiefer Gesichts Chir (1999) 3:263-296. 132. Wang X, Lu Y, Shen G, Chen W. One germline mutation of PTCH gene in a Chinese family with non- syndromic keratocystic odontogenic tumors. Int J Oral Maxillofac Surg. 2011; 40: 829- 833. 133. Williams J A , Guicherit OM, Zaharian B-I, Xu Y, Chai L, Wichterle H, Gatchalian C, Porter JA, Rubin LL, Wang FY. Identification of a small molecule inhibitor of the hedgehog signaling pathway: Effects on basal cell carcinoma-like lesions. 4616– 4621 PNAS April 15, 2003 vol. 100 no. 8. 134. Wiltfang J. Maligne Tumore der Mundhöhle. In: In: Reichart PA, Hausamen J-E, Becker J, Neukam W, Schliephake H, Schmelzeisen R, editors. Zahn-, Mund- und Kieferkrankheiten, Curriculum-Chirurgie Band II, Quintessenz Verlags-GmbH, Berlin, 2002, p.411-419. 135. Wiltfang J, Gellrich NC. Plastische und Wiederherstellungschirurgie. In: Hausamen J-E, Becker J, Neukam W, Reichart PA, Schliephake H, Schmelzeisen R, editors. Zahn-, Mund- und Gesichtschirurgie, Curriculum-Chirurgie Band III, Quintessenz Verlags-GmbH, Berlin, 2003, p.481-514. 136. Wright BA, Wysocki GP, Larder TC. Odontogenic keratocysts presenting as periapical diseas.; Oral Surg., October,1983 Vol.56, No.4. 137. Wright JM. The odontogenic keratocyst: Orthokeratinized variant. Oral Surg Oral Med Oral Pathol. 1981 Jun; 51 (6):609-18. 138. Zhang L, Sun Z-J, Zhao Y-F, Bia Z. Fan MW, Chen Z. Inhibition of SHH signaling pathway: Molecular treatment strategy of odontogenic keratocyst. Medical Hypothesis (2006) 7, 1242-1244. 109 Literaturverzeichnis 139. Zhao Y, Liu B, Han Q-H, Wang S-P, and Y-N. Changes in Bone Density and Cyst Volume After Marsupialization of Mandibular Odontogenic Tumors. J Oral Maxillofac Surg 2011.69:1361-1366. 110 Tabellenverzeichnis 7. Tabellenverzeichnis Tabelle 1: Übersicht einzelner Studienergebnisse im Bezug auf die Rezidive, der Kontrollzeit und untersuchter Fallzahl ..............................................................22 Tabelle 2: Häufigkeit der angewandten Operationsmethoden (n=111) .................................38 Tabelle 3: Häufigkeitsverteilung der unterschiedlichen Operations- und Augmentationsverfahren. In Klammern wird die Häufigkeit in Kombination mit einer stabilisierenden Osteosynthese (n=7) nach jeweiliger OP/ Augmentationsmethode angegeben. ...............................................................40 Tabelle 4: Häufigkeiten der Rezidive (n=111) .......................................................................42 Tabelle 5: Zusammenfassung der Rezidivhäufigkeiten in Abhängigkeit von Alter und Geschlecht; nach T-Test; Kreuztabelle + Chi-Quadrat nach Pearson mit Zeilenprozenten (n=111); (statistisch bei p=0,05 als signifikant und p=0,01 als sehr signifikant angenommen) .......................................................46 Tabelle 6: Vergleiche der Altersverteilung von Frauen/ Männern bei Erstmanifestation des KZOT mit/ ohne Erhalt eines Rezidivs (n=111) .........................................48 Tabelle 7: Häufigkeiten der angewandten Operationsmethoden mit prozentualer Angabe der Rezidivhäufigkeit (innerhalb der Gesamtzahl/ innerhalb der Operationsmethoden/ innerhalb der Rezidive) .................................................50 Tabelle 8: Vergleich der ZE / ZE+CS mit Häufigkeits- und Prozentangaben der Rezidive (p=0,027 mit ᵡ²=6,031 (df=1) (Kreuztabelle zum Chi-Quadrattest) .....51 Tabelle 9: Häufigkeit des Auftretens eines Rezidivs innerhalb der n=71 Patienten ...............55 Tabelle 10: Zusammenfassung der Ergebnisse des Chi-Quadrat und des T-Test für unabhängige Variablen; Gruppenvergleich [Alter/ Geschlecht] (n=71) .............55 Tabelle 11: Häufigkeitsverteilung der Rezidive nach angewandter Operationsmethoden und prozentuale Angaben der Rezidivhäufigkeit (innerhalb der Gesamtzahl/ innerhalb der Operationsmethoden/ innerhalb der Rezidive) (n=71)..............................................................................................................58 Tabelle 12: Häufigkeit des Auftretens eines Rezidivs innerhalb der n= 45 Patienten ............60 Tabelle 13: Häufigkeitsverteilung der Rezidive nach angewandter Operationsmethoden und prozentuale Angaben der Rezidivhäufigkeit innerhalb unterschiedlicher Gruppen (n=45) ...................................................................62 Tabelle 14: Erfassungsbogen .............................................................................................117 111 Abbildungsverzeichnis 8. Abbildungsverzeichnis Abbildung 1: Schematische Darstellung der Entstehung einer odontogenen Zyste: Ruhende Epithelkeime der Zahnleiste/ Proliferierende Epithelzellnester durch einen Reiz ausgelöst/ Epithelzellnester umfassen einen Hohlraum/ Größenzunahme der odontogenen Zyste (Skizze eigenständig angefertigt) ....................................................................................................... 6 Abbildung 2: Schematische Darstellung des Zystenwachstums; Das Zystenepithel fungiert als eine semipermeable Membran, Flüssigkeit strömt in das Lumen (Pfeile), es erfolgt eine Volumenzunahme und eine dadurch bedingte Osteolyse des Knochens (Skizze eigenständig angefertigt) ............... 7 Abbildung 3:Schematische Darstellung eines KZOT mit anterior-posteriorer Ausbreitung im Unterkiefer, beginnender Wurzelresorption und Bildung von Satellitenzysten (Skizze eigenständig angefertigt) ....................................10 Abbildung 4: Das Epithel eines KZOT zeigt die typische prominente Basalzellschicht, etwa 5-6 Zellschichten, eine Parakeratose; Reteleisten sind nur angedeutet zu erkennen (x400). ......................................................................14 Abbildung 5: Schematische Darstellung einer Zystostomie: Apikale Zyste um Zahnwurzel mit paramarginaler Schnittführung; Anlegen des Zystenfenster und Wurzelspitzenresektion + Einschlagen des Mukoperiostlappens ins Lumen/ Einbringen der Obturatorprothese zur Offenhaltung des Lumens (Skizze eigenständig angefertigt) ...........................16 Abbildung 6: Schematische Darstellung einer Zystektomie: zystischer Prozess apikal eines Zahnes/ Entfernung der Zyste und des Zystenbalges mit anschließender WSR/ Speicheldichter Wundverschluss (Skizze eigenständig angefertigt) .................................................................................17 Abbildung 7: Veranschaulichung der Auswahl der Patienten ................................................26 Abbildung 8: Geschlechterverteilung n=111 in Prozentangaben [%].....................................33 Abbildung 9: Altersverteilung bei Erstdiagnose, x-Achse gibt die Altersintervalle bei Erstdiagnose wieder; y-Achse die Häufigkeitsdichte (n=111)...........................33 Abbildung 10: Die Skizze zeigt die Häufigkeitsverteilung (in %) der insgesamt aufgetretenden KZOT (n=113) im Bezug auf die Lokalisation im Unterkiefer und Oberkiefer (Kieferseiten sind willkürlich gewählt) (Skizze eigenständig angefertigt) .................................................................................35 112 Abbildungsverzeichnis Abbildung 11: Zystenlokalisation (x-Achse; Aufgeteilt nach den Quadranten) in Bezug auf die Gesamtzahl der Patienten (n=111; y-Achse) Häufigkeiten der Zysten in Prozent [%] ......................................................................................35 Abbildung 12: Prozentualer Anteil der keratozystisch odontogenen Tumore mit und ohne enger Zahnbeziehung (n=111)................................................................37 Abbildung 13: Prozentuale Häufigkeitsangaben (y-Achse) der unterschiedlichen Augmentationsmethoden bezogen auf das gesamte Kollektiv (n=111) (xAchse) .............................................................................................................41 Abbildung 14: Darstellung des postoperativen Kontrollzeitraumes in Monaten (x-Achse) des Patientenkollektivs (n=111) mit prozentualen Häufigkeitsangaben (yAchse) .............................................................................................................42 Abbildung 15: Häufigkeit des Auftretens der 41 Rezidive in Prozent (y-Achse) nach Monaten (x-Achse) ..........................................................................................43 Abbildung 16: Häufigkeitsverteilung der Rezidive (n=41) in Prozent (y-Achse) innerhalb der Altersgruppen (x-Achse) ............................................................................44 Abbildung 17: Kaplan-Meier-Analyse für die kumulierte Wahrscheinlichkeit der Rezidivfreiheit innerhalb der unterschiedlichen Altersgruppen (n=111, pWert = 0,674) ..................................................................................................45 Abbildung 18: Gegenüberstellung der Anzahl von Frauen/ Männern mit und ohne Rezidiv (n=111) ...............................................................................................47 Abbildung 19: Kaplan-Meier-Analyse für die kumulierte Wahrscheinlichkeit der Rezidivfreiheit innerhalb der Geschlechter (n=111, p-Wert = 0,126) ................47 Abbildung 20: Rezidivauftreten nach den jeweiligen Operationsmethoden (bei n=106, ZO wurde nicht mit einbezogen), Chi-Quadrat-Test (p= 0,025)........................51 Abbildung 21: Rezidivauftreten nach der Zystektomie und nach der Zstektomie mit Carnoyscher Lösung, ......................................................................................52 Abbildung 22: Graphische Darstellung der kumulativen Wahrscheinlichkeit der Rezidivfreiheit nach den unterschiedlichen Operationsmethoden (n=106, p-Wert = 0,088) ...............................................................................................53 Abbildung 23: Häufigkeitsverteilung (y-Achse) der postoperativen Nachkontrollen in Monaten (x-Achse) (n=71) ...............................................................................54 Abbildung 24: Kumulierte Wahrscheinlichkeit der Rezidivfreiheit innerhalb der Geschlechter (n=71, p-Wert=0.036) ................................................................56 Abbildung 25: Häufigkeitsverteilung der wahrgenommenen, postoperativen Nachkontrollen (y-Achse) in Monaten (x-Achse) ab einem Beobachtungszeitraum von 36 Monaten (n=45) ..............................................59 Abbildung 26: Häufigkeitsverteilung (y-Achse) des postoperativen Rezidivauftretens in Monaten (x-Achse) (n=45) ...............................................................................60 113 Abbildungsverzeichnis Abbildung 27: Altersvergleich zwischen GGS/ non-syndromalen Patienten ..........................63 Abbildung 28: Exemplarische histopathologische Bilder des KZOT zu dem Patientenbeispiel (#III) R.F., 27.11.28*;(A) Originalvergrößerung x100, (B) Vergrößerung x400..........................................................................................64 Abbildung 29: Präoperativer Zustand mit Raumforderung Regio 37/38 (Pfeile) (28.08.2009) ....................................................................................................66 Abbildung 30: Postoperativer Zustand mit beginnender Knochenkonsolidierung (Pfeile) (08.09.2009) ....................................................................................................66 Abbildung 31: Postoperativer Zustand mit guter Knochenkonsolidierung (Pfeile) (29.03.2010) ....................................................................................................67 Abbildung 32: Postoperativer Zustand ohne Anzeichen auf ein Rezidiv (Pfeile) (18.10.2010) ....................................................................................................67 Abbildung 33: Exemplarische histopathologische Bilder des KZOT zu dem Patientenbeispiel (#I) B.O., 10.01.55*, (C) Vergrößerung x100, (D) Vergrößerung x400, (E) Vergrößerung x100....................................................69 Abbildung 34: Präoperativer Zustand mit multiplen Zysten (Pfeile) im Ober- und Unterkiefer (19.11.2004) ..................................................................................71 Abbildung 35: Postoperativer Zustand mit guter Knochenkonsolidierung (Pfeile) (31.03.2005) ....................................................................................................72 Abbildung 36: Kein Anhalt auf Rezidive (Pfeile) (02.10.2007) ...............................................72 Abbildung 37: Weiterhin keine Anzeichen für neue Rezidive (Pfeile) (07.04.2010) ...............73 Abbildung 38: Präoperatives 3D-Bild (CT) mit Darstellung der Weichgewebe, des Knochens sowie Hervorhebung des KZOT Regio 33 bis 46 (blau) ..................74 Abbildung 39: Präoperatives Schnittbild des Unterkiefers aus der axialen Ebene mit Markierung des KZOT (blau) Regio 33 bis 46 und Abmessung seiner maximalen Ausdehnung in dieser Ebene (mesio-distal=51.1mm; vestibulo-lingual=14.9mm) ...............................................................................75 Abbildung 40: Präoperatives Schnittbild des Unterkiefers aus der coronalen Ebene mit Markierung (blau) des KZOT Regio 33 bis 46 und Abmessung seiner maximalen Ausdehnung in dieser Ebene (mesio-distal=38.5mm; kraniokaudal=16.9mm)..............................................................................................76 Abbildung 41: Präoperatives Schnittbild des Unterkiefers aus der sagittalen Ebene mit Markierung (blau) des KZOT und Abmessung seiner maximalen Ausdehnung in dieser Ebene (vestibulo-lingual=19.5mm; kraniokaudal=21.4mm)..............................................................................................77 Abbildung 42: Postoperatives 3D-Bild (CT) nach Teilresektion und Rekonstruktion; Darstellung der Weichgewebe, des Knochens sowie der alloplastischen Rekonstruktion durch ein Patienten-spezifisches individualisiertes CAD114 Abbildungsverzeichnis CAM Implantat; der KZOT wurde im Bezug auf die Resektionsgrenzen schematisch eingefügt (blau) ...........................................................................78 Abbildung 43: 3D Volumenberechnung (CT) des KZOT aus der axialen Ebene, Volumen: 12.599cm³, Bone HU=898 ...............................................................79 Abbildung 44: Präoperativer Zustand mit einer Raumforderung von 33 bis 46 (Pfeile) und intraluminalen Knochensepten (13.02.2013).............................................80 Abbildung 45: Postoperativer Zustand nach Unterkieferteilresektion mit alloplastischer Rekonstruktion (Pfeile) durch ein Patienten-spezifisches individualisiertes CAD-CAM Implantat (18.02.2013) ...................................................................80 Abbildung 46: Zustand nach Entfernung des Zahnes 34 (Pfeil) (09.04.2013) .......................81 Abbildung 47: Postoperativer Zustand vom 30.07.2013........................................................81 Abbildung 48: Postoperativer Zustand nach Rekonstruktion durch einen mikrovaskuläranastomosiertes Fibulatransplantat (Pfeile) (06.08.2013) ................................82 115 Anhang 9. Anhang 9.1. Beispieltabelle der Datenerhebung Erläuterung Patientennummer Geburtstag Geschlecht Alter Anzahl der Zysten Lokalisation der Zyste 1.- 4. Quadrant Zahnbeziehung Verbindung zum Nervus alveolaris inferior Gekammerte Zyste Entzündete Zyste Sekret in Lumen Zystostomie (Partsch I) Zystektomie mit Carnoyscher Lösung Zystektomie (Partsch II) Zystektomie mit dem Ausfräsen des Lumens Unterkieferteilresektion Einlage von Kollagenvlies Einbringung von Knochenmaterial, welches mittels „Bone - Scraper“ aus der nahen Umgebung (Kieferbereich) gewonnen wurde 116 Ja Nein Anhang Knochenaugmentation mit autogener Spongiosa (mittels Stanze aus der Crista iliaca gewonnen) Augmentation von autogenem Knochen und Einlage von Kollagenvlies Einbringung von mono- bikortikalen, oder avaskulären Knochenstücken, welche aus dem Becken entnommen wurden Schwellungen Mundöffnungsbeschwerden Radiologische Größe (zweidimensional in mm) Beobachtungszeitraum [Monate/ Jahre] Rezidiv Postoperatives Auftreten des ersten Rezidivs [Jahre/ Monate] Tabelle 14: Erfassungsbogen 117 Danksagung Danksagung Ich bedanke mich bei Herrn Univ.-Prof. Dr. Dr. N.-C. Gellrich, Direktor der Abteilung für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover, für die hervorragenden Voraussetzungen, die diese Studie erst ermöglicht haben. Ich bedanke mich bei meinem Doktorvater, Herrn Prof. Dr. Dr. H. Kokemüller, Leitender Oberarzt der Abteilung für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover, für die umfassenden wissenschaftlichen Anregungen und Diskussionen, die sehr zum Gelingen dieser Arbeit beigetragen haben. Mein Dank gilt auch Herrn PD Dr. Hussein, Institut für Pathologie der Medizinischen Hochschule Hannover, für die Bereitstellung der histopathologischen Daten. Auch gilt mein Dank Herrn Dipl.-Math. B. Vaske, Institut für Biometrie, für seine fachkundige Unterstützung bei der Datenverarbeitung und der statistischen Auswertung der erhobenen Daten. Herrn Dr. Dr. Rana, Abteilung für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover, danke ich für seine Unterstützung beim Zusammentragen des radiologischen Bildmaterials. Ihm und seiner Frau, Dr. M. Rana, gilt mein besonderer Dank für ihre großzügige Bereitschaft und Hilfe bei grundlegenden auswertungstechnischen und wissenschaftlichen Fragestellungen. Von Herzen möchte ich Denny danken, der mich mit viel Geduld beim Fortschreiten dieser Arbeit begleitet und unterstützt hat. Auch danke ich meiner Familie und meinen Freunden für ihre stete Unterstützung. 118 Erklärung nach §2 Abs. 2 Nrn. 6 und 7 der Promotionsordnung Erklärung nach §2 Abs. 2 Nrn. 6 und 7 der Promotionsordnung Ich erkläre, dass ich die der Medizinischen Hochschule Hannover zur Promotion eingereichte Dissertation mit dem Titel „Der keratozystisch odontogene Tumor (KZOT) - Eine retrospektive Auswertung des Hannoveraner Patientenguts von 1991 bis 2010“ in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Medizinischen Hochschule Hannover unter der Betreuung von Herrn Prof. Dr. Dr. H. Kokemüller mit der Unterstützung durch Herrn Univ.Prof. Dr. Dr. N.-C. Gellrich ohne sonstige Hilfe durchgeführt und bei der Abfassung der Dissertation keine anderen als die dort aufgeführten Hilfsmittel benutzt habe. Die Gelegenheit zum vorliegenden Promotionsverfahren ist mir nicht kommerziell vermittelt worden. Insbesondere habe ich keine Organisation eingeschaltet, die gegen Entgelt Betreuerinnen und Betreuer für die Anfertigung von Dissertationen sucht oder die mir obliegenden Pflichten hinsichtlich der Prüfungsleistungen für mich ganz oder teilweise erledigt. Ich habe diese Dissertation bisher an keiner in- oder ausländischen Hochschule zur Promotion eingereicht. Weiterhin versichere ich, dass ich den beantragten Titel bisher noch nicht erworben habe. Hannover, den Marcia K. Kirn 120