23.4 Signalverarbeitung in der Netzhaut
Werbung

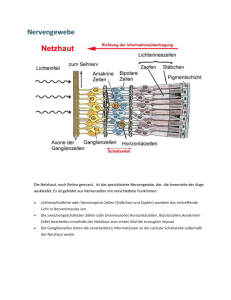
23.4 Signalverarbeitung in der Netzhaut die Erregung aus dem Zapfensystem erhalten und bei Tagessehen die Stäbchenamakrinen (Abb. 23.8) hemmen und damit die Fortleitung der Stäbchenantwort unterbrechen. Eine weitere neuronale Komponente der Dunkeladaptation ist die Zunahme der erregenden Konvergenz im rezeptiven Feld (s. u.). Stäbchenmonochromat 2 Kohlrausch-Knick 3 5 23.4 Nachtblindheit 4 normale Dunkeladaptation 6 0 5 10 15 20 25 30 Adaptationszeit (min) 35 40 Abb. 23.10 Dunkeladaptation. Normale Dunkeladaptationskurve (schwarz), Verlauf bei Nachtblindheit (rote unterbrochene Linie) und beim Stäbchenmonochromaten (blaue gepunktete Linie). In Abwesenheit der Zapfen verläuft die Dunkeladaptation schneller, der Beginn der Messungen liegt in diesem Fall bei t = 6 min. des nicht lichtempfindlichen All-trans-Retinals (Helladaptation), während längerer Aufenthalt im Dunkeln zu einem Überwiegen der 11-cis-Form und damit zu einer hohen Photosensibilität der Stäbchen führt (Dunkeladaptation). hell Signalverarbeitung in der Netzhaut Die Hyperpolarisation des Photorezeptors nach Belichtung wird im retinalen Netzwerk durch synaptische Übertragung an Folgeneuronen entweder als Hyperpolarisation weitergeleitet oder in eine Depolarisation umgekehrt. Unter den Bipolar- und Ganglienzellen entstehen dadurch lichterregte und lichtgehemmte Neurone (on- bzw. off-Neurone). Sie können als Hellund Dunkelsystem betrachtet werden. Laterale Hemmungsmechanismen beeinflussen benachbarte Netzhautzellen. Dadurch entstehen die rezeptiven Felder der Ganglienzellen bzw. der Fasern des N. opticus mit erregenden Zentren und hemmenden Umfeldern. Der Mechanismus führt zu einer Kontrastverschärfung in der Netzhaut. Je eine Klasse großer und kleiner Ganglienzellen sind Ausgangspunkte eines magnozellulären und eines parvozellulären Systems für eine im Gehirn zunehmend spezialisierte Weiterverarbeitung von Bewegungs- und Tiefenwahrnehmung (magnozellulär) und Farb- und Formwahrnehmung (parvozellulär). 11-cis-Retinal Ð All-trans-Retinal dunkel Nach einer kurzen, sehr hellen Beleuchtung der Netzhaut dauert der Resyntheseprozess (photochemischer Anteil der Dunkeladaptation) über 1 Stunde. Bei der Dunkeladaptation (Abb. 23.10) nimmt die Empfindlichkeit des Auges in 30 – 50 min um 6 – 7 Zehnerpotenzen zu. Das photopische Sehen (Tagessehen) der Zapfen geht am Ende der Zapfenadaptation nach etwa 8 – 10 min am Kohlrausch-Knick in das skotopische Sehen (Dämmerungs- und Nachtsehen) der Stäbchen über. Die Stäbchenadaptation trägt dann den Hauptanteil zur Empfindlichkeitszunahme bei. Da 11-cis-Retinal ein Aldehyd des Vitamin A1 ist, lässt sich die durch Vitamin-A-Mangel bedingte Nachtblindheit erklären. Durch die unterschiedlichen Absorptionsmaxima der Zapfenpigmente (555 nm) und des Stäbchenpigments (500 nm) ergibt sich bei der Dunkeladaptation eine Empfindlichkeitsverschiebung zum kurzwelligeren Lichtbereich hin (Purkinje-Verschiebung). Neben der photochemischen Adaptation und der oben beschriebenen Helladaptation der enzymatischen Produktion von cGMP tragen auch neuronale Komponenten zur Adaptation bei. Die bereits beschriebene Pupillenreaktion wirkt als schnellerer Schutz gegen Blendung bei Helladaptation. Die Umschaltung vom Zapfen- auf das Stäbchensehen ist ein weiterer neuronaler Mechanismus. Beim photopischen Sehen wird das Stäbchensystem durch das Zapfensystem unterdrückt. Dies geschieht durch einen Typ dopaminerger, amakriner Zellen, Heller- und Dunklersehen wird durch verschiedene Ganglienzellen vermittelt Die Signalverarbeitung in Rezeptoren und Bipolarzellen (auch in Horizontalzellen und in amakrinen Zellen) erfolgt über fein abgestufte Änderungen des Membranpotenzials, synaptische Übertragung und postsynaptische Potenziale. An den Ganglienzellen treten innerhalb der Retina erstmalig Aktionspotenziale auf. Durch die Verschaltung der retinalen Zellen entstehen rezeptive Felder (Abb. 23.11). Als rezeptives Feld eines Neurons, z. B. einer Faser des N. opticus, wird derjenige Bereich der Netzhaut bzw. des Gesichtsfeldes bezeichnet, von dem aus seine Aktivität beeinflusst werden kann. Auf der Netzhaut entspricht das der Photorezeptorenfläche, die mit der Zelle verbunden ist. Entsprechend dieser Definition gibt es rezeptive Felder bei Bipolarzellen ebenso wie bei Ganglienzellen. Die rezeptiven Felder der Ganglienzellen bestehen aus einem Zentrum und einem Umfeld. On-Zentrum- und Off-Zentrum-Zellen bilden zwei getrennte Systeme für die Hell- und Dunkelwahrnehmung bei gegebener Adaptation. Abb. 23.11 A zeigt, wie auf dem Weg zwischen Zapfen und Ganglienzellen (Abb. 23.8) die On- und Off-Zentrum-Eigenschaften entstehen. Der durch den Dunkelstrom ausgelöste, kontinuierliche Transmitterfluss des Glutamats vom Photorezeptor zur Bipolarzelle wird durch Lichtreize moduliert. Erregende Synapsen geben die Signale zu den Off-Bipolaren gleichsinnig weiter, die invaginierenden, hemmenden Synapsen kehren die Signale an den On-Bipolaren um. Während die Depolarisation an den Off-Bipolaren durch das Glutamat über ligandengesteuerte Kationenka- Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! R. Klinke, H-C. Pape, St. Silbernagl: Physiologie (ISBN 3-13-796005-3) © Georg Thieme Verlag Stuttgart 2005 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. log relative Sensitivität 0 1 695 23 Sehsystem rezeptives Feld Licht Zentrum Licht Umfeld Rezeptor Depolarisation Hyperpolarisation Hyperpolarisation mGLUR iGLUR iGLUR Horizontalzelle A Beleuchtung im Zentrum Abb. 23.11 On- und Off-Zentrum-Antworten im retinalen Netzwerk und Verschaltung des antagonistischen Umfeldes. A Oben ist das rezeptive Feld mit Zentrum und Umfeld auf der Netzhaut dargestellt. Der Photorezeptor hyperpolarisiert bei Licht im Zentrum. Die invaginierte, hemmende Synapse zur On-Bipolarzelle invertiert das Signal. näle und einen Na+-Einwärtsstrom vermittelt wird, erfolgt die Hyperpolarisation durch Glutamat an den OnBipolaren über einen metabotropen Glutamatrezeptor und eine intrazelluläre Signalkaskade ähnlich wie im Photorezeptor: Ein Na+-Kanal wird geschlossen, der in Abwesenheit von Glutamat geöffnet ist. Glutamat löst über ein G-Protein das Schließen dieser Kanäle aus und führt damit zur Hyperpolarisation der Bipolarzelle. Ein Lichtreiz hyperpolarisiert den Photorezeptor, vermindert die Glutamatausschüttung und bedingt so eine Depolarisation der On-Bipolaren und eine Hyperpolarisation der Off-Bipolaren, die diese Signale dann über erregende Synapsen gleichsinnig an die On-Zentrum- und Off-Zentrum-Ganglienzellen weitergeben. Die Hyperpolarisation der Rezeptoren wird für das On-System bereits im Auge in eine Depolarisation von Bipolar- und Ganglienzellen umgesetzt. Diese Darstellung gilt so für die Zapfen und das photopische Sehen. Die Stäbchenantwort beim skotopischen Sehen verwendet dagegen einen Umweg zu den On- und Off-Zapfenbipolarzellen (Abb. 23.8): Spezielle Stäbchenbipolarzellen werden zunächst durch Lichtreize depolarisiert. Sie erregen Stäbchenamakrine, die dann On-Bipolare über eine elektrische Synapse erregen OFF-Zellen Axone im N. opticus ON-Zellen OFF-Zellen Ganglienzellen B Beleuchtung im Umfeld B Licht im Umfeld wirkt auf den Photorezeptor im Zentrum über die laterale Horizontalzellverschaltung hemmend (negative Rückkoppelung auf den Photorezeptor, Transmitter unbekannt); das Signal wird invertiert und führt zu einer Depolarisation am Photorezeptor, die im On-Kanal hemmend, im Off-Kanal erregend wirkt (nach 16). und Off-Bipolare über eine chemische Synapse hemmen. Damit lösen sie an den Ganglienzellen dieselben Lichtantworten aus wie das Zapfensystem. Hemmende Umfelder verstärken den visuellen Kontrast Die Horizontalzellen spielen eine wichtige Rolle bei der Signalverarbeitung in der Netzhaut. Sie sind an der Entstehung des retinalen Zentrum-Umfeld Antagonismus beteiligt, der auf einer lateralen Hemmung zwischen Umfeld und Zentrum beruht (Abb. 23.11 B). Seitlich gelegene Photorezeptoren übertragen ihre Signale gleichsinnig über erregende Synapsen auf die Horizontalzellen. Diese hemmen über invertierende Synapsen benachbarte Photorezeptoren. Somit löst ein Lichtreiz in der Peripherie am Photorezeptor im Zentrum umgekehrte Effekte aus als ein Licht im Zentrum. Durch die lateralen Hemmungsmechanismen entstehen in der Netzhaut konzentrische, antagonistische rezeptive Felder, die kontrastverstärkend wirken. Man findet sie bereits bei den Bipolarzellen, besonders ausgeprägt aber bei den On- und Off-Zentrum-Feldern der Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! R. Klinke, H-C. Pape, St. Silbernagl: Physiologie (ISBN 3-13-796005-3) © Georg Thieme Verlag Stuttgart 2005 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Bipolarzellen ON-Zellen 696 23.4 Signalverarbeitung in der Netzhaut 697 Elektrische Signale ermöglichen objektive Bestimmungen der Netzhautfunktion + + B Hermann-Gitter + + C Erregungsmuster im rezeptiven Feld Abb. 23.12 Psychophysische Beispiele lateraler Hemmung: Simultankontrast und Hermann-Gitter. A Beide Kreisflächen haben die gleiche Graustufe, dennoch erscheint das Grau im hellen Umfeld dunkler und im dunklen heller. B Die Kreuzungsstellen im Gitter erscheinen dunkler als die Streifen. Das gilt bei zentraler Fixation nicht für die Kreuzung in der Mitte (wegen der zentral kleineren rezeptiven Felder). C Erklärung der Täuschungen durch Hemmung aus der RF-Peripherie von On-Zentrum-Neuronen. In beiden Fällen führt die stärkere Reizung der hemmenden Peripherie (am Rand des hellen Umfeldes in A und an den Kreuzungsstellen in B) zu einer geringeren Helligkeitswahrnehmung. retinalen Ganglienzellen. Bei einer On-Zentrum-Zelle führt „Licht an“ im Zentrum zu einer erhöhten Impulsrate (On-Erregung), „Licht aus“ im Zentrum führt zu einer verminderten Impulsrate (Off-Hemmung). Entgegengesetzt wirkt sich die Reizung des Umfeldes derselben OnZentrum-Zelle aus. „Licht an“ im Umfeld führt zu einer verringerten Impulsrate (On-Hemmung), während „Licht aus“ zu einer erhöhten Impulsrate führt (Off-Erregung). Genau spiegelbildlich verhalten sich die Off-ZentrumZellen. Eng verbunden mit den funktionellen Eigenschaften der Netzhaut sind einige bekannte psychophysische Beobachtungen. Nach längerer Fixation eines visuellen Musters entstehen Nachbilder (Sukzessivkontrast). Sie beruhen auf lokaler, photochemischer und neuronaler Adaptation. Demgegenüber sind sofort sichtbare Phänomene wie der visuelle Simultankontrast, bei dem die Wahrnehmung einer Fläche durch die Umgebung beeinflusst wird (Abb. 23.12 A, B), eine Folge lateraler Hemmung. Durch die Wirkung der hemmenden Umfelder rezeptiver Felder werden hier Kontraste überhöht und Helligkeitswahrnehmungen verändert. Solche psychophysischen Beobachtungen sind auch Beispiele dafür, dass die dem Sehen zugrunde liegenden photochemischen und neurophysiologischen Mechanismen unter speziellen Bedingungen zu Täuschungen führen können. Die klassischen Untersuchungen des Sehsystems beruhen auf subjektiven Aussagen des Patienten. Durch klinischneurophysiologische Messungen können jedoch auch einige objektive Aussagen gemacht werden. Zwischen dem Pigmentepithel und den Rezeptoraußengliedern besteht eine Potenzialdifferenz, das korneoretinale Bestandspotenzial, das zu einer relativen Positivität des vorderen Augenabschnitts gegenüber dem hinteren führt. Das Elektrookulogramm (EOG) (Kap. 22 und 26) entsteht als Folge dieses elektrischen Dipols und kann mit Elektroden beiderseits an den Schläfen zur Darstellung von Augenbewegungen genutzt werden. Das Bestandspotenzial ist belichtungsabhängig. Bei Dunkeladaptation fällt es ab, bei Helladaptation steigt es auf den doppelten Wert. Dieses Phänomen wird diagnostisch genutzt. Bei Störungen des Stoffwechsels zwischen Pigment- und Sinnesepithel, wie z. B. fortgeschrittener diabetischer Retinopathie, ausgedehnter Netzhautablösung oder Medikamentenvergiftungen (z. B. durch Chloroquin) ist der Anstieg des Potenzials bereits vermindert, bevor irgendwelche subjektiven oder ophthalmoskopisch sichtbaren Veränderungen auftreten. Zur Ableitung von Signalen aus der Netzhaut liegt eine ringförmige, differente Elektrode in einer Kontaktlinse eingebettet auf der Kornea, die indifferente Elektrode an der Stirn. Das frühe Rezeptorpotenzial (early receptor potential – ERP) und das Elektroretinogramm (ERG) stehen im direkten Zusammenhang mit dem photorezeptorischen Prozess und der Signalverarbeitung im neuronalen Netzwerk der Retina (Abb. 23.13). Das ERP tritt nach einem kurzen Lichtblitz mit einer Latenz unter 1 ms und einer Dauer von 1,5 ms auf und stellt das bioelektrische Äquivalent der primären Rezeptorprozesse in den Photorezeptoren (lichtinduzierter Abbau der Sehfarbstoffe) dar. Trotz der geringeren Zapfenzahl in der Netzhaut beruht dieses Potenzial zu 70% auf der Zapfenantwort. Das Elektroretinogramm zeichnet sich durch verschiedene Komponenten aus, die der zeitlich aufeinander folgenden Aktivität von Netzhautstrukturen zugeordnet werden können. Die negative a-Welle entspricht der elektrischen Aktivierung der Photorezeptoren. Es wird auch als spätes Rezeptorpotenzial (late receptor potential – LRP) bezeichnet. Die Latenz dieser Welle beträgt zwischen 10 und 15 ms und liegt damit weit hinter dem ERP, das nach 2 ms abgeschlossen ist. Die aufwärts gerichtete positive b-Welle entspricht der Aktivität der Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! R. Klinke, H-C. Pape, St. Silbernagl: Physiologie (ISBN 3-13-796005-3) © Georg Thieme Verlag Stuttgart 2005 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. A Simultankontrast Bestimmte Funktionen der Netzhaut können mit klinisch-neurophysiologischen Methoden gemessen werden. So beruht das Elektrookulogramm auf einer Potenzialdifferenz zwischen Pigmentepithel und Rezeptoraußengliedern und spiegelt mögliche Funktionsstörungen in diesem Bereich wider. Das Elektroretinogramm kann der Funktion von Photorezeptoren und dem folgenden neuronalen Netzwerk zugeordnet und entsprechend interpretiert werden. 23 Sehsystem ERP (early receptor potential) a=1(1/60°) ERG (Elektroretinogramm) K d d c-Welle b-Welle A Visusbestimmung mit Landolt-Ring x a »10 d-Welle OFF-Effekt = LRP (late receptor potential) C foveales Zapfenmosaik Lichtreiz 1 2 3 4 Zeit (s) Abb. 23.13 Frühes Rezeptorpotenzial (ERP) und Helligkeitselektroretinogramm (ERG) in Beantwortung eines Ganzfeldlichtreizes von 1 s Dauer (gelber Balken, unten). ERP und die reizabhängigen Wellen (a – d) des ERG lassen sich bestimmten retinalen Funktionen zuordnen (s. Text). nachgeschalteten Netzhautzellen. Parallel zur b-Welle ändert sich auch das Membranpotenzial der Glia (MüllerZellen). Mit einer Verzögerung von etwas über 1 s beginnt die langsame c-Welle. Sie wird der Reaktion der Pigmentepithelzellen zugeordnet. Bei Licht-aus entsteht die dWelle (Off-Effekt), die durch das Ende der a-Welle mitbedingt wird. Nur a-, b- und d-Wellen sind Ausdruck intraretinaler Informationsverarbeitung. Bei akutem Zentralarterienverschluss fallen die inneren Netzhautschichten aus, während durch die getrennte Blutversorgung die Rezeptorschicht funktionell intakt bleibt. In diesem Fall zeigt das ERG nur noch die a-Welle. Demgegenüber fällt bei Netzhautablösung wegen der fehlenden Blutversorgung der Rezeptorschicht das gesamte ERG aus. Eine klinische Bedeutung des ERG liegt in der Beurteilung der Netzhautfunktion bei Trübungen der brechenden Medien zur Bestimmung der Operationsindikation (z. B. bei intraokular liegenden Metallfremdkörpern wie Eisen, Kupfer). Eine wichtige Rolle spielt das ERG bei erblichen degenerativen Netzhauterkrankungen (Retinitis pigmentosa S. 693). Hier kann bereits lange vor Auftreten klinischer Symptome eine Voraussage über die mögliche Manifestation oder das Ausbleiben dieser erblichen Krankheit gemacht werden. 23.5 x B Noniussehschärfe a-Welle 0 x » 2,4 2,6 mm Sehschärfe Die Sehschärfe (Visus) ist der Kehrwert des räumlichen Auflösungsvermögens des Auges in Winkelminuten. Die normale Sehschärfe (Visus = 1) liegt vor, wenn Einzelheiten eines Zeichens erkannt werden, die 1 Winkelminute Sehwinkel entsprechen. Die Noniussehschärfe, bei der ein Kontursprung erkannt wird, ist 5 – 10fach größer. Die Grundlage der Sehschärfe ist das Photorezeptormosaik der Netzhaut sowie die Größe und Funktion der weiterverarbeitenden rezeptiven Felder. d x x x » 2,5 mm D maximale Auflösung Abb. 23.14 Grundlagen der Sehschärfe. A Landolt-Ring mit Lücke d und Abbildung d' im Auge. B Kontursprung zur Prüfung der Noniussehschärfe. C Rezeptormosaik in der Primatenretina mit Zapfenreihenabstand x (schematisch nach 28). D Interpretation der maximalen räumlichen Auflösung in Bezug auf den mittleren Zapfenreihenabstand x in der Fovea (nach 25). Die Sehschärfe ist vom retinalen Ort und der Helligkeit abhängig, sie verringert sich mit Abstand von der Fovea und bei abnehmender Helligkeit. Das Mosaik der Photorezeptoren und die rezeptiven Felder bestimmen die Sehschärfe Die Bestimmung der Sehschärfe (Visus) ist eine der wichtigsten Kontrollen für die Funktion des Auges. Die Sehschärfe ist der Kehrwert des in Winkelminuten angegebenen räumlichen Auflösungsvermögens des Auges. Visus = 1/α (Winkelminuten–1) Wenn eine Lücke (d) im Landolt-Ring (Abb. 23.14 A) unter einem Sehwinkel von 1 Winkelminute von der Netzhaut aufgelöst wird, beträgt der Visus 1. Das ist (zufälligerweise) der Wert für die normale Sehschärfe unter derart standardisierten Testbedingungen. Der Visus kann besser als 1 sein, Jugendliche erreichen oft Werte von 1,2 – 1,6. 5 – 10fach größer als der normale Visus ist die Noniussehschärfe (5 – 10 Winkelsekunden Auflösung), bei der ein Sprung im Verlauf einer Kontur wahrgenommen wird (Abb. 23.14 B). Die Sehschärfe ist in der Fovea am größten und nimmt zur Peripherie der Netzhaut hin ab. Sie spiegelt die räumliche Verteilung der Netzhautzellen mit ihrer höchsten Dichte in der Fovea centralis wider. Das trianguläre foveale Zapfenmosaik (Abb. 23.14 C) hat einen minimalen Zapfenmittenabstand von 2,8 – 3,0 µm und einen Zapfen- Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! R. Klinke, H-C. Pape, St. Silbernagl: Physiologie (ISBN 3-13-796005-3) © Georg Thieme Verlag Stuttgart 2005 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 698