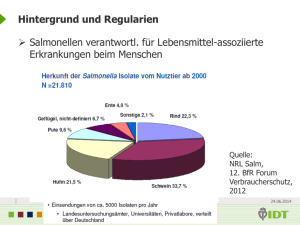
W ie bke O e llric h H annover 2 0 0 6 E xpe rim en te lle U n te rs
Werbung

Experimentelle Untersuchungen zum Verlauf von Infektionen mit Salmonella Enteritidis und Salmonella Typhimurium bei der kommerziell genutzten Pekingente (Anas platyrhynchos) Hannover 2006 Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH 35392 Gießen · Frankfurter Str. 89 · Tel. 0641 / 24466 · Fax: 0641 / 25375 e-mail: [email protected] · Homepage: http://www.dvg.net Wiebke Oellrich ISBN 3-938026-86-3 Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über http://dnb.ddb.de abrufbar. 1. Auflage 2006 © 2006 by Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH, Gießen Printed in Germany ISBN 3-938026-86-3 Verlag: DVG Service GmbH Frankfurter Straße 89 35392 Gießen 0641/24466 [email protected] www.dvg.net AUS DER KLINIK FÜR GEFLÜGEL DER TIERÄRZTLICHEN HOCHSCHULE HANNOVER Experimentelle Untersuchungen zum Verlauf von Infektionen mit Salmonella Enteritidis und Salmonella Typhimurium bei der kommerziell genutzten Pekingente (Anas platyrhynchos) INAUGURAL-DISSERTATION zur Erlangung des Grades einer DOKTORIN DER VETERINÄRMEDIZIN (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Wiebke Oellrich aus Stade Hannover 2006 Wissenschaftliche Betreuung: PD Dr. G. Glünder 1. Gutachter: PD Dr. G. Glünder 2. Gutachter: Prof. Dr. G. Klein Tag der mündlichen Prüfung: 31. Mai 2006 Meinen Eltern und Markus INHALTSVERZEICHNIS INHALTSVERZEICHNIS Abkürzungen 10 1 EINLEITUNG 13 2 LITERATUR 15 2.1 Enten als Wirtschaftsgeflügel 2.1.1 15 2.1.1.1 Pekingenten (Anas platyrhynchos) 16 2.1.1.2 Moschusenten (Cairina moschata) 18 2.1.1.3 Mulardenten 18 2.1.2 2.2 Abstammung und zoologische Systematik 15 Wirtschaftliche Bedeutung Salmonellen-Infektionen bei der Ente unter Berücksichtigung anderer Geflügelarten 2.2.1 Epidemiologie 19 21 21 2.2.1.1 Ente 27 2.2.1.2 Huhn 31 2.2.1.3 Pute 33 Pathogenese 34 2.2.2 2.2.2.1 Adhäsion 35 2.2.2.2 Invasion 36 2.2.2.3 Endotoxine 2.2.2 Klinik 38 39 2.2.2.1 Ente 41 2.2.2.2 Huhn 43 2.2.2.3 Pute 45 2.2.3 Bekämpfungsstrategien 46 2.2.3.1 Hygienemaßnahmen 47 2.2.3.2 Probiotika und Competitive exclusion (CE) 51 INHALTSVERZEICHNIS 2.2.3.3 Therapie 53 2.2.3.4 Immunisierung 55 3 MATERIAL UND METHODEN 62 3.1 Versuchstiere 62 3.1.1 Herkunft 62 3.1.2 Haltung 3.1.2.1 Räumlichkeiten 63 63 3.1.2.2 Futter und Wasser 64 3.1.2.3 Temperatur und Licht 65 3.1.2.4 Reinigung und Desinfektion 65 3.2 Bakterienstämme 66 3.2.1 Herkunft und Charakteristika 66 3.2.2 Nährmedien 68 3.2.3 Keimzahlbestimmung 69 3.2.4 Markierung der Teststämme 71 3.2.5 Überprüfung der Nalidixinsäure-Resistenz 73 3.3 Untersuchungen zum Verlauf einer Infektion mit Salmonellen bei Enten 3.3.1 Versuchsaufbau 3.3.1.1 Vorversuche: Auswahl geeigneter Stämme, Organe und der Infektionsdosis 3.3.1.2 Hauptversuche: Untersuchungen zum Infektionsverlauf 74 74 74 78 3.3.2 Herstellung und Verabreichung des Inokulums 81 3.3.3 Klinische und pathologisch-anatomische Untersuchungen 83 3.3.4 Isolierung der Teststämme 83 3.3.4.1 Quantitative Untersuchung 84 3.3.4.2 Qualitative Untersuchung 86 3.3.5 Kontrolltiere 86 3.3.6 Bestimmung der minimalen Infektionsdosis 87 INHALTSVERZEICHNIS 3.4 Statistische Auswertung 87 4 ERGEBNISSE 89 4.1 Markierung der Teststämme 89 4.1.1 Gewinnung Nalidixinsäure-resistenter Mutanten 89 4.1.2 Überprüfung der Nalidixinsäure-Resistenz 90 4.2 Vorversuche zur Auswahl geeigneter Stämme, Organe und der Infektionsdosis für die Versuche zum Infektionsverlauf 91 4.2.1 Auswahl geeigneter Stämme 93 4.2.1.1 Salmonella Enteritidis 93 4.2.1.2 Salmonella Typhimurium 96 4.2.2 Auswahl geeigneter Organe 100 4.2.3 Festlegung der Infektionsdosis 102 4.3 Zeitlicher Infektionsverlauf in Abhängigkeit vom Alter der Enten (Hauptversuch) 4.3.1 Isolierungsraten 108 109 4.3.1.1 Caecum 110 4.3.1.2 Leber 112 4.3.1.3 Milz 114 4.3.2 Keimzahlen 116 4.3.2.1 Caecum 116 4.3.2.2 Leber 118 4.3.3 Wechselbeziehung zwischen dem Salmonellennachweis in verschiedenen Organen und dem Alter der Enten zum Zeitpunkt der Infektion 120 4.4 Beeinflussung der Salmonellen-Isolierungsraten durch die Infektionsdosis 121 4.5 Salmonellen-Nachweisrate in Abhängigkeit vom Zeitpunkt nach der Infektion 123 4.5.1 Caecum 126 4.5.2 Leber und Milz 127 INHALTSVERZEICHNIS 4.6 Nachweishäufigkeit von Salmonellen in Caecum, Leber und Milz 127 4.7 Klinische Beobachtungen 128 4.8 Pathologisch-anatomische Beobachtungen 129 4.9 Minimale infektiöse Dosis 129 5 DISKUSSION 131 5.1 Teststämme 132 5.1.1 Auswahl der Teststämme 132 5.1.2 Markierung der Teststämme 133 5.1.3 Vergleich der Infektiosität von Salmonella Enteritidis mit Salmonella Typhimurium 134 5.2 Nachweis von Salmonellen in verschiedenen Organen 135 5.2.1 Methodische Verfahrensweise 135 5.2.2 Auswahl zu untersuchender Organe für das Infektionsmodell 136 5.3 Untersuchungen zur Infektionsdosis 139 5.3.1 Ermittlung der Infektionsdosis für die Studie zum Infektionsverlauf 139 5.3.2 Minimale Infektionsdosis 141 5.4 Infektionsmodell 142 5.4.1 Klinik 142 5.4.2 Pathologisch-anatomische Beobachtungen 143 5.4.3 Zeitlicher Verlauf von experimentellen Salmonellen-Infektionen bei Enten 143 5.4.4 Einfluss des Alters der Enten auf die Infektion 147 5.4.5 Reproduzierbarkeit 148 5.5 Schlussfolgerungen 149 6 ZUSAMMENFASSUNG 151 7 SUMMARY 154 INHALTSVERZEICHNIS 8 LITERATURVERZEICHNIS 157 9 ANHANG 188 9.1 Zusammensetzung und Herstellung der verwendeten Medien 188 9.2 Zusammensetzung des Futters 193 9.3 Auflistung der Werte 199 9.3.1 Vorversuche – erster Abschnitt 199 9.3.2 Vorversuche – zweiter Abschnitt 201 9.3.3 Hauptversuche 205 Danksagung 209 ABKÜRZUNGEN Abkürzungen Aqua bidest. Aqua bidestillata (zweifach destilliertes Wasser) Aqua dest. Aqua destillata (destilliertes Wasser) BfR Bundesinstitut für Risikobewertung BPLS Brilliantgrün-Phenolrot-Lactose-Saccharose c Konzentration °C Grad Celsius CE Competitive exclusion d Tag(e) d.p.i. Tag(e) post infectionem f.d. forma domestica g Gramm h Stunde(n) I.E. Internationale Einheit(en) KbE Kolonie bildende Einheiten l Liter L. Linné LMBG Lebensmittel- und Bedarfsgegenständegesetz log Logarithmus LPS Lipopolysaccharide LT Lebenstag mg Milligramm Mh harmonisches Mittel MHC major histocompatibility complex MHK Minimale Hemmstoff-Konzentration MJ Megajoule ml Milliliter mol Mol µg Mikrogramm ABKÜRZUNGEN µl Mikroliter µm Mikrometer n Stichprobenumfang Nal Nal r Nalidixinsäure Nalidixinsäure-resistent p.a. per annum PBS phosphate buffered saline (Phosphat-gepufferte Salzlösung) pH Potentia Hydrogenii p.i. post infectionem PT Phagentyp r Korrelationskoeffizient r resistent (bezüglich Nalidixinsäure) S. Salmonella SAS Statistical Analysis System SE Salmonella Enteritidis SEF Salmonella Enteritidis Fimbriae SPI Salmonella Pathogenicity Island spp. Spezies (Pl.) subsp. Subspezies ST Salmonella Typhimurium TBG Tetrathionat-Brilliantgrün-Galle VO Verordnung w/v Massenanteil (%) pro Volumen x Häufigkeit x̄ gew gewogener arithmetischer Mittelwert x̄ arithmetischer Mittelwert Die chemischen Elemente wurden gemäß dem internationalen Periodensystem abgekürzt. Abkürzungen des allgemeinen Sprachgebrauchs werden nicht aufgeführt. 1 EINLEITUNG 1 13 Einleitung In den letzten zwanzig Jahren ist ein rapider Anstieg in der Entenfleischproduktion zu verzeichnen (PINGEL 1998, 2004; YAN 2004). Dabei werden zwei unterschiedliche Entenarten in der landwirtschaftlichen Geflügelproduktion genutzt, nämlich die aus der Stockente hervorgegangene Pekingente und die Moschusente, sowie als Mularden bezeichnete Hybriden aus beiden Arten. Die größte wirtschaftliche Bedeutung kommt aber der Pekingente zu (STIMPSON 1998; RAETHEL 2003). Entenbestände gelten weltweit als salmonelleninfiziert (KÖHLER et al. 1996), wobei die Tiere in der Regel symptomlose Träger sind (HENRY 2000). Die vorherrschende Serovar bei der Ente ist Salmonella (S.) Typhimurium (SIMKO 1988; HENRY 2000; HARTUNG 2004), aber auch S. Enteritidis wird nachgewiesen (KÖHLER et al. 1996). Beide Salmonellen-Serovaren gelten als Zoonoseerreger, die durch kontaminierte Lebensmittel (BREDT 1996) übertragen werden und besonders häufig an der Salmonellose (ALPERS u. JANSEN 2004; HARTUNG 2004) des Menschen mit gelegentlicher Todesfolge beteiligt sind (FRIES 2005). Deshalb wird besonders diesen beiden Serovaren unter dem Aspekt des Verbraucherschutzes eine große Bedeutung bei Bekämpfungsmaßnahmen beigemessen (Richtlinie 2003/99/EG; Verordnung EG Nr. 2160/2003). Durch die Neufassung der Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember 2005 ist der Nachweis von Salmonella spp. bei Enten, Puten, Gänsen, Hühnern und Tauben zu melden. Da die erfolgreiche Bekämpfung der Salmonelleninfektionen nicht ausreichend über Hygienemaßnahmen gewährleistet werden kann, wurden für Elterntiere und Legehennen Impfungen gegen Salmonellen vorgeschrieben, um die Prävalenz in den Herden sowie die Keimzahl in infizierten Tieren und damit den Eintrag in die Umwelt zu reduzieren (Hühner-Salmonellen-VO). 14 1 EINLEITUNG Während die Anwendung und Wirkung von Salmonellen-Impfstoffen beim Huhn bereits ausgiebig wissenschaftlich untersucht wurde und eine Reihe von zugelassenen Salmonellenimpfstoffen für das Huhn existiert, beruht der Einsatz dieser Impfstoffe bei der Ente bisher nur auf empirisch erhobenen Daten. Damit stellt sich die Forderung, diesen auf eine wissenschaftliche Basis zu stellen. Ziel dieser Arbeit war es, den Verlauf einer experimentellen Infektion mit S. Enteritidis und S. Typhimurium bei der Pekingente zu untersuchen, um ein Modell für die Prüfung der Wirksamkeit von Salmonellen-Impfstoffen zur Verfügung stellen zu können. Dazu war es erforderlich, aus mehreren Salmonellen-Stämmen die am besten geeigneten auszuwählen, die für eine Infektion erforderliche Dosis zu finden und die Wechselbeziehung zwischen dem Alter der Enten und dem Infektionsverlauf zu klären. 2 LITERATUR 2 Literatur 2.1 Enten als Wirtschaftsgeflügel 2.1.1 Abstammung und zoologische Systematik 15 Enten zählen innerhalb des zoologischen Systems (Abb. 1) zur Ordnung der gänseartigen Vögel (Anseriformes). Sie leben an Gewässern und halten sich wenigstens zeitweise auch im Wasser auf. Bedeutung für die Haustierwerdung erlangte die Familie der Entenvögel (Anatidae) mit der Unterfamilie Entenverwandte (Anatinae). Innerhalb der Unterfamilie Entenverwandte sind die Stockente (Anas platyrhynchos) und die Moschusente (Cairina moschata) domestiziert worden (siehe Abb. 1). Beide Arten existieren weiterhin in der Wildbahn, die Stockente sogar in 7 Unterarten. Mit der Fleckschnabelente (Anas poecilorhyncha) kommt es in China zur Überlappung und häufig zur Kreuzung mit der Stockente, so dass auch diese Art an der Haustierwerdung in China beteiligt gewesen sein kann (PINGEL 2000). Die Stockente (Anas platyrhynchos L.) als Stammart der Pekingente sowie die Moschusente (Cairina moschata L.) als Stammart der domestizierten Moschusente sind nur sehr entfernt verwandt. Beide Arten besitzen zwar die gleiche Chromosomenanzahl (80), diese sind aber in Größe und Form nicht generell übereinstimmend, was bei den Hybriden Sterilität zur Folge hat (SCHMIDT 1996; PLATZBECKER 2000). 16 2 LITERATUR Klasse Aves (Vögel) Ordnung Anseriformes (Gänseartige Vögel) Unterordnung Anseres Familie Anatidae (Entenvögel) Unterfamilie Anatinae (Entenverwandte) Tribus Gattung Art Abb. 1: 2.1.1.1 Cairini Anatini (Glanzenten) (Gründelenten) Cairina Anas (aufbaumende Ente) (Schwimmente) Cairina moschata (L.) Anas platyrhynchos (L.) (Moschusente) (Stockente) Zoologische Systematik (SCHMIDT 1996; PINGEL 2000; PAYER 2001) Pekingenten (Anas platyrhynchos) Die Pekingente (Anas platyrhynchos forma domestica (f.d.)) gehört zu der Gattung der Schwimmenten (Anas) und ist eine domestizierte Form der Stockente. Sie stammt ursprünglich aus China, von wo aus sie über Amerika und England nach Deutschland gelangte (RAETHEL 2003). Ihre Brutdauer beträgt 28 Tage (ALTRICHTER u. BRAUNSBERGER 1997). Sie ist sehr witterungsunempfindlich, wird hauptsächlich zur Fleischproduktion gehalten und daneben auch als Federlieferant genutzt (RAETHEL 2003). Besonders auf dem asiatischen Markt ist die Pekingente die bevorzugte Rasse zur Fleischproduktion (STIMPSON 1998). Auch in Deutschland ist die Pekingente die am weitesten verbreitete Entenrasse (RAETHEL 2003). Weltweit wird die Entenpopulation auf etwa 1,5 Milliarden geschätzt. Hieran hat die Pekingente mit 1,2 Milliarden Tieren einen Anteil von 80 % (STIMPSON 1998). 2 LITERATUR 17 Pekingenten werden in zwei voneinander abweichenden Richtungen gezüchtet: Der deutschen und der amerikanischen Pekingente. Deutsche Pekingente Die deutsche Pekingente besitzt einen massigen, rechteckigen Körper, der in aufgerichteter Stellung getragen wird. Das Hinterteil steht senkrecht zur Körperachse. Das Gefieder ist weiß mit einem gelben Anflug und auf dem Halsrücken bilden v. a. bei älteren Erpeln die verlängerten Federn die so genannte Frisur. Der Kopf ist eher rund mit hoher, breiter Stirn und einem kurzen, breiten, geraden, orangeroten Schnabel. Das Gewicht beträgt ca. 3 kg bei der Ente und 3,5 kg beim Erpel (PLATZBECKER 2000; RAETHEL 2003). Amerikanische Pekingente Die amerikanische Pekingente ist durch Einkreuzung von Aylesbury- und Laufenten entstanden. Der Körper besteht aus einem lang gestreckten, vorn nur leicht angehobenen, gerundetem Rumpf mit rein weißem und straff anliegendem Gefieder. Der Kopf ist eher länglich mit einem breiten, langen, oft auch löffelförmigen Schnabel, der hellgelb bis orangefarbig ist. Das Gewicht beträgt wie bei der deutschen Pekingente bei weiblichen Tieren ca. 3 kg und 3,5 kg beim Erpel (PLATZBECKER 2000; RAETHEL 2003). Die amerikanische Pekingente wurde 1874 im amerikanischen Rassestandard anerkannt. Sie gelangte 1918 nach Deutschland (SCHMIDT 1996; PLATZBECKER 2000). In der ehemaligen Deutschen Demokratischen Republik (DDR) wurde die Amerikanische Pekingente in großen Mengen im Raum Potsdam erzeugt (SCHMIDT 1996). Sie ist die in Europa und in Nordamerika für die Fleischproduktion am weitesten verbreitete Mastrasse (BENECKE 1994). 18 2.1.1.2 2 LITERATUR Moschusenten (Cairina moschata) Die Moschusente wird auch Warzen-, Flug-, Barbarie-, Türken-, Stumm-, La-Plata-, Rothaut-, Gans- oder Bisamente genannt (BENECKE 1994; SCHMIDT 1996; RAETHEL 2003). Während der Begriff „Warzenente“ in der Rassegeflügelzucht und der Name „Flugente“ in Deutschland allgemein genutzt wird, findet die Bezeichnung „Barbarie-Ente“ in der aktuellen Vermarktungsnorm der EU ihre Anwendung (PINGEL 2000). Moschusenten sind Tropenvögel, die im Wald leben und auf Bäumen brüten. Die Wildform kommt in Mexiko, Mittel- und Südamerika bis Peru im Westen und Uruguay im Osten vor. Sie wurde von den Ureinwohnern domestiziert und gelangte im Jahr 1514 durch die Spanier nach Europa. Erpel der domestizierten Form sind etwa 5 kg, Enten 3 kg schwer. Das Fleisch der Moschusente ist dunkel gefärbt (RAETHEL 2003). Die Brutdauer beträgt 35 Tage (ALTRICHTER u. BRAUNSBERGER 1997). Auf dem asiatischen Markt ist die Moschusente aufgrund der schwierigen Zucht, den hohen Produktionskosten sowie dem deutlichen Unterschied der Schlachtkörper zwischen den Geschlechtern nicht erfolgreich (STIMPSON 1998). 2.1.1.3 Mulardenten Als Mulardenten oder Mularden wird eine Kreuzung aus Moschuserpel mit Pekingente bezeichnet (PINGEL 1998). Mularden sind unfruchtbar (PINGEL 2000; PLATZBECKER 2000). Taiwan und z. T. Malaysia haben einen bedeutsamen Markt für Mularden, der jedoch durch billigere und einfacher zu produzierende Pekingenten unter Druck gesetzt wird (STIMPSON 1998). In Frankreich ersetzen Mularden neben Moschusenten - immer mehr die Pekingente. Sie sollen sich besonders gut zur Fettleberherstellung eignen (BENECKE 1994; PINGEL 1998). 2 LITERATUR 2.1.2 19 Wirtschaftliche Bedeutung Im Vergleich zur Hühnerfleischproduktion spielen Enten und Gänse in den meisten Ländern eine untergeordnete Rolle (PINGEL 1998). Dennoch ist im Weltmaßstab in den letzten zwanzig Jahren ein rapider Anstieg in der Enten- und Gänsefleischproduktion zu verzeichnen (PINGEL 1998, 2004; YAN 2004). Hauptproduktionsort für Entenfleisch ist China (PINGEL 1998, 2004; STIMPSON 1998, FRENZ 2001; YAN 2004). Mehr als zwei Drittel der Enten werden hier produziert (PINGEL 2004; YAN 2004). Hierbei handelt es sich um etwa eine Milliarde Enten vom Fleischtyp pro Jahr, was einem Anstieg von 5000 % in den letzten zwanzig Jahren entspricht (STIMPSON 1998, YAN 2004). Es folgen mit deutlichem Abstand die Länder Frankreich, Thailand, Taiwan, die Ukraine und Vietnam (PINGEL 1998, 2004; YAN 2004). YAN (2004) berichtet, dass außerhalb Asiens, mit Ausnahme von Frankreich und Nordamerika, der Verzehr von Enten stark abhängig ist von dem Anteil an Chinesen in der Bevölkerung und infolgedessen von der Anzahl an chinesischen Restaurants in einem Land. Die Welterzeugung von Geflügelfleisch stieg in den 90er Jahren durchschnittlich mit rund 5 % p.a. an (FRENZ 2001). Dabei blieb der Anteil von Hühnerfleisch an der gesamten ausgewiesenen Geflügelfleischproduktion mit etwa 86 % nahezu konstant. Putenfleisch hat mit rund 4,8 Mio. t (1999) einen Anteil von etwa 7 %. Der weltweite Anteil von Entenfleisch zur globalen Geflügelfleisch-Erzeugung betrug 1999 ca. 2,7 Mio. t (4 %) und der von Gänsefleisch 1,9 Mio. t (3 %). China stellt mit rund 1,9 Mio. t fast 70 % der globalen Entenfleisch- und, mit rund 1,7 Mio. t, etwa 90 % der Gänsefleischerzeugung. 20 2 LITERATUR In Deutschland sind mehr als 70 % der Entenproduktion in Brandenburg und Niedersachsen konzentriert (KÖHLER et al. 1996). Der Selbstversorgungsgrad für Entenfleisch beträgt in Deutschland etwa 60 % (PINGEL 2004). Laut ZMP (Zentrale Markt- und Preisberichtstelle für Erzeugnisse der Land-, Forstund Ernährungswirtschaft GmbH, 2004) betrug 2003 der Anteil von Entenfleisch an der Geflügelfleischgesamtproduktion (927.840 t Schlachtgewicht) in Deutschland rund 4,6 % und lag damit an dritter Stelle hinter der Produktion von Hähnchenfleisch mit 53 % und der von Putenfleisch mit 38 %. Eine geringere Bedeutung kam mit rund 3,8 % bzw. 0,19 % nur noch den Schlachthennen bzw. den Gänsen zu (ZMP 2004). Während Gänse saisonal fast nur in den Wintermonaten geschlachtet werden, werden Enten in relativ gleich bleibender Menge mit durchschnittlich rund 3.500 t pro Monat über das ganze Jahr verteilt geschlachtet (PINGEL 2004; ZMP 2004). Der jährliche pro Kopf-Verbrauch an Enten beträgt in Deutschland 0,4 Stück, in China 1,0 Stück, in Hong Kong 2,5 Stück, weltweit ohne China 0,1 Stück und weltweit inklusive China 0,4 Stück (YAN 2004). In Deutschland entspricht das 0,9 kg pro Kopf und Jahr (GRAMZOW 2005). In Asien, v. a. Indonesien und China, gibt es zusätzlich einen nicht unbedeutenden Markt für Enteneier als Lebensmittel (STIMPSON 1998). Zudem kommt den als Nebenprodukt anfallenden Federn und Daunen mit über 50.000 t weltweit für die weitere Verarbeitung eine wirtschaftliche Bedeutung zu. Hieran hat Deutschland einen Anteil von rund 6 % (PINGEL 2000). 2 LITERATUR 2.2 21 Salmonellen-Infektionen bei der Ente unter Berücksichtigung anderer Geflügelarten 2.2.1 Epidemiologie Die Salmonellose ist eine Zoonose. Über 2500 Salmonellen-Serovaren sind bisher bekannt (MEYER 1999). Salmonellen sind als tier- und als humanpathogene Erreger weltweit von Bedeutung (SÜDBECK 2005). So war im Jahr 2003 die Salmonellose die am häufigsten an das Robert-Koch-Institut übermittelte Krankheit mit einer Inzidenz von 76,4 Erkrankungen pro 100.000 Einwohner (ALPERS u. JANSEN 2004). Salmonellosen des Menschen werden überwiegend durch tierische Nahrungsmittel einschließlich Geflügelfleisch und Eier verursacht (BREDT 1996; HARTUNG 2004; SÜDBECK 2005). Da die Serovaren in ihrer Bedeutung unterschiedlich zu beurteilen sind (BLAHA 1993), werden sie in drei verschiedene epidemiologische Gruppen unterteilt: epidemisch vorkommende, speziesadaptierte Serovaren (z. B. S. Choleraesuis beim Schwein und S. Dublin beim Rind); sporadisch vorkommende, nicht speziesadaptierte Serovaren (z. B. S. Agona und S. Infantis) und endemisch vorkommende, nicht speziesadaptierte Serovaren. Von besonderer zoonotischer Bedeutung sind in der Lebensmittelhygiene derzeit S. Enteritidis und S. Typhimurium, die beide der letztgenannten Gruppe zugeordnet werden (CLARKE u. GYLES 1993; SELBITZ 2000), gefolgt von den Serovaren S. Infantis, S. Virchow, S. Derby und S. Hadar (ALPERS u. JANSEN 2004; SÜDBECK 2005). Von 1985 bis 1992 stieg die Zahl der gemeldeten Salmonellosefälle beim Menschen von rund 30.000 auf knapp 200.000 an. Die Inzidenzrate betrug hierbei etwa 60 Erkrankungen pro 100.000 Einwohner im Jahr 1985 und maximal 350 Erkrankungen im Jahr 1992. Dieser Anstieg war mit einem Erregerwechsel verbunden. Anstelle von S. Typhimurium rückte nunmehr S. Enteritidis in den Vordergrund des 22 2 LITERATUR Infektionsgeschehens (KÜHN 1993). Der Anstieg der S. Enteritidis-Infektionen wurde v. a. mit dem Verzehr von Hühnereiern in Verbindung gebracht (MEYER et al. 1993b; BARROW et al. 2003). Der Anteil von S. Enteritidis an Salmonellosen des Menschen betrug im Jahr 2003 67 % und von S. Typhimurium 19 % (ALPERS u. JANSEN 2004; HARTUNG 2004). Bei S. Enteritidis wird der Phagentyp (PT) 4 zurzeit am häufigsten aus dem Menschen, dem Geflügel und anderen Tierarten isoliert (NASTASI u. MAMMINA 1996; BOONMAR et al. 1998; SCHROETER et al. 2000, 2004; BERGHOLD u. KORNSCHOBER 2004; NYGARD et al. 2004). Das Vorkommen dieses Phagentyps dominiert seit über zehn Jahren gegenüber anderen Phagentypen wie PT1, PT8, PT14b und PT21 in Deutschland und in vielen Ländern in Mitteleuropa. (SCHROETER et al. 2000, 2004; BERGHOLD u. KORNSCHOBER 2004; NYGARD et al. 2004; O’BRIEN et al. 2004). Die S. Typhimurium-Infektion des Menschen wird bevorzugt von dem multiresistenten Phagentyp DT104 verursacht (DUIJKEREN et al. 2002). Auch beim Geflügel konnte insgesamt der Phagentyp DT104 am häufigsten nachgewiesen werden, gefolgt von dem Phagentyp DT8 und teilweise DT9 (SCHROETER et al. 2000; DUIJKEREN et al. 2002; LAILLER et al. 2002). In Deutschland wurde zwischen 1972 und 1990 die Mehrzahl der S. Typhimurium-Isolate bei der Pekingente dem Phagentyp DT46 zugeordnet. Danach wurde dieser Typ fast nicht mehr nachgewiesen und der Phagentyp DT8 stand im Vordergrund (KÖHLER et al. 1996; RABSCH et al. 2002). Einer ungarischen Untersuchung zufolge stammten 19 % aller aus Schweinen und verschiedenen Geflügelarten isolierten S. Typhimurium-Stämme des Phagentyps DT104 von Enten (SZMOLLENY et al. 2000). Die Bedeutung der Salmonellose als Zoonose findet u. a. in der europäischen Verordnung (EG) Nr. 2160/2003 und in der Richtlinie 2003/99/EG ihren Ausdruck. Zur Senkung der Prävalenz sollen durch die Verordnung (EG) Nr. 2160/2003 des Europäischen Parlamentes und des Rates vom 17. November 2003 zur Bekämpfung 2 LITERATUR 23 von Salmonellen und bestimmten anderen durch Lebensmittel übertragbaren Zoonoseerregern (Zoonosen-Bekämpfungsverordnung) Bekämpfungsmaßnahmen u. a. gegen alle Salmonellen-Serotypen, die von Belang für die öffentliche Gesundheit sind, für das Geflügel sowie für Schweine festgelegt werden. Hierbei werden ausdrücklich Salmonella Enteritidis und Salmonella Typhimurium erwähnt. Die Verordnung erstreckt sich dabei beim Geflügel auf Gallus-gallus-Zuchtherden, Legehennen, Masthähnchen und Puten. Enten werden in der Verordnung nicht aufgeführt. Die Richtlinie 2003/99/EG des Europäischen Parlaments und des Rates vom 17. November 2003 regelt die Überwachung von Zoonosen und Zoonoseerregern einschließlich deren Antibiotikaresistenzen, die epidemiologische Untersuchung lebensmittelbedingter Krankheitsausbrüche und den Austausch von Informationen über Zoonosen und Zoonoseerregern. Im Anhang I wird die Salmonellose und ihre Erreger unter Punkt A „Überwachungspflichtige Zoonosen und Zoonoseerreger“ aufgeführt. Durch die Bekanntmachung der Neufassung der Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember 2005 ist das Auftreten von Salmonella spp. bei Enten, Puten, Gänsen, Hühnern und Tauben unverzüglich der zuständigen Behörde zu melden. Ausgenommen von dieser Meldung sind nur die Serovaren S. Enteritidis und S. Typhimurium beim Haushuhn, soweit die Mitteilungspflicht nach § 4 der Hühner-Salmonellen-Verordnung besteht, oder soweit die Salmonellose und ihre Erreger des Rindes betroffen sind, wenn die Anzeigepflicht nach der Verordnung über anzeigepflichtige Tierseuchen besteht. Diese Daten sollen auf der Basis der in den Mitgliedstaaten bestehenden Überwachungssysteme Erkenntnisse zum Auftreten der Salmonellen liefern und eine Beurteilung der Bedeutung als Quelle einer Zoonose zulassen. Auf diese Weise soll der Kenntnisstand vor einem Einstieg in die Bekämpfung der Salmonellen gemäß der Zoonosen-Bekämpfungsverordnung (VO (EG) Nr. 2160/2003) verbessert werden. Von Bedeutung ist auch eine mögliche Einschätzung, inwieweit durch Lebensmittel verursachte Krankheitsausbrüche beim 24 2 LITERATUR Menschen auf Salmonellenbefunde in der Tierhaltung zurückgeführt werden können oder ob andere Faktoren eine Rolle bei solchen Ausbrüchen spielen. Diese Erkenntnisse sollen dazu beitragen, dass die für die Bekämpfung der Salmonellen nach der Verordnung (EG) Nr. 2160/2003 notwendig werdenden nationalen Programme in fachlich und sachlich geeigneter Weise erarbeitet werden können (SCHNEIDER 2005). Geflügel ist häufig mit verschiedenen nicht wirtsspezifischen Salmonellen-Serovaren infiziert. Die Infektion ist meistens auf den Gastro-Intestinaltrakt beschränkt und führt bei Vögeln oft zu Salmonellenausscheidung über den Kot (POPPE 2000). Es bestehen vielfältige Wechselbeziehungen zwischen dem Auftreten von Salmonellen bei Menschen, beim landwirtschaftlichen Nutztier, beim Haus- bzw. Heimtier und beim Wildtier (BÖHM 1993). Salmonellen werden durch indirekte oder direkte Übertragung leicht von Tier zu Tier, von Tier zu Mensch und von Mensch zu Mensch weitergegeben (D’AOUST 1989; CLARKE u. GYLES 1993). Die Übertragungswege in den Geflügelhaltungen sind vielfältig (FRIES 2005). Belebte und unbelebte Vektoren spielen in diesem Geschehen eine zentrale Rolle. Dabei setzt eine Übertragung von Salmonellen durch unbelebte Vektoren eine ausreichende Überlebensfähigkeit derselben in der Umwelt voraus (BÖHM 1993). Die Tiere können über Futtermittel (POPPE 2000), über Vektoren aus der Umwelt wie z. B. Schadnagern (HENZLER u. OPITZ 1992) und Insekten (SKOV et al. 2004) oder durch den Menschen bei mangelnder Betriebshygiene infiziert werden (HARTUNG 2004). Abbildung 2 illustriert die Stellung der wirtschaftlich genutzten Ente innerhalb dieses Kreislaufes. Die Haltungskaskade von der Zucht über die Vermehrungsphase in den Legebetrieb oder in die Mast hinein ermöglicht die Übertragung über die Generationenfolge der Tiere. Dieser Weg kann sich dann horizontal in der Herde fortsetzen. Der enge Kontakt der Individuen untereinander bringt es mit sich, dass sich die Erreger leicht im Bestand ausbreiten können (FRIES 2005). S. Enteritidis und S. Typhimurium 2 LITERATUR 25 nicht wirtsspezifische Salmonellen (z.B. S. Enteritidis, S. Typhimurium) Kontamination (Infektion) (Klinik) (Keimträgertum) Infektion Klinik Keimträgertum Ausscheidung Passage Ausscheidung (Passage) unbelebte Umwelt Lebensmittel belebte Umwelt (Staub, Wasser, Einstreu, Futter) (Fleisch / Eier) (Schadnager, Insekten, Wildvögel, Personal) [Infektion] [Klinik] [Keimträgertum] Mensch Passage Ausscheidung Erläuterungen: Regelfall gelegentlich vorkommender Fall Ausnahmefall Abb. 2: Schema zu den Erreger-Wirtsbeziehungen der Salmonellen (aus SCHÖLL 1988, modifiziert) können sich in Geflügelbeständen etablieren und sind damit weniger als andere Serovaren auf den ständigen Eintrag von Außen angewiesen (COOPER 1994). Die Infektion mit Salmonellen erfolgt primär via oral-fäkaler Übertragung (BÖHM 1993). Dabei spielt kontaminierte Einstreu eine wichtige Rolle, da die Tiere oft große Mengen an Salmonellen durch das Picken und Wühlen im Kot anderer Tiere aufnehmen. So erreichte die Infektion von salmonellenfreien Hühnern auf infizierter Einstreu innerhalb von sieben Tagen 100 % (SNOEYENBOS et al. 1969). Enten haben die Eigenart, in der Einstreu zu gründeln (HENRY 2000) und sind so in besonderer Weise infektionsgefährdet. Salmonellen können über das Futter in den Bestand eingetragen werden und die Ursache für die Infektion von Geflügel sein (POPPE 2000). Das Tränkewasser spielt ebenfalls eine epidemiologische Rolle für 26 die 2 LITERATUR Übertragung von Krankheitserregern. Salmonellen, die bereits in der Tränkeeinrichtung vorhanden sind oder über Futter, Schnabel, Nase, Staub und Kot eingebracht werden, können sich dort vermehren (HEYN et al. 2005a) und so in der Herde verbreitet werden. In Broilerherden waren die Wasserproben von 63 der 292 untersuchten Herden (21,6 %) Salmonellen-positiv (POPPE et al. 1991). Aber auch das Einatmen salmonellenhaltiger Luft kann zu einer Infektion führen, wie BASKERVILLE et al. (1992) an Legehennen zeigten. Die Kontamination des Eiinhaltes kann durch die Verschmutzung der Eischalen mit Kot von Salmonellen-Ausscheidern erfolgen. Dies geschieht, indem die Salmonellen durch die Poren der verschmutzten Eischalen hindurch einwandern, bevor die Cutikula ausgebildet ist (STOKES et al. 1956). Da Enten die Angewohnheit haben, in das Nest zu koten, und Enten-Kot noch dazu eine flüssige Konsistenz aufweist, kann es hier besonders leicht zur Verschmutzung von Eiern kommen. Zudem kratzen Enten auch noch häufig an den Eischalen bevor die Cuticula ausgebildet ist (HENRY 2000). Die horizontale Ausbreitung von Salmonellen kann während der Bebrütung der Eier geschehen. Dieses wurde gezeigt, als kontaminierte und salmonellenfreie Eier miteinander bebrütet wurden (CASON et al. 1994). Die vertikale Übertragung von Salmonellen auf das Brutei kann eine Folge der Infektion des Ovars und Oviducts sein. Dazu muss das Tier eine systemische Infektion durchgemacht haben. Die geflügelspezifischen Serovaren S. Pullorum und S. Gallinarum sind die am häufigsten vertikal übertragenen Serovaren. Aber auch andere Serovaren wie S. Typhimurium, S. Enteritidis, S. Heidelberg und S. Menston können laut verschiedener Studien transovarielle Infektionen verursachen (SCHAAF 1936; SNOEYENBOS et al. 1969; COOPER et al. 1989; McILROY et al. 1989; GAST u. BEARD 1990; KELLER et al. 1995; POPPE 2000). Bei der Ente soll die vertikale Übertragung laut HENRY (2000) auf S. Typhimurium beschränkt sein. Sie konnte 2 LITERATUR 27 acht Tage nach experimenteller S. Typhimurium-Infektion über das Trinkwasser bei erwachsenen Enten nachgewiesen werden. Eine andere wichtige Rolle bei der Infektion spielen Nager. Die Mäusepopulation ist ein wichtiges Reservoir für Salmonellen (FRIES 2005). So wurden bei der Untersuchung von Mäusekot aus einem Geflügelbestand mehr als 105 Salmonellen pro Kotpellet gezählt (HENZLER u. OPITZ 1992). Bei Ratten ist je nach Biotop von Infektionsraten mit Salmonellen zwischen 4 % und 30 % auszugehen (BÖHM 1993). S. Typhimurium soll ein natürliches Wirtsreservoir in Schadnagern haben (BÖHM 1993, RABSCH et al. 2002). Wenn auch bei Insekten nicht in vergleichbarem Maße ein Salmonellosegeschehen abläuft wie bei Schadnagern, so können sie doch in die epidemiologischen Kreisläufe eingeschaltet sein, wie z. B. der Getreideschimmelkäfer beim Geflügel (BÖHM 1993). SKOV et al. (2004) untersuchten die Bedeutung von Käfern in der Einstreu als potentielles Reservoir für Salmonella enterica-Infektionen. Es konnte nachgewiesen werden, dass Käfer trotz Reinigung und Desinfektion bei dem „all-in-all-out“Verfahren in Schlupfwinkeln des Stalles überleben konnten und dabei Träger derselben Salmonellen-Serovar waren, die im vorausgegangenen und im darauf folgenden Mastdurchgang bei Broilern aufgetreten war. Neben Käfern dürfte Fliegen eine große Bedeutung bei der Übertragung von Salmonellen zukommen (OLSEN u. HAMMACK 2000; MIAN et al. 2002; LIEBANA et al. 2003; MOORE et al. 2003). 2.2.1.1 Ente Entenbestände gelten weltweit als salmonellenverseucht (KÖHLER et al. 1996). Bei der Stallmast auf Tiefstreu zeigen Enten ausgeprägtes Gründeln und Schnattern in der Einstreu. Dabei bearbeiten und durchpflügen die Tiere das Einstreumaterial intensiv mit dem Schnabel (HEYN et al. 2005b), was die Aufnahme von Salmonellen begünstigt. Laut SCHWARZ und NEURAND (1972) soll die besondere Gefährdung 28 2 LITERATUR der Entenbestände weniger aus der Haltung in feuchten Biotopen sondern vor allem durch die dreimal so dicke Schalenhaut des Enteneies im Verhältnis zum Hühnerei bedingt sein, wodurch den Salmonellen ein größeres Maschenwerk zur Besiedlung und Vermehrung zur Verfügung steht. Auch im rechtlichen Bereich spielt das Thema Salmonellen bei Enten schon lange eine Rolle. So müssen seit 1954 nach der Entenei-Verordnung bzw. nach der Eierund Eiprodukte-Verordnung Enteneier vor dem Verzehr mindestens zehn Minuten gekocht werden, um das Abtöten möglicher Salmonellen zu garantieren (SÜDBECK 2005). Trotz der so genannten Salmonellenproblematik bei Enten liegen kaum systematisch erhobene Daten vor. So werden Angaben über Infektionen von Herden und über die Verteilung verschiedener Serovaren innerhalb eines Pools von Isolaten gemacht, ohne auf die Häufigkeit infizierter Herden oder die Infektionsrate innerhalb bestimmter Populationen einzugehen. In Deutschland sollen in 2002 ca. 7,9 % und in 2003 ca. 12,7 % der Entenherden mit Salmonellen infiziert gewesen sein (HARTUNG 2004; HEYN et al. 2005a). In Taiwan werden aufgrund einer Untersuchung zwischen März 2000 und Januar 2001 20 % der Entenfarmen als Salmonellen-infiziert angesehen (TSAI u. HSIANG 2005). Für Frankreich liegen Angaben über die Infektionsrate von Zuchtenten vor: dort steigerte sich die Häufigkeit infizierter Herden von ca. 31 % im Jahr 2001 auf 36 % im Jahr 2002. In Dänemark lag die Infektionsrate mit 55 % sogar noch deutlich höher, während in Norwegen und Schweden keine Salmonellen in kommerziell gehaltenen Entenherden nachweisbar gewesen sein sollen (EC 2004; EFSA 2004). Die Salmonellen-Serovaren, die Enten infizieren und zu einer allgemeinen Infektion oder zum Trägerstatus im Darm führen können, unterscheiden sich grundsätzlich nicht von denen bei anderem Geflügel. Allerdings kommt S. Gallinarum nur gelegentlich vor (HENRY 2000) und führt bei der Ente nur zu kurzer subklinischer Infektion ohne Gewebeschäden (BUCHHOLZ u. FAIRBROTHER 1992). 2 LITERATUR 29 Im Rahmen der regelmäßigen diagnostischen Überwachung von Entenherden in Deutschland über einen längeren Zeitraum von 1983-1990 (KÖHLER et al. 1996) konnten aus gestorbenen und erkrankten Enten 22 verschiedene SalmonellenSerovaren isoliert werden. Im Vordergrund standen S. Typhimurium mit 66,6 % der Isolate und S. Enteritidis mit 17,7 % Für die Anzahl untersuchter Proben von Enten, bei unbekannter Tier- oder Herdenzahl, liegen für das Vorkommen von S. Typhimurium weitere Angaben vor: In Österreich und Deutschland waren 16,7 % bzw. 10,6 % der Proben Salmonellenpositiv (EC 2004; EFSA 2004). Die Infektionsrate der Enten in Taiwan - ermittelt durch die Untersuchung von Kloakentupferproben - soll 4,6 % betragen (TSAI u. HSIANG 2005). Untersuchungen von Enten und Entenfleisch bestätigen die häufige Isolierung von S. Typhimurium (DORN et al. 2000; HARTUNG 2004). Aus Enten wurden in den USA (PRICE et al. 1962) 93 % der Isolate aus Enten als S. Typhimurium typisiert, in Slowenien 61 % (SIMKO 1988), in Vietnam 12,5 % (TRAN et al. 2004) und aus Enteneiern in Thailand 5,5 % (SAITANU et al. 1994). Die während eines Zeitraumes von 13 Jahren gesammelten S. TyphimuriumStämme, die aus unterschiedlichstem Material in Zusammenhang mit Enten oder aus deren Umfeld isoliert wurden, ließen sich (KÖHLER et al. 1996) fünf Phagentypen zuordnen. Davon entfielen 63,2 % der Isolate auf den Phagentyp DT8 nach dem Typisierungssystem nach Anderson (WARD et al. 1987) Die Ente soll das Hauptreservoir für diesen Typ darstellen, da 90,8 % aller bei Tieren festgestellten Infektionen mit dem Phagentyp DT8 bei der Ente auftraten. Die übrigen vier Phagentypen spielten eine vergleichsweise geringe Rolle. Während S. Typhimurium die am häufigsten nachgewiesene Salmonellen-Serovar in Deutschland war, konnte S. Enteritidis mit 17,7 % in einem Untersuchungszeitraum zwischen 1983 und 1996 seltener nachgewiesen werden. Nach erstmaligem 30 2 LITERATUR Nachweis im Jahr 1989 nahmen die Isolierungsraten von S. Enteritidis ständig zu, so dass 1995 und 1996 S. Enteritidis mit 77,4 % und 90,3 % die am häufigsten isolierte Serovar bei Enten war. Im Untersuchungszeitraum von 1988 bis 1996 stammten 33,9 % der S. EnteritidisIsolate aller Haustierarten von der Ente. Im Jahr 1995 wurde S. Enteritidis erstmals häufiger bei der Ente als beim Huhn gefunden. Weitergehende Untersuchungen ergaben, dass der Phagentyp 4 mit ca. 85 % bei Isolaten aus allen Tierarten deutlich überwog (KÖHLER et al. 1996). S. Typhimurium und S. Enteritidis und andere Salmonellen lassen sich in Umgebungsproben in Brütereien und auf oder in Enteneiern nachweisen, was eine horizontale Übertragung von den Elterntieren auf die nachfolgende Mastentengeneration begünstigt (KÖHLER et al. 1996; HENRY 2000). Eine mögliche Beteiligung von S. Typhimurium und S. Enteritidis an septikämischen Erkrankungen junger Entenküken wird von HENRY (2000) beschrieben. Ferner ließen sich S. Typhimurium, aber auch andere humanpathogenen Salmonellen aus Tränken (BAGGESEN et al. 1996; SELBITZ 2002; HEYN et al. 2005a) der Pekingenten-Haltungen in Deutschland isolieren, was die Verbreitung innerhalb eines Bestandes begünstigen dürfte. Neben S. Typhimurium und S. Enteritidis wird über zahlreiche andere SalmonellenSerovaren berichtet, die in unterschiedlicher Häufigkeit in verschiedenen Ländern isoliert wurden. So waren in Deutschland zusätzlich 20 weitere Serovaren nachweisbar (KÖHLER et al. 1996). Die sechs häufigsten waren: S. Saintpaul mit 4,7 %, S. Anatum mit 3,3 %, S. Brandenburg mit 2,8 %, S. Hadar mit 1,3 %, S. Kottbus mit 0,8 % und S. Indiana mit 0,7 %. In Großbritannien sind in einer Zusammenstellung verschiedener Autorenangaben (HENRY 2000) 36 verschiedene Serovaren ohne weitergehende Daten aufgeführt. Einem anderen Bericht zufolge waren dort S. Indiana mit 26,4 %, S. Orion mit 13,2 %, S. Binza mit 12,7 % sowie S. Hadar mit 2 LITERATUR 31 11,5 % an Salmonellen-Infektionen beteiligt. Für Nord-Irland werden S. Mbandaka und S. Budapest als Enten-Isolate ohne genaue Nachweisrate angegeben. In Dänemark wurde S. Anatum bei Enten nachgewiesen (EC 2004; EFSA 2004). In Slowenien stellten S. Anatum 22 % und S. Meleagridis 4 % der Isolate (SIMKO 1988), in Thailand (SAITANU et al. 1994) waren S. Cerro mit 4,1 % und S. Tennessee mit 2,8 % am Salmonellengeschehen beteiligt. Für taiwanesische Entenherden (TSAI u. HSIANG 2005) liegen sehr detaillierte Angaben über zehn verschiedene Serovaren vor: S. Potsdam 31,9 %, S. Düsseldorf 18,7 %, S. Indiana 14,3 %, S. Typhimurium 7,7 %, S. Hadar 5,5 %, S. Newport 4,4 %, S. Derby 4,4 %, S. Montevideo 2,2 %, S. Schwarzengrund 2,2 % und S. Asinnine 1,1 %. 2.2.1.2 Huhn Die Angaben zum Salmonellenvorkommen im Huhn berücksichtigen die entsprechenden Nutzungsrichtungen Zucht-, Lege- und Masttier. In Zuchtherden der Länder Dänemark. Finnland, Norwegen und Schweden beträgt die Prävalenz von S. Enteritidis und S. Typhimurium zusammen mit anderen Salmonellen-Serovaren seit 1998 weniger als 1 %. In den EU Ländern, einschließlich Deutschland, besteht ein abnehmender Trend in der Prävalenz von S. Enteritidis und S. Typhimurium. Im Jahr 2002 betrug die Prävalenz dieser beiden Serovaren zwischen 0 % in Großbritannien und 6 % in Griechenland für Broilerzuchtherden. S. Enteritidis war mit 42 % die am häufigsten gemeldete Serovar. In Deutschland machte 2003 S. Enteritidis etwa die Hälfte der nachgewiesenen Salmonellen in der Aufzucht- und Legephase bei Zuchthühnern aus. Der Anteil von S. Typhimurium betrug in Zuchtherden 4 % (EC 2004; EFSA 2004; HARTUNG 2004). In Legehennenherden der Länder Finnland, Norwegen und Schweden beträgt die Prävalenz von Salmonella spp. weniger als 1 %, in Dänemark und Irland liegt sie bei 32 2 LITERATUR unter 5 %. In Deutschland bewegt sich die Salmonellen-Isolierungsrate seit 1995 um 2 %; im Jahr 2002 betrug sie 1,5 % und 2003 lag sie bei 2,6 % (HARTUNG 2004). Im Jahr 2002 rangierte in vielen europäischen Ländern wie Österreich, Deutschland, Spanien, Griechenland, Frankreich, Italien, Großbritannien, Nord-Irland und den Niederlanden die Isolierung von S. Enteritidis vor S. Typhimurium. In diesen Ländern betrug die Prävalenz von S. Enteritidis zwischen 0,8 % in Deutschland und 7,2 % in Spanien und S. Typhimurium zwischen 0,1 % in Deutschland und 0,7 % in Griechenland für (EC 2004; EFSA 2004). In Broilerherden der Länder Finnland, Norwegen und Schweden liegt die Nachweisrate von Salmonella spp. seit 1996 im Allgemeinen unter 1 %. In Österreich, Spanien, Griechenland, Italien und den Niederlanden reicht die Prävalenz in den Jahren 2000-2002 von 1,2 % bis 22,8 % (EC 2004; EFSA 2004). In Deutschland (HARTUNG 2004) wiesen 2003 rund 4 % der Herden Salmonellen auf. Der Anteil von S. Enteritidis unter den Isolaten aus Deutschland lag in 2002 bei 26% und in 2003 bereits bei 57 %, für S. Typhimurium wird er mit 3,4 % in 2003 angegeben. Angaben über den Anteil verschiedener Serovaren unter den Isolaten lassen sich nur schwer systematisch zusammenfassen, da je nach Quelle unterschiedliche Bezugsgrößen gewählt wurden. So werden für Broilerherden in den oben genannten europäischen Ländern die Anteile unter den Isolaten für S. Paratyphi B var. Java mit 20 % und für S. Enteritidis mit 11 % angegeben, für S. Infantis, S. Virchow, S. Livingstone, S. Mbandaka, S. Typhimurium, S. Senftenberg sowie S. Hadar betrugen die Isolierungsraten zwischen 3 und 6 % (EC 2004; EFSA 2004). Für Isolate aus Eiern, Eiprodukten und Hühnerfleisch betrugen die Nachweisraten für die aufgeführten europäischen Staaten im Jahr 2002 bzw. 2003 für S. Enteritidis insgesamt 73 % bzw. 77 %, S. Typhimurium wurde deutlich seltener isoliert (EC 2004; EFSA 2004; HARTUNG 2004). 2 LITERATUR 33 Unabhängig von der Nutzungsrichtung wurde für Hühner in Deutschland der Anteil von S. Enteritidis mit etwa 38 % im Jahr 2002 und 34 % im Jahr 2003 benannt, wobei sich über die Hälfte dieser Isolate dem Phagentyp 4 zuordnen ließ (SCHROETER et al. 2004). Auch in Großbritannien wurde S. Enteritidis am häufigsten isoliert, gefolgt von S. Senftenberg und S. Mbandaka (POPPE 2000). Für die Niederlande liegen Angaben über das Auftreten verschiedener Salmonellen für das Jahr 1989 (VAN DE GIESSEN et al. 1991) vor: S. Infantis und S. Virchow jeweils 30,9 %, S. Typhimurium 25,0 %, S. Enteritidis 20,6 % und S. Hadar 17,6 %. 2.2.1.3 Pute Mastputenherden (HAFEZ et al. 1997) wurden zwischen 1993 und 1995 im Rahmen eines Programms auf Salmonellen überwacht: am häufigsten konnten S. Newport (34,6 %) und S. Reading (30,3 %), gefolgt von S. Bredeney (10,6 %), isoliert werden. S. Enteritidis PT 8 wurde nur über eine kurze Zeit von fünf Wochen in einer Herde nachgewiesen. Die Salmonellenausscheidung fand intermittierend statt und betrug zwischen 1 und 20 Wochen. In 16 von 24 Herden konnten während des Untersuchungszeitraumes zum Teil verschiedene Serovaren gleichzeitig nachgewiesen werden. In Zuchtputenherden konnten im Jahr 2002 in Monitoring-Programmen der Länder Finnland, Schweden, Norwegen, den Niederlanden und Irland weder S. Enteritidis noch S. Typhimurium nachgewiesen werden. In Putenherden betrug die Prävalenz von Salmonella spp. zwischen 0 % in Schweden sowie Norwegen und 8,6 % in Irland. Dabei betrug der Anteil an S. Enteritidis zwischen 0 % bis 0,2 % und der von S. Typhimurium zwischen 0 % und 1,6 % (EC 2004; EFSA 2004). 34 2 LITERATUR Unabhängig von der Nutzungsrichtung der Puten waren in Deutschland 3,95 % der Herden im Jahr 2003 und 9,74 % im Jahr 2002 Salmonellen-positiv. Dabei wurde S. Saintpaul sowohl in den Herden- als auch bei den Einzeltieruntersuchungen am häufigsten nachgewiesen. Es folgten S. Senftenberg, S. Reading und S. Typhimurium (HARTUNG 2004). Die Isolierungsrate von S. Senftenberg insbesondere in Putenfleisch mit 76 % in 2003 nach 78 % in 2002 lässt eine enge Assoziierung mit Lebensmitteln vermuten (BAGGESEN et al. 1996; HARTUNG 2004). Der Anteil von S. Enteritidis an den Isolaten aus Puten ist mit 1 % sehr gering (SCHROETER et al. 2004). 2.2.2 Pathogenese Typischerweise gelangen Salmonellen über kontaminiertes Futter oder Wasser in ihren Wirt (COTTER u. DiRITA 2000). Nach der Aufnahme müssen die Salmonellen dem sauren Milieu des Magens und den abbauenden Wirkungen der Gallensalze standhalten, um den Hauptort ihrer Besiedlung erreichen zu können (COTTER u. DiRITA 2000). Hierbei handelt es sich um die kaudalen Regionen des Intestinaltraktes, vor allem um das Caecum, (FANELLI et al. 1971; TURNBULL u. SNOEYENBOS 1974; HOLT et al. 1995). Die pathogene Wirkung von Salmonellen beruht auf der Fähigkeit sich an Darmepithelzellen anzulagern, Adhäsion genannt, und in sie einzudringen, als Invasion bezeichnet (DINJUS u. HÄNEL 1997). Bestimmend für die Virulenz von Salmonellen sind neben der Adhäsivität und Invasivität der fakultativ intrazelluläre Parasitismus und die Toxinbildung des Erregers. 2 LITERATUR 2.2.2.1 35 Adhäsion Im Verlauf der Infektion unterstützen die aktiven Flagellen die chemotaktische Bewegung der Salmonellen zur Wirtszelle hin (FRETER 1981; CLARKE u. GYLES 1993; LA RAGIONE et al. 2003). Damit wird die Wahrscheinlichkeit, eine geeignete Stelle zur Adhäsion und Invasion der Enterozyten zu erreichen, erhöht (JONES et al. 1981; LOCKMAN u. CURTISS III 1990). Durch eine Proteinsynthese der Salmonellen wird der Kontakt zwischen Bakterium und Epithelzelle hergestellt (FINLAY et al. 1989a, b). Hierfür besitzen Salmonellen einen speziellen Syntheseapparat, das Salmonella-Pathogenitätsinsel 1- und 2codierte Typ-III-Sekretionssystem (TTSS) (GALAN 1998; GALAN u. ZHOU 2000). Dieser Syntheseapparat ist auf so genannten Pathogenitätsinseln (SPI = engl. Salmonella pathogenicity islands) codiert (HENSEL 2001; KÖHLER et al. 2001). Dabei handelt es sich um chromosomale Genorte, die entscheidend für die Virulenz diverser Salmonellenarten sind und in größere Funktionseinheiten zusammengefasst werden (STONE et al. 1992; DARWIN u. MILLER 1999). Bei Kontakt der Salmonellen mit den Wirtszellen, z. B. den M-Zellen der Peyerschen Platten, wird der Typ III-Apparat aktiviert und die Effektorproteine in das Zytosol „injiziert“ (FINLAY et al. 1989a; JONES u. FALKOW 1996). Die gebildeten Proteine werden neben der Adhäsion auch zur Invasion benötigt (FINLAY et al. 1989b; HENSEL 2001). Bei der Anlagerung von Salmonellen an die Enterozyten spielen Adhäsine ebenfalls eine Rolle. Zu den bekanntesten Adhäsionsfaktoren gehören Fimbrien. Hierbei handelt es sich um fädige Proteinstrukturen auf der Bakterienoberfläche, die die Anheftung der Erreger an das Schleimhautepithel ermöglichen und durch ihre hämagglutinierenden Eigenschaften nachgewiesen werden können (SELBITZ et al. 1995; WOODWARD et al. 2000). Fimbrien binden sich über ihre Lektine an Mannose und andere Kohlenhydrate enthaltende Rezeptoren der Zielzellen. Die Hämagglutination mannosebindender Fimbrien lässt sich durch die Zugabe von Mannose hemmen (DE BUCK et al. 2003), so dass man von der mannosesensiblen Hämag- 36 2 LITERATUR glutination spricht. Fimbrien dieses Typs werden zum Typ 1 gerechnet und können bei vielen Salmonellenstämmen nachgewiesen werden. Mannoseresistente Fimbrien kommen bei Salmonellen relativ selten vor. Bei S. Enteritidis konnten bisher drei Fimbrientypen nachgewiesen werden. Sie werden entsprechend den Molekülmassen als Salmonella Enteritidis Fimbriae (SEF) 14, SEF 17 und SEF 21 bezeichnet. Inwieweit Fimbrien in der Pathogenese von Salmonellosen eine Rolle spielen ist noch nicht endgültig geklärt, da diesbezüglich kontroverse Untersuchungsergebnisse vorliegen (SELBITZ et al. 1995). Bekannt ist allerdings, dass Typ-1-Fimbrien bei der Übertragung von S. Enteritidis auf das Hühnerei eine große Rolle spielen. Dabei sind die tubulären Drüsen des Isthmus der Hauptort der Kolonisierung im Eileiter (DE BUCK et al. 2003, 2004b, 2004c). 2.2.2.2 Invasion Im Anschluss an die Adhäsion kann die Invasion nach bereits einer Minute erfolgen (FRANCIS et al. 1992) und ist ebenfalls genetisch determiniert (JONES u. FALKOW 1996). Diese initialen Prozesse werden als entscheidende Voraussetzung für eine erfolgreiche Infektion angesehen (DOUCE et al. 1991). Kropf und Caecum sind beim Geflügel die Hauptorte für die Durchwanderung der Salmonellen vom Darmlumen in die inneren Gewebe (TURNBULL u. SNOEYENBOS 1974). Die bevorzugten Stellen der Salmonelleninvasion in die Darmschleimhaut sind die von spezialisierten Enterozyten, den M-Zellen, überzogenen ilealen Peyerschen Platten und möglicherweise auch die zäkalen lymphatischen Platten (CARTER u. COLLINS 1974; KOHBATA et al. 1986). Für das Eindringen in die Enterozyten müssen die Salmonellen die physiologische Darmflora (SONNENBORN u. GREINWALD 1991) und den von den Becherzellen gebildeten und die Enterozyten bedeckenden Schleim verdrängen (WELLS et al. 1988). Dieses erfolgt durch Veränderung der Permeabilität der intestinalen Mukosa (TURNBULL et al. 1995). Durch die Zerstörung des Bürstensaums der epithelialen 2 LITERATUR 37 Zellen kommt es zur Degeneration des apikalen Zytoplasmas (KOHBATA et al. 1986; YOKOYAMA et al. 1987; CLARKE u. GYLES 1993; JONES et al. 1994; BAUER u. HÖRMANSDORFER 1995) und zu einer Reduktion des transepithelialen Widerstandes (FINLAY u. FALKOW 1990). Die Zerstörung von M-Zellen lässt innerhalb des follikelassoziierten Epithels (FAE) der Peyerschen Platten eine Lücke entstehen, die den Salmonellen die Invasion in benachbarte lebende Zellen ermöglicht (JONES et al. 1994). Durch Makropinozytose werden die Salmonellen internalisiert (KÖHLER et al. 2001). Im Verlauf des Infektionsgeschehens kommt es zur Enteritis mit der entsprechenden klinischen Symptomatik durch vermehrte Flüssigkeits- und Elektrolytansammlung im Darmlumen. Diese wird verursacht durch Malabsorption der zerstörten Villi und degenerierten Enterozyten, aber auch durch eine vermehrte Durchlässigkeit der Darmwand aufgrund von Gefäßschäden und durch Enterotoxine, die eine Sekretion von Elektrolyten und Flüssigkeit durch Aktivierung des Adenylat-Cyclase-Systems bewirken (CLARKE u. GYLES 1993; BAUER u. HÖRMANSDÖRFER 1995). Innerhalb der Lamina Propria treffen die Salmonellen auf polymorphkernige Granulozyten und Makrophagen (COTTER u. DiRITA 2000). Daher ist es für Salmonellen nach dem Eindringen in die Enterozyten von entscheidender Bedeutung, den intrazellulären sauerstoffabhängigen und -unabhängigen Abwehrmechanismen des Wirtes zu entgehen, um in tiefere Schichten der Darmschleimhaut zu gelangen (FINLAY u. FALKOW 1997; LIBBY et al. 2004). Die Widerstandsfähigkeit gegenüber den sauerstoffabhängigen Tötungsmechanismen der spezialisierten Phagozyten wird als wichtigster Aspekt der Salmonellenresistenz angesehen (VAZQUES-TORRES u. FANG 2001). Die oxidative Abtötung durch Phagozyten beruht auf der Produktion von toxischen und hochreaktiven Molekülen, die in der Lage sind, mikrobielle DNA, Proteine und Lipide zu schädigen (DEMPLE u. HALBROOK 1983). Gegen diesen Selektionsdruck haben Salmonellen oxidative Stressresistenz-Mechanismen entwickelt, welche für ihr Überleben innerhalb der Phagosomenkompartimente notwendig sind. Die Fähigkeit von Salmonellen, 38 2 LITERATUR innerhalb der Wirtsmakrophagen zu überleben und sich auch zu vermehren, ist ein wesentlicher Aspekt der Möglichkeit, systemische Infektionen verursachen zu können (FIELDS et al. 1986, 1989; FINLAY u. FALKOW 1989, 1997). Die Expression von Oberflächenproteinen, die das Überleben in Makrophagen sichern, wird durch ein Regulon gesteuert. Diese Proteine sind in der Lage, auf das unwirtliche Milieu in den Salmonellen-haltigen Vakuolen zu reagieren, indem sie z. B. die Zusammensetzung der LPS und der Außenmembran verändern und die Bakterienoberfläche verringern (LIBBY et al. 2004). Salmonellen sind ebenfalls in der Lage, mittels eines SPI vermittelten Vorganges die Fusion von Phagosomen mit Lysosomen zu verhindern (VAZQUEZ-TORRES u. FANG 2001) und damit dem enzymatisch wirkenden Inhalt der Lysosomen zu entgehen. Der genaue Mechanismus dieses Vorganges ist jedoch noch unbekannt. Gelingt es den phagozytierenden Zellen nicht, die Salmonellen während des Transportes in tiefere Schichten zu eliminieren, werden sie an der Basalmembran wieder freigesetzt (POPIEL u. TURNBULL 1985; FINLAY et al. 1988a; FINLAY et al. 1989a) und können über den Lymph- bzw. Blutstrom den Organismus systemisch besiedeln. In vielen Fällen einer Infektion dringen die Salmonellen in andere Organe ein (TIMONEY et al. 1989; GAST u. BEARD 1990). An der Verbreitung in verschiedene Organe können Makrophagen beteiligt sein (POPIEL u. TURNBULL 1985; COTTER u. DiRITA 2000). Die Vermehrung der Salmonellen findet innerhalb des Retikuloendothelialen Systems (HORMAECHE et al. 1993) statt, weshalb besonders häufig Leber und Milz mit Salmonellen infiziert sind (CLARKE u. GYLES 1993; COTTER u. DiRITA 2000). 2.2.2.3 Für die Endotoxine Pathogenität der Salmonellen ist die Bildung von Endotoxinen (Lipopolysaccharide, LPS) von großer Bedeutung. LPS ist ein Hauptbestandteil der Außenmembran der Salmonellen und besteht aus drei Hauptkomponenten: dem 2 LITERATUR 39 inneren Lipid A, dem Coreprotein und dem hochantigenen O-Polysaccharid. Sie produziert ein Toxin, das mit dem Wirtsimmunsystem interagiert und eine Entzündung hervorruft (CLARKE u. GYLES 1993; LIBBY et al. 2004). Das Lipid A ist verantwortlich für die endotoxischen Effekte der LPS durch die Überstimulation der Zytokinreaktion der Wirtszellen. Für den Tod von Tieren durch eine systemische Salmonellose werden diese endotoxischen Effekte verantwortlich gemacht (LIBBY et al. 2004). Mutanten von S. Typhimurium, die einen Lipid A Defekt aufweisen, können sich in der Leber und Milz von Mäusen bis zu einer Keimzahl von 109 vermehren, ohne tödlich zu sein, während beim Wildtyp Keimzahlen von 1/100 bis 1/1000 dieser Menge tödlich sind (GARCIA-DEL PORTILLO 2001). Raue LPS-Mutanten (r-, „rough“ Mutanten) haben eine unvollständige LPS und sind weniger in der Lage, letale Infektionen zu verursachen, da sie empfindlicher gegenüber der Wirtsabwehr sind. Die meisten Salmonellen-Isolate aus klinischen Infektionen liegen daher in der S-Form („smooth“) vor und haben eine vollständige LPS (YETHON et al. 2000; LIBBY et al. 2004). ERNST et al. (1999, 2001) berichten, dass Salmonellen die Struktur des O-Polysaccharids verändern können, um so die Immunantwort des Wirtes zu verringern. Die Entzündungsreaktion, die durch den LPS-Komplex hervorgerufen wird, lässt sich in erster Linie auf die Interaktion mit den Makrophagen zurückführen (FREUDENBERG et al. 2001). 2.2.2 Klinik Die Infektion von Tieren mit verschiedenen Spezies von Salmonella kann bei diesen zu ernsthaften Erkrankungen führen und stellt ein bedeutsames Reservoir für die Erkrankung des Menschen dar. Das Zusammenspiel zwischen den Salmonellen mit ihren Wirten beinhaltet verschiedene Formen wie Wirtsspezifität, inapparente Infektionen, genesene Träger, Enteritis, Septikämie, Abort und die Kombination dieser Syndrome. Salmonellen werden durch indirekte oder direkte Übertragung 40 2 LITERATUR leicht von Tier zu Tier, von Tier zu Mensch und von Mensch zu Mensch weitergegeben (D’AOUST 1989; CLARKE u. GYLES 1993). Salmonella enterica subsp. enterica kann auf der Basis der Pathogenese und Infektionsbiologie in zwei große Gruppen von Serovaren eingeteilt werden. Eine Gruppe besteht aus einer kleinen Anzahl an Serovaren, die in spezifischen Wirten schwere typhusähnliche Krankheiten verursachen können. Beim Geflügel beinhaltet diese Gruppe die Serovar Gallinarum mit den Biovaren Gallinarum und Pullorum. Die dadurch verursachten klinischen Erkrankungen werden Pullorumkrankheit bzw. Hühnertyphus (Fowl Typhoid) genannt (CLARKE u. GYLES 1993; EFSA 2004). An dieser Serovar erkranken vor allem Hühner (SHIVAPRASAD 2003). Krankheitsausbrüche sind durch eine hohe Morbidität und Mortalität gekennzeichnet (HAFEZ u. JODAS 2000; POPPE 2000; GAST 2003; EFSA 2004). Früher waren Erkrankungen dieser Serovar recht häufig, mittlerweile ist dieser Infektionserreger weitestgehend aus den Beständen eliminiert (WRAY 1985; HINZ et al. 1989; REDMANN et al. 1989; CHRISTENSEN et al. 1994; SHIVAPRASAD 2003; EFSA 2004). Die andere Gruppe besteht aus einer Vielzahl an Serovaren, die nicht an dass Geflügel adaptiert sind, aber Infektionen bei diesen und in einer Vielzahl von Wirten verursachen können. Sie werden unter dem Begriff Paratyphus-Infektionen zusammengefasst. Diese Serovaren können beim Menschen eine Infektion über Nahrungsmittel verursachen und sind dementsprechend als Zoonoseerreger von Bedeutung. Obwohl Infektionen mit nicht adaptierten Salmonellen beim Geflügel sehr verbreitet sind, verursachen sie nur selten akute systemische Erkrankungen. Ausgenommen davon sind meist hochempfängliche Küken. Im Allgemeinen sind die Infektionen durch die asymptomatische Besiedlung des Intestinaltraktes gekennzeichnet (CLARKE u. GYLES 1993; GAST 2003; EFSA 2004). Paratyphus-Infektionen kommen beim Geflügel in der EU häufig vor. Im Gegensatz zu Pullorum/Gallinarum verlaufen sie beim Geflügel meist subklinisch. Trotzdem können sie unter bestimmten Bedingungen schwere klinische Erscheinungen und Mortalität verursachen (GAST 2003). Das Zustandekommen einer Salmonellose wird 2 LITERATUR 41 von verschiedenen Faktoren beeinflusst. Dies ist in der Regel für das Huhn beschrieben. Dazu gehören das Alter der Vögel, die Infektionsdosis, die Infektionsroute, die Serovar, die Invasivität des Stammes, die Genetik der Tiere - z. B. die Rasse-, das Vorhandensein anderer Erkrankungen und das Haltungsmanagement (BARROW et al. 1987a, b; BUMSTEAD u. BARROW 1988, 1993; DUCHETSUCHAUX et al. 1997; DHILLON et al. 1999; GAST 1999; HAFEZ u. JODAS 2000, POPPE 2000; EFSA 2004). 2.2.2.1 Ente Laut HENRY (2000) wird vermutet, dass die Lebensweise der Enten zu einer genetisch bedingten Toleranz gegenüber potentiell pathogenen Salmonellen geführt hat. Denn obwohl die Ente nicht selten mit Salmonellen der Paratyphus-Gruppe infiziert ist, weist sie nur selten klinische Symptome auf. In der Regel stehen klinische Symptome mit einem schlechten Hygiene-Management oder Klimafaktoren in Zusammenhang (HENRY 2000). Sowohl BARROW et al. (1999, 2002) als auch FULTON et al. (2002) konnten selbst bei Eintagsküken, die mit 106 bzw. 108 KbE experimentell infiziert wurden, keine Krankheitsanzeichen beobachten, obwohl es zu einer Infektion der Tiere gekommen war. Im Gegensatz dazu führen KÖHLER et al. (1996) auf, dass sich experimentelle S. Typhimurium- und S. Enteritidis-Infektionen als besonders virulent für Enten erwiesen haben. Dabei nimmt die Resistenz mit dem Alter zu. Weiterhin geben sie eine Anzahl von Studien an, nach denen Erkrankungen bei erwachsenen Enten und die Entwicklung latenter Erregerträger durch haltungshygienische Mängel, Futterwechsel, ungenügende Lüftung, Unterkühlung, vitaminarme Fütterung und anderen Stressfaktoren entscheidend gefördert werden sollen. Meistens soll die klinische Salmonellose bei der Ente jedoch infolge von Kälte-Stress auftreten (HENRY 2000). 42 2 LITERATUR HENRY (2000) gibt an, dass die üblichen Symptome einer klinischen SalmonellenErkrankung für gewöhnlich nur bei sehr jungen Küken zu finden sind. Es kann sich hierbei um allgemeine Apathie, Zusammenkauern, Diarrhöe, Abmagerung, Dehydrierung mit halb geschlossenen Augen und verklebten Augenlidern sowie reduzierter Wasser- und Futteraufnahme, die möglicherweise Zeichen einer nerval bedingten Inkoordination ist und eventuell Koma und Tod handeln. Die Erkrankung kann sehr kurz dauern und wurde aufgrund des plötzlichen Umkippens der Tiere im Amerikanischen als „Keel Disease“ bezeichnet (PRICE et al. 1962; HENRY 2000). In der Regel dauert die klinische Erkrankung 4-5 Tage. Später können Arthritis und Synovitis an den Füssen hinzukommen. Wenn sich ältere Tiere infizieren, sind zunächst weder klinische Anzeichen noch ein Abfall der Legeleistung zu beobachten. Latente Salmonelleninfektionen sollen sich jedoch später in Arthritiden, Amyloidosis, fibrinöser Degeneration der Milz und anderen chronischen Organerkrankungen äußern können (KÖHLER et al. 1996; HENRY 2000). Die S. Typhimurium-Salmonellose ist vor allem eine Erkrankung der Küken mit Verlusten in der ersten Lebenswoche (KÖHLER et al. 1996). Bei älteren Mastenten sind S. Typhimurium-Septikämien selten. Die Erkrankung tritt nur noch als sporadische Erkrankung einzelner Organe in Erscheinung. Bei der septikämischen S. Typhimurium-Infektion in der ersten Lebenswoche der Ente beschränken sich die Organveränderungen auf Schwellungen, perivaskuläre Infiltrationen und Stauungserscheinungen der Leber und Lunge, Lungenödem sowie Vergrößerung der Milz. Eine fibrinöse Perikarditis, fibrinös-eitrige Polyserositis sowie Proliferation der weißen Pulpa und Nekrosen in der Milz wurden nur selten festgestellt (KÖHLER et al. 1996). PRICE et al. (1962) beobachteten bei meist mit S. Typhimurium infizierten Entenküken klinische Anzeichen einer Salmonellose, bis die Tiere in Folge von Dehydrierung und Erschöpfung teilweise zitternd und mit Opisthotonus starben. In der Leber fanden sich kleine nekrotische Bezirke, in dem Caecum käsige Beläge und 2 LITERATUR 43 eine Verdickung der Wand sowie Impaktbildung im Rektum. Die Nieren waren blass und enthielten Urate. Auch bei Infektion mit S. Enteritidis kommt es laut KÖHLER et al. (1996) in der ersten Lebenswoche zu Septikämien. Im Gegensatz zu S. Typhimurium findet im Anschluss daran aber eine für eine S. Enteritidis-Salmonellose charakteristische lokale Absiedlung des Erregers auf den serösen Häuten und in den inneren Organen statt. Wie KÖHLER et al. (1996) weiterhin aufführen, sind für die generalisierte S. Enteritidis-Infektion eine fibrinöse Perikarditis, fibrinöse Polyserositis und Tumor lienis, zu einem Drittel mit Nekrosen und Poliferation der weißen Pulpa einhergehend, typisch. Des Weiteren ist eine fibrinös-eitrige Pneumonie kennzeichnend. Die größten Verluste sind zwischen dem 15. und 20. Lebenstag und ein erneuter Anstieg der Erkrankung zwischen dem 30. und 35. Lebenstag zu beobachten. Laut HEYN et al. (2005a) erkranken Pekingenten bzw. Mulardenten selten an Salmonellen, obwohl sie häufig infiziert sind. An Salmonellen erkranken in der Regel sehr junge Enten, meist unmittelbar nach dem Schlüpfen. Die Symptome sind ähnlich wie bei anderen bakteriellen Infektionen. Die Tiere sind apathisch und nehmen weniger Futter und Wasser auf. Hinzu kommt ein Durchfall, der die Tiere austrocknen lässt. Zentralnervöse Störungen bis hin zum Koma und raschem Tod sind möglich. 2.2.2.2 Huhn In Eintagsküken können Paratyphus-Infektionen zu großer Morbidität und hoher Mortalität führen, während bei älteren Vögeln die intestinale Kolonisation und auch die systemische Ausbreitung von Salmonellen im Allgemeinen ohne signifikante Morbidität und Mortalität einhergeht (GAST u. BEARD 1989; DESMIDT et al. 1997). Bei adulten Legehennen wurde nach experimenteller Infektion mit S. Enteritidis (KINDE et al. 2000) nur gelegentlich von Mortalität und leichten klinischen 44 2 LITERATUR Erscheinungen wie milder Diarrhöe und Depression bis zu drei Tagen berichtet. Ausgewachsene Vögel werden allerdings wieder hochempfänglich für die Infektion, wenn sie mausern (CORRIER et al. 1997). Dabei können S. Enteritidis-Infektionen zu Darmentzündungen führen (HOLT 2003). Diese altersabhängigen Unterschiede in der Empfänglichkeit von Paratyphus-Infektionen wurden bei vielen verschiedenen Serovaren, wie z. B. S. Hadar (DESMIDT et al. 1998) beobachtet. Bei einigen Paratyphus-Infektionen ist die Klinik charakterisiert durch ein oder mehrere der folgenden Symptome: Störungen des Allgemeinbefindens, Anorexie, Adipsie, Zusammenkauern, gesträubte Federn, Bewegungsunlust, Somnolenz, Dehydrierung, weiße Diarrhöe und verklebte Kloaken (SCHAAF 1936; McILROY et al. 1989; BASKERVILLE et al. 1992; MARTHEDAL 1977). Die genannten klinischen Erscheinungen und Mortalität wurden nur für eine begrenzte Anzahl von Serovaren berichtet. Unter anderem sind diese S. Enteritidis (DESMIDT et al. 1997), S. Typhimurium (BARROW et al. 1987a; BUMSTEAD u. BARROW 1988), S. Hadar (DESMIDT et al. 1998) und S. Heidelberg (ROY et al. 2001). BARROW et al. (1987b) beobachteten, dass hohe Mortalitätsraten bei Hühnern im Allgemeinen mit Diarrhöe einhergehen. Bei Broilern wurde nach der Infektion mit S. Typhimurium verzögertes Wachstum, Blindheit, verdrehte Hälse und Lahmheit beobachtet. Die Mortalitätsrate des Bestandes betrug in verschiedenen Herden in den ersten beiden Lebenswochen zwischen 1,7 % bis 10,6 % (PADRON 1990). McILROY et al. (1989) verzeichneten bei Broilern, die mit S. Enteritidis PT 4 infiziert waren, Mortalitätsraten von 2 % innerhalb der ersten 48 Stunden und eine Gesamtmortalität von 6 % bei einer Morbiditätsrate von 20 % bis zum fünften Lebenstag. Legehennenherden sind trotz der Isolierung von S. Enteritidis aus Kot, Staub und Einstreu oft klinisch unauffällig (HINTON et al. 1989, McILROY et al. 1989). Im chronischen Stadium ist ein verzögertes Wachstum üblicherweise die einzige deutliche Folge (O’BRIEN 1988; DESMIDT et al. 1998). Die Dosis, die für eine Infektion benötigt wird, ist vom Alter abhängig und nimmt mit steigendem Alter zu (SADLER et al. 1969). So wird bei 2 LITERATUR 45 Eintagsküken von COX et al. (1988) sowie von MILNER und SHAFFER (1952) eine Infektionsdosis von nur 10 Keimen beschrieben, während 106 Bakterien in einer Studie von SADLER et al. (1969) bei der Hälfte von acht Wochen alten Hühnern nicht in der Lage waren, eine Infektion zu induzieren. Viele Paratyphus-Serovaren scheinen unter keiner Bedingung klinische Anzeichen zu verursachen. Sie besiedeln zeitweise den Darm und verschwinden innerhalb von Tagen oder Wochen (HEYNDRICKX et al. 2002). Einige Serovaren können jedoch innere Organe für Wochen besiedeln (VAN IMMERSEEL et al. 2004). S. Enteritidis ist bei adulten Legehennen die wichtigste Serovar. Nur wenige S. Enteritidis-Isolate verursachen nach experimenteller oraler Infektion einen Abfall der Legeleistung (GAST 1994). In natürlich infizierten Legehennenherden blieb die Legeleistung innerhalb der normalen Bandbreite (AWAD-MASALMEH u. THIEMANN 1993). Bis heute ist unklar, wie die Serovar Enteritidis vorzugsweise Hühnereier infiziert, ohne klinische Symptome oder einen Abfall der Legeleistung zu verursachen (DE BUCK et al. 2004a). 2.2.2.3 Pute Laut HAFEZ und JODAS (2000) sind Salmonellen-Infektionen die bedeutsamsten bakteriellen Erkrankungen auf dem Putenzüchter-Sektor und können zu hohen Verlusten im ersten Monat nach dem Schlupf führen. Nach BIERER (1960) beträgt die Inkubationszeit 2 bis 5 Tage. Bei jungen Tieren soll die Mortalität von 0 % bis zu 10-20 % variieren und bei schweren Krankheitsausbrüchen 80 % und mehr erreichen. Die Schwere des Ausbruches hängt dabei von der beteiligten Serovar ab. 46 2 LITERATUR Symptome, die vor allem bei jungen Tieren auftreten, sind Somnolenz, Schwäche, hängende Flügel, gesträubte Federn sowie Zusammenkauern in Gruppen an warmen Stellen. Tiere, die die ersten Tage überleben, magern ab und die Federn in Kloakennähe sind kotverschmiert. Diarrhöe ist allerdings kein konstantes Symptom. Lahmheit, verursacht durch Arthritis als Folge einer systemischen Infektion, kann auftreten (HAFEZ u. JODAS 2000). Ältere Puten zeigen für gewöhnlich keine oder nur geringe Anzeichen einer Erkrankung (HAFEZ u. JODAS 2000). Beinschwächen bei erwachsenen Tieren sollen allerdings nicht ungewöhnlich sein. HIGGINS et al. (1944) beschreiben eine mit Salmonellen infizierte 24-Wochen alte Putenherde, die so schwer arthritisch erkrankte, dass 10 % der Tiere nicht zu vermarkten waren. 2.2.3 Bekämpfungsstrategien Da das Geflügel eine der Hauptquellen für die Infektion des Menschen mit Salmonellen darstellt (HARTUNG 2004), ist die Bekämpfung beim Geflügel von großer Bedeutung und wird durch die Verordnung EG Nr. 2160/2003 des Europäischen Parlaments und des Rates vom 17. November 2003 vorgeschrieben. Die Verordnung erstreckt sich dabei beim Geflügel auf Gallus-gallus-Zuchtherden, Legehennen, Masthähnchen und Puten. Enten werden in der Verordnung nicht aufgeführt. Ausdrücklich werden S. Enteritidis und S. Typhimurium als zu bekämpfende Serovaren genannt. Die Wirtschaftsgeflügelhaltung stellt die Vorstufe der Lebensmittelerzeugung dar. Ein Qualitätssicherungssystem muss daher schon in den Bereichen Zucht, Brut und Mast beginnen. Dies gilt insbesondere für die Salmonellenproblematik. Da eine Vielzahl der Überträger von Salmonellen nicht nur aus der freien Natur (Vögel, Nagetiere, 2 LITERATUR 47 Käfer etc.) bekannt sind, ist der Schutz vor einer Reinfektion entsprechend aufwendig (SÜDBECK 2005). Während für die Ente keine Angaben über eine genetisch fixierte Resistenz gegen eine Salmonellose in der Literatur vorliegen, ist dies für Hühnerlinien beschrieben worden (BUMSTEAD u. BARROW 1988, 1993). Der Mechanismus der Resistenz wird zurzeit noch diskutiert (BUMSTEAD u. BARROW 1988; COTTER et al. 1998; KRAMER et al. 1999; MARIANI et al. 2001; WIGLEY et al. 2002; BARROW et al. 2003). Ein Problem wird jedoch darin gesehen, dass die züchterische Selektion auf eine verminderte Mortalität bei bestehender Salmonelleninfektion gleichzeitig zu einer höheren Anzahl asymptomatisch infizierter Tiere führen könnte (JANSS u. BOLDER 2000). Da dies unter Zoonoseaspekten nicht erwünscht sein kann, wurde die Forderung gestellt, nicht die Erkrankungsrate, sondern den Trägerstatus züchterisch zu senken (BEAUMONT et al. 2003). Nachfolgend sollen wichtige Maßnahmen zur Bekämpfung von Salmonellen im Geflügelbestand dargestellt werden. Es handelt sich hierbei um Maßnahmen der Hygiene, der Anwendung von Probiotika oder Competitive Exclusion Flora, der antibiotischen Therapie und der Immunisierung. 2.2.3.1 Hygienemaßnahmen Hygienemaßnahmen nehmen eine herausragende Stellung in der Prophylaxe von Salmonellen-Infektionen ein (FRIES 2005). Die wichtigsten werden im Folgenden kurz erläutert. Haltung Bei der Ente (KÖHLER et al. 1996) haben die Umstellung von der Auslaufhaltung zur ganzjährigen Stallhaltung auf Strohhäcksel sowie der Verzicht auf Schwimmrinnen im Auslauf, in denen sich Schmutzwasser anreichert, zur Reduzierung von 48 2 LITERATUR Salmonellen-Infektionen beigetragen. Saubere Legenester und die TränkwasserVersorgung über Nippeltränken wurden eingeführt und trugen ebenfalls zur Abnahme der Salmonellen-Infektionen bei, da so eine fäkale Verunreinigung des Tränkwassers unterbunden wird. FRIES (2005) empfiehlt zudem Stroh bekannter, eventuell mikrobiologisch geprüfter Herkunft zu verwenden und die Einstreu trocken zu halten. Futter Auch Futter kann Salmonellen enthalten und die Ursache für die Infektion von Geflügel sein (POPPE 2000). Zur Futtermitteldekontamination eignen sich Gammaoder energiereiche Elektrodenstrahlen. Diese Verfahren sind jedoch nicht in allen Ländern zugelassen (HEIDER u. MONREAL 1992). Die chemische Behandlung des Futters kann durch Zusatz von organischen Säuren erfolgen, wobei jedoch die Abtötung von Salmonellen nicht stets gewährleistet ist (VOGT et al. 1981, 1982; IZAT 1990). Des Weiteren gibt es die Möglichkeit, Salmonellen im Futter durch Erhitzung alleine (HIMATHONGKHAM et al. 1996) oder in Kombination mit organischen Säuren (MATLHO et al. 1997) abzutöten. Die thermische Dekontamination wird durch die Erhitzung beim Pelletierungsvorgang versucht (McILROY et al. 1989). COX et al. (1986) beobachteten, dass die Dampf-Konditionierung und Pelletierung von kommerziellem Geflügelfutter zu einer Reduktion von Enterobakterien führt. Nach der Pelletierung unter Hochdruckdampf waren keine Salmonellen im Futter mehr nachzuweisen. Einer möglichen Rekontamination des behandelten Futters durch salmonellenhaltigen Staub ist durch entsprechende Entlüftung und Lagerung Vorsorge zu tragen (HEIDER u. MONREAL 1992; HENRY 2000). KÖHLER et al. (1996) konnten u. a. durch die Veränderung der Fütterungstechnik eine Reduzierung von Salmonellen-Infektionen bei der Ente erreichen. Es erfolgte die Umstellung vom Futterautomaten, in dem das Futter teilweise lange verweilte und ein Verkoten möglich war, auf eine Rohrfütterungsanlage (REETZ 2005, persönliche Information). 2 LITERATUR 49 Reinigung, Desinfektion und Schädlingsbekämpfung Um den auf das Betriebsareal beschränken Infektionszyklus zu unterbrechen, ist eine gründliche Reinigung und Desinfektion aller Räumlichkeiten, Geräte, Fahrzeuge, Wege und Behältnisse notwendig (HEIDER u. MONREAL 1992; FRIES 2005). Zur Desinfektion eignen sich Präparate, die als Wirkstoffe Aldehyde, Phenol oder Chlor bzw. Chlorverbindungen enthalten (HEIDER u. MONREAL 1992), aber auch die Behandlung mit Formaldehyd (DAVIES u. WRAY 1995) und vor allem Peressigsäure (THAMLIKITKUL et al. 2001; VADHANASIN et al. 2004) wird empfohlen. FRIES (2005) empfiehlt nur auf ihre Wirksamkeit gegenüber Salmonellen geprüfte Desinfektionsmittel zu verwenden und die vorgeschriebenen Gebrauchskonzentrationen und Einwirkzeiten einzuhalten. Deutliche Verbesserungen bei der Dekontamination ließen sich nach Aufdeckung und anschließender Korrektur von Fehlern bei der Anwendung und Verdünnung von Desinfektionsmitteln erzielen (DAVIES u. WRAY 1996). Die Wirksamkeit von Reinigung und Desinfektion auf das Vorkommen von Salmonellen bei verschiedenen Haltungssystemen wurde von DAVIES und BRESLIN (2003) untersucht. Sie zeigten auf, wie schwierig es ist, eine salmonellenfreie Umgebung zu schaffen und wie wichtig dabei eine gründliche Reinigung vor der Desinfektion mit geeigneten Mitteln ist. So konnte beispielhaft an der Reinigung von Transportkisten gezeigt werden, dass eine sichere Desinfektion der anhaftenden Salmonellen mit 70 °C heißem Desinfektionsmittel in kurzer Zeit erfolgreich war, wenn zuvor eine Reinigung mit Detergenzien erfolgt war (RAMESH et al. 2003). Nager, vor allem Mäuse (HENZLER u. OPITZ 1992; FRIES 2005), sowie Fliegen (OLSEN u. HAMMACK 2000; MIAN et al. 2002; LIEBANA et al. 2003; MOORE et al. 2003) und Käfer (SKOV et al. 2004) spielen eine Rolle bei der Übertragung von Salmonellen. So konnten SKOV et al. (2004) nach einer vorausgegangenen Infektion von Broilern mit S. Indiana später nach Ausstallung der Tiere und bereits erfolgter Reinigung und Desinfektion des Stalles dieselbe Salmonella-Serovar in kontaminierten Käfern nachweisen. DAVIES und BRESLIN (2003) sowie FRIES 50 2 LITERATUR (2005) fordern deshalb neben der Reinigung und Desinfektion die gleichzeitige Schädlingsbekämpfung einschließlich einer strikten Kontrolle der getroffenen Maßnahmen. Brüterei und Bruteibehandlung In etwa 10 % untersuchter Staubproben aus Entenbrütereien (KÖHLER et al. 1996), ließen sich Salmonellen nachweisen. Hierbei handelte es sich zu 77 % um S. Enteritidis und S. Typhimurium. Brütereistaub spielt eine nicht unwesentliche Rolle in der Übertragung von Salmonellen und erschwert den Reinigungs- und Desinfektionsprozess. So konnte die Zahl Salmonellen-infizierter Küken signifikant gesenkt werden (MITCHELL et al. 2002), wenn er durch elektrische Felder abgefangen und anschließend herausgewaschen wurde. COX et al. (1990) wiesen in mehr als zwei Drittel von Proben aus verschiedenen Broiler-Brütereien verschiedene Salmonellen einschließlich S. Typhimurium nach. Die Präsenz und Persistenz von Salmonellen in den Broiler-Brütereien zeigen an, dass sich Küken eher in der Brüterei als während der Aufzucht mit Salmonellen infizieren können (COX et al. 1990). Dies bestätigen auch CASON et al. (1994). Sie beschreiben die Übertragung von S. Typhimurium von infizierten Broiler-Eiern auf Küken aus Salmonellen-freien Bruteiern im selben Brüter. Laut COX et al. (1991) haben viele Studien nachgewiesen, dass aus Brütereien isolierte SalmonellaSerovaren auch später während der Aufzucht und sogar von den Schlachtkörpern isoliert werden können. Somit stellen Salmonellen bei Bruteiern einen „Critical Control Point“ dar (COX et al. 2000). Die Kenntnis dieses Risikos führte u. a. zu den Richtlinien 90/539/EWG und 1999/90/EG zur Bruteibehandlung aus Drittländern. Bruteier können Salmonellen entweder auf, in oder unterhalb der Eischale tragen (DORN 1970; COX et al. 1991). Besonders Enteneier bieten Salmonellen durch ihre Schalenhaut-Morphologie NEURAND 1972). gute Bedingungen zur Persistenz (SCHWARZ u. 2 LITERATUR 51 Wie STORCK (2001) in ihrer Arbeit aufführt, stehen für die Bruteibehandlung physikalische, chemische und mechanische Verfahren zur Verfügung. Allerdings sind chemische Reinigungsverfahren nicht immer in den vom Hersteller angegebenen Konzentrationen wirksam (SOLJOUR et al. 2004). Außerdem erfassen die genannten Verfahren in der Regel nicht bereits in das Eiinnere eingedrungene Bakterien (DORN 1970; HEIDER u. MONREAL 1992). Für die Entenbrut konnten KÖHLER et al. (1996) neben anderen Hygienemaßnahmen durch den Einsatz von Wasch- und Desinfektionsmaschinen für Bruteier eine Reduzierung von Salmonellen-Infektionen bei anschließenden Aufzucht der Enten im Feld beobachten. 2.2.3.2 Probiotika und Competitive exclusion (CE) Probiotika Probiotika sind lebende, mikrobielle Zusatzstoffe, die die Darmflora in einem für das Wirtstier positiven Sinne beeinflussen. Sie bestehen aus einem oder wenigen, genau definierten Mikroorganismus-Stämmen (WHO 1994). Am häufigsten werden Spezies aus den Genera Lactobacillus und Enterococcus verwendet (KLEIN 2000). Für Probiotika werden allgemein verschiedene Wirkungsmechanismen angenommen: die Erzeugung von kurzkettigen Fettsäuren, die als Hemmstoffe zu einer pH-Wert-Absenkung führen, sowie weiteren Substanzen, die gegen andere Mikroorganismen einen Selektionsvorteil bieten, ohne die gewünschte Darmflora zu unterdrücken. Ferner wird die Verdrängung bzw. Verhinderung des Anheftens potentiell pathogener Keime an der Darmschleimhaut diskutiert. Auch eine Hemmung bei der Bildung mikrobieller Toxine, die Stimulierung des lokalen Immunsystems im Darm oder die Beeinflussung der physikochemischen Verhältnisse im Darm, wie pH-Wert und Redox-Potential sowie die Beeinflussung des Gallensäureabbaus und damit Unterstützung der Fettabsorption werden angenommen. Zusätzlich wird eine Beeinflussung des Darmepithels sowie eine Verbesserung der Absorptionskapazität vermutet (AWT 1999). 52 2 LITERATUR So konnte nach Verabreichung geflügelspezifischer Probiotika an Hühner (PASCUAL et al. 1999) und an Broiler (TELLEZ et al. 2001) eine deutliche Herabsetzung der Besiedlung mit S. Enteritidis nachgewiesen werden. Nicht immer können durch die Verwendung von Probiotika zusätzliche Effekte erzielt werden (JOHANNSEN et al. 2004; PRIYANKARAGE et al. 2004). Dies könnte mit der unterschiedlichen Ausgangssituation bezüglich der mikrobiellen Besiedlung im Verdauungstrakt im Zusammenhang stehen (AWT 1999). Competitive exclusion (CE) Da intensiv aufgezogenes Junggeflügel nur langsam die komplexe intestinale Mikroflora älterer Vögel entwickelt, neigt es besonders zur Kolonisation mit Salmonellen (BARROW et al. 2003). Durch die Verabreichung von Mikroorganismen der Darmflora adulter Tiere an junge Tiere soll ein Schutz gegen pathogene kolonisierende Mikroorganismen übertragen werden. Dieses Verfahren wurde bereits 1992 von NURMI et al. bei der Bekämpfung der Salmonelleninfektion des Huhnes angewandt und mit der Bezeichnung „Competitive exclusion“ (CE) beschrieben. Kommerzielle CE-Produkte enthalten eine große Anzahl an verschiedenen, nicht genau definierten Keimen, die in der Regel aus dem Inhalt des Caecums adulter Spendertiere stammen. Ihre exakte Zusammensetzung ist i. d. R. unbekannt. Sie müssen jedoch vor Anwendung auf die Abwesenheit aller bekannten geflügel- und humanpathogenen Keime getestet werden (SELBITZ et al. 1995; BARROW et al. 2003). CE-Produkte definierter Zusammensetzung sollen weniger wirksam sein (STAVRIC u. D’AOUST 1993). Der genaue Mechanismus des inhibitorischen Effektes von CE-Produkten gegenüber der Kolonisation mit Salmonellen ist unbekannt. Für die Schutzwirkung sollen mehrere Mechanismen verantwortlich sein: die Konkurrenz um Nährstoffe und bei der Adhäsion an die Mukosa, ein geringes Redoxpotential, die Produktion von 2 LITERATUR 53 Schwefelwasserstoff sowie die Bildung von antibakteriellen Substanzen wie kurzkettige Fettsäuren und Bacteriocine (NURMI et al. 1992; BARROW et al. 2003). Viele unter Laborbedingungen durchgeführte Studien (HINTON et al. 1990; ZIPRIN et al. 1990; CORRIER et al. 1991) sowie eine Feldstudie in Schweden (WIERUP et al. 1992) haben eine gewisse Wirksamkeit der CE-Anwendung gegen SalmonellenInfektionen bestätigt, jedoch stellt sich nur selten ein kompletter Schutz ein (MEAD 2000). Nach Verabreichung einer CE-Flora soll die zusätzliche Gabe von Laktose zum Futter zu einer Senkung des pH-Wertes im Caecum bei einer gleichzeitigen Erhöhung des Gehaltes an flüchtigen Fettsäuren führen. Dadurch wiederum soll die Kolonisierung mit S. Typhimurium gehemmt werden (OYOFO et al. 1989; CORRIER et al. 1990). Während auch Puten gegen eine Infektion mit Salmonellen durch die Verabreichung von CE-Zubereitungen aus Hühnern geschützt werden können sollen (IMPEY et al. 1982), konnte bei Enten bisher noch kein Effekt durch die Übertragung anaerober Kulturen der Darmflora adulter Tiere auf Jungtiere gezeigt werden (HENRY 2000). 2.2.3.3 Therapie In der EU wird das Ziel angestrebt, die Prävalenz der zoonotisch bedeutsamen Salmonellen in den Geflügelbeständen zu senken (VO EG Nr. 2160/2003 und Richtlinie 2003/99/EG des Europäischen Parlaments und des Rates vom 17. November 2003). Daher kann die Behandlung gegen Salmonellen nur eine Notmaßnahme sein. Prinzipiell wäre eine Therapie mit einer Vielzahl von Antibiotika und Chemotherapeutika möglich. Salmonellen in Großbritannien zeigen eine gute in vitro 54 2 LITERATUR Sensitivität gegen Amoxycillin, Chloramphenicol, Colistin, Enrofloxacin, Neomycin, Spectinomycin, Streptomycin, Tetrazykline und Trimethoprim (HENRY 2000). Die Anwendung von Chloramphenicol ist jedoch verboten und Neomycin und Colistin werden kaum resorbiert, weshalb sie sich zur Therapie einer extraintestinalen Infektion kaum eignen. Enrofloxacin wurde teilweise erfolgreich zur Elimination von S. Enteritidis in Enten-Elterntierherden eingesetzt (HENRY 2000). Welche Antibiotika und Chemotherapeutika zugelassen sind, hängt von den rechtlichen Bestimmungen der einzelnen Staaten ab (HENRY 2000; BARROW et al. 2003). Da in Deutschland derzeit jedoch kein ausdrücklich für die Ente, gegen Salmonellen wirksames, zugelassenes Antibiotikum bzw. Chemotherapeutikum auf dem Markt ist, käme eine Anwendung im Therapienotstand nur nach Umwidmung infrage (UNGEMACH 2003). Dieses würde für die Ente nach § 12a der Tierärztlichen Hausapotheken-Verordnung eine Mindestwartezeit von 28 Tagen für essbare Gewebe nach sich ziehen und ist somit für Enten-Mastherden in der Regel nicht praktikabel. Bei einer heute teilweise üblichen Mastdauer von 42 Tagen wäre der Einsatz von Antibiotika längstens bis zum 14. Lebenstag möglich. Die Anwendung kann zudem nur durch empirische Dosisschemata bzw. Dosisextrapolation erfolgen (UNGEMACH 2003), da für die Ente keine Darreichungsformen und Dosierungen in der Zulassung geprüft wurden. Somit sind auch keine minimalen Hemmstoffkonzentrationen (MHK-Werte) bzw. therapeutische Level bekannt. Ferner kann ein antibiotisches Vorgehen aus therapeutischen Gründen oder gar als reine Prophylaxemaßnahme nicht als Mittel der Wahl zur Bekämpfung von Salmonelleninfektionen angesehen werden, da bereits heute zunehmend Einfach- und auch Mehrfachresistenzen gegenüber gängigen Antibiotika bei Salmonellen beobachtet werden (THRELFALL et al. 1997; HELMUTH 2000; SCHROETER et al. 2004), wie dies auch verschiedene Monitoring-Programme dokumentieren (HELMUTH u. PROTZ 1997; HELMUTH et al. 2004; SCHROETER et al. 2004). So zeigte ein Forschungsvorhaben des Bundesinstituts für Risikobewertung (BfR) bereits 2003 eine Prävalenz von Resistenzen bei Isolaten aus Geflügel von ca. 54 % auf. 2 LITERATUR 55 Insbesondere der massive Einsatz von Chinolonen und Fluorochinolonen seit Mitte der 80er Jahre führte zu einer steigenden Anzahl Resistenzen bei Salmonellen (PIDDOCK et al. 1990; WRAY et al. 1990; OTEO et al. 2000). Dies drückt sich darin aus, dass im Jahre 2000 und 2001 Isolate vom Geflügel durchschnittlich mit etwa 11 % resistent waren, bei S. Hadar mehr als 40 % der Isolate. Im Jahr 2003 lag der Anteil Chinolon-resistenter Isolate vom Geflügel mit 26 % bereits signifikant höher (SCHROETER et al. 2004), eine verminderte Fluorochinolon-Empfindlichkeit lag sogar bei einigen Serovaren vom Geflügel in mehr als 50 % der untersuchten Isolate vor (MALORNY et al. 2003). 2.2.3.4 Immunisierung Zwischen 1985 und 1990 stieg die Prävalenz von Infektionen mit S. Enteritidis im Menschen markant an. Dieses wurde v. a. mit dem Verzehr von Eiern in Verbindung gebracht (MEYER et al. 1993b; BARROW et al. 2003). Gegenwärtig sind S. Enteritidis und S. Typhimurium zusammen an mehr als 80 % der Erkrankungen des Menschen durch Salmonellen beteiligt, wobei S. Enteritidis die vorherrschende Serovar ist (DORN et al. 2000; ALPERS u. JANSEN 2004; HARTUNG 2004). Bei S. Enteritidis wird der Phagentyp 4 zurzeit am häufigsten sowohl aus dem Menschen als auch aus dem Geflügel isoliert (NASTASI u. MAMMINA 1996; BOONMAR et al. 1998; SCHROETER et al. 2000; BERGHOLD u. KORNSCHOBER 2004; NYGARD et al. 2004). Bei S. Typhimurium dominiert der Phagentyp DT104, gefolgt von DT8 und DT9 in Probenmaterial vom Menschen (SCHROETER et al. 2000), während bei der Pekingente der Phagentyp DT8 deutlich im Vordergrund steht (KÖHLER et al. 1996). Das gehäufte Auftreten von S. Enteritidis-Infektionen des Menschen, an denen vorwiegend Rohspeisen mit Hühnereiern beteiligt waren, führte im Jahr 1992 auf EGEbene zu der Verabschiedung der Richtlinie 92/117/EWG (PITTLER 1993). Die nationale Umsetzung dieser Richtlinie folgte im Jahr 1994 durch den Erlass der 56 2 LITERATUR Hühner-Salmonellen-Verordnung (RABSCH 2000). Diese verfolgt das Ziel, die Prävalenz der Salmonellen-Infektionen bei Hühnern zu senken. Die Impfpflicht gegen S. Enteritidis und S. Typhimurium in Aufzuchtbeständen mit mehr als 250 Tieren ist dabei ein wesentlicher Bestandteil. Während einige wirtsadaptierte Serovaren wie S. Gallinarum beim Geflügel, S. Choleraesuis beim Schwein oder S. Dublin beim Kalb als Krankheitserreger für den jeweiligen Wirt, jedoch in der Regel nicht für den Menschen gelten (BLAHA 1993, SELBITZ et al. 1995; BARROW et al. 2003), sind andere, nicht wirtsadaptierte Serovaren wie S. Enteritidis und S. Typhimurium (SELBITZ et al. 1995) als Zoonoseerreger zu beachten. Daher zielt die Impfung von Geflügel nicht auf die Gesundheit der Tiere oder die Produktivität ab, sondern soll vorrangig dem Schutz der Gesundheit der Bevölkerung dienen (BARROW et al. 2003; EFSA 2004). Ziel der Impfung gegen Salmonellen ist, die Prävalenz von Salmonellen im Geflügelbestand abzusenken und einen Abriss der Infektkette von Tier zu Tier und vom Tier zum Menschen zu bewirken (HAHN u. SCHÖLL 1984; LINDE et al. 1996; HAHN 1999; EFSA 2004). Die Besiedlung mit Feld-Salmonellen kann durch Impfungen alleine zwar nicht vollständig verhindert, zumindest aber doch reduziert werden (MEYER et al. 1993a; CSEREP 2001; EFSA 2004; SCHRÖDER et al. 2004; BEHR et al. 2005). Die Ansprüche, die laut BARROW et al. (2003) an eine ideale Salmonellen-Vakzine gestellt werden, sind die Verhinderung des Krankheitsausbruchs durch die vorherrschenden Salmonellen-Serovaren und deren verwandte Serovaren. Sie soll die Dauer und das Ausmaß der Ausscheidung minimieren, nicht zu symptomlosen Trägern führen, daneben von unerwünschten Nebeneffekten frei sein und die Immunität stimulieren, welche auf die Nachkommen übertragen werden soll. Des Weiteren soll die aktive Immunität auch bei Anwesenheit von maternalen Antikörpern rasch angeregt werden, und der Impfstoff einfach anzuwenden sein. Lebendvakzinen sollen stabil sein und keine Virulenzsteigerung erfahren. Die mit dem Impfstoff 2 LITERATUR 57 applizierten Stämme sollen von Wildtyp-Stämmen zu unterscheiden sein und nicht ohne weiteres in der Umwelt überleben können. Während inaktivierte Vakzine nur zu einer humoralen Immunität führen, bewirken Lebendimpfstoffe neben der humoralen auch eine zellvermittelte Immunität (BARROW 2005; BEHR et al. 2005). Diese ist von größerer Bedeutung für den Schutz gegen Salmonellen (SELBITZ et al. 1995; HAHN 1999; BARROW 2005). Oral verabreichte attenuierte Salmonellen-Lebendimpfstoffe bieten den besten Schutz gegen eine Salmonellen-Infektion, besonders wenn große Belastungs- („challenge“-) Dosen verabreicht werden. Dieser bessere Schutz beruht auf der Fähigkeit der Lebendimpfstoffe, eine effektivere zellvermittelte Immunantwort zu stimulieren als inaktivierte Zubereitungen (Totimpfstoffe). Die orale Verabreichung erlaubt den attenuierten Impfstämmen den natürlichen Weg der Infektion zu nutzen, das Antigen den Lymphozyten des darmassoziierten Lymphgewebes zu präsentieren und die Produktion von sekretorischem IgA auf den Mucosa-Oberflächen im Körper zu induzieren (CLARKE u. GYLES 1993). Die Wirksamkeit von Lebendimpfstoffen (BARROW et al. 1990, 1991; HASSAN u. CURTISS III 1996, 1997; LINDE et al. 1996) sowie deren Überlegenheit im Vergleich zu Totimpfstoffen (BARROW et al. 1990) ist in einer Vielzahl von Studien beim Huhn nachgewiesen worden. So konnten in einer Studie bei Hühnern (BARROW et al. 1990), die mit Lebendimpfstoffen immunisiert wurden, deutlich weniger und über einen kürzeren Zeitraum Salmonellen nachgewiesen werden, als bei ungeimpften Tieren. Ein gleichzeitig verwendeter Totimpfstoff hatte kaum einen Effekt auf die Ausscheidung des Challenge-Stammes. In einem Wirksamkeitsversuch bei Hühnern (HAHN 1999), in dem vergleichend verschiedene Inaktivatimpfstoffe und ein Lebendimpfstoff geprüft wurden, wurde bewiesen, dass nur der Lebendimpfstoff eine Organmanifestation und Ausscheidung des Infektionsstammes verhindert bzw. im Vergleich mit ungeimpften Kontrollen reduziert. Obwohl für die Ente bisher keine Lebendimpfstoffe zugelassen sind, wurde ihre Wirksamkeit in Feldstudien bereits erfolgreich geprüft (KÖHLER et al. 1996; BEHR et al. 2005). In Anbetracht der 58 2 LITERATUR Immunmechanismen und in Folge des intrazellulären Parasitismus der Salmonellen kann man davon ausgehen, dass auch bei der Ente Lebendimpfstoffe effektiver als Totimpfstoffe sein werden (SELBITZ et al. 1995; HENRY 2000). Die Immunisierung älterer Enten entweder mit dem Totimpfstoff Bovivac® (Intervet, Großbritannien), der S. Typhimurium-Antigen enthält, oder mit der inaktivierten S. Enteritidis-Vakzine Salenvac® (Intervet, Großbritannien) soll zwar die Übertragung dieser Salmonellen über das Ei nicht verhindert, jedoch reduziert haben (HENRY 2000). Die Weitergabe von maternalen Antikörpern über das Ei an die Nachkommen von Hühnern nach Immunisierung mit Lebendimpfstoffen oder avirulenten Stämmen ist vielfach untersucht worden (METHNER et al. 1994, 2002; HASSAN u. CURTISS III 1996; METHNER u. STEINBACH 1997; BARMAN et al. 2005). In einer Studie von HASSAN und CURTISS III (1996) hatten die Hühnerküken von Hennen, die mit einem avirulenten S. Typhimurium-Stamm infiziert waren, nach der Infektion mit einem anderen, virulenten S. Typhimurium-Stamm einen signifikant höheren Antikörper-Titer als die Küken nicht infizierter Hennen. Die Verteilung maternal übertragener Salmonella-Antikörper und deren protektive Wirkung wurde bei Nachkommen von Broilerelterntieren, die mit S. Typhimurium-Lebend- und S. Enteritidis-Inaktivatimpfstoffen vakziniert worden waren, untersucht (METHNER u. STEINBACH 1997). Die Immunisierung führte zu einer signifikanten Erhöhung der Antikörperkonzentration im Eidotter der Bruteier, sowie im Serum und Jejunum der Küken. Ein erhöhter Antikörpertiter wurde noch am 21. Lebenstag nachgewiesen. Im Infektionsmodell wurde die Wirksamkeit der maternalen Antikörper gegen eine S. Enteritidis-Infektion untersucht. Dabei kam es im Caecum von Nachkommen immunisierter Elterntiere vom 7. bis 21. Lebenstag zu signifikant geringeren Keimzahlen als bei Kontrolltieren. In einer anderen Studie von METHNER et al. (2002) wiesen die Nachkommen vakzinierter Elterntiere im Vergleich zu den Kontrolltieren nicht immunisierter Elterntiere im Caecum eine reduzierte Keimzahl 2 LITERATUR 59 des an sie verabreichten Impfstammes auf. Dabei wurde die Wirksamkeit der aktiven Immunisierung durch die reduzierte Impfstammkolonisation nicht beeinträchtigt. Bei der Ente konnte in kontrollierten Feldversuchen durch die Immunisierung von Pekingelterntieren ab 1987 mit dem für das Huhn bzw. Rind entwickelten S. Typhimurium-Lebendimpfstoff Zoosaloral H bzw. Zoosaloral R „Dessau“® (Impfstoffwerk Dessau-Tornau) ein starker Rückgang der Salmonellen-Infektionen beobachtet werden (HAHN 1990; MEYER et al. 1993a; KÖHLER et al. 1996). Später untersuchten KÖHLER et al. (1996) in einer Feldstudie zunächst die Effektivität des für das Huhn entwickelten S. Typhimurium-Lebendimpfstoffes TAD Salmonella vac® T (LAH, Cuxhaven) zur Bekämpfung der Salmonelleninfektionen bei Pekingenten in Norddeutschland. Hierbei wurden die Entenelterntiere vier und zwei Wochen vor Beginn der ersten Legeperiode (Alter 21. und 23. Lebenswoche) sowie vier und zwei Wochen vor der zweiten Legeperiode (75. und 77. Lebenswoche) mit der doppelten Impfdosis für Hühner von 2 x 108 KbE pro Ente in 1 ml Resuspensionsflüssigkeit subkutan im Nacken vakziniert. Die Vakzination wurde von den Enten weitgehend ohne Nebenwirkungen vertragen. In Kombination mit einer konsequenten Hygiene führte die Impfung in Entenzuchtbetrieben und Elterntierfarmen mit TAD Salmonella vac® T zu einer Sanierung der latenten S. Typhimurium-Ausscheider, wodurch die Übertragung der Feldstämme von S. Typhimurium mit dem Brutei auf die nächste Kükengeneration und in den Mastentenbeständen unterbrochen wurde. Die Nachweisrate von S. Typhimurium in den Enteneiern reduzierte sich von 18,4 % vor der Vakzination auf 0,0 % nach der Impfung. TAD Salmonella vac® T erwies sich auch als effektiv gegen andere Serovaren der Gruppe B. Der Impfstoff war nicht wirksam gegen S. Enteritidis (Gruppe D) und gegen Salmonella-Serovaren der Gruppen C und E. Aufgrund der unzureichenden Kreuzimmunität des S. Typhimurium-Lebendimpfstoffes TAD Salmonella vac® T gegen Infektionen mit S. Enteritidis hatte die Vakzination keine vollständige Eliminierung der latenten Ausscheider von S. Enteritidis zur Folge. 60 2 LITERATUR Laut KÖHLER et al. (1996) weisen der regelmäßige Nachweis von S. Enteritidis PT 4 in Enten und in Brutstaubproben sowie vereinzelte Befunde in Enteneiern auf vertikal von den Zuchtenten bzw. von der Brüterei ausgehende Infektionsketten hin, die auch nach Einführung der Elterntierimpfung mit S. Typhimurium-Lebendimpfstoff TAD Salmonella vac® T nicht unterbrochen werden konnten. Dagegen kommt es nach Vakzination von Hühnern mit einem S. Typhimurium-Lebendimpfstoff zu einer teilweisen Kreuzimmunität auch gegenüber der Infektion mit S. Enteritidis (VIELITZ et al. 1992; MEYER et al. 1993a, LINDE et al. 1996; HASSAN u. CURTISS III 1997). Somit sind laut KÖHLER et al. (1996) zur Bekämpfung der S. Enteritidis- und S. Typhimurium-Infektionen auf jeden Fall Impfstoffe gegen beide Erreger erforderlich. Wegen der zunehmenden Belastung der Pekingenten mit S. Enteritidis wurde 1996 die S. Enteritidis-Lebendvakzine TAD Salmonella vac® E (LAH, Cuxhaven) zunächst bei Mastenten einer akut erkrankten Mastentenherde getestet (KÖHLER et al. 1996). Nach der parenteralen Immunisierung - subcutan im Nacken - am 14. und 28. Lebenstag traten in der Vakzinationsgruppe im Gegensatz zu der Kontrollgruppe keine durch S. Enteritidis hervorgerufenen Erkrankungen oder Todesfälle auf. Zum Zeitpunkt der Schlachtung am 45. Lebenstag hatte sich im Organnachweis der Anteil der mit S. Enteritidis infizierten Tiere in der geimpften Versuchsgruppe auf 2 % reduziert, während die ungeimpfte Kontrollgruppe eine Infektionsrate von 32 % aufwies. Drei Wochen nach der Immunisierung mit TAD Salmonella vac® E reduzierte sich die Nachweisrate von S. Enteritidis in Kloakentupferproben der geimpften Mastenten auf 0,25 % im Verhältnis zu 4,80 % in der nichtvakzinierten Kontrollgruppe. In einer Zuchtentenherde konnten nach der Vakzination mit TAD Salmonella vac® E keine S. Enteritidis-Feldisolate in Kloakentupferproben nachgewiesen werden. Die Immunisierung von zwei Zuchtentenherden im Rahmen der klinischen Erprobung von TAD Salmonella vac® E hatte innerhalb von zwei Monaten zu einer einschneidenden Reduzierung der S. Enteritidis-Infektionen auch in den davon abstammenden 2 LITERATUR 61 Mastentenherden geführt. Die kombinierte Immunisierung mit TAD Salmonella vac® E und TAD Salmonella vac T bei Zuchtenten erwies sich somit wirksam bei der Eliminierung latenter Salmonellen-Infektionen im Bestand und führte damit zur Verhinderung der Übertragung von S. Typhimurium und S. Enteritidis an die Nachkommen. (KÖHLER et al. 1996). Die Vakzination von Enten-Eintagsküken zur Prävention von S. Enteritidis- oder S. Typhimurium-Infektionen wurde bisher nicht untersucht (HENRY 2000). 62 3 3 MATERIAL UND METHODEN Material und Methoden Die vorliegende Arbeit gliedert sich in Vorversuche und in Hauptversuche. Die Vorversuche sind ihrerseits in zwei Abschnitte gegliedert, wobei Untersuchungen im zweiten Abschnitt auf Ergebnissen des Ersten aufbauen. Im Folgenden werden die für die Untersuchungen verwendeten Tiere, die Materialien sowie der Versuchsablauf im Einzelnen vorgestellt. 3.1 Versuchstiere 3.1.1 Herkunft Bei den verwendeten Tieren handelte es sich um Pekingmastenten (Anas platyrhynchos forma domestica). Diese wurden als Eintagsküken von der Seddiner Zucht- und Mastenten GmbH, Neutrebbin und von der Firma DucTec, Brüterei GmbH, Belzig bezogen. Bei den Eintagsküken handelte es sich um Tiere aus einer separat von anderen Enten gehaltenen kleinen Elterntierherde, die zu keinem Zeitpunkt Kontakt mit Salmonellen hatte, weder durch natürliche Infektion noch durch Impfstoffe. Dieses wurde durch regelmäßige kulturelle Untersuchungen von Kotproben und durch serologische Kontrollen von anderer Seite vor Ort kontrolliert. Es erfolgte keine Geschlechtertrennung. 3 MATERIAL UND METHODEN 3.1.2 Haltung 3.1.2.1 Räumlichkeiten 63 Im ersten Abschnitt der Vorversuche wurden die Tiere unmittelbar nach der Anlieferung als Eintagsküken nach dem Zufallsprinzip in Gruppen eingeteilt. Im zweiten Abschnitt der Vorversuche und in den Hauptversuchen wurden die Tiere bis zum Infektionszeitpunkt zunächst in einer Großgruppe auf Stroh gehalten und erst zum Infektionstermin in die entsprechenden Isolierställe verteilt, sodass die Tiere die gleiche Keimflora entwickeln konnten. Am Tag der jeweiligen Infektion wurden per Zufallsprinzip Enten für eine Gruppe herausgefangen. Die in der Großgruppe verbliebenen Tiere dienten als Kontrollgruppe. Je nach Versuchsabschnitt kamen durch die unterschiedliche Lebensdauer der Tiere, durch die Gruppengröße, sowie durch den unterschiedlichen Versuchsaufbau zwei verschiedene Haltungsformen zum Einsatz. Im ersten Abschnitt der Vorversuche wurden alle Gruppen in räumlich getrennten Isoliereinheiten (Digestorien) untergebracht. Die den Tieren zur Verfügung stehenden Flächen in den Isoliereinheiten bestanden aus Drahtgitterböden mit einem zusätzlichen engmaschigen Kunststoffgeflecht als Auflage und einer darunter liegenden Kotplatte. Jede Isoliereinheit wurde über einen separaten Abluftschacht durch Unterdruck zwangsentlüftet, dabei wurde aus dem Vorraum Luft passiv zugeführt. Im zweiten Abschnitt der Vorversuche wurden Gruppen mit 4 Tage alten Küken aus Platzgründen in den oben beschriebenen Isoliereinheiten und Gruppen mit 7 Tage alten Enten in gefliesten Isolierabteilen auf Stroheinstreu gehalten. Belüftet wurde über Luftschächte als Überdrucklüftung. 64 3 MATERIAL UND METHODEN In den Hauptversuchen wurden sämtliche Gruppen in den gefliesten Isolierabteilen in Bodenhaltung auf Stroh aufgestallt. Während der gesamten Versuche wurde bei der Haltung der Tiere die in der Vereinbarung des Niedersächsischen Ministeriums für Ernährung, Landwirtschaft und Forsten (ML) und der Niedersächsischen Geflügelwirtschaft, Landesverband e. V. (NGW) über die Mindestanforderungen an die Haltung von Pekingmastenten (2003) vorgeschriebene Besatzdichte von maximal 20 kg Lebendgewicht pro m2 nutzbarer Stallgrundfläche deutlich unterschritten. 3.1.2.2 Futter und Wasser Futter und Wasser stand allen Tieren ad libitum zur Verfügung. Futter Das Futter wurde in Futtersilos angeboten. In Abhängigkeit vom Alter der Tiere wurde Entenstarter- (Alleinfuttermittel für Entenküken; Georg Stolle GmbH, Westerscheps), Entenmittelmast- (Alleinfuttermittel für Mastenten; Georg Stolle GmbH, Westerscheps) und Entenendmastfutter (Alleinfuttermittel für Mastenten Endmast; Georg Stolle GmbH, Westerscheps) verfüttert. Weil für die letzten zwei Versuchsdurchgänge im Hauptversuch dieses Futter nicht mehr erhältlich war, wurde im vorletzten Versuch Gänse- und Entenstarter- (G/E-Starterfutter; B 240/19 Deuka, Bramsche) und Gänse- und Entenmastfutter (G/E-Mastfutter; B 242/21 Deuka, Bramsche) sowie im letzten Versuch Broilerendmastfutter (Landkornendmast; B 390/43 Deuka, Bramsche) angeboten. Dieses Broilerendmastfutter wurde auch für die Versuche zur minimalen Infektionsdosis verwendet. Es enthielt, ebenso wie das Entenstarter-, Entenmittelmast- und Entenendmastfutter der Stolle GmbH, keine Zusätze mit antimikrobieller Wirkung. Die Zusammensetzungen und Verabreichungszeiten der verwendeten Futtersorten sind im Anhang unter 9.2 aufgeführt. 3 MATERIAL UND METHODEN 65 Wasser Zum Tränken wurde Wasser aus dem kommunalen Trinkwassernetz verwendet. In den Digestorien, sowie bis zum fünften Lebenstag der Tiere auch in Bodenhaltung, wurde das Wasser aus runden Stülptränken angeboten. In der Bodenhaltung kamen ab dem fünften Lebenstag vollautomatische runde Geflügeltränken mit verstellbarer Aufhängevorrichtung für Niederdruckleitungen zum Einsatz. Diese waren in Rückenhöhe angebracht und schlossen dadurch ein Verkoten weitgehend aus. 3.1.2.3 Temperatur und Licht Temperatur Die Temperaturgestaltung erfolgte in Abhängigkeit vom Tieralter. In den ersten drei Lebenstagen wurden in Tierhöhe Temperaturen von 30-32 °C eingehalten. Bis zum Ende der ersten Lebenswoche wurde die Stalltemperatur täglich um 1 °C auf 25 °C abgesenkt. In der zweiten Lebenswoche erfolgte eine weitere schrittweise Absenkung auf 18 °C. Diese Temperatur wurde bis zum Versuchsende beibehalten, es sei denn, höhere Außentemperaturen lagen vor. Licht In den ersten drei Lebenstagen betrug die Lichtphase 24 Stunden. Anschließend wurde eine zusammenhängende Dunkelphase von 4 Stunden bis zum 7. Lebenstag und ab dem 8. Lebenstag von 8 Stunden eingeführt. In Tierhöhe gemessen betrug die Lichtintensität im Schnitt 170 Lux. 3.1.2.4 Reinigung und Desinfektion Nach der Desinfektion der Einstreu und sämtlicher Einrichtungsgegenstände mit Venno® FF (Venno GmbH, Norderstedt), einem auf verschiedenen Aldehyden basierenden Mittel, welches bakterizide, fungizide und teilweise viruzide 66 3 MATERIAL UND METHODEN Eigenschaften besitzt, erfolgte eine Hochdruckreinigung des Stalls mit heißem Wasser und anschließend eine nochmalige Desinfektion mit Venno® FF. Zur Versorgung der Tiere wurde für jede Isoliereinheit neue Schutzkleidung angelegt. Die Hände wurden mit Kodan® (Schülke & Mayr, Norderstedt), Einrichtungs- und Bedarfsgegenstände mit Mikrozid® (Schülke & Mayr, Norderstedt) desinfiziert. Während der Hauptversuche wurden die Vorräume der Isolierställe nach jedem Stallbesuch mit einer 1% igen Venno® FF-Lösung ausgesprüht. 3.2 Bakterienstämme 3.2.1 Herkunft und Charakteristika Für die Untersuchungen standen zehn verschiedene Salmonellen-Stämme (Tab. 1) zur Verfügung. Die Stämme wurden über die Lohmann Animal Health GmbH & Co. KG, Cuxhaven, zur Verfügung gestellt und stammten aus dem Robert-Koch-Institut, Wernigerode, in welchem auch eine Phagentypisierung mit verschiedenen Systemen erfolgt war. Die erhaltenen Stämme wurden einmalig auf mehreren Brolacin-Agarplatten kultiviert, makroskopisch und im gefärbten Präparat auf Reinheit überprüft und anschließend in steriler Magermilch suspendiert. Nach dem Abfüllen kleiner ca. 1,5 ml großer Portionen in sterile Röhrchen wurden sie als eine einheitliche Charge bis zu ihrem Gebrauch bei –70 °C aufbewahrt. 3 1 9b/n.c. 4/6 Ente, ?4 Ente, ? SE-059, SE-059r 3 SE-058 SE-03-03059 Nalr -2 03-03059 03-03058 ST-265r ST-360r ST-485r ST-02-10265 Nalr ST-02-06360 Nalr ST-02-05485 Nalr 02-10265 02-06360 02-05485 ST-279r ST-02-10279 Nalr 02-10279 4/3 Ente, Organe Stamm wurde nicht markiert Isolationsort unbekannt n.c./n.c. Gans, Organe 4 1 var. 18/1 Ente, Organe 4/3 ST-148r ST-02-11148 Nalr 02-11148 Gans, Organe 20/n.c. Ente, Organe SE-191 - 02-00191 2bPhi4/23 4/6 Gans, Organe SE-864, SE-864r SE-02-02864 Nalr 02-02864 Phagentyp nach Felix/Callow Ente, Organe 21/1 Ente, Organe SE-391 - 02-06391 2 Phagentyp nach Ward/Lalko und Laszlo Herkunft verwendete Kurzbezeichnung1 Bezeichnung nach Markierung Stamm Verwendete Salmonellen-Stämme diese Kurzbezeichnungen werden nachfolgend verwendet das hochgestellte Suffix „r“ kennzeichnet Nalidixinsäure-resistente Stämme Salmonella Typhimurium (ST) Salmonella Enteritidis (SE) Serovar Tab. 1: DT008 RDNC DT126 DT008 DT092 Phagentyp DT nach Lilleegen 3 MATERIAL UND METHODEN 67 68 3.2.2 3 MATERIAL UND METHODEN Nährmedien Für die kulturell-bakteriologischen Untersuchungen wurden die in Tabelle 2 aufgeführten Medien eingesetzt. Tab. 2: Verwendete Medien, Hersteller und Verwendungszweck Medium Hersteller/ Artikelnummer Verwendung Standard-I-Nährbouillon Merck, Darmstadt/ 1.07882.0500 Vermehrung von Salmonellen PBS-Lösung (Phosphate Buffered Saline), pH 7,4 Sigma, Steinheim/ P-3813 Natriumchlorid Merck, Darmstadt/ 1.06404.0500 Verdünnungsreihen; Verdünnungslösung physiologische Natriumchlorid-Lösung: Inokulum der Kontrolltiere; Verdünnungslösung Brolacin-Agar (Bromthymolblau-LactoseCystin-Agar) Merck, Darmstadt/ 1.01638.0500 TBG-Bouillon, modifiziert Merck, Darmstadt/ (Tetrathionat-Brilliantgrün1.05178.0500 Galle-Anreicherungsbouillon) BPLS-Agar (BrilliantgrünPhenolrot-LactoseSaccharose-Agar), modifiziert BPLS100 (BPLS-Agar mit 100 mg/l Nalidixinsäure) Keimzahlbestimmung selektive Anreicherung der Salmonellen aus dem Untersuchungsmaterial Oxoid; Wesel/ CM329 Isolierung von Salmonellen aus klinischem Material Oxoid, Wesel/ Spezialanfertigung Isolierung von Salmonellen aus Untersuchungsmaterial mit Begleitflora Novobiocin Merck, Darmstadt/ CALB 491209 Unterdrückung von Proteus Nalidixinsäure Fluka, Neu-Ulm/ 70162 Zusatz zu BPLS-Agar: Hemmung der Begleitflora aus dem Untersuchungsmaterial 3 MATERIAL UND METHODEN 69 Die Basisnährmedien wurden nach Herstellerangaben zubereitet. Zusätze wie Antibiotika wurden nach Abkühlen der Medien auf 50 °C hinzugefügt und homogen verteilt. Die Zusammensetzung der verwendeten Nährmedien und ihre Herstellung ist unter 9.1 im Anhang aufgeführt. Alle mit Salmonellen beimpften Medien wurden 24 Stunden bei 37 °C im aeroben Milieu in einem Brutschrank inkubiert. 3.2.3 Keimzahlbestimmung Die Bestimmung der Keimzahl bzw. der Kolonie bildenden Einheiten (KbE) erfolgte mit dem Oberflächen-Spatelverfahren. Dazu wurden die in Standard-I-Bouillon in Reinkultur angezüchteten Salmonellen-Teststämme mittels einer um den Faktor 10 fallenden Verdünnungsreihe bis 10-9 verdünnt. Um die Verdünnungsstufe 10-1 zu erhalten, wurde von der Bouillon 1 ml entnommen und zu 9 ml Verdünnungslösung (PBS-Lösung) gegeben und mittels eines Reagenzglasschüttlers (Vortex Genie, Fa. Scientific Industries, New York) gemischt. Die Herstellung weiterer Verdünnungsstufen erfolgte entsprechend. Von den Verdünnungsstufen 10-6 bis 10-9 wurden jeweils 0,1 ml im Doppelansatz auf Brolacin-Agar ausgestrichen. Die beiden höchsten Verdünnungsstufen, auf denen ein Wachstum von Kolonien verzeichnet werden konnte, wurden ausgezählt und unter Berücksichtigung der inokulierten Menge mit dem gewogenen arithmetischen Mittel die Keimzahl pro 1 ml Reinkultur errechnet. 70 3 MATERIAL UND METHODEN Formel zur Berechnung des gewogenen arithmetischen Mittelwertes aus PICHARDT (1998): x̄ Σx gew = n1 w1 + n2 w2 + … xd Legende: x̄ gew: gewogenes arithmetisches Mittel Σx: Summe aller KbE aller Platten n1: Plattenanzahl der niedrigsten Verdünnung n2: Plattenanzahl der nächsthöheren Verdünnung w1: Gewicht der niedrigsten Verdünnung w2: Gewicht der nächsthöheren Verdünnung d: Faktor der niedrigsten Verdünnung Beispiel: Es wurden aus der Verdünnungsstufe 10-3 260 und 280 Kolonien ausgezählt. Bei der Verdünnungsstufe 10-4 wurden 21 und 24 Kolonien ausgezählt. = [260 + 280] + [21+24] x 103 2 x 1 + 2 x 0,1 = 585 x 103 2,2 = 266 x 103 = gerundet 2,7 x 105 KbE/g 3 MATERIAL UND METHODEN 3.2.4 71 Markierung der Teststämme Um bei Isolierungsversuchen die störenden Begleitkeime aus dem Caecum durch Zusatz von Nalidixinsäure zum Nährboden bei der quantitativen Untersuchung zu unterdrücken, wurden die verwendeten Salmonellen-Stämme durch eine Nalidixinsäure-Resistenz markiert. Hierzu wurde je eine Brolacin-Agarplatte mit den zu markierenden Teststämmen so beimpft, dass ein Bakterienrasen entstand. Das Bakterienmaterial wurde in 5 ml einer Standard-I-Nährbouillon suspendiert. Anschließend wurde 1 ml dieser Bouillon in 9 ml PBS-Lösung überführt und eine dekadische Verdünnung bis 1 x 10-10 durchgeführt. Mit jeweils 0,1 ml jeder Verdünnungsstufe wurde eine Brolacin-Agarplatte beimpft und 24 Stunden bei 37° C bebrütet, um die Keimdichte der Suspension bestimmen zu können. Die restliche Salmonellensuspension wurde in Volumina von je 0,1 bzw. 0,5 ml auf Nalidixinsäuresupplementierten BPLS-Agarplatten (100 mg Nalidixinsäure pro 1 Liter BPLS-Agar) ausgespatelt und ebenfalls 24 Stunden bei 37 °C bebrütet. Die Bestimmung der Mutationshäufigkeit erfolgte durch die Ermittlung der Keimzahl pro Milliliter der Salmonellensuspension unter gleichzeitiger Berücksichtigung der Anzahl der auf dem supplementierten BPLS-Agar gewachsenen KbE pro Inokulationsvolumen (siehe auch Abb. 3). Die auf dem supplementierten BPLS-Agar gewachsenen Kolonien wurden in fünf Passagen nochmals auf supplementiertem BPLS-Agar subkultiviert; die Salmonellen der fünften Passage wurden einmalig auf Brolacin vermehrt und als eine einheitliche Charge in steriler Magermilch bis zur weiteren Verwendung bei - 70 °C tiefgefroren. Die Bezeichnung der markierten Stämme erfolgte auf die in Tabelle 1 angegebene Weise. Der Erhalt der Nalidixinsäure-Resistenz wurde durch anschließende zehnfache Passage auf unsupplementiertem Brolacin-Agar mit abschließender Subkultur auf supplementiertem BPLS-Agar überprüft. 72 3 MATERIAL UND METHODEN Beimpfen von Brolacinagar mit entsprechendem Salmonellen-Stamm (24 h, 37 °C) Herstellung einer hochkonzentrierten Keimsuspension mit 5 ml Standard-I-Nährlösung definiertes Volumen der Suspension auf dekadische Verdünnung supplementierten BPLS-Agar (100mg Nal/l), Mehrfachansatz (24 h, 37 °C) Beimpfen von Brolacin- Bestimmung der Anzahl Agar (24 h, 37 °C) resistenter KbE Bestimmung der Gesamtkeimzahl pro ml Suspension Bestimmung der Mutationshäufigkeit Abb. 3: Isolierung von Mutanten Markierung der Teststämme und Bestimmung der Mutationshäufigkeit 3 MATERIAL UND METHODEN 3.2.5 73 Überprüfung der Nalidixinsäure-Resistenz Die Nalidixinsäure-Resistenz der markierten Stämme sollte 100 mg Nal/l Agar BPLS betragen. Dieses wurde in der in Abbildung 4 beschriebenen Weise überprüft. Beimpfung von Brolacin-Agar mit entsprechendem Salmonellen-Stamm (24 h, 37 °C) Herstellung einer Keimsuspension in PBS-Lösung entsprechend McFarland-Standard 2 0,8 ml der Suspension zu 200 ml Standard-I-Nährbouillon (24 h, 37 °C, Schüttelinkubator 60 x/min) dekadische Verdünnung Beimpfung von unsupplementiertem Beimpfung von supplementiertem BPLS-Agar (24 h, 37 °C) BPLS-Agar (24 h, 37 °C) Vergleich der Anzahl KbE Abb. 4: Überprüfung der Nalidixinsäure-Resistenz 74 3 MATERIAL UND METHODEN 3.3 Untersuchungen zum Verlauf einer Infektion mit Salmonellen bei Enten Ziel dieser Studie war es, Basisdaten über den Verlauf einer Infektion mit S. Enteritidis und S. Typhimurium bei Enten zu erarbeiten. Dazu war es erforderlich, in Vorversuchen geeignete Salmonellen-Stämme, Organe für die Reisolierung und die Infektionsdosis für die Hauptversuche zu ermitteln. Nachfolgend wird der Aufbau der Versuche im Einzelnen dargestellt. 3.3.1 Versuchsaufbau 3.3.1.1 Vorversuche: Auswahl geeigneter Stämme, Organe und der Infektionsdosis Ziel der Vorversuche war es: • aus je fünf S. Enteritidis- und fünf S. Typhimurium-Stämmen jeweils einen möglichst virulenten Stamm für die Hauptversuche zum Infektionsverlauf auszuwählen; • aus zunächst mehreren in den Vorversuchen untersuchten Organen drei auszuwählen, die sich aufgrund einer relativ häufigen Nachweisrate zur Beurteilung einer Infektion eignen; • zu klären, welche Infektionsdosis für die Hauptversuche eingesetzt werden soll. 3 MATERIAL UND METHODEN 75 Die dafür erforderlichen Untersuchungen erfolgten aus versuchstechnischen Gründen in zwei Abschnitten: Im ersten Abschnitt der Vorversuche sollte zunächst • eine Eingrenzung der ursprünglich jeweils fünf Salmonellen-Stämme auf jeweils zwei Stämme erfolgen; • aus sechs untersuchten Organen vier für nachfolgende Untersuchungen ausgewählt werden. Tabelle 3 gibt schematisch für einen Stamm den Ablauf des mit jeweils fünf S. Enteritidis- und fünf S. Typhimurium-Stämmen durchgeführten Versuches wieder. Pro Stamm wurden jeweils fünf Tiere am 4. und am 7. Lebenstag mit einer Dosierung von 1 x 106 KbE/Tier oral infiziert (siehe 3.3.2). Das Inokulum wurde mit einer Knopfkanüle direkt in die dem Kropf ähnelnde spindelförmige Erweiterung des Ösophagus appliziert. Das Inokulationsvolumen betrug 0,4 ml. Einer jeweiligen Kontrollgruppe wurde das gleiche Volumen an physiologischer NatriumchloridLösung verabreicht. Sieben Tage nach der Infektion (11. und 14. Lebenstag) wurden die Tiere durch Betäubung mit anschließendem Blutentzug getötet und seziert. Caecum und Leber wurden stets qualitativ (3.3.4.2) und quantitativ (3.3.4.1) auf die inokulierten Salmonellen hin untersucht, um neben einer Aussage über die Infektionshäufigkeit auch Angaben über die Keimzahl machen zu können. Bei Lunge, Herz, Gehirn und Gallenblase erfolgte der Salmonellennachweis nur qualitativ. Die Ergebnisse (siehe 4.2.1) dieses Versuchsabschnittes führten zur Festlegung auf die Stämme SE-059, SE-864, ST-360r und ST-485r für die Verwendung im zweiten Versuchsabschnitt, sowie zur Auswahl von Caecum, Leber, Lunge und Gallenblase. 76 3 MATERIAL UND METHODEN Tab. 3: Versuchsschema für orientierende Untersuchungen zur Pathogenität von je fünf S. Enteritidis- und S. Typhimurium-Stämmen und zur Einbeziehung von Organen in das Infektionsgeschehen Lebenstag 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Tage 1. Gruppe p.i. Tage 2. Gruppe p.i. Einstallung 0 1 2 3 4 5 6 7 Einstallung Infektion Sektion 0 1 2 3 4 5 6 7 Infektion Sektion Im zweiten Abschnitt der Vorversuche erfolgte • die Festlegung eines S. Enteritidis- bzw. S. Typhimurium-Stammes aus den jeweils zwei Stämmen des vorausgegangenen Versuchsabschnittes; • aufgrund der erweiterten Kenntnisse die Auswahl von drei Organen für die Hauptversuche; • die Auswahl einer geeigneten Infektionsdosis aus drei unterschiedlichen, parallel eingesetzten Infektionsdosen. Des Weiteren war von Interesse, ob sich die Höhe der Infektionsdosis sowohl auf die Anzahl an infizierten Organen, als auch auf die Keimzahlen in Leber und Caecum auswirken würde. 3 MATERIAL UND METHODEN 77 Tabelle 4 gibt schematisch den Versuchsablauf wieder, der mit jedem der vier zu prüfenden Salmonellenstämme mit drei verschiedenen Infektionsdosen durchgeführt wurde. Pro Stamm wurden am 4. und am 7. Lebenstag jeweils zehn Tiere mit einer Keimmenge von 1 x 103; 1 x 106 und 1 x 109 KbE pro Tier oral infiziert. Das Inokulationsvolumen für 1 x 103 und 1 x 106 KbE/Tier betrug 0,4 ml und für 1 x 109 KbE/Tier je nach Konzentration der Stammlösung zwischen 0,6 und 1,1 ml. Fünf Tage post infectionem (p.i.) (9. bzw. 12. Lebenstag) und 14 Tage p.i. (18. bzw. 21. Lebenstag) wurden jeweils fünf Tiere getötet und seziert. Caecum und Leber wurden wie im ersten Versuchsabschnitt quantitativ und qualitativ, Lunge und Gallenblase nur qualitativ auf die inokulierten Salmonellen hin untersucht. Bei den Untersuchungen mit S. Typhimurium wurde zusätzlich die Milz als Organ in die qualitativen Untersuchungen mit einbezogen. Die Untersuchungen führten zu der Auswahl der beiden Stämme SE-864r und ST-485r (siehe 4.2.1), einer Infektionsdosis von 1 x 106 KbE/Tier (siehe 4.2.3) und den Organen Caecum, Leber und Milz (siehe 4.2.2) für die Untersuchungen zum Infektionsverlauf in den Hauptversuchen. 78 3 MATERIAL UND METHODEN Tab. 4: Versuchsschema zur Ermittlung der Infektionsdosis, weiteren Stammund Organauswahl Lebenstag 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 3.3.1.2 Tage 1. Gruppe 2. Gruppe p.i. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Infektion Tage 3. Gruppe 4.Gruppe p.i. Infektion Sektion Sektion 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Infektion Infektion Sektion Sektion Hauptversuche: Untersuchungen zum Infektionsverlauf Für die Untersuchungen zum Infektionsverlauf wurden Enten mit den in den Vorversuchen ausgewählten Stämmen und der dort ermittelten Infektionsdosis infiziert, um die Infektionsdauer, die Nachweishäufigkeit und die isolierten Keimzahlen nach Infektion der Tiere im unterschiedlichen Alter zu verfolgen. Diese Untersuchungen erfolgten in vier zeitlich aufeinander folgenden Versuchen, wobei im ersten und dritten Versuch die Infektion mit S. Enteritidis und im zweiten und vierten Versuch die Infektion mit S. Typhimurium verfolgt wurde. Der dritte und vierte Versuch wurden auch als Wiederholungsversuch bezeichnet. Sie dienten der Überprüfung der Reproduzierbarkeit der Ergebnisse. 3 MATERIAL UND METHODEN 79 Da anzunehmen war, dass die Infektion je nach Alter der Tiere verschieden verläuft, wurden fünf unterschiedliche Altersgruppen in den beiden ersten Versuchen mit je 25 Enten und im dritten und vierten Versuch mit je 30 Tieren pro Salmonellen-Stamm gebildet, die am 5., 8., 15., 22. und 43. Lebenstag infiziert wurden. Diese Gruppen wurden mit steigendem Alter zum Zeitpunkt der Infektion mit den Buchstaben A bis E versehen (Gruppe A = 5. LT; Gruppe B = 8. LT; Gruppe C = 15. LT; Gruppe D = 22. LT; Gruppe E = 43. LT). Während in den beiden ersten Versuchsdurchgängen alle Tiere mit einer Infektionsdosis von 1 x 106 KbE pro Tier oral infiziert wurden, erfolgte in den beiden letzten Versuchsdurchgängen bis zum 8. Lebenstag (Gruppe A und B) die Infektion mit der gleichen Dosis, während sie für Tiere ab dem 15. Lebenstag (Gruppen C bis E) auf 1 x 109 KbE pro Tier erhöht wurde. Jeweils fünf Tiere einer Altersgruppe wurden 3, 5, 7, 14, 21 und im dritten und vierten Versuch auch 28 Tage nach der Infektion getötet, seziert und die inokulierten Salmonellen aus Caecum und Leber quantitativ und qualitativ, sowie aus der Milz nur qualitativ isoliert. Tabelle 5 beschreibt das Versuchsschema für einen dieser insgesamt vier Versuche. 80 Tab. 5: Lebenstag 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 3 MATERIAL UND METHODEN Versuchsschema für einen von vier Stämmen im Hauptversuch "Infektionsverlauf" d.p.i. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Gruppe A Infektion Sektion Sektion Sektion Sektion Sektion Sektion d.p.i. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Gruppe B Infektion Sektion Sektion Sektion Sektion Sektion Sektion d.p.i. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Gruppe C Infektion Sektion Sektion Sektion Sektion Sektion Sektion d.p.i. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Gruppe D Infektion Sektion Sektion Sektion Sektion Sektion Sektion d.p.i. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Gruppe E Infektion Sektion Sektion Sektion Sektion Sektion Sektion 3 MATERIAL UND METHODEN 3.3.2 81 Herstellung und Verabreichung des Inokulums Herstellung Drei Tage vor der Infektion wurden mit dem frisch aufgetauten Salmonellen-Stamm zwei Platten Brolacin-Agar beimpft und 24 Stunden bei 37 °C bebrütet (Vorkultur) (Abb. 5). Um die Herstellung der Hauptkultur zu standardisieren, wurde von der Vorkultur mit einer Impföse so viel Material entnommen, in ein Reagenzglas mit 5 ml PBS-Lösung gegeben und mit Hilfe eines Reagenzglasschüttler homogenisiert, dass die sich daraus ergebene Trübung dem McFarland Standard 2 (Biomérieux, Marcyl'Etoile, Frankreich, REF 70 900) entsprach. Nach Angaben von BURKHARDT (1992) ergibt sich daraus rein rechnerisch ein Keimgehalt von etwa 5 x 108 KbE pro 800 µl der Salmonellensuspension. Diese 800 µl wurden mit einer Eppendorf-Pipette in 200 ml Standard-I-Nährbouillon überführt und auf einem Horizontalschüttler (GFL, Hannover) mit einer Frequenz von 60 Bewegungen pro Minute 24 Stunden bei 37 °C bebrütet (Hauptkultur). Im Anschluss daran wurde die Hauptkultur in einen Kühlschrank mit +4 °C gestellt und dort bis zum Zeitpunkt der Infektion aufbewahrt. Um zu gewährleisten, dass stets weitgehend identisches Inokulum für die Versuche verwendet wurde, wurde aus einer Probe der gut gemischten Hauptkultur eine dekadische Verdünnungsreihe auf Brolacin-Agar durchgeführt. Es erfolgte eine Bebrütung der Brolacin-Agarplatten für 24 Stunden bei 37 °C. Am Tag der Infektion wurde anhand der Kolonie bildenden Einheiten der Verdünnungsreihe die Keimzahl pro 1 ml der Hauptkultur bestimmt (Berechnung siehe 3.2.3). Zur Absicherung und Gewährleistung, dass nicht unerkannte Einflüsse während der 24-stündigen Aufbewahrungszeit auf die Keimsuspension eingewirkt hatten, erfolgte parallel zur Infektion nochmals eine Keimzahlbestimmung. 82 3 MATERIAL UND METHODEN Anzucht der tiefgefrorenen Stämme auf Brolacin 24 h, 37 °C (Vorkultur) Herstellung einer Keimsuspension in PBS-Lösung; entsprechend McFarland Standard II 800 µl der Suspension in 200 ml Standard-I-Nährbouillon (Hauptkultur); Horizontalschüttler 60 x/min, 37 °C, 24 h dekadische Verdünnung Kühlschrank + 4 °C, 24 h Berechnung des Keimgehaltes vor der Kühlung nochmalige Keimzahlbestimmung Herstellung des Inokulums Infektion Abb. 5: Herstellung des Inokulums Verabreichung und Dosierung Anhand der errechneten Keimkonzentration der Hauptkultur wurden die Inokula so eingestellt, dass die gewünschten Keimzahlen von 1 x 103 KbE/ Tier und 6 1 x 10 KbE/ Tier in 0,4 ml physiologischer Natriumchlorid-Lösung enthalten waren. Bei der Keimzahl von 1 x 109 KBE/ Tier wurde ein Volumen verabreicht, wie es sich aus der Hauptkultur ergab, das Volumen betrug zwischen 0,6 und 1,1 ml. Die Kontrolltiere erhielten die äquivalente Menge an physiologischer Natriumchlorid- 3 MATERIAL UND METHODEN 83 Lösung. Das Inokulum wurde mittels einer geraden, je nach Alter der Enten unterschiedlich großen Knopfkanüle (WDT eG, Garbsen, Art.-Nr. 07511 (1,2 x 60 mm), Art.Nr. 07512 (1,5 x 80 mm), Art.Nr. 07514 (2,0 x 120 mm) mit aufgesetzter 1 ml Einmalspritze (Dispomed Witt GmbH, Gelnhausen, REF 22006, steril) direkt in die spindelförmige Erweiterung des Ösophagus instilliert. In den Hauptversuchen wurde den älteren Tieren aufgrund ihrer Größe die Dosis 1 x 106 KbE/ Tier bzw. 1 x 109 KbE/ Tier mit einer serologischen Einmalpipette mit offener Spitze (VWR, Darmstadt, Best.-Nr. 612-1241) verabreicht. 3.3.3 Klinische und pathologisch-anatomische Untersuchungen Alle Gruppen wurden während des Versuches täglich auf das Allgemeinbefinden und klinische Symptome wie Diarrhöe, Lidbindehautentzündungen, Gelenkentzündungen, Lähmungen, Gleichgewichtsstörungen und auf das Gefiederbild hin untersucht. Während der Sektion wurden die Organe auf pathologisch-anatomische Veränderungen geprüft. 3.3.4 Isolierung der Teststämme Für die Isolierung wurden die Tiere nach Betäubung durch Blutentzug getötet und ihre Körperoberfläche mit Mikrozid® Liquid (Schülke & Mayr, Norderstedt) desinfiziert. Nach Eröffnung der Bauchhöhle wurden die Organe inspiziert und die zur weiteren Untersuchung vorgesehenen Organe (je nach Versuchsabschnitt: Leber, Caecum, Milz, Gallenblase, Gehirn, Herz, Lunge) steril entnommen. Die Caeca und Teile der Leber wurden zur quantitativen Aufarbeitung einzeln in beschrifteten sterilen Petrischalen (Nerbe plus, Winsen Luhe) gesammelt. Die Organproben, die zur qualitativen Untersuchung bestimmt waren, wurden direkt nach der Sektion in einer Menge von ca. 0,5 bis maximal 1,0 g einzeln zu 10 ml TBG- 84 3 MATERIAL UND METHODEN Bouillon in Reagenzgläsern gegeben; im Falle der Caeca erfolgte dies nach der quantitativen Aufarbeitung eines Teils des Caecuminhaltes. 3.3.4.1 Quantitative Untersuchung Von jedem einzelnen Tier wurden Caecuminhalt und Leber quantitativ untersucht. Hierzu wurde die Blinddarmingesta mit Hilfe einer sterilen Deckglaspinzette nach Kühne (Roth, Karlsruhe) herausgedrückt und direkt in ein 4 ml großes durchsichtiges Polystyrolröhrchen mit rundem Boden und Lamellenstopfen (Nerbe plus, Winsen Luhe) eingewogen. Die Einwaage betrug aufgrund der geringen Caeca-Inhalte der jungen Tiere zwischen 0,200 und 0,280 g und wurde auch bei älteren Enten beibehalten. Diese Menge wurde mit der neunfachen Menge an PBS-Lösung aufgefüllt (Verdünnungsstufe 10-1) und auf einem Reagenzglasschüttler homogen vermischt. Von den Lebern wurde ein mindestens 0,5 g schweres Stück in ein 10 cm langes Reagenzglas (VWR, Darmstadt) eingewogen, ebenfalls mit der neunfachen Menge an PBS-Lösung aufgefüllt (erste Verdünnungsstufe 10-1) und mit einem UltraThurrax® (IKA-Werke, Staufen) mit Hartkunststoff-Dispergierwerkzeug (Omni-Tip, Omnilab, Bremen) bei einer Geschwindigkeit von 13.000 U/min zu einer homogenen Suspension verarbeitet. In einer 48-Well Zellkulturplatte mit Deckel (3548, Corning Costar, Wiesbaden) wurden die fünf Proben von Caecuminhalt bzw. Leber einer Gruppe gleichzeitig verdünnt. Hierzu wurden in die benötigten Wells je 900 µl der Verdünnungslösung (PBS-Lösung) vorgelegt und aus der Erstverdünnung 100 µl hinzugefügt (zweite Verdünnungsstufe 10-2). Nach der gründlichen Durchmischung mit einer Mehrkanalpipette (Brand, Wertheim) wurden aus der zweiten Verdünnungsstufe 100 µl in die nächste Vertiefung pipettiert. Auf diese Weise wurden Verdünnungsreihen bis 10-6 angelegt. Aus jeder Verdünnungsstufe wurden 100 µl im Doppelansatz auf Nalidixinsäure-supplementierten BPLS-Agar (Oxoid, Wesel) gegeben und mit einem Drigalski Glasspatel (Roth, Karlsruhe) ausgespatelt. Um die Nachweisgrenze für die in der Leber teilweise nur in geringer Anzahl auftretenden Salmonellen zu erhöhen, wurden zusätzlich vier Agarplatten mit jeweils 3 MATERIAL UND METHODEN 85 250 µl beimpft. Anschließend erfolgte eine Inkubation im Brutschrank für 24 Stunden bei 37 °C. Nach der Inkubation der supplementierten BPLS-Nährböden wurden diese makroskopisch anhand der Morphologie und der Indikatorreaktion des Agars auf Salmonellen hin untersucht. Stichprobenhaft wurde zur Absicherung von einzelnen Kolonien eine Objekträgerschnellagglutination durchgeführt (siehe 3.3.4.2). Soweit möglich, wurden die Kolonie bildenden Einheiten der zwei höchsten positiven Verdünnungsstufen ausgezählt. Durch das Ausspateln von 100 µl aus der Erstverdünnung konnte eine 2 Nachweisgrenze von 1,0 x 10 KbE/g Blinddarminhalt erzielt werden. Das teilweise massive Auftreten von unerwünschten Keimen aus dem Caecuminhalt in den niedrigen Verdünnungsstufen ließ teilweise eine quantitative Auswertung dieser Verdünnungsstufen jedoch nicht zu. Somit handelt es sich um eine theoretische Nachweisgrenze. Durch das Ausspateln von 4 x 250 µl aus der Erstverdünnung des Leberhomogenisates auf je eine Platte, welche zusammen als eine gewertet wurden, konnte die Nachweisgrenze für die Leber auf 1,0 x 101 KbE/g erhöht werden. Die Keimzahlen wurden unter Berücksichtigung der Einwaage des Untersuchungsmaterials als gewogener arithmetischer Mittelwert nach der in 3.2.3 angegebenen Formel errechnet und als KbE/ g Blinddarminhalt bzw. Leber angegeben. War nur die qualitative Untersuchung positiv, wurde davon ausgegangen, dass Keime unterhalb der Nachweisgrenze der quantitativen Auswertung vorhanden waren. Für die Ergebnisse wurden für diesen Fall 50 KbE/ g Blinddarminhalt bzw. 5 KbE/ g Leber angenommen. Konnten sowohl qualitativ als auch quantitativ keine Salmonellen nachgewiesen werden, Untersuchungen mit „0“ angesetzt. wurde der Wert für die statistischen 86 3 MATERIAL UND METHODEN 3.3.4.2 Qualitative Untersuchung Die für den qualitativen Nachweis in TBG-Bouillon verbrachten Organproben wurden für mindestens 24 Stunden bei 37 °C bebrütet und im Anschluss daran mit einer Impföse auf supplementiertem BPLS-Agar ausgestrichen. Die Bebrütung der Agarplatten erfolgte für 24 Stunden bei 37 °C. Die gewachsenen Kolonien wurden mit Salmonella-Testserum (Dade Behring, Marburg) durch Objektträger- schnellagglutination stichprobenartig serologisch überprüft. Hierbei wurde für S. Enteritidis-Stämme das Testserum Anti – O 9 (REF ORNH03), für S. Typhimurium-Stämme das Testserum Anti – O 5 (REF ORND03) verwendet. Negative Proben wurden erneut nach einer insgesamt 48-stündigen Bebrütung aus der TBGBouillon ausgestrichen und auf Salmonellenwachstum untersucht. Proben der Kontrolltiere wurden auf unsupplementiertem BPLS-Agar ausgestrichen. In den seltenen Fällen, in denen quantitativ Salmonellen nachgewiesen werden konnten, qualitativ jedoch nicht, wurde das Organ als positiv gewertet. 3.3.5 Kontrolltiere Abgesehen von den Vorversuchen zur Auswahl pathogener Stämme wurden die Tiere bis zur Infektion gemeinsam in einem separaten Raum gehalten. Zur Infektion wurde die benötigte Anzahl von Enten aus dem Stall entnommen. Die jeweils verbliebenen uninfizierten Tiere dienten als Kontaminationskontrollen. Von ihnen wurden im Versuchsverlauf zu den jeweiligen Sektionsterminen Proben vom Caecum und der Leber gewonnen, in Tetrathionat (TBG-Bouillon) angereichert, auf nichtsupplementiertem BPLS-Agar ausgestrichen und auf das Freisein von Salmonellen hin untersucht. 3 MATERIAL UND METHODEN 3.3.6 87 Bestimmung der minimalen Infektionsdosis Zur Bestimmung der minimalen Infektionsdosis wurden Enten am 4. und am 32. Lebenstag mit einem S. Enteritidis-Stamm (SE-864r) bzw. mit einem r S. Typhimurium-Stamm (ST-485 ) infiziert. Die Dosen betrugen am 4. Lebenstag für beide Stämme 1 x 101, 1 x 102 und 1 x 103 KbE pro Tier. Am 32. Lebenstag erfolgte die Infektion mit S. Typhimurium mit den gleichen Dosen (1 x 101, 1 x 102 und 1 x 103 KbE), die Dosen für S. Enteritidis wurden um jeweils eine Zehnerpotenz erhöht (1 x 102, 1 x 103 und 1 x 104 KbE). Die Herstellung und Verabreichung des Inokulums erfolgte auf die bereits beschriebene Art und Weise. Jede Gruppe bestand aus 12 Tieren, wovon 7 Enten von ungeimpften und 5 Enten von geimpften Elterntieren stammten. Zur Unterscheidung der Herkunft wurden die Tiere mit Fußringen markiert. Am 5. Tag p.i. wurden die Tiere getötet, seziert und das Caecum qualitativ auf das Vorhandensein von Salmonellen hin untersucht (siehe auch 3.3.4.2). 3.4 Statistische Auswertung Für die graphische Darstellung wurden die Logarithmen (log10) der Einzelwerte einer Gruppe arithmetisch gemittelt. Um auch Null-Werte und Werte ≤1 darstellen zu können, wurde zu jedem Wert die Zahl 1 addiert. Somit waren auch Null-Werte logarithmisch definiert bzw. darstellbar, und Werte ≤1 lagen im positiven Achsenabschnitt. Die Untersuchungsergebnisse wurden auf statistisch signifikante Unterschiede überprüft (p < 0,05). Innerhalb der Abbildungen wurden signifikante Unterschiede durch unterschiedliche Buchstaben gekennzeichnet. Die rechnerische Bearbeitung der Daten erfolgte unter Zuhilfenahme des Computerprogramms SigmaStat®, Version 3.1 (Jandel, Erkrath). Qualitative 88 3 MATERIAL UND METHODEN Ergebnisse wurden dabei mittels Chi-Square-Test und quantitative Ergebnisse mit dem t-Test überprüft. Die statistische Auswertung der Daten in den Abbildungen 25-28 wurde in Zusammenarbeit mit dem Institut für Biometrie, Epidemiologie und Informationsverarbeitung der Tierärztlichen Hochschule Hannover durchgeführt. Es handelt sich um eine unabhängige, zweifaktorielle Varianzanalyse. Die rechnerische Bearbeitung der Daten erfolgte mit dem Computerprogramm SAS („Statistical Analysis System“), Version 9.1.3. 4 ERGEBNISSE 89 4 Ergebnisse 4.1 Markierung der Teststämme 4.1.1 Gewinnung Nalidixinsäure-resistenter Mutanten Die für die Infektionsversuche zu testenden Salmonellen-Stämme wurden mit einer Resistenz gegenüber dem Antibiotikum Nalidixinsäure markiert. Dieses machte den Zusatz dieses Antibiotikums zu den Nährböden möglich. Hierdurch sollte das Wachstum unerwünschter Begleitkeime aus der natürlichen Caecalflora unterdrückt werden und die sichere Reisolierung der Salmonellen und damit eine quantitative Auswertung der Proben möglich werden. Hierzu wurden die zwei S. EnteritidisStämme, die für die weiterführenden Untersuchungen in Frage kamen (vgl. 4.2.1), sowie alle fünf S. Typhimurium-Stämme - wie unter 3.2.4 beschrieben - mit einer Nalidixinsäure-Resistenz markiert, die 100 mg Nalidixinsäure/l BPLS-Nähragar erreichen sollte. Die Gewinnung Nalidixinsäure-resistenter Spontanmutanten gelang bei allen verwendeten Stämmen. Bereits bei den unmarkierten Stämmen fiel auf, dass der Durchmesser der Kolonien von S. Enteritidis nach 24-stündiger Bebrütung geringer war als der von S. Typhimurium. Dieser Größenunterschied blieb auch bei den resistenten Mutanten bestehen. Aufgrund der auf dem supplementierten BPLSAgar gewachsenen Anzahl an Kolonien und unter Berücksichtigung der Ausgangskeimzahl konnten die in Tabelle 6 angegebenen Mutationshäufigkeiten der verwendeten Stämme bestimmt werden (siehe auch 3.2.4, Abb. 3). Die Nalidixinsäure-resistenten Mutanten wurden nachfolgend durch das hochgestellte Suffix „r“ für resistent gekennzeichnet. Zusätzlich wurde das Wachstum auf supplementiertem BPLS-Agar nach einer zehnfachen Passage der Stämme auf unsupplementiertem Brolacin-Nährboden überprüft. Auch nach diesen Passagen zeigten die Keime ein gutes Wachstum, wobei die Resistenz gegenüber Nalidixinsäure erhalten blieb. 90 4 ERGEBNISSE Tab. 6: Mutationshäufigkeiten der verwendeten S. Enteritidis- und S. Typhimurium-Stämme S. Enteritidis S. Typhimurium 4.1.2 Stamm Mutationshäufigkeit SE-864 1,1 x 10-8 SE-059 2,4 x 10-8 ST-360 2,2 x 10-9 ST-485 3,0 x 10-9 ST-265 4,7 x 10-9 ST-279 6,1 x 10-10 ST-148 1,3 x 10-8 Überprüfung der Nalidixinsäure-Resistenz Die für Untersuchungen zum Infektionsverlauf in der Ente verwendeten und mit einer Nalidixinsäure-Resistenz markierten Salmonellen-Stämme wurden daraufhin überprüft, inwieweit Zusätze von 75, 100, 150 und 200 mg Nalidixinsäure pro Liter BPLS-Agar eine gegebene Keimzahl beeinflussen. Dazu wurden aus derselben Ausgangssuspension zwei Verdünnungsreihen hergestellt und damit jeweils im Doppelansatz parallel Nährböden ohne und mit Zusatz von Nalidixinsäure beimpft. Wie die Ergebnisse in Tabelle 7 erkennen lassen, waren die Schwankungen zwischen den einzelnen Antibiotikastufen nicht größer als die zwischen zwei parallelen Verdünnungsreihen ein und derselben Ausgangssuspension. Erst ab einer Nalidixinsäure-Konzentration von 150 mg/l Agar kam es bei dem S. EnteritidisStamm SE-864r zu einer Keimreduktion, die über die technisch bedingten Schwankungen hinausging. Für den S. Typhimurium-Stamm ST-485r ergab sich bis zu einer Nalidixinsäure-Konzentration von 200 mg/l Agar keine Reduktion der Keimzahl. Damit war das Ziel, beide Stämme mit einer Resistenz gegen 100 mg Nalidixinsäure/l BPLS-Agar zu markieren, erreicht. 4 ERGEBNISSE 91 Wachstum vom S. Enteritidis-Stamm SE-864r und S. TyphimuriumStamm ST-485r auf unterschiedlich supplementiertem und unsupplementiertem BPLS-Agar Tab. 7: Stamm NalidixinsäureKonzentration [mg/l] KbE/ml Reihe 1 Reihe 2 SE-864r 0 75 100 150 200 9,95 x 108 * 9,18 x 108 9,05 x 108 4,12 x 108 1,00 x 107 1,29 x 109 1,40 x 109 9,40 x 108 2,95 x 108 1,40 x 107 ST-485r 0 75 100 150 200 1,14 x 109 1,26 x 109 1,09 x 109 1,78 x 109 1,05 x 109 1,46 x 109 1,54 x 109 1,67 x 109 1,69 x 109 1,75 x 109 * Mittel aus einem Doppelansatz 4.2 Vorversuche zur Auswahl geeigneter Stämme, Organe und der Infektionsdosis für die Versuche zum Infektionsverlauf Ziel war es, aus den jeweils fünf zur Verfügung gestellten S. Enteritidis- und S. Typhimurium-Stämmen jeweils einen geeigneten Stamm für die Versuche zum Infektionsverlauf (Hauptversuche) zu ermitteln. Zudem sollte bestimmt werden, welche Organe eine hohe Isolierungsrate aufweisen und damit für die weiteren qualitativen und quantitativen Untersuchungen von Interesse sind, sowie welche Infektionsdosis für die Hauptversuche geeignet ist. Der erste Abschnitt der Vorversuche diente dazu, aus den fünf Stämmen pro Serovar zunächst jeweils zwei Stämme herauszufinden, die bei Enten zu möglichst hohen Infektionsraten des Caecums und weiteren Organen führen. Gleichzeitig war zu klären, aus welchen Organen sie sich am häufigsten reisolieren lassen. Hierzu 92 4 ERGEBNISSE wurden Enten im Alter von 4 und 7 Tagen mit je einem Salmonellen-Stamm mit einer Infektionsdosis von 1 x 106 KbE/Tier oral infiziert, nach 7 Tagen getötet, Caecum, Leber, Herz, Lunge, Gallenblase und Gehirn entnommen und diese qualitativ sowie Leber und Caecum auch quantitativ auf Salmonellen untersucht. Die Ergebnisse des zweiten Abschnitts der Vorversuche sollten dazu dienen, eine endgültige Entscheidung darüber zu treffen, welcher Stamm je Serovar mit welcher Infektionsdosis in den Hauptversuchen zum Infektionsverlauf zum Einsatz kommen sollte. Hierzu wurden Gruppen entweder am 4. oder am 7. Lebenstag mit den im ersten Abschnitt ermittelten S. Enteritidis- oder S. Typhimurium-Stämmen in drei unterschiedlichen Dosierungen (1 x 103; 1 x 106; 1 x 109 KbE/Tier) oral infiziert. Nach 5 bzw. 14 Tagen wurden die Tiere einer Gruppe zur Probengewinnung getötet (siehe hierzu auch Tab. 4). Im Folgenden werden die Ergebnisse der beiden Abschnitte der Vorversuche getrennt unter den Gesichtspunkten zur Stammauswahl (siehe 4.2.1), zur Organauswahl (siehe 4.2.2) und zur Festlegung der Infektionsdosis (siehe 4.2.3) dargestellt. Signifikante Unterschiede werden innerhalb der Abbildungen durch verschiedene Buchstaben gekennzeichnet. Die in den qualitativen Untersuchungen erhobenen Daten werden als Isolierungsraten in Prozent und die quantitativen Daten als Keimzahlen bzw. als Kolonie bildende Einheiten (KbE) pro Gramm Organ angegeben. 4 ERGEBNISSE 93 4.2.1 Auswahl geeigneter Stämme 4.2.1.1 Salmonella Enteritidis Von den fünf im ersten Abschnitt der Vorversuche eingesetzten unmarkierten S. Enteritidis-Stämmen (Abb.6; Daten siehe 9.3, Tab. 11) gelang bei dem Stamm SE-864 mit insgesamt 28,3 % die Isolierung aus Caecum, Galle, Gehirn, Herz, Leber und Lunge im Vergleich mit den anderen verwendeten Stämmen, mit Ausnahme von SE-059, signifikant häufiger. Die Stämme SE-059 und SE-391 wurden mit 15 % und 11,7 % weniger häufig isoliert. Stamm SE-058 war kaum (3,3 %) in den Organen nachzuweisen und Stamm SE-191 führte nicht zur Infektion. 100 90 Isolierungsrate [%] 80 70 60 50 40 30 a 20 a,b b,c 10 c b,c 0 0 SE-864 SE-391 SE-058 SE-059 SE-191 Stammbezeichnung Abb. 6: Isolierungsraten verschiedener S. Enteritidis-Stämme 7 Tage p.i.; Ergebnisse aus Caecum, Galle, Gehirn, Herz, Leber und Lunge von jeweils 10 Enten pro Stamm zusammengefasst (=ˆ 60 Organproben) 94 4 ERGEBNISSE In Abbildung 7 (Daten siehe 9.3, Tab. 10) werden die in den quantitativen Untersuchungen ermittelten Keimzahlen als Kolonie bildende Einheiten der im ersten Versuchsabschnitt verwendeten S. Enteritidis-Stämme aus der Leber dargestellt. Wie auch bei den Isolierungsraten nach qualitativer Isolierung (Abb. 6) konnten aus den Lebern der mit SE-864, SE-391 und SE-059 infizierten Tiere im Mittel pro Gramm Gewebe die meisten Kolonie bildenden Einheiten isoliert werden. Im quantitativen Verfahren konnten die Stämme SE-058 und SE-191 aus der Leber nicht nachgewiesen werden. Die quantitative Reisolierung aus den Caeca wurde versucht, eine Auswertung war jedoch aufgrund des massiven Wachstums der natürlichen Caecumflora nicht möglich, da zu diesem Zeitpunkt noch nicht die Markierung mit einer Nalidixinsäure-Resistenz erfolgt war. Bei den Stämmen SE-864, SE-391 und SE-059 bestanden keine signifikanten Unterschiede zwischen den aus der Leber isolierten Keimzahlen. Aufgrund der jeweils höchsten Keimzahlen und Isolierungsraten wurden die Stämme SE-864 und SE-059 für die weiteren Untersuchungen ausgewählt und mit einer Nalidixinsäure-Resistenz markiert (siehe 4.1.1). 8 7 KbE / g [log 10] 6 5 4 3 a a a,b 2 1 b b 0 0 SE-864 SE-391 SE-058 0 SE-059 SE-191 Stammbezeichnung Abb. 7: Mittlere Keimzahl bei fünf S. Enteritidis-Stämmen in der Leber 7 Tage p.i. (je Stamm n= 10) 4 ERGEBNISSE 95 Im zweiten Abschnitt der Vorversuche konnte der Stamm SE-059r aus Caecum, Galle, Leber und Lunge nicht signifikant häufiger isoliert werden als der Stamm SE-864r (Abb. 8; Daten siehe 9.3, Tab. 16). Auch bei der Betrachtung aller Organe gemeinsam als Mittelwert, konnten keine signifikanten Unterschiede bezüglich der Isolierungsraten zwischen den Stämmen SE-864r und SE-059r ermittelt werden. SE-864r SE-059r 100 a1 a1 90 Isolierungsrate [%] 80 70 a3 60 a3 50 am am 40 30 a4 20 a2 10 a4 a2 0 Caecum Galle Leber Lunge Mittelwert Organ Abb. 8: Vergleich der Isolierungsraten zweier S. Enteritidis-Stämme (SE-864r, SE-059r) aus verschiedenen Organen (je Organ n=60). Ergebnisse von drei Versuchen mit unterschiedlichen Infektionsdosen (103, 106, 109 KbE) zusammengefasst Während der Stamm SE-864 im ersten Abschnitt der Vorversuche höhere prozentuale Isolierungsraten als SE-059 erzielte, war dies im zweiten Abschnitt der Vorversuche umgekehrt. Es bestanden jedoch keine signifikanten Unterschiede in der Besiedlungsfähigkeit zwischen den beiden Stämmen. 96 4 ERGEBNISSE Auch in den quantitativen Untersuchungen kam es nach der Verabreichung unterschiedlicher Infektionsdosen bei den beiden S. Enteritidis-Stämmen SE-864r und SE-059r zu ähnlichen Keimzahlen in Caecum (Abb. 14) und Leber (Abb. 15) (siehe Kapitel 4.2.3). Nur zwei Wochen nach der Infektion wurde SE-864r bei Zusammenfassung aller Werte in geringerer Anzahl aus dem Caecum isoliert. Die vorgestellten Ergebnisse zeigen grundsätzlich ein ähnliches Infektionsverhalten der Stämme SE-864r und SE-059r auf und lassen nicht den Schluss zu, dass einer der beiden verwendeten S. Enteritidis-Stämme besser für die Infektion der Enten im Hauptversuch geeignet wäre. Da es sich bei dem Stamm SE-864r gleichzeitig um den Phagentyp (PT) 4 handelt, lag es nahe, diesen für den folgenden Hauptversuch auszuwählen, da er eine besondere epidemiologische Bedeutung hat und auch beim Menschen am häufigsten vorkommt. 4.2.1.2 Salmonella Typhimurium Aufgrund der Erfahrungen aus den quantitativen Untersuchungen mit den unmarkierten S. Enteritidis-Stämmen wurden die fünf S. Typhimurium-Stämme nur als Nalidixinsäure-resistente Mutanten (vgl. 4.1) eingesetzt. S. Typhimurium (Abb. 9; Daten siehe 9.3, Tab. 13) konnte mit bis zu 53,3 % insgesamt wesentlich häufiger aus Caecum, Galle, Gehirn, Herz, Leber und Lunge isoliert werden als S. Enteritidis (Abb. 6) mit maximal 28,3 % (siehe auch Kapitel 4.6.). Zudem waren zwischen den fünf S. Typhimurium-Stämmen, im Gegensatz zu S. Enteritidis, keine signifikanten Unterschiede bei den Isolierungsraten vorhanden. Der Stamm ST-485r konnte aus über der Hälfte (53,3 %) der untersuchten Organproben isoliert werden, Stamm ST-360r aus genau der Hälfte der Proben. Die Isolierungsraten der übrigen Stämme bewegten sich zwischen 41 % und 43 %. 4 ERGEBNISSE 97 100 90 Isolierungsrate [%] 80 70 60 a a 50 a a a 40 30 20 10 0 ST-485r ST-360r ST-265r ST-279r ST-148r Stammbezeichnung Abb. 9: Isolierungsraten verschiedener S. Typhimurium-Stämme 7 Tage p.i.; Ergebnisse aus Caecum, Galle, Gehirn, Herz, Leber und Lunge von jeweils 10 Enten pro Stamm zusammengefasst (=ˆ 60 Organproben) Bei den quantitativen Untersuchungen konnten im ersten Abschnitt der Vorversuche, wie sich aus Abbildung 10 (Daten siehe 9.3, Tab. 12) entnehmen lässt, bei allen fünf eingesetzten S. Typhimurium-Stämmen sowohl aus der Leber als auch aus dem Caecum Salmonellen isoliert werden. Hierbei lagen die aus den Caeca isolierten mittleren Keimzahlen im Allgemeinen um etwa 2,5 bis 3 Zehnerpotenzen höher als die aus den Lebern. Die Keimzahlen in der Leber betrugen etwa 102 KbE/g. Nach Infektion mit dem Stamm ST-485r konnten die höchsten Keimzahlen aus der Leber isoliert werden, jedoch gleichzeitig die geringsten aus dem Caecum. Da nur in Einzelfällen signifikante Unterschiede zwischen den Keimzahlen der Stämme bestanden (Abb. 10), wurden auch in diesem Fall in erster Linie die Ergebnisse der qualitativen Untersuchungen zur Auswahl der Stämme für den zweiten Versuchsabschnitt herangezogen. Aufgrund der höchsten Isolierungsraten wurden für die weiteren Untersuchungen die beiden Stämme ST-485r und ST-360r ausgewählt. 98 4 ERGEBNISSE 8 b 7 Caecum Leber a, b 6 a, b a KbE / g [log 10] a 5 4 c c, d 3 c, d c, d d 2 1 0 ST-485r ST-360r ST-265r ST-279r ST-148r Stammbezeichnung Abb. 10: Mittlere Keimzahl bei fünf S. Typhimurium-Stämmen in Caecum und Leber 7 Tage p.i. (je Stamm n= 10) Im zweiten Abschnitt der Vorversuche konnte der Stamm ST-485r (Abb. 11; Daten siehe 9.3, Tab. 19), wie schon im ersten Abschnitt (Abb. 9), bei den qualitativen Untersuchungen häufiger aus den Organen isoliert werden als ST-360r. Signifikante Unterschiede zwischen den beiden Stämmen bestanden bei der Isolierung aus Leber und Milz. Während ST-485r aus diesen Organen zu 70 % bzw. 74 % isoliert werden konnte, gelang dieses bei ST-360r nur aus 37 % bzw. 42 % der Proben. Auch bei der Betrachtung der gemittelten Isolierungsraten aus allen Organen zusammen konnte der Stamm ST-485r mit 57,6 % signifikant häufiger isoliert werden als ST-360r mit 38,7 %. 4 ERGEBNISSE 99 ST-485r ST-360r 100 90 a1 80 a5 Isolierungsrate [%] a1 a3 70 am 60 50 b5 40 b3 a4 a2 bm a4 30 20 a2 10 0 Caecum Galle Leber Lunge Milz Mittelwert Organ Abb. 11: Vergleich der Isolierungsraten zweier S. Typhimurium-Stämme (ST-485r, ST-360r) aus verschiedenen Organen (je Organ ST-485r n=50; ST-360r n =60). Ergebnisse von drei Versuchen mit unterschiedlichen Infektionsdosen (103, 106, 109 KbE) zusammengefasst Die Bestimmung der Keimgehalte im Caecum (Abb. 17) (siehe Abschnitt 4.2.3) nach Infektion mit unterschiedlichen Dosen ergab insgesamt keine signifikanten Unterschiede zwischen den Stämmen, während aus der Leber (Abb. 18) sowohl am 5. als auch am 14. Tag p.i. bei den Stamm ST-485r insgesamt signifikant mehr Kolonien (jeweils p=0,007) isoliert werden konnten als bei dem Stamm ST-360r. Da der Stamm ST-485r qualitativ signifikant häufiger Organe infiziert hatte und zumindest in der Leber auch quantitativ insgesamt signifikant höhere Keimzahlen erreichte, wurde er für die Infektion der Enten zur Untersuchung des Infektionsverlaufes in den Hauptversuchen ausgewählt. Ein weiterer Grund, diesen Stamm zu wählen, lag darin, dass es sich um den Phagentyp DT8 handelt, der zurzeit besonders häufig unter den S. Typhimurium-Isolaten der Ente vertreten ist. 100 4 ERGEBNISSE 4.2.2 Auswahl geeigneter Organe Zur Auswahl geeigneter Organe für die Isolierung der Salmonellen wurden die Ergebnisse des ersten Abschnittes der Vorversuche unter dem Aspekt der Isolierungsraten aus Caecum, Gallenblase, Gehirn, Herz, Leber und Lunge von S. Typhimurium unabhängig vom jeweiligen zur Infektion verwendeten Stamm ausgewertet. S. Typhimurium (Abb. 12; Daten siehe 9.3, Tab. 13) konnte aus allen untersuchten Organen der Enten isoliert werden. a 100 a 90 Isolierungsrate [%] 80 70 60 d 50 40 30 b 20 b,c 10 c 0 Caecum Galle Gehirn Herz Leber Lunge Organ Abb. 12: Isolierungsraten aus verschiedenen Organen (je Organ n= 50); ermittelt aus allen im ersten Abschnitt verwendeten fünf S. TyphimuriumStämmen 4 ERGEBNISSE 101 Die höchsten Isolierungsraten wurden aus Caecum (100 %), Leber (92 %) und Lunge (52 %) erzielt, deutlich geringer war der Nachweis aus Gallenblase (22 %), Herz (8 %) und Gehirn (4 %). Während zwischen den Isolierungsraten aus Caecum und Leber keine signifikanten Unterschiede bestanden, war die Nachweisrate aus den übrigen untersuchten Organen signifikant geringer. Aufgrund dieser Daten wurden als Organe für die weiterführenden Untersuchungen Caecum, Leber und Lunge ausgewählt. Die Gallenblase wurde als viertes zu untersuchendes Organ bestimmt, da diese bei S. Typhimurium verhältnismäßig hohe Isolierungsraten aufwies. Nachdem im ersten Abschnitt eine Vorauswahl der zu untersuchenden Organe getroffen wurde, sollte diese Auswahl im zweiten Abschnitt der Vorversuche weiter eingegrenzt werden. Daher wurden nach Infektion mit S. Enteritidis Caecum, Gallenblase, Leber und Lunge qualitativ untersucht und die Isolierungsraten bewertet. Dabei bestätigten die sich in den vorherigen Untersuchungen erarbeiteten Ergebnisse derart, dass das Caecum und die Leber unabhängig vom verwendeten Stamm und der verwendeten Dosierung deutlich häufiger mit Salmonellen belastet waren als die Lunge oder die Gallenblase (Abb. 8 und Abb. 13). Für die Untersuchungen mit S. Typhimurium wurde zusätzlich die Milz mit einbezogen. Wie sich aus den Abbildungen 11 und 16 entnehmen lässt, gilt auch für eine Infektion mit S. Typhimurium, dass sich aus dem Caecum und der Leber deutlich häufiger Salmonellen isolieren lassen, als aus der Lunge oder der Gallenblase. Die Milz war ähnlich häufig infiziert wie die Leber. Aufgrund dieser Ergebnisse wurden Caecum, Leber und Milz als Organe für die Untersuchungen zum Infektionsverlauf im Hauptversuch ausgewählt. 102 4 ERGEBNISSE 4.2.3 Festlegung der Infektionsdosis Für die Untersuchungen zum Infektionsverlauf im Hauptversuch war es erforderlich, eine Infektionsdosis zu ermitteln, die die Infektion aller Tiere sicherstellt. Hierzu wurden im zweiten Abschnitt der Vorversuche Infektionsdosen von 1 x 103, 1 x 106 und 1 x 109 KbE pro Tier gewählt. Für je zwei S. Enteritidis- und je zwei S. Typhimurium-Stämme wurden pro Infektionsdosis am 4. und am 7. Lebenstag je eine Gruppe Enten, bestehend aus 10 Tieren, eingesetzt. (Daten siehe 9.3.2, Tab. 14-19). Nach Infektion mit S. Enteritidis (Abb. 13; Daten siehe 9.3, Tab. 16) stieg die Isolierungsrate aus den Organen mit Erhöhung der Infektionsdosis tendenziell, jedoch nicht signifikant an. Hierbei wurden die Daten für beide Stämme und die Untersuchungszeitpunkte am 5. und 14. Tag p.i. zusammengefasst. Infektionsdosis: 1 x 103 KbE 1 x 106 KbE 1 x 109 KbE a1 100 Isolierungsrate [%] 90 a1 a1 80 70 a3 60 50 a3 am a3 30 a4 20 10 a2 a2 a2 am am 40 a4 a4 0 Caecum Galle Leber Lunge Mittelwert Organ Abb. 13: Isolierungsraten aus verschiedenen Organen (pro Organ und Dosis n= 40) in Abhängigkeit zur Infektionsdosis der zwei verwendeten S. Enteritidis-Stämme (5 und 14 Tage p.i.) 4 ERGEBNISSE 103 Die Höhe der Infektionsdosis beeinflusste nicht signifikant die quantitativ ermittelten Keimzahlen der S. Enteritidis-Stämme im Caecum (Abb. 14; Daten siehe 9.3, Tab. 14). Fünf Tage nach der Infektion bewegten sich die Keimzahlen der unterschiedlichen Infektionsdosen innerhalb einer Zehnerpotenz, 14 Tage p.i. innerhalb von zwei Zehnerpotenzen. Zwei Wochen nach der Infektion waren die Keimzahlen der mit SE-864r infizierten Tiere im Verhältnis zu denen von SE-059r um etwa eineinhalb Zehnerpotenzen abgesunken. Die Dosierung von 1 x 103 KbE 14 Tage p.i. führt bei diesem Stamm zu geringeren Keimzahlen. 8 a1 a2 7 a1 a1 a2 a4 a2 a4 KbE/g [log10] 6 a4 am 5 am a3 a3 4 bm a3 3 am 2 1 r SE-059 SE-864 0 103 103 106 106 109 Infektionsdosis [KbE] r SE-864 109 103 5 dpi Abb. 14: 106 r SE-059 109 103 106 Infektionsdosis [KbE] r 109 14 dpi Quantitativer Nachweis von S. Enteritidis im Caecum (n= 10) bei zwei Stämmen in Abhängigkeit von der Infektionsdosis 5 und 14 Tage p.i. (Querstrich = Mittelwert aller Dosierungen) Auch die mittleren Keimzahlen von S. Enteritidis im Lebergewebe (Abb. 15; Daten siehe 9.3, Tab. 15) ließen weder 5 noch 14 Tage nach der Infektion einen Zusammenhang zu der Höhe der Infektionsdosis erkennen. Allerdings waren in der Leber 14 Tage p.i. nur noch wenige Kolonien nachweisbar. 104 4 ERGEBNISSE 4,5 4 3,5 KbE/g [log10] 3 2,5 a2 a2 a1 a2 a1 a1 am 2 SE-864 r SE-059 1,5 a4 1 a3 a3 a4 r SE-864 103 SE-059 103 106 106 109 Infektionsdosis [KbE] 5 dpi Abb. 15: a4 a3 0,5 0 r am r 0 109 103 106 am am 109 103 106 Infektionsdosis [KbE] 109 14 dpi Quantitativer Nachweis von S. Enteritidis in der Leber (n= 10) bei zwei Stämmen in Abhängigkeit von der Infektionsdosis 5 und 14 Tage p.i. (Querstrich = Mittelwert aller Dosierungen) Nach der Applikation von S. Typhimurium (Abb. 16; Daten siehe 9.3, Tab. 19) stiegen die Isolierungsraten bei höherer Infektionsdosis z. T. signifikant an. Hierbei kam es zu einem signifikanten Anstieg der Anzahl positiver Proben aus Caecum, Leber und Milz bei dem Einsatz einer Dosierung von 1 x 106 anstelle von 1 x 103 KbE/Tier. Dieser signifikante Anstieg der Isolierungsrate ließ sich bei einer weiteren Erhöhung der Infektionsdosis auf 1 x 109 KbE/Tier nicht mehr beobachten. Im Unterschied dazu bestand bei der Gallenblase zwischen der niedrigen und der mittleren Dosierung kein deutlicher Unterschied in der Isolierungsrate, während sich durch die Verabreichung der hohen Infektionsdosis diese Rate signifikant steigern ließ. Am deutlichsten war eine Korrelation zwischen der verabreichten Dosis und dem Salmonellen-Nachweis in der Lunge zu erkennen: Die Verwendung der niedrigen Dosierung ließ keine Isolierung der Keime zu, bei der mittleren waren es 4 ERGEBNISSE 105 27,5 %; dieser Wert konnte durch die hohe Dosierung auf 57,5 % erhöht werden. Werden die Ergebnisse für alle Organe als Mittelwert zusammengefasst, steigt nach Infektion mit S. Typhimurium – im Gegensatz zu einer Infektion mit S. Enteritidis – die Isolierungsrate mit Erhöhung der Infektionsdosis signifikant an. Infektionsdosis: 1 x 103 KbE 1 x 106 KbE 1 x 109 KbE b1 100 b1 Isolierungsrate [%] 90 b5 80 b3 70 c4 bm 50 40 cm b5 b3 60 b2 a1 b4 30 a3 20 am a5 a2 a4 a2 10 0 0 Caecum Galle Leber Lunge Milz Mittelwert Organ Abb. 16: Isolierungsraten aus verschiedenen Organen (pro Organ bei 103 KbE n= 30; 106 und 109 KbE n= 40) in Abhängigkeit zur Infektionsdosis der zwei verwendeten S. Typhimurium-Stämme (5 und 14 Tage p.i.) Auch die quantitative Untersuchung von S. Typhimurium im Caecuminhalt (Abb. 17; Daten siehe 9.3, Tab. 17) ergab sowohl 5 Tage p.i. als auch 14 Tage p.i. mit steigender Infektionsdosis einen deutlichen und z. T. signifikanten Anstieg der Keimzahlen. 106 4 ERGEBNISSE 8 c1 7 b2 6 b3 b1 KbE/g [log10] a2 5 am a3 a2 4 a3 b4 am b4 3 am 2 am a4 1 a1 ST-360 0 103 106 r r ST-485 6 109 103 10 Infektionsdosis [KbE] ST-360 109 5 dpi Abb. 17: 103 106 r r ST-485 109 103 106 Infektionsdosis [KbE] 109 14 dpi Quantitativer Nachweis von S. Typhimurium im Caecum (n= 10; ST-485r, 103 KbE, n= 5) bei zwei Stämmen in Abhängigkeit von der Infektionsdosis 5 und 14 Tage p.i. (Querstrich = Mittelwert aller Dosierungen) Bei der quantitativen Untersuchung der Leber (Abb. 18; Daten siehe 9.3, Tab. 18) wurden 5 Tage nach der Infektion signifikant zunehmende Salmonellenzahlen bei steigender Infektionsdosis nachgewiesen, während 14 Tage p.i. keine Steigerung der Keimzahlen bei steigender Infektionsdosis auftrat. 4 ERGEBNISSE 107 4,5 c2 4 c1 b2 3,5 r KbE/g [log10] ST-485 b1 3 a4 am 2,5 a2 a4 2 ST-360 am 1,5 r a4 a3 a3 1 am a3 0,5 a1 ST-360 0 0 103 106 r ST-485 103 106 109 Infektionsdosis [KbE] 5 dpi Abb. 18: am r 109 103 106 109 103 106 Infektionsdosis [KbE] 109 14 dpi Quantitativer Nachweis von S. Typhimurium in der Leber (n= 10) bei zwei Stämmen in Abhängigkeit von der Infektionsdosis 5 und 14 Tage p.i. (Querstrich = Mittelwert aller Dosierungen) Zusammenfassend lässt sich feststellen, dass sich die prozentualen Isolierungsraten mit steigender Infektionsdosis erhöhten. Auch bezogen auf die mittleren Keimzahlen deutete sich tendenziell ein ähnlicher Zusammenhang an. Sowohl die Ergebnisse der qualitativen als auch der quantitativen Untersuchung betreffend war eine signifikante Korrelation zwischen der Infektionsdosis und der Isolierung von Salmonellen nur bei S. Typhimurium nachzuweisen. 108 4 ERGEBNISSE Schlussfolgerungen für die Untersuchungen zum Infektionsverlauf Die zu wählende Keimdosis muss sicherstellen, dass eine Infektion erfolgt. Hierzu war eine Dosis von 1 x 103 KbE/Tier zumindest bei Enten im Alter von 4 bis 7 Tagen nicht grundsätzlich in der Lage. Eine Dosierung von 1 x 109 KbE/Tier schien gegenüber von 1 x 106 KbE/Tier prinzipiell keinen Vorteil zu bieten. Daher wurde für Studien über den Infektionsverlauf zunächst die Dosierung 1 x 106 KbE/ Tier gewählt. Da sich später herausstellte, dass sich bei älteren Tieren ab dem 15. Lebenstag die gewählte Infektionsdosis als zu gering erwies, wurden in den Wiederholungsversuchen diese Tiere mit einer Dosis von 1 x 109 KbE/Tier infiziert. 4.3 Zeitlicher Infektionsverlauf in Abhängigkeit vom Alter der Enten (Hauptversuch) Die Untersuchungen zum Infektionsverlauf in Abhängigkeit vom Alter der Ente (Hauptversuche) erfolgten mit den in den Vorversuchen ausgewählten Stämmen S. Enteritidis (SE-864r) und S. Typhimurium (ST-485r) zeitlich nacheinander und zwar – bezeichnet nach den zur Infektion verwendeten Salmonellen – in folgender Reihenfolge: 1. S. Enteritidis (1. Versuch) 2. S. Typhimurium (1. Versuch) 3. S. Enteritidis (2. Versuch, auch als Wiederholungsversuch bezeichnet) 4. S. Typhimurium (2. Versuch, auch als Wiederholungsversuch bezeichnet) Je Versuch wurden Gruppen für verschiedene Altersstufen zum Zeitpunkt der Infektion gebildet und mit Buchstaben bezeichnet: Gruppe A (5. LT), Gruppe B (8. LT), Gruppe C (15. LT), Gruppe D (22. LT) und Gruppe E (43. LT). In jeder Altersstufe wurden Teilgruppen gebildet und 3, 5, 7, 14 und 21 Tage, teilweise auch 28 Tage nach der Infektion auf das Vorhandensein der inokulierten Salmonellen- 4 ERGEBNISSE 109 Stämme untersucht. Dies sollte die Bewertung des Infektionsverlaufes in Abhängigkeit vom Alter zum Zeitpunkt der Infektion ermöglichen. Die Auswertung erfolgte mit qualitativen und quantitativen Nachweisverfahren. Nachfolgend werden zunächst die Ergebnisse der qualitativen Untersuchungen als Isolierungsraten, danach die Resultate der quantitativen Untersuchungen präsentiert. Die Gliederung erfolgte nach den Organen, aus denen die inokulierten Salmonellen nachgewiesen wurden. 4.3.1 Isolierungsraten Die Organe Caecum, Leber und Milz wurden qualitativ auf das Vorhandensein von Salmonellen untersucht. Der Auswertung lagen für die Untersuchungszeitpunkte zehn Proben pro Gruppe zugrunde, mit Ausnahme des 28. Tag p.i., an dem nur fünf Proben zur Verfügung standen. Im Folgenden werden die als salmonellenpositiv ermittelten Proben als Isolierungsrate in Prozent angegeben. Durch einen erneuten Ausstrich der Proben nach 48-stündiger Anreicherung in TBG-Bouillon konnten im Vergleich zu der 24-stündigen Anreicherung zusätzlich Salmonellen nachgewiesen werden. Den Anstieg der Isolierungsraten aus den qualitativen Untersuchungen gibt Tabelle 8 wieder. Tab. 8: Anstieg der Isolierungsraten durch 48-stündige Anreicherung in TBG-Bouillon Anzahl untersuchter Proben [n] Anzahl positiver Proben nach 48 h 24 h Anreicherung Anreicherung Steigerung der Isolierungsrate [%] Caecum 550 317 335 5,7 Leber 550 146 170 16,4 Milz 550 110 125 13,6 110 4.3.1.1 4 ERGEBNISSE Caecum Die Ergebnisse für beide Versuche mit S. Enteritidis (Abb. 19; Daten siehe 9.3, Tab. 22) und für beide Versuche mit S. Typhimurium (Abb. 20; Daten siehe 9.3, Tab. 25) wurden jeweils zusammengefasst dargestellt, da sich die Daten des ersten Versuches und des Wiederholungsversuches ähnelten. Betrachtet man die Isolierungsraten beider Serovaren in Abhängigkeit vom Alter, so zeigte sich bei den Tieren, die zum Zeitpunkt der Infektion jünger waren, eine Tendenz zu einer verzögerten Abnahme der Nachweisrate im Vergleich zu den älteren Tieren. Nach einer Infektion mit S. Enteritidis (Abb. 19) schien es früher zu einer Elimination der Salmonellen aus dem Caecum zu kommen, als dieses nach der Infektion mit S. Typhimurium (Abb. 20) der Fall war. Während 28 Tage nach der Infektion S. Enteritidis nur noch bei einer Altersgruppe aus 20 % der Proben isoliert werden konnte (Abb. 19), war dieses bei S. Typhimurium noch immerhin in vier von fünf Altersgruppen in 20 bis zu 40 % der Fälle möglich. Die Elimination der Salmonellen aus dem Caecum begann je nach Tiergruppe im Allgemeinen bereits 5 oder 7 Tage nach der Infektion. Für beide SalmonellenSerovaren zeigte sich, dass bei Enten, die am 5. und 8. Lebenstag infiziert wurden, ein mit über 50 % relativ großer Anteil der Tiere bis zum 14. Tag p.i. Salmonellen im Caecum aufwies. Danach reduzierte sich die Isolierungsrate deutlich. Die zugehörigen Kurven in den Grafiken weisen einen eher konvexen Verlauf auf. Die entsprechenden Kurven für Enten, die im Alter von etwa 3 und 6 Wochen infiziert wurden, deuten eher eine konkave Form an, d.h. die Nachweisrate sank bereits zum 7. und 14. Tag p.i. hin deutlich und nahm danach langsamer ab. Enten, die im Alter von ca. 2 Wochen (15. LT) infiziert wurden, wiesen eine gleichförmige Abnahme der Infektionsrate auf, die zwischen diesen Gruppierungen liegt; die entsprechende Kurve in den Grafiken weist daher tendenziell einen linearen Verlauf auf, ähnlich wie der Verlauf der Kurve, die die Mittelwerte aus den erhobenen Einzeldaten darstellt. 4 ERGEBNISSE 111 100 Isolierungsrate [%] 80 Alter bei Infektion: A (5. LT) 60 B (8. LT) C (15. LT) D (22. LT) E (43. LT) 40 Mittelwert 20 0 0 5 10 15 20 25 30 Tage p. i. Isolierungsraten aus dem Caecum nach Infektion mit S. Enteritidis in Abhängigkeit vom Alter zum Zeitpunkt der Infektion Abb. 19: 100 Isolierungsrate [%] 80 Alter bei Infektion: A (5. LT) 60 B (8. LT) C (15. LT) D (22. LT) 40 E (43. LT) Mittelwert 20 0 0 5 10 15 20 25 30 Tage p. i. Abb. 20: Isolierungsraten aus dem Caecum nach Infektion mit S. Typhimurium in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 112 4.3.1.2 4 ERGEBNISSE Leber Während keine deutlichen Unterschiede im Verlauf der Infektion im Caecum bei den beiden verwendeten Stämmen unterschiedlicher Serovaren festgestellt werden konnten, war dieses bei der Leber der Fall. Abbildungen 21 und 22 (Daten siehe 9.3, Tab. 22 und 25) zeigen die Anzahl Salmonellen-positiver Leberproben in Abhängigkeit vom Alter der Enten bei der Infektion über einen Zeitraum von vier Wochen, wobei wiederum die Ergebnisse von jeweils zwei Versuchsdurchgängen mit S. Enteritidis (Abb. 21) und mit S. Typhimurium (Abb. 22) zusammengefasst wurden. Sowohl S. Enteritidis (Abb. 21) als auch S. Typhimurium (Abb. 22) waren in der Lage, bereits drei Tage nach der Infektion die Leber zu besiedeln. Dieses war bei einer Infektion mit S. Typhimurium (Abb. 22) bei mehr Tieren der Fall als bei S. Enteritidis (Abb. 21). Das Maximum der Infektion der Leber schien bei S. Enteritidis um den 5. Tag nach der Infektion zu liegen (4 von 5 Gruppen), während bei S. Typhimurium dieses Maximum sehr uneinheitlich zwischen dem 3. und 15. Tag p.i. erreicht war. Vergleicht man den Verlauf der Infektion mit S. Enteritidis (Abb. 21) mit dem von S. Typhimurium (Abb. 22), so zeigt sich, dass S. Typhimurium in allen Altersgruppen deutlich häufiger in den Lebern der Enten nachzuweisen war und über einen längeren Zeitraum persisierte. Während S. Enteritidis 14 Tage p.i. nur noch bei Tieren, die am 5. Lebenstag (Gruppe A) infiziert wurden, nachweisbar war, (Abb. 21), konnte S. Typhimurium 14 Tage p.i. stets mit einer Rate zwischen 30 % bis 90 % – je nach Altersgruppe – isoliert werden (Abb. 22). In den Lebern der zum Infektionszeitpunkt älteren Tieren der Gruppen C (15. LT), D (22. LT) und E (43. LT) konnten erst 28 Tage p.i. keine Salmonellen mehr nachgewiesen werden. In den Gruppen A (5. LT) und B (8. LT) mit jüngeren Tieren war zum selben Zeitpunkt noch jede fünfte Probe positiv. 4 ERGEBNISSE 113 100 Isolierungsrate [%] 80 Alter bei Infektion: A (5. LT) B (8. LT) C (15. LT) D (22. LT) E (43. LT) Mittelwert 60 40 20 0 0 5 10 15 20 25 30 Tage p.i. Abb. 21: Isolierungsraten aus der Leber nach Infektion mit S. Enteritidis in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 100 Isolierungsrate [%] 80 Alter bei Infektion: A (5. LT) B (8. LT) C (15. LT) D (22. LT) E (43. LT) Mittelwert 60 40 20 0 0 5 10 15 20 25 30 Tage p.i. Abb. 22: Isolierungsraten aus dem Leber nach Infektion mit S. Typhimurium in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 114 4.3.1.3 4 ERGEBNISSE Milz Die Isolierungsraten aus der Milz zu verschiedenen Zeitpunkten nach der Infektion unterschiedlich alter Entenküken lassen Unterschiede im Verhalten zwischen S. Enteritidis (Abb. 23; Daten siehe 9.3, Tab. 22) und S. Typhimurium (Abb. 24; Daten siehe 9.3, Tab. 25) erkennen. So ergaben sich bei S. Enteritidis generell geringe Isolationsraten, wobei Enten, die am 22. oder 43. Lebenstag infiziert wurden, kaum Salmonellen aufwiesen. Bei jüngeren Tieren war S. Enteritidis anfangs nach der Infektion etwas häufiger, ab dem 7. Tag p.i. allerdings auch nur noch bei wenigen Küken in der Milz zu finden. Aus den Milzen der mit S. Typhimurium infizierten Enten konnten nicht nur häufiger (bis 70 %), sondern auch deutlich länger Salmonellen isoliert werden, nämlich bei 4 von 5 Altersgruppen (Gruppe A-D) noch 21 Tage p.i. Während bei einer S. Enteritidis-Infektion bei 4 von 5 Gruppen das Maximum der Nachweisrate am 5. Tag p.i. bereits überschritten war, war dies nach Infektion mit S. Typhimurium bei den drei jüngsten Gruppen mit Infektion am 5., 8. und 15. LT erst nach dem 7. Tag p.i. der Fall. Tendenziell ließ sich für beide Serovaren beobachten, dass die Milzen der zum Zeitpunkt der Infektion jüngeren Enten (Gruppen A und B) häufiger und länger infiziert waren, als die der älteren Tiere (Gruppen D und E). 4 ERGEBNISSE 115 100 Isolierungsrate [%] 80 Alter bei Infektion: 60 A (5. LT) B (8. LT) C (15. LT) D (22. LT) E (43. LT) Mittelwert 40 20 0 0 5 10 15 20 25 30 Tage p.i. Abb. 23: Isolierungsraten aus der Milz nach Infektion mit S. Enteritidis in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 100 Isolierungsrate [%] 80 Alter bei Infektion: A (5. LT) B (8. LT) C (15. LT) D (22. LT) E (43. LT) Mittelwert 60 40 20 0 0 5 10 15 20 25 30 Tage p.i. Abb 24: Isolierungsraten aus der Milz nach Infektion mit S. Typhimurium in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 116 4.3.2 4 ERGEBNISSE Keimzahlen Die Ergebnisse der quantitativen Untersuchungen (KbE/g [log10]) von Caecum und Leber werden nachfolgend dargestellt. Hierbei war auch von Interesse, ob diese die Ergebnisse der qualitativen Untersuchungen ([%]) in Bezug auf das Alter der Enten zum Zeitpunkt der Infektion und den Zeitpunkt p.i. widerspiegeln. 4.3.2.1 Caecum Die Abbildungen 25 (S. Enteritidis; Daten siehe 9.3, Tab. 20) und 26 (S. Typhimurium; Daten siehe 9.3, Tab. 23) zeigen den Verlauf der aus dem Caecum isolierten Keimzahlen nach der Infektion in Abhängigkeit vom Alter zum Zeitpunkt der Infektion. Da es sich um Versuchswiederholungen handelte und die Kurven ähnlich verliefen, wurden die Daten der jeweiligen Serovaren zusammengefasst, um jedem Punkt in der Abbildung eine größere Tierzahl (n=10) zugrunde legen zu können. Sowohl nach Infektion mit S. Enteritidis (Abb. 25) als auch mit S. Typhimurium (Abb. 26) lag die maximal nachgewiesene Salmonellenzahl bei etwa 2 x 107 KbE/g Caecuminhalt. Im Verlauf von 21 Tagen kam es grundsätzlich zu einer Abnahme der Keimzahlen. Bei beiden Serovaren ließ sich aus den Caeca der zum Infektionszeitpunkt jüngsten Tiere (5. und 8. LT) über den Untersuchungszeitraum von 21 Tagen die größte Anzahl an Kolonien isolieren. Im Gegensatz zu S. Typhimurium (Abb. 26) spielt das Alter der Enten bei Infektion mit S. Enteritidis (Abb. 25) eine größere Rolle. Hier war die Trennung der Altersgruppen nicht nur deutlicher ausgeprägt, sondern die Abnahme der Keimzahlen verlief bei den jüngeren Tieren auch deutlich protrahiert. Während sich nach Applikation von S. Typhimurium nur der Infektionsverlauf der beiden jüngeren Gruppen (≤ 1 Woche) von dem der älteren Gruppen (>2 Wochen) signifikant unterscheidet, lassen sich nach S. EnteritidisInfektion statistisch abgesichert drei Gruppen unterscheiden, nämlich ≤ 1 Woche / ~ 2 Wochen / > 3 Wochen. 4 ERGEBNISSE 117 5 4 KbE/g [log10] a a,b Alter bei Infektion: 3 A (5.LT) B (8.LT) C (15.LT) D (22.LT) E (43.LT) b 2 c c 1 0 0 5 10 15 20 25 Tage p.i. Abb. 25: Verlauf der aus dem Caecum isolierten Keimzahlen nach Infektion mit S. Enteritidis in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 5 a 4 KbE/g [log10] a Alter bei Infektion: 3 A (5. LT) b B (8. LT) C (15. LT) 2 D (22. LT) b E (43. LT) b 1 0 0 5 10 15 20 25 Tage p.i. Abb. 26: Verlauf der aus dem Caecum isolierten Keimzahlen nach Infektion mit S. Typhimurium in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 118 4.3.2.2 4 ERGEBNISSE Leber Für die Leber wurden ebenfalls die in Wiederholungsversuchen erhobenen Daten je Salmonellen-Serovar zusammengefasst, um eine größere Tierzahl (n=10) je Untersuchungszeitpunkt zugrunde legen zu können. Die Infektion der Leber mit S. Enteritidis (Abb. 27; Daten siehe 9.3, Tab. 21) und S. Typhimurium (Abb. 28; Daten siehe 9.3, Tab. 22) verlief unterschiedlich. Die Kurvenverläufe spiegeln für beide Salmonellen-Stämme jedoch im Prinzip die Ergebnisse der qualitativen Untersuchungen in der Leber (Abb. 21 und 22) wider. Deutlicher als bei den qualitativen Untersuchungen ließ sich für S. Enteritidis ein Maximum der nachgewiesenen Keimzahlen am 5. Tag p.i. und für S. Typhimurium am 7. Tag p.i. erkennen. Grundsätzlich ließen sich auch quantitativ aus den Lebern der mit S. Typhimurium infizierten Enten Salmonellen nicht nur in deutlich größerer Zahl, sondern auch über einen längeren Zeitraum nachweisen. Während bei S. Typhimurium 21 Tage nach der Infektion aus den Lebern aller Altersgruppen Salmonellen zu isolieren waren, gelang dieses bei S. Enteritidis in keinem einzigen Fall mehr. Betrachtet man die dargestellten Kurvenverläufe unter dem Aspekt des Alters zum Zeitpunkt der Infektion, so lässt sich für beide Serovaren die Aussage treffen, dass grundsätzlich bei jüngeren Tieren nach der Infektion mehr Salmonellen aus der Leber zu isolieren waren als bei den älteren Tieren. Bei S. Enteritidis können in der Leber grundsätzlich zwei Altersklassen gebildet werden (≤ 2 Wochen; > 2 Wochen), da hier teilweise signifikante Unterschiede zwischen dem Infektionsverlauf der Gruppen bestehen. In Bezug auf Gruppe B, die nach der Berechnung mit „SAS“ keine Signifikanz zu den älteren Tieren aufweist, muss gesagt werden, dass der p-Wert zur Gruppe D nur 0,0508 und zu der Gruppe E nur 0,0847 betrug und sich die Gruppen somit dennoch deutlich, wenn auch nicht signifikant, unterscheiden. Für S. Typhimurium ist eine Einteilung nach Altersklassen nach der Statistik nicht möglich. Nur in einem Fall Gruppe C zu Gruppe D - besteht ein signifikanter Unterschied, der auf die ungewöhnlich hohe Keimzahl von Gruppe C am 5. Tag p.i. zurückzuführen ist. 4 ERGEBNISSE 119 2 KbE/g [log 10] 1,5 Alter bei Infektion: A (5. LT) B (8. LT) C (15. LT) D (22. LT) E (43. LT) 1 a,b 0,5 a a b b 0 0 5 10 15 20 25 Tage p.i. Abb. 27: Verlauf der aus der Leber isolierten Keimzahlen nach Infektion mit S. Enteritidis in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 2 1,5 a,b KbE/g [log 10] a a,b Alter bei Infektion: a,b A (5. LT) B (8. LT) C (15. LT) D (22. LT) E (43. LT) 1 b 0,5 0 0 5 10 15 20 25 Tage p.i. Abb. 28: Verlauf der aus der Leber isolierten Keimzahlen nach Infektion mit S. Typhimurium in Abhängigkeit vom Alter zum Zeitpunkt der Infektion 120 4.3.3 4 ERGEBNISSE Wechselbeziehung zwischen dem Salmonellennachweis in verschiedenen Organen und dem Alter der Enten zum Zeitpunkt der Infektion Die Abbildungen 29 und 30 stellen die Isolierungsraten (%) aus Caecum, Leber und Milz in Abhängigkeit vom Alter zum Zeitpunkt der Infektion im Hauptversuch dar. Um die Ergebnisse auf den Einfluss des Alters der Enten zum Infektionszeitpunkt einzuengen, wurden die Isolierungsraten zu verschiedenen Zeitpunkten nach der Infektion als Mittelwert angegeben. Die Abbildungen beziehen sich auf die Ergebnisse des jeweils ersten Versuches nach Infektion mit S. Enteritidis (Abb. 29; Daten siehe 9.3, Tab. 22) bzw. mit S. Typhimurium (Abb. 30; Daten siehe 9.3, Tab. 25). Die Wiederholungs-Versuche wurden nicht in diese Auswertung einbezogen, da dort bei älteren Enten aus anderen Gründen (siehe 4.4) eine höhere Infektionsdosis gewählt wurde. Bei beiden Salmonellen-Serovaren gelang der Nachweis am häufigsten aus dem Caecum. Hierbei war die Nachweisrate z. T. signifikant am höchsten, wenn die Küken am 5. Lebenstag (Gruppe A) infiziert wurden. Nach einer Infektion am 8. Lebenstag (Gruppe B) fiel der Nachweis geringer aus und verringerte sich nochmals z. T. signifikant nach Infektion am 15. Lebenstag (Gruppe C); bei noch späterer Infektion am 22. oder 43. Lebenstag ergab sich bei S. Typhimurium im Gegensatz zu S. Enteritidis keine weitere signifikante Senkung der Isolierungsrate. Die Isolierungsraten aus der Leber sanken z. T. signifikant mit zunehmendem Alter bis zur dritten Woche p.i. Mit weiter zunehmendem Alter der Enten wurde die Nachweisrate nicht geringer. Die Isolierungsraten aus der Milz betreffend war eher ein stetiger Abfall mit zunehmendem Alter zu beobachten, der teilweise signifikant war. 4 ERGEBNISSE 100 121 aC Caecum aC bC Isolierungsrate [%] Leber aC bC 80 Milz bC 60 aL aL aM 40 aM bM aM bM cC aL bL aL bL 20 cM bL A Abb. 29: 100 cM bM 0 0 B C D Gruppenbezeichnung E S. Enteritidis aC Caecum Leber Isolierungsrate [%] aC bC 80 Milz aL aM 60 aL bL 40 bC cC cC aM bM bC cC aL bL aL bL bL bM 20 bM bM 0 A B C D E Gruppenbezeichnung Abb. 30: S. Typhimurium Abb. 29 u. 30: 4.4 Isolierungsraten aus Caecum(C), Leber(L) und Milz(M) in Abhängigkeit vom Alter zum Zeitpunkt der Infektion, unabhängig vom Zeitpunkt der Untersuchung nach der Infektion (Ergebnisse aller Untersuchungstermine p.i. zusammengefasst; statistischer Vergleich nur zwischen den Werten jeweils eines Organs) Beeinflussung der Salmonellen-Isolierungsraten durch die Infektionsdosis In dem jeweils ersten Versuchsdurchgang mit S. Enteritidis und S. Typhimurium ließ sich erkennen, dass bei älteren Enten die Nachweisraten stets geringer ausfielen, und die Salmonellen schneller aus Leber und Milz eliminiert waren. Dies war der Anlass, in den Wiederholungsversuchen Tiere, die 15 Tage und älter waren, mit 1 x 109 anstelle von 1 x 106 KbE/Tier zu inokulieren. 122 4 ERGEBNISSE S . Enteritidis [%] 100 6 9 Infektionsdosis 1x10 KbE Infektionsdosis 1x10 KbE 80 aC aC 60 Caecum Leber 40 Milz aL 20 aL aM aM 0 15 22 43 Mittelwert Lebenstag bei Infektion Abb. 31: 15 22 43 Mittelwert Lebenstag bei Infektion Einfluss der Infektionsdosis auf die Isolierungsraten von S. Enteritidis aus Caecum(C), Leber(L) und Milz(M) bei Enten. (Statistischer Vergleich nur zwischen den Mittelwerten desselben Organs) In den Abbildungen 31 und 32 (Daten siehe 9.3, Tab. 22 und 25) sind für jeweils beide Versuche mit derselben Salmonellen-Serovar die Isolierungsraten unabhängig vom Tag p.i. summarisch dargestellt. Zur besseren Interpretation, trotz gewisser Schwankungen der Ergebnisse innerhalb eines Versuches, wurden die Mittelwerte gebildet. Für S. Enteritidis (Abb. 31) sind diese Werte, unabhängig von der gewählten Infektionsdosis, fast identisch. [%] 100 S . Typhimurium 6 9 Infektionsdosis 1x10 KbE Infektionsdosis 1x10 KbE bC 80 Caecum bL aC 60 bM aL Leber Milz 40 aM 20 0 15 22 43 Lebenstag bei Infektion Abb. 32: Mittelwert 15 22 43 Mittelwert Lebenstag bei Infektion Einfluss der Infektionsdosis auf die Isolierungsraten von S. Typhimurium aus Caecum(C), Leber(L) und Milz(M) bei Enten. (Statistischer Vergleich nur zwischen den Mittelwerten desselben Organs) 4 ERGEBNISSE 123 Für S. Typhimurium (Abb. 32) ergibt sich ein deutlich anderes Bild: Die Isolierungsraten sowohl aus dem Caecum als auch aus Leber und Milz lagen für jede Altersgruppe erkennbar höher, wenn die Enten mit 1 x 109 KbE/Tier infiziert worden waren. So unterschieden sich auch die Mittelwerte für das Caecum (p=0,009), für die Leber (p=0,022) und die Milz (p=0,001) signifikant. 4.5 Salmonellen-Nachweisrate in Abhängigkeit vom Zeitpunkt nach der Infektion Im Folgenden werden die Isolierungsraten (%) aus Caecum, Leber und Milz dargestellt (Abb. 33 und 34; Daten siehe 9.3, Tab. 22 und 25). Die Abbildungen geben an, wie oft an einem bestimmten Tag p.i. unabhängig vom Alter der Enten bei der Infektion im untersuchten Organ Salmonellen nachzuweisen waren. Solch eine Auswertung ist wichtig für die Wahl der Untersuchungszeitpunkte im Infektionsmodell. Diese Art der Auswertung soll ggf. einen Anstieg und eine Reduktion der Salmonellenzahlen in den Organen erkennen lassen. Ferner lässt sich durch zunächst getrennte Darstellung der einzelnen Versuche die Reproduzierbarkeit der Resultate bei einer Salmonellen-Serovar erkennen. Anschließendes Zusammenführen der jeweils zwei Versuche mit derselben Serovar soll zeigen, wie sich die für S. Enteritidis (Abb. 35) bzw. S. Typhimurium (Abb. 36) erhobenen Daten zueinander verhalten. 124 4 ERGEBNISSE 100 100 Caecum Leber Milz 60 40 Caecum Leber Milz 80 Isolierungsrate [%] Isolierungsrate [%] 80 60 40 20 20 0 0 0 5 10 15 Tage p. i. 20 0 25 Abb. 33a: S. Enteritidis 5 10 15 Tage p. i. 20 25 30 Abb. 33b: S. Enteritidis (Wiederholungsversuch) 100 60 40 20 Caecum Leber Milz 80 Isolierungsrate [%] 80 Isolierungsrate [%] 100 Caecum Leber Milz 60 40 20 0 0 0 5 10 15 20 25 Tage p. i. Abb. 34a: S. Typhimurium 0 5 10 15 20 25 30 Tage p.i. Abb. 34b: S. Typhimurium (Wiederholungsversuch) Abb. 33 und 34: Isolierungsraten aus Caecum, Leber und Milz (n=25) in Abhängigkeit vom Zeitpunkt nach der Infektion (Tage p.i.) Da die Versuche mit S. Enteritidis (Abb. 33a und b) und S. Typhimurium (Abb. 34a und b) den zeitlichen Verlauf der Isolierungsraten betreffend sehr ähnlich verliefen, wurden die Ergebnisse jeweils für S. Enteritidis (Abb. 35) und S. Typhimurium (Abb. 36) zusammengefasst, um den Daten eine größere Anzahl an Tieren zugrunde legen zu können. 4 ERGEBNISSE 125 100 Caecum Leber Milz Isolierungsrate [%] 80 60 40 20 0 0 5 10 15 20 25 30 Tage p. i. Abb. 35: Isolierungsraten aus Caecum, Leber und Milz (n=50; 28 Tage p.i. n=25) in Abhängigkeit vom Zeitpunkt nach der Infektion mit S. Enteritidis unabhängig vom Infektionsalter 100 Caecum Leber Milz Isolierungsrate [%] 80 60 40 20 0 0 5 10 15 20 25 30 Tage p. i. Abb. 36: Isolierungsraten aus Caecum, Leber und Milz (n=50; 28 Tage p.i. n=25) in Abhängigkeit vom Zeitpunkt nach der Infektion mit S. Typhimurium unabhängig vom Infektionsalter 126 4 ERGEBNISSE 4.5.1 Caecum Die Isolierungsraten von Salmonellen aus den Caeca der mit S. Enteritidis (Abb. 35; Daten siehe 9.3, Tab. 22) und S. Typhimurium (Abb. 36; Daten siehe 9.3, Tab. 25) infizierten Enten wiesen einen ähnlichen Verlauf auf: Vom 3. Tag p.i. an kam es zu einem moderaten Anstieg der Isolierungsraten mit einem Maximum am 5. Tag p.i., um dann bereits zum 7. Tag p.i. hin abzufallen. Dieser Abfall der Isolierungsrate setzte sich kontinuierlich bis zum Ende der Untersuchungen am 28. Tag p.i. fort; zu diesem Zeitpunkt waren nach der Infektion mit S. Enteritidis nur noch vereinzelt Salmonellen aus dem Caecum zu isolieren, bei S. Typhimurium jedoch bei etwa 30% der Enten. Um die Elimination besser abschätzen zu können, sind in Abbildung 37 die aus den Daten gemittelten Verlaufskurven für die Elimination der beiden getesteten Stämme dargestellt. Nach Überschreiten des Maximums der Nachweisrate scheinen beide Kurven näherungsweise linear zu verlaufen. Die berechneten Regressionsgeraden deuten eine mittlere Nachweisrate von etwa 29 Tagen für S. Enteritidis (y= -3,6x + 103,6) und von 33 Tagen für S. Typhimurium (y= -3,1784x + 104,48) an. 100 ST SE ST Regr.-gerade Isolierungsrate [%] 80 SE Regr.-gerade 60 40 20 0 0 5 10 15 20 25 30 35 Tage p.i. Abb. 37: Vergleich der Isolierungsraten von S. Enteritidis und S. Typhimurium aus dem Caecum (n=50; 28 Tage p.i. n=25) und ihrer Regressionsgeraden 4 ERGEBNISSE 4.5.2 127 Leber und Milz Wie man in Abbildung 35 und 36 (Daten siehe 9.3, Tab. 22 und 25) erkennen kann, differieren die als Kurvenverlauf dargestellten Nachweisraten von S. Enteritidis aus Leber und Milz (Abb. 35) deutlich von S. Typhimurium (Abb. 36). Der Kurvenverlauf von Leber und Milz ist jeweils ähnlich. Allerdings liegen die Nachweisraten für die Milz immer etwas niedriger als die für die Leber. Bei S. Enteritidis (Abb. 35) lag das Maximum der Isolierungsrate aus Leber und Milz am 5. Tag p.i., danach erfolgte ein deutlicher Abfall. Nach 14 Tagen p.i. war in der Regel, abgesehen von Einzelfällen, fast kein Nachweis mehr möglich. Bei S. Typhimurium (Abb. 36) lag für diese beiden Organe das Maximum der Isolierungsrate eher am 7. Tag p.i. Danach fand die Elimination des Erregers aus den Organen im Vergleich zu S. Enteritidis verzögert statt, so dass auch über den 14. Tag p.i. hinaus in nicht unerheblichem Maße Salmonellen in diesen Organen vorhanden waren. 4.6 Nachweishäufigkeit von Salmonellen in Caecum, Leber und Milz Wie die Ergebnisse unter unterschiedlichen Gesichtspunkten zeigen, sind Salmonellen am häufigsten in den Caeca und weniger häufig in Leber und Milz zu finden. Um dies klarer herausstellen zu können, wurden alle erhobenen Isolierungen für die genannten Organe zusammengefasst und getrennt nach S. Enteritidis (Abb. 38) und S. Typhimurium (Abb. 38) (Daten siehe 9.3, Tab. 22 und 25) dargestellt. Diese Zusammenfassung erschien gerechtfertigt, weil für beide Salmonellen-Serovaren identisches Datenmaterial erhoben werden konnte. Sowohl für S. Enteritidis als auch für S. Typhimurium ließen sich die Unterschiede in den Isolierungsraten zwischen Caecum, Leber und Milz statistisch absichern. Gleichzeitig konnte S. Typhimurium aus dem Caecum, der Leber und der Milz signifikant häufiger nachgewiesen werden als S. Enteritidis. 128 4 ERGEBNISSE 80 Caecum Leber Milz a2 70 a1 n = 192 Isolierungsrate [%] 60 n = 168 50 b2 signifikant n = 134 40 c2 30 n = 93 b1 signifikant 20 n = 56 10 c1 n = 32 signifikant 0 S. Enteritidis Abb. 38: 4.7 S. Typhimurium Isolierungsrate aus Caecum, Leber und Milz S. Enteritidis und S. Typhimurium; (je Organ n=275) nach Infektion Klinische Beobachtungen Während aller Experimente konnten im Untersuchungszeitraum von maximal 28 Tagen p.i. sowohl bei jungen Tieren, die frühestens am 4. Lebenstag infiziert wurden als auch bei älteren Tieren, die spätestens am 43. Lebenstag infiziert wurden, unabhängig von der verwendeten Infektionsdosis von 1 x 103, 1 x 106, 1 x 109 KbE/Tier keine klinischen Symptome einer Salmonellose beobachtet werden. Es trat keine Mortalität nach der Infektion mit Salmonellen auf. 4 ERGEBNISSE 4.8 129 Pathologisch-anatomische Beobachtungen Sowohl in den Kontrollgruppen als auch in den mit Salmonellen belasteten Gruppen fielen bei der Sektion keine Veränderungen an den Organen auf, die mit einer Salmonelleninfektion in Verbindung gebracht werden konnten. 4.9 Minimale infektiöse Dosis Ziel dieses Versuches war es zu ermitteln, mit welcher minimalen Dosis es möglich ist, eine Salmonellen-Infektion in Enten zu induzieren. Hierzu wurden jeweils sieben Enten nicht vakzinierter (Gruppe nv) und fünf Enten vakzinierter Elterntiere (Gruppe v) am 4. und am 32. Lebenstag mit unterschiedlichen Keimzahlen (siehe Tab. 9) von S. Enteritidis (verwendeter Stamm SE-864r) oder S. Typhimurium (verwendeter Stamm ST-485r) oral infiziert. Im Alter von 4 Tagen konnten Entenküken mit S. Enteritidis mit der Dosis 1 x 101 und 1 x 102 KbE nicht infiziert werden. Mit 1 x 103 KbE gelang bei 75 % der Tiere eine Infektion des Caecums. Bei der Verwendung des S. Typhimurium Stammes in einer Dosierung von 1 x 101 KbE pro Tier konnten die 4 Tage alten Küken ebenfalls nicht infiziert werden. Ab einer Keimmenge von 1 x 102 und 1 x 103 KbE gelang hier die Infektion zu 100 Prozent. Bei einem Infektionsalter von 32 Tagen konnten mit Dosierungen von 1 x 102, 1 x 103 und 1 x104 KbE keine Enten mehr mit S. Enteritidis infiziert werden, während mit 1 x 103 KbE S. Typhimurium ein Tier von insgesamt 12 Enten im Alter von 32 Tagen infiziert werden konnte. 130 Tab. 9: 4 ERGEBNISSE Ergebnisse der Untersuchungen zur minimalen infektiösen Dosis bei Enten im Alter von 4 und 32 Tagen S. Enteritidis InfektionsAlter bei Dosis Infektion (KbE/Tier) 4 Tage nv1 v1 S. Typhimurium Summe nv v Summe 1 x 101 0/72 0/5 0/12 (0 %) 0/7 0/5 0/12 (0 %) 1 x 102 0/7 0/5 0/12 (0 %) 7/7 5/5 12/12 (100 %) 1 x 103 6/7 3/5 9/12 (75 %) 7/7 5/5 12/12 (100 %) 1 x 101 -3 - - 0/7 0/5 0/12 (0 %) 1 x 102 0/7 0/5 0/12 (0 %) 0/7 0/5 0/12 (0 %) 1 x 103 0/7 0/5 0/12 (0 %) 1/7 0/5 1/12 (8,3 %) 1 x 104 0/7 0/5 0/12 (0 %) - - - 32 Tage 1 Nachkommen von vakzinierten (v) oder nicht vakzinierten (nv) Elterntieren Anzahl positiv/untersucht 3 nicht untersucht 2 5 DISKUSSION 5 131 Diskussion S. Enteritidis und S. Typhimurium sind zurzeit die bei Salmonellosen des Menschen am häufigsten isolierten Serovaren (GERIGK 1992; RABSCH et al. 2001). Neben Fleisch und Fleischprodukten (GERIGK 1992) anderer Tierarten spielen auch Geflügel und Eier sowie daraus gewonnene Produkte als mögliche Infektionsquelle eine große Rolle (RABSCH et al. 2001). So können Enten und Entenfleisch mit Salmonellen, v. a. mit der Serovar S. Typhimurium aber auch S. Enteritidis, infiziert sein (KÖHLER et al. 1996; DORN et al. 2000; HARTUNG 2004). Die Bedeutung, die Salmonelleninfektionen beigemessen wird, ergibt sich aus der Neufassung der Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember 2005, der zufolge das Auftreten von Salmonella spp. auch bei Enten zu melden ist. Während der Verlauf von Salmonelleninfektionen beim Huhn (SADLER et al. 1969; BARROW et al. 1987b, 1988; SHIVAPRASAD et al. 1990, BARROW 1991; BARROW u. LOVELL 1991; METHNER et al. 1995; BERCHIERI et al. 2001; FEBERWEE et al. 2001; BJERRUM et al. 2003) ausführlich untersucht wurde und Infektionsmodelle für die Prüfung der Wirksamkeit von Impfstoffen vorliegen, gibt es kaum Kenntnisse über den Infektionsverlauf bei der Ente. Anliegen dieser Arbeit war es daher, den Verlauf einer Infektion mit S. Enteritidis und S. Typhimurium bei Enten zu untersuchen, mit dem Ziel ein Infektionsmodell zu entwickeln. Ein reproduzierbares Infektionsmodell ist die Voraussetzung, um die Wirkung von Impfstoffen bei Enten zu testen. Dieses Infektionsmodell soll beschreiben, wie die Infektion unter den gegebenen experimentellen Bedingungen wie Entenspezies, Alter, Wahl der Salmonellen-Stämme und Höhe der Infektionsdosis bei den gegebenen Haltungsbedingungen in dem Tier verläuft. 132 5 DISKUSSION 5.1 Teststämme 5.1.1 Auswahl der Teststämme Ziel dieser Experimente war es, je einen S. Enteritidis- und einen S. TyphimuriumStamm für die Untersuchungen zum Infektionsmodell von Salmonellen-Infektionen bei der Ente auszuwählen. Dazu wurden fünf S. Enteritidis- und fünf S. TyphimuriumStämme, die alle aus Wassergeflügel stammten, im ersten Abschnitt der Vorversuche getestet. Zwei S. Enteritidis-Stämme – SE-864 und SE-059 – wurden aufgrund ihrer teilweise signifikant höheren Isolierungsraten und Keimzahlen in den Organen ausgewählt. Zwischen den S. Typhimurium-Stämmen bestanden nur geringere Unterschiede; hier wurden ebenfalls die zwei Stämme mit den höheren Nachweisraten und Keimzahlen – ST-485r und ST-360r – in die weiteren Untersuchungen einbezogen. In einem zweiten Abschnitt der Vorversuche sollte diese getroffene Auswahl auf jeweils einen Stamm je Serovar weiter eingeengt werden. Aufgrund der Isolationsraten und Keimzahlen in weiteren Infektionsversuchen ergab sich kein eindeutiger Unterschied zwischen den zwei S. Enteritidis-Stämmen. Die Entscheidung, den Stamm SE-864r, der ursprünglich aus Organen der Gans isoliert wurde, für die Hauptversuche zu verwenden wurde gefällt, weil es sich um den Phagentyp (PT) 4 handelte, der sowohl beim Menschen, als auch beim Geflügel eine besondere epidemiologische Bedeutung hat (NASTASI u. MAMMINA 1996; BOONMAR et al. 1998; SCHROETER et al. 2000, 2004; BERGHOLD u. KORNSCHOBER 2004; NYGARD et al. 2004; O’BRIEN et al. 2004). Von den zwei S. Typhimurium-Stämmen fiel die Auswahl auf den Stamm ST-485r, der ursprünglich aus Organen der Ente isoliert wurde, weil er zu einer signifikant häufigeren Besiedlung der Organe in weiterführenden Untersuchungen führte und weil er als Phagentyp DT8 dem bei der Ente in Deutschland dominierenden Typ angehört (KÖHLER et al. 1996). 5 DISKUSSION 5.1.2 133 Markierung der Teststämme Der erste Abschnitt der Vorversuche wurde mit unmarkierten S. Enteritidis-Stämmen durchgeführt. Auf dem unsupplementierten BPLS-Nährboden wuchsen bei der quantitativen Untersuchung der Caeca auch viele unterschiedliche Keime der natürlichen Caecalflora. Sie überwucherten teilweise die nachzuweisenden Salmonellen und machten dadurch eine quantitative Auswertung unmöglich. Da die meisten Enterobacteriaceae als empfindlich gegenüber Fluorochinolonen gelten (WIEDEMANN u. HEISIG 1994), ist eine gute Unterdrückung durch Nalidixinsäure zu erwarten. Andererseits ist bekannt, dass Salmonellen leicht eine Resistenz gegenüber den Fluorochinolonen entwickeln können (PIDDOCK et al. 1990; WRAY et al. 1990; OTEO et al. 2000; EAVES et al. 2004; MARIMON et al. 2004). Daher wurden die für die Versuche verwendeten Stämme mit einer Nalidixinsäure-Resistenz von 100 mg/l BPLS-Agar markiert, um das Problem der Überwucherung zu beheben. In der Literatur (WATTS et al. 1997; KNOLL et al. 1999; SCHUHMACHER et al. 2006) werden für die Mehrzahl der Isolate von Enterobakterien allgemein minimale Hemmstoffkonzentrationen (MHK) von Fluorochinolonen von bis zu 1 mg/L angegeben. Mit der gewählten Nalidixinsäure-Konzentration wurde dieser MHK-Wert deutlich überschritten, wenn auch bei einzelnen Stämmen von Enterobacteriaceae MHK-Werte über diesem Wert liegen können (SCHUHMACHER et al. 2006). Die Markierung durch Gewinnung resistenter Spontanmutanten gelang bei allen verwendeten Stämmen problemlos. Drei (SE-864, SE-059, ST-148) der sieben untersuchten Stämme wiesen eine Mutationsrate von 10-8, drei (ST-360, ST-485, ST-265) von 10-9 und einer (ST-279) von 10-10 auf. In der Literatur werden zu erwartende Mutationsraten von 10-6 bis 10-11 (BRANDIS 1988; WIEDEMANN 1992) angegeben. Somit lagen die im eigenen Versuch ermittelten Raten im mittleren Bereich. Aufgrund der durch die Tierversuchsgenehmigung eingeschränkten Tierzahlen konnte der erste Vorversuch nicht mit den markierten Stämmen wiederholt werden. Die Bewertung der Infektiosität der S. Enteritidis-Stämme erfolgte im ersten Abschnitt 134 5 DISKUSSION der Vorversuche daher vor allem unter Zugrundelegung der qualitativen Untersuchungsergebnisse. In allen weiteren Versuchen wurden nur markierte Stämme und mit Nalidixinsäure supplementierte BPLS-Agarplatten eingesetzt. In einigen Fällen wurde die Caecalflora in der 10-2 Verdünnungsstufe und in wenigen Fällen in der 10-3 Verdünnungsstufe jedoch nicht völlig unterdrückt. 5.1.3 Vergleich der Infektiosität von Salmonella Enteritidis mit Salmonella Typhimurium In den Untersuchungen erwiesen sich Stämme von S. Typhimurium als virulenter für die Ente als Stämme von S. Enteritidis. S. Typhimurium konnte in der Regel in mehr Organen, häufiger, in größerer Menge und über einen längeren Zeitraum nachgewiesen werden, als dieses bei der Infektion mit S. Enteritidis der Fall war. Dieses steht im Gegensatz zu anderen Studien mit Enten, bei denen sich Stämme von S. Enteritidis als virulenter bzw. kolonisationsfähiger erwiesen als Stämme von S. Typhimurium (BARROW et al. 1999, 2002). Virulente Stämme breiten sich schneller systemisch im Körper aus, persistieren länger und sind invasiver als avirulente Stämme (BARROW et al. 1987b). Zwischen Hühnerlinien gibt es jedoch große Unterschiede in der Empfänglichkeit und der Mortalität, so dass durch die Verwendung des gleichen Stammes an unterschiedliche Linien von HühnerEintagsküken Mortalitäten bis zu 100 % auftraten (BARROW et al. 1987b; BUMSTEAD u. BARROW 1988, 1993; PROTAIS et al. 1996; DUCHET-SUCHAUX et al. 1997). Dieses ist sicherlich auch bei der Ente zu erwarten. Stämme einer Serovar können sich sehr in ihrer Virulenz bei der Ente unterscheiden. So waren zwei der verwendeten S. Enteritidis-Stämme (siehe Abb. 7) überhaupt nicht in der Leber nachweisbar, während bei den anderen die Keimzahlen durchaus im Mittel zwischen 101 und 102 KbE/g Leber lagen. Unterschiede zwischen den S. TyphimuriumStämmen sind zwar nicht so augenfällig, aber in einem Fall auch statistisch abgesichert (siehe Abb. 10). Da sich die Stämme einer Serovar stark in ihrer Virulenz unterscheiden können, kann sich die Aussage zur Virulenz nur auf den verwendeten 5 DISKUSSION 135 Stamm und weniger auf die zugehörige Serovar beziehen. In der vorliegenden Studie erwies sich bei der Serovar Enteritidis der Stamm (SE-864r) am virulentesten, der gleichzeitig dem Phagentyp 4 angehört und der bei der Ente allgemein am häufigsten vorkommt (KÖHLER et al. 1996). Dieses könnte darauf hindeuten, dass die Virulenz die Ursache für das häufige Auftreten jenes Phagentyps bei S. Enteritidis-Isolaten der Ente ist. 5.2 Nachweis von Salmonellen in verschiedenen Organen 5.2.1 Methodische Verfahrensweise Die ersten Untersuchungen des Caecuminhaltes fanden bei Tieren im Alter von 8 Tagen statt. Zu diesem Zeitpunkt und im Laufe einer guten weiteren Woche war das Caecum noch relativ klein, so dass in der Regel Einwaagen zwischen 0,2 und 0,25 g für die quantitativen Untersuchungen zur Verfügung standen. Die Höhe der Einwaage mit etwa 0,25 g wurde im weiteren Verlauf auch bei älteren Tieren beibehalten, um alle Proben gleich zu behandeln. Für die Isolierung von Salmonellen wurde als Selektivnährboden BPLS-Agar verwendet, der neben dem XLD (Xylose-Lysin-Desoxycholat)-Agar in der „Amtlichen Sammlung von Untersuchungsverfahren nach § 35 LMBG“ (L 00.00-20) zum Nachweis von Salmonella spp. empfohlen wird. Für die eigenen Untersuchungen war es von Nachteil, dass nur das Wachstum grampositiver Bakterien, nicht aber das der gramnegativen Enterobacteriaceae (BAST 2001) gehemmt wird. Obwohl coliforme Keime Lactose und Saccharose verstoffwechseln und durch den aus der pH-WertÄnderung resultierenden Farbumschlag des Agars nach „gelb“ von den „rot“ wachsenden Salmonellen zu unterscheiden sind (SELBITZ et al. 1995), konnte dennoch ein massives Wachstum der Caecalflora das Erkennen von Salmonellen erschweren. Deshalb wurde der Agar mit 100 mg/l Nalidixinsäure supplementiert. Dadurch wurden coliforme Keime weitgehend unterdrückt, die verwendeten 136 5 DISKUSSION Salmonellen-Stämme konnten aber aufgrund der vorher erfolgten ResistenzMarkierung gegenüber diesem Antibiotikum auf dem supplementierten Nährboden ungehindert wachsen. Um auch geringe Keimmengen in den untersuchten Organen qualitativ nachweisen zu können, erfolgte Selektiv-Anreicherung (Europäisches Arzneibuch 2002) in einer Tetrathionat-Brilliantgrün-Galle-Anreicherungsbouillon (TBG-Bouillon). Im Anschluss daran erfolgte ein Ausstreichen auf supplementiertem BPLS-Nährboden. Die Proben der Negativkontrollen wurden dabei auf unsupplementierten BPLS-Nährböden ausgestrichen, um eine Infektion mit Salmonellen anderer Herkunft ausschließen zu können. Ergänzend zur Herstellerangabe wurden die nach 24-stündiger Bebrütung noch qualitativ negativen Proben nach einer insgesamt 48-stündigen Bebrütung nochmals auf BPLS-Nähragar ausgestrichen. Dadurch konnte die Anzahl an positiven Proben erhöht werden. Insbesondere die Nachweisrate der Leber ließ sich so um 16,4 % steigern. Ein alleiniger Nachweis nach 48-stündiger Bebrütung ist nicht zu empfehlen, da es vor allem bei Caecumproben zu einem „Umkippen“ des Mediums kommen kann, was den Nachweis der Salmonellen erschwert. 5.2.2 Auswahl zu untersuchender Organe für das Infektionsmodell Aus den in den Vorversuchen untersuchten Organen konnten in abnehmender Reihenfolge der Höhe der Isolierungsrate aus Caecum, Leber, Milz, Lunge, Gallenblase, Herz und Gehirn Salmonellen isoliert werden. Das Caecum war, in Abhängigkeit vom Zeitpunkt der Untersuchung, mit einer Isolierungsrate von 100 % am häufigsten mit Salmonellen besiedelt. Dieses deckt sich mit Untersuchungen anderer Autoren (BARROW et al. 1987b; METHNER et al. 1995). Ähnlich wie beim Huhn konnten auch bei der Ente Salmonellen mit Isolierungsraten bis zu 92 %, 62 % und 52 % aus Leber, Milz und Lunge mit nachgewiesen werden. Eine Salmonellen- 5 DISKUSSION 137 Isolierungsrate von maximal 22 % aus Gallenblase oder 8 % aus dem Gehirn deutet ebenfalls an, dass bezüglich der Organbesiedlung keine grundsätzlichen Unterschiede zwischen der Salmonellen-Infektion des Huhnes und der Ente bestehen. Da nur hohe Isolierungsraten eine gute Diskriminierung zwischen unterschiedlich infizierten Gruppen erwarten lassen, lag es nahe, für weiterführende Untersuchungen den Salmonellen-Nachweis aus Caecum, Leber und Milz zu führen. Nach Infektion von 5 oder 8 Tage alten Entenküken konnten 3 Tage p.i. Salmonellen zwischen 104 und 105 KbE/g Caecuminhalt nachgewiesen werden (siehe 4.3.2.1). Wurden dagegen in Untersuchungen von BARROW et al. (1999) Entenküken am ersten Lebenstag mit einer höheren Dosis von 108,7 KbE inokuliert, ließen sich 3 Tage p.i. durchschnittlich 106,8 KbE/g nachweisen, was vielleicht unabhängig von der höheren Infektionsdosis auf eine noch gesteigerte Empfänglichkeit in diesem Alter hindeutet. Eine etwas höhere Empfänglichkeit von Hühnern für SalmonellenInfektion kann aus Untersuchungen von METHNER et al. (1995) abgeleitet werden, weil sich nach Infektion 8 Tage alter Küken mit 109 KbE nach 7 Tagen noch 105,5 KbE/g Cecuminhalt reisoliert wurden. Besonders in den ersten Tagen nach der Infektion waren in allen Altersgruppen nach Infektion mit S. Typhimurium im Mittel höhere Keimgehalte zu ermitteln als nach Infektion mit S. Enteritidis. Diese Beobachtung wird durch die Untersuchungsergebnisse von BARROW et al. (1999) gestützt. Aus der Leber (siehe 4.3.2.2) konnten am zweithäufigsten Salmonellen isoliert werden; dabei zeichnet sich ein deutlicher Unterschied zwischen einer Infektion mit S. Enteritidis und S. Typhimurium ab. So konnte in Abhängigkeit vom Alter der Enten und dem Zeitpunkt der Untersuchung S. Typhimurium maximal in 90 %, S. Enteritidis dagegen nur in maximal 70 % der Lebern nachgewiesen werden. Dieser Unterschied zwischen beiden Salmonellen-Serovaren lässt sich auch in den quantitativen Untersuchungsergebnissen wieder finden: während der drei ersten Untersuchungstermine nach der Infektion lagen die Keimzahlen für S. Typhimurium zwischen 101 und 102 KbE/g Leber, während sie für S. Enteritidis im selben Zeitraum stets unter 138 5 DISKUSSION 101 KbE/g lagen. Bezogen auf eine Infektion mit S. Enteritidis bei Hühnern stehen die Ergebnisse von DUCHET-SUCHAUX et al. (1997) insofern mit den eigenen Untersuchungen in Einklang als auch dort in der Leber nie Reisolierungsraten über 102 KbE/g gefunden wurden. Dagegen wiesen METHNER et al. (1995) bei Hühnern mit Keimzahlen zwischen 103 bis104 KbE/g Leber deutlich mehr Salmonellen nach; gleichzeitig berichten sie allerdings, dass kein Unterschied zwischen S. Enteritidis und S. Typhimurium erkannt wurde. Ähnlich wie bei der Leber ergab sich auch für den Salmonellen-Nachweis aus der Milz, dass ein Zusammenhang (siehe 4.3.1.3 und 4.3.3) zwischen dem Alter der Entenküken und dem Untersuchungszeitpunkt besteht. Höhere Isolierungsraten wurden stets bei jüngeren Tieren am 5. bis 7. Tag p.i. erzielt. Allerdings lagen die Isolierungsraten aus der Milz stets niedriger als die aus der Leber. Bei Untersuchungen am Huhn wurden dagegen stets höhere Keimzahlen und/oder Isolierungsraten aus der Milz berichtet, und zwar sowohl nach Infektion von Küken (BARROW et al. 1987b; METHNER et al. 1995; DUCHET-SUCHAUX et al. 1997) als auch älteren Legehennen (BARROW u. LOVELL 1991). Während METHNER et al. (1995) nach Infektion von Hühnerküken keinen Unterschied zwischen einer S. Enteritidis- und S. Typhimurium-Infektion feststellten, führte in den eigenen Untersuchungen S. Typhimurium mit maximal 70 % zu einer signifikant höheren Nachweisrate als S. Enteritidis mit maximal 50 %. Der häufige Nachweis von Salmonellen in Leber und Milz könnte eine Erklärung darin finden, dass Salmonellen als intrazelluläre Parasiten (POPIEL u. TURNBULL 1985; HORMAECHE et al. 1993) in den reichlich in diesen Organen vorhandenem monozytärem Gewebe vorkommen und besonders häufig in Makrophagen zu finden sind. Die relativ hohe Nachweisrate von S. Enteritidis mit ca. 20 % und S. Typhimurium mit ca. 30 % in der Lunge (siehe Abb. 8 und 12) in den Vorversuchen werden durch vergleichbare Beobachtungen bei Hühnern von BARROW et al. (1987b) bestätigt 5 DISKUSSION 139 und ebenfalls auf den intrazellulären Verbleib der Salmonellen zurückgeführt. Für diese Erklärung spricht, dass Makrophagen im Bindegewebe des Darmes, in der Leber und Milz und in der Lunge besonders zahlreich vorkommen (JANEWAY et al. 2002). Im Blut sind Salmonellen in geringerem Maße anzutreffen. Dies lässt sich daraus schließen, dass die Isolierungsrate aus dem Herzen (siehe 4.2.2) nur bei 8 % lag und wird auch durch Untersuchungsergebnisse bei Hühnern bestätigt (BARROW et al. 1987b). 5.3 Untersuchungen zur Infektionsdosis 5.3.1 Ermittlung der Infektionsdosis für die Studie zum Infektionsverlauf Da in der Literatur kaum Erkenntnisse über eine geeignete Keimdosis für eine Salmonellen-Infektion bei der Ente vorlagen, mussten entsprechende Basisdaten erst durch eigene Untersuchungen und die experimentelle Gabe von drei unterschiedlichen Keimdosierungen erarbeitet werden. Um den natürlichen Infektionsweg (MATTHES 1992) nach oraler Aufnahme nachzuempfinden, wurden die Inokula in die spindelförmige Erweiterung des Ösophagus verabreicht. Während eine Dosis von 1 x 103 KbE/Tier nicht bei allen Enten zu einer Infektion führte, ließen sich mit 1 x 106 KbE und auch mit 1 x 109 KbE alle Tiere infizieren. Durch die Erhöhung der Dosis konnte bei beiden Salmonellen-Serovaren die Isolierungsrate gesteigert werden, allerdings ließ sich dies nur für S. Typhimurium statistisch absichern. Um einer natürlichen Infektion möglichst nahe zu kommen, wurde für die Versuche zum Infektionsverlauf zunächst eine Infektionsdosis von 1 x 106 KbE/Tier für alle Altersgruppen gewählt. Wie sich später in den zwei ersten Versuchsdurchgängen der Hauptversuche zum Infektionsverlauf herausstellte, reichte diese Dosis zwar, um ähnlich junge Tiere wie in den Vorversuchen zu infizieren, nicht aber, um bei Enten im Alter von 15 Tagen und älter höhere Isolierungsraten aus den Organen zu 140 5 DISKUSSION erzielen. Deshalb wurde in den Wiederholungsversuchen zum Infektionsverlauf nur für Tiere im Alter von 5 (Gruppe A) und 8 Tagen (Gruppe B) die Infektionsdosis von 1 x 106 KbE/Tier beibehalten und für ältere Enten eine Infektionsdosis von 1 x 109 KbE/Tier verwendet. Dabei stellte sich heraus, dass – wie bereits in den Vorversuchen ähnlich beobachtet werden konnte – die für eine stabile Infektion zu verabreichende Dosis nicht nur vom Alter der Tiere abhängig ist, sondern auch vom verwendeten Stamm. So konnten die Isolierungsraten aus Caecum, Leber und Milz durch die Erhöhung der Infektionsdosis bei S. Typhimurium (ST-485r) wieder signifikant gesteigert werden, während es bei S. Enteritidis (SE-864r) zu keinem signifikanten Anstieg der Isolierungsraten kam. Im Gegensatz zu wenigen Untersuchungen bei der Ente wurde eine große Anzahl von Studien mit experimenteller Infektion bei Hühnern durchgeführt. Hierbei wurden verschiedene Infektionsdosen zwischen 102 KbE (VAN IMMERSEEL et al. 2004) bis zu 1011 KbE/Tier (METHNER et al. 1995) benutzt. Die meisten Untersucher verwendeten sowohl beim Huhn als auch bei der Ente eine Infektionsdosis mit 106 bis 109 KbE/Tier (BARROW et al. 1987b, 1999; GAST u. BEARD 1989; BJERRUM et al. 2003). Laut BARROW et al. (2003) haben ältere Vögel eine komplexe intestinale Mikroflora und sind daher schwerer zu infizieren als intensiv aufgezogenes junges Geflügel, welches nur langsam eine stabile Darmflora entwickelt und daher besonders zur Kolonisation mit Salmonellen neigt. BJERRUM et al. (2003) untersuchten die Infektionsdynamiken unterschiedlicher Dosierungen von S. Typhimurium an Broilern im Alter von 1 und 14 Tagen. Sie konnten mit einer Infektionsdosis von 1 x 107 KbE eine stabile Infektion bei den Eintagsküken erzielen. Bei 14 Tage alten Broilern waren hierzu 1 x 109 KbE notwendig. HUMPHREY et al. (1991) beobachteten bei Hennen, denen 103 Keime verabreicht wurden, entweder gar keine oder nur eine kurz bis zu drei Tage währende Ausscheidung von Salmonellen mit dem Kot. Sowohl aus den eigenen Untersuchungsergebnissen als auch den wenigen Literaturangaben zu einer experimentellen Salmonellen-Infektion bei der Ente ergibt 5 DISKUSSION 141 sich, dass mit 106 KbE/Tier in den meisten Fällen eine Infektion auch bei 6 Wochen alten Enten zu erzielen ist. Diesem Zeitpunkt kommt insofern für Infektionsmodelle eine Bedeutung zu, weil Mastenten dann bereits das Mastziel erreicht haben und geschlachtet werden. Jedoch lässt sich aus den eigenen Untersuchungen erkennen, dass die Infektion mit einer höheren Keimdosis von 109 KbE/Tier zu einer höheren Nachweisrate und im Falle von S. Typhimurium auch höheren Keimzahlen in Leber und Milz führt. Vergleichbare Resultate erzielten andere Autoren auch bei Hühnern sowohl beim Masttyp (BJERRUM et al. 2003) als auch beim Legetyp (METHNER et al. 1995). Insofern ergibt sich aus den hier vorgestellten Ergebnissen, dass sich die Infektionsdosen bei der Ente und die damit erzielten Nachweisraten nicht grundsätzlich von denen beim Huhn unterscheiden. Zu der gleichen Schlussfolgerung gelangten auch BARROW et al. (2002). Ebenfalls in Übereinstimmung mit diesem Autor scheint allerdings die Resistenz einer Ente gegenüber einer Erkrankung durch Salmonellen größer als beim Huhn zu sein, da eine Erkrankung zu keinem Zeitpunkt beobachtet werden konnte. 5.3.2 Minimale Infektionsdosis Untersuchungen zur minimalen infektiösen Dosis wurden nur in einem kleinen orientierenden Rahmen durchgeführt und zeigen einerseits, dass die minimale infektiöse Dosis für beide Salmonella-Serovaren am 32. Lebenstag mindestens 10-fach höher liegen muss als am 4. Lebenstag. Andererseits liegt die minimale infektiöse Dosis für S. Typhimurium um den Faktor 10 niedriger als für S. Enteritidis, was die bereits aufgrund anderer Ergebnisse vermutete höhere Infektiosität bestätigt. Auch SADLER et al. (1969), MILNER und SHAFFER (1952) sowie SHAFFER et al. (1957) machten gleichartige Beobachtungen in ähnlichen Studien an Hühnern. Sie konnten nachweisen, dass die Resistenz gegenüber einer Infektion mit steigendem Alter stark ansteigt. Schon bei 4 Tage alten Hühnerküken war die orale Empfänglichkeit bereits niedriger als bei Eintagsküken, bei denen bereits 1 bis 10 KbE S. Typhi- 142 5 DISKUSSION murium oral oder via Kloake zur Infektion führen können (COX et al. 1988; MILNER u. SHAFFER 1952). Während bis zum Alter von 3 Wochen fast alle Küken mit 108 KbE infiziert werden konnten, führte dieselbe Keimdosis nur bei einem Teil der Tiere im Alter von 7 Wochen zur Infektion. 5.4 Infektionsmodell 5.4.1 Klinik In den eigenen Untersuchungen konnten zu keinem Zeitpunkt, auch nicht bei den jüngeren Tieren, klinische Erscheinungen einer Salmonellose oder gar Todesfälle beobachtet werden. Dieses deckt sich mit Aussagen von BARROW et al. (1999, 2002) und FULTON et al. (2002), die bei infizierten Enten ebenfalls keine klinischen Erscheinungen erkennen konnten. So infizierten BARROW et al. (1999) EntenEintagsküken, die als besonders empfänglich für eine Salmonellose (HENRY 2000) gelten, oral mit S. Enteritidis und S. Typhimurium in einer höheren Dosierung als sie in dieser Arbeit verwendet wurde. Trotzdem gelang es ihnen anschließend nicht, Krankheitsanzeichen oder Todesfälle während einer dreiwöchigen Beobachtungszeit festzustellen. In anderen Untersuchungen mit S. Enteritidis und S. Typhimurium, die an Hühnern durchgeführt wurden, kam es zu sehr unterschiedlichen Beobachtungen. Einerseits konnten klinische Erscheinungen wie Kloakenverschmutzung infolge Diarrhöe, Anorexie, Abneigung gegen Trinken, Lethargie verbunden mit Abmagerung und sogar Mortalitätsraten bis zu 100 % (BARROW et al. 1987b; GAST u. BEARD 1989; BJERRUM et al. 2003) beobachtet werden, wobei die Schwere der Erkrankung teilweise mit dem Einsatz verschiedener Salmonellen-Stämme (BARROW et al. 1987b) oder dem Alter der Hühner (GAST u. BEARD 1989) begründet wird. Andererseits wurde aber auch ein Infektionsverlauf ohne klinische Symptome (BARROW et al. 1987b; METHNER et al. 1995; BJERRUM et al. 2003) beschrieben. Da genetische 5 DISKUSSION 143 Resistenzunterschiede gegenüber einer klinischen Salmonellose und gegenüber der Dosis letalis media zwischen verschiedenen Hühnerlinien beschrieben sind (BUMSTEAD u. BARROW 1993; GUILLOT et al. 1995; WIGLEY et al. 2002; BEAUMONT et al. 2003), lässt sich wahrscheinlich auch aus der genetischen Unterschiedlichkeit zwischen Enten und Hühnern erklären, dass klinische Symptome in den eigenen Untersuchungen nicht ausgelöst werden konnten. 5.4.2 Pathologisch-anatomische Beobachtungen Bei den eigenen Versuchen traten keine Läsionen an den inneren Organen der Enten auf, die mit einer Salmonelleninfektion in Verbindung gebracht werden konnten. Auch in anderen Studien mit Enten von FULTON et al. (2002) und BARROW et al. (1999, 2002) waren die Tierkörper bei der Sektion stets unauffällig. Dies ist insofern nicht außergewöhnlich, da die infizierten Enten zu keinem Zeitpunkt klinische Symptome zeigten, denn HUMPHREY et al. (1991) konnten nicht einmal bei klinisch erkrankten Hennen makroskopisch Läsionen der Organe erkennen. 5.4.3 Zeitlicher Verlauf von experimentellen Salmonellen-Infektionen bei Enten Nach der Infektion unterschiedlich alter Enten mit S. Enteritidis und S. Typhimurium kam es in Caecum, Leber und Milz zu charakteristischen Infektionsverläufen. Von solchen charakteristischen Verläufen wurde ebenfalls von METHNER et al. (1995) nach der experimentellen Infektion von Hühnern mit S. Enteritidis oder S. Typhimurium berichtet. Sie ähneln vom Prinzip her denen dieser Arbeit. Zunächst nahmen die Isolierungsraten im Verlauf der eigenen Untersuchungen aus allen drei Organen zu. Aus dem Caecum ließen sich am 5. Tag p.i. - bis auf eine Ausnahme - maximale Isolierungsraten von 100 % erzielen. Der Zeitpunkt der maxi- 144 5 DISKUSSION mal möglichen Isolierungen aus der Leber und der Milz war abhängig von der verwendeten Serovar. Tendenziell lag er bei Verwendung von S. Enteritidis am 5. Tag p.i., bei S. Typhimurium am 7. Tag p.i. Wie in der eigenen Studie konnten auch BJERRUM et al. (2003) in Untersuchungen bei Hühnern für S. Typhimurium eine maximale Kolonisation der Organe mit Salmonellen 7 Tage p.i. beobachten. Unabhängig vom verwendeten Stamm kam es bei allen Organen im weiteren Verlauf zu einer kontinuierlichen Abnahme der Isolierungsraten. Hierbei wurde S. Enteritidis wesentlich schneller aus den Organen eliminiert als S. Typhimurium. Bereits 14 Tage nach Infektion waren in allen Organen, v. a. bei Verwendung von S. Enteritidis, die Isolierungsraten deutlich gesunken. Nach 28 Tagen p.i. konnte S. Enteritidis weder aus der Leber noch der Milz und nur noch in sehr seltenen Fällen aus dem Caecum isoliert werden. Die Eliminierung von S. Typhimurium aus den Organen ging deutlich langsamer vonstatten. Diverse Studien zum Verlauf von Salmonelleninfektionen bei Enten und Hühnern bestätigen in ihrer Tendenz grundsätzlich die genannten Beobachtungen. Allerdings gibt es in diesen Studien unterschiedliche Aussagen zu der Dauer und dem Grad der Infektion sowie zu den betroffenen Organen. Diese könnten teilweise auch durch die verwendeten Stämme, die Höhe der Infektionsdosis und das Alter der Tiere bei der Infektion bedingt sein. In der vorliegenden Studie wurde der Caecuminhalt der Enten bis zum 28. Tag p.i. qualitativ auf Salmonellen untersucht. Zu diesem Zeitpunkt konnten sowohl nach Infektion mit S. Enteritidis, vor allem aber mit S. Typhimurium noch Salmonellen in einzelnen Proben nachgewiesen werden. Da die Eliminierung aus dem Caecum im zeitlichen Verlauf in etwa linear erfolgt, ergibt sich durch Berechnung der Regressionsgeraden für S. Enteritidis eine mittlere Infektionsdauer von 29 Tagen und für S. Typhimurium von 33 Tagen (Abb. 37). Jedoch ergeben sich Schwankungen in Bezug auf die Ausscheidungsdauer in Abhängigkeit vom Alter der Enten zum Zeitpunkt der Infektion (Abb. 19, 20, 25, 26). BARROW et al. (1999) beobachteten in 5 DISKUSSION 145 zwei aufeinander folgenden Versuchen an Enten, die als Eintagsküken infiziert wurden, das eine Mal eine Ausscheidungsdauer über den Kot von vier Wochen und das andere Mal von über sechs Wochen, während Enten, die als 21 Tage alte Tiere infiziert wurden, Salmonellen nur drei Wochen lang ausschieden. In einer weiteren Studie von BARROW et al. (2002) wird hingegen beschrieben, dass selbst nach sechs Wochen noch Salmonellen im Kot der untersuchten Enten nachgewiesen wurden. Insgesamt ergibt sich aus den eigenen Daten in Verbindung mit Literaturangaben, dass eine Salmonellen-Infektion bei Enten nur über einen Zeitraum zwischen etwa vier und sechs Wochen besteht und danach eine Elimination erfolgt. Es ist allerdings zu vermuten, dass Salmonellen in wenigen Individuen unterhalb der in den eigenen Untersuchungen gewählten Nachweisgrenze persistieren können. Der Nachweis von Salmonellen in Leber und Milz der Enten wies in den eigenen Untersuchungen stets einen gleichartigen zeitlichen Verlauf auf mit einen Maximum 7 Tage p.i. DUCHET-SUCHAUX et al. (1997) konnten bei der Infektion von Hühnern mit S. Enteritidis (PT4) ebenfalls eine Woche p.i. die höchste Nachweisrate aus der Leber beobachten. Allerdings erzielten sie im Vergleich zu den hier vorgestellten Untersuchungen aus der Milz erst eine Woche später eine maximale Nachweisrate. Insgesamt lag in den eigenen Untersuchungen die Salmonellen-Nachweisrate aus der Leber (siehe 4.3.1.2) deutlich höher als aus der Milz (siehe 4.3.1.3). Während der Nachweis von S. Enteritidis bei beiden Organen über 14 Tage p.i. hinaus nur selten gelang, konnte S. Typhimurium auch noch häufig am 28. Tag p.i. nachgewiesen werden. Diese Ergebnisse decken sich weitgehend mit denen, die in einer anderen Studie mit Enten von FULTON et al. (2002) erzielt wurden. BARROW et al. (1999) hingegen konnten 3 Wochen nach der Infektion von Enten-Eintagsküken mit S. Enteritidis und S. Typhimurium zu diesem deutlich früheren Zeitpunkt nicht nur S. Enteritidis, sondern auch S. Typhimurium nicht mehr aus der Milz reisolieren. GAST und BEARD (1989) beobachteten bei 14 Tage alten Broilern, dass nach Inokulation von S. Typhimurium aus der Milz nach 30 Tagen keine Salmonellen 146 5 DISKUSSION isoliert werden konnten. Die Leber war zu diesem Zeitpunk nur noch bis zu 17 % der untersuchten Organe infiziert. Insofern entsprechen diese Ergebnisse denen, die auch in dieser Arbeit bei Enten gleichen Alters erhoben werden konnten. Die Untersuchungen des Verlaufes der mittleren Keimzahlen von Caecuminhalt und Leber (siehe 4.3.2) über 21 Tage hinweg spiegelten den Verlauf der Isolierungsraten grundsätzlich wieder. Während nach Infektion mit S. Enteritidis sowohl die Infektionsraten (Abb. 19) als auch die Keimzahlen (Abb. 25) bei fast allen Gruppen bereits am 3. Tag p.i. ein Maximum aufwiesen und danach stetig abfielen, erreichten nach Infektion mit S. Typhimurium beide Parameter (Abb. 20. u. 26) oft erst am 5. Tag p.i. die höchsten Werte. Bei ähnlichen Untersuchungen an Broilern beschreiben METHNER et al. (1995) für Infektionen mit S. Typhimurium und S. Enteritidis einen Peak der Keimzahlen im Caecum, während BJERRUM et al. (2003) keinen Peak im SalmonellenNachweis, jedoch eine stabile Infektion von Hühnern für die nächsten Wochen erhielt. Die ermittelten Keimzahlen im Caecuminhalt lagen bei beiden Gruppen jüngerer Tiere (Infektionsalter 5. und 8. LT) etwa gleich hoch und signifikant über denen der beiden ältesten Gruppen, die nach dem 21. Lebenstag infiziert wurden. Diese Beobachtung kann sowohl für eine Infektion mit S. Enteritidis als auch mit S. Typhimurium getroffen werden. Enten, die am 14. Lebenstag infiziert wurden, wiesen Keimzahlen auf, die deutlich und teilweise signifikant abgesichert zwischen den Werten der jüngeren und älteren Gruppen lagen. Dies lässt sich mit der zunehmenden Ausreifung des Immunsystems (NEUMANN u. KALETA 1992) besonders in den ersten Lebenswochen erklären. BARROW et al. (1999) infizierten in ihren Versuchen Eintagsküken mit S. Enteritidis und S. Typhimurium und konnten nur eine allmähliche Abnahme der Keimzahlen feststellen, so dass es offensichtlich bei so jungen Küken zu einer deutlich protrahierten Eliminierung kommt, was am 21. Tag p.i. in ca. 106 KbE Salmonellen/g Caecuminhalt ausdrückt wird. 5 DISKUSSION 147 In der Leber konnte quantitativ der gleiche Peak 5 Tage p.i. bei S. Enteritidis (Abb. 27) und 7 Tage p.i. bei S. Typhimurium (Abb. 28) mit anschließender kontinuierlicher Abnahme der Keimzahlen festgestellt werden. S. Enteritidis war dabei quantitativ nur bei der jüngsten Tiergruppe über den 14. Lebenstag hinaus nachweisbar, während S. Typhimurium noch in allen Gruppen am 21. Tag p.i. vorhanden war. Wie bereits beim Infektionsverlauf in den Caeca beobachtet, lassen sich auch tendenziell höhere Keimzahlen in der Leber bei jüngeren Tieren feststellen, jedoch sind hier die Unterschiede nicht so deutlich ausgeprägt und seltener statistisch abzusichern. METHNER et al. (1995) beobachteten in der Leber von Hühnern nicht nur für S. Typhimurium sondern – abweichend von den eigenen Untersuchungen – auch für S. Enteritidis einen Peak am 7. Tag p.i. Im Anschluss daran nahmen die Keimzahlen auch in deren Studie kontinuierlich ab. 5.4.4 Einfluss des Alters der Enten auf die Infektion Je älter die Enten zum Zeitpunkt der Infektion (siehe 4.3) waren, desto geringer fielen die Isolierungsraten und die Keimzahlen in den untersuchten Organen zum vergleichbaren Untersuchungszeitpunkt aus. Der vorliegenden Studie liegen pro Untersuchungszeitpunkt Daten von zehn Proben zugrunde. Dadurch kann sich eine abweichende Probe mehr oder weniger auf den Kurvenverlauf auswirken und zu Schwankungen führen. Unter Berücksichtigung dieser Schwankungen zeichnet sich jedoch ab, dass tendenziell die Keimzahlen und Isolierungsraten - vor allem aus dem Caecum - bei älteren Tieren mit Infektion am 15., 22. und 43. Lebenstag deutlich – oft statistisch abgesichert – früher und schneller absanken, als bei den jüngeren Enten mit Infektion am 5. und 8. Lebenstag. BARROW et al. (1999) beobachteten bei ihren Versuchen ebenfalls, dass Enten, die am 2. Lebenstag infiziert wurden, eine deutlich höhere Salmonellenausscheidung aufwiesen, als solche, die in der 3. Lebenswoche infiziert wurden; 8 Wochen alte Enten erwiesen sich als sehr resistent gegenüber einer oralen Infektion, so dass nur 148 5 DISKUSSION wenige Salmonellen isoliert werden konnten. Auch GAST und BEARD (1989) kamen in ihrer Studie mit 1 und 14 Tage alten Broilern zu dem Ergebnis, dass die Anzahl der Salmonellen im Darm mit steigendem Alter der Tiere abnimmt. Die gleiche Tendenz ließ sich auch bei der Milz und etwas weniger deutlich bei der Leber erkennen. Die Salmonellen scheinen aus den Organen älterer Enten früher eliminiert zu werden, als dieses bei jüngeren Tieren der Fall ist. Es deutet sich an, dass nicht nur die Höhe, sondern auch die Dauer der Infektion der Organe mit Salmonellen auch vom Alter beeinflusst wird. Während BJERRUM et al. (2003) und BARROW et al. (2002) bei Enten eine Abnahme der Infektionsdauer mit steigendem Alter beobachteten, kamen GAST und BEARD (1989) mit einer kleinen Anzahl von Versuchstieren zu dem Schluss, dass die Eliminierung der Salmonellen aus Leber und Milz nicht mit zunehmenden Alter beschleunigt erfolgt. TURNBULL und SNOEYENBOS (1974) beobachteten anhand von Immunfluoreszenz-Untersuchungen, dass die Penetration von Salmonellen in das Caecumgewebe mit zunehmendem Alter von Hühnern abnimmt. Da dieser Zusammenhang sicherlich auch für Enten angenommen werden kann, ließe sich so auch die Abnahme der Keimzahlen und der Isolierungsraten bei älteren Enten erklären. 5.4.5 Reproduzierbarkeit Es wurden mit S. Enteritidis und S. Typhimurium jeweils zwei in Bezug auf Tiere, Alterstufen, Infektionszeitpunkte und Untersuchungsmodi identische Versuche zur Überprüfung der Reproduzierbarkeit der Ergebnisse durchgeführt (siehe Anhang 9.3.3). Lediglich in wenigen Fällen wurde aus bereits aufgeführten Gründen eine abweichende Keimzahl für die Infektion gewählt. Weitgehend deckungsgleiche Ergebnisse demonstrieren, dass die präsentierten Daten unter den gegebenen Voraussetzungen als abgesichert gelten können. Obwohl die Dauer der Infektion und die Nachweisraten zwischen den Versuchen mit S. Enteritidis und S. Typhimurium 5 DISKUSSION 149 unterschiedlich sind, gleichen sich dennoch die Versuchsergebnisse im Verlauf der Infektion, so dass bezogen auf die Tendenzen des Infektionsverlaufs auch die zwei mit S. Enteritidis durchgeführten Versuche als Indiz für die Reproduzierbarkeit der Versuche mit S. Typhimurium und umgekehrt herangezogen werden können. Variationen in der Ausscheidungsrate bei Versuchswiederholungen erklären BARROW et al. (1999) damit, dass die natürliche Darmflora von Tiergruppe zu Tiergruppe schwankt. So ließen sich kleinere Abweichungen der Ergebnisse in den eigenen Untersuchungen erklären. 5.5 Schlussfolgerungen In der vorliegenden Studie wurden sowohl Unterschiede im Infektionsverlauf nach oraler Salmonellenapplikation bei unterschiedlich alten Enten als auch bei der Verwendung zweier verschiedener Serovaren beobachtet. Ein zunehmendes Alter führt zu einer höheren Resistenz gegenüber der Infektion mit Salmonellen. Dieses spiegelt sich zum einem darin wider, dass die Isolierungsraten aus und die Keimzahlen in den Organen bei älteren Enten in der Regel deutlich niedriger sind als bei jüngeren Tieren. Zum anderen ist die Elimination der Salmonellen aus den infizierten Organen ebenfalls früher beendet als bei den jüngeren Enten. Daher sollten für ein Infektionsmodell - in Abhängigkeit zur Fragestellung - bevorzugt jüngere Tiere verwendet werden. Der verwendete S. Typhimurium-Stamm war für die Ente virulenter als der verwendete S. Enteritidis-Stamm, da er nicht nur in höherem Maße zu isolieren war, sondern auch länger in den Organen persistierte. Da große Unterschiede in der Virulenz verschiedener Stämme derselben Serovar bestehen, kann sich das dargestellte Infektionsmodell nur auf die hier untersuchten Stämme (SE-864r und ST-485r) beziehen. 150 5 DISKUSSION Als Organe für Untersuchungen in einem Infektionsmodell eignen sich aufgrund der Isolierungsraten in abfallender Reihenfolge Caecum, Leber und Milz. Andere Organe wie Lunge, Gallenblase, Gehirn und Herz eignen sich weniger. Da die qualitativ erhobenen Ergebnisse eng mit den quantitativ bestimmten Keimzahlen korrelieren, könnte auch in Erwägung gezogen werden, nur qualitative Nachweise zu führen. Dabei ist zur Erhöhung der Nachweisrate, ein qualitativer Nachweis aus den Organen sowohl nach 24- als auch nach 48-stündiger Anreicherung sinnvoll. Sowohl bei S. Enteritidis als auch bei S. Typhimurium liegt das Maximum an nachweisbaren Salmonellen innerhalb der ersten Woche p.i. Für Untersuchungen des Caecums eignet sich insbesondere der 5. Tag p.i. Für den Untersuchungszeitpunkt von Leber und Milz ergeben sich Unterschiede zwischen der Infektion mit S. Enteritidis und S. Typhimurium. Während nach Infektion mit S. Enteritidis das Maximum der Isolierungsraten am 5. Tag p.i. liegt, ist es nach Infektion mit S. Typhimurium eher am 7. Tag p.i. zu beobachten. Dieses sollte bei Untersuchungen berücksichtigt werden. Bei Tieren bis zu einem Alter von 8 Tagen erwies sich eine Infektionsdosis von 1 x 106 KbE/Tier als ausreichend. Bei älteren Tieren scheint eine Erhöhung der Infektionsdosis auf 1 x 109 KbE/Tier empfehlenswert, da im Fall von S. Typhimurium signifikant höhere Isolierungsraten erzielt werden konnten (siehe 4.4). Klinische Symptome einer Salmonellose konnten mit den verwendeten S. Enteritidisund S. Typhimurium-Stämmen selbst mit Dosierungen von 1 x 109 KbE/Tier bei keiner Altersgruppe induziert werden. Diese Beobachtungen weisen darauf hin, dass Pekingenten sehr resistent gegenüber einer klinischen Salmonellose - verursacht durch S. Enteritidis und S. Typhimurium - sind. Dieses verringert zwar die ökonomischen Verluste, macht jedoch ein Erkennen der Infektion schwierig. 6 ZUSAMMENFASSUNG 6 151 Zusammenfassung Wiebke Oellrich (2006): Experimentelle Untersuchungen zum Verlauf von Infektionen mit Salmonella Enteritidis und Salmonella Typhimurium bei der kommerziell genutzten Pekingente (Anas platyrhynchos) Die Salmonelleninfektion der Ente wird im Gegensatz zum Huhn in der Literatur nur wenig thematisiert. Fundierte Kenntnisse über den Infektionsverlauf in der Ente sind jedoch im Rahmen der Entwicklung und Prüfung potentieller Salmonella-Impfstoffe unabdingbar. Diese Arbeit beschreibt den Infektionsverlauf von Salmonella (S.) Enteritidis und S. Typhimurium in der Pekingente unter experimentellen Bedingungen. Die Untersuchungen berücksichtigen insbesondere die Parameter Erregerdosis, Alter der Tiere, Organpräferenz, Ausscheidungsdauer und –rate. Fünf zur Verfügung stehende S. Enteritidis-Stämme verhielten sich sehr unterschiedlich bezogen auf die Besiedlung des Caecums und das Invasionsvermögen innerer Organe als Virulenzkriterien, während fünf S. Typhimurium-Stämme eher einheitlich waren. Als Organe für die Beurteilung einer Salmonellen-Infektion erwiesen sich Caecum, Leber und Milz wegen hoher Nachweisraten als gut geeignet im Vergleich zu Lunge, Herz, Gallenblase und Gehirn. Enten im Alter von 5, 8, 15, 22 und 43 Tagen wurden mit je einem ausgewählten S. Enteritidis- oder S. Typhimurium-Stamm oral infiziert. Die Infektionsdosis betrug 1x106 KbE/Tier. Nach 3, 5, 7, 14, 21 und bei einigen Gruppen auch nach 28 Tagen wurden von jeweils fünf Tieren Caecum, Leber und Milz qualitativ sowie Caecum und Leber zusätzlich quantitativ auf Salmonellen untersucht. Die Versuche wurden in identischer Weise wiederholt, mit der Ausnahme, dass Enten, die 15 Tage und älter waren, eine höhere Infektionsdosis mit 109 KbE/Tier erhielten. 152 6 ZUSAMMENFASSUNG Die Nachweishäufigkeit und die Anzahl der isolierten Salmonellen waren bei jüngeren Enten mit Infektion am 5. und 8. Lebenstag z. T. signifikant höher als bei den beiden ältesten Gruppen mit Infektion am 22. und 43. Lebenstag. Die Gruppe, die am 15. Lebenstag infiziert wurde, nahm in der Regel eine intermediäre Stellung ein. Dies war unabhängig davon, ob die Infektion mit S. Enteritidis oder S. Typhimurium erfolgte. Nach Infektion mit S. Enteritidis wurde das Maximum der Nachweisraten in allen Organen meist am 5. Tag p.i. erreicht; danach kam es zu einer kontinuierlichen Abnahme der Salmonellen, so dass der Erreger 28 Tage p.i. aus Leber und Milz überhaupt nicht und aus dem Caecum nur noch selten nachweisbar war. Die Infektion mit S. Typhimurium erreichte ihr Maximum im Caecum am 5. Tag p.i. und in Leber und Milz am 7. Tag p.i. Der Erreger war auch 28 Tage p.i. noch häufig aus den untersuchten Organen, vor allem jüngerer Tiere, isolierbar. Für S. Enteritidis ergaben sich maximale Isolierungsraten aus der Leber von 70 % und aus der Milz von 50 %. Für S. Typhimurium betrugen die entsprechenden Werte 90 % in der Leber und 70 % in der Milz. Diese Unterschiede wurden durch Bestimmung der Keimzahlen bestätigt, die für S. Typhimurium etwa doppelt so hoch lagen wie für S. Enteritidis. Unter Zusammenfassung aller Ergebnisse ergab sich für beide Salmonella-Stämme die höchste Isolierungsrate aus dem Caecum; sie war signifikant geringer aus der Leber und nochmals signifikant geringer aus der Milz. Gleichzeitig waren die Nachweisraten für S. Enteritidis aus Caecum, Leber und Milz jeweils signifikant geringer als die für S. Typhimurium, was andeutet, dass die Invasivität in Organe und damit die Pathogenität von S. Typhimurium für die Ente größer ist als von S. Enteritidis. Für ein Infektionsmodell ergab sich, dass für Enten, die jünger als zwei Wochen sind, eine Infektionsdosis von 106 KbE ausreichend ist, während bei älteren Tieren eine Dosis von 109 KbE vorzuziehen ist. Für die Bewertung der Schutzwirkung einer 6 ZUSAMMENFASSUNG 153 Substanz oder Immunprophylaxe kann die Bestimmung der isolierbaren Keimzahlen am 5. Tag p.i. ein geeigneter Parameter für die Prüfung der Wirksamkeit sein. Als Organe sind in besonderer Weise Caecum, Leber und Milz für die Untersuchungen geeignet. Bezogen auf das Alter der Tiere zum Prüfzeitpunkt ist ein früher Zeitpunkt vorzuziehen, da aufgrund der höheren Nachweisraten eine bessere Diskriminierung der Ergebnisse möglich ist. 154 7 6 ZUSAMMENFASSUNG Summary Wiebke Oellrich (2006): Experimental studies on the course of infections with Salmonella Enteritidis and Salmonella Typhimurium in the commercially used Pekin duck (Anas platyrhynchos) In literature, the Salmonella infection of the duck, in contrast to that of the chicken, only is a rare subject of discussion. However, well-founded knowledge about the course of infection inside of the duck is indispensable within the scope of development and examination of potential Salmonella vaccines. This study describes the route of infection with Salmonella (S.) Enteritidis and S. Typhimurium within the Pekin duck under experimental conditions. During the studies, particular regard was paid to parameters like infective dose, age of the animals, organ preference, excretion duration and quantity. In this respect, the five strains of S. Enteritidis tested were found to show great variety in their function as virulence markers in terms of their colonisation of the caecum, whereas five strains of S. Typhimurium were rather uniform. As infection was detected more frequently in Caecum, liver and spleen than in lung, heart, gall bladder and brain, the three organs mentioned first, were chosen for the evaluation of Salmonella infections. Different groups of ducks aged 5, 8, 15, 22, and 43 days were each infected during the experiment by oral application of a selected strain of S. Enteritidis or S. Typhimurium. The infective dose was 1 x 106 CFU/animal. In addition to this, caecum, liver and spleen of five animals from each group were examined qualitatively for salmonella after 3, 5, 7, 14, 21 days, and in some cases, also after 28 days of infection. Caecum and liver were also examined quantitatively for 7 SUMMARY 155 Salmonella. Both experiments were repeated identically except that a higher infective dose (1 x 109 CFU/animal) was administered to ducks being 15 days old or older. There was a significantly higher frequency of detection and of the amounts of Salmonella isolated in younger ducks infected on the 5th and 8th day of life than in both of the oldest groups infected on day of life 22 and 43. The group infected on day 15 was normally positioned in between the others. This was the case regardless of whether the infection was caused by S. Enteritidis or S. Typhimurium. After infection with S. Enteritidis the maximum frequency of detection was mostly reached in all organs on the 5th day p.i. After that time, there was a continuous decrease in salmonella infections, so that no S. Enteritidis, at all, could be isolated from liver and spleen 28 days p.i. At that time this strain was only detected in very few samples from the caecum. Infection with S. Typhimurium reached its maximum 5 days p.i. within the caecum and 7 days p.i. within liver and spleen. This strain was also isolated 28 days after infection, primarily in organs from younger animals. S. Enteritidis could be isolated with a maximum rate of 70 % from liver and 50 % from spleen. For S. Typhimurium the maximum rate was 90 % from liver and 70 % from spleen. These differences were confirmed by bacterial count, which was nearly twice as high for S. Typhimurium as for S. Enteritidis. When summarizing all results, both Salmonella strains were found most frequently within the caecum, whereas the rate of isolation was significantly lower from liver and, once more, the isolation rate from spleen was significantly lower than that from liver. At the same time, S. Enteritidis was isolated from caecum, liver and spleen significantly less frequently than S. Typhimurium which may indicate that S. Typhimurium invades extra-intestinal organs more intensely and is thus more pathogenic for the duck than S. Enteritidis. 156 6 ZUSAMMENFASSUNG For an experimental infection model, a dose of 106 CFU was found to be sufficient for ducks with less than two weeks of age, whereas a dose of 109 CFU is preferable for older animals. To evaluate the protective effect of any substances or vaccinations, the count of isolatable bacteria on day 5 after infection seems to be an adequate parameter for testing its effectiveness. Caecum, liver and spleen are the most appropriate organs for study. As the frequency of detection is higher in young animals, they are preferable for control purposes, and this should lead to more highly differentiated results. 8 LITERATURVERZEICHNIS 8 157 Literaturverzeichnis ALPERS, K., u. A. JANSEN (2004): Infektionen mit Salmonellen beim Menschen. In: HARTUNG, M. (2004): Epidemiologische Situation der Zoonosen in Deutschland im Jahr 2003. Bundesinstitut für Risikobewertung (BfR), Berlin, S. 15-18 ALTRICHTER, G., u. F. BRAUNSBERGER (1997): Bäuerliche Geflügelhaltung: Produktion und Vermarktung von Eiern und Qualitätsgeflügel. 2. Aufl. Österreichischer Agrarverlag, Klosterneuburg, S. 279-281 AWAD-MASALMEH, M., u. G. THIEMANN (1993): Salmonella monitoring and related biological parameters in laying hens and hatcheries. Tierärzt. Umsch. 48, 706-713 AWT (Arbeitsgemeinschaft für Wirkstoffe in der Tierernährung e. V.) (Hrsg.) (1999): Probiotika in der Tierernährung. Verlag Buchedition Agrimedia GmbH, Bergen BAGGESEN, D. L., H. C. WEGENER, J. P. CHRISTENSEN (1996): Typing of Salmonella enterica serovar Saintpaul: an outbreak investigation. APMIS, 104, 411-418 BARMAN, T. K., V. D. SHARMA, u. S. KUMAR (2005): Protective efficacy of maternal antibodies induced by Salmonella toxoid (vaccine). Indian J. Exp. Biol. 43, 163-166 BARROW, P. A. (1991): Experimental infection of chickens with Salmonella enteritidis. Avian Pathol. 20, 145-153 BARROW, P. A. (2005): Salmonella infections and vaccines. 17th World Veterinary Poultry Congress, 22-26. August 2005, Istanbul, Türkei, 86-98 BARROW, P. A., J. O. HASSAN, u. A. BERCHIERI (1990): Reduction in faecal excretion of Salmonella typhimurium strain F98 in chickens vaccinated with live and killed Salmonella typhimurium organisms. Epidemiol. Infect. 104, 413-426 BARROW, P. A., M. B. HUGGINS, M. A. LOVELL, u. J. M. SIMPSON (1987b): Observations on the pathogenesis of experimental Salmonella typhimurium infection in chickens. Res. Vet. Sci. 42, 194-199 158 8 LITERATURVERZEICHNIS BARROW, P. A., u. M. A. LOVELL (1991): Experimental infection of egg-laying hens with Salmonella enteritidis phage type 4. Avian Pathol. 20, 335-348 BARROW, P. A., M. A. LOVELL, u. A. BERCHIERI (1991): The use of two live attenuated vaccines to immunize egg-laying hens against Salmonella enteritidis phage type 4. Avian Pathol. 20, 681-692 BARROW, P. A., M. A. LOVELL, C. K. MURPHY, u. K. A. MARSTON (2002): Experimental salmonellosis in ducks – possibilities for control. International Symposium Salmonella & Salmonellosis Proceedings. Saint-Brieuc, France 29.-31. May 2002, 261-262 BARROW, P. A., M. A. LOVELL, C. K. MURPHY, u. K. PAGE (1999): Salmonella infection in a commercial line of ducks; Experimental studies on virulence, intestinal colonization and immune protection. Epidemiol. Infect. 123, 121-132 BARROW, P. A., G. C. MEAD, C. WRAY, u. M. DUCHET-SUCHAUX (2003): Control of food-poisoning salmonella in poultry – biological options. World Poultry Sci. J., 59, 373-383 BARROW, P. A., J. M. SIMPSON, u. A. LOVELL (1988): Intestinal colonisation in the chicken by food-poisoning Salmonella serotypes; microbial characteristics associated with faecal excretion. Avian Pathol. 17, 571-588 BARROW, P. A., J. F. TUCKER, u. J. M. SIMPSON (1987a): Inhibition of colonization of the chicken alimentary-tract with Salmonella typhimurium gram-negative facultatively anaerobic bacteria. Epidem. Inf. 98, 311-322 BASKERVILLE, A., T. J. HUMPHREY, R. B. FITZGEORGE, R. W. COOK, H. CHART, B. ROWE, u. A. WHITEHEAD (1992): Airborne infection of laying hens with Salmonella enteritidis phage type 4. Vet. Rec. 130, 395-398 BAST, E. (2001): Mikrobiologische Methoden: Eine Einführung in grundlegende Arbeitstechniken. 2. Aufl., Spektrum Akademischer Verlag, Heidelberg, Berlin, S. 48, 74 BAUER, J., u. S. HÖRMANSDORFER (1995): Salmonellosen bei Nutztieren. Fleischwirtschaft 75, 958-960 8 LITERATURVERZEICHNIS 159 BEAUMONT, C., G. DAMBRINE, A. M. CHAUSSÉ, u. D. FLOCK (2003): Selection for disease resistance: Conventional breeding for resistance to bacteria and viruses. In: W. M. MUIR und S. E. AGGREY (Hrsg.): Poultry genetics, breeding and biotechnology. CABI Publishing, Wallingford, UK, S. 357-384 BEHR, K. P., M. PÖPPEL, u. G. REETZ (2005): Schutzimpfungen. In: Geflügeljahrbuch 2005. Jahrbuch des Zentralverbandes der Deutschen Geflügelwirtschaft e. V. und seiner Mitgliedsverbände. Ulmer-Verlag, Stuttgart, S. 199-206 BENECKE, N. (1994): Der Mensch und seine Haustiere: Die Geschichte einer jahrtausendealten Beziehung. Verlag Theiss, Stuttgart, S. 382-383, S. 394-396 BERCHIERI, A., P. WIGLEY, K. PAGE, C. K. MURPHY, u. P. A. BARROW (2001): Further studies on vertical transmission and persistence of Salmonella enterica serovar Enteritidis phage type 4 in chickens. Avian Pathol. 30, 297-310 BERGHOLD, C., u. C. KORNSCHOBER (2004): Jahresbericht 2003 der Nationalen Referenzzentrale für Salmonellen an der Österreichischen Agentur für Gesundheit und Ernährungssicherheit. Institut für medizinische Mikrobiologie und Hygiene. Mitteilungen der Sanitätsverwaltung 4, 8-13 BIERER, W. B. (1960): Effect of age factor on mortality in Salmonella typhimurium infection in turkey poults. J. Am. Vet. Med. Assoc. 137, 657-658 zit. nach: HAFEZ u. JODAS (2000) BJERRUM, L., R. M. ENGBERG, u: K. PEDERSEN (2003): Infection Models for Salmonella typhimurium DT110 in Day-Old and 14-Day-Old Broiler Chickens Kept in Isolators. Avian Dis. 47, 1474-1480 BLAHA, T. (1993): The diffusion dynamics of Salmonella in animal herds. Dtsch. tierärztl. Wschr. 100, 278-280 BÖHM, R. (1993): Verhalten ausgewählter Salmonellen in der Umwelt. Dtsch. tierärztl. Wschr. 100, 275-278 160 8 LITERATURVERZEICHNIS BOONMAR, S., A. BANGTRAKULNONTH, S. PORNRUNANGWONG, J. TERAJIMA, H. WATANABE, K.-I. KANEKO, u. M. OGAWA (1998): Epidemiological analysis of Salmonella enteritidis isolates from humans and broiler chickens in Thailand by phage typing and pulse-field gel electrophoresis. J. Clin. Microbiol. 36, 971-974 BRANDIS, H. (1988): Genetik der Bakterien. A. Das Bakterien-Genom, Mutation, parasexuelle Vorgänge. In: BRANDIS, H. u. G. PULVERER (Hrsg.): Lehrbuch der Medizinischen Mikrobiologie. 6. Aufl., Gustav Fischer Verlag, Stuttgart, New York, S. 50 BREDT, W. (1996): Infektionen durch Bakterien und Pilze. In: GROSS, R., P. SCHÖLMERICH, u. W. GEROK (Hrsg.):Die Innere Medizin. 9. Aufl., Schattauer Verlag, Stuttgart, S. 1151-1159 BUCHHOLZ, P. S., u. A. FAIRBROTHER (1992): Pathogenicity of Salmonella pullorum in northern bobwhite quail and mallard ducks. Avian Dis. 36, 304-312 BUMSTEAD, N., u. P. A. BARROW (1988): Genetics of resistance to Salmonella typhimurium in newly hatched chicks. Br. Poult. Sci. 29, 521-529 BUMSTEAD, N., u. P. BARROW (1993): Resistance to Salmonella gallinarum, S. pullorum, and S. enteritidis in inbred lines of chickens. Avian Dis. 37, 189-193 BURKHARDT, F. (Hrsg.) (1992): Mikrobiologische Diagnostik. Thieme Verlag, Stuttgart, New York, S. 611, 779-780 CARTER, P. B., u. F. M. COLLINS (1974): The route of enteric infection in normal mice. J. Exp. Med. 139, 1189-1203 CASON, J. A., N. A. COX, u. J. S. BAILEY (1994): Transmission of Salmonella typhimurium during hatching of broiler chicks. Avian Dis. 38, 583-588 CHRISTENSEN, J. P., M. N. SKOV, K. H. HINZ, u. M. BISGAARD (1994): Salmonella enterica serovar gallinarum biovar gallinarum in layers: Epidemiological investigations of a recent outbreak in Denmark. Avian Pathol. 23, 489-501 8 LITERATURVERZEICHNIS 161 CLARKE, R. C., u. C. L. GYLES (1993): Salmonella. In: GYLES, C. L., u. C. O. THOEN (Hrsg.): Pathogenesis of bacterial infections in animals. 2. Aufl., Iowa State University Press, Ames, S. 133-153 COOPER, G. L. (1994): Salmonellosis – infections in man and the chicken: pathogenesis and the development of live vaccines – a review. Vet. Bull. 64, 123-143 COOPER, G. L., R. A. NICHOLAS, u. C. D. BRACEWELL (1989): Serological and bacteriological investigations of chickens from flocks naturally infected with Salmonella enteritidis. Vet. Rec. 125, 567-572 CORRIER, D. E., B. HARGIS, A. Jr. HINTON, D. LINDSEY, D. CALDWELL, J. MANNING, u. J. DeLOACH (1991): Effect of anaerobic cecal microflora and dietary lactose on colonization resistance of layer chicks to invasive Salmonella enteritidis. Avian Dis. 35, 337-343 CORRIER, D. E., A. HINTON, R. L. ZIPRIN, R. C. BEIER, u. J. R. DeLOACH (1990): Effect of dietary lactose on cecal pH, bacteriostatic volatile fatty acids, and Salmonella typhimurium colonization of broiler chicks. Avian Dis. 34, 617-625 CORRIER, D. E., D. J. NISBET, B. M. HARGIS, P. S. HOLT, J. R. DELOACH (1997): Provision of lactose to moulting hens enhances resistance to Salmonella Enteritidis colonization. J. Food Prot. 60, 10-15 COTTER, P. A., u. V. J. DiRITA (2000): Bacterial virulence gene regulation: an evolutionary perspective. Annu. Rev. Microbiol. 54, 519-565 COTTER, P. F., R. L. Jr TAYLOR, u. H. ABPLANALP (1998): B-complex associated immunity to Salmonella enteritidis challenge in congenic chickens. Poult. Sci., 77, 1846-1851 COX, N. A., J. S. BAILEY, L. C. BLANKENSHIP, u. F. McHAN (1988): Colonization dose-50% of baby broiler chicks following oral or intracloacal inoculation of Salmonella typhimurium. Poult. Sci. 67 (Suppl. 1), 71 (Abstr.) 162 8 LITERATURVERZEICHNIS COX, N. A., J. S. BAILEY, J. M. MAULDIN, u. L. C. BLANKENSHIP (1990): Presence and impact of Salmonella contamination in commercial broiler hatcheries. Poult. Sci., 69, 1606-1609 COX, N. A., J. S. BAILEY, J. M. MAULDIN, L. C. BLANKENSHIP, u. J. L. WILSON (1991): Extent of Salmonellae Contamination in Breeder Hatcheries. Poult. Sci., 70, 416-418 COX, N. A., M. E. BERRANG, u. J. A. CASON (2000): Salmonella penetration of egg shells and proliferation in broiler hatching eggs – a review. Poult. Sci., 79, 1571-1574 COX, N. A., D. BURDICK, J. S. BAILEY, u. J. E. THOMSON (1986): Effect of the steam conditioning and pelleting process on the microbiology and quality of commercial-type poultry feeds. Poult. Sci., 65, 704-709 CSEREP, T. (2001): Vaccines and vaccination. In: JORDAN, F., M. PATTISON, D. ALEXANDER, u. T. FARAGHER (Hrsg.): Poultry Diseases. 5. Aufl., Saunders Verlag, London, S. 55-70 D’AOUST, J.Y. (1989): Salmonella. In: DOYLE, M. P. (Hrsg.): Foodborne bacterial pathogens. Marcel Dekker, New York, S. 327-445 DARWIN, K. H., u. V. L. MILLER (1999): Molecular basis of the interaction of Salmonella with the intestinal mucosa. Clin. Microbiol. Rev. 12, 405-428 DAVIES, R., u. M. BRESLIN (2003): Observations on Salmonella contamination of commercial laying farms before and after cleaning and disinfection. Vet. Rec., 152, 283-287 DAVIES, R. H., u. C. WRAY (1995): Observations on disinfection regimens used on Salmonella enteritidis infected poultry units. Poult. Sci., 74, 638-647 DAVIES, R. H., u. C. WRAY (1996): Studies of contamination of three broiler breeder houses with Salmonella enteritidis before and after cleaning and disinfection. Avian Dis. 40, 626-633 8 LITERATURVERZEICHNIS 163 DE BUCK, J., F. PASMANS, F. VAN IMMERSEEL, F. HAESEBROUCK, u. R. DUCATELLE (2004b): Tubular glands of the isthmus are the predominant colonization site of Salmonella Enteritidis in the upper oviduct of laying hens. Poult. Sci. 83, 352-358 DE BUCK, J., F. VAN IMMERSEEL, F. HAESEBROUCK, u. R. DUCATELLE (2004a): Colonisation of the chicken reproductive tract and egg contamination by Salmonella. J. Appl. Microbiol. 97, 233-245 DE BUCK, J., F. VAN IMMERSEEL, F. HAESEBROUCK, u. R. DUCATELLE (2004c): Effect of type 1 fimbriae of Salmonella enterica serotype Enteritidis on bacteraemia and reproductive tract infection in laying hens. Avian Pathol. 33, 314-320 DE BUCK, J., F. VAN IMMERSEEL, G. MEULEMANS, F. HAESEBROUCK, u. R. DUCATELLE (2003): Adhesion of Salmonella enterica serotype Enteritidis isolates to chicken isthmal glandular secretions. Vet. Microbiol. 93, 223-233 DEMPLE, B., u. J. HALBROOK (1983): Inducible repair of oxidative DNA damage in Escherichia coli. Nature 304, 466-468 DESMIDT, M., R. DUCATELLE, u. F. HAESEBROUCK (1997): Pathogenesis of Salmonella Enteritidis phage type four after experimental infection of young chickens. Vet. Microbiol. 56, 99-109 DESMIDT, M., R. DUCATELLE, u. F. HAESEBROUCK (1998): Serological and bacteriological observations on experimental infection with Salmonella Hadar in chickens. Vet. Microbiol. 60, 259-269 DHILLON, A. S., B. ALISANTOSA, H. L. SHIVAPRASAD, O. JACK, D. SCHABERG, D. BANDLI (1999): Pathogenicity of Salmonella Enteritidis phage type 4, 8, and 23 in broiler chicks. Avian Dis. 43, 506-515 DINJUS, U. u. I. HÄNEL (1997): In-vitro-Untersuchungen zu Adhäsions-und Invasionseigenschaften von SalmonellaStämmen bovinen Ursprungs. Berl. Münch. Tierärztl. Wschr. 110, 369-372 DORN, P. (1970): Zur Desinfektion von Bruteiern. Dtsch. Geflügelwirtschaft 22, 318 164 8 LITERATURVERZEICHNIS DORN, C., A. SCHROETER, A. MIKO, u. R. HELMUTH (2000): Vorkommen von Salmonella-Serovaren beim Geflügel in den letzten Jahren im Einsendungsmaterial an das Nationale Referenzlabor für Salmonellen. Tagungsberichte in Bundesgesundheitsbl. – Gesundheitsforsch. – Gesundheitsschutz, Springer-Verlag, Berlin, 1–2000 43, S. 68-69 DOUCE, G. R., I. I. AMIN, u. J. STEPHEN (1991): Invasion of HEP-2-cells by strains of Salmonella typhimurium of different virulence in relation to gastroenteritis. J. Med. Microbiol. 35, 349-357 DUCHET-SUCHAUX, M., F. MOMPART, F. BERTHELOT, C. BEAUMONT, P. LÉCHOPIER, u. P. PARDON (1997): Differences in frequency, level, and duration of cecal carriage between four outbred chicken lines infected orally with Salmonella enteritidis. Avian Dis. 41, 559-567 DUIJKEREN, E. VAN, W. J. B. WANNET, D. J. HOUWERS, u. W. VAN PELT (2002): Serotype and phage type distribution of Salmonella strains isolated from humans, cattle, pigs, and chickens in The Netherlands from 1984 to 2001. J. Clin. Microbiol. 40, 3980-3985 EAVES, D. J., L. RANDALL, G. T. GRAY, A. BUCKLEY, M. J. WOODWARD, A. P. WHITE, u. L. J. V. PIDDOCK (2004): Prevalence of mutations within the quinolone resistance-determining region of gyrA, gyrB, parC, and parE and association with antibiotic resistance in quinolone-resistant Salmonella enterica. Antimicrob. Agents Chemotherap. 48, 4012-4015 EC (European Commission) (2004): Trends and sources of zoonotic agents in animals, feeding stuffs, food and man in the European Union and Norway in 2002. SANCO/29/2004 EFSA (EUROPEAN FOOD SAFETY AUTHORITY) (2004): Opinion of the Scientific Panel on Biological Hazards on a request from the Commission related to the use of vaccines for the control of Salmonella in poultry. The EFSA Journal 114, 1-74 ERNST R. K., T. GUINA, u. S.I. MILLER (1999): How intracellular bacteria survive: surface modifications that promote resistance to host innate immune responses. J. Infect. Dis. 179 Suppl 2, 326-330 8 LITERATURVERZEICHNIS 165 ERNST R. K., T. GUINA, u. S.I. MILLER (2001): Salmonella typhimurium outer membrane remodeling: role in resistance to host innate immunity. Microbes Infect. 3, 1327-1334 FANELLI, M. J., W. W. SADLER, C. E. FRANTI, u. J. R. BROWNELL (1971): Localization of salmonellae within the intestinal tract of chickens. Avian Dis. 15, 366-375 FEBERWEE, A., T. S. DE VRIES, E. G. HARTMAN, J. J. DE WIT, A. R. ELBERS, u. W. A. DE JONG (2001): Vaccination against Salmonella enteritidis in Dutch commercial layer flocks with a vaccine based on a live Salmonella gallinarum 9R strain: evaluation of efficacy, safety, and performance of serologic Salmonella tests. Avian Dis., 45, 83-91 FIELDS, P. I., E. A. GROISMAN, u. F. HEFFRON (1989): A Salmonella locus that controls resistance to microbicidal proteins from phagocytic cells. Science 243, 1059-1062 FIELDS, P. I., R. V. SWANSON, C. G. HAIDARIS, u. F. HEFFRON (1986): Mutants of Salmonella typhimurium that cannot survive within the macrogphage are avirulent. Proc. Natl. Acad. Sci. USA 83, 5189-5193 FINLAY B. B., u. S. FALKOW (1989): Salmonella as an intracellular parasite. Mol. Microbiol. 31, 1833-1841 FINLAY, B. B., u. S. FALKOW (1990): Salmonella interactions with polarized human intestinal Caco-2 epithelial cells. J. Infect. Dis. 162, 1096-1106 FINLAY B. B., u. S. FALKOW (1997): Common themes in microbial pathogenicity revisited. Microbiol. Mol. Biol. Rev. 61, 136-169 FINLAY, B. B., J. FRY, E. P. ROCK, u. S. FALKOW (1989a): Passage of Salmonella through polarized epithelial cells: Role of the host and bacterium. J. Cell Sci. Suppl. 11, 99-107 FINLAY, B. B., B. GUMBINER, u. S. FALKOW (1988a): Penetration of Salmonella through a polarized Madin-Darby canine kidney epithelial cell monolayer. Cell Biol. 107, 221-230 166 8 LITERATURVERZEICHNIS FINLAY, B. B., F. HEFFRON, u. S. FALKOW (1989b): Epithelial cell surfaces induce Salmonella proteins required for bacterial adherence and invasion. Science 243, 940-943 FRANCIS, C. L., M. N. STARNBACH, u. S. FALKOW (1992): Morphological and cytoskeletal changes in epithelial cells occur immediately upon interaction with Salmonella Typhimurium grown under low-oxygen conditions. Mol. Microbiol. 6, 3077-3087 FRENZ, K. (2001): Die Welt- und EU-Märkte für Eier und Geflügelfleisch. FAL Bundesforschungsanstalt für Landwirtschaft Jahresbericht 2001, S. 143-144 FRETER, R. 1981 Mechanisms of association of bacteria with mucosal surfaces. Ciba Found. Symp. 80, 36-55 FREUDENBERG, M. A., T. MERLIN, M. GUMENSCHEIMER, C. KALIS, R. LANDMANN, u. C. GALANOS (2001): Role of lipopolysaccharide susceptibility in the innate immune response to Salmonella typhimurium infection: LPS, a primary target for recognition of Gramnegative bacteria. Microbes Infect. 3, 1213-1222 FRIES, R. (2005): Hygienegrundsätze. In: Geflügeljahrbuch 2005. Jahrbuch des Zentralverbandes der Deutschen Geflügelwirtschaft e. V. und seiner Mitgliedsverbände. Ulmer-Verlag, Stuttgart, S. 186-198 FULTON, R. M., B. N. NERSESSIAN, u. W. M. REED (2002): Prevention of Salmonella enteritidis infection in commercial ducklings by oral chicken egg-derived antibody alone or in combination with probiotics. Poult. Sci. 81, 34-40 GALAN, J. E. (1998): Interactions of Salmonella with host cells: Encounters of the closest kind. Proc. Natl. Acad. Sci. U.S.A. 95, 14006-14008 GALAN, J. E., u. D. ZHOU (2000): Striking a balance: Modulation of the actin cytoskeleton by Salmonella. Proc. Natl. Acad. Sci. U.S.A. 97, 8754-8761 GARCIA-DEL PORTILLO (2001): Salmonella intracellular proliferation: where, when and how? Microbes Infect. 3, 1305-1311 8 LITERATURVERZEICHNIS 167 GAST, R. K. (1994): Understanding Salmonella Enteritidis in laying chickens – the contributions of experimental infections. Int. J. Food Microbiol. 21, 107-116 GAST, R. K. (1999): Applying experimental infection models to understand the pathogenesis, detection, and control of Salmonella enterica serovar Enteritidis in poultry. In: SAEED et al. (1999), S. 233-243 GAST, R. K. (2003): Salmonella infections. In: SAIF, Y. M. (Hrsg.): Diseases of poultry. 11. Aufl., Iowa State Press, Ames, S. 567-568 GAST, R. K., u. C. W. BEARD (1989): Age related changes in the persistance and pathogenicity of Salmonella typhimurium in chicks. Poult. Sci., 68, 1454-1460 GAST, R. K., C. W. BEARD (1990): Serological detection of experimental Salmonella enteritidis infections in laying hens. Avian Dis. 34, 721-728 GERIGK, K. (1992): Salmonellose. Einführung in die Problematik – Begriffsbestimmung, Wesen und Definitionen. Interdisziplinäres Symposium „Salmonellose“ am 16./17. November 1992 in BonnBad Godesberg, ATF Schriftenreihe, S. 1-6 GRAMZOW, S. (2005): Produktionsverfahren Entenmast. In: Geflügeljahrbuch 2005. Jahrbuch des Zentralverbandes der Deutschen Geflügelwirtschaft e. V. und seiner Mitgliedsverbände. Ulmer-Verlag, Stuttgart, S. 40-47 GUILLOT, J. F., C. BEAUMONT, F. BELLATIF, C. MOULINE, F. LANTIER, P. COLIN, u. J. PROTAIS (1995): Comparison of resistance of various poultry lines to infection by Salmonella enteritidis. Vet. Res., 26, 81-86 HAFEZ, H. M., u. S. JODAS (2000): Salmonella infections in turkeys. In: C. WRAY und A. WRAY (Hrsg.): Salmonella in Domestic Animals. CABI Publishing, Wallingford, New York, S. 133-155 168 8 LITERATURVERZEICHNIS HAFEZ, H. M., A. STADLER, u. J. KÖSTERS (1997): Surveillance on Salmonella in turkey flocks and processing plants. Dtsch. Tierärztl. Wschr. 104, 33-35 HAHN, I. (1990): Ergebnisse der Anwendung von Zoosaloral „Dessau“ ® Geflügel. Referatesammlung 40. Fachgespräch über Geflügelkrankheiten November 1990 in Hannover, S. 10-17 HAHN, I. (1999): Ein Beitrag für den Verbraucherschutz: TAD Salmonella vac® E – ein neuer Lebendimpfstoff für Hühner gegen Salmonella Enteritidis. Lohmann Information 3/1999, 17-20 HAHN, I., u. W. SCHÖLL (1984): Zur Salmonella-dublin-Bekämpfung und –Sanierung in Rinderbeständen unter Anwendung eines kompletten Immunisierungsprogrammes. Mh. Vet.-Med. 39, 208-213 HARTUNG, M. (2004): Mitteilungen der Länder über Salmonella-Nachweise in Deutschland. In: HARTUNG, M. (2004): Epidemiologische Situation der Zoonosen in Deutschland im Jahr 2003. Bundesinstitut für Risikobewertung (BfR), Berlin, S. 21-114 HASSAN, J. O., u. R. CURTISS III (1996): Effect of vaccination of hens with an avirulent strain of Salmonella typhimurium on immunity of progeny challenged with wild-type Salmonella strains. Infect. Immun., 64, 938-944 HASSAN, J. O., u. R. CURTISS III (1997): Efficacy of a live avirulent Salmonella typhimurium vaccine in preventing colonization and invasion of laying hens by Salmonella typhimurium and Salmonella enteritidis. Avian Dis. 41, 783-791 HEIDER, G. u. G. MONREAL (Hrsg.)(1992): Krankheiten des Wirtschaftsgeflügels – Ein Handbuch für Wissenschaft und Praxis. Band II: Spezieller Teil 2 Gustav Fischer Verlag, Jena, Stuttgart, S. 110-141 HELMUTH, R. (2000): Antibiotic Resistance in Salmonella. In: C. WRAY und A. WRAY (Hrsg.): Salmonella in Domestic Animals. CABI Publishing, Wallingford, New York, S. 89-106 8 LITERATURVERZEICHNIS 169 HELMUTH, R., B. GUERRA, B. MALORNY, A. MIKO, u. A. SCHROETER (2004): Erfassung phänotypischer und genotypischer Resistenzeigenschaften bei Salmonella- und E. coli-Isolaten vom Tier, Lebensmitteln, Futtermitteln und der Umwelt. Abschlußbericht zum Forschungsvorhaben. Bundesinstitut für Risikobewertung (BfR), S.1-42 HELMUTH, R., u. D. PROTZ (1997): How to modify conditions limiting resistance in bacteria in animals and other reservoirs. Clin. Infect. Dis., 24, Suppl. 1, 136-138 HENRY, R. R. (2000): Salmonella infection in ducks. In: C. WRAY und A. WRAY (Hrsg.): Salmonella in Domestic Animals. CABI Publishing, Wallingford, New York, S. 157-167 HENSEL, M. (2001): Pathogenitätsinseln in Salmonella enterica. Hygiene und Mikrobiologie 1, 17-20 HENZLER, D. J., u. H. M. OPITZ (1992): The role of mice in the epizootiology of Salmonella enteritidis infection on chicken layer farms. Avian Dis. 36, 625-631 HEYN, E., K. DAMME, M. MANZ, S. PLATZ, u. M. ERHARD (2005a): Tiergerechte Wasserversorgung von Pekingenten: Erfüllen offene Tränken hygienische Ansprüche? DGS Magazin 11, 46-49 HEYN, E., K. DAMME, F. REMY, S. PLATZ, u. M. ERHARD (2005b): Tiergerechte Wasserversorgung von Pekingenten: Zugang zur offenen Tränke zeitlich begrenzen? DGS Magazin 9, 51-56 HEYNDRICKX, M., D. VANDERKERCHOVE, L. HERMAN, I. ROLLIER, K. GRIJSPEERDT, u. L. DE ZUTTER (2002): Routes for Salmonella contamination of poultry meat: epidemiological study from the hatchery to slaughterhouse. Epidemiol. Infect. 129, 253-265 HIGGINS, W. A., J. B. CHRISTIANSEN, u. C. H. SCHROEDER (1944): A Salmonella enteritidis infection associated with leg deformity in turkeys. Poult. Sci. 23, 340-341 zit. nach: HAFEZ u. JODAS (2000) 170 8 LITERATURVERZEICHNIS HIMATHONGKHAM, S., M. G. PEREIRA, u. H. RIEMANN (1996): Heat destruction of Salmonella in poultry feed: effect of time, temperature, and moisture. Avian Dis. 40, 72-77 HINTON, A., D. E. CORRIER, G. E. SPATES, J. O. NORMAN, R. L. ZIPRIN, R. C. BEIER, u. J. R. DeLOACH (1990): Biological Control of Salmonella typhimurium in Young Chickens. Avian Dis. 34, 626-633 HINTON, M., G. R. PEARSON, E. J. THRELFALL, B. ROWE, M. WOODWARD, u. C. WRAY (1989): Experimental Salmonella enteritidis infection in chicks. Vet. Rec. 124, 223 HINZ, K.-H., G. GLÜNDER, S. ROTTMANN, u. M. FRIEDERICHS (1989): Über Salmonella gallinarum Feldisolate der Biovare Pullorum und Gallinarum. Berl. Münch. Tierärztl. Wschr. 102, 205-208 HOLT, P. S. (2003): Moulting and Salmonella enterica serovar Enteritidis infection: the problem and some solutions. Poult. Sci. 82, 1008-1010 HOLT, P. S., N. P. MACRI, u. R. E. PORTER (1995): Microbiological analysis of the early Salmonella enteritidis infection in molted and unmolted hens. Avian Dis. 39, 55-63 HORMAECHE, C. E., B. VILLARREAL, G. DOUGAN, u. S. N. CHATFIELD (1993): Immunity mechanisms in experimental salmonellosis. In: Cabello, F., C. HORMAECHE, P. MASTROENI, u. L. BONINA (Hrsg.): Biology of Salmonella. Plenum Press, New York, S. 223-235 HUMPHREY, T. J., A. BASKERVILLE, H. CHART, B. ROWE, u. A. WHITEHEAD (1991): Salmonella enteritidis PT4 infection in specific pathogen free hens: influence of infecting dose. Vet. Rec. 129, 482-485 IMPEY, C. S., G. C. MEAD, u. S. M. GEORGE (1982): Competitive exclusion of salmonellae from the chick caecum using a defined mixture of bacterial isolates from the caecal microflora of an adult bird. J. Hygiene, 89, 479-490 8 LITERATURVERZEICHNIS 171 IZAT, A. L., N. M. TIDWELL, R. A. THOMAS, M. A. REIBER, M. H. ADAMS, M. COLBERG, u. P. W. WALDROUP (1990): Effects of a buffered propionic acid in diets on the performance of broiler chickens and on microflora on the intestine and carcass. Poult. Sci. 69, 818-826 JANEWAY, C. A., P. TRAVERS, M. WALPORT, u. M. J. SHLOMCHIK (2002): Immunologie. 5. Aufl., Spektrum Akademischer Verlag, Heidelberg, S. 42-44 JANSS, L. L., u. N. M. BOLDER (2000): Heritabilities of and genetic relationships between salmonella resistance traits in broilers. J. Anim. Sci., 78, 2287-2291 JOHANNSEN, S. A., R. W. GRIFFITH, I. V. WESLEY, u. C. G. SCANES (2004): Salmonella enterica serovar typhimurium colonization of the crop in the domestic turkey: Influence of probiotic and prebiotic treatment (Lactobacillus acidophilus and Lactose). Avian Dis. 48, 279-286 JONES, B. D., u. S. FALKOW (1996): Salmonellosis: Host immune responses and bacterial virulence determinants. Annu. Rev. Immunol. 14, 533-561 JONES, B. D., N. GHORI, u. S. FALKOW (1994): Salmonella Typhimurium initiates murine infection by penetrating and destroying the specialized epithelial M cells of the Peyer's patches. J. Exp. Med. 180, 15-23 JONES, G. W., L. A. RICHARDSON, u. D. UHLMAN (1981): The invasion of HeLa cells by Salmonella Typhimurium: reversible and irreversible bacterial attachment and the role of bacterial motility. J. Gen. Microbiol. 127, 351-360 KELLER, L. H., C. E. BENSON, K. KROTEC, u. R. J. ECKROADE (1995): Salmonella enteritidis colonization of the reproductive tract and forming freshly laid eggs of chickens. Infect. Immun. 63, 2443-2449 KINDE, H., H. L. SHIVAPRASAD, B. M. DAFT, D. H. READ, A. ARDANS, R. BREITMEYER, G. RAJASHERA, K. V. NAGARAJA, u. I. A. GARDNER (2000): Pathologic and bacteriologic findings in 27-week-old commercial laying hens experimentally infected with Salmonella Enteritidis phage type 4. Avian Dis. 44, 239-248 172 8 LITERATURVERZEICHNIS KLEIN, G. (2000): Lebensmittel als potentielle Vektoren für Antibiotikaresistenzen, 2. Mitteilung: Bedeutung von Milchsäurebakterien. Berl. Münch. Tierärztl. Wschr. 113, 46-52 KNOLL, U., G. GLÜNDER, u. M. KIETZMANN (1999): Comparative study of the plasma pharmacokinetics and tissue concentrations of danofloxacin and enrofloxacin in broiler chickens. J. Vet. Pharmacol. Therap. 22, 239-246 KÖHLER W., H. J. EGGERS, B. FLEISCHER, R. MARRE, H. PFISTER, u. G. PULVERER (2001): Medizinische Mikrobiologie. 8. Aufl., Urban& Fischer Verlag, München, S. 290-292 KÖHLER, B., G. REETZ, K. ALBRECHT, u. W. RABSCH (1996): Diagnostik, Epidemiologie und Bekämpfung der Salmonella-Typhimurium- und Salmonella-Enteritidis-Infektion bei Enten unter besonderer Berücksichtigung der Immunprophylaxe mit Lebendimpfstoffen. Referatesammlung des 51. Fachgespräches der Fachgruppe für Geflügelkrankheiten in Hannover 31.10.-01.11.1996, S. 91-144 KOHBATA, S., H. YOKOYAMA, u. E. YABUUCHI (1986): Cytopathogenic effect of Salmonella Typhi GIFU 10007 on M cells of murine ileal peyer's patches in ligated ileal loops: An ultrastructural study. Microbiol. Immunol. 30, 1225-1237 KRAMER, J., S. H. M JEURISSEN, J. A. WAGENAAR, u. A. H. VISSCHER (1999): Differences in macrophages functions between broiler chicken lines against Salmonella enteritidis. Archiv für Tierzucht, Dummerstorf, 42, 112-115 zit. nach BARROW et al. (2003) KÜHN, H. (1993): Vorkommen von Enteritidis-Salmonellen beim Menschen. Dtsch. Tierärztl. Wschr. 100, 255-258 LAILLER, R., F. GRIMONT, Y. JONES, P. SANDERS, u. A. BRISABOIS (2002): Subtyping of Salmonella typhimurium by pulsed-field gel electrophoresis and comparisons with phage types and resistance types. Pathol. Biol. 50, 361-368 LA RAGIONE, R. M., W. A. COOLEY, P. VELGE, M. A. JEPSON, u. M. J. WOODWARD (2003): Membrane ruffling and invasion of human and avian cell lines is reduced for aflagellate mutants of Salmonella enterica serotype Enteritidis. Int. J. Med. Microbiol. 293, 261-272 8 LITERATURVERZEICHNIS 173 LIBBY, S. J., T. A. HALSEY, C. ALTIER, J. POTTER, u. C. L. GYLES (2004): Salmonella. In: C. L. GYLES, J. F. PRESCOTT, J. G. SONGER und C. O. THOEN (Hrsg.): Pathogenesis of Bacterial Infections in Animals. 3. Aufl., Verlag Blackwell, Iowa, S. 143-167 LIEBANA, E., L. GARCIA-MIGURA, C. CLOUTING, F. A. CLIFTON-HADLEY, M. BRESLIN, u. R. H. DAVIES (2003): Molecular fingerprinting evidence of the contribution of wildlife vectors in the maintenance of Salmonella Enteritidis infection in layer farms. J. Appl. Microbiol. 94, 1024-1029 LINDE, K., I. HAHN, u. E. VIELITZ (1996): Entwicklung von optimal an das Huhn attenuierten Salmonella-Lebendimpfstoffen. Tierärztl. Umschau 51, 23-31 LOCKMAN, H. A., u. R. CURTISS III (1990): Salmonella Typhimurium mutants lacking flagella or motility remain virulent in BALB/c mice. Infect. Immun. 58, 137-143 MALORNY, B., A. SCHROETER, B. GUERRA, u. R. HELMUTH (2003): Incidence of quinolone resistance in strains of Salmonella isolated from poultry, cattle and pigs in Germany between 1998 and 2001. Vet. Rec. 153, 643-648 MARIANI, P., P. A. BARROW, H. H. CHENG, M. M. GROENEN, R. NEGRINI, u. N. BUMSTEAD (2001): Localization to chicken Chromosome 5 of a novel locus determining salmonellosis resistance. Immunogenetics, 53, 786-791 MARIMÓN, J. M., M. GOMÁRIZ, C. ZIGORRAGA, G. CILLA, u. E. PÉREZTRALLERO (2004): Increasing prevalence of quinolone resistance in human nontyphoid Salmonella enterica isolates obtained in Spain from 1981 to 2003. Antimicrob. Agents Chemotherap. 48, 3789-3793 MARTHEDAL, H. E. (1977): The occurrence of salmonellosis in poultry in Denmark 1935-75, and the controlling programme established. In: BARNUM, D. A. (Hrsg.): Proceedings of the international symposium on Salmonella and prospects of control. Guelph, Canada, S. 78-94 zit. nach: EFSA (2004) 174 8 LITERATURVERZEICHNIS MATLHO, G., S. HIMATHONGKHAM, H. RIEMANN, P. KAAS (1997): Destruction of Salmonella enteritidis in poultry feed by combination of heat and propionic acid. Avian Dis. 41, 58-61 MATTHES, S. (1992): Salmonella-Infektionen. In: HEIDER, G. u. G. MONREAL (Hrsg.): Krankheiten des Wirtschaftsgeflügels – Ein Handbuch für Wissenschaft und Praxis. Band II: Spezieller Teil 2 Gustav Fischer Verlag, Jena, Stuttgart, S. 110-124 McILROY, S. G., R. M. McCRAKEN, S. D. NEILL, u. J. J. O’BRIEN (1989): Control, prevention and eradication of Salmonella enteritidis infection in broiler and broiler breeder flocks. Vet. Rec. 125, 545-548 MEAD, G. C. (2000): Prospects for ‘competitive exclusion’ treatment to control salmonellas and other foodborne pathogens in poultry. Vet. J., 159, 111-123 METHNER, U., S. KEILING, B. KREUTZER, u. P. SCHWEINITZ (2002): Wird die Wirksamkeit der Immunisierung von Küken mit SalmonellaLebendimpfstoffen durch maternale Antikörper beeinflusst? Dtsch. tierärztl. Wschr. 109, 149-153 METHNER, U., H. KOCH, u. H. MEYER (1995): Modell zur experimentellen Wirksamkeitsprüfung von Bekämpfungsmaßnahmen gegen Salmonellainfektionen beim Huhn. Dtsch. tierärztl. Wschr. 102, 225-228 METHNER, U., u. G. STEINBACH (1997): Wirksamkeit maternaler Salmonellaantikörper gegen eine orale Testinfektion von Küken mit Salmonella Enteritidis. Berl. Münch. Tierärztl. Wschr. 110, 373-377 METHNER, U., G. STEINBACH, u. H. MEYER (1994): Untersuchungen zur Wirksamkeit einer Salmonella-Immunisierung von Broilerelterntieren auf die Salmonella-Besiedlung dieser Tiere und deren Nachkommen nach experimenteller oraler Testinfektion. Berl. Münch. Tierärztl. Wschr. 107, 192-198 MEYER, H. (1999): Tiere als Infektionsquelle für die Menschen – Salmonellosen. Dtsch. tierärztl. Wschr. 106, 344-351 8 LITERATURVERZEICHNIS 175 MEYER, H:, H. KOCH, U. METHNER, u. G. STEINBACH (1993a): Vaccines in salmonellosis control in animals. Zbl. Bakt. 278, 407-415 MEYER, H., G. STEINBACH, u. U. METHNER (1993b): Bekämpfung von Salmonellen-Infektionen in Tierbeständen – Grundlage der Reduzierung des Salmonelleneintrags in Lebensmitteln. Dtsch. tierärztl. Wschr. 100, 292-295 MIAN, L. S., H. MAAG, u. J. V. TACAL (2002): Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino County, California. J. Vector. Ecol. 27, 82-85 MILNER, K. C., u. M. F. SHAFFER (1952): Bacteriological studies of experimental Salmonella infections in chicks. J. Inf. Dis. 90, 81-96 MITCHELL, B. W., R. J. BUHR, M. E. BERRANG, J. S. BAILEY, u. N. A. COX (2002): Reducing airborne pathogens, dust and Salmonella transmission in experimental hatching cabinets using an electrostatic space charge system. Poult. Sci., 81, 49-55 MOORE, B. C., E. MARTINEZ, J. M. GAY, u. D. H. RICE (2003): Survival of Salmonella enterica in freshwater and sediments and transmission by aquatic midge Chironomus tentans (Chironomidae: Diptera). Appl. Environ. Microbiol. 69, 4556-4560 NASTASI, A., u. C. MAMMINA (1996): Epidemiology of Salmonella enterica serotype Enteritidis infections in southern Italy during the years 1980-1994. Res. Microbiol. 147, 393-403 NEUMANN, U., u. E. F. KALETA (1992): Immunsystem und Immunreaktionen. In: HEIDER, G., u. G. MONREAL (Hrsg.): Krankheiten des Wirtschaftsgeflügels. Gustav Fischer Verlag, Jena, S. 159-185 NURMI, E., L. NUOTIO, u. C. SCHNEITZ (1992): The competitive exclusion concept: development and future. Int. J. Food Microbiol. 15, 237-240 176 8 LITERATURVERZEICHNIS NYGARD, K., B. DE JONG, P. J. GUERIN, Y. ANDERSSON, A. OLSSON, u. J. GIESECKE (2004): Emergence of new Salmonella Enteritidis phage types in Europe? Surveillance of infections in returning travellers. BMC Med. 2004 Sep2; 2:32 O’BRIEN, J. D. P. (1988): Salmonella Enteritidis infection in broiler chickens. Vet. Rec. 122, 214 O’BRIEN, S., I. GILLESPIE, A. CHARLETT, B. ADAK, J. THRELLFALL, u. L. WARD (2004): National case-control study of Salmonella Enteritidis phage type 14b infection in England and Wales implicates eggs used in catering trade. Eurosurveillance Weekly, Vol. 8, Issue 8 OLSEN, A. R., u. T. S. HAMMACK (2000): Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera: Muscidae), at caged-layer houses. J. Food Prot. 63, 958-960 OTEO, J., B. ARACIL, J. I. ALOS, u. J. L. GOMEZ-GARCES (2000): High rate of resistance to nalidixic acid in Salmonella enterica: its role as a marker of resistance to fluoroquinolones. Clin. Microbiol. Infec. 6, 273-276 OYOFO, B. A., J. R. DeLOACH, D. E. CORRIER, J. O. NORMAN, R. L. ZIPRIN, u. H. H. MOLLENHAUER (1989): Effect of Carbohydrates on Salmonella typhimurium colonization in Broiler Chickens. Avian Dis. 33, 531-534 PADRON, M. N. (1990): Salmonella typhimurium outbreak in broiler chicken flocks in Mexico. Avian Dis. 34, 221-223 PASCUAL, M., M. HUGAS, J. I. BADIOLA, J. M. MONFORT, u. M. GARRIGA (1999): Lactobacillus salivarius CTC2197 prevents Salmonella enteritidis colonization in chickens. Appl. Environ. Microb. 65, 4981-4986 PAYER, M. (Hrsg.) (2001): Entwicklungsländerstudien. Teil I: Grundgegebenheiten. --Kapitel 8: Tierische Produktion. --7. Geflügel. --2. Enten zusammengestellt von Alois Payer. --Fassung vom 2001-02-20. -- URL: http://www.payer.de/entwicklung/entw0872.htm. –[Stichwort: Zoologische Systematik Enten] Zugriff 2004-12-01 8 LITERATURVERZEICHNIS 177 PICHARDT, K. (1998): Lebensmittelmikrobiologie: Grundlagen für die Praxis. Springer-Verlag, Berlin, Heidelberg, S.42-43 PIDDOCK, L. V. J., C. WRAY, I. MCLAREN, u. R. WISE (1990): Quinolone resistance in Salmonella: veterinary pointers. Lancet 336, 125 PINGEL, H. (1998): Wo steht die deutsche Enten- und Gänseproduktion? DGS Magazin 6, 49-52 PINGEL, H. (2000): Enten und Gänse. Verlag Ulmer, Stuttgart, S.10, S.14-16, S.27-28 PINGEL, H. (2004): Duck and geese production around the world. World Poultry 20, Nr. 8, 26-28 PITTLER, H. (1993): Bekämpfungsstrategien gegen Salmonellen-Infektionen in der Geflügelhaltung auf EG-Ebene – Zur Umsetzung der sog. EG-Zoonosen-Richtlinie. Dtsch. tierärztl. Wschr. 100, 295-297 PLATZBECKER, M. (2000): Der große Geflügelstandard in Farbe. 2. Aufl., Bd.3 Wassergeflügel: Gänse und Enten. Verlag Oertel und Spörer, Reutlingen, S.12-13, S.74-76 POPIEL, I. u. P. C. B. TURNBULL (1985): Passage of Salmonella enteritidis and Salmonella thompson through chick ileocecal mucosa. Infect. Immun. 47, 786-792 POPPE, C. (2000): Salmonella infections in domestic fowl. In: C. WRAY und A. WRAY (Hrsg.): Salmonella in Domestic Animals. CABI Publishing, Wallingford, New York, S. 107-132 POPPE, C., R. J. IRWIN, S. MESSIER, G. G. FINLEY, u. J. OGGEL (1991): The prevalence of Salmonella enteritidis and other Salmonella spp. among Canadian registered commercial chicken broiler flocks. Epidemiol. Infect. 107, 201-211 PRICE, J. I., E. DOUGHERTY, u. D. J. W. BRUNNER (1962): Salmonella infections in white pekin duck. A short summary of the years 1950-1960. Avian Dis. 6, 145-147 178 8 LITERATURVERZEICHNIS PRIYANKARAGE, N., S. S. SILVA, G. A. GUNAWARDANA, M. W. PALLIYAGURU, W. M. WEERASINGHE, G. K. FERNANDO, u. R. A. CHANDIMA (2004): Effect of different probiotics against a lethal dose of Salmonella challenge in broiler chickens. Br. Poult. Sci. 45, Suppl. 1, S.43-45 PROTAIS, J., P. COLIN, C. BEAUMONT, J. F. GUILLOT, F. LANTHIER, P. PARDON, u. G. BENNEJEAN (1996): Line differences in resistance to Salmonella enteritidis PT 4 infection. Br. Poultry Sci., 37, 329-339 RABSCH, W. (2000): Die Salmonellose im ausgehenden 20.Jahrhundert. Epidemiologische Betrachtungen zum Auftreten von Salmonella Typhimurium und Salmonella Enteritidis beim Menschen und Geflügel in Deutschland. Tagungsberichte in Bundesgesundheitsbl. – Gesundheitsforsch. – Gesundheitsschutz, Springer-Verlag, Berlin, 1–2000 43, S. 68 RABSCH, W., H. L. ANDREWS, R. A. KINGSLEY, R. PRAGER, H. TSCHÄPE, L. G. ADAMS, u. A. J. BÄUMLER (2002): Salmonella enterica serotype Typhimurium and its host-adapted variants. Infect. Immun. 70, 2249-2255 RABSCH, W., H. TSCHÄPE, u. A. J. BÄUMLER (2001): Non-typhoidal salmonellosis: emerging problems. Microbes Infect., 3, 237-247 RAETHEL, H.-S. (2003): Wasser- und Ziergeflügel 5. Aufl., Verlag Oertel und Spörer, Reutlingen, S.119-121, S.149-150 RAMESH, N., S. W. JOSEPH, L. E. CARR, L. W. DOUGLASS, u. F. W. WHEATON (2003): Serial disinfection with heat and chlorine to reduce microorganism populations on poultry transport containers. J. Food Prot., 66, 793-797 REDMANN, T., G. GLÜNDER, B. SCHILDGER, T. GÖBEL, u. E. F. KALETA (1989): Therapieversuch mit Enrofloxacin (BaytrilR) in einer Legehennenhaltung mit Pullorum-Salmonellose. Dtsch. Tierärztl. Wschr. 96, 137-138 ROY, P., A. S. DHILLON, H. L. SHIVAPRASAD, D. M. SCHABERG, D. BANDLI, u. S. JOHNSON (2001): Pathogenicity of different serogroups of avian Salmonellae in specific-pathogen-free chickens. Avian Dis. 45, 922-937 8 LITERATURVERZEICHNIS 179 SADLER, W. W., J. R. BROWNELL, u. M. J. FANELLI (1969): Influence of age and inoculum level on shed pattern of Salmonella Typhimurium in chickens. Avian Dis. 13, 793-803 SAEED, A. M., R. K. GAST, M. E. POTTER, u. P. G. WALL (Hrsg.) (1999): Salmonella enterica serovar Enteritidis in human and animals. Epidemiology, pathogenesis, and control. Iowa State Press, Ames SAITANU, K., J. JERNGKLINCHAN, u. C. KOOWATANAUKUL (1994): Incidence of salmonellae in duck eggs in Thailand. Southeast Asian J. Trop. Med. Public Health 25, 328-331 SCHAAF, J. (1936): Die Salmonellose (infektiöse Enteritis, Paratyphose) des Geflügels, ihre Bedeutung und Bekämpfung. Zeitschrift für Infektionskrankheiten, Parasitäre Krankheiten und Hygiene der Haustiere 49, 322-332 zit. nach: POPPE (2000) SCHMIDT, H. (1996): Groß- und Wassergeflügel: Puten, Perlhühner, Gänse, Enten. 2. Aufl. Verlag Ulmer, Stuttgart, S.27-31, S.45-47, S.160-163, S.180 SCHNEIDER, T. (2005): Bedeutung der Meldepflicht für Salmonellenbefunde bei Geflügel vor dem Hintergrund der Zoonosenüberwachung nach der Europäischen Zoonosenrichtlinie und der Zoonosenbekämpfung nach der Europäischen Zoonosenverordnung. Referatesammlung des 68. Fachgespräches der Fachgruppe für Geflügelkrankheiten in Hannover 12.-13. Mai 2005, S. 7-11 SCHÖLL, W. (1988): Zur Bekämpfung einer typhoiden Salmonellose unter besonderer Berücksichtigung des Impfstoffeinsatzes. Leipzig, Veterinärmed. Fak. Univ. Leipzig, Habil.-Schr. SCHRÖDER, I., M. IBURG, u. E. REBESKI (2004): Anwendung von TAD Salmonella vac® T und TAD Salmonella vac® E in der Geflügelpraxis unter besonderer Berücksichtigung der Impfstoffapplikation und – kontrolle. Lohmann Information 4/2004, 31-34 180 8 LITERATURVERZEICHNIS SCHROETER, A., C. DORN, u. R. HELMUTH (2004): Weitere Beiträge – Bericht des Nationalen Veterinärmedizinischen Referenzlabors für Salmonellen im Jahr 2003. In: HARTUNG, M. (2004): Epidemiologische Situation der Zoonosen in Deutschland im Jahr 2003. Bundesinstitut für Risikobewertung (BfR), Berlin, S. 115-126 SCHROETER, A., W. RABSCH, C. DORN, A. MIKO, u. R. HELMUTH (2000): Ergebnisse der Lysotypie von Salmonella-Enteritidis- und Salmonella-TyphimuriumIsolaten aus dem Geflügel. Tagungsberichte in Bundesgesundheitsbl. – Gesundheitsforsch. – Gesundheitsschutz, Springer-Verlag, Berlin, 1–2000 43, S. 69 SCHUHMACHER, A., P. STEINKE, J. A. BOHNERT, M. AKOVA, D. JONAS, u. W. V. KERN (2006): Effect of 1-(1-naphthylmethyl)-piperazine, a novel putative efflux pump inhibitor, on antimicrobial drug susceptibility in clinical isolates of Enterobacteriaceae other than Escherichia coli. J. Antimicrob. Chemotherap. 57, 344-348 SCHWARZ, R., u. K. NEURAND (1972): Die Bedeutung der Schalenhautmorphologie im Entenei für eine Besiedlung mit Salmonellen. Dtsch. Tierärztl. Wschr. 79, 431-433 SELBITZ, H.-J. (2002): Bakterielle Krankheiten der Tiere. In: ROLLE, M., u. A. MAYR (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 7. Auflage, Enke Verlag, Stuttgart, 417-588 SELBITZ, H.-J. (2000): Epidemiologische Aspekte von Salmonella-Infektionen bei Vögeln. Ein Beitrag zur Bewertung des Zoonoserisikos. Tagungsberichte in Bundesgesundheitsbl. – Gesundheitsforsch. – Gesundheitsschutz, Springer-Verlag, Berlin, 1–2000 43, S. 68 SELBITZ, H.-J., H.-J. SINELL, u. A. SZIEGOLEIT (1995): Das Salmonellen-Problem: Salmonellen als Erreger von Tierseuchen und Zoonosen. Gustav Fischer Verlag, Jena SHAFFER, M. F., K. C. MILNER, D. I. CLEMMER, u. J. F. BRIDGES (1957): Bacteriological studies of experimental Salmonella infection in chicks. II. J. Inf. Dis. 100, 17-31 SHIVAPRASAD, H. L. (2003): Pullorum disease and fowl typhoid. In: SAIF, Y. M. (Hrsg.): Diseases of poultry. 11. Aufl., Iowa State Press, Ames, S. 568-582 8 LITERATURVERZEICHNIS 181 SHIVAPRASAD, H. L., J. F. TIMONEY, S. MORALES, B. LUCIO, u. R. C. BAKER (1990): Pathogenesis of Salmonella enteritidis infection in laying chickens. I. Studies on egg transmission, clinical signs, fecal shedding, and serologic responses. Avian Dis. 34, 548-557 SIMKO, S. (1988): Salmonellae in ducks and geese on farms with latent infections and in centres of salmonellosis. Immunoprofylaxia 1-2, 92-101 zit. nach HENRY (2000) und TRAN et al. (2004) SKOV, M. N., A. G. SPENCER, B. HALD, L. PETERSEN. B. NAUERBY, B. CARSTENSEN, u. M. MADSEN (2004): The role of litter beetles as potential reservoir for Salmonella enterica and thermophilic Campylobacter spp. between broiler flocks. Avian Dis., 48, 9-18 SNOEYENBOS, G. H., V. L. CARLSON, C. F. SMYSER, u. O. M. OLESIUK (1969): Dynamics of Salmonella infection in chicks reared on litter. Avian Dis. 13, 72-83 SOLJOUR, G., M. A. ASSANTA, S. MESSIER, u. M. BOULIANNE (2004): Efficacy of egg cleaning compounds on eggshells contaminated with Salmonella enterica serovar Enteritidis. J. Food Prot., 67, 706-712 SONNENBORN, U., u. R. GREINWALD (1991): Beziehungen zwischen Wirtsorganismus und Darmflora unter besonderer Berücksichtigung von Physiologie und Funktion der normalen Escherichia coli-Flora. Schattauer Verlag, Stuttgart, New York, S. 55-76 STAVRIC, S., u. J-Y. D’AOUST (1993): Undefined and defined bacterial preparations for the competitive exclusion of Salmonella in poultry – a review. J. Food Prot., 56, 173-180 STIMPSON, M. J. (1998): Future development of the duck industry in Asia Pacific. World Poultry 14, Nr. 12, 38-40 STOKES, J. L., W. W. OSBORNE, u. H. G. BAYNE (1956): Penetration and growth of Salmonella in shell eggs. Food Res. 21, 510-518 zit. nach POPPE (2000) 182 8 LITERATURVERZEICHNIS STONE, B. J., C. M. GARCIA, J. L. BADGER, T. HASSETT, R. I. SMITH, u. V. L. MILLER (1992): Identification of novel loci affecting entry of Salmonella Enteritidis into eukaryotic cells. J. Bacteriol. 174, 3945-3952 STORCK, B. M. (2001): Bruteihygiene bei Puten: Literaturübersicht. Berlin, Freie Univ., Fachber. Veterinärmed., Diss. SÜDBECK, M. (2005): Zur Handhabung der Meldepflicht beim Vorkommen von Salmonellen in Geflügel oder Geflügelfleisch. Referatesammlung des 68. Fachgespräches der Fachgruppe für Geflügelkrankheiten in Hannover 12.-13. Mai 2005, S. 12-16 SZMOLLENY, G., A. KOSTYAK, S. KOVACS, K. SPEED, Y. JONES, V. G. LASZLO, I. GADO, J. PASZTI, C. WRAY, u. B. NAGY (2000): Epidemiology and characterization of animal Salmonella enterica subspecies Enterica serotype Typhimurium DT104 in Hungary. Acta Vet. Hung. 48, 407-420 TELLEZ, G., V. M. PETRONE, M. ESCORCIA, T. Y. MORISHITA, C.W: COBB, L. VILLASENOR, u. B. PROMSOPONE (2001): Evaluation of avian-specific probiotic and Salmonella enteritidis-, Salmonella typhimurium-, and Salmonella heidelberg-specific antibodies on cecal colonization and organ invasion of Salmonella enteritidis in broilers. J. Food Prot. 64, 287-291, 933 THAMLIKITKUL, V., S. TRAKULSOMBOON, S. LOUISIRIROTCHANAKUL, A. CHAIPRASERT, S. FOONGLADDA, K. THIPSUVAN, W. ARJRATANAKOOL, R. KUNYOK, C. WASI, S. SANTIPRASITKUL, u. S. DANCHAIVIJITR (2001): Microbial killing activity of peracetic acid. J. Med. Assoc. Thai. 84, 1375-1382 THRELFALL, E. J., L. R. WARD, J. A. SKINNER, u. B. ROWE (1997): Increase in multiple antibiotic resistance in nontyphoidal salmonellas from humans in England and Wales: a comparison of data for 1994 and 1996. Microb. Drug Resist. 3, 263-266 TIMONEY, J. F., H. L. SHIVAPRASAD, R. C. BAKER, u. B. ROWE (1989): Egg transmission after infection of hens with Salmonella enteritidis phage type 4. Vet. Rec. 125, 600-601 8 LITERATURVERZEICHNIS 183 TRAN, T. P., T. L. K. LY, T. T. NGUYEN, M. AKIBA, N. OGASAWARA, D. SHINODA, A. T. OKATANI, u. H. HAYASHIDANI (2004): Prevalence of Salmonella spp. in pigs, chickens and ducks in the Mekong Delta, Vietnam. J. Vet. Med. Sci. 66, 1011-1014 TSAI, H. J., P. H. HSIANG (2005): The prevalence and antimicrobial susceptibilities of Salmonella and Campylobacter in ducks in Taiwan. J. Vet. Med. Sci. 67, 7-12 TURNBULL, P. C. B., u. G. H. SNOEYENBOS (1974): Experimental salmonellosis in the chicken. 1. Fate and host response in alimentary canal, liver, and spleen. Avian Dis. 18, 153-177 TURNBULL, R. G., J. A. TALBOT, u. S. M. HAMILTON (1995): Hemodynamic changes and gut barrier function in sequential hemorrhagic and endotoxic shock. J. Trauma 38, 705-712 UNGEMACH, F. (2003): Antibiotikatherapie in der Geflügelmedizin. Samstagsakademie vom 28. Juni 2003 an der Veterinärmedizinischen Fakultät der Universität Leipzig. Prof. für Vogelkrankheiten und Institut für Pharmakologie, Pharmazie und Toxikologie. VADHANASIN, S., A. BANGTRAKULNONTH, u. T. CHIDKRAU (2004): Critical control points for monitoring salmonellae reduction in thai commercial frozen broiler processing. J. Food Prot. 67, 1480-1483 VAN DE GIESSEN, A. W., R. PETERS, P. A. T. A. BERKERS, W. H. JANSEN, u. S. H. W. NOTERMANS (1991): Salmonella contamination of poultry flocks in The Netherlands. Veterinary Quarterly 13, 41-46 zit. nach POPPE (2000) VAN IMMERSEEL, F., J. DE BUCK, F. PASMANS, L. BOHEZ, F. BOYEN, F. HAESEBROUCK, u. R. DUCATELLE (2004): Intermittent long-term shedding and induction of carrier birds after infection of chickens early posthatch with a low or high dose of Salmonella Enteritidis. Poult. Sci. 83, 1911-1916 VAZQUEZ-TORRES, A., u. F. C. FANG (2001): Salmonella evasion of the NADPH phagocyte oxidase. Microbes Infect. 3, 1313-1320 184 8 LITERATURVERZEICHNIS VIELITZ, E., C. CONRAD, M. VOSS, U. LÖHREN, J. BACHMEIER, u. I. HAHN (1992): Immunisierung gegen Salmonella-Infektionen mit Lebend- und Inaktivat-Vakzinen. Dtsch. tierärztl. Wschr. 99, 483-485 VOGT, H., S. MATTHES, u. S. HARNISCH (1981): Der Einfluss organischer Säuren auf die Leistungen von Broilern und Legehennen. Arch. Geflügelk. 45, 221-232 VOGT, H., S. MATTHES, u. S. HARNISCH (1982): Der Einfluss organischer Säuren auf die Leistungen von Broilern – 2. Mitteilung. Arch. Geflügelk. 46, 223-227 WARD, L. R., J. D. H. DE SA, u. B. ROWE (1987): A phage typing system scheme for Salmonella Enteritidis. Epidemiol. Infect. 99, 291-294 WATTS, J. L., S. A. SALMON, M. S. SANCHEZ, u. R. J. YANCEY (1997): In vitro activity of premafloxacin, a new extended-spectrum fluoroquinolone, against pathogens of veterinary importance. Antimicrob. Agents Chemotherap. 41, 1190-1192 WELLS, C. L., M. A. MADDAUS, u. R. L. Simmons (1988): Proposed mechanisms for the translocation of intestinal bacteria. Rev. Infect. Dis. 10, 958-979 WHO (1994): zit. nach: AWT (Arbeitsgemeinschaft für Wirkstoffe in der Tierernährung e. V.) (Hrsg.) (1999): Probiotika in der Tierernährung. Verlag Buchedition Agrimedia GmbH, Bergen WIEDEMANN, B. (1992): Bestimmung der Wirksamkeit von Chemotherapeutika. Empfindlichkeitsprüfung von Bakterien (Resistenzbestimmung, Antibiogramm). In: BURKHARDT, F. (Hrsg.): Mikrobiologische Diagnostik. Thieme Verlag, Stuttgart, New York, S. 715 WIEDEMANN, B., u. P. HEISIG (1994): Mechanisms of quinolone resistance. Infection. 22 Suppl. 2, 73-79 WIERUP, M., H. WAHLSTROM, u. B. ENGSTROM (1992): Experience of a 10-year use of competitive exclusion treatment as part of the Salmonella control programme in Sweden. Int. J. Food Microbiol., 15, 287-291 8 LITERATURVERZEICHNIS 185 WIGLEY, P., S. D. HULME, N. BUMSTEAD, u. P. A. BARROW (2002): In vivo and in vitro studies of genetic resistance to systemic salmonellosis in the chicken encoded by the SAL1 locus. Microbes. Infect., 4, 1111-1120 WOODWARD, M. J., M. SOJKA, K. A. SPRIGINGS, u. T. J. HUMPHREY (2000): The role of SEF14 and SEF17 fimbriae in the adherence of Salmonella enterica serotype Enteritidis to inanimate surfaces. J. Med. Microbiol. 49, 481-487 WRAY , C. (1985): Is salmonellosis still a serious problem in veterinary practise? Vet. Rec. 116, 485-489 WRAY, C., I. MCLAREN, R. WISE, u. L. J. V. PIDDOCK (1990): Nalidixic acid-resistant salmonellae. Vet. Rec. 126, 489 YAN, X. (2004): The changing face of the world of duck production. International Hatchery Practise 18, Nr. 6, 7-9 YETHON J. A., J. S. GUNN, R. K. ERNST, S. I. MILLER, L. LAROCHE, D. MALO, u. C. WHITFIELD (2000): Salmonella enterica serovar typhimurium waaP mutants show increased susceptibility to polymyxin and loss of virulence In vivo. Infect. Immun. 68, 4485-4491 YOKOYAMA, H., M. IKEDO, S. KOHBATA, T. EZAKI, u. E. YABUUCHI (1987): An ultrastructural study of HeLa cell invasion with Salmonella Typhi GIFU 10007. Microbiol. Immunol. 31, 1-11 ZIPRIN, R. L., D. E. CORRIER, A. HINTON, R. C. BEIER, G. E. SPATES, J. R. DeLOACH, u. M. H. ELISSALDE (1990): Intracloacal Salmonella typhimurium Infection of Broiler Chickens: Reduction of Colonization with Anaerobic Organisms and Dietary Lactose. Avian Dis. 34, 749-753 ZMP Zentrale Markt- und Preisberichtstelle für Erzeugnisse der Land-, Forst- und Ernährungswirtschaft GmbH Geflügel, Nr. 45/2004, Sonderausgabe zur EuroTier 2004 Jahrgang 42, Nr. 45; (ISSN 0946-6533), 4-5 186 8 LITERATURVERZEICHNIS Richtlinien, Verordnungen und Gesetze: Richtlinie 90/539/EWG des Rates vom 15. Oktober 1990 über die tierseuchenrechtlichen Bedingungen für den innergemeinschaftlichen Handel mit Geflügel und Bruteiern für ihre Einfuhr aus Drittländern. (ABl. L 303 vom 31.10.1990, S. 6) Richtlinie 92/117/EWG des Rates über Maßnahmen zum Schutz gegen bestimmte Zoonosen bzw. ihre Erreger bei Tieren und Erzeugnissen tierischen Ursprungs zur Verhütung lebensmittelbedingter Infektionen und Vergiftungen vom 17. Dezember 1992. ABl. EG Nr. L 62, S. 38 Richtlinie 1999/90/EG des Rates vom 15. November 1999 zur Änderung der Richtlinie 90/539/EWG über die tierseuchenrechtlichen Bedingungen für den innergemeinschaftlichen Handel mit Geflügel und Bruteiern sowie für ihre Einfuhr aus Drittländern. (ABl. L 300 vom 23.11.1999, S.19-21 Richtlinie 2003/99/EG des Europäischen Parlaments und des Rates vom 17. November 2003 zur Überwachung von Zoonosen und Zoonoseerregern und zur Änderung der Entscheidung 90/424/EWG des Rates sowie zur Aufhebung der Richtlinie 92/117/EWG des Rates. Amtsblatt der Europäischen Union, L325/31-40 Verordnung über Enteneier vom 25. August 1954 (Entenei-Verordnung). BGBl. I S. 265, i.d.F. der Verordnung vom 17.12.1956 (BGBl. I S. 944) und der Eiprodukte-Verordnung vom 19.2.1975 (BGBl. I S. 537) Verordnung über die hygienischen Anforderungen an Eier, Eiprodukte und roheihaltige Lebensmittel vom 17. Dezember 1993 (Eier- und EiprodukteVerordnung). BGBl. I S. 2288, 20.7.2000 S. 1073; 14.8.2002 S. 3082; 10.4.2003 S. 478; 9.11.2004 S. 2691; 09.11.2004 S. 2791, 2794 Verordnung über tierärztliche Hausapotheken (TÄHAV) vom 27. März 1996 (BGBl. I, S. 554), zuletzt geändert durch Artikel 2 der Verordnung vom 10. August 2001 (BGBl. I, S. 2131) Verordnung zum Schutz gegen bestimmte Salmonelleninfektionen beim Haushuhn (Hühner-Salmonellen-Verordnung) vom 11.April 2001 BGBl. I, S. 544 8 LITERATURVERZEICHNIS 187 Verordnung (EG) Nr. 2160/2003 des Europäischen Parlaments und des Rates vom 17. November 2003 zur Bekämpfung von Salmonellen und bestimmten anderen durch Lebensmittel übertragbaren Zoonoseerregern (ZoonosenbekämpfungsVerordnung). Abl. L325 vom 12.12.2003, S. 1-15 Tierseuchengesetz in der Fassung vom 22. Juni 2004 (BGBl. I, S. 1260) Sonstiges: Bekanntmachung der Neufassung der Verordnung über meldepflichtige Tierkrankheiten vom 20. Dezember 2005 (BGBl. I, Nr. 74, S. 3516-3519) Europäisches Arzneibuch (2002): Mikrobiologische Prüfung nicht steriler Produkte: Nachweis spezifizierter Mikroorganismen. Amtliche deutsche Ausgabe, Band 1, Allgemeiner Teil, Monographiegruppen Deutscher Apotheker Verlag, Stuttgart, S. 166-170 Vereinbarung des Niedersächsischen Ministeriums für Ernährung, Landwirtschaft und Forsten (ML), Calenberger Str. 2, 30169 Hannover und der Niedersächsischen Geflügelwirtschaft, Landesverband e. V. (NGW), Mars-la-Tour-Straße, 26121 Oldenburg über Mindestanforderungen an die Haltung von Pekingmastenten vom 13.01.2003. Hrsg.: Niedersächsisches Ministerium für Ernährung, Landwirtschaft und Forsten, Referat 108 (Tierschutz) Az. 108-42503/2-497 188 9 ANHANG 9 Anhang 9.1 Zusammensetzung und Herstellung der verwendeten Medien Verwendete Medien (typische Zusammensetzung in g/l; sofern nicht anders angegeben) BPLS-Agar, modifiziert (Oxoid): Brillantgrün-Phenolrot-Lactose-Saccharose-Agar, modifiziert (Art.-Nr. CM329) Fleischextrakt 'Lab-Lemco' 5,0 Pepton 10,0 Hefeextrakt 3,0 Dinatriumhydrogenphosphat 1,0 Natriumdihydrogenphosphat 0,6 Lactose 10,0 Saccharose 10,0 Phenolrot 0,09 Brilliantgrün 0,0047 Agar 12,0 pH 6,9 ± 0,2 bei 25°C 52 g in 1 Liter Aqua dest. suspendieren und vorsichtig unter Rühren bis zum vollständigen Lösen erhitzen. Nicht autoklavieren! Nalidixinsäure-Stammlösung, 1% (w/v): Nalidixinsäure 1,0 g (Fluka BioChemika, Art.-Nr. 70162) Natronlauge c(NaOH) 1 mol/l 6,0 ml 9 ANHANG 189 (VWR, Art.-Nr. 1.09137.1000) Aqua bidest., steril ad 100 ml Nalidixinsäure einwiegen, Natronlauge hinzupipettieren (Lösen der Nalidixinsäure), Aqua bidest. hinzugeben; gut mischen. Lösung mit einem sterilem Rotilabo®-Spritzenfilter, 0,22 µm, aus Zellulosemischester (Roth, Art.-Nr. P664.1) und einer sterilen 20 ml Normject-Einmalspritze (Henke Sass Wolf GmbH, HSW; REF-Nr. 4 200.000VO) filtrieren. Aufbewahrung der Lösung bei 4-8 °C. BPLS-Agar, modifiziert mit 100mg/l Nalidixinsäure-Zusatz: Zusammensetzung des BPLS-Agars (Oxoid) wie oben angegeben. Bei der Herstellung Ansatz um 10 ml Aqua bidest. reduzieren. Nach Abkühlen des Agars auf 50 °C, Zugabe von 10 ml 1%iger NalidixinsäureStammlösung pro 990 ml Nährmedium. Gut mischen. Zu Platten gießen. BPLS100-Agar (Oxoid): (Sonderanfertigung) BPLS-Agar, modifiziert (Zusammensetzung wie oben angegeben) mit einem Zusatz von 100 mg Nalidixinsäure pro Liter Agar. 190 9 ANHANG Brolacin-Agar (C.L.E.D. Agar) (Merck): Bromthymolblau-Lactose-Cystin-Agar (Art.-Nr. 1.01638.0500) Peptone 7,0 Hefeextrakt 2,0 Fleischextrakt 2,0 L-Cystin 0,128 Lactose 10,0 Bromthymolblau 0,03 Agar-Agar 12,0 pH 7,3 ± 0,2 bei 25 °C 33g in 1 Liter Aqua dest. lösen und für 15 Minuten bei 121°C autoklavieren. Magermilch (Oxoid): (Art.-Nr. L 31) Typische Analyse (%, w/w) Feuchtigkeitsgehalt 5,0 Asche 8,0 Gesamtstickstoff 5,3 Reduzierende Zucker (als Lactose) 48,0 Ätherlösliche Substanzen 0,25 10 g der Magermilch auf 100 ml mit Aqua dest. auffüllen und 20 Minuten im Dampftopf bei 100 °C sterilisieren. Die Lösung 24 h bei Raumtemperatur aufbewahren und nochmals 20 Minuten im Dampftopf bei 100 °C sterilisieren. 9 ANHANG 191 TBG-Bouillon, modifiziert (Merck): Tetrathionat-Brilliantgrün-Galle-Anreicherungsbouillon (Art.-Nr. 1.05178.0500) Peptone 8,6 Ochsengalle, getrocknet 8,0 Natriumchlorid 6,4 Calciumcarbonat 20,0 Kaliumtetrathionat 20,0 Brilliantgrün 0,07 63g in 1 Liter Aqua dest. lösen, nötigenfalls unter kurzem Erwärmen auf max. 50 °C. Beim Abfüllen das ungelöste Calciumcarbonat gleichmäßig verteilen. Nicht autoklavieren! pH auf 7,0 ± 0,2 einstellen. Zugabe von 0,04 g / Liter Novobiocin Sodium Salt (Calbiochem Art.-Nr. 491207; Lieferant VWR Best.Nr. CALB 491207) zur Unterdrückung von Proteus. Standard I-Nährbouillon (Merck): (Art.-Nr. 1.07882.0500) Peptone 15,0 Hefeextrakt 3,0 Natriumchlorid 6,0 D(+)-Glucose 1,0 pH 7,5 ± 0,2 bei 25 °C 25g in 1 Liter Aqua dest. lösen und 15 Minuten bei 121 °C autoklavieren. 192 9 ANHANG Physiologische Kochsalzlösung: Natriumchlorid pro analysi (Merck) (Art.-Nr. 1.06404.0500) Natriumchlorid 9,0 g Aqua dest. 1l Das Natriumchlorid im Aqua dest. vollständig lösen und 15 Minuten bei 121 °C autoklavieren. Phosphatgepufferte Kochsalzlösung (PBS-Lösung): Natriumchlorid zur Analyse 8,0 (VWR Art.-Nr. 1.06404.0500) Kaliumdihydrogenphosphat reinst Ph. Eur. USP 0,2 (AppliChem, Art.-Nr. A1364,0500) di-Natriumhydrogenphosphat-Dodecahydrat reinst Ph. Eur., BP; USP 2,9 (AppliChem, Art.-Nr. A2641,0500) Einwiegen. Mit Aqua bidest. (eingestellt mit Salzsäure c(HCl) 1 mol/l (VWR, Art.-Nr. 1.09057.1000) und Natronlauge c(NaOH) 1 mol/l (VWR, Art.-Nr. 1.09137.1000) auf pH 7,4) ad 1000 ml. 9 ANHANG 9.2 193 Zusammensetzung des Futters Alleinfuttermittel für Entenküken (Georg Stolle GmbH, Westerscheps) Verabreichungszeit: 1. – 12. Lebenstag Inhaltsstoffe (laut Hersteller): Rohprotein 22,00 % Rohfett 4,50 % Rohfaser 4,00 % Rohasche 6,00 % Methionin 0,53 % Calcium 1,10 % Phosphor 0,75 % Natrium 0,15 % ME 11,80 MJ/kg Zusatzstoffe: Vitamin A als Vit.A-Präparat 7.000 I.E. Vitamin D3 3.000 I.E. Vitamin E als Vit.E-Präparat 50 mg Kupfer als Kupfer-(II)-Sulfat-Pentahydrat 15,5 mg Zusammensetzung: Weizen, Sojaextraktionsschrot, Erbsen, Mais, Triticale, Pflanzenfett, ZusatzstoffVormischung, Calciumcarbonat, L-Lysin-Monohydrochlorid, DL-Methionin. 194 9 ANHANG Alleinfuttermittel für Mastenten - Mittelmast - (Georg Stolle GmbH, Westerscheps) Verabreichungszeit: 13. – 35. Lebenstag Inhaltsstoffe (laut Hersteller): Rohprotein 18,00 % Rohfett 5,00 % Rohfaser 4,50 % Rohasche 5,50 % Methionin 0,50 % Calcium 1,05 % Phosphor 0,75 % Natrium 0,15 % ME 12,00 MJ/kg Zusatzstoffe: Vitamin A als Vit.A-Präparat 10.000 I.E. Vitamin D3 3.000 I.E. Vitamin E als Vit.E-Präparat 30 mg Kupfer als Kupfer-(II)-Sulfat-Pentahydrat 25 mg Zusammensetzung: Weizen, Sojaextraktionsschrot, Erbsen, Triticale, Mais, Roggen, Gerste, Rapsextraktionsschrot, Pflanzenfett, Sonnenblumenextraktionsschrot, ZusatzstoffVormischung, Calciumcarbonat, Zuckerrohrmelasse, L-Lysin-Monohydrochlorid, DLMethionin. 9 ANHANG 195 Alleinfuttermittel für Mastenten - Endmast; ab 36.LT - (Georg Stolle GmbH, Westerscheps) Verabreichungszeit: ab 36. Lebenstag Inhaltsstoffe (laut Hersteller): Rohprotein 17,00 % Rohfett 4,00 % Rohfaser 4,00 % Rohasche 5,50 % Methionin 0,45 % Calcium 1,00 % Phosphor 0,70 % Natrium 0,14 % ME 12,20 MJ/kg Zusatzstoffe: Vitamin A als Vit.A-Präparat 10.000 I.E. Vitamin D3 3.000 I.E. Vitamin E als Vit.E-Präparat 30 mg Kupfer als Kupfer-(II)-Sulfat-Pentahydrat 25 mg Zusammensetzung: Weizen, Erbsen, Triticale, Sojaextraktionsschrot, Roggen, Pflanzenfett, ZusatzstoffVormischung, Rapsextraktionsschrot, Calciumcarbonat, L-Lysin-Monohydrochlorid, DL-Methionin, L-Threonin. Die Futtermittel werden durch die Landwirtschaftskammer Weser-Ems (LUFA) auf den Gehalt an Schadstoffen kontrolliert. 196 9 ANHANG B240/19 deuka G/E-Starterfutter - Alleinfuttermittel für Enten und Gänse, gekörnt (Deuka, Bramsche) Verabreichungszeit: 1. – 12. Lebenstag Inhaltsstoffe (laut Hersteller): Rohprotein 21,00 % Rohfett 3,90 % Rohfaser 5,00 % Rohasche 7,50 % Methionin 0,45 % Calcium 1,20 % Phosphor 0,80 % Natrium 0,15 % ME 11,4 MJ/kg Hydroxy-Analog von Methionin (0,07 % Gesamtsäure, 0,05 % monomere Säure) Zusatzstoffe je kg Mischfutter: Vitamin A 10.000 I.E. Vitamin D3 3.000 I.E. Vitamin E (DL-a-Tocopherylacetat) 40 mg Kupfer (Kupfersulfat) 10 mg Antioxidans BHT Propionsäure Zusammensetzung: Weizen; Sojaextraktionsschrot, dampferhitzt; Maisschrot; Weizenkleie; Pflanzenöl (Mais, Sonnenblume, Kokos, Palm, Soja); Calciumcarbonat; Monodicalciumphosphat (anorganisch); Natriumchlorid; 0,08 % Hydroxy-Analog von Methionin. 9 ANHANG 197 B242/21 deuka G/E-Mastfutter - Alleinfuttermittel für Enten und Gänse, gekörnt (Deuka, Bramsche) Verabreichungszeit: ab 13. Lebenstag Inhaltsstoffe (laut Hersteller): Rohprotein 18,00 % Rohfett 3,80 % Rohfaser 4,00 % Rohasche 6,50 % Methionin 0,40 % Calcium 1,10 % Phosphor 0,70 % Natrium 0,15 % ME 12,2 MJ/kg Hydroxy-Analog von Methionin (0,06 % Gesamtsäure, 0,05 % monomere Säure) Zusatzstoffe je kg Mischfutter: Vitamin A 10.000 I.E. Vitamin D3 3.000 I.E. Vitamin E (DL-a-Tocopherylacetat) 40 mg Kupfer (Kupfersulfat) 10 mg Antioxidans BHT Propionsäure Zusammensetzung: Weizen; Sojaextraktionsschrot, dampferhitzt; Maisschrot; Pflanzenöl (Mais, Sonnenblume, Kokos, Palm, Soja); Calciumcarbonat; Monodicalciumphosphat (anorganisch); Natriumchlorid; 0,07 % Hydroxy-Analog von Methionin. 198 9 ANHANG B390/43 deuka Landkornendmast- Alleinfuttermittel I für Masthühnerküken (Broiler), gekörnt (Deuka, Bramsche) Inhaltsstoffe (laut Hersteller): Rohprotein 21,50 % Rohfett 7,50 % Rohfaser 3,50 % Rohasche 6,50 % Methionin 0,45 % Calcium 0,90 % Phosphor 0,65 % Natrium 0,13 % ME 12,6 MJ/kg Hydroxy-Analog von Methionin (0,08 % Gesamtsäure, 0,06 % monomere Säure) Zusatzstoffe je kg Mischfutter: Vitamin A 10.000 I.E. Vitamin D3 3.000 I.E. Vitamin E (DL-a-Tocopherylacetat) 25 mg Kupfer (Kupfersulfat) 10 mg Endo-1,4-ß-Xylanase (IUB 3.2.1.8) EG-Nr.5 200 FXU Antioxidans BHT Zusammensetzung: Weizen; Sojaextraktionsschrot, dampferhitzt; Maisschrot; Triticale; Rapskuchen; Pflanzenfett (Palm, Kokos, Sonnenblume); Calciumcarbonat; Pflanzenöl (Mais, Sonnenblume, Kokos, Palm, Soja); Monodicalciumphosphat (anorganisch); LysinHCL; Natriumchlorid; L-Threonin; 0,09 % Hydroxy-Analog von Methionin. 9 ANHANG 9.3 199 Auflistung der Werte Aufgrund der Vielzahl der erhobenen Daten werden im Folgenden die Mittelwerte der Keimzahlen aufgelistet. Jeder Mittelwert besteht aus fünf Einzelwerten (n=5). 9.3.1 Vorversuche - erster Abschnitt Salmonella Enteritidis Quantitativ Tab. 10: Organ Caecum2 Leber 1 2 Keimzahlen (KbE/g [log10]) am 7. Tag p.i. nach Infektion mit verschiedenen S. Enteritidis-Stämmen Alter bei Infektion 4. LT 7. LT 4. LT 7. LT Stamm1 SE-864 1,96 0,61 SE-391 0,93 0,40 SE-058 0,00 0,00 SE-059 1,61 1,53 SE-191 0,00 0,00 unmarkierte Stämme quantitative Auswertung war nicht möglich Qualitativ Tab. 11: Organ Caecum Leber Gallenblase Lunge Herz Gehirn 1 Vergleich der Anzahl salmonellen-positiver Organproben am 7. Tag p.i. nach Infektion mit verschiedenen S. Enteritidis-Stämmen Alter bei Infektion 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT unmarkierte Stämme Stamm1 SE-864 5 2 4 2 0 0 4 0 0 0 0 0 SE-391 2 1 3 1 0 0 0 0 0 0 0 0 SE-058 1 0 0 0 0 0 1 0 0 0 0 0 SE-059 0 0 4 3 0 0 0 0 0 0 2 0 SE-191 0 0 0 0 0 0 0 0 0 0 0 0 200 9 ANHANG Salmonella Typhimurium Quantitativ Tab. 12: Organ Caecum Leber Keimzahlen (KbE/g [log10]) am 7. Tag p.i. nach Infektion mit verschiedenen S. Typhimurium-Stämmen Stamm Alter bei Infektion ST-485 ST-360 ST-265r ST-279r ST-148r 4. LT 7. LT 4. LT 7. LT 5,01 3,24 2,56 2,23 6,08 3,46 2,22 1,56 4,85 3,77 2,21 1,72 6,22 5,31 1,64 2,03 5,27 3,62 1,87 1,27 r r Qualitativ Tab. 13: Organ Caecum Leber Gallenblase Lunge Herz Gehirn Vergleich der Anzahl salmonellen-positiver Organproben am 7. Tag p.i. nach Infektion mit verschiedenen S. Typhimurium-Stämmen Alter bei Infektion 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT 4. LT 7. LT Stamm r r ST-485 ST-360 ST-265r ST-279r ST-148r 5 5 5 4 3 2 4 2 1 0 0 1 5 5 5 4 2 0 5 3 1 0 0 0 5 5 5 4 0 1 2 3 1 0 0 0 5 5 5 4 1 1 0 2 0 1 0 1 5 5 5 5 1 0 2 3 0 0 0 0 9 ANHANG 201 9.3.2 Vorversuche – zweiter Abschnitt Salmonella Enteritidis Quantitativ Keimzahlen (KbE/g [log10]) im Caecum nach Infektion mit unterschiedlichen Infektionsdosen Tab. 14: Stamm r Alter bei Infektion 4. LT SE-864 7. LT SE-059r 4. LT 7. LT Tab. 15: Stamm SE-864r 5 14 5 14 5 14 5 14 Dosis [KbE/Tier] 3 1 x 10 1 x 106 1 x 109 6,40 1,43 3,76 1,28 6,31 4,55 4,05 1,80 5,28 3,05 4,76 1,54 6,06 6,07 4,31 2,64 4,80 4,03 5,08 1,54 5,95 5,70 3,43 2,86 Keimzahlen (KbE/g [log10]) in der Leber nach Infektion mit unterschiedlichen Infektionsdosen Alter bei Infektion 4. LT 7. LT SE-059r Tage p.i. 4. LT 7. LT Tage p.i. 5 14 5 14 5 14 5 14 Dosis [KbE/Tier] 3 1 x 10 1 x 106 1 x 109 1,69 0,42 0,89 0,00 2,06 0,31 1,64 0,00 2,21 0,00 1,29 0,40 1,96 0,16 1,23 0,16 1,08 0,00 1,87 0,00 2,43 0,53 2,21 0,26 202 9 ANHANG Qualitativ Tab. 16: Stamm Vergleich der Anzahl Salmonellen-positiver Organproben nach Infektion mit unterschiedlichen Infektionsdosen Alter bei Infektion Tage p.i. 5 4. LT 14 SE-864r 5 7. LT 14 5 4. LT 14 SE-059r 5 7. LT 14 Organ Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Caecum Leber Gallenblase Lunge Dosis [KbE/Tier] 1 x 103 1 x 106 1 x 109 5 4 0 0 3 2 0 0 5 3 0 1 3 0 0 0 5 4 0 1 5 2 1 0 5 5 0 1 3 0 0 0 5 4 1 2 5 0 0 0 5 5 0 3 4 1 0 0 5 5 0 0 5 1 1 2 5 3 0 2 4 1 0 0 5 5 0 0 5 0 0 1 5 4 3 3 4 0 0 0 5 5 0 1 5 2 0 2 5 5 1 2 5 1 0 1 9 ANHANG 203 Salmonella Typhimurium Quantitativ Keimzahlen (KbE/g [log10]) im Caecum nach Infektion mit unterschiedlichen Infektionsdosen Tab. 17: Alter bei Infektion Stamm 4. LT r ST-485 7. LT 4. LT ST-360r 7. LT 1 5 14 5 14 5 14 5 14 Dosis [KbE/Tier] 3 1 x 10 1 x 106 1 x 109 -1 2,38 0,34 0,00 0,00 0,34 3,48 3,80 2,28 3,84 1,52 3,46 3,57 4,42 0,68 5,90 3,15 5,84 1,54 6,33 4,62 5,98 3,67 keine Daten Keimzahlen (KbE/g [log10]) in der Leber nach Infektion mit unterschiedlichen Infektionsdosen Tab. 18: Stamm r Alter bei Infektion 4. LT ST-485 7. LT ST-360r 4. LT 7. LT 1 Tage p.i. keine Daten Tage p.i. 5 14 5 14 5 14 5 14 Dosis [KbE/Tier] 3 1 x 10 1 x 106 1 x 109 -1 0,61 1,26 0,00 0,00 0,00 0,91 2,15 0,82 2,84 0,76 0,83 0,16 2,35 0,60 3,57 1,06 3,65 0,79 3,24 0,16 2,69 0,21 204 9 ANHANG Qualitativ Tab. 19: Stamm Vergleich der Anzahl Salmonellen-positiver Organproben nach Infektion mit unterschiedlichen Infektionsdosen Alter bei Infektion Tage p.i. Dosis [KbE/Tier] Organ 1 x 10 5 4. LT 14 ST-485r 5 7. LT 14 5 4. LT 14 ST-360r 5 7. LT 14 Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz Caecum Leber Gallenblase Lunge Milz 4 1 1 0 1 1 3 1 0 2 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 4 3 0 0 2 3 1 x 106 1 x 109 5 5 1 2 3 5 3 1 0 5 5 5 2 2 5 3 3 0 1 3 5 2 0 2 1 5 1 0 0 2 5 5 1 3 5 2 3 0 1 1 5 5 4 5 5 5 3 2 1 5 5 5 3 5 5 3 2 0 0 3 5 5 4 4 5 5 1 0 3 1 5 5 4 5 5 5 1 0 0 3 9 ANHANG 9.3.3 205 Hauptversuche Salmonella Enteritidis Quantitativ Tab. 20: Keimzahlen (KbE/g [log10]) im Caecum nach Infektion von unterschiedlich alten Enten mit SE-864r Versuch 2 (Wiederholung) Versuch 1 Tage p.i. Tab. 21: 3 5 7 14 21 3 5 7 14 21 Versuch 1 A (5.LT) B (8.LT) C (15.LT) D (22.LT) E (43.LT) 5,81 5,11 4,94 6,10 2,51 2,58 2,12 1,29 0,00 0,34 5,20 5,89 5,95 4,64 1,89 4,06 1,36 1,14 2,55 0,74 4,11 4,65 3,74 1,83 0,00 4,95 3,73 3,47 0,00 0,00 0,00 2,30 2,01 0,00 0,00 4,95 3,89 1,90 0,00 0,68 2,86 2,97 1,37 0,68 0,60 3,71 2,42 0,94 0,00 1,25 Keimzahlen (KbE/g [log10]) in der Leber nach Infektion von unterschiedlich alten Enten mit SE-864r Tage p.i. Versuch 2 (Wiederholung) Gruppe (Alter) 3 5 7 14 21 3 5 7 14 21 Gruppe (Alter) A (5.LT) B (8.LT) C (15.LT) D (22.LT) E (43.LT) 0,65 1,58 0,52 0,31 0,00 0,00 0,00 0,31 0,00 0,00 0,31 1,35 1,20 0,00 0,00 0,00 0,00 0,16 0,00 0,00 0,16 0,76 0,52 0,00 0,00 0,77 0,92 0,16 0,00 0,00 0,00 0,16 0,16 0,00 0,00 0,31 0,47 0,16 0,00 0,00 0,47 0,47 0,16 0,00 0,00 0,00 0,16 0,21 0,00 0,00 206 9 ANHANG Qualitativ Tab. 22: Anzahl Salmonellen-positiver Organproben nach Infektion von unterschiedlich alten Enten mit SE-864r Organ Versuch 1 Caecum Leber Milz Versuch 2 (Wiederholung) Caecum Leber Milz 1 nicht untersucht Tage p.i. 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 Gruppe (Alter) A (5.LT) B (8.LT) C (15.LT) 5 5 5 5 5 -1 2 4 3 2 0 1 4 1 0 1 5 5 2 0 1 0 0 0 1 0 0 0 0 0 0 0 0 0 5 5 5 5 3 2 4 5 0 0 1 3 3 0 0 5 3 3 5 2 0 0 0 1 0 0 0 0 0 1 0 0 0 5 5 5 5 0 1 3 3 0 0 3 3 2 1 0 5 5 5 0 0 0 3 4 1 0 0 0 2 2 0 0 0 0 D (22.LT) E (43.LT) 0 4 3 0 0 0 1 1 0 0 0 0 0 0 0 5 5 3 0 2 1 2 3 1 0 0 0 1 1 0 0 0 0 5 5 4 2 1 3 3 1 0 0 0 1 0 0 0 5 5 2 0 2 0 0 1 1 0 0 0 1 0 0 0 0 0 9 ANHANG 207 Salmonella Typhimurium Quantitativ Tab. 23: Keimzahlen (KbE/g [log10]) im Caecum nach Infektion von unterschiedlich alten Enten mit ST-485r Versuch 2 (Wiederholung) Versuch 1 Tage p.i. Versuch 2 (Wiederholung) Versuch 1 Tab. 24: 3 5 7 14 21 3 5 7 14 21 Gruppe (Alter) A (5.LT) 4,91 5,32 4,60 6,28 2,36 1,62 2,99 3,26 2,80 1,60 B (8.LT) 4,27 3,57 3,71 2,94 0,40 3,71 5,00 3,79 1,93 1,32 C (15.LT) 2,58 2,39 1,00 0,46 0,00 5,36 5,49 3,49 0,34 0,00 D (22.LT) 2,70 1,94 0,60 1,94 0,00 3,75 3,33 2,00 1,71 1,02 E (43.LT) 1,54 2,65 2,42 0,34 0,00 5,24 4,43 4,05 1,02 1,90 Keimzahlen (KbE/g [log10]) in der Leber nach Infektion von unterschiedlich alten Enten mit ST-485r Gruppe (Alter) Tage p.i. A (5.LT) B (8.LT) C (15.LT) D (22.LT) E (43.LT) 3 5 7 14 21 3 5 7 14 21 1,15 2,19 2,62 1,43 0,29 0,00 0,00 0,67 1,01 0,73 0,59 1,73 1,71 0,97 0,34 0,21 1,07 1,75 0,82 0,36 0,35 1,28 0,62 1,82 0,47 2,05 2,53 2,23 0,21 0,16 0,69 0,21 0,90 0,65 0,58 1,24 1,82 1,39 0,21 0,00 0,00 0,96 1,26 1,32 1,15 2,22 1,97 1,71 0,00 0,00 208 9 ANHANG Qualitativ Tab. 25: Anzahl Salmonellen-positiver Organproben nach Infektion von unterschiedlich alten Enten mit ST-485r Organ Versuch 1 Caecum Leber Milz Versuch 2 (Wiederholung) Caecum Leber Milz 1 nicht untersucht Tage p.i. 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 3 5 7 14 21 28 Gruppe (Alter) A (5.LT) B (8.LT) C (15.LT) 5 5 5 5 5 -1 3 4 5 4 1 1 4 5 4 1 3 5 5 4 3 2 0 0 2 5 2 1 0 0 1 1 2 1 5 5 5 5 1 2 5 3 2 1 1 3 3 2 1 5 5 5 4 0 0 1 4 5 3 1 1 1 3 4 3 2 3 5 5 2 1 0 1 3 2 4 1 1 2 1 1 2 5 5 5 1 0 1 5 5 5 1 1 0 4 3 4 0 2 0 D (22.LT) E (43.LT) 5 5 1 3 0 2 1 2 2 2 0 0 1 0 0 5 5 3 5 3 2 5 5 4 1 0 0 5 1 1 3 2 0 4 5 5 1 0 0 2 3 5 2 0 2 1 0 0 5 5 5 3 3 2 5 5 5 0 0 0 5 4 2 0 0 0 DANKSAGUNG Herrn Priv. Doz. Dr. G. Glünder danke ich herzlich für die Betreuung meiner Arbeit, die wertvollen Anregungen und seine ständige Gesprächsbereitschaft. Herrn Prof. Dr. U. Neumann gilt mein Dank für die Bereitstellung des Arbeitsplatzes. Mein besonderer Dank gilt LOHMANN ANIMAL HEALTH GmbH & Co. KG, Cuxhaven, für die Überlassung des interessanten Themas und die finanzielle Unterstützung dieser Arbeit. Ganz besonders bedanke ich mich hierbei bei Frau Dr. I. Schröder, Herrn Dr. Dr. D. Rebeski sowie bei Frau K. Holzgrabe für die ergänzende Betreuung meiner Arbeit. Frau Katrin Schröck, sowie Frau Dr. A. Bolte, danke ich für die praktische Betreuung der Elterntiere vor Ort und die zuverlässige Bereitstellung der Küken. Gleichfalls gilt mein Dank Herrn Dr. H. Flore, der mich für diese Arbeit begeistern konnte. Ebenso möchte ich mich bei den Mitarbeiterinnen und Mitarbeitern der Klinik für Geflügel, ganz besonders jedoch bei Frau Sonja Bernhardt, für ihre Hilfsbereitschaft und Unterstützung bedanken. Bei Frau Dr. M. Auerbach bedanke ich mich für die jederzeit gewährte Hilfe in Computerfragen. Ein herzliches Dankeschön Frau Dr. Ilka Pohlmeyer für das Korrekturlesen und für unsere netten Gespräche. Arndt Rohwedder sage ich Danke für die Unterstützung bei der statistischen Auswertung der Ergebnisse, Dr. Wolfhard Keiser für das Korrekturlesen sowie Sibylle Simon für die Korrektur der Summary. Bei all meinen Freundinnen und Freunden und bei meiner Familie, an erster Stelle bei Nina Blechschmid, aber auch bei Deborah Castelletti, Carsten Mosenheuer, Marita Meurer, Andrea Grandke, Kerstin Weber mit Else, Kirstin Beyer, Stefan und Frauke Oellrich mit Jakob, Oma Rotenburg und vor allem bei Bernd Möller möchte ich mich dafür bedanken, dass sie Verständnis dafür aufgebracht haben, dass ich in den letzten zweieinhalb Jahren ein seltener Gast und eine seltene Gastgeberin war. Ihr seid toll! Nicht zuletzt möchte ich mich ganz besonders bei meinen lieben Eltern Ilse und Gerhard Oellrich vor allem dafür bedanken, dass sie mir mein Studium so großzügig finanziert und mich auch während der Promotion unterstützt haben. Für alles ganz vielen lieben Dank! Über die gesamte Zeit stand mir mein Freund Markus Keiser stets liebevoll und tatkräftig zur Seite, obwohl er teilweise zeitgleich die Last seiner eigenen Doktorarbeit trug. Vielen Dank für Deine Unterstützung und Dein Verständnis! Dir gehört mein ganz besonderer Dank! Experimentelle Untersuchungen zum Verlauf von Infektionen mit Salmonella Enteritidis und Salmonella Typhimurium bei der kommerziell genutzten Pekingente (Anas platyrhynchos) Hannover 2006 Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH 35392 Gießen · Frankfurter Str. 89 · Tel. 0641 / 24466 · Fax: 0641 / 25375 e-mail: [email protected] · Homepage: http://www.dvg.net Wiebke Oellrich ISBN 3-938026-86-3