Eigenschaften uv-bestrahlter X
Werbung

B A N D 14b
ZE ITSC H R IFT FÜ R NA T U R FO R SC H U N G
H EFT 10
Eigenschaften uv-bestrahlter X-Phagen
Von G.
K e lle n b e r g e r ,
W.
A rb er
und E.
K e lle n b e r g e r
Aus dem Laboratoire de B iophysique, U niversite de Geneve
(Z. N aturforschg. 14 b, 615— 629 [1959] ; ein g eg a n g en am 6. Juli 1959)
X-phage inactivated by UV irradiation has been studied w ith respect to the follow ing properties:
adsorption, in jection of D N A , lysogenisation, and the ab ility of several genes (h, d 14, i 1, i2 ) to
express their functions. Only adsorption and D N A -in jection are not influenced by the UV-lesions.
This fact is in som e disagreem ent with observations obtained w ith T 2. One p ossible explanation is
discussed: It is found that, as a function of the UV-dose, an increasing part of the D N A of irradiated
X is broken down in the host c ell and elim inated. A new property of irradiated X is described which
consists in establism ent of double lysogeny in cooperation with an already existin g 2-prophage.
In einer früheren A rb e it 1 wurden die Inaktivierung
des A-Phagen durch UV-Bestrahlung und verschiedene
Reaktivierungs-Möglichkeiten beschrieben. Es zeigte sich
im Laufe jener Untersuchungen, daß die UV-Bestrah­
lung an den Phagen Schäden hervorrufen kann, die nicht
unbedingt eine letale W irkung haben, sondern solche
die je nach dem physiologischen Zustand der Wirtszelle
als letal oder subletal bezeichnet werden können. Wir
haben uns deshalb vorgenommen, die Eigenschaften der
bestrahlten Phagen näher zu betrachten, und zwar nicht
nur in bezug auf die Überlebensfähigkeit, sondern eben­
falls auf eventuelle restliche Funktionen, die den nicht
mehr vermehrungsfähigen Phagen noch zugeschrieben
werden könnten. Man kennt, durch das Studium defek­
tiv-lysogener Bakterien2-5, gerade für diesen Phagen
eine ganze Reihe von M utanten, in denen ein oder eine
ganze Gruppe von Genen ihre Teil-Funktion zur Phagen­
bildung nicht auszuüben vermögen und aus diesem
Grunde keine infektiösen, vermehrungsfähigen Partikel
hervorbringen, jedoch Teilsynthesen auszuführen in der
Lage sind. Diese Mutanten, unfähig zur lytischen Selbst­
vermehrung, können als Prophagen in den defektiv­
lysogenen Bakterienstämmen erhalten und vermehrt
werden. Es zeigte sich in diesen Fällen, daß der Defekt
erblich ist und für einen gegebenen Stamm immer ein
und dieselbe Funktion betrifft, sei es, daß der Phage
unfähig ist nach Induktion ein komplettes infektiöses
Partikel zu bilden, wohl aber leere Kopfmembranen *,
Schwänze und Phagen-DNS produziert, sei es, daß ein
früheres Entwicklungsstadium davon betroffen werde,
wie die vegetative DNS-Vermehrung. Das defektive Prophagengenom kann jedoch unter gewissen Umständen
nach Induktion sich vermehren und zu einem infektiösen
Partikel heranreifen, dann nämlich, wenn ein überinfizierender Phage in der selben Zelle die fehlende Syn­
these ausführt. Bei der Lysis werden in diesem Falle
zwei Sorten von Phagen frei, welche beide phänotypisch
vollständig zur Infektion einer neuen Zelle ausgerüstet
sind, von denen jedoch ungefähr die Hälfte das defek­
1 G.
K e l l e n b e r g e r u . J . W e i g l e , Biochim. biophysica A cta
[Amsterdam] 30, 112 [1 9 5 8 ].
2 R. K . A p p l e y a r d , G enetics 39, 440 [1 9 5 4 ].
s F . J a c o b , C. R. F u e r s t u . E. W o l l m a n , Ann. Inst. P asteur
93, 724 [19 5 7 ].
tive Genom in sich trägt, das sich ohne fremde Hilfe
nicht weiter vermehren kann. Infiziert ein solcher defek­
tiver Phage allein eine neue Wirtszelle, so wird er ent­
weder die ihm noch verbleibenden Funktionen ausüben,
wodurch im allgemeinen die infizierte Zelle getötet und
lysiert wird 5, oder er wird die Zelle lysogenisieren und
sich als defektiver Prophage weiter vermehren.
Die M annigfaltigkeit der genetischen Defekte, die für
X bereits bekannt sind, läßt vermuten, daß die verschie­
densten für den Phagen an sich letalen Mutationen
dessen Erhaltung und Fortpflanzung als Prophage nicht
beeinträchtigen. Wir zeigen in der vorliegenden Arbeit,
daß im Gegensatz dazu die durch UV-Bestrahlung er­
zeugten letalen Schädigungen größtenteils anderer N atur
sein müssen, denn uv-inaktivierte Phagen verhalten sich,
wie zu erwarten war, nicht wie eine heterogene Popula­
tion verschieden-defektiver Phagen. Wir haben zunächst
untersucht, ob sie eine letale Wirkung auf die infizierten
Bakterien haben, ob sie defektiv-lysogene Bakterien her­
vorbringen können und ob sie zur Ausübung einzelner
Funktionen noch imstande sind. Diese letztere Eigen­
schaft wurde getestet in bezug auf ihre Fähigkeit für
einen bestimmten, defektiven Prophagen die fehlende
Synthese ausführen zu können. Eine mögliche E rklä­
rung für das Ausbleiben jedwelcher restlicher Synthe­
sen wird auf Grund von Experimenten mit 3 2 P-markierten Phagen diskutiert. Sie zeigen, daß die DNS uvbestrahlter A-Phagen teilweise von der Wirtszelle aus­
geschieden, also wahrscheinlich abgebaut wird. Schließ­
lich haben wir eine neue, spezifische Eigenschaft der
schwach bestrahlten Phagen näher untersucht, welche
A r b e r 5 erstmals für den bestrahlten Transduktor-Pha­
gen X dg nachgewiesen h a t: Infiziert man nämlich be­
reits für X lysogene Bakterien mit bestrahlten 2-Phagen,
so können einzelne Gene des bestrahlten Phagen in das
lysogene System eingebaut werden. Auf diese Weise er­
hält man mit einer sehr hohen Frequenz sogenannte
doppeltlysogene Bakterien. Ein nicht bestrahlter Phage
hingegen fixiert sich nur sehr selten an zweiter Stelle.
G. K e l l e n b e r g e r , Virology 5 , 458 [1 9 5 8 ],
Arch, des S e i . 11, 259 [1 9 5 8 ].
* D ie leeren Kopfm em branen scheinen von D N S-gefüllten,
bei der Lysis geplatzten unreifen P hagen herzustammen,
s. K e l l e n b e r g e r , S e c h a r d u. R y t e r , V irology 8, 478 [1 9 5 9 ].
4 W . A rber u .
5 W.
A rber,
Dieses Werk wurde im Jahr 2013 vom Verlag Zeitschrift für Naturforschung
in Zusammenarbeit mit der Max-Planck-Gesellschaft zur Förderung der
Wissenschaften e.V. digitalisiert und unter folgender Lizenz veröffentlicht:
Creative Commons Namensnennung-Keine Bearbeitung 3.0 Deutschland
Lizenz.
This work has been digitalized and published in 2013 by Verlag Zeitschrift
für Naturforschung in cooperation with the Max Planck Society for the
Advancement of Science under a Creative Commons Attribution-NoDerivs
3.0 Germany License.
Zum 01.01.2015 ist eine Anpassung der Lizenzbedingungen (Entfall der
Creative Commons Lizenzbedingung „Keine Bearbeitung“) beabsichtigt,
um eine Nachnutzung auch im Rahmen zukünftiger wissenschaftlicher
Nutzungsformen zu ermöglichen.
On 01.01.2015 it is planned to change the License Conditions (the removal
of the Creative Commons License condition “no derivative works”). This is
to allow reuse in the area of future scientific usage.
616
G. KELLENBERGER. W. ARBER UND E. KELLENBERGER
M aterial und M ethoden
Die B akterienstäm m e K 12S, C600, CR 63, G a^ Gal2-,
W 3110, sensitiv oder lysogen für den Phagen X, die in
dieser Arbeit verwendet wurden, haben wir bereits in
früheren Arbeiten beschrieben, desgleichen den Phagen
X++ 6 und seine aktiven oder defektiven Mutanten X c,
X vir, X dg, X i l, X i2, X d l4 *>4’ 5.
Für die Titration der Phagen und Bakterien wurden
die üblichen Methoden 7 angewendet. Das Auszählen im
Elektronenmikroskop erfolgte nach der Methode von
K e l l e n b e r g e r und A r b e r 8.
D ie P rü fu n g der Bakterien auf aktive oder defektive
L ysogenie durch die A bdruckm ethode nach L ederb erg
ist in der A rbeit von A rb er 5 beschrieben. Es sei hier
led iglich das ihr zugrunde liegende Prinzip w iederholt:
D ie zu prüfend en B akterien werden, 100 bis 300 an der
Zahl, auf N äh ragarplatten ausgestrichen und zu K olo­
nien heranwachsen gelassen. Von diesen P latten wird ein
Abdruck auf einen Sam tstem pel gem acht und dieser
zunächst auf P latten m it sensitiven Indikatorbakterien
und hernach auf m it X c beschickte P latten übertragen.
A ktiv lysogen e Bakterien bilden, nach kurzer, die In du k­
tion bew irkende, U V -B estrahlung, auf den sensitiven
B akterien eine gut sichtbare Inhibitionszone. Da sie im ­
m un gegen X c sind wachsen sie auch auf den X c en th al­
tenden P latten rasch zu einem kom pakten B akterien­
haufen heran. D efek tiv-lysogene K olonien bilden keine
Inhibitionszone, sind jedoch ebenfalls im m un gegen X c
und wachsen dem zufolge auf den X c-Platten. Schließlich
bringen sensitive Bakterien weder einen Lysenhof her­
vor, noch w achsen sie auf X c. Der V ergleich der zw ei
A bdruckplatten gestattet dem zufolge die K olonien nach
den gesuchten E igenschaften zu unterscheiden.
Als Kulturmedium haben wir ausschließlich DifcoTrypton 1 % + NaCl 0,5% verwendet. Alle Kulturen in
flüssigem Medium wurden belüftet und bei 37° be­
brütet.
Zur Adsorption von X wurden die K ulturen im Ad­
sorptionsmedium von K a i s e r 6 aufgenommen (0,01 Mol
M gS 0 4 in dest. Wasser) und während einer Stde. unter
Belüftung bei 37° ausgehungert. 2 h adsorbiert sehr
schlecht in diesem Medium. Alle Experimente mit
Ah wurden daher in Trypton ausgeführt, in welchem
X h im Gegensatz zu X h+ sehr gut adsorbiert. Dies ge­
stattet insbesondere die Experimente mit Überinfek­
tion ohne Karenzieren der induzierten Bakterien aus­
zuführen.
Die UV-Bestrahlung der Phagen erfolgte im Adsorp­
tionsmedium und wurde mit einer Westinghouse-Lampe
Typ W.L. 782-30 mit einem Abstand von 53 cm aus­
geführt.
Zur Vermeidung der Photo-Reaktivierung wurden
sämtliche UV-Experimente bei hellroter Laboratoriums­
beleuchtung vorgenommen.
6 A. D. K a i s e r , Virology 1, 424 [19 5 5 ].
7 M. H. A d a m s , in: Methods in medical research, Vol. II,
1 —73, The Year Book Publ., Chicago 1950.
8 E. K e l l e n b e r g e r u . W. A r b e r , Virology 3, 245 [1 9 5 7 ].
9 J. W e i g l e , Proc. nat. Acad. Sei. USA 39, 628 [1 9 5 3 ].
Ergebnisse
1
. W i r k u n g u v - b e s t r a h l t e r X- P h a g e n
auf sensitive Bakterien
Setzt m an einen P hagenstode ein er gegebenen
D osis U V -B estrahlung aus, so k an n m an zunächst
durch gew öhnliche P h ag en titratio n au f sensitiven
B akterien zwei K lassen von P h ag en unterscheiden:
a) die überlebenden, d. h. jene P hagen, die die F ä­
h ig k eit d er V erm ehrung und d am it der Plaque-B il­
dung au f In d ik ato rb a k terie n beibehalten haben und
b) jen e P hagen, die sich nicht m ehr verm ehren kön­
nen. D ie A nteile b eid er K lassen fü r v ariable B estrah­
lungsdosen können durch eine Ü berlebenskurve d a r­
gestellt w erden, wie sie von verschiedenen A utoren
(s. 1 . c . 1) fü r X gem essen w urde. D iese K urve ist
nicht vom T ypus ein er Ein-Treffer-K urve, auch ist
ih r V erlauf vom physiologischen Z ustand der In d i­
k ato rb a k terie n ab hängig.
D ie L a te n zze it der eine U V -B estrahlung ü b er­
leb e n d en P h a g en , gem essen in einer S erie von „Onestep “ -E xperim enten ist je nach der UV-Dosis 2 - bis
3-m al län g er als die no rm aler, u n b estrah lter P hagen.
D ie ü berlebenden P h ag en sind som it von der Be­
strah lu n g nicht u n b e rü h rt geblieben.
D ie A u sb eu te nach In fek tio n m it die U V -Bestrah­
lung ü berlebenden P h ag en ist norm al. E ine Reihe
von K o ntrollexperim enten h at gezeigt, daß es sich
bei den oft in „O ne-step“ - und sogar in EinzelwurfE x perim enten gefundenen hohen A usbeuten nach
U V -B estrahlung um das E rgebnis eines zweiten V er­
m ehrungszyklus einzelner der freigegebenen P h a­
gen h an d elt. Tatsächlich erfolgt die Lyse der die
U V -B estrahlung überlebenden P h ag en zwangsläufig
in G egenw art einer bedeutenden A nzahl sensitiver
B akterien, w enn m an die R eaktivierung durch M ehr­
fachinfektion verm eiden will, so daß die Readsorptio n n ie völlig ausgeschlossen w erden kann. Es sei
nebenbei erw ähnt, daß die Einzelw urf-Experim ente
gestatteten festzustellen, daß der Ü berlebensanteil
d er P h ag en in flüssigem M edium derselbe ist wie auf
den P latten , d. h. die zu A nfang der B ebrütung durch
P lattieren ausgezählten Infektionszentren entspra­
chen genau d er A nzahl d er in flüssigem M edium er­
haltenen Einzelw ürfe.
D ie u v-in a k tivie rte n P h a g en können unter gewis­
sen B edingungen (M ehrfachinfektion, A dsorption
auf uv-bestrahlten B akterien) reak tiv iert werden
D iese R eak tiv ieru n g erlau b te schon W e i g l e 9 anzu­
nehm en, d aß die uv-inaktivierten P h ag en noch fähig
EIGENSCHAFTEN UV-BESTRAHLTER PHAGEN
sind zu adsorbieren und ihre DNS zu injizieren.
D urch A uszählen im E lektronenm ikroskop haben w ir
nachgeprüft ob alle oder n u r ein Teil der abgetöteten
P hag en noch zur A d so rp tio n fähig sind.
E x p .l. Adsorption. — Ein Stock / vir wurde wäh­
rend 6 Min. mit UV bestrahlt. Der Bruchteil der über­
lebenden Phagen betrug 10-5 . Die bestrahlten Phagen
wurden während 20 Min. auf im Adsorptionsmedium
karenzierte K 12 S bei 37° mit einer M ultiplizität von
m = 40 adsorbiert. Dann wurde diese Mischung direkt
für das Elektronenmikroskop präpariert und, für einen
anderen Teil, die Bakterien abzentrifugiert und nur der
Uberstand präpariert. Die erste Probe zeigte mit Phagen
besetzte Bakterien und nur ausnahmsweise freie P ha­
gen. Wegen der technischen Schwierigkeiten (nur die
randständigen Phagenköpfe können gut gesehen wer­
den) war es hingegen nicht möglich festzustellen, ob
alle adsorbierten Phagen injiziert hatten. Nach Abzentri­
fugieren der Bakterien fanden wir weniger als 5% der
ursprünglich zugegebenen Phagen im Überstand.
Beide h ier angeführten K ontrollen zeigten, daß
die A dsorption der bestrah lten P h agen noch ebenso­
g ut w ar wie fü r u n b estrahlte P hagen, d. h. besser
als 95 Prozent.
Um die F rage der D N S -In je k tio n nach UVB estrahlung von X zu beantw orten, hab en w ir einen
Stock von X c m it 32P m ark iert (spezifische A ktivität
= 0,5 m C /m g), bestrah lt und nach A dsorption auf
sensitiven Bakterien im M ixer behandelt, um den
nicht injizierten P h o sp h o r von den B akterien a b ­
zustreifen 10. Im E xperim ent 2 w urden zunächst die
optim alen Injektionsbedingungen fü r norm ale 2-Phagen erm ittelt und hernach u n ter diesen B edingungen
die In jek tion uv-bestrahlter X getestet. Es zeigte sich
zunächst, daß die In jek tio n durch norm ale P hagen
nicht oder schlecht vor sich geht in allen fü r eine gute
A dsorption erforderlichen B edingungen (K arenzieren der B akterien im A dsorptionsm edium , Karenzieren in P hosphatpuffer, alte K ulturen in T rypton,
K ulturen in T rypton m it KCN 0,01 M o l.). H ingegen
in jizieren die adsorbierten P hagen nach V erdünnen
in frischer N ährlösung bereits in n erh alb einiger
M inuten. D er eigentliche A kt der In jek tio n scheint
dabei höchstens 1 bis 2 M in. in A nspruch zu neh ­
men, denn der A nteil der P roduktionszentren, d. h.
d erjenigen B akterien, in welchen die In jek tio n voll­
ständig und beendet ist, steigt fast gleichzeitig an
m it der P rop o rtio n des injizierten P h o sp h o rs im
G anzen. U nter den fü r norm ale P h ag en optim alen
In jektionsbedingungen jedoch scheinen uv-bestrahlte
P hagen, in A bhängigkeit von der UV -D osis, w eni­
10 A. D.
H ersh ey u .
M.
C h ase,
J. gen. Physiol. 36, 39 [1952].
617
ger u n d w eniger 32P zu injizieren. V or u n d nach
jedem E x p erim en t m it dem M ixer w urde die optische
D ichte d er B akteriensuspension gem essen; in keinem
Fall kon n ten w ir eine A ufhellung der K u ltu r fest­
stellen, welche Z erstörung der infizierten Zellen a n ­
gezeigt hätte. H ingegen w eisen eine R eihe w eiterer
E xperim ente, von denen n u r eines u n ter 2 c a n ­
gefü h rt sei, d a ra u f hin, daß es sich bei dem m it be­
strah lten P h ag en erhaltenen geringeren 3 2 P-G ehalt
der B akterien w eniger um eine m angelhafte In je k ­
tion, als um eine rasch nachfolgende W ieder-Ausscheidung des in jizierten P h o sp h o rs handelt. D ie
diesbezüglichen R esultate sind jedoch unregelm äßig
un d ab h ä n g ig vom physiologischen Z ustand der B ak­
terien (A lter d er K u ltu r u n d K arenzzeit), auch
scheint d ie Z ugabe von KCN den A usscheidungspro­
zeß eh er zu fö rd ern . D er Z eitpunkt dieses A bbaus
kan n nicht genau festgelegt w erden, denn w ir w issen
nicht, w elcher A nteil an 32P erst beim Z entrifugieren
un d W aschen (Z im m ertem peratur) ausgeschieden
w urde, eine P ro zed u r die ziemlich viel Zeit in A n ­
spruch n im m t und nicht im m er genau k o n tro lliert
w urde. Um g enauere A ufschlüsse ü b er diesen V o r­
gan g zu erhalten, m üßte m it einem hoch gereinigten
P hagenstock g earbeitet w erden, so daß der au s­
geschiedene P h o sp h o r im Ü berstan d gem essen w er­
den könnte. Säm tliche E xperim ente zeigen jedoch,
daß bei k ü rzerer B ebrütung (nach V erdünnen in
T ry p to n ) oder rascherem W aschen m ehr P h o sp h o r
m it den Zellen verbunden b leib t; u n ter U m ständen
hab en w ir bis zu 90% erhalten auch m it stark b e­
strah lten P h ag en (9 M in u ten ). Dem zufolge w urde
der P h o sp h o r anfänglich in jiziert und erst n achträg­
lich w ieder ausgeschieden, was w ir bei nicht b estra h l­
ten P h ag en nie feststellen konnten, sofern deren E n t­
w icklung durch Z ugabe von KCN gestoppt w urde.
Es k an n gesagt w erden, daß die fü r den A us­
schluß d er b estrah lten DNS verantw ortlichen UVD osen relativ hoch sind u n d daß also bei schwäche­
re r B estrah lu n g ein b edeutender A nteil der uvb estrah lten P hagen-D N S in den B akterien verbleibt.
T rotzdem ist besonders beim S tudium h ö h erer D o­
sen diese A usscheidung zu berücksichtigen u n d d arf
nie au ß e r acht gelassen w erden. W ir w erden in d er
D iskussion eingehend auf dieses P hänom en zurück­
kom m en.
Exp. 2. DNS-Injektion. — a) unbestrahlte Phagen:
7 -IO9 3 2 P-markierte Xc wurden adsorbiert auf 10 1 0
K 12 S und hernach während 2 Min. im Mixer behan­
delt. Vor und nach dem Mixen wurden die optische
618
G. KELLENBERGER, W. ARBER UND E. KELLENBERGER
Dichte und die Infektionszentren gemessen. (Inaktivie­
rung der freien Phagen mit anti-/.-Serum.) Die W eiter­
entwicklung der Phagen wurde gleich vor dem Mixen
gestoppt durch Zugabe von 0,01 Mol KCN, die Bakte­
rien nach dem Mixen zentrifugiert, in Phosphatpuffer
zweimal gewaschen und hernach ihr Gehalt an injizier­
tem 32P gemessen. — b) uv-bestrahlte Phagen: Bei den
für normale Phagen ermittelten maximalen Injektions­
bedingungen, nämlich nach 8 Min. Adsorption in M gS 0 4
und weiteren 8 Min. Bebrütung in Trypton, wurde in
Funktion der UV-Dosis der injizierte 32P gemessen wie
unter a. Man sieht, daß der Phosphorgehalt der Bak­
terien durch die Bestrahlung beeinträchtigt wird, jedoch
nie auf den mit K 1 2 S/X ermittelten W ert der bloßen
Verunreinigung durch 32P absinkt, c) 360 Sek. uvbestrahlte Phagen, Ausschluß von 32P in Abhängigkeit
von der Z eit: Die Suspension wurde mit dem Mixer
behandelt (ohne KCN) schon nach 3 Min. Bebrütung in
Trypton, hernach erneut bebrütet und zu verschiedenen
Zeiten eine Probe abzentrifugiert und gewaschen.
Bedingungen
a) unbestrahlte Phagen: Injektionsbedingungen
1. X + K12S ausgewachsene K ultur in Trypton,
bei 37° adsorbiert während 20 Minuten
2. X + K12S karenziert in Phosphat puffer,
bei 37° adsorbiert während 20 Minuten
3. X + K12S im Adsorptionsmedium karenziert :
Adsorption 8 Minuten
hernach verdünnt in Trypton und bebrütet
[Min.]
0
(dann KCN und gemixt)
2,5 (dann KCN und gemixt)
4,5 (dann KCN und gemixt)
6,5 (dann KCN und gemixt)
9 (dann KCN und gemixt)
11 (dann KCN und gemixt)
bebrütet in Gegenwart von KCN, 10 Minuten
4. Ä + K12S/Aim Adsorptionsmedium 8 Min.,
hernach verdünnt und bebrütet in Trypton 10 Min.
b) bestrahlte Phagen, in Abhängigkeit der UV-Dosis, bei
optimalen Injektionsbedingungen für normale X
wie unter a 3. Nach Verdünnen in Trypton 8 Min.
bebrütet
unbestrahlt
[Sek.]
UV 90
UV 180
UV 270
UV 360
UV 450
c) 360 Sek. uv-bestrahlte X, nach Verdünnen in Trypton
3 Min. bebrütet, gemixt ohne KCN zentrifugiert und
gewaschen
unmittelbar nach dem Mixen
nach weiteren 10 Min. Bebrütung
nach weiteren 20 Min. Bebrütung
Vor dem Mixen
Infektionszentren
Nach dem Mixen
32p
Infektions­
zentren
,0 0 *
0,50
0,45
32p
1
1
,0 0 *
0,95
0,81
0,25
0,25
0,80
0,90
0,28
0,30
1,06
0,95
0,14
0,81
0,08
0,60
0,77
0,98
0,87
0 ,8 8
1 ,0 0
1 ,0 2
1 ,0 0
0,90
0,70
0 ,0 0 1
1,06
1,13
0,43
1 ,0 0
0,40
0 ,0 0 1
1 ,0 0
1 ,0 0
1,08
0,79
0,56
0,37
0,29
0,29
0,79
0,60
0,48
* Referenzwert 1,00 = Mittel von 4 Messungen.
In w eiteren E xperim enten versuchten w ir abzuklä­
ren. ob uv-inaktivierte A-Phagen einen L etaleffekt
au f sensitive B akterien zeigen:
Exp. 3. Letaleffekt.
— 108 sensitive Bakterien
G al^ G a^ - wurden mit konstant bleibenden Multiplizitäten von m = 0,7, m = 1, m = 2,3 und m = 3 an bestrahl­
ten A++ infiziert. In Abhängigkeit von der UV-Dosis
wurden nach entsprechender Verdünnung die Infektions-
Zentren und die überlebenden Bakterien ausgezählt. Ihre
Summe entsprach nahezu den im Absorptionsröhrchen
insgesamt vorhandenen Bakterien, war aber im Durch­
schnitt um 20% geringer. Die bei der Infektion und
durch die Verdünnungen verursachten Fehler gestatten
keine genaue Messung.
U nsere E xperim ente zeigen, daß die uv-inaktivierten /-P h a g e n bei E infachinfektion von sensitiven
EIGENSCHAFTEN UV-BESTRAHLTER PHAGEN
B akterien diese nicht unbedingt töten, aber auch nicht
ganz unbeeindruckt lassen. U nter anderem w ird das
W achstum der überlebenden B akterien, gem essen an
d er optischen Dichte der K ultur, w ährend 60 M in.
bedeutend gehem m t. Es besteht jedoch ein deutlicher
U nterschied im V erhalten zwischen uv-inaktivierten
A-Phagen und T 2. F ür letztere haben D o e r m a n n und
M ita rb b . 1 1 gezeigt, daß die F ähigkeit der P hagen
zum Töten der infizierten B akterien ganz bedeutend
w eniger uv-empfindlich ist als ihre F ähigkeit sich zu
verm ehren, und daß in nerhalb dieser E m pfindlich­
keitsgrenze alle uv-inaktivierten T 2 töten.
E ine andere Serie von M essungen, ausg efü h rt m it
619
stark b estrah lten P h ag en in A bhängigkeit von der
M ultiplizität erg ab jedoch einen deutlichen L eta l­
effekt b e i V ielfachinfektion.
Exp. 4. Letaleffekt bei Vielfachinfektion mit uvbestrahlten oder m it normalen Phagen. — 3 -IO 8 sensi­
tive Bakterien K 12 S wurden mit steigenden Multiplizi­
täten von X c oder X c-UV (5 Min.) beschickt, die nicht
adsorbierten Phagen mit anti-2-Serum inaktiviert und
nach entsprechender Verdünnung die Infektionszentren
und die überlebenden Bakterien gezählt. Bei Infektion
mit bestrahlten Phagen wurde ferner die Proportion der
Bakterien bestimmt, welche noch zur Reproduktion von
unbestrahlten X vir fähig sind durch gleichzeitige Infek­
tion mit m —0,001 X vir.
X c UV 5 Minuten
Summe
K apazität
( 1 ) + (2 )
für X vir.
überlebende
Bakterien
(1 )
Infektions­
zentren
(2 )
0 ,2
1 ,0 0
0 ,0 0 0 1
1 ,0 0
1 ,0 0
2 ,0
1,13
0 ,0 0 1
1,13
1 ,1 0
0 ,8 8
0 ,0 0 2
0 ,8 8
1,08
0,85
0,80
0,64
0,59
0,61
0,42
0,36
0,25
0,005
1,08
m
2,4
3,0
3,8
4,8
5,9
7,4
9,3
1 2
15
19
0 ,0 1
0 ,8 6
0 ,0 2
0,82
0 ,0 2
0 ,6 6
0,03
0,05
0,06
0,07
0,62
0 ,6 6
0,48
0,43
0,35
0 ,1 0
T rotz der ziemlich hohen experim entell bedingten
S treu u n g sehen w ir aus diesem Versuch, daß auch
norm ale P hagen bei hohen M ultiplizitäten einen Teil
d er B akterien töten ohne sich zu verm ehren. D ieser
M ultiplizitätseffekt w ird in genau dem selben M aße
erh alten m it uv-inaktivierten P hagen. In beiden F ä l­
len kann das Ausscheiden der B akterien als P laq u e­
b ild n e r (bei norm alen P hagen) bzw. als K olonie­
b ild n e r (bei inaktivierten Phagen) nicht m it einem
bestim m ten G renzw ert an infizierenden P hagen in d i­
rekte V erbindung gebracht w erden. Es sei außerdem
erw ähnt, daß dieser Effekt nicht im m er genau re p ro ­
d u zierb ar ist und je nach dem physiologischen Z u­
stan d der B akterien variiert.
2. E i n f l u ß d e r U V - B e s t r a h l u n g a u f d a s
L y s o g e n i s i er u n g s -V e r m ö g e n der
X -P h a g en
Im folgenden untersuchen w ir, ob B akterien
welche m it uv-bestrahlten P hagen infiziert sind, sen­
sitiv bleiben oder lysogenisiert w erden. A us dem
0,99
0,85
0,81
0,84
0,81
0,73
0,64
0,63
0,51
0,48
unbestrahlter X c,
Infektionszentren
pro infiziertes
Bakterium
1 ,0 0
0,70
0,79
0,77
0,65
0,65
0,72
0,60
0,58
0,48
0,44
0,36
nachfolgenden E x p erim en t 5 ist ersichtlich, daß ein
u v-bestrahlter / ++-Stock noch ein gewisses Lysogenisierungs-V erm ögen beibehält. Dieses b eträg t bei E in ­
fachinfektion (schwache M ultiplizitäten) u ngefähr
6 %, berechnet in bezug auf aktive, überlebende P h a ­
gen. D ie L ysogenisierungs-W ahrscheinlichkeit der
überleb en d en P h ag en ist som it im D urchschnitt etwa
dreim al k leiner als die von u nbestrahlten, norm alen
X++. E inen an alogen Effekt haben G a r e n und Z i n d e r 12
fü r uv-bestrahlte tem p erierte P 22-P hagen gefunden.
A us E xp erim en t 5 b ist ersichtlich, daß bei M ehrfach­
infektion m it b estrah lten P hagen offenbar eine wei­
tere V erm in d eru n g des Lysogenisierungs-V erm ögens
stattfindet ( s .a . K olonne 5, Exp. 5 a ) , welche der
gleichzeitigen A nw esenheit von inak tiv ierten /.^ -P h a­
gen in d er Zelle zuzuschreiben w äre. W ir haben die­
sen Effekt noch n äh e r untersucht und zw ar indem
w ir nicht n u r überlebende, sondern norm ale, unb estrah lte X++ gleichzeitig m it inaktivierten X++ adsor11
12
A. H. D o e r m a n n , M. C h a s e u . W. S t a h l , J. cellular comparat. Physiol. 45, Suppl. 2, 51 [1955].
A. G a r e n u . N. D . Z i n d e r , Virology 1, 347 [1955].
620
G. KELLENBERGER, W. ARBER UND E. KELLENBERGER
Exp. 5. Lysogenisation sensitiver Bakterien durch
normale und durch uv-bestrahlte Phagen. — Im Ad­
b ierten (Exp. 6 ). F ü r norm ale aktive
ist b e­
k an n t 13,5, d aß bei M ehrfachinfektion die Lysogenisierungs-W ahrscheinlichkeit pro B akterium eher
h ö h er ist als bei Infektion m it M ultiplizitäten u n ter 1.
D agegen ersieht m an aus E xperim ent 6 , d aß ein n o r­
m aler, aktiver P hage seine L ysogenisierungs-Fähigkeit w eitgehend verliert, wenn auf dem gleichen
B akterium durch U V -B estrahlung inaktivierte X++
ad so rb ie rt w urden.
sorptionsmedium karenzierte Bakterien Gal^Galg” wer­
den mit der gewählten Multiplizität normaler oder uvbestrahlter Phagen infiziert. Nach 20 Min. Adsorption
werden die Infektionszentren durch Plattieren bei 37°
gemessen. Ferner werden angemessene Verdünnungen
auf mehreren mit anti-A-Serum versehenen Platten aus­
gestrichen, worauf nach 12 Stdn. Bebrütung die gewach­
senen Kolonien mit der Abdruckmethode auf ihre sen­
sitive oder lysogene N atur untersucht werden.
a) Schwache Multiplizitäten. — Getestet: Verschiedene Mengen, siehe total adsorbierte X
UV-Dosis Sekunden
Bruchteil überlebende X
m (total)
m (überlebende)
Ausgezählte Menge:
Total adsorbierte X
Infektionszentren
lysogene Bakterien
defektiv-lysogene Bakterien
Lysogenisation bezgl. aktive X
( = Infektions-Zentren + lysog. Bakt.)
30
0,48
0,25
0
1
0,25
0,25
0 ,1 2
2980
2250
597
5960
2670
2 0 1
0
60
0,17
0,25
0,04
60
0,17
1,25
90
1 2 0
0 ,1 1
0,08
0 ,2 0
0 ,2 0
0 ,2 1
0 ,0 2
0,016
0,33
0,003
5960
960
63
14900
2680
55
3250
550
33
3250
260
14
92000
804
58
*
0
0
0,07
0 ,2 1
0
0,062
0
0
0,057
0 ,0 2 0
0,051
150
0 ,0 1
0,067
b) Multiplizität total — 5. Getestet: Überlebende Kolonien und Infektionszentren von ungefähr 2000 infizierten
Bakterien
UV-Dosis Sekunden
Infektionszentren
Sensitive Bakterien
Lysogene Bakterien
Defektiv-lysogene Bakterien
Lysogenisation bezgl. aktive X
( = Inf.-Zentren + lysog. Bakterien)
60
1505
344
16
30
1886
92
90
0
1589
32
375
0
0
0,19
90
1 1 0 0
984
16
0
0,045
0
0,015
0 ,0 1
120
300
1314
7
0
0,02
nicht getestet.
Exp. 6. Beeinflussung des Lysogenisations- Vermögens
unbestrahlter Phagen durch uv-bestrahlte Phagen. —
Karenzierte Bakterien Gal1 -Gal2- werden mit den an­
Multiplizität an
a) normalen Phagen
b) uv-bestrahlter Phagen
UV-Dosis Sekunden
adsorbierte Menge
a) normaler Phagen
b) uv-bestrahlter Phagen
Infektions-Zentren
Lysogene Bakterien
total aktive Phagen
(Infektions-Zentren + lysogene Bakterien)
Lysogenisation
a) bezüglich normale Phagen
b) bezüglich total aktive Phagen
gegebenen M ultiplizitäten normaler und uv-bestrahlter
Phagen infiziert und dann in gleicher Weise behandelt
wie bei Exp. 5 besdirieben.
0,3
0,3
3,0
60
—
3,0
60
—
—
—
1 2 0 0
—
977
204
4060
27
1181
4087
0,17
0,17
M an kann sich fragen, ob eventuell die uv-inaktivierten P hagen, welche sich ja nicht m ehr verm ehren
und bei den gew ählten M ultiplizitäten keinen g ro ­
ßen Letaleffekt auf das infizierte B akterium haben,
in diesem eine tem poräre Im m unität h ervorzurufen
verm ögen, w odurch ein später ankom m ender P hag e
5180
59
7800
64500
12480
148
5239
12628
1 2 0 0
1 2 0 0 0
—
0,007
1 2 0 0 0
j
0,4
3,3
150
0,05
0 ,0 2
0 ,0 1
0 ,0 1
sich nicht m eh r sofort verm ehren oder das B akterium
nicht m ehr lysogenisieren könnte. Die R esultate des
E xperim entes 7 zeigen aber, daß keine tem poräre Im ­
m u n ität bew irkt w ird. E rstens verm ehren sich nor13 M.
L ie b ,
J. Bacteriol. 65, 642 [1953].
621
EIGENSCHAFTEN UV-BESTRAHLTER PHAGEN
m ale tem perierte X h-P hagen in den m it uv-inaktivierten P h ag en beschickten B akterien gleich schnell
wie v irulente, von denen m an erw arten konnte,
daß sie von einer Im m u n ität nicht b eh in d ert w ür­
den. Zw eitens verm ehren sich die überinfizierten
P h ag en ebenso schnell wie die der K ontroll-E xperim ente, in welchen die B akterien keine uv-bestrahlten
P h ag en enthielten.
Exp. 7. „One-step“-Experim ent auf Bakterien Gal{~
Gal2~, welche uv-bestrahlte Phagen enthalten. — Auf
einer karenzierten K ultur werden mit m = 4 uvbestrahlte X adsorbiert. Nach 10 Min. Adsorption wer­
den Teile der K ultur mit m = 0 ,l an: a) normalen Ah,
b) normalen X vir und c) normalen X c überinfiziert.
Nach erneuten 10 Min. Adsorption wird in Trypton ver­
dünnt und bei 37° die Phagenproduktion als Funktion
der Zeit gemessen bezüglich des normalen, nicht be­
strahlten Typus. Parallel dazu werden auf denselben
Bakterien, ohne vorherige Infektion mit bestrahlten
Phagen, die drei entsprechenden Kontrollen durch­
geführt. Sämtliche 6 „One-step“ -Kurven, auf deren Wie­
dergabe wir hier verzichten, zeigen genau denselben
V erlauf: die Phagenfreigabe setzt normal an und geht
rasch und gleichzeitig zu Ende.
W ir haben fern er untersucht, ob das verm inderte
L ysogenisierungs-V erm ögen bei überlebenden P h a ­
gen eine erbliche Eigenschaft sei. Die N achkom m en­
schaft d er überlebenden P h ag en nach einem V er­
m ehrungszyklus erw ies sich jedoch als norm al in
bezug au f ih r L ysogenisierungs-V erm ögen.
Bei keinem d er hier beschriebenen sowie zahlrei­
chen an d eren L ysogenisierungs-V ersuchen haben w ir
defektiv-lysogene K olonien gefunden, d. h. B akte­
Lysat von
m — 5 X aktiv + 5 X UV 60 Sek. (0,2 überlebend)
m = 5 X aktiv + 5 X UV 360 Sek. (10- 5 überlebend)
U n ser E xperim ent zeigt, daß w eniger als 1/iooo
der 60 Sek. bestrahlten P h a g e n sich wie defektive
P h ag en v erhalten, d. h. m it H ilfe von aktiven P h a ­
gen einen V erm ehrungszyklus ausführen und an ­
schließend lysogenisieren. N u n kennt m an zw ar ge­
rad e u n te r den defektiven P h ag en solche, die n u r
schlecht lysogenisieren (scheinbar dann, w enn sie
u nfäh ig sind zu r vegetativen D N S-V erm ehrung ohne
frem d e H ilfe ). A ber auch in diesen F ällen ist die
L ysogenisierungs-W ahrscheinlichkeit höchstens 25m al g erin g er als n o r m a l5, u n d diese P hagen verm eh­
ren sich n orm al in G egenw art eines aktiven P h a ­
rien, deren N achkom m enschaft d urch einen in a k ti­
ven P hag en im m u n isiert w orden w äre. Es scheint,
daß der uv-inaktivierte i-P h a g e , w enn ü b erh au p t,
noch seltener als der überleb en d e ein sensitives B ak­
terium lysogenisiert u n d d aß er sich also nicht wie
ein defektiver P h ag e verhält. M an k an n sich jedoch
fragen, ob nicht eine som atische S chädigung ganz
einfach die L ysogenisierung durch den uv-bestrahl­
ten P h ag en unm öglich gem acht h atte, da ja bereits
fü r die überlebenden P h ag en die L ysogenisierungsW ahrscheinlichkeit g erin g er ist als fü r norm ale. A us
diesem G runde haben w ir versucht, w ie obenstehend
fü r die überlebenden P h ag en , auch den inaktiven
P h ag en einen V erm ehrungszyklus zu erm öglichen,
der ihnen gestatten sollte, ein gew isses L ysogenisie­
rungs-V erm ögen zurückzugew innen. D a eventuelle
defektive P hag en definitionsgem äß sich allein nicht
verm ehren können, w ohl a b e r m it H ilfe aktiver P h a ­
g e n 3-5, haben w ir diesen V erm ehrungszyklus in
B akterien au sgeführt, die gleichzeitig m it aktiven,
u n b estrah lten X++ infiziert w urden.
Exp. 8. Vermehrungszyklus uv-bestrahlter Phagen X++
mit H ilfe von aktiven Phagen: w erden dabei defektive
Phagen gebildet? — UV-bestrahlte X++ (60 Sek. und
360 Sek. UV) werden gleichzeitig mit aktiven Phagen
auf sensitiven Bakterien G al 1 _Gal2_ adsorbiert mit einer
M ultiplizität von je 5 und während 60 Min. bebrütet.
Das Lysat wurde untersucht auf seinen Gehalt an defek­
tiven, lysogenisierungs-fähigen Partikeln durch Infektion
neuer Bakterien mit geringer M ultiplizität an aktiven
Phagen und Test der diese Infektion überlebenden Bak­
terien.
Ausgezählte Menge an überlebenden Bakterien
nach Infektion mit m aktiven Phagen des Lysates
aktivI defektiv- 1 sensitiv
m
lysogen
lysogen
0,5
0,3
966
172
0
0
1 0 0 0 0
2700
gen. Folglich enthielt der w ährend 6 0 Sek. b estrah lte
Phagenstock auch u n ter den schlechtesten B edingun­
gen, näm lich dann, w enn säm tliche zu den schlecht
lysogenisierenden gezählt w erden m üssen, w eniger
als einen defektiven au f vierzig in ak tiv e P hagen.
3. F u n k t i o n e i n z e l n e r G e n e
uv -i n a k t i v i er t e r P h a g e n
Es ist bereits b ekannt, daß genetische M arker uvin ak tiv ierter P h ag en durch In terak tio n m it einem in ­
takten P hagengenom o d er einem in d u zierten P ro ­
phagen gerettet, d. h. in aktiven T ochterphagen w ie­
622
G. KELLENBERGER, W. ARBER UND E. KELLENBERGER
d ergefunden w erden können. D ieses Phänom en, ge­
n an n t C ross-R eaktivation oder „M arker-R escue“ ,
w urde f ü r den P hagen X von J a c o b und W o l l m a n 14
beschrieben. A udi kan n es zwischen zwei inaktivier­
ten P h ag en zu einer R eaktivierung kom m en (M R
= R eaktivierung durch M ehrfachinfektion), welche
allerdings bei X im V ergleich zu der m it T 2 gefun­
denen M R sehr viel seltener i s t 1. Es ist som it sicher,
daß zum indest ein T eil der uv-inaktivierten P hagen
zu genetischer R ek om bination noch fäh ig ist. Es stellt
sich nun die F rage, ob die scheinbar intakten Teile,
die bei einer gegenseitigen R eaktivierung einen
aktiven P h agen h erv o rb rin g en können, ih re F unktion
auch ausüben, ohne d aß ein aktiver P hag e gebildet
w erden m uß. Tatsächlich können z. B. zwei defektive
P ro p h ag en , von denen je d er einen än d ern geneti­
schen D efekt aufw eist, sich gegenseitig ergänzen und
infektiöse defektive P h ag en h ervorbringen, ohne
daß durch R ekom bination entstandene aktive P hagen
bei ih re r R eifung m itzuhelfen brauchten. Liegen die
beiden D efekte auf d er genetischen K arte nahe ge­
nug, so daß n u r selten eine R ekom bination auftritt,
die sie beide elim iniert, so findet m an, daß ein g ro ­
ß er P rozentsatz so ld ier doppelt defektiv-lysogener
Zellen nach Induktion zwei Sorten von defektiven
P hagen produziert, ohne gleichzeitig auch einen ak ti­
ven R ekom binanten freizugeben 5. Beide P rophag en
jedoch können allein niem als einen defektiven P h a ­
gen h ervorbringen, so ndern füh ren lediglich T eil­
synthesen aus.
K önnen auch uv-inaktivierte P h ag en m ithelfen bei
der S ynthese infektiöser, genetisch defektiver P h a ­
gen in Z usam m enarbeit m it einem induzierten, defek­
tiven P ro p h a g en ? D as heißt, funktionieren einzelne,
unverletzte Gene u n ab h ä n g ig von anderw eitigen UVS d iäd en ? W ir haben fü r diese U ntersuchungen drei
unabhängige, defektiv-lysogene Stäm m e gew ählt,
G a lj'G a ^ (A d l 4 ) , G a l^ G a ^ ( Ai l ) und G al^ G al,(A i2 ), welche alle ih re DNS verm ehren können.
D iese w urden in d u ziert und m it uv-bestrahlten / h
überinfiziert. Alle — und ausschließlich jen e — Bak­
terien, in welche durch den bestrahlten P hagen ein
aktives Gen d l 4 +, i l + resp. i 2 + ein g efü h rt w orden
war. h ätten defektive P h ag en produzieren m üssen,
u n ab h än g ig davon ob dieses unverletzte Gen durch
R ekom bination in einen (nun aktiven!) P hagen ein­
gebaut w urde oder an den uv-inaktivierten P hagen
gebunden blieb. Da der „M arker-R escue“ bei X sehr
E. W o l l m a n , Cold Spring Harbor Sympos. quantitat. Biol. 18. 101 [1953].
14 J . J a c o b u .
gering ist, können w ir voraussetzen, daß die CrossR eaktivations-K urve eines einzelnen M arkers nicht
gleichzeitig seiner Ü b erlebenskurve entspricht. M it
anderen W orten, w enn die In ak tiv ieru n g des P h ag en
durch einzelne v o neinander u n ab h än g ig e lokalisierte
Schäden erfolgte, so m üssen zahlreiche B akterien
nach Infektion m it b estrahlten P h ag en unverletzte
Gene defektiv" enthalten, ohne aktive P hag en zu p ro ­
duzieren.
D as E xperim ent 9 zeigt, d aß kein nennensw erter
A nteil der uv-inaktivierten P h ag en im stande w ar,
die fehlende F u n k tio n bei den defektiven P ro p h ag en
d l4 , i l und i 2 zu ersetzen. D ie leichte V erschiebung
der P ro d u k tio n sv erh ältn isse zugunsten der defekti­
ven P hagen läß t sich dadurch erk lären , d aß die p ro ­
duktiven B akterien bei zunehm ender D osis relativ
kleine W ürfe an aktiven P h ag en freigaben, so daß
die P ro d u k te von d l 4 +, i l + resp. i 2 + m ehr und m ehr
von defektiven G enom en g eb rau ch t w urden (s. a.
Exp. 10, phänotypische M isch u n g ). Aus dem p ra k ­
tisch konstant bleibenden V erh ältn is der defektiven
zu den aktiven P hagen in den L ysaten k an n m an
schließen, daß defektive P artik e l n u r in jenen B ak­
terien p ro d u ziert w urden, in denen eine CrossR eaktivation stattgefunden h atte o der ein ü b erleb en ­
der P h ag e v o rhanden w ar. D asselbe R esultat, n äm ­
lich kein e K ooperation, w urde ebenfalls zwischen den
defektiven T ran sd u k to ren -P h ag en X dg und uv-inaktivierten X gefunden. In diesem F alle m uß m an je ­
doch bedenken, daß die fehlenden C haraktere auf
dem T ran sd u k to ren -P h ag en X dg u n g efäh r ein V ier­
tel der bis jetzt bekannten genetischen K arte von X
ausm achen 5 und daß also die W ahrscheinlichkeit fü r
den bestrahlten P hagen, auf diesem Stück des Ge­
nom s keine V erletzung zu trag e n , bedeutend g e rin ­
ger wäre als fü r die alleinigen M ark er d l 4 +, i l + und
i 2 +. D iese letzteren D efekte hingegen sind P u n k t­
m u tatio n en ; tatsächlich können diese defektiven P h a ­
gen in ih re aktive F orm zurückm utieren.
In einem w eiteren Versuch h ab e n w ir uns gefragt,
ob uv-bestrahlte X h noch fäh ig seien, nach M isch­
infektion m it aktiven X h+, die fü r sie spezifische A d­
sorptions-S ubstanz h zu p ro d u zieren .
W enn auch ohne M arker-rescue dieses Gen h trotz
der In ak tiv ieru n g des P h ag en w eiterfunktionieren
könnte, so m üßten m it zuneh m en d er D osis m ehr und
m ehr P h änotypen h gefunden w erden im V erh ältn is
zu den G enotypen h. Aus E xp. 10 ist ersichtlich, daß
dies nicht der Fall ist. H ingegen zeigt die T abelle,
daß m ehr und m ehr der p ro d u zierten h-Substanz von
623
EIGENSCHAFTEN UV-BESTRAHLTER PHAGEN
Exp. 9. Zusamm enarbeit uv-bestrahlter Phagen mit
induzierten defektiven Prophagen. — Defektiv-lysogene
d 14
0
il
0 ,2 0
0,03
0,005
0
1 ,0 0
90
180
300
i2
40
35
27
23
1 ,0 0
90
180
300
0,30
0,07
0,007
0
1 ,0 0
90
180
300
Mittlere Aus­
beute an akti­
ven Phagen
Infektions­
zentren pro
überinfiziertes
Bakterium
UV-Dosis des
überinfizieren­
den Äh
Induzierter.
defektiver
Prophage
K ulturen Gal1 ”Gal2- (A d l 4 ) , G al 1 ”Gal2_(A il)
und
Gal1 ~Gal2_(2 i2) in exponentiellem Wachstum werden
zentrifugiert, in Puffer aufgenommen, mit einer opti­
malen UV-Dosis induziert und in Trypton resuspendiert.
Dann werden mit einer M ultiplizität von ungefähr 0,5
A h-Phagen darauf adsorbiert, welche zuvor mit variablen
UV-Dosen bestrahlt wurden. 45 Min. nach der Induk­
tion werden die aktiven Infektionszentren gemessen. In
0,17
0,03
0 ,0 0 2
Lysogenisation sensitiver Bakterien m it dem L ysat
»'aktiv
0,5
0,4
0,25
0 ,1
30
35
13
3
0,4
0,4
0,05
0,005
|
0
90
1 2 0
180
240
300
3,2 • 107
2,3 • 107
1 ,8 • 1 0 7
1 ,2 • 1 0 7
4,3 • 106
1,1 • 106
306
232
119
411
117
136
115
537
0,39
0,59
170
237
337
42
40
83
123
14
0,23
0,35
0,36
0,33
2 0 0 0
64
70
9
18
29
13
6000
2
6
0,28
0,41
(1,5)
(3,0)
1 2 0 0 0
400
1 0 0 0
900
2400
0 ,6
Exp. 10. Phänotypische Mischung zwischen normalen
Produktionszentren
mit Genotyp h
Verhältnis
defektivzu aktivlysogen
1500
1300
0,5
0,5
35
31
16
16
ausgezählte Kolonien
I
, .
I , „, .
...
aktivdelektivsensitiv
,lvsogen
,
Ivsogen
1 2 0 0
0 ,1 0
A h+ und uv-inaktivierten Ah. — Eine aktiv-lysogene
K ultur 3110 (A h+) in exponentiellem Wachstum wurde
induziert, in 6 Portionen geteilt und jeder Teil mit der­
selben M ultiplizität von 0,5 an mit verschiedenen UVDosen bestrahlten A h überinfiziert. Nach 45 Min. Be­
brütung wurden die Infektionszentren gemessen, welche
aktive genotypische A h produzieren (Marker-rescue)
durch Plattieren auf gemischten Indikatorbakterien
CR 63 und C 600 1 : 1 . (Auf dieser Mischung markiert
-^
UV Sek.
den nach 2 Stdn. Bebrütung erhaltenen Lysaten werden
mit Chloroform eventuelle überlebende Bakterien ab­
getötet, das Chloroform entfernt und die Lysate mit der
Lysogenisations-Methode auf ihren Gehalt an aktiven
und defektiven (A dl4, A il, A i2) Phagen geprüft. Alle
drei defektiven Phagen lysogenisieren annähernd nor­
mal und sind zur DNS-Vermehrung fähig. Spontane
Mutationsrate d l4 —>■d l4 += 1 0 - 9 ; il —> i l += 5 • 1 0 —6;
i2
i2+= 3 • 10~8.
1 0 0 0
1 0 0 0
72
56
38
13
Genotyp h
Phänotyp
mittlere
h + h+
Ausbeute
3,4
1,7 • 109
1 ,2 • 1 0 9
6 ,2 • 1 0 8
2,5 • 108
5,3 • 107
1 ,6 • 1 0 7
53
52
35
2 1
1 2
14
h +-Genotypen verw endet w ird, w oraus m an bei flüch­
tig er Betrachtung schließen könnte, daß diese S ub­
stanz auch in B akterien sy nth etisiert w urde, welche
keine aktiven G enotypen h freigaben. Jedoch läßt
1,30
nur der Genotyp h, unabhängig vom ursprünglichen
Phänotyp.) Nach 2 Stdn. Bebrütung wurden die 6 Lysate
geprüft auf ihren Gehalt an aktiven A h (Genotyp) durch
Adsorption auf C 600 und Plattieren auf CR 63. Der
Phänotyp h wurde bestimmt durch Adsorption auf
CR 63, Inaktivierung der nicht adsorbierten Phagen
durch anti-A-Serum und Plattieren auf gemischtem In ­
dikator CR 63 und C 600 1 : 10. (Auf dieser Mischung
m arkiert der Genotyp h als klare, der Genotyp h+ als
trübe Plaque.)
Lysate
Phänotyp h
Genotyp h
Genotyp h+
total
3,0 • 108
•108
1 ,1 • 1 0 8
4,4 • 107
2 ,0 • 1 0 7
9,6 • 106
1,3 • 109
6.4 • 108
3,8 • 108
1 ,0 • 1 0 8
[%]
1 0 0
1 ,0 0
•109
• 108
• 108
• 107
• 107
3 ,0 • 106
1 ,0
4,2
2,7
5,9
1,7
2 ,2
3,7 • 107
1,3 • 107
Verhältnis
Phänotyp h
zu
Genotyp h
0.76
0,53
0,61
0,41
0,70
0,80
sich diese Tatsache dadurch erklären, daß die m itt­
lere A usbeute an A h der h-produzierenden B akterien
abnim m t, so daß die W ahrscheinlichkeit des Zusamm enfindens von G enotypen h und P h än o ty p en h ver­
624
G. KELLENBERGER, W. ARBER UND E. KELLENBERGER
rin g ert w ird. Tatsächlich bleibt auch bei der stä rk ­
sten D osis im m er noch ein D rittel der P hänotypen h
an G enotypen h g ebunden; zudem sinkt die P ro d u k ­
tion des P h än o ty p en h p ro p o rtio n al zu der des Geno­
typen ab und übersteig t nie deren Zahl. W ir können
d arau s ableiten, daß P h agen m it dem P hänotyp h n u r
in solchen B akterien p ro d u ziert w urden, welche auch
aktive G enotypen h freigaben, sei es als Folge von
Cross- oder M ultiplizitäts-R eaktivierung, sei es nach
Infektion m it einem überlebenden P h ag en X h.
Z usam m enfassend stellen w ir fest, daß keine der
in diesem K apitel untersuchten F unktionen au s­
geführt w urde von nicht m ehr verm ehrungsfähigen,
uv-inaktivierten P hagen, es sei denn, daß die en t­
sprechenden Gene durch M arker-rescue in aktive
P hagen eingebaut w urden.
4. V e r m e h r u n g d e r D N S
uv- i n a k t i v i e r t e r P h a g e n
E in T eil der bekannten defektiven P hagen ist dazu
befähigt, sich vegetativ zu verm ehren. D ie Z unahm e
der genetischen E inheiten kann verfolgt w erden m it
genetischen E x p e rim e n te n 3,15: die induzierten, de­
fektiv-lysogenen B akterien w erden in zunehm enden
Z eitabständen nach Beginn der E ntw icklung ü b er­
infiziert m it einem aktiven M utanten, der m ehr und
m ehr zum m in o ritären E lternteil w ird, was sich in
der R ekom binations-F requenz ausdrückt. D ie so e r­
haltenen A ufschlüsse w urden von J a c o b und M it­
arbb. 3 in sehr eleganter W eise durch das S tudium
der W urfgrößen je n e r (seltenen) B akterien bestä­
tigt, in welchen der defektive P ro p h a g e in seine
aktive F orm zurückm utierte: Bei V erm ehrung der
Genome, von denen jedes dieselbe W ahrscheinlich­
keit zu m utieren hat, sind die m eisten W ürfe klein,
da eine M utation pro B akterium w eit häufiger am
E nde der V erm ehrung eintritt, w enn viele Genome
in der Zelle vorh an d en sind. In solchen Stäm m en
jedoch, die u n fäh ig sind zur D N S-V erm ehrung,
bleibt die W ahrscheinlichkeit, pro B akterium aktive
M utanten zu bilden, w ährend der ganzen Latenzzeit
dieselbe, so daß m an ebensoviele große, m ittlere als
auch kleine W ürfe erhält.
W eder die eine noch die and ere M ethode, sin n ­
gem äß fü r die uv-inaktivierten P hag en angew andt,
ergab befriedigende R esultate. V ersuche m it Ü b er­
infektion u n d solche, die sich der U V -R eaktivierung 1
an Stelle der M utation bedienten, w eisen d ara u f hin,
15
J. F.
W h it f ie l d u .
453 [1 9 5 7 ].
R. K.
A ppley ard ,
J. gen. Microbiol. 17,
daß eine V erm ehrung der D N S u v -inaktivierter P h a ­
gen nicht stattfindet. Doch ist die In terp reta tio n die­
ser R esultate ausnahm slos an H ypothesen und u n ­
k o n tro llierb are V oraussetzungen g ebunden, so daß
sich deren ausführliche B eschreibung nicht lohnt, da
sie keine ganz sicheren Schlüsse zulassen.
5. E i n b a u v o n M a r k e r n u v - b e s t r a h l t e r
P h a g e n in l y s o g e n e B a k t e r i e n
F ü r die G al-T ransduktoren-P hagen X dg w urde
gezeigt, daß ih r T ransduktions-V erm ögen durch eine
nicht zu starke U V -B estrahlung b edeutend gesteigert
w erden k a n n 3. W äh ren d jedoch die T ran sd u k tio n
sensitiver B akterien n o rm alerw eise im m er von einer
L ysogenisation begleitet ist, blieben diese nach I n ­
fektion m it b estrahlen X dg sensitiv. D ie transduzierten G al-C haraktere w urden definitiv in das B akterien­
genom eingebaut und blieben nicht, w ie n o rm aler­
weise, an die G egenw art eines (defektiven) P ro ­
phagen X dg gebunden. U m so ü b errasch en d er w ar
nach diesen R esultaten die Feststellung, d aß in lyso­
genen B akterien die tran sd u z ie rte n G al-C haraktere
fast ohne A usnahm e m it dem defektiven P ro p h ag en
zusam m en sich in der Zelle fixierten, m it diesem segregierten und sich auch m it diesem , nach In duktion,
in der üblichen hohen F requenz v erm ehrten. E ine
A rt von R estau ratio n des b estrah lten P h ag en X dg
m ußte in den lysogenen B akterien vorgekom m en
sein und eine L ysogenisation durch den bestrahlten
P hagen h atte stattgefunden. D abei blieb der u r ­
sprünglich vorhan d en e P ro p h a g e u n v erseh rt, d. h.
alle auf diese W eise tran sd u zierten B akterien bleiben
aktiv-lysogen. W ir untersuchen im folgenden ob n o r­
male, nicht tran sd u zieren d e P h ag en ebenfalls zu
einer solchen F ix ieru n g an zw eiter Stelle fäh ig sind.
U V -bestrahlte
/ h w urd en in E infachinfektion
0,5) auf aktiv-lysogene B akterien
W 3 1 1 0 ( / h +) ad so rb iert (E xp. 11, K u rv e 1 ). Mit
der A bdruckm ethode w urden die K olonien, welche
die N achkom m enschaft der infizierten B akterien d a r­
stellen, in bezug auf den C h arak ter h, untersucht.
M an ersieht aus dem E x p erim en t, d aß sich u n ­
bestrahlte P h ag en n u r selten in den lysogenen B ak­
terien fixieren. D ie F requenz solcher L ysogenisation
k ann von einem E xperim ent zum an d eren stark v a ri­
ieren (IO - 2 bis 1 0 ~ 4) . N ach U V -D osen von 1 bis
2 Min. jedoch bauen u n g efäh r 30% aller infizierten
B akterien den genetischen C h a ra k te r h, welcher vom
bestrahlten P hag en /. h stam m t, ein u n d verm ehren
ihn in einem P rophag en g en o m bei ih re r Fortpflan(m = un g efäh r
625
EIGENSCHAFTEN UV-BESTRAHLTER PHAGEN
zung m it. F ü r w eiter ansteigende UV -D osen beginnt
der Bruchteil der fü r A h lysogenen B akterien a b ­
zufallen. D ie K urven 2 bis 4 stellen analoge E x p eri­
m ente dar, die m it defektiv-lysogenen B akterien g e ­
m acht w urden. D abei dienten die D efekte d l 4 und i l
als gewöhnliche P hagenm arken. U Y -bestrahlte X h
w urden au f diesen B akterien a d so rb ie rt und m it der
A bdruckm ethode alle jene K olonien gesucht, die
aktiv-lysogen gew orden w aren, also den M ark er (de­
fek tiv )+ erw orben hatten. A uf C 6 0 0 -Indikatorplatten zeigten sich alle aktiv-lysogenen K olonien an, auf
CR 6 3 -In d ik ato rp latten n u r jene, welche zugleich
einen aktiven P ro p h ag en und den C h arak ter h tru ­
gen. M it diesem In d ik ato r m ißt m an also die W a h r­
scheinlichkeit, daß sow ohl d er C h arak ter h als auch
der C h arak ter d l 4 + resp. i l + eingebaut w urde. M an
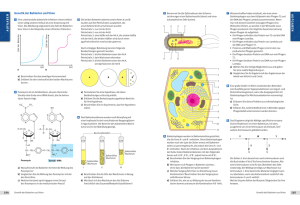
sieht aus der A bb., daß diese W ahrscheinlichkeit wie
zu erw arten kleiner ist als die, einen C h a ra k te r allein
zu finden (K urven 2 b und 3 b ) . M it den heterogenoten defektiv-lysogenen B akterien
Als Abszisse: UV-Dosis in Min. für den überinfizieren­
den Phagen Ah. Als Ordinate: Bruchteil der als Prophagencharakter wiedergefundenen genetischen M arker
des bestrahlten Phagen bezüglich total überinfizierende
P hag en :
Kurve 1 : Abdruck auf CR 63, M arker h (D ).
Kurve 2: a) erster Abdruck auf C 600, M arker d l4 +
(O).
b) zweiter Abdruck auf CR 63, M arker d l4 +
und h ( • ) .
Kurve 3: a) erster Abdruck auf C 600, M arker i l +
(A),
b) zweiter Abdruck auf CR 63, M arker i l +
und h ( A ) .
Kurve 4: Abdruck auf C 600, M arker dg+ (x).
Kurve 5: überlebende Ah gemessen auf W 3110 sensi­
tiv (unter denselben Bedingungen kultiviert
und resuspendiert im Absorptionsmedium)
( + )•
UV-Dosis in Minuten
\
G a l^ G a ^ /ex G aF —/ dg
endlich h at m an die M öglichkeit, die E rh a ltu n g einer
relativ ausgedehnten R egion d er genetischen K arte
von A nachzuprüfen. A lle in d er R egion dg liegenden
C haraktere des uv-bestrahlten P h ag en m üssen n äm ­
lich unversehrt geblieben und eingebaut sein, dam it
diese B akterien nach In d u k tio n aktive P h ag en p ro ­
duzieren können. Tatsächlich ist diese W ahrschein­
lichkeit k leiner als fü r die E rh a ltu n g eines einzelnen
C harakters (K urve 4 ) . D er h ie r beschriebene E inbau
genetischer M arker des bestrah lten P h ag en zeigt sich
auch in lysogenen B akterien, deren P ro p h a g e zu X
eng v erw andt ist, jedoch nicht die Im m u n ität gegen
X v ersch afft16. W ir haben dies in E xperim ent 1 2
qu alitativ untersucht.
Exp. 11. Einbau von M arkern uv-bestrahlter Phagen
in lysogene Bakterien. — Ein Stock von aktiven X h-Pha-
gen wird mit verschiedenen Dosen UV bestrahlt und Pro­
ben davon mit der M ultiplizität m auf folgende im Ad­
sorptionsmedium ausgehungerte Bakterien adsorbiert
(Kulturen von 2 • 10 9 Zellen/ml) :
1. Normal-lysogene W 3110(A h+), m = 0,46,
2. defektiv-lysogene Gal 1 -Gal2- (A d l 4 ) , m = 0,53,
3. defektiv-lysogene G al^G a^^A i l ) , to = 0,40,
4. defektiv-lysogene Heterogenoten
G a l^ G a ^ /e x Gal+—X dg, m = 0,43.
Nach 30 Min. Adsorption bei 37° werden Verdünnun­
gen auf mit anti-A-Serum versehene Platten ausgebreitet
und die Kolonien nach Bebrütung mit der Abdruck­
methode auf vom bestrahlten Phagen herkommende
Marker geprüft.
16 F.
J a co b u .
E.
W ollm an .
Ann. Inst. Pasteur 91, 486 [1956].
[\
■
\
i 1u.2a
-
\ \
\
\
\
\
\
\
,
3a
k »
Abb. 1. Marker-Einbau uv-bestrahlter P hagen in lysogene
Bakterien (s. Exp. 1 1 ).
Exp. 12. Markereinbau durch bestrahlte X c in für
den Phagen 82 lysogene W 3110(82). — Xc, 60 Sek.
uv-bestrahlt ( 1 2 % Überlebende) wurde mit m = 0 , 2 auf
aktiv-lysogene W 3110(82) adsorbiert. Mit dem Ab­
druckverfahren wurden die überlebenden Kolonien auf
ihren lysogenen Charakter untersucht, und zwar dienten
als Indikatorstämme C 600, gegen Adsorption resistente
C 600/A und C 600/82 und immune, d. h. lysogene Bak­
terien C 600(A) und C 600(82). Der Vergleich der P lat­
ten zeigte zahlreiche doppelt-lysogene Kolonien. Man
fand dabei vor allem Stämme mit der Immunität 82, die
den genetischen Charakter zur Produktion von A-Schwänzen zeigten. Seltener fanden wir, daß der zweite P ro­
phage wie der erste 82-Schwänze machte, jedoch die Im ­
munität für A verschaffte. Jene Prophagen zeigten auch
den c-Charakter und waren aus diesem Grunde sehr
unstabil. Den Verlust der Immunität 82 konnten wir in
keinem Fall beobachten.
626
G. KELLENBERGER, W. ARBER UND E. KELLENBERGER
Unsere Experimente zeigen, daß bestrahlte Pha­
gen fähig sind in hoher Frequenz genetische Marker
in bereits für / lysogene Bakterien einzubauen, wel­
che gleich einem Prophagencharakter sich fortan in
den Bakterien weitervermehren. D iese Charaktere
können von überlebenden Phagen herkommen. doch
zeigt der Vergleich der Kurven 1 bis 4 und der I berlebenskurve 5 in Exp. 11. daß auch inaktive Phagen
genetische Marker beitragen. Betrachtet man gleich­
zeitig zwei verschiedene Charaktere so sieht man,
daß häufig nur einer davon, also ein Teilstück des
bestrahlten Phagen eingebaut wird. Im folgenden
Abschnitt werden wir die zunächst nur für die vom
bestrahlten Phagen herkommenden Charaktere ge­
wählten Kolonien weiter untersuchen.
6. A n a l y s e d e r l y s o g e n e n K o l o n i e n ,
d i e n a c h I n f e k t i o n mi t b e s t r a h l t e n
Phagen einen neuen P r o p h a g e n ­
charakter zeigen
Handelt es sich beim Einbau einzelner Charaktere
uv-bestrahlter Phagen in lysogene Bakterien um Sub­
stitution einzelner Teile des bereits vorhandenen
Prophagen oder um eine partielle oder sogar totale
Zygosie?
Vor dem endgültigen Test der mit der Abdruck­
methode für einen bestimmten Charakter gewählten
K olonien wurden diese wie folgt gereinigt, um sie
ganz von den auf derselben Platte gezüchteten 100
bis 300 anderen Kolonien zu trennen:
R einigungsprozeß: Auf der Originalplatte wird die
Kolonie mit der Platinöse ausgehoben, in Trypton sus­
pendiert und diese Suspension erneut auf einer Agar­
platte ausgestrichen und bebrütet. Derselbe Prozeß wird
mit einer neu gewachsenen, gut isolierten Kolonie wie­
derholt, von welcher wir uns durch einen Abdruck ver­
sichert haben, daß sie den gewählten Charakter trägt.
Auf der zweiten Reinigungsplatte wiederum wird eine
isolierte Kolonie für den endgültigen Test ausgehoben.
Es zeigte sich bei diesem Reinigungsprozeß, daß
in der ursprünglichen Kolonie die Hälfte bis drei
Viertel der Bakterien den neuen Charakter nicht ent­
hielten. Dies ist weiter nicht erstaunlich, wenn man
bedenkt, daß die mit den bestrahlten Phagen infizier­
ten Bakterien mehr als einen Zellkern enthalten kön­
nen oder doch eine Verdoppelung ihres genetischen
Materials ausführen mußten um den neuen Charak­
ter einzugliedern. Wir haben dieser primären Segre­
gation weiter keine Beachtung geschenkt und. wie be­
reits erwähnt, durch einen Abdruck kontrolliert, ob
die für die zweite Reinigung gewählte Kolonie den
Charakter des bestrahlten Phagen noch enthielt.
Die zweite Reinigung zeigte, daß sich der neue
Charakter tatsächlich im Laufe der ersten Bakterien­
generation stabilisiert haben muß, denn er wurde in
nahezu allen Subkolonien wiedergefunden. Jedoch
bleibt eine gew isse sekundäre Segregation auch spä­
ter noch und ständig erhalten. Im folgenden Experi­
ment wurde die Frequenz dieser Segregation für
einen der Stämme bestimmt und zu 3,7 * 1 0 -3 pro
Zellteilung gefunden. Qualitative Segregations-Ex­
perimente zeigten an, daß die Mehrzahl der Stämme
mit einer ähnlichen Frequenz segregieren.
Exp. 13. Segregation und M essung der SegregationsFrequenz des durch einen bestrahlten Phagen eingeführ­
ten Charakters d l4 +. — /T+ wurde während 60 bzw.
90 Sek. bestrahlt und dann auf (defektiv) -lysogenen
Bakterien Gal1 -Gal2- (A d l4 ) adsorbiert. Für die Dosis
60 Sek. wurden mit der Abdruckmethode 9 Stämme aus­
gewählt, die fähig waren aktive Phagen zu produzieren,
also den Marker d l4 + erworben hatten und für die Dosis
90 Sek. weitere 14 Stämme. Nach der zweiten Reinigung
segregierten alle 23 jetzt aktiv-lysogenen Stämme mit
schwacher Frequenz defektiv-lysogene Kolonien, waren
also doppelt lysogen. Die K ultur eines der 23 Stämme,
welche 13% defektiv-lysogene Segreganten enthielt,
wurde bis zu einer Konzentration von 5 Bakterien pro
ml in Trypton verdünnt. Von dieser Verdünnung wur­
den 50 Pipetten zu 0,1 ml abgefüllt und horizontal wäh­
rend 260 Min. bei 37° bebrütet. Dann wurde deren
Inhalt sowie 0,1 ml zu deren Ausspülung verwendetes
Trypton auf Platten ausgebreitet. Nach 15 Stdn. Inkuba­
tion wurden die Kolonien mit der Abdruckmethode ge­
testet. Es wurden keine sensitiven Segreganten gefunden.
Anzahl Pipetten: 50. Ohne Bakterien: 26. Mit nur
Segreganten: 22. Mit nur Elterntyp: 9. Mit Elterntyp
und Segreganten: 13. p 0 = Proportion der Platten, die
keine Segreganten enthalten: 0,41. N = mittlerer „Clonesize“ an Bakterien: 243. Nach der von M o rse und Mitarbb. 1 7 verwendeten Formel berechnet sich die W ahr­
scheinlichkeit der Segregation pro Zellteilung
Der ursprüngliche Charakter d l4 des Prophagen
ist in diesen Experimenten in allen 23 Stämmen er­
halten geblieben; diese sind also doppelt lysogen.
Andere Experimente, z. B. mit den Markern h und h+
zeigten ebenfalls, daß Stämme, die durch Infektion
lysogener Bakterien mit uv-bestrahlten / erhalten
und für einen vom bestrahlten Phagen herkommen­
den Charakter ausgewählt wurden, meistens doppelt
lysogen sind. Wenn man von doppelt oder mehrfach
lysogenen Bakterien spricht, so dient als Kriterium
nur die Tatsache, daß die Bakterien für einen oder
627
EIGENSCHAFTEN UV-BESTRAHLTER PHAGEN
einige wenige betrachtete Marker doppelte oder
mehrfache genetische Information tragen. Im Sinne
dieser Definition finden wir somit bei unseren Stäm­
men nicht eine Substitution, sondern doppelte Lysogenie. Es ist jedoch schwierig, die Möglichkeit einer
direkten Substitution ganz auszuschließen, denn tat­
sächlich findet man auch Stämme, die nach der üb­
lichen Reinigung den ursprünglichen Prophagencharakter verloren haben. Es ist möglich, daß es sich
in diesen Fällen um eine Substitution handelt oder
aber um eine frühe Segregation.
D ie Frage ob auch der ursprünglich vorhandene,
nicht bestrahlte Prophagencharakter in unseren dop­
pelt-lysogenen Bakterien segregiert, soll in einer spä­
teren Arbeit beantwortet werden sow ie auch der V er­
gleich mit Stämmen, die ohne vorherige Bestrahlung
der Phagen durch Simultaninfektion mit zwei ver­
schiedenen Phagen erhalten wurden. Weitere Unter­
suchungen sind im Gange. Sie sollen gestatten ab­
zuklären, ob es sich in unseren Bakterien um zwei in
sich vollständige, voneinander unabhängige, intakte
Prophagengenome handelt oder um an den ursprüng­
lichen Prophagen angehängte Teilstücke.
Diskussion
D ie vorliegende Untersuchung der Eigenschaften
uv-bestrahlter ^.-Phagen wurde in der Absicht aus­
geführt, einesteils verschiedene Funktionen des Pha­
gen unterscheiden und eventuell trennen zu können
und andernteils die Natur der Strahlenschädigung
näher zu erfassen. Es zeigte sich jedoch, daß durch
eine relativ geringe Bestrahlung schon nahezu alle
hier untersuchten Funktionen der Phagen stark be­
einträchtigt oder verunmöglicht wurden. So ihre
letale Wirkung auf die Wirtszelle, das Lysogenisierungs-Potential, die Funktion der Gene d l4 +, i l +, i2 +
und dg+, die Produktion des spezifischen Proteins h
und wahrscheinlich auch die vegetative Vermehrung
der Phagen-Genome: Alle diese Eigenschaften ver­
loren sich mit der Vermehrungsfähigkeit gleichzeitig
oder doch in einem nicht meßbaren Abstand. Es
scheint als ob der Tod der Phagen durch eine Schädi­
gung erfolgt, die alle diese Funktionen beherrscht.
Wir haben gesehen, daß zumindest eine starke
UV-Bestrahlung einen merklichen Ausschluß der be­
strahlten Phagen-DNS durch die Wirtszelle bewirkt.
Wir können mit Sicherheit sagen, daß dieser A us­
schluß größtenteils nach (und nicht anläßlich) der In­
jektion stattfindet, daß also die Bakterien sehr wahr­
scheinlich die stark bestrahlte Phagen-DNS zu degra­
dieren vermögen. Ob dieser Abbau eine direkte Folge
der Strahlenschädigung ist, indem z. B. gew isse Ver­
letzungen auf dem DNS-Strang diesen für eine even­
tuell in der Zelle anwesende Nuclease anfälliger
machten, kann nicht entschieden werden. Wir möch­
ten lediglich darauf hinweisen, daß ein ähnlicher
Abbau ebenfalls erreicht werden kann, wenn nicht
der Phage, sondern die W irtszelle stark bestrahlt
wird (G. K e l l e n b e r g e r , unpublizierte Resultate), daß
also in diesem Falle auch ohne UV-Schädigung die
Phagen-DNS ausgestoßen werden kann. Dem zufolge
würde es sich eher um eine indirekte F olge der Be­
strahlung handeln, wie z. B. Induktion von Nucleasen
durch Anwesenheit inaktiver D N S. In Anbetracht der
Ähnlichkeit der DNS der temperierten Phagen und
derjenigen der Wirtszelle wären solche Interaktionen
nicht weiter erstaunlich. Das Studium der UV-Schäden
auf temperierten Phagen scheint uns deshalb lohnend,
weil damit nicht die direkte Schädigung, sondern die
Schädigung im Zusammenhang mit den Reaktionen
einer, wenn auch primitiven Zelle untersucht werden
kann. D ie von zahlreichen Autoren (G. S . S t e n t 18) her­
vorgehobene engere Verwandtschaft des temperierten
Phagen mit der Wirtszelle braucht sich dabei nicht
zwangsläufig durch genetischen Austausch zu m anife­
stieren, sondern kann ebensogut im rein chemischen
Verhalten zum Ausdruck kommen. Es wäre z. B.
möglich, daß zur Heilung gewisser UV-Schäden die
Wirtszelle den temperierten Phagen weitgehende Mit­
tel zur Verfügung stellt, daß aber umgekehrt eine
Bresche, die anderswo in den DNS-Faden geschlagen
wurde, dessen völligen Abbau zur Folge hat, wäh­
rend eine zell-fremde DNS, wie die von T 2 und T 4
weder geheilt, noch gänzlich zerstört werden könnte.
Es ist demzufolge schwierig, unsere Resultate mit
denen zu vergleichen, welche mit uv-bestrahlten T 2
und T 4 erhalten wurden. Zwar wurde ebenfalls
keine Synthese von Phagenantigen durch uv-inaktivierte T 2 festgestellt19. Andere, namentlich „frühe“
Funktionen jedoch blieben soweit erhalten, daß man
annehmen muß, ein unverletztes Gen könne unabhän­
gig von allen übrigen funktionieren, sofern der Aus­
druck dieser Funktion gemessen werden kann, d. h.
nicht durch anderweitige Schäden verhindert wird.
17
M . L . M o r se,
E.
M . L e d e rb e rg
u.
J.
L e d e rb e rg ,
G enetics
41, 142 [1 9 5 6 ].
18 G.
S . S tent , in: Advances in Virus Research 5, A cadem ic
Press Inc., New York 1958.
19 I. W a t a n a b e , J. gen. P hysiol. 40, 521 [1 9 5 7 ].
628
G. KELLENBERGER, W. ARBER UND E. KELLENBERGER
Auch sind für die virulenten Phagen die UV-Schäden durchaus lokaler Natur.
Eine für T 2 und T 4 weit uv-resistentere Eigen­
schaft als ihre Vermehrungsfähigkeit ist ihre Fähig­
keit, das infizierte Bakterium zu töten. D o e r m a n n
und Mitarbb. 11 haben gemessen, daß diese Eigen­
schaft etwa 50-mal weniger uv-empfindlich ist als
die Vermehrungsfähigkeit. Man kann jedoch anfüh­
ren. daß es sich hier nicht um die Funktion eines
Gens handelt, sondern um eine fertig injizierte Sub­
stanz. Doch weisen neuere Experimente darauf hin,
daß es sich eher um eine phagenspezifische Synthese
handeln muß, nämlich dann, wenn man annimmt,
daß das Abtöten des infizierten Bakteriums eine
F olge der Zerstörung des Bakterienkerns ist. D iese
Zerstörung kann morphologisch verfolgt werden. Sie
findet ebenfalls nach Adsorption uv-inaktivierter
Phagen statt, ist jedoch inhibiert in allen Fällen
durch Zusatz von Chloramphenicol, d. i. bei Inhibi­
tion der Proteinsynthese. Somit würde es sich,
gleichwohl ob der von D o e r m a n n und Mitarbb. ge­
m essene Letaleffekt damit identisch ist, zumindest
was die Zerstörung der Nukleoide betrifft, um eine
Proteinsynthese handeln, die der uv-inaktivierte
Phage noch einleiten kann.
Eine weitere Eigenschaft, die für uv-inaktivierte
T 4 r+-Phagen von K r i e g 20 untersucht worden ist, ist
die Funktion r+, welche vom bestrahlten Phagen noch
ausgeführt wird auch ohne Marker-rescue des r Gens. Ferner bleibt die von H a r m 21 untersuchte
Funktion u von T 4 selbst nach enormen UV-Dosen
noch wirksam.
W ie bereits erwähnt, ließe sich der Unterschied
im Verhalten bestrahlter /-Phagen und demjenigen
von T 2 und T 4 dadurch erklären, daß sich die DNS
des temperierten Phagen vielmehr wie BakterienD N S verhält und somit dem bereits komplizierten
DNS-Mechanismus der Wirtszelle zugänglich ist.
M cF all, P ardee und S t e n t 22 haben beim Studium
von durch 32P-Zerfall getöteten Bakterien gefunden,
daß ein einziger tödlicher Treffer genügt, Enzym-,
Protein- und RNA-Synthesen zu stoppen und daraus
abgeleitet, daß die Überlebensfähigkeit Bedingung
dieser Synthesen sei. D iese Forderung scheint auch
für X gültig zu sein. Was aber genau das Bakterium
20 D. R.
K r i e g , Ph. D. thesis U niversity of Rochester, R o­
chester N. Y. 1957.
21 W . H a r m , Naturw issenschaften 16. 3 9 1 [ 1 9 5 8 ] .
22 E. M c F a l l , A. B. P a r d e e u . G. S . S t e n t , Biochim. biophysica A cta [Am sterdam ] 27, 282 [1 9 5 8 ].
23 R. H . E p s t e i n , V irology 6, 382 [1 9 5 8 ].
selbst als tödlichen T reffer fü r / bezeichnet, bleibt
nach wie v o r u nklar, doch scheint ein so ld ier eine A rt
K ettenreaktion h ervorzurufen, die das ganze Genom
elim iniert.
In keinem einzigen von zahlreichen E xperim enten
konnten w ir feststellen, d aß das b estrah lte Genom
eine letale M u tatio n w eiterv ererb t h ätte in der A rt,
wie defektive P ro p h a g en ih ren D efekt vererben. D er
T od der P h ag en erfolgt also in der w eitaus größten
Zahl der F älle durch eine Schädigung, die nicht m it
einer M u tatio n oder F eh lin fo rm atio n zu vergleichen
ist. Zu dem selben Schluß sin d auch D oerm ann und
M itarb b . 1 1 u n d E p ste in 2 3 fü r die bestrahlten P hag en
T 4 gekom m en: die U V -Schädigung w ird nicht v er­
m ehrt, nicht ko p iert. D urch U V -B estrahlung h erv o r­
gerufene letale M utationen scheinen fast ebenso sel­
ten zu sein w ie lebensfähige M u tan ten ; sie w ären
eher dem M edianism us d er R ep aratio n durch die
W irtszelle zuzuschreiben als einem direkten UVSchaden. U m gekehrt w ird allgem ein angenom m en,
daß die U V -B estrahlung au f die DNS, also au f das
genetische M aterial w irkt. F ü r den P h ag en T 2
konnte diese W irk u n g in beachtensw erter W eise be­
stätigt w erden durch die E xperim ente von Tomis a w a 24. Jedoch k onnte auch in diesem F alle nicht die
reine D N S b estra h lt w erden, sondern eine zum indest
m it P o ly a m in e n 2 5 ’ 2 6 u n d eventuell auch m it b asi­
schen P ro te in e n 2' ab g esättig te N ucleinsäure.
D ie einzige bis jetzt g ut e rfaß b a re R eaktion, deren
der uv-inaktivierte /.-Phage noch fähig ist, ist die
genetische R ekom bination, die anderw eitig beschrie­
ben w u rd e lj 14. M arker-rescue und M ultiplizitätsR eaktivierung sind jedoch relativ selten. D er G rund
dazu k an n in der schwachen R ekom binations-T en­
denz von X im allgem einen gesucht w e rd e n 6 sowie
auch in d er Tatsache, d aß sta rk geschädigte DNS
relativ rasch von der W irtszelle w ieder ausgeschieden
w ird. M öglicherw eise v o rh an d en e spezielle E igen­
schaften d er w enigen rek o m binierenden P h ag en h ä t­
ten w ir m it unseren T estm ethoden nicht erfassen
können. W as w ir von der M ehrzahl d er uv-inaktivierten P hag en h ie r aussagen. ist deshalb nicht unbedingt
auch fü r diese P h ag en gültig.
Es erg ib t sich die F rag e, ob es ebenfalls diese R e­
k o m b in atio n sfäh ig k eit ist, die es dem b estrahlten
V irology 6 , 55 [1 9 5 8 ].
Virology 4, 237 [1 9 5 7 ],
B. N . A m e s , D . T . D ubin u . S. M . R o s e n t h a l , S cien ce [W a­
shington] 1 2 7 , 814 [1 9 5 8 ].
L . L e v i n e , J. L . B a r l o w u . H . V a n V u n a k i s , Virology 6, 702
[19 5 8 ].
24 J . T o m is a w a ,
25 A. D .
26
27
H ersh ey ,
629
UNTEREINHEITEN DES NEWCASTLE DISEASE- UND MUMPS-VIRUS
P hag en gestattet, Teilstücke seines G enom s in ein
lysogenes B akterium einzubauen. W ir können d a r­
auf auf G rund unserer E xperim ente keine A ntw ort
geben. Tatsächlich erhöht eine schwache U V -B estrah­
lung die R ekom binations-F requenz zwischen zwei
A-Phagen 28. W ie bereits erw ähnt, w erden die A rb ei­
ten zur K lärung dieser F ragen durch eingehendes
S tu d iu m
gesetzt.
dieser
doppelt-lysogenen
Stäm m e
fo rt­
Diese Arbeit wurde mit Hilfe eines Beitrages des
S c h w e i z e r i s c h e n N a t i o n a 1f o n d s z u r F ö r ­
derung
der
wissenschaftlichen
For­
s c h u n g ausgeführt.
28 F.
J a cob
u. E.
W ollm an ,
Ann. Inst. Pasteur 88 , 724 [1 9 5 5 ].
Untereinheiten des N ew castle Disease- und Mumps-Virus
V on
W ern er S chäfer
un d
R u d o l f R ott
Aus dem M ax-Planck-Institut für Virusforschung, Tübingen
(Z. N aturforsd ig. 14 b , 629— 631 [1959] ; ein g eg a n g en am 10. J u li 1959)
Es werden fadenförm ige Strukturen beschrieben, die aus gereinigtem N ew castle Disease- und
Mumps-Virus durch Schütteln m it Ä ther gew onnen werden konnten. Vermutlich handelt es sich um
die g-A ntigene dieser Viren.
In den letzten Ja h re n h at sich unsere A rb eits­
g ruppe eingehender m it dem F einbau einiger m en­
schen- und tierpathogener V iru sarten befaßt. D abei
w urden die V iruspartikel zerlegt und die m orpholo­
gischen, chemischen und biologischen E igenschaften
der gew onnenen U ntereinheiten stu d iert. Bei den
geprüften V irusarten gelang die Z erlegung auf re ­
lativ einfache W eise durch Schütteln m it Ä ther, ein
V erfahren, das zuerst von H o y l e 1 em pfohlen w urde.
Bisher w urden von uns in der angegebenen Rich­
tung einige V iren der Influenza-G ruppe untersucht,
näm lich: das V irus der K lassischen Geflügelpest
(Lit. s. 1. c. 2) , das V irus N 3, das Schweine-Influenza-V irus und m ehrere Stäm m e der menschlichen
Influenza 4. M it den U ntereinheiten m enschlicher Influenza-Stämm e haben sich auch verschiedene a n ­
dere A utoren b e f a ß t5_10.
D ie U ntersuchungen w urden n u n m eh r au f die
V iren der N ew castle D isease (N D ) und des M um ps
ausgedehnt. D iese beiden V iru sarten w erden zw ar
wie die V iren d er Influenza-G ruppe zu den M yxo­
viren gezählt (vgl. I . e . 11), sie lassen sich ab er m o r­
phologisch eindeutig von den Influenza-V iren u n te r­
scheiden u n d scheinen auch serologisch nicht m it
ihn en verw andt zu sein. W ohl ab er w urde bereits
ü b e r serologische Beziehungen zwischen Mumpsun d N D -V irus berichtet (Lit. s. 1. c . 12,13) . Es w urde
vorgeschlagen 12,14, diese beiden V iru sarten in eine
beso n d ere U n terg ru p p e der M yxoviren ein zu o rd ­
nen. D a sie in h ö h er konzentrierten Salzlösungen
von sphärischen G ebilden in gestreckte übergehen,
w urden sie als „m ultiform e V iren “ b ezeich n et14.
Im folgenden soll kurz ü b er U ntereinheiten be­
richtet w erden, die bei der Z erlegung dieser V iren
m it H ilfe von Ä ther gew onnen w urden.
1 L. H oyle , J. o f H y g . 48, 277 [ 1 9 5 0 ] .
2 W. S chäfer , in : V ir u s g r o w th a n d v a r ia t io n , C a m b r id g e
U n iv e r s it y P r e s s , 1959, S . 61.
3 R . R o t t u . W. S c h ä f e r , in V o r b e r e it u n g .
4 F . M. D avenport , R . R ott u . W. S ch äfer , in V o r b e r e it u n g .
5 L . H oyle , J. o f H y g . 50, 229 [1 9 5 2 ],
6 L . H oyle , R . R eed u . W . T . A stbu r y , N a t u r e [ L o n d o n ]
10 K. P aucker , A . B irch - A nderson u. P . v. M agnu s , V irology
8, 1 [1959],
11 C. H . A nd r ew es , Nature [London] 173, 620 [1954].
12 G. S chramm , D ie Biochem ie der Viren, Springer-Verlag,
B erlin-G öttingen-H eidelberg
13
u
.
L . H o y le ,
J. o f
H yg.
54, 201
[1 9 5 6 ].
8 F . S . L i e f u . W . H e n l e , V ir o lo g y 2, 753, 772 [ 1 9 5 6 ] .
9 K . P a u c k e r , F . S . L ie f u . W . H e n l e , V ir o lo g y 2, 798 [1 9 5 6 ].
1954.
N . I sh id a , Y. H in um a , Y. N umazaki
u.
M . H omma , Fed. Proc.
18, 575 [1959].
14 W.
171, 256 [1 9 5 3 ].
7 W . F r is c h -N ig g e m e y e r
F ü r die Untersuchungen wurden der ND-Stamm
„Italien“ * und der Mumps-Stamm „Enders“ verwendet.
Beide wTurden durch fraktioniertes Zentrifugieren
(35 Min. pi. 14,2; 15 Min. pi. 0,1 15, 2 Zyklen) gerei­
nigt, in 0,14-m. NaCl, 0,02-m. Phosphatpuffer ph 7,2
(„N aC l/7,2“) aufgenommen und anschließend in der
früher beschriebenen Weise 1 6 mit peroxydfreiem Äther
behandelt. Der Hämagglutinations (HA)-Test wurde
bei beiden Virusarten mit gewaschenen H ühnererythro­
zyten durchgeführt. F ür die Bestimmung der Infektiosi-
S chäfer , Ergebn. H yg., Bakteriol., Im m unitätsforsch.,
exp. Therapie 31, 1 [1958].
* In früheren Veröffentlichungen als „atypisches G eflügelpest-V irus“ bezeichnet (vgl. 1. c . 19) .
15 P . G ie b l e r , Z. Naturforschg. 13 b, 238 [1958].
16 W. S chäfer u . W. Z illig , Z . N aturforsdig. 9 b, 779 [1954].