Folie 1 - WordPress.com
Werbung

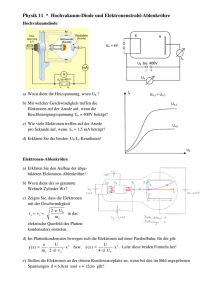
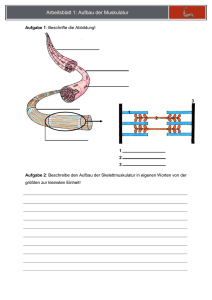
Beantworte die Frage Beantworte die Frage Korrigiere deinen Partner 1. Beschreibe, was man unter Ionen versteht. 1. Ionen sind positiv oder negativ geladene Atome oder Moleküle. Sie bewegen sich in einem elektrischen Feld je nach Ladung zur Anode oder Kathode. 2. Beschreibe, was man unter einem Kation bzw. einem Anion versteht. 2. Kationen sind positiv geladene Ionen. Anionen sind negativ geladene Ionen. 3. Beschreibe, wie aus einem Atom ein Kation entstehen kann. 3. Kationen haben einen Elektronenmangel, d.h. sie haben Elektron(en) abgegeben. Dadurch überwiegt ihre Anzahl an Protonen und sie erhalten eine positive Ladung. 4. Beschreibe, wie aus einem Atom ein Anion werden kann. 4. Anionen haben einen Elektronenüberschuss, d.h. sie haben Elektron(en) aufgenommen. Dadurch überwiegt ihre Anzahl an Elektronen und sie erhalten eine negative Ladung. 5. Erkläre, warum Atome „freiwillig“ Elektronen abgeben bzw. aufnehmen. 5. Atome sind dann besonders stabil, wenn sie eine mit Elektronen vollbesetzte letzte Schale haben. Um dies zu erreichen, geben die Atome der Elemente der Hauptgruppe I-III ihre Elektronen bevorzugt ab und die Atome der Elemente der Hauptgruppen V-VII nehmen bevorzugt Elektronen auf, um eine so genannte Edelgaskonfiguration zu erreichen 6. Elemente der Hauptgruppen I bis III reagieren besonders gut mit den Elementen der Hauptgruppen V-VII. Beschreibe am Beispiel der Reaktion von Natrium und Chlor was im Einzelnen bei der Reaktion abläuft. 6. Natrium gibt bei dieser Reaktion sein einzelnes Elektron der letzten Schale an ein Chloratom ab. Es entstehen Natriumkationen und Chloranionen, welche sich aufgrund der Anziehung zu einem Ionengitter anordnen. Ein Salz ist entstanden. Beantworte die Frage Beantworte die Frage Korrigiere deinen Partner 7. Formuliere die Reaktionsgleichung für die Reaktion von Natrium mit Chlor. 8. Erkläre, warum man 2 Natriumatome benötigt. 9. Beschreibe, welches Salz entsteht, wenn man Magnesium und Chlor reagieren lässt. Gib den Namen und die Summenformel des Salzes an. 10. Beschreibe, nach welchen Regeln Salze benannt werden. 7. 2Na (s) + Cl2(g) 2 Na+Cl- 8. Die Chloratome kommen nicht einzeln vor, sondern sind im Chlorgas als Paar verbunden. Diese Verbindung wird bei der Reaktion zwar gelöst, aber dann liegen doppelt so viele Chloratome vor. Demzufolge müssen gleich viele Natriumatome eingesetzt werden, wenn die Reaktion ohne Reste ablaufen soll. 9. Magnesium steht in der zweiten Hauptgruppe und besitzt 12 Elektronen. Es befinden sich daher 2 Elektronen auf der letzten Schale. Davon nimmt sich jeweils ein Chloratom ein Elektron, um die Edelgaskonfiguration zu erreichen. Die Summenformel ist daher Mg2+Cl2-. Das Verhältnis der Ionen beträgt 1:2, d.h. auf einem Magnesiumkation kommen zwei Chloranionen. 10. Der Name des Metalls steht vorne. Danach kommt der Name des Nichtmetalls mit der Endung –id. Beispiel: Natriumchlorid, Magnesiumchlorid. Bei einigen Nichtmetallen wird der wissenschaftliche Name verwendet. Beispiel: Schwefel: sulfid, Stickstoff: nitrid, Phosphor: phosphid, Sauerstoff: oxid. Kationen haben einen Elektronenmangel, d.h. sie haben Elektron(en) abgegeben. Dadurch überwiegt ihre Anzahl an Protonen und sie erhalten eine positive Ladung.