PDF - Biotechnologie.de
Werbung

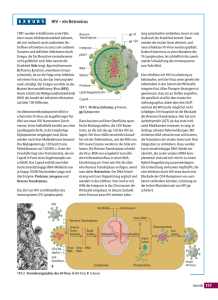
1 Quelle: Robert-Koch-Institut HIV und AIDS 1. HIV Das Human Immunodeficiency Virus (HIV) gehört zu den Retroviren (Unterfamilie Lentiviren) und infiziert in erster Linie CD4+-Zellen, d. h. T-Helfer-Zellen. Diese THelfer-Zellen spielen eine zentrale Rolle bei der Immunantwort auf Infektionen. Ein gesunder Mensch hat 800 – 1200 T-Helfer-Zellen pro µl Blut, bei einer HIV-Infektion nimmt diese Menge ab. Ist die TH-Zellen-Menge unter 200 TH-Zellen pro µl Blut gesunken, wird der Patient anfällig für Infektionen und entwickelt im Vollbild die Immunschwächekrankheit AIDS. 2 1.1. Aufbau des HIV: Die genetische Information des HI-Virus besteht aus einzelsträngiger RNA, jedes HIVirus enthält zwei Kopien seiner RNA in der Virushülle. In der HIV-Hülle (envelope) sind ca. 72 Moleküle des komplexen Env-Proteins eingebettet, bestehend aus gp120 (gp = glycoprotein) und aus einem Transmembran-Anteil gp41. Innerhalb der Hülle ist ein Capsid, aufgebaut aus 2000 Proteinen p24. Das Capsid umgibt die zwei Einzelstränge RNA, die jeweils Kopien der neun Virusgene enthalten. Drei HIV-Gene sind Strukturgene, die Informationen für Strukturproteine enthalten: gag (für Kernproteine), pol (für Protease + reverse Transkriptase + Integrase), env (für Hüllen-/Membranproteine). Drei regulatorische Gene tat, rev und nef sowie drei Hilfsgene vif, vpr und vpu enthalten weitere Informationen, die für eine erfolgreiche HIV-Infektion und Replikation notwendig sind. Die virale Reverse Transkriptase schreibt die RNA in DNA um, wodurch das HIV in das Wirtsgenom integrieren kann. Quelle: Chemistry Pictures V3-Design 3 Es gibt verschiedene Subtypen des Virus, was zu einer genetischen Diversität beiträgt. Aufgrund häufiger Mutationen liegt das Virus zusätzlich in vielfachen Varianten vor. Durch die extrem hohe Mutationsrate und die schnelle Replikation (ca. 10 Milliarden Viren täglich) ohne dass die Reverse-Transkription einen ProofreadingMechanismus hat, liegen HIV-Viren in einem einzelnen infizierten Individuum in einer größeren genetischen Diversität vor als z. B. die weltweite Diversität des Influenza A Virus. Die hohen Mutationsraten bewirken auch, dass relativ schnell resistente VirenStämme bei antiretroviraler Behandlung selektiert werden. 1.2. Life Cycle des HIV: Der Infektionsverlauf beginnt mit einer Anlagerung des Virus über das gp120 an den zellulären CD4-HIV-Rezeptor, den T-Helfer-Zellen auf ihrer Oberfläche haben. Chemokin-Rezeptoren wirken als Co-Rezeptoren (CCR5, CXCR4), die die viralen Hüll-Glycoproteine in eine Konformation überführen, die eine Membranfusion und damit den Eintritt des Virus in die Zelle ermöglichen. Neben den T-Helfer-Zellen werden auch Makrophagen infiziert. Nach der Ankopplung des Virus an die Rezeptoren fusioniert die Virushülle mit der Zellmembran, ein Prozess, an dem gp41 und Co-Faktoren beteiligt sind. Die Virus-RNA und -Proteine werden in die Zelle freigesetzt. Die RNA wird dann von der HIV Reverse-Transkriptase in DNA umgeschrieben, die in den Zellkern transportiert wird und mit Hilfe der HIV-Integrase in das Genom integriert (Provirus). Diese Provirus-Gene werden danach transkribiert (unter Kontrolle der tat-Gene), und die HIV-Proteine werden von der Wirtszelle synthetisiert. Innerhalb der Zelle werden die langen Proteinketten des unreifen Virus Cores von einer HIV-Protease in die einzelnen Proteine zerschnitten und erst danach können infektiöse Viruspartikel gebildet werden. Das reife Virus „knospt“ aus der Zellmembran, in die die viralen Hüllproteine integriert sind. In den HIV-infizierten Zellen wird wahrscheinlich durch HIV-Proteine der programmierte Zelltod (Apoptose) induziert. 4 Quelle: Howard Hughes Medical Institute 1.3. Auswirkungen auf das Immunsystem: Während der HIV-Infektion wird das Immunsystem chronisch aktiviert: durch die massive Virusproduktion in den Zellen des Immunsystems werden diese stark aktiviert, in aktivierten TH-Zellen vermehrt sich HIV schneller. Diese Aktivierung der TH-Zellen führt zu einer gesteigerten Apoptose und damit zu einem hohen Turnover von TH-Zellen, deren Halbwertszeit sich auf 1,6 Tage verkürzt, was auf Dauer zu einer Erschöpfung des Immunsystems beiträgt. Die chronische Aktivierung führt zudem zu der Bildung verschiedener Cytokine, die zum Teil verheerende Effekte auf den Organismus haben können. So wird der hohe TNF-alpha-Gehalt mit dem hohen Gewichtsverlust in Verbindung gebracht, den HIV-Infizierte zum Teil haben. Die Aktivierung führt zu einer massiven Stimulierung zytotoxischer T-Zellen und auch von B-Zellen (und damit zu einer vermehrten Bildung von anti-HIV-Antikörpern). Neben der unspezifischen Aktivierung werden auch große Mengen an HIVspezifischen T-Zellen aktiviert, dabei mutiert das Virus so schnell, dass es der Immunantwort immer vorauseilt. Hinzu kommt noch, dass das HIV bevorzugt Memory-T-Zellen infiziert, so dass nach ca. zwei Wochen ca. 90% der CD4-MemoryZellen zerstört sind. Dies ist sowohl für den Schutz vor Infektionen ein Problem, auf die der Organismus bereits eine Immunantwort gezeigt hat, aber auch für die Entwicklung eines möglichen Impfstoffes. Das gesamte Immunsystem gerät durch die HIV-Infektion aus dem Gleichgewicht, Autoimmunphänomene treten auf. 5 Ist eine antiretrovirale Therapie erfolgreich, wird die pathologisch gesteigerte T-ZellTeilungsrate reduziert und nach wenigen Monaten wieder normalisiert. Neben den direkten Folgen der HIV-Infektion wie dem Gewichtsverlust und neurologischen Funktionsstörungen geht die HIV-Infektion mit zahlreichen Infektionen einher – mehr als hundert opportunistische Infektionen durch Viren, Bakterien, Pilze und Protozoen aber auch verschiedene Krebsarten werden mit AIDS in Verbindung gebracht. 1.4. HIV Epidemie HIV wurde im Jahr 1983 erstmals identifiziert und beschrieben. Inzwischen sind ca. 39 Millionen Menschen mit dem Virus infiziert und bereits mehr als 25 Millionen Menschen an AIDS gestorben. Es wird geschätzt, dass sich täglich 16.000 Menschen neu mit dem Virus infizieren, die meisten davon im südlichen Afrika. Die meisten AIDS-Therapien sind für die Infizierten in den Entwicklungsländern unerreichbar und sind zudem in ihrer Wirkung durch ihre Toxizität limitiert. Eine völlige Heilung ist mit den bisherigen Medikamenten nicht möglich. Dies sind Gründe für die verstärkte Forschung an neuen Medikamenten und an HIV-Impfungen. In den Industrienationen hat die erfolgreiche Chemotherapie den Verlauf der AIDSErkrankung verändert, aber es sind weiter neue AIDS-Medikamente erforderlich, um die Nebenwirkungen durch die Chemotherapie zu mildern und um den ständig neuen Resistenzen des Virus entgegen zu wirken. 2. Diagnose und Behandlung von HIV-Infektionen 2.1. HIV-Diagnostik: Es gibt prinzipiell zwei Wege HIV nachzuweisen, den direkten Virusnachweis und den Antikörpernachweis. Der direkte Virusnachweis erfolgt über die Polymerase Chain Reaktion (PCR) bei der Teile des Virusgenoms amplifiziert werden können. Es ist heute möglich, die Virus-RNA quantitativ nachzuweisen. Die gegenwärtige 6 Nachweisgrenze beträgt ca. 50 Kopien per ml Plasma. Der Antikörpernachweis erfolgt über den Nachweis von Antikörpern, die von dem Patienten gegen HIVBestandteile gebildet werden. Diese Antikörper sind über einen kurzen Zeitraum nach der Infektion nicht nachweisbar, wodurch eine diagnostische Lücke entsteht. Durch die hohe Mutationsrate und die schnelle Replikation der Viren treten häufig resistente Virenstämme auf. Um die geeigneten Medikamente auswählen zu können, werden die Resistenzen innerhalb eines Patienten vor der Behandlung bestimmt. Es gibt zwei Sorten von Drug-resistance Tests: einen phänotypischen Test, der mit Hilfe der PCR ein gag-pol-Fragment amplifiziert. Dieses Fragment wird in ReporterZellen überführt und auf verschiedene Medikamenten-Konzentrationen getestet. Am häufigsten werden jedoch genotypische Tests verwendet, in denen HIV-Amplikons sequenziert werden. 2.2. Antiretrovirale Therapie Die ersten Medikamente, die zur Behandlung von AIDS entwickelt wurden, richteten sich gegen das virale Enzym Reverse Transkriptase des HIV. Die Reverse Transkriptase „schreibt“ die virale einzelsträngige RNA in doppelsträngige DNA um, damit diese im Falle einer erfolgreichen Infektion in das Wirtszell-Genom integriert werden kann. Zur Hemmung der Reverse Transkriptase wurden zum einen Nukleosid-Inhibitoren zum anderen Non-Nukleosid-Inhibitoren entwickelt. Nukleosid-Inhibitoren der Reverse Transkriptase (NRTI): Bei den Nukleosid-Inhibitoren handelt es sich um Nukleosid-Analoga. Nukleoside sind die „Bausteine“ aus denen das DNA-Polymer aufgebaut ist. Das Nukleosid besteht dabei aus einer der vier Purin- (A, G) oder Pyrimidinbasen (C, T) Nglycosidisch verbunden mit der Ribose (RNA) bzw. Desoxyribose (DNA). Durch Bindung von einer Phosphatgruppe an den Zucker entsteht ein Nukleotid. Das RNA bzw. DNA-Molekül wird über eine Verknüpfung, eine sogenannte PhosphodiesterBindung, zwischen jeweils dem 3´-OH-Ende und dem 5´-OH-Ende des nächsten Nukleotids verlängert. Die Analoga werden anstelle natürlicher Nukleoside von der Reverse Transkriptase in die DNA-Kette eingebaut. Im Gegensatz zum natürlichen 7 Nukleosid hat das Analogon z. B. kein 3´-OH-Ende. Mit Fehlen des 3´-OH-Endes kann die DNA-Kette nicht verlängert werden, d. h. es kommt zu einem Kettenabbruch. Eine Virusvermehrung ist auf diese Weise nicht mehr möglich. (Bsp.: Retrovir® Thymidin Analogon, Videx® Adenosin Analogon, Hivid® Pyrimidin Analogon, Zerid® Thymidin Analogon, Epivir® Cytidin Analogon, Ziagen® Guanosin Analogon) Non-Nukleosid Inhibitoren der Reverse Transkriptase (NNRTI): Bei den NNRTI handelt es sich meist um polyzyklische Komponenten, die an verschiedenen Stellen nahe dem katalytischen Zentrum der Reverse Transkriptase binden. Durch die Bindung wird die Aktivität des Enzyms durch mögliche Konformationsänderungen blockiert. Gegen diese Klasse von Reverse Transkriptase-Inhibitoren entstehen schnell Resistenzen, sie sollten daher nur in Kombination mit anderen Medikamenten eingesetzt werden. Bsp.: Viramune®, Rescriptor®, Sustiva®) Es gibt darüber hinaus noch Nucleotid Inhibitoren der Reverse Transkriptase (NtRTI), die den Umbau des Nukleosids zum Nukleotid nicht benötigen. (Bsp.: Viread®, Preveon®) Als weitere zugelassene Klasse von AIDS-Therapeutika wurden als besonders potente antivirale Medikamente die Protease-Inhibitoren entwickelt: Die Virus-Core-Proteine werden im Cytoplasma zunächst als Polyprotein gebildet (gag-pol) und müssen von einer viralen Protease in reife funktionelle Proteine zerschnitten werden. Protease-Inhibitoren binden an die Domäne der Protease, die das Schneiden der Proteinketten in Proteine ermöglicht, und verhindern so, dass reife Core-Proteine gebildet werden können. Es handelt sich bei den ProteaseInhibitoren um „Peptidomimetics“, die das virale Peptid-Substrat imitieren aber nicht von der Protease gespalten werden können. Durch die Protease-Blockade ist eine Entstehung reifer und damit infektiöser Viren nicht mehr möglich. Resistenzen entstehen relativ schnell und führen bei dieser Klasse von Medikamenten häufig zu cross-Resistenzen. 8 (Bsp.: Fortovase®, Norvir®, Crixivan®, Agenerase®, Reyataz®, Lexiva®, Aptivus®, Kaletra®) Aus mindestens drei der verschiedenen HIV-Medikamente wird die sogenannte Highly Active Anti-Retroviral Therapy (HAART) zusammengestellt. Jedes der antiviralen Medikamente kann die Viruslast reduzieren, aber nur durch die Kombination von drei oder mehr Medikamenten kann eine dauerhafte Suppression des Virus und ein Ausbruch resistenter Viren verhindert werden. Durch die Kombination der anti-viralen Medikamente wird die Replikationsrate so stark reduziert, dass auch die Mutationsrate gegen Null sinkt. Ca. 50 bis 90% der Patienten reagieren auf eine Kombinationstherapie. Um einen geeigneten Medikamenten-Spiegel zu gewährleisten, müssen die Kombinationstherapien zwei bis dreimal täglich verabreicht werden. Durch die ständig neu auftretenden Resistenzen des HIV gegen bestehende Therapien ist es erforderlich, fortwährend neue Medikamente zur anti-retroviralen Therapie zu entwickeln. Neben Medikamenten mit bekanntem Mechanismus aber erhöhter Wirksamkeit werden Medikamente entwickelt, die sich gegen neue Zielmoleküle richten: gag-Gen: In der Forschung befinden sich Medikamente, die sich gegen die Zink-Finger-Struktur des gag-Proteins (HIV-Core-Protein-Gen) richten, dem Gen, das für das HIV-CoreProtein codiert. Integrase-Inhibitor: Ein weiteres interessantes Medikamenten-Ziel ist die Integrase: Integrase ist das Enzym, das die Integration der umgeschriebenen viralen DNA (reverses Transkript) in die Wirtszell-DNA vermittelt. Dies ist ein essentieller Schritt in der VirusReplikation. Potentielle Inhibitoren konnten identifiziert werden. 9 Fusions-Inhibitoren: Es werden weiterhin Medikamente entwickelt, die die Fusion des HIV mit der Wirtszelle, als dem ersten Schritt der Infektion, verhindern sollen. Dazu werden sowohl Substanzen getestet, die auf das HIV-Oberflächen-Glycoprotein (gp41) zielen als auch auf die Zytokin-Rezeptoren auf der Zelloberfläche. T-20 und T-1249 sind Peptide, die mit der extrazellulären Komponente des gp41 korrespondieren und die Konformationsänderung des gp41 verhindern, die zu einer erfolgreichen Fusion des Virus mit der Zellmembran notwendig ist. Zelloberflächenproteine CXCR4 und CCR5 sind Chemokinrezeptoren, die zusammen mit dem CD4-Rezeptor der T-Zellen vom HI-Virus als Co-Rezeptoren genutzt werden. Small-molecules, die an diese Rezeptoren binden oder die diese Rezeptoren nachahmen, inhibieren in Tests die HIV-Replikation. Ein weiteres interessantes Forschungsgebiet sind anti-sense Produkte, d. h. RNAoder DNA-Oligos, siRNA, die komplementär zu Sequenzen des Virusgenoms sind und durch eine Bindung an Strukturen des Genoms dessen Replikation bzw. die Transkription sterisch oder durch RNAse-Abbau verhindern können. 2.3. HIV Vakzine: Seit Beginn der Aids-Forschung wird intensiv an der Entwicklung eines brauchbaren HIV-Impfstoffes gearbeitet. Der Impfstoff sollte sicher und effizient sein, ein breites Spektrum an Virus-Varianten erfassen und zu einem Langzeit-Immunschutz führen sowohl bei der zellulären Abwehr (memory T-Zellen) als auch bei der humoralen Abwehr (neutralisierende Antikörper). HIV-Vakzinen sind bisher zahlreich getestet worden: ca. 100 PhaseI-Studien wurden initiiert, davon wurden nur wenige Produkte in Phase II getestet, in Phase III befindet sich derzeit keine einzige Vakzine. Viele verschiedene HIV-Proteine und Antigene wurden als Zielmoleküle verwendet, zahlreiche Vektoren (DNA, Polio, Vakzinia, Salmonella, Adeno-assoziierte Viren u.v.m.) und auch verschiedene Adjuvantien wurden getestet. Bisher ist es jedoch nicht gelungen, eine Vakzine zu entwickeln, die einen ausreichenden Schutz vor einer Infektion darstellt. Initiiert durch die nicht-kommerzielle „International Aids Vaccine Initiative“ (IAVI)und unterstützt von verschiedenen Regierungen, 10 Pharmakonzernen, der Weltbank, der Bill & Melinda Gates Foundation und anderen Stiftungen wurde die Forschung an HIV-Vakzinen weiter ausgebaut. Neben der Entwicklung von Schutzimpfungen wird auch verstärkt an therapeutischen Impfungen gearbeitet (d.h. nach einer Infektion können durch Impfung die Chemotherapeutika reduziert werden). Es ist jedoch nicht damit zu rechnen, dass eine wirklich sichere prophylaktische Vakzine in näherer Zukunft auf den Markt kommt.