Surfactantproteine als Marker für Abstoßung oder - biomed
Werbung

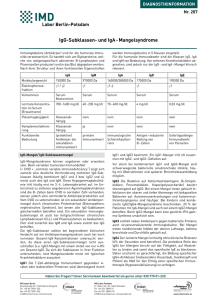
12 wissenschaft & praxis veolarepithelzellen genannt werden, bilden und speichern den Surfactant. Surfactant setzt sich zu 90% aus Lipiden und zu 10% aus surfactantspezifischen Proteinen zusammen. Die Surfactantproteine werden in 2 Gruppen gegliedert. Es gibt die hydrophilen Zusammenfassung der Diplomarbeit von Michaela Hochenegger, Surfactantproteine-A die 2001 an der MTA-Akademie Innsbruck diplomierte. und -D (SP-A, SP-D) und die hydrophoben Surfactantproteine-B und -C (SP-B, SP-C). SP-A, SP-B sowie SP-C sind sehr stark mit Li1.Einleitung piden assoziiert (Abb.: Gel-Silberfärbung von Surfactantproteine). 1.1 Lungentransplantation Man glaubte Surfactantproteine nur in der Lunge zu finDie erste erfolgreiche Lungentransplantation den, doch wurden mittlerweile SP-A, SP-B und SP-D bereits im Serum (LuTX) am Menschen wurde in den frühen mittles 80er Jahren durchgeführt. Seit damals steigt wissenschaft ELISA die Zahl der LuTX sowie die Zahl der Patien& praxis (Enzymeten, die eine Transplantation benötigen, rasch linked-iman. Der Grund dafür ist die ständige Erweiterung des Krankmunosorheitsspektrums, welches eine LuTX als letztmöglichen Thebent Asrapieansatz zur Heilung vorsieht. Eine LuTX soll dem Patiensay) detekten eine bessere Lebensqualität zurückgeben. Eine LuTX tiert. Es wird vor allem bei Patienten mit einer fortgeschrittenen Lungibt vergenparenchym- oder Lungenkreislauferkrankung durchgeschiedene führt. Die häufigsten Indikationen sind Lungenemphysem, HypotheMucoviszidose, Lungenfibrose und pulmonale Hypertonie. Gel-Silberfärbung von Surfactantproteine sen für den Statistiken zeigen, dass die 1-, 2- und 3-Jahres-ÜberlebensÜbertritt raten nach einer LuTX durchschnittlich 70%, 60% und der Surfac50% betragen. Die Gefahr einer Abstoßung oder Infektion darf auch nach dem Krankenhausaufenthalt nicht vergessen tantproteine aus der Lunge im Rahmen von Lungenerkranwerden. Um postoperative Komplikationen in Schach zu kungen: 1. eine Destruktion der Barriere zwischen Alveolahalten, ist nach einer LuTX die immunsuppressive Therapie repithel und Gefäß basierend auf einem Basalmembransehr wichtig. Die Unterdrückung der Abwehrreaktion des schaden, 2. eine Erhöhung der Permeabilität im Bereich der Körpers wird auch als Immuntoleranz bezeichnet. Die Im- Lungenvenen, 3. der Gradient in den Surfactantprotein-Konmunsuppression darf nur in einem gewissen Ausmaß erfol- zentrationen zwischen Alveole und Blut. Im Serum gesunder gen, denn das Immunsystem soll seine eigentlichen Aufgaben Menschen sind nur sehr geringe Surfactantprotein-Konzennoch erfüllen können. Zu diesen Aufgaben zählen die Er- trationen (ng/ml) zu erwarten. Ziel meiner Untersuchung kennung und Beseitigung von Bakterien, Viren, Pilzen und war es, einen Immunoassay für SP-A zu entwickeln, der senTumorzellen. Auch soll der Patient so wenig wie möglich sitiv sowie spezifisch genug ist, SP-A im Serum Gesunder sodurch die immunsuppressiven Medikamente beeinträchtigt wie im Serum von LuTX-Patienten zu messen. werden. Die Immuntoleranz wird mit der Basisimmunsuppression eingestellt. Tritt eine Abstoßungsreaktion auf, wird 2. Ziel der Arbeit zusätzlich zur Basisimmunsuppression eine AbstoßungsbeDurch eine longitudinale Beobachtung der Surfactanthandlung hinzugefügt. Immunsuppressiva zur Prophylaxe einer Abstoßung sind Glucocorticoide, Azathioprin, Cyclos- protein-Konzentrationen im Serum von LuTX-Patienten sollporin, Antithymozytenglobulin und Okt3 (orthoklonaler, te man Erkenntnisse über eine Abstoßung oder Infektion der gegen den T-Zellrezeptor gerichteter Antikörper). Bei einer transplantierten Lunge erhalten und dadurch eine frühzeitiAbstoßungsbehandlung werden diese Immunsuppressiva in ge gezielte Behandlung des LuTX-Patienten erreichen. Ein plötzlicher, starker Konzentrationsanstieg der Surfactantverschiedenen Kombinationen eingesetzt. proteine im Serum könnte auf einen generalisierten Prozeß im Sinne einer akuten Abstoßungsreaktion in der Lunge hin1.2 Surfactantproteine weisen. Ein langsamer Anstieg der Surfactantprotein-KonSurfactant ist ein Lipid-Protein-Komplex, dessen Haupt- zentrationen könnte möglicherweise charakteristisch für eiaufgabe die Herabsetzung der Oberflächenspannung an ne Infektion sein, da eher ein lokalisierter Prozeß vorliegt. Soder Gasaustauschfläche der Alveolen in der Lunge ist (Ge- mit lautet die Hypothese, dass bei Abstoßung der Lunge setz von Laplace, Kurt Neergard, 1929). Die Alveolen wer- höhere Surfactantprotein-Konzentrationen im Serum von den von Alveolarepithelzellen ausgekleidet. Die Alveola- LuTX-Patienten zu erwarten sind als bei einer Infektion der repithelzellen vom Typ 2 , welche auch „granulierte“ Al- Lunge. Surfactantproteine als Marker für Abstoßung oder Infektion nach Lungentransplantation q wissenschaft & praxis 3. Methodik und Ergebnisse Wie schon oben erwähnt, habe ich mich mit der Entwicklung eines Immunoassay für das hydrophile SP-A befasst, das im Serum eines Gesunden in einer Konzentration von ca. 50 ng/ml vorliegt. 3.1 Immunoassay 3.1.1 SP-A ELISA Als erstes versuchte ich mittels ELISA (Enzyme-linked immunosorbent Assay) eine SP-A-Standardkurve zu erstellen. Gecoatet wurde die Mikrotiterplatte mit humanem SP-A, das aus einer bronchoalveolären Lavage gereinigt wurde. Es wurde eine Verdünnungsreihe in log2-Schritten ab der Verdünnung 300 ng/ml bis 0,59 ng/ml in der Platte hergestellt. Da ein Gesunder eine SP-A-Konzentration im Serum von ca. 50 ng/ml hat, sollte er somit innerhalb des pipettierten Bereiches des Standards liegen. Nach dem Blocken der Mikrotiterplatte wurde das Antigen (SP-A) mit einem monoklonalen Antikörper (Maus-anti-SP-A) inkubiert. Nach dieser Inkubation gab man zum Antigen-Antikörper-Komplex ein horse-raddishperoxidase markiertes Konjugat (Anti-Maus-IgG-HRP) in die Mikrotiterplatte. Nach der Inkubation der jeweiligen Antikörper fand ein mehrmaliges Waschen ELISA-Prinzip statt, um überschüssige ungebundene Antikörper zu entfernen. Nach Zugabe des Substrates (Tetramethylbenzidin) katalysierte das Enzym des Konjugates die Substratumsetzung (FarbEntwicklung). Diese Farbentwicklung wurde nach einer bestimmten Zeit gestoppt und anschließend photometrisch gemessen (Abb.: ELISA-Prinzip). Es ist wichtig, bei jedem ELISA einen Blank (kein Antigen-Coating) sowie eine Konjugat-Kontrolle (Fehlen des spezifischen Antikörpers) mitzuführen. Mit dieser ELISA-Methode erhielt ich eine relativ kurze Standardkurve, mit einer unteren Nachweisgrenze von 18,75 ng/ml. Da unsere negative Kontrolle (Gesunder) bei dieser Standardkurve im unteren Bereich zu erwarten wäre, wurde eine sensitivere Methode in Betracht gezogen. Während der Operation 3.1.2. SP-A DELFIA Da Fluoreszenz-Messungen meist sensitiver sind als photometrische Messungen, wurde eine SP-A-Standardkurve nach dem DELFIA-Prinzip (Dissoziation-enhancement linked fluoreszenz immunosorbent Assay) erstellt. Diese Methode beruht auf der speziellen fluoreszierenden Wirkung der Lanthaniden. Lanthanide gehören zu der 3. Nebengruppe im Periodensystem. Meistens wird Europium (Eu3+) verwendet. Eu3+ kann stabile Fluoreszenz-Komplexe formen, welche lange Halbwertszeiten sowie hohe Fluoreszenz-Intensitäten besitzen. Um dieses Nachweisverfahren noch sensitiver zu gestalten, wird ein enzymatischer Schritt (Streptavidin-Europium) eingeführt. Nachdem der spezifische Antikörper an das gecoatete Antigen gebunden hat, wird der Antigen-Antikörper-Komplex mit einem biotinylierten Antikörper inkubiert. Nach der Inkubation und nach dem Waschschritt wird Streptavidin mit Europium gekoppelt hinzugegeben. Streptavidin hat eine sehr hohe Affinität zu Biotin. Dieser enzymatische Schritt vervielfacht das Assay-Signal. Überschüssiges Streptavidin mit Europium gekoppelt wird weggewaschen und als letzten Schritt gibt man die Enhancement Solution dazu. Die Enhancement Solution bewirkt aufgrund ihres niederen pH-Wertes das Ablösen des Europiums vom nicht fluoreszierenden StreptavidinKomplex. Die freien Kationen des Europiums formen neue hochfluoreszierende, stabile Chelate, welche schützend von Mizellen der Enhancemant Solution umgeben werden. Dieses DELFIA-System bietet hohe Sensitivität, stabile Fluoreszenz und reproduzierbare Resultate. Gemessen wird die Fluoreszenz für 1 sec in einem Time-resolved-Fluorometer bei einer Extinktions-Wellenlänge von 340 nm und einer Emission von 614 nm. Angegeben wird die gemessene Fluoreszenz in Fluorescence counts per seconds (Fl-cps). Mit diesem Prinzip erreichte ich eine zufriedenstellende SP-A-Standardkurve, die einen interessanten, relevanten Messbereich (300 – 0,59 ng/ml) für SP-A zeigte. Für alle weiteren Versuche wurde daher diese DELFIA-Methode angewandt. 13 14 wissenschaft & praxis 3.2 Messung der SP-A-Konzentration im Serum Nachdem ich die DELFIA-SP-A-Standardkurve einer Qualitätssicherung unterzogen hatte, wollte ich im nächsten Schritt die SP-A-Konzentration im Serum eines Gesunden (negative Kontrolle) messen. Leider konnte kein SP-A direkt nachgewiesen werden, da wahrscheinlich kein Coating von SP-A stattfindet. Das menschliche Serum hat einen Gesamtproteingehalt von ca. 70 mg/ml. Es ist zu berücksichtigen, dass möglicherweise SP-A mit all den anderen Proteinen um die Bindungsstellen in der Mikrotiterplatte konkurrieren muss. Da SP-A nur in sehr geringen Mengen im Serum zu vermuten ist, ist die Wahrscheinlichkeit groß, dass all die anderen „Störproteine“ die Bindungsstellen an der Mikrotiterplatte besetzen. Weiters darf man nicht vergessen, dass Surfactantproteine stark mit Phospholipiden assoziiert sind, die auf diese Weise das Protein maskieren und für spezifische erste Antikörper schwer erkennbar machen. Auf alle Fälle bedarf es einer Vorbehandlung des Serums, damit man SP-A im Serum mit diesem Testprinzip messen kann. 3.2.1 Detergens-Vorbehandlung des Serums Detergenzien sind synthetisch hergestellte Seifen mit stark polaren und apolaren Verbindungen. Der apolare Teil des Detergenz reicht ins Fetttröpfchen (Phospholipide) hinein, der polare Teil hingegen ist der Lösung (Wasser / Hauptbestandteil des Serums) zugewandt. Auf diese Weise sollten die Phospholipide, die unser SP-A-Molekül umgeben können, feinst emulgiert werden. Anstatt des üblich verwendeten PBSPuffer als Probenpuffer, um die Verdünnungsreihe in der Mikrotiterplatte herzustellen, wurde eine Detergenzlösung mit 0,2 % BSA, 0,05 % Tween 20 und 1 % Triton in PBS verwendet. Weder vorbehandeltes, gereinigtes SP-A noch vorbehandeltes Serum eines Gesunden zeigten ein Fluoreszenzsignal. Daraus war zu schließen, dass das Detergenz an die Mikrotiterplatte ebenfalls coatet und somit mit dem Ag um die Bindungsstellen konkurrierte. Aufgrund dieser Tatsache wurde dieselbe Detergenzlösung erst nach dem Coaten und Blocken als zusätzlicher Schritt eingefügt. Das Ergebnis dieser Vorbehandlung zeigte zwar eine zufriedenstellende Standardkurve mit gereinigtem SP-A, jedoch im Serum waren keine Fl-cps-Signale zu messen. 3.2.2 EDTA-Vorbehandlung des Serums Es ist bewiesen, dass Lipidbindungen durch Ca2+-Ionen verstärkt werden. Da EDTA (Ethylendiamine-tetraacetic Acid) Ca2+-Ionen bindet, sollte man dadurch die Lipide vom Protein lösen. Es wurde 5 mM EDTA dem Probenverdünnungspuffer beigefügt. Die Signale der SP-A-Standardkurve mit EDTA-Behandlung beim Coating waren wesentlich geringer als die der Standardkurve ohne Behandlung. Im Serum eines gesunden Patienten konnten wiederum keine Fluoreszenzsignale nachgewiesen werden. 3.2.3 Lipase-Vorbehandlung des Serums Durch eine Inkubation des Serums mit Lipase erhofft man sich, dass störende Phospholipide an den Surfactantproteinen abgebaut werden und die Epitope dadurch frei zugänglich werden. Die Lipase spaltet die Phospholipide zwischen dem Glycerol und den Fettsäuren. Die gesamte Lipidkonzentration im Serum eines Gesunden beträgt ca. 9 mmol/l. Die verwendete Lipase stammt aus dem Chromobacterium viscosum und spaltet bei 37 °C 1 µmol Fettsäure/min bei einem pH-Wert von 8 ab. Die Lipase wurde im Verhältnis 1:2 und 1:10 zu der normalen Lipidkonzentration im Serum eingesetzt. Da die Lipase ein Enzym und somit ein Protein ist, wurde diese Behandlung auch erst nach dem Blocken eingeschoben, um ein Coating der Lipase zu verhindern. Überraschend war zu beobachten, dass die SP-AStandardkurve mit der 10fachen Lipase-Anwendung wesentlich höhere Signale zeigte als bei unbehandeltem SP-A. Doch leider waren im Serum wiederum keine Fluoreszenzsignale aufgetreten. 3.2.4 Affinitätschromatographie und Immunpräzipitation Aufgrund der vorhergehenden Ergebnisse wurde der „Seize-X-Protein-G-Immunoprecipitation-Kit“ (Firma Pierce) als weitere Vorbehandlungsmöglichkeit des Serums verwendet. Mit diesem Testkit sollte man das gewünschte Antigen (SP-A) mittels eines monoklonalen Antikörpers spe- wissenschaft & praxis 15 munoprecipitation Kit). Sämtliche Versuche mit dem „Seize-X-Immunoprecipitation-Kit“, die mittels DELFIA kontrolliert wurden, wiesen darauf hin, dass der Antikörper SP-A bindet, jedoch SP-A nicht mehr eluiert werden kann. Dies ist vermutlich auf die extrem hohe Affinität des Antikörpers zum SP-AMolekül (Ka = 1 x 1011 M–1) zurückzuführen. 4. Zusammenfassung Spenderlunge zifisch aus dem Serum gewinnen und gleichzeitig den Antigen-Gehalt konzentrieren können. Diese Affinitätschromatographie basiert auf einer hochspezifischen Interaktion zwischen dem Protein (Antigen) und dem immobilisierten Liganden. Der Ligand setzt sich aus 3 Teilen zusammen, den „Trägerbeads“ (6 % Agarose), die mit Protein G beschichtet sind, und dem spezifischen Antikörper, der mit seinem Fc-Teil an Protein G bindet. Der 1. Schritt bei der klassischen Immunpräzipitationsmethode ist die Inkubation des Liganden mit der zu reinigenden Antigenlösung. Nach einer bestimmten Inkubationszeit haben sich Antigen-AntikörperKomplexe gebildet, die nun mit Hilfe der Trägerbeads abzentrifugiert werden können, alle Störproteine verbleiben im Überstand. Anschließend muß das Antigen nur noch vom Antikörper eluiert werden (Abb.: Seize-X-Protein-G-Im- Das Ziel der Arbeit, einen immunologischen Test zur Messung von SP-A im Serum zu entwickeln, konnte bis jetzt teilweise erreicht werden. Insbesondere fanden wir, dass mittels DELFIA der interessante Meßbereich für SP-A abgedeckt werden kann. Gereinigtes, lipidfreies SP-A konnte mittels DELFIA einfach und reproduzierbar genau gemessen werden. Im Gegensatz dazu bereitete die Messung von SP-A im Serum Probleme, da SP-A-assoziierte Lipide sowie die große Menge an Serumproteinen störten. Der Versuch, durch eine Vorbehandlung des Serums mit Detergenzien, EDTA oder Lipase die Detektierbarkeit von SP-A im Serum zu ermöglichen, führte nicht zum Erfolg. Darüber hinaus erbrachten durchgeführte Immunpräzipitationen mit unterschiedlichen SP-A-Antikörpern zwecks Anreicherung des Proteins bisher nicht den gewünschten Effekt. Abschließend kann jedoch gesagt werden, daß die gewonnenen Erkenntnisse zu einem besseren Verständnis der komplexen Protein-Lipid-Bindung führten und Affinitätsunterschiede ■ diverser SP-A-Antikörper aufzeigten. Dipl. MTA Michaela Hochenegger Abstrakt der Diplomarbeit, MTA-Akademie Innsbruck, 2001. Ausgeführt an der Univ.-Klinik für Anästhesie und Allgemeine Intensivmedizin der Universität Innsbruck, in Zusammenarbeit mit dem Institut für Pathophysiologie der Universität Innsbruck, betreut durch A. Univ.-Prof. Dr. G. Putz und A. Univ.-Prof. Dr. H. Wolf. Herzlichst bedanken möchte ich mich bei MTA Monika Blunder für ihre zuvorkommende, unermüdliche Betreuung während der gesamten Diplomarbeit sowie MTA Katharina Rossi für die Einschulung auf dem Gebiet ELISA und DELFIA. OP-Bilder dankenswerterweise von Univ.-Prof. Dr. L. Müller, Univ.-Klinik für Chirurgie, klinische Abteilung für Herzchirurgie (Innsbruck), zur Verfügung gestellt. E-Mail: [email protected]