Voll funktionsfähige humane dendritische Zellinie
Werbung
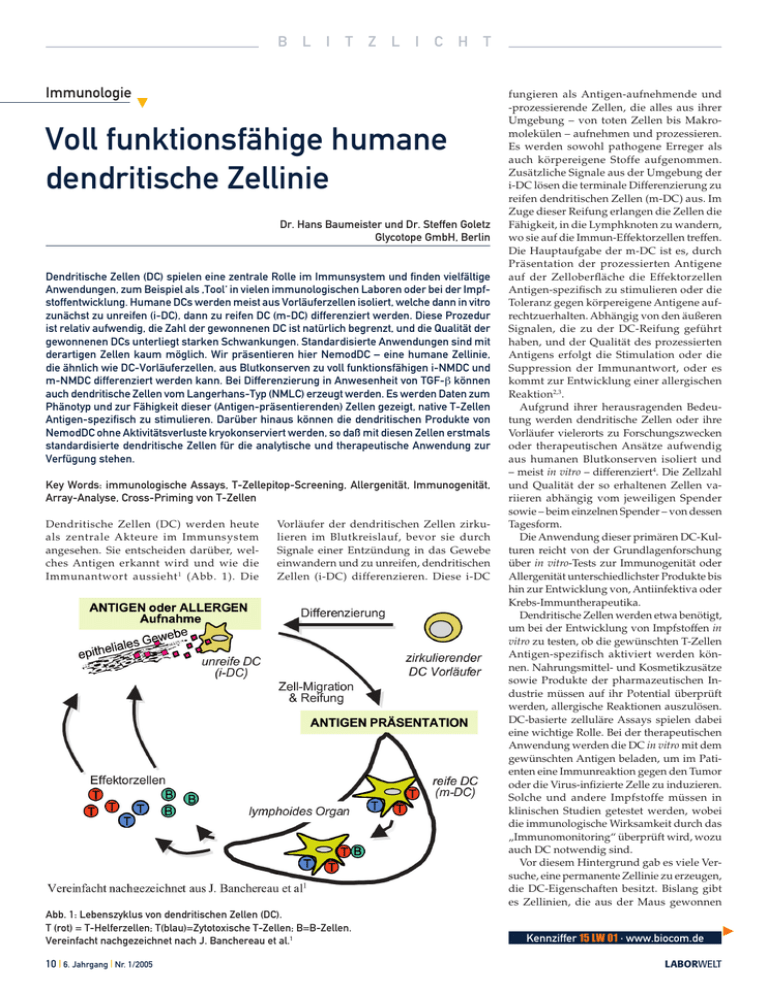
B L I T Z L I C H T Voll funktionsfähige humane dendritische Zellinie Dr. Hans Baumeister und Dr. Steffen Goletz Glycotope GmbH, Berlin Dendritische Zellen (DC) spielen eine zentrale Rolle im Immunsystem und finden vielfältige Anwendungen, zum Beispiel als ‚Tool‘ in vielen immunologischen Laboren oder bei der Impfstoffentwicklung. Humane DCs werden meist aus Vorläuferzellen isoliert, welche dann in vitro zunächst zu unreifen (i-DC), dann zu reifen DC (m-DC) differenziert werden. Diese Prozedur ist relativ aufwendig, die Zahl der gewonnenen DC ist natürlich begrenzt, und die Qualität der gewonnenen DCs unterliegt starken Schwankungen. Standardisierte Anwendungen sind mit derartigen Zellen kaum möglich. Wir präsentieren hier NemodDC – eine humane Zellinie, die ähnlich wie DC-Vorläuferzellen, aus Blutkonserven zu voll funktionsfähigen i-NMDC und m-NMDC differenziert werden kann. Bei Differenzierung in Anwesenheit von TGF-β können auch dendritische Zellen vom Langerhans-Typ (NMLC) erzeugt werden. Es werden Daten zum Phänotyp und zur Fähigkeit dieser (Antigen-präsentierenden) Zellen gezeigt, native T-Zellen Antigen-spezifisch zu stimulieren. Darüber hinaus können die dendritischen Produkte von NemodDC ohne Aktivitätsverluste kryokonserviert werden, so daß mit diesen Zellen erstmals standardisierte dendritische Zellen für die analytische und therapeutische Anwendung zur Verfügung stehen. Key Words: immunologische Assays, T-Zellepitop-Screening, Allergenität, Immunogenität, Array-Analyse, Cross-Priming von T-Zellen Dendritische Zellen (DC) werden heute als zentrale Akteure im Immunsystem angesehen. Sie entscheiden darüber, welches Antigen erkannt wird und wie die Immunantwort aussieht 1 (Abb. 1). Die Vorläufer der dendritischen Zellen zirkulieren im Blutkreislauf, bevor sie durch Signale einer Entzündung in das Gewebe einwandern und zu unreifen, dendritischen Zellen (i-DC) differenzieren. Diese i-DC Abb. 1: Lebenszyklus von dendritischen Zellen (DC). T (rot) = T-Helferzellen; T(blau)=Zytotoxische T-Zellen; B=B-Zellen. Vereinfacht nachgezeichnet nach J. Banchereau et al.1 10 | 6. Jahrgang | Nr. 1/2005 fungieren als Antigen-aufnehmende und -prozessierende Zellen, die alles aus ihrer Umgebung – von toten Zellen bis Makromolekülen – aufnehmen und prozessieren. Es werden sowohl pathogene Erreger als auch körpereigene Stoffe aufgenommen. Zusätzliche Signale aus der Umgebung der i-DC lösen die terminale Differenzierung zu reifen dendritischen Zellen (m-DC) aus. Im Zuge dieser Reifung erlangen die Zellen die Fähigkeit, in die Lymphknoten zu wandern, wo sie auf die Immun-Effektorzellen treffen. Die Hauptaufgabe der m-DC ist es, durch Präsentation der prozessierten Antigene auf der Zelloberfläche die Effektorzellen Antigen-spezifisch zu stimulieren oder die Toleranz gegen körpereigene Antigene aufrechtzuerhalten. Abhängig von den äußeren Signalen, die zu der DC-Reifung geführt haben, und der Qualität des prozessierten Antigens erfolgt die Stimulation oder die Suppression der Immunantwort, oder es kommt zur Entwicklung einer allergischen Reaktion2,3. Aufgrund ihrer herausragenden Bedeutung werden dendritische Zellen oder ihre Vorläufer vielerorts zu Forschungszwecken oder therapeutischen Ansätze aufwendig aus humanen Blutkonserven isoliert und – meist in vitro – differenziert4. Die Zellzahl und Qualität der so erhaltenen Zellen variieren abhängig vom jeweiligen Spender sowie – beim einzelnen Spender – von dessen Tagesform. Die Anwendung dieser primären DC-Kulturen reicht von der Grundlagenforschung über in vitro-Tests zur Immunogenität oder Allergenität unterschiedlichster Produkte bis hin zur Entwicklung von, Antiinfektiva oder Krebs-Immuntherapeutika. Dendritische Zellen werden etwa benötigt, um bei der Entwicklung von Impfstoffen in vitro zu testen, ob die gewünschten T-Zellen Antigen-spezifisch aktiviert werden können. Nahrungsmittel- und Kosmetikzusätze sowie Produkte der pharmazeutischen Industrie müssen auf ihr Potential überprüft werden, allergische Reaktionen auszulösen. DC-basierte zelluläre Assays spielen dabei eine wichtige Rolle. Bei der therapeutischen Anwendung werden die DC in vitro mit dem gewünschten Antigen beladen, um im Patienten eine Immunreaktion gegen den Tumor oder die Virus-infizierte Zelle zu induzieren. Solche und andere Impfstoffe müssen in klinischen Studien getestet werden, wobei die immunologische Wirksamkeit durch das „Immunomonitoring“ überprüft wird, wozu auch DC notwendig sind. Vor diesem Hintergrund gab es viele Versuche, eine permanente Zellinie zu erzeugen, die DC-Eigenschaften besitzt. Bislang gibt es Zellinien, die aus der Maus gewonnen Kennziffer 15 LW 01 · www.biocom.de Immunologie LABORWELT B L I T Z L I C H T Biosquare LABORWELT 6. Jahrgang | Nr. 1/2005 | 11 B L I T Z L I C H T men insbesondere in der Haut vor und sind wesentlich schwieriger zu isolieren als DC aus Blutkonserven. Mit der Herstellung von NMLC aus NemodDC stehen deshalb erstmals Langerhans-Zellen in größeren Mengen zur Verfügung, was für die klinische Anwendung und für Forschungszwecke sehr nützlich erscheint. Die aus NemodDC gewonnenen m-NMDC haben die für reife dendritische Zellen typische Morphologie (Abb. 4) und sind in allen Belangen voll funktionsfähig. Phänotypische Charakterisierung von NemodDC Abb. 2: Die humane Zellinie NemodDC hat die Eigenschaft von dendritischen Vorläuferzellen. Durch Kultivierung der Zellinie (NemodDC oder prec-NMDC) in Anwesenheit von IL-4 und GM-CSF differenzieren die Zellen zu unreifen, CD11c-positiven, CD83-negativen, dendritischen Zellen (i-NMDC) und anschließend durch weitere Kultivierung mit TNF-α zu reifen, CD11cund CD83-positiven, dendritischen Zellen (m-NMDC). Der untere Teil der Abbildung stellt das Ergebnis einer durchflußzytometrischen Analyse der drei Entwicklungsstadien (prec-NMDC, i-NMDC und m-NMDC) nach Doppelfärbung mit anti CD11c- und anti CD83- Antikörpern dar. werden konnten – allerdings mit Techniken, die nicht für den menschlichen Organismus anwendbar sind5. Deshalb blieb die Herstellung einer humanen dendritischen Zellinie bisher erfolglos. Mit NemodDC wird diese Lücke geschlossen. Die Zellinie besitzt die Eigenschaften von Vorläuferzellen (precNMDC), die sich in Anwesenheit von IL-4 und GM-CSF zu den unreifen dendritischen Zellen (i-NMDC) und anschließend in Anwesenheit von TNF-α-Konzentrationen zu m-NMDC differenzieren lassen (Abb. 2). Unter veränderten Differenzierungs- und Reifungsbedingungen können zudem die DC-Subtypen DC1 (IL-12-sekretierend), DC2 (IL-10-sekretierend) und NMLC (Langerin-exprimierende Langerhans-Zellen) erzeugt werden. Langerhans-Zellen kom- Abb. 3: Analyse von Zelloberflächenmarkern, die charakteristisch für die unterschiedlichen Differenzierungsstadien von dendritischen Zellen sind. Die Zellen wurden durchflußzytometrisch analysiert, wobei der prozentuale Anteil der für den jeweiligen CD-Marker positiven Zellen angegeben ist. Es wurden die Zellinie (prec-NMDC, blau), die differenzierten, aber unreifen DC (i-NMDC, grün) und die daraus gewonnenen reifen DC (m-NMDC, rot) analysiert. Die i-NMDC wurden nach Differenzierung kryokonserviert und für die Analyse und die Reifung zu m-NMDC aufgetaut. 12 | 6. Jahrgang | Nr. 1/2005 Die immunzytologischen Analysen von Oberflächenmarkern, die typisch für dendritische Zellen sind, ergaben, daß der Phänotyp der i-NMDC und m-NMDC dem Phänotyp von dendritischen Zellen entspricht, die aus Blutkonserven gewonnen wurden (Abb. 3). Die Vorläufer-Zellinie (prec-NMDC), die ursprünglich von einem AML-Patienten gewonnen wurde, ist CD11c-, CD34- und CD14positiv und entspricht damit dem Phänotyp von myeloid-monozytären Stammzellen. Durch Differenzierung zu i-NMDC und Reifung zu m-NMDC (oder m-NMLC) nimmt die CD34- und CD14-Expression ab, und die für dendritische Zellen charakteristischen Proteine erscheinen auf der Zelloberfläche (Abb. 3). So wird die Expression der Antigen-präsentierenden Moleküle (z.B. CD1a und CD1d), der co-stimulatorischen Moleküle (z.B. CD40, CD80 und CD86) und von Rezeptoren für die Erkennung von Pathogenen (z.B. CD209) stimuliert. Der für die vollständige DC-Reifung wichtige Marker, CD83, ist nicht auf der Zellinie, kaum auf den i-NMDC, dagegen auf den m-NMDC vorhanden (Abb. 3). Eine einzige Abweichung stellt die Expression der Antigen-präsentierenden MHC I- und II-Komplexe dar, die während der gesamten Zelldifferenzierung von der Zellinie bis zu den m-NMDC in hohem Maße auf der Zelloberfläche nachgewiesen werden können. Die molekularbiologische HLA-Typisierung hat ergeben, daß die Zellen A2, A3, B44, B56, Cw4, Cw7 (MHCI) und DR10, DR11, DR52, DQ5, DQ7, DPw3, DPw4 (MHC II) positiv sind. Die Expression der für die DC-Migration wichtigen Chemokin-Rezeptor CCR5, CCR6 CXCR4 und CCR7 wurde molekularbiologisch nach der Differenzierung oder nach der Reifung nachgewiesen. Für die Pathogen-Erkennung und Reifung der DC ist die Familie der Toll-like Rezeptoren (TLR) wichtig6, deren Vorhandensein wir in bezug auf 10 Rezeptoren (TLR1-10) mittels RT-PCR analysiert haben. NemodDC synthetisiert zumindest die mRNA für die TLR1, 2, 4, 6, 7, 8, 9 und 10. Die TLR1, 2 und 4 sind charakteristisch für die häufigsten dendritischen Zellen vom myeloiden Typ, wogegen die Expression von LABORWELT B L I T Z L I C H T TLR9 typisch für die wesentlich selteneren plasmocytoiden DC ist7. Charakterisierung der DC-Aktivitäten Entscheidend für die DC-Eigenschaft einer Zelle ist die Fähigkeit native T-Zellen, die noch keine Stimulation erfahren haben, Antigen-spezifisch zu aktivieren. Dies wurde in zahlreichen T-Zellassays erfolgreich für die m-NMDC getestet. Das in Abbildung 5 gezeigte Beispiel einer ELISPOT-Analyse verdeutlicht, daß m-NMDC in der Lage sind, native CD8+ T-Zellen Antigen-spezifisch zu stimulieren. In anderen ELISPOT-Analysen und Proliferationsassays wurde deutlich, daß neben nativen CD8+-T-Zellen auch „memory“ CD8+- und native sowie „memory“ CD4+T-Zellen und regulatorische NKT-Zellen (‚natural killer‘-T-Zellen) aktiviert werden können. Für die Anwendung von NemodDC als DC-Quelle ist zudem die Fähigkeit entscheidend, Antigene zu prozessieren und diese anschließend T-Zellen zu präsentieren. In zahlreichen ELISPOT-Analysen und Zytotoxizitäts-Assays wurden Peptide durch m-NMDC effizient präsentiert sowie Proteine, Zellysate und DNA-Vakzine durch die i-NMDC prozessiert, um anschließend von den m-NMDC in Form von Peptiden erfolgreich T-Zellen präsentiert zu werden. In diesem Zusammenhang konnte auch ein effizientes Cross-Priming beobachtet werden. Auch die Fusion der m-NMDC mit Tumorzellen ist ein vielversprechender Weg, Antigene auf m-NMDC zu präsentieren. Diese Ergebnisse machen deutlich, daß die bekannten Möglichkeiten von dendritischen Zellen, Antigene zu präsentieren und T-Zellen (über MHC I-, MHC II- und CD1Komplexe) zu stimulieren, bei NemodDC weitgehend zur Verfügung stehen. Am Rande sei erwähnt, daß die stimulierten CD8+T-Zellen in der Lage sind, ihre zytotoxische Aktivität Antigen-spezifisch an Tumorzellen zu entfalten, daß sehr erfolgreich T-Zellklone erzeugt werden konnten, und – wichtig für eine therapeutische Anwendung von NemodDC– auch bestrahlte m-NMDC in der Lage sind, auf CCR7-spezifische Chemokine chemotaktisch durch Zellmigration zu reagieren. einem sehr schonenden Verfahren aufgetaut, ist kaum eine Beeinträchtigung der Zellvitalität zu beobachten (80% ± 10% vs. 85% ± 7% für i-NMDC und 50% ± 10% vs. 40% ± 10% für m-NMDC jeweils vor und nach dem Einfrieren/Auftauen). Eine grundlegende Veränderung des dendritischen Phänotyps konnte nicht beobachtet werden (vgl. Abb. 3). Schließlich wurde der kritischste Punkt überprüft: sind die aufgetauten Zellen noch in der Lage Antigene zu präsentieren und T-Zellen zu stimulieren? Zu diesem Zweck wurde eine ELISPOT-Analyse mit Antigenpräsentierenden m-NMDC durchgeführt, die entweder aus kryokonservierten i-NMDC gewonnen oder „frisch“ produziert wurden. Die Ergebnisse dieser Analysen sind in Abbildung 5 dargestellt und zeigen, daß keine gravierenden Einbußen in der T-Zellaktivierung Abb. 4: Morphologie reifer dendritischer Zellen (m-NMDC), die aus der Zellinie NemodDC durch Differenzierung und Reifung gewonnen wurden. Zur Herstellung der m-NMDC siehe Text und Abbildung 2. Kennziffer 16 LW 01 · Informationen ordern? · www.biocom.de Strathmann ‚Ready-to-use‘ dendritische Zellen und passende T-Zellen Um NemodDC zur Verfügung stellen zu können, haben wir die Möglichkeit getestet, die differenzierten, unreifen i-NMDC und die reifen m-NMDC ohne Verlust der dendritischen Eigenschaften einzufrieren und auf Trockeneis zu verschicken. Werden die in einem DMSO-haltigen Einfriermedium eingefrorenen i-NMDC und m-NMDC in LABORWELT 6. Jahrgang | Nr. 1/2005 | 13 B L I T Z L I C H T zu beobachten sind, wenn die i-NMDC einmal eingefroren und aufgetaut wurden. Vergleichbare ELISPOT-Analysen ergaben, daß auch die m-NMDC kryokonserviert werden können, ohne daß die Fähigkeit, T-Zellen zu stimulieren, größere Einbußen erfahren hätte. Die mögliche Dauer der Lagerung der eingefrorenen Zellen hängt von deren Art ab, wobei die Lagerung im flüssigen Stickstoff am günstigsten ist und mindestens ein Jahr ohne größere Veränderungen der Zellen möglich ist. Für einige Anwendungen der dendritischen Zellen (siehe unten) werden neben den DC auch T-Zellen benötigt. In vielen Labors werden T-Zellen und DCs aus demselben Spender gewonnen, um einen identischen HLA-Typ von T-Zellen und DCs zu garantieren. Für NemodDC wurde dieses Problem gelöst, indem T-Zellen von zahlreichen HLA-A2+-Spendern in ELISPOT-Analysen getestet getestet wurden. Aufgrund dieser Analysen können nun T-Zellen bereitsgestellt werden, die funktionell gut zu NemodDC passen. Diese können auch kryokonserviert als PBMC, isolierte CD8+- oder CD4+-T-Zellen verschickt werden. Fazit NemodDC und die davon abgeleiteten dendritischen Produkte DC-Tools sind geeignet, humane DC aus Blutkonserven in DC-basierten in vitro-Assays zu ersetzen. Bei Verwendung der passenden T-Zellen kann bei in vitro-T-Zellassays ganz auf Blutkonserven verzichtet werden. Die konstante Abb. 5: Ergebnis eines repräsentativen TZellassays (ELISPOT-Analyse). Die m-NMDC wurden durch Differenzierung und Reifung (s. Abb. 2) aus der Zellinie NemodDC gewonnen, mit einem bekannten HLA-A2-Peptid aus dem MART-1 Protein beladen und zur ersten Stimulation (Prime) von isolierten HLA-A2 + -, CD8 + -T-Zellen verwendet. Die T-Zellantwort wurde durch Bestimmung der Zahl der aktivierten (IFN-γ-sekretierenden) CD8+-T-Zellen quantifiziert. Der Antigen (MART1)-spezifische Anteil dieser T-Zellantwort wird dadurch deutlich, daß die auf das MART-1 Peptid ‚geprimten‘ T-Zellen (i) mit MART-1 Peptid-präsentierenden Zellen restimuliert wurden, (ii) mit Zellen, die ein irrelavantes HLA-A2+- Peptid (aus dem HIVgag-Protein) oder (iii) kein Peptid präsentierten. Schließlich wird die Qualität von m-NMDC, die aus aufgetauten i-NMDC (grün) bzw. „frischen“ i-NMDC (blau) gewonnen wurden, miteinander verglichen. Qualität und nahezu unbegrenzte Zellzahl der aus NemodDC gewonnenen i-NMDC und m-NMDC ermöglichen erstmals die notwendige Standardisierung dieser Assays. Dazu gehören etwa die in vitro-Analysen zur Wirksamkeit von Impfstoffen und des Allergie-Potentials von Nahrungsmitteln und Kosmetikzusätzen sowie von pharmazeutischen Produkten (Abb. 6). Methoden, die bisher nicht möglich oder nur unter großen Schwierigkeiten durchführbar waren, weil humane DC nur in sehr variabler Qualität und Zellzahl zur Verfügung standen, können jetzt etabliert werden. Dazu gehören die Entwicklung von Screening-Techniken (Abb. 6), um immunmodulierende Eigenschaften einer Substanzgruppe zu identifizieren oder zu optimieren, und die Möglichkeit der Identifizierung neuer T-Zellepitope beispielsweise von Tumormarkern oder die Optimierung solcher Epitope. Eine ganz neue Perspektive bietet die Möglichkeit auch Langerhans-Zellen im Labor in ausreichender Menge und standardisierter Qualität zur Verfügung herstellen zu können. Eine klinische Anwendung von NemodDC erscheint sehr vielversprechend, zumal die Zellinie Virus-frei ist und inzwischen Serumfrei kultiviert wird. Literatur [1] [2] [3] [4] [5] [6] [7] J. Banchereau et al., Immunbiology of dendritic cells, Annu. Rev. Immunol. 18, 767-811 (2000) M. Lutz und G. Schuller, Immature, semimature and fully mature dendritic cells: which signals induce tolerance or immunity?, Trends Immunol. 23, 445-449 (2002) S.C. Eisenbarth et al., The master regulators of allergic inflammation: dendritic cells in Th2 sensitization, Curr. Opin. Immunol. 15, 620-626 (2003) G. Schuler und N. Romani, Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability, Adv. Exp. Med. Biol. 417, 7-13 (1997) S. Ebihara et al., Immortalized dendritic cell line with efficient cross-priming ability established from transgenic mice harboring the temperaturesensitive SV40 large T-antigen gene, J. Biochem. (Tokyo) 136, 321-328 (2004) S. Akira und H. Hemmi, Recognition of pathogen-associated molecular patterns by TLR family, Immunol. Letters 85, 85-95 (2003) V. Hornung et al., Quantitative expression of Toll-like receptors 1-10 mRNA in cellular subsets of human peripheral blood mononuclear cells and sensitivity to CpG oligodeoxynucleotides, J. Immunol. 168, 4531-4537 (2002) Korrespondenzadresse Abb. 6: In vitro-Assays unter Verwendung von dendritischen Zellen (DC). NemodDC erlaubt die Standardisierung dieser Assays, da Qualitätsschwankungen entfallen, die bei aus Blutkonserven isolierten DCs zu beobachten sind. 14 | 6. Jahrgang | Nr. 1/2005 Dr. Hans Baumeister GLYCOTOPE GmbH Robert-Rössle-Str. 10. D-13125 Berlin Tel.: +49-30-941084-207 Fax: +49-30-941084-188 eMail: [email protected] www.glycotope.com LABORWELT











