VL 4 - Innate PRRs and inflammation
Werbung

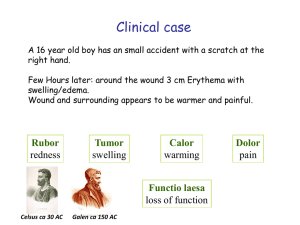
Clinical case A 16 year old boy has an small accident with a scratch at the right hand. Few Hours later: around the wound 3 cm Erythema with swelling/edema. Wound and surrounding appears to be warmer and painful. Rubor redness Tumor swelling Calor warming Functio laesa loss of function Celsus ca 30 AC Galen ca 150 AC Dolor pain What can trigger an inflammation? pathogen infection Injury, mechanical stress, Trauma Cell death – DANGER! Activation of the immune system Elimination of pathogen Removal of dead cells What can trigger an inflammation? pathogen Typical Biochemical structures= patterns Injury, mechanical stress, Trauma PAMPs= DAMPs=Alarmine Pathogen Associated molecular patterns Damage associated molecular patterns Pattern recognition receptors = PRRs (soluble and cell-associated) Activation of the immune system Elimination of pathogen Removal of dead cells Fungal PAMPs •How are viruses recognized? •ssRNA viruses •use dsRNA stage •for replication What can trigger an inflammation? pathogen Typical Biochemical structures= patterns Injury, mechanical stress, Trauma PAMPs= DAMPs=Alarmine Pathogen Associated molecular patterns Damage associated molecular patterns Pattern recognition receptors = PRRs (soluble and cell-associated) Activation of the immune system Elimination of pathogen Removal of dead cells Mustererkennungrezeptoren (PRRs) • membrangebundene PRRs scavenger Rezeptoren Toll-like Rezeptoren C-Typ-Lektin-Rezeptoren Erkennung nach Opsonisierung: mit Antikörpern: Fc-Rezeptoren mit C3b: Komplement-Rezeptoren CR3 • cytosolische PRRs NOD-like Rezeptoren (NOD1, NOD2) RIG-I-likeRNA-Helikase • sezernierte Proteine Collektine: (gehören auch zu C-Typ-Lektinen) Mannose-bindendes Lectin (MBL) und surfactant protein A, D (SP-A, SP-D) Ficoline Pentraxine: Serum Amyloid, C-reaktives Protein, • endozytierende Rezeptoren • signalgebende Rezeptoren: adaptive Immunantwort (Expression von Cytokinen , kostimulatorischen Proteinen • Komplement-Aktivierung 1.Phase: reaction of local inflammation Activation of • Plasma enzymes • Complement • Bradykinin Activation of Coagulation „DAMPs“ „PAMPs“ complement MBLectin pathway Alternative pathway MBL „Pathogene surface“ Plasmaproteases C3 convertase C4b2b C3 C3aC3 C5aC3 C5 Convertase: C3b,Bb plus C3b C4b2b plus C3b C5 (C9)n C5b Analaphylatoxine C3 convertase C3b,Bb Antibody C4 C2 C3b Membrane attacking complex MAC Classical pathway Incorporation into Pathogenic membrane (pores, lysis) Antigen-gebundenes IgM und IgG1+3 aktivieren Komplement Figure 14-10 C1 binding to the Fc portions of IgM and IgG. C1 must bind to two or more Fc portions to initiate the complement cascade. The Fc portions of soluble pentameric IgM are not accessible to C1 (A). After IgM binds to surface-bound antigens, it undergoes a shape change that permits C1 binding and activation (B). Soluble IgG molecules will also not activate C1 because each IgG has only one Fc region (C), but after binding to cell surface antigens, adjacent IgG Fc portions can bind and activate C1 (D). Downloaded from: StudentConsult (on 28 November 2012 10:30 AM) © 2005 Elsevier Der lösliche Inhibitor C1 INH hemmt die Aktivierung des klassischen Pathways Figure 14-13 Regulation of C1 activity by C1 INH. C1 INH displaces C1r2s2 from C1q and terminates classical pathway activation. Downloaded from: StudentConsult (on 28 November 2012 10:30 AM) © 2005 Elsevier Die zellmembran-gebundenen Inhibitoren DAF, CR1 + MCP inaktivieren die C3-Konvertase DAF = (CD55) decay accelerating factor MCP = (CD46) Membrane cofactor CR1 = (CD35) Complement receptor 1 Figure 14-14 Inhibition of the formation of C3 convertases. Several membrane proteins present on normal cells displace either C2a from the classical pathway C3 convertase (A) or Bb from the alternative pathway C3 convertase (B) and stop complement activation. Downloaded from: StudentConsult (on 28 November 2012 10:30 AM) © 2005 Elsevier Der zellmembran-gebundene Inhibitor CD59 (Protektin) verhindert die Polymerisierung von C9 und damit die MAC-Formierung Figure 14-16 Regulation of formation of the MAC. The MAC is formed on cell surfaces as an end result of complement activation. The membrane protein CD59 and S protein in the plasma inhibit formation of the MAC. Downloaded from: StudentConsult (on 28 November 2012 10:30 AM) © 2005 Elsevier Zellmembran-gebundene Inhibitoren (CD59 (Protektin), DAF) agieren species-spezifisch Problem in der Xenotransplantation Pigs transgenic for human complement inhibitors Mast cell activation activated Complement Dolor pain Degranulation (few minutes) Pre-formed Bradykinin C3a C5a Anaphylatoxines Nerve cells itching Histamin Mast cells (Basophile Eosinophile) Endothelial cells Vasodilatation Rubor redness Tumor swelling 1.Phase: reaction of local inflammation Activation of • Plasma enzymes • Mast cells • macrophages •PAMPS-TLR-Specificities •West AP, et al. 2006 in Annu. Rev. CellDev. + Biology TLRs can trigger immune response via 2 different signalling pathways only Myd88 Independent (= TRIF dependent) only Myd88 dependent TLR1/2 TLR2/6 TLR5 TLR7 TLR8 TLR9 TRIF TLR3 TLRs are located in different cell types and compartiments mainly in macrophages and mDCs mainly in pDCs NF-kB TNFa etc. IRF7 IFNb Nucleus Also other (non-immune) cells (e.g. epithelial cells) can express TLRs •Other PRRs – C-type lectins Scavenger receptors: PPRs for both infectious nonself and modified self • • • • erkennen modified LDL (mLDL) und anionische Substanzen (z.B. LPS, Lipoteichonsäuren, einige Polynukleotide) Aufnahme von acetyliertem und oxidiertem LDL und haben eine Bedeutung bei der Entstehung der Arteriosklerose (CD 36 und SR-A) Aufnahme von Listerien, Staphylokokken, Neisserien und apoptotischen Zellen (SR-A) Aufnahme von Streptokokken (MARCO, MAcrophage Receptor with COllagenous structure) one receptor – many ligands LDL receptor ist spezifischer splice-Varianten 2 TM N-term. extrazellulär http://miami.uni-muenster.de/servlets/DerivateServlet/Derivate-131/d_einleitung.pdf Mustererkennungrezeptoren (PRRs) • membrangebundene PRRs scavenger Rezeptoren Toll-like Rezeptoren C-Typ-Lektin-Rezeptoren Erkennung nach Opsonisierung: mit Antikörpern: Fc-Rezeptoren mit C3b: Komplement-Rezeptoren CR3 • cytosolische PRRs NOD-like Rezeptoren (NOD1, NOD2) RIG-I-likeRNA-Helikase • sezernierte Proteine Collektine: (gehören auch zu C-Typ-Lektinen) Mannose-bindendes Lectin (MBL) und surfactant protein A, D (SP-A, SP-D) Ficoline Pentraxine: Serum Amyloid, C-reaktives Protein, • endozytierende Rezeptoren • signalgebende Rezeptoren: adaptive Immunantwort (Expression von Cytokinen , kostimulatorischen Proteinen • Komplement-Aktivierung Other PRRs – NOD1 and NOD2 as intracellular PRRs How can a virally infected non-immune cell, which does not express TLR3, 7 or 9 sense the viral infection and induce IFNa expression? Alternative (TLR independent) intracellular RNA recognition Intracellular DNA and RNA sensors Inhibition of virus replication by IFNa/b IFNa/b 2-5OA RNAseL Degradation of dsRNA PKR eIF2-p PKR = RNA-dependent protein kinase 2-5OA = 2´-5´ oligoadenylate synthetase translation Alarmins = DAMPs (damage/danger associated molecular patterns) Necrotic dying cells release danger signals ECM infection MSU Cell death Inflammasome activation ATP Trauma Injury burn DC HMGB1 HSPs inflammation Plasma enzymes HMGB = high mobility group B HSPs = heat shock proteins MSU = monosodium urate; uric acid crystals ECM = extra cellular matrix ECM Degradation (e.g. Hyalunoric acid) TLR Stimulation (also other receptors) cytokines Inflammasome Partikel, die zum lysosomalen Schaden (und damit mitochondrialen Stress) führen, aktivieren das Inflammasom und damit Entzündung Beispiele: Harnsäurekristalle (Gicht), Asbest, Nanopartikel (Kosmetika), Aluminiumsalze (Adjuvanz) fMet mtDNA Inflammasome structure LRR = Leucin rich repeats CARD = Caspase recruitment domain NACHT= Nucleotide binding domain PYD = Pyrin domain Cell death (DANGER signal) can trigger inflammation DAMPs get released by necrotic but not apoptotic cells DAMPs can get inactivated during Apoptosis Summary PRRs Summary PRR signaling Other cytokines (IL-1, TNF-a) stimulate similar pathways IL-17 IL-1R Such cytokines activate (amplify) inflammation – they act as danger signals ! pathogen 3) Sekretion of pro-inflammatory mediators by immune cells (Makrophages, Dendritic cells) bioactive lipids (Thromboxanes, Prostaglandines, leukotriens) Vasodilation Higher blood circulation rubor=redness cytokines Activation of local endothelial cells chemokines attract „gorging“ phagocytic cells tumor=Swelling Synthesis of bioactive Lipids Pharmacological Targets: Phospholipase A2 Cyclooxygenase (COX) Ibuprofen Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFa, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors Cytokine production is controlled on several levels LPS TLR4 MAPK IkB AP-1 NF-kB ARE Level of cytokine production IL-10 effect Signalling No Transcription (factors + epigenetic) ? mRNA-stability yes Cytokine processing/ secretion yes Epigenetic regulation of cytokine expression Posttranscriptional control of LPS induced cytokine induction LPS ATP TLR4 Uric acid crystals Bacterial RNA MDP Nigericin P2X7 K+ K+ ? ? Caspase-1 Pro-cytokine TAK1 IL-1b processing translation MKK 3,6 mRNA IL-1b AUUUA ARE-BPs IkB p50 JNK p65 p38 MK2 NF-kB transcription AP-1 Jun secretion Inflammasome TRAF6 IKK a,b,g IL-1b FOS p50 p65 IL-1b IL-18 TNF-a AAAAA miRNAs IL-1b mature cytokine Blutgefäß Gewebe (Haut) Zytokine machen Entzündung Chemokine locken Leukozyten ins entzündete Gewebe Haut (Epithel) Chemokine Zytokine Gefäßwand (Endothel) transmigration Slow rolling rolling Blutfluss Leukozyt Entzündungsbotenstoffe weisen den Weg zur Infektionsstelle Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFa, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFa, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors Anlocken und Extravasation von Neutrophilen Glykoprotein-Selektin CXCL8 (IL-8) wirkt chemotaktisch auf Neutrophile Chemokin-Chemokin-Rezeptor bacterial products (fMLP), C5a, LTB4 Ca2+ Cytoskelett Integrin-Integrin-Ligand PECAM Neutrophile wandern schneller zum Entzündungort (1 d) als Monozyten (2-3 d) P-selectin glycoprotein ligand-1 P(platelet)-Selektin aus intrazellulären Vesikeln (Weibel-Palade-bodies) Sekunden nach Signal, z. B. Histamin an die Zelloberfläche E(endothelial)-Selektin: Neusynthese induziert durch TNF-a oder IL-1 über NFkB TNF-a, IL-1 induzieren Bildung von Zell-adhäsionsmolekülen, erhöhte Gefäßpermeabilität (TNF-a) IL-6 IL-12 Aktivierung von NK-Zellen Leber: Bildung von AkutPhase-Proteinen Fieber (IL-1, TNF-a, IL-6) Neutrophil ways of KILLING Adhesion molecules neutro neutro LFA-1 ICAM-1 TNFa, IL-1 CXCL8= IL-8 Macro PAMPs Induction of Adhesion molecules (Selektines) on Endothelial cells (ICAM-1; E-Selectin) and Immun cells (LFA-1; L-Selectin) Konzentrations gradient cytokines (TNF-a; IL-1, IL-6) Chemokines e.g. Interleukin-8 (IL-8) = CCL8 complement activation C5a Inflammatory locus Makrophage functions 1) Secretion of pro-inflammatory mediators a) cytokine b) chemokines c) bioactive lipids 2. Phase: attraction/accumulation of more/other immune cells 2) Phagocytosis 3) Killing of phagocytosed pathogen Clinical case development • Afternoon: ague (shivering fever) 38,5 oC. Local inflammation signs enhanced. • Additonally signs of Lymphadenitis and swelling of lymphnodes. • Medic prescribes Antibiotics (Ampicillin) and lokal cooling Kühlung. Start of acute phase response „Warning“ remote response cytokines Tumor Necrosis Factor alpha (TNF-a) Interleukin-1 (IL-1) Pyrogene cytokines Interleukin-6 (IL-6) Granulocytes/Monocytes Colony Stimulating factor GM-CSF Hypothalamus Temperature Set point changes Liver Synthesis of Acute-Phase-Proteins Bone marrow New synthesis of Phagocytic cells Fever u.a. Opsonisation „Linksverschiebung“ Akut Phase Proteine Opsonisierung: Markierung von Erregern durch Bindung an Erregerstrukturen für die erleichterte Phagozytose Beispiele: Collectins: C reaktives Protein (CRP) mannose binding protein (MBP) serum amyloid protein (SAP) surfactant proteins (SP-A SP-D) Komplement C3 (C3b) Energy for the immune system Adipocyted Lipolyse LipoproteinlipaseActivity Lipid metabolism Muscle cells IL-1 and TNF-alpha Protein metabolism Appetite cachexia and Wasting Makrophage functions 1) Secretion of pro-inflammatory mediators a) cytokine b) chemokines c) bioactive lipids 2. Phase: attraction/accumulation of more/other immune cells 2) Phagocytosis 3) Killing of phagocytosed pathogen Phagozytosis receptors for opsonized pathogenes ? CRP-Rezeptor (CD32??) ? MBP-Rezeptor (CD14??) CRP MBP Fibronektin Komplement (C3b) Integrine „Pathogene Oberfläche“ C3b CR1 (CD35) Antikörper Fc-Rezeptoren (CD16; CD32; CD64) Opsonisierungsprinzip Makrophagen Phagozytosis receptors for non-opsonized pathogenes Scavenger-Rezeptoren: SR-A I+II MARCO Lektin-type-Rezeptoren: Mannose Rezeptor b-Glukan-Rezeptor (Dectin-1) LPS-Rezeptor CD14 Phagozytose-Rezeptoren für opsonisierte Pathogene ? CRP-Rezeptor (CD32??) ? MBP-Rezeptor (CD14??) CRP MBP Fibronektin Komplement (C3b) Integrine „Pathogene Oberfläche“ C3b CR1 (CD35) Antikörper Fc-Rezeptoren (CD16; CD32; CD64) Opsonisierungsprinzip Makrophagen Phagozytose 1) Aufnahme des Erregers - Pseudopoiden - Aufnahme in die Zelle - Ablösung von Zellmembran 2) Verschmelzung mit Lysosom - Phagolysosom - saurer pH 3) Abtöten des Erregers - oxidative burst (O2-Radikale; NO) 4) Abbau der Erregerbestandteil - Enzyme (Hydrolasen, Proteasen, etc...) Principles of KILLING ROS-formation ROS = reactive oxygen species „respiratory burst“ Stickstoffoxid-abhängiges Abtöten Trotz „unfreundlicher“ Bedingungen Überleben von intrazellulären Bakterien Beispiele: Mycobakterien tuberculosis leprae Phagozytose nicht möglich-Was nun? Parasiten z.B. Würmer „Frustrierte“ Phagozytose Degranulation C3a C5a Fce IgE Mastzellen Eosinophile Basophile Phagozytose nicht möglich-Was nun? Hermetisch „Abriegeln“ Granulom What happens if you have a mutation in the NAPDH-Oxidase Chronic granulomatosis Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFa, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors Von der angeborenen zur erworbenen Immunität: Transport von Erregerbestandteilen zum Lymphknoten TLR Von der angeborenen zur erworbenen Immunität: Lymphknoten – Treffpunkt der Immunzellen Activation of inflammation by „Danger“ is required to initiate an immune response apoptotic cell death necrotic cell death NO danger Damage (DAMPS) DC Pathogen (PAMPS) DC Ag presen tation T soluble Mediators (e.g. cytokines) Ag presen tation costimulation T Lymphe und Lymphbahnen • Lymphe: wasserklare Flüssigkeit; nur viszeral durch Chylomikronen milchig getrübt; bis 2 L/d werden in die Blutbahn eingespeist • Gefäße und Leitungen, welche Flüssigkeit der Gewebe aufnehmen und zurück zur Blutbahn bringen (überwiegend linke Schlüsselbeinvene) Immunologie-Vorlesung MHC und Antigenpräsentation • Haupthistokompatibilitätskomplex (MHC, major histocompatibility complex) • Antigen-Prozessierung • Professionelle Antigen-präsentierende Zellen: Dendritische Zellen, B-Zellen und Makrophagen soweit nicht anders angegeben, Abbildungen aus Janeway´s Immunobiology, Garland Science, 8.ed. / 2008 Antigen presentation via Major histocompatibility Antigens responsible for Transplant rejection Major histocompatibility complex = MHC (all spezies) In Humans they are named: Human Leukocyte Antigen = HLA Erworbene Immunität: Aktivierung von CD4+ T-Helfer-Zellen Extrazelluläre Erreger Antigen präsentierende Zelle • Extrazelluläre Erreger werden in endozytotischen Vesikeln prozessiert und über MHC Klasse II Moleküle CD4+ T-Helfer-Zellen präsentiert. • MHC Klasse II Moleküle werden nur von Antigen präsentierenden Zellen exprimiert (Dendritische Zellen, Makrophagen, B-Zellen) MHCII-presentation Erworbene Immunität: Aktivierung von CD8+ zytotoxischen T-Zellen Infizierte Zelle viral protein Major Histocompatibility Complex • Intrazelluläre Erreger werden durch das Proteasom prozessiert und über MHC Klasse I Moleküle den CD8+ zytotoxischen T-Zellen präsentiert. • MHC Klasse I Moleküle werden von allen Körperzellen exprimiert MHCI-presentation Antigen-Präsentation von cytosolischen Antigenen über MHC-I • fehlgefaltete cytosolische (und virale) Proteine werden ubiquitiniert und im Proteasom gespalten • über einen ABC-Transporter (TAP) ins ER transportiert • dort an MHC-I-Moleküle gebunden und zur Zelloberfläche transportiert Viruses have evolved different evasion strategies for MHCI escape MHC class I MHC class II HLA-A, B und C = HLA-DR, DP und DQ Presentation of endogenes Antigens (host, Tumors, Viruses) Presentation exogenes Antigens (Bakterien, Pilze etc.) all nucleated cells Only on specialized Antigen-presenting cells (=APCs) (DCs, Makrophages; Monocytes, B-cells) Recognition by cytotoxic T-Lymphozyten (CD8+) Recognition by T-Helper Lymphozyten (CD4+) Professionelle antigenpräsentierende Zellen Dendritische Zelle FcgR, CR, Mannose receptors, DEC-205 phagocytosis Viral Infection macropinocytosis endocytosis Endosomes/lysosomes cross presentation Cytosol MHC-I MHC-II starke Induktion der Expression von MHC-II und B7 durch verschiedene Rezeptoren (TLR, scavenger receptor, CR, MMR), geeignetes Wanderungsverhalten (treffen T-Zellen in den Lymphknoten Makrophage phagocytosis FcgR, CR, Mannose receptors Endosomes/lysosomes MHC-II B-Lymphozyt kostimulatorisches Molekül B7.1 wird durch LPS induziert BCR B cells only internalize antigens that bind to BCR. MHC-II stark exprimiert Induktion der Expression von MHC-II und B7 durch verschiedene Rezeptoren (TLR, scavenger receptor, CR, MMR) MHC-II How can DCs prime naive CD8+ T cells for viral antigens ? MHC class I MHC class II HLA-A, B und C = HLA-DR, DP und DQ Presentation of endogenes Antigens (host, Tumors, Viruses) Presentation exogenes Antigens (Bakterien, Pilze etc.) all nucleated cells Only on specialized Antigen-presenting cells (=APCs) (DCs, Makrophages; Monocytes, B-cells) Recognition by cytotoxic T-Lymphozyten (CD8+) Recognition by T-Helper Lymphozyten (CD4+) Crosspresentation (viral epitopes for naive CD8+ T cells) Blutgefäß Gewebe (Haut) Zytokine machen Entzündung Chemokine locken Leukozyten ins entzündete Gewebe Haut (Epithel) Chemokine Zytokine Gefäßwand (Endothel) transmigration Slow rolling rolling Blutfluss Leukozyt Entzündungsbotenstoffe weisen den Weg zur Infektionsstelle Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFa, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors