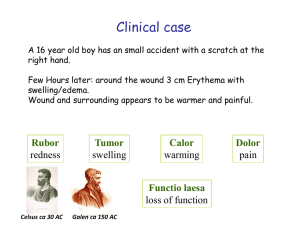
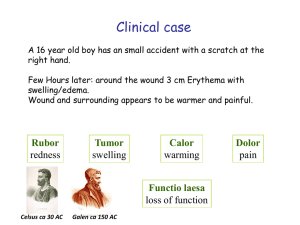
VL 2 - Innate first line defence
Werbung
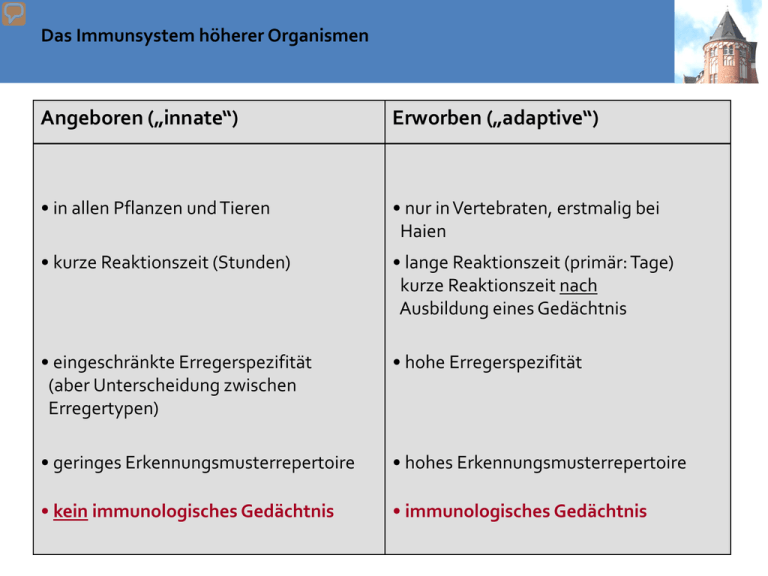
Das Immunsystem höherer Organismen Angeboren („innate“) Erworben („adaptive“) • in allen Pflanzen und Tieren • nur in Vertebraten, erstmalig bei Haien • kurze Reaktionszeit (Stunden) • lange Reaktionszeit (primär: Tage) kurze Reaktionszeit nach Ausbildung eines Gedächtnis • eingeschränkte Erregerspezifität (aber Unterscheidung zwischen Erregertypen) • hohe Erregerspezifität • geringes Erkennungsmusterrepertoire • hohes Erkennungsmusterrepertoire • kein immunologisches Gedächtnis • immunologisches Gedächtnis Teile des Immunsystems: humorale Komponenten (Bestandteil des Blutplasmas) innate adaptive Komplementsystem Antikörper Bordet, 1890, Komplementvermittelte Bakteriolyse : hitzelabile Komponente im Serum (> 30 Proteine) verstärkt (komplementiert) die Wirkung von Antikörpern. sIgA-dimer Zytokine (lösliche Regulatoren des Immunsystems) Teile des Immunsystems: zelluläre Komponenten (Leukozyten) Phagozyten Granulozyten T lymphoyctes (T cells) Neutrophile Eosinophile Basophile T helfer Zellen (TH, CD4+) zytotoxische T Zellen (Tc, CD8+) Monozyten Makrophagen (MФ) Dendritische Zellen (DCs) B lymphocytes (B cells) Antigen präsentierende Zellen (APCs) Mastzellen Natural Killer Cells (NK cells) Lymphozyten adaptive innate Phagocytes Polymorphkernige Granulozyten 60-70% Entsprechend der Färbbarkeit der Granula Neutrophile Eosinophile >90% 2-5% Bakterien/Pilze Phagozytose Parasiten Basophile Monozyten 10% Differenziert Zu MΦ oder DC 0,1-1% Allergien Degranulation Bakterien/Pilze Phagozytose Antigenpräsentation Lymphocytes innate NK cells 10% CD16, CD56 adaptive 60% Percentage of PBMCs CD3 CD4 T helper=TH Cell killing B cells T cells Immune regulation Bone marrow plasma cells 2-5% CD19 CD8 T cytotoxic=Tc Cell killing Antibody maturation Antibody secretion Angeborenes Immunsystem: Phagozyten Neutrophile Granulozyten: • Phagozytose • Mehrlappiger Kern, feine zytopl. Granula • antibakterielle Abwehr • Auswurf von “NETs” (Neutrophil Extracellular Traps) Eosinophile Granulozyten: • Phagozytose • Parasitenabwehr • toxische Enzyme in den Granula Angeborenes Immunsystem: Phagozyten „mit erweitertem Aufgabenbereich“ Dendritische Zellen: • Phagozytose • Erkennen von Erregermustern • Präsentation von Erregerbestandteilen Makrophage (Gewebe)/Monozyt (Blut): • Phagozytose • Erkennen von Erregermustern • Präsentation von Erregerbestandteilen Angeborenes Immunsystem: Mast- und NK-Zellen Mastzellen: • Histamin/Heparin in zytopl. Granula • Allergie • Parasitenabwehr Natürliche Killerzellen (NK-Zellen): • Erkennen und Abtöten von infizierten / gestressten Zellen durch tox. Enzyme • Einleiten von adaptiven Immunantworten Blood smear 95 % O,14% 4,7% Neutrophile (<90%) polymorphkernige Granulozyten (50-70%) Eosinophile (2-5%) Basophile (<1%) angeboren Makrophagen Leukozyten Monozyten (2-8%) (4000-10000/µl) im Gewebe Dendritische Zellen PBMCs NK-Zellen (10%) Lymphozyten (ca 20-45%) T-Zellen (60%) B-Zellen (2-5%) erworben Anzahl der Zellen im Blut kann Indikator für polymorphkernige bestimmte Infektionen sein Granulozyten (50-70%) Neutrophile (<90%) Eosinophile (2-5%) Basophile (<1%) angeboren Makrophagen Leukozyten Monozyten (2-8%) (4000-10000/µl) im Gewebe Dendritische Zellen PBMCs NK-Zellen (10%) Lymphozyten (ca 20-45%) T-Zellen (60%) B-Zellen (2-5%) erworben Lymphe und Lymphbahnen • Lymphe: wasserklare Flüssigkeit; nur viszeral durch Chylomikronen milchig getrübt; bis 2 L/d werden in die Blutbahn eingespeist • Gefäße und Leitungen, welche Flüssigkeit der Gewebe aufnehmen und zurück zur Blutbahn bringen (überwiegend linke Schlüsselbeinvene) Tissue distribution of haematopoiesis Background Allogeneic hematopoietic stem cell transplantation (allo-HSCT) • Treatment of – hematopoietic/ non-hematopoietic tumors – congenital disorders (e.g. immune deficiencies) • Conditioning – myeloablative high dosis chemotherapy (e.g. cyclophosphamide) 12 Gy TBI – RIC (older patients) e.g. Fludara/Treo 2-8 Gy irradiation • GvHD prophylaxis – immune suppressiva (e.g. Cyclosporine, Methotrexat) – ATG Self renewal versus differentation Non-symmetric cell division differentiation NO differentiation Oberflächemarker: Lin- (keine lineage spezifischen Marker) Sca1+; Thy1.1lo, c-kit+; CD34-/lo Extracellular factors driving Haematopoiesis Commensals Pathogens First line defences of the immune system pathogen What does protect us Before the pathogen (or commensals) can enter the tissue? Organization of mucosal immune system Mucosa-associated lymphatic tissue (MALT) http://www.nature.com/ni/multimedia/mucosal/animation/index.html Lung alveoli First line defences of the immune system Acid enviroment skin/stomach (pH 5,5): antifungal pathogen Mucus (produced by globlet cells) Cilia movement competition (commensal versus pathogen) Bacteriocidal Substances (enzymes, defensins) in secreted fluids (saliva, sudor,lachrymal) sIgA physical/ chemical barrier of skin and mucosa Mucus is formed by mucines highly negative loaded Mukoviszidose Cystic Fibrosis repeat structure (protein-domain) oligosaccharide (sulfatated, negativ loaded) First line defences of the immune system Acid enviroment skin/stomach (pH 5,5): antifungal pathogen Mucus (produced by globlet cells) Cilia movement competition (commensal versus pathogen) Bacteriocidal Substances (enzymes, defensins) in secreted fluids (saliva, sudor,lachrymal) sIgA physical/ chemical barrier of skin and mucosa First line defences of the immune system Acid enviroment skin/stomach (pH 5,5): antifungal pathogen mucosa; cilia competition (commensal versus pathogen) Bacteriocidal Substances (enzymes, defensins) in secreted fluids (saliva, sudor,lachrymal) sIgA physical/ chemical barrier of skin and mucosa First line defences of the immune system Acid enviroment skin/stomach (pH 5,5): antifungal pathogen mucosa; cilia competition (commensal versus pathogen) Bacteriocidal Substances (enzymes, defensins) in secreted fluids (saliva, sudor,lachrymal) sIgA physical/ chemical barrier of skin and mucosa Bacteriocidal substances in secreted fluids Enzymes: lysozyme murein degradation peroxidase killing by radicals lactoferrin Fe competition Bacteriocidal peptides: α-defensines β-defensines Cathelicidin (LL-37) Histatins S100 Proteine membrane penetration influence of bacterial functions Structural classes of defensines Antibacterial peptides - β-Defensines cellular sources: - Epithelial cells of the skin, Urogenital- and Respiratory tract - Monocytes In humans there are over 30 Genes for β-Defensines. The most important are: - HBD-1 constitutively in most cells - HBD-2 mainly inducible (by IL-1β, IL-22) - HBD-3 constitutively and inducible (IFN-γ, IL-22) α- and β-Defensines can exert multiple functions: - antibacterial (by pore formation) - chemotactic via CCR6 - Mast cell activation - Neo-Vascularisation - DC-maturation function of defensines Anti-bacterial peptides – S100 Proteins The most relevant S100 Proteins are: - S100A7 (Psoriasin) - S100A8 (Calgranulin A) - S100A9 (Calgranulin B) cellular sources: - epithelial cells - Leukocytes (S100A8 und S100A7) S100 proteine: either epithelial cell constitutively and inducible (IL-22) Psoriasin a The main skin protecting factor against E. coli. anti-Psoriasin Antibody Defensines: induction and immunmodulation First line defences of the immune system Acid enviroment skin/stomach (pH 5,5): antifungal pathogen mucosa; cilia competition (commensal versus pathogen) Antibody isotypes Bacteriocidal Substances (enzymes, defensins) in secreted fluids (saliva, sudor,lachrymal) sIgAdimer sIgA The Revenge of Montezuma Travelling diarrhoe The Revenge of Montezuma Travelling diarrhoe Generation of protective IgA-Antibodies needs development of MEMORY Effector functions of IgA Transcytosis of IgA into Mucosa Immunological outcome depends on Antigen-dosage and accompanying danger signals Organization of mucosal immune system Barrieren zum Schutz vor Infektion Main principles Acid enviroment skin/stomach pathogen (pH 5,5): antifungal mucosa; cilia competition (commensal versus pathogen) Bacteriocidal Substances (enzymes, defensins) in secreted fluids (saliva, sudor,lachrymal) sIgA Avoidance of adhesion bacteriocidal Clinical case A 16 year old boy has an small accident with a scratch at the right hand. Few Hours later: around the wound 3 cm Erythema with swelling/edema. Wound and surrounding appears to be warmer and painful. Clinical case A 16 year old boy has an small accident with a scratch at the right hand. Few Hours later: around the wound 3 cm Erythema with swelling/edema. Wound and surrounding appears to be warmer and painful. Rubor redness Tumor swelling Calor warming Functio laesa loss of function Celsus ca 30 AC Galen ca 150 AC Dolor pain What can trigger an inflammation? pathogen infection Injury, mechanical stress, Trauma Cell death – DANGER! Activation of the immune system Elimination of pathogen Removal of dead cells Inflammation beneficial Local inflammation Local activation of endothelial vessel cells for recruitment of immune effector mechanisms harmful Systemic inflammation Systemic activation of endothelial cells Septic shock Chronic inflammation Elimination of inflammatory stimulus No elimination of inflammatory stimulus Resolution of inflammation Tissue remodelling e.g. artherosclerosis, rheumatoid arthritis What can trigger an inflammation? pathogen Typical Biochemical structures= patterns Injury, mechanical stress, Trauma PAMPs= DAMPs=Alarmine Pathogen Associated molecular patterns Damage associated molecular patterns Pattern recognition receptors = PRRs (soluble and cell-associated) Activation of the immune system Elimination of pathogen Removal of dead cells What can trigger an inflammation? pathogen Typical Biochemical structures= patterns Injury, mechanical stress, Trauma PAMPs= DAMPs=Alarmine Pathogen Associated molecular patterns Damage associated molecular patterns Pattern recognition receptors = PRRs (soluble and cell-associated) Activation of the immune system Elimination of pathogen Removal of dead cells •äußere Membran •Peptidoglykyan •Zellmembran •(B) •Lipopolysaccharid •(A) •Porine •äußere Membran •Lipoprotein •Peptidogykan •Periplasmatischer Raum • (D) Aufbau des Lipopolysaccharids •Zellmembran •(C) •Membranproteine •O-spezifische Seitenkette (O-Antigen) •Kern-Oligosaccharid •Lipid A Fungal PAMPs •How are viruses recognized? •ssRNA viruses •use dsRNA stage •for replication What can trigger an inflammation? pathogen Typical Biochemical structures= patterns Injury, mechanical stress, Trauma PAMPs= DAMPs=Alarmine Pathogen Associated molecular patterns Damage associated molecular patterns Pattern recognition receptors = PRRs (soluble and cell-associated) Activation of the immune system Elimination of pathogen Removal of dead cells Mustererkennungrezeptoren (PRRs) • membrangebundene PRRs scavenger Rezeptoren Toll-like Rezeptoren C-Typ-Lektin-Rezeptoren Erkennung nach Opsonisierung: mit Antikörpern: Fc-Rezeptoren mit C3b: Komplement-Rezeptoren CR3 • cytosolische PRRs NOD-like Rezeptoren (NOD1, NOD2) RIG-I-likeRNA-Helikase • sezernierte Proteine Collektine: (gehören auch zu C-Typ-Lektinen) Mannose-bindendes Lectin (MBL) und surfactant protein A, D (SP-A, SP-D) Ficoline Pentraxine: Serum Amyloid, C-reaktives Protein, • endozytierende Rezeptoren • signalgebende Rezeptoren: → adaptive Immunantwort (Expression von Cytokinen , kostimulatorischen Proteinen • Komplement-Aktivierung 1.Phase: reaction of local inflammation Activation of • Plasma enzymes • Complement • Bradykinin pathogen 1) wound closure (clotting, thrombocyte activation) Physical/ chemical barrier of the skin and mucosa 2) Activation of Plasma enzymes Bradykinin dolor=pain complement Kill/Lyse pathogen Mediators Mark target (opsonization) Anaphylatoxine Chemotaxis Kallikrein-Kinin-System Coagulation Pre-kallikrein Faktor XII (Hagemann) Plasmin Trypsin Bacterielle Enzymes Snake poisson Kallikrein Kininogen Kinine (Bradykinin, Kallidin) complement MBLectin pathway Alternative pathway MBL „Pathogene surface“ Antibody Plasmaproteases C4 C2 C3b C3 convertase C3b,Bb C3 convertase C4b2b C3 C3aC3 C5 Convertase: C3b,Bb plus C3b C4b2b plus C3b C5aC3 Membrane attacking complex MAC C5 (C9)n C5b Analaphylatoxine Classical pathway Incorporation into Pathogenic membrane (pores, lysis) Komplementsystem Bordet, 1890, Komplement-vermittelte Bakteriolyse (Vibrio cholerae): hitzelabile Komponente im Serum (> 30 Proteine) verstärkt (komplementiert) die Wirkung von Antikörpern. Der MBL- und der alternative Weg sind phylogenetisch älter als der zuerst entdeckte „klassische“ Weg. Bildung des Membranangriffs-Komplexes (MAC) • Bedeutung des MAC nicht so groß; Fehlen von C5-9 erhöht nur Empfindlichkeit für Neisseria-Erkrankungen • bei Erythrocyten genügen 3-10 C5b-Moleküle, um eine Pore zu erzeugen Regulation des Komplement-Systems • wichtig, da das Komplement-System sonst auch eigene Zellen angreifen könnte • lösliche und membrangebundene Regulatoren der Komplementaktivierung C1-Inhibitor (C1INH, “serpin”) hemmt den klassischen bzw. den Lektin-Weg durch Bindung an C1r/C1s bzw. MASP Bildung der C3 convertase wird durch Bindung an C3b oder C4b verhindert (C4bbinding protein, C4bBP) bzw. Spaltung von C3b oder C4b durch Factor I (Serin-Protease) nach Bindung von C4BP, MCP,Faktor H oder CR1 Dissoziation der C3 convertase (C2b:C4b und C3b:Bb) durch den membrangebundenen decay accelerating factor (DAF = CD55) Defekt in GPI-Anker → PNH, Therapie: Eculizumab gg. C5 Komplement: Regulatoren / Inhibitoren Problem: C3 ist Substrat und Kofaktor der C3 Konvertase --- sofortiger Komplementverbrauch ohne Inhibitoren Regulatoren der Fluid Phase: - Verhindern Komplementaktivierung und Verbrauch im Plasma Beispiel: Inhibition C3-Konvertase Membrangebundene Regulatoren : - Schützen die eigenen Körperzellen vor Attacke durch Komplement Fluid Phase: CR1 C1-INH C4bp H S-Protein SP-40 Zellmembran: C1 C4b C3b C9 C9 MCP DAF CR1 HRF CD59 C4b/C3b C4b/C3b C4b/C3b C9 C9 Complement activation regulation Aufgaben des Komplementsystems Beseitigung von Immunkomplexen • Auslösen einer Entzündung über C3a und besonders C5a (→GPCR) – Degranulation von Mastzellen (Histamin, TNF-α), Eosinophilen und Basophilen – Chemotaxis von Leukozyten zur Entzündungsstelle – Freisetzung hydrolytischer Enzyme von Neutrophilen – Verstärkung der Expression von CR – Induktion von Adhäsionsproteinen auf Endothelzellen – Plättchenaggregation • Opsonisierung zur Verstärkung der Phagozytose über C3b (einige 1000 C3b-Moleküle auf der Oberfläche notwendig) • Beseitigung von Immunkomplexen über C3b und C4b diese werden an CR1-Rezeptoren an der Oberfläche von Erythrozyten gebunden; in der Milz entfernen Makrophagen über ihre Fc und CR1Rezeptoren diese Immunkomplexe und bauen sie ab (die Erythrozyten werden dabei nicht zerstört) • Lyse von Zellen durch den MAC (C5b-9) 1.Phase: reaction of local inflammation Activation of • Plasma enzymes • Mast cells Mast cell activation activated Complement Dolor pain Degranulation (few minutes) Pre-formed Bradykinin C3a C5a Anaphylatoxines Nerve cells itching Histamin Mast cells (Basophile Eosinophile) Endothelial cells Vasodilatation Rubor redness Tumor swelling anaphylactic shock Komplement activation Mast cells (Basophiles Eosinophiles) Vasodilatation Histamin Bradykinin C3a C5a Endothelial gap junctions Degranulation FcεR Blood pressure IgE crosslinking Shock 1.Phase: reaction of local inflammation Activation of • Plasma enzymes • Mast cells • macrophages What kind of PRRs do we know? pathogen Typical Biochemical structures= patterns Injury, mechanical stress, Trauma PAMPs= DAMPs=Alarmine Pathogen Associated molecular patterns Damage associated molecular patterns Pattern recognition receptors = PRRs (soluble and cell-associated) •How are viruses recognized? •ssRNA viruses •use dsRNA stage •for replication Receptores for PAMPs = Pattern recognition receptors (PRRs)? LPS LBP CD14 ?? NF-κB Pro-inflammatorische Zytokine (z.B. TNF-α) Immune response of the fruit fly (Drosophila) Nüsslein-Volhardt Jules Hoffmann Drosophila Human/Mice etc •PAMPS-TLR-Specificities •West AP, et al. 2006 in Annu. Rev. CellDev. + Biology TLRs can trigger immune response via 2 different signalling pathways only Myd88 Independent (= TRIF dependent) only Myd88 dependent TLR1/2 TLR2/6 TLR5 TLR7 TLR8 TLR9 TRIF TLR3 TLRs can trigger immune response via 2 different signalling pathways How can immune system distinguish between self and viral DNA? TLRs: Receptors as relays of differences in dangers Output: Patterned responses! Innate recognition of molecular patterns drives inflammation and T cell fate Innate Immune cells infection PAMPs (e.g. LPS Peptidoglycans) DAMPs (e.g. HSPs HMGB1) Inflammatory Mediators (e.g. cytokines) TNFα IL-12 adaptive Immune cells TH-1 IFNγ TLRs Monocytes Macrophages DCs Cell death (DANGER!) PAMPs = pathogen associated molecular patterns DAMPS = danger associated molecular patterns TLRs = Toll like receptors LPS = Lipopolysaccharide Intracellular pathogens TGF-β IL-1 IL-6 IL-23 TH17 IL-17 extracellular pathogens TLRs are located in different cell types and compartiments mainly in macrophages and mDCs mainly in pDCs NF-κB TNFα etc. IRF7 IFNβ Nucleus Also other (non-immune) cells (e.g. epithelial cells) can express TLRs Other PRRs – NOD1 and NOD2 as intracellular PRRs How can a virally infected non-immune cell, which does not express TLR3, 7 or 9 sense the viral infection and induce IFNα expression? Alternative (TLR independent) intracellular RNA recognition Intracellular DNA and RNA sensors Inhibition of virus replication by IFNα/β IFNα/β 2-5OA RNAseL Degradation of dsRNA PKR eIF2-p PKR = RNA-dependent protein kinase 2-5OA = 2´-5´ oligoadenylate synthetase translation Typ-I-Interferone Bildung • Induktion von IFN-β durch dsRNA (TLR3 oder PKR) in allen Zellen • Verstärkung autokrin oder parakrin über IFN-R , Bildung von IFN-α (wirkt dann unabhängig von NFkB) • Interferon-producing cells (IPC) (1 % der Leukozyten, sehen wie Plasmazellen aus), können 1000x mehr IFN produzieren als andere Zellen) und besitzen verschiedene TLR und differenzieren zu plasmacytoid dendritic cells (pDCs) Folgen • Bildung von Oligoadenylat-Synthetase (Synthese von 2´-5´-oligoA, aktiviert Endonuklease, baut virale RNA ab) • verstärkt Proliferation und Cytotoxizität von NK-Zellen und bewirkt Expression von Liganden für NK-Zellen (MIC-A, MIC-B) • Induktion von PKR als PRR •Other PRRs – C-type lectins C-Typ-Lektin-Rezeptoren typisch ist eine Ca2+-abhängige CRD-Domäne (carbohydrate recognition domain) • Mφ mannose receptor • DC-SIGN • Dectin-1 • Mφ mannose receptor is a constantly recycling endocytic receptor, recognition of terminal mannose/fucose > NAc-Glc (CRD) and sulphated-NAcGal • DC-SIGN (DC-specific ICAM3 grabbing non-integrin) is largely restricted to DC, recognises highmannose oligosaccharides • Dectin-1 exhibits specificity for β-(1,3/1,6)-glucans in fungal cell walls expressed on monocytes, MØ, neutrophils and subsets of DC Mφ Mannose Receptor DC-SIGN Dectin-1 http://users.path.ox.ac.uk/~cholt/Lecture1%20handout.pdf Scavenger receptors: PPRs for both infectious nonself and modified self • • • • erkennen modified LDL (mLDL) und anionische Substanzen (z.B. LPS, Lipoteichonsäuren, einige Polynukleotide) Aufnahme von acetyliertem und oxidiertem LDL und haben eine Bedeutung bei der Entstehung der Arteriosklerose (CD 36 und SR-A) Aufnahme von Listerien, Staphylokokken, Neisserien und apoptotischen Zellen (SR-A) Aufnahme von Streptokokken (MARCO, MAcrophage Receptor with COllagenous structure) one receptor – many ligands LDL receptor ist spezifischer splice-Varianten 2 TM N-term. extrazellulär http://miami.uni-muenster.de/servlets/DerivateServlet/Derivate-131/d_einleitung.pdf Alarmins = DAMPs (damage/danger associated molecular patterns) Necrotic dying cells release danger signals ECM MSU infection Inflammasome activation ATP Cell death Trauma Injury burn DC HMGB1 HSPs inflammation Plasma enzymes HMGB = high mobility group B HSPs = heat shock proteins MSU = monosodium urate; uric acid crystals ECM = extra cellular matrix ECM Degradation (e.g. Hyalunoric acid) TLR Stimulation (also other receptors) cytokines Inflammasome Partikel, die zum lysosomalen Schaden (und damit mitochondrialen Stress) führen, aktivieren das Inflammasom und damit Entzündung Beispiele: Harnsäurekristalle (Gicht), Asbest, Nanopartikel (Kosmetika), Aluminiumsalze (Adjuvanz) fMet mtDNA DAMPs get released by necrotic but not apoptotic cells DAMPs can get inactivated during Apoptosis Mustererkennungrezeptoren (PRRs) • membrangebundene PRRs scavenger Rezeptoren Toll-like Rezeptoren C-Typ-Lektin-Rezeptoren Erkennung nach Opsonisierung: mit Antikörpern: Fc-Rezeptoren mit C3b: Komplement-Rezeptoren CR3 • cytosolische PRRs NOD-like Rezeptoren (NOD1, NOD2) RIG-I-likeRNA-Helikase • sezernierte Proteine Collektine: (gehören auch zu C-Typ-Lektinen) Mannose-bindendes Lectin (MBL) und surfactant protein A, D (SP-A, SP-D) Ficoline Pentraxine: Serum Amyloid, C-reaktives Protein, • endozytierende Rezeptoren • signalgebende Rezeptoren: → adaptive Immunantwort (Expression von Cytokinen , kostimulatorischen Proteinen • Komplement-Aktivierung Summary PRRs Summary PRR signaling Other cytokines (IL-1, TNF-α) stimulate similar pathways IL-17 IL-1R Such cytokines activate (amplify) inflammation – they act as danger signals ! Blutgefäß Gewebe (Haut) Zytokine machen Entzündung Chemokine locken Leukozyten ins entzündete Gewebe Haut (Epithel) Chemokine Zytokine Gefäßwand (Endothel) transmigration Slow rolling rolling Blutfluss Leukozyt Entzündungsbotenstoffe weisen den Weg zur Infektionsstelle Activation of inflammation by „Danger“ is required to initiate an immune response apoptotic cell death necrotic cell death Pathogen (PAMPS) NO danger Damage (DAMPS) DC DC Ag presen tation soluble Mediators (e.g. cytokines) T Ag presen tation costimulation T Adjuvantien wirken über PRRs • „verstärken auf unspezifische Weise die spezifische Immunität gegenüber einem Antigen“ (Ramon, 1925) werden häufig bei Totimpfstoffen zugesetzt lange vermutete Wirkungsweisen: Depoteffekte (verzögerte Freisetzung von Ag), unspezifische Migration von Zellen zum Injektionsort (Granulombildung), mitogener Effekt, ... entfalten ihre Wirkung zumindest teilweise auch über PRRs • Freunds Adjuvans (nicht beim Menschen, zu toxisch!) • • • – komplettes FA (cFA): Mineralöl, Emulgator, hitzeinaktivierte Mycobakterien – inkomplettes FA (iFA): Mineralöl, Emulgator • • Bordetella pertussis Aluminiumsalze – Aluminiumsulfat oder Aluminiumhydroxid • definierte Adjuvantien ... aber für die Zulassung gibt es große Hürden − MF59 (mit Squalen) im Grippeimpfstoff FLUAD − MPL (Monophosphoryl-Lipid A) bei einem speziellen HBV-Impfstoff (Fendrix) − CpG-basiertes Adjuvans (VaxImmune) (immer noch in Erprobung) Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFα, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors Anlocken und Extravasation von Neutrophilen Glykoprotein-Selektin CXCL8 (IL-8) wirkt chemotaktisch auf Neutrophile Chemokin-Chemokin-Rezeptor bacterial products (fMLP), C5a, LTB4 → Ca2+ → Cytoskelett Integrin-Integrin-Ligand PECAM Neutrophile wandern schneller zum Entzündungort (1 d) als Monozyten (2-3 d) P-selectin glycoprotein ligand-1 P(platelet)-Selektin aus intrazellulären Vesikeln (Weibel-Palade-bodies) Sekunden nach Signal, z. B. Histamin an die Zelloberfläche E(endothelial)-Selektin: Neusynthese induziert durch TNF-α oder IL-1 über NFκB TNF-α, IL-1 induzieren Bildung von Zell-adhäsionsmolekülen, erhöhte Gefäßpermeabilität (TNF-α) IL-6 IL-12 Aktivierung von NK-Zellen Leber: Bildung von AkutPhase-Proteinen Fieber (IL-1, TNF-α, IL-6) Neutrophil ways of KILLING Gewebe (Haut) Haut (Epithel) Komplement aktivierung MΦ Mast zelle Histamin Blutgefäß DCs PGs Öffnung Vaso Tight dilatation junctions Chemokine Zytokine (z.B. TNFα, IL-1) (z.B. IL-8 = CXCL8) Influx C +AK Induktion Influx Adhäsions Granulozyten moleküle PAMPs = pathogen associated molecular patterns DAMPS = danger/damage associated molecular patterns PRRs = pattern recognition receptors