Immunkontrolle von Leukämie stammzellen
Werbung

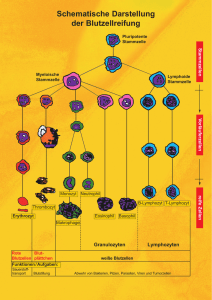
419 AK TUELL Träger des Otto Naegeli-Preises 2016 Immunkontrolle von Leukämie­ stammzellen Adrian F. Ochsenbein Universitätsklinik für Medizinische Onkologie, Inselspital, Universität Bern Unser Immunsystem kann spezifisch Antigen-exprimierende Krebszellen erkennen. Seit vielen Jahren werden deshalb Immuntherapien getestet, die das Immunsystem spezifisch gegen Krebszellen aktivieren. Otto Naegeli-Preis für die medizinische Forschung Der «Otto Naegeli-Preis für die medizinische Forschung» wurde 1960 zum Andenken an den 1938 Durch viele dieser Immuntherapien konnte zwar das Immunsystem messbar aktiviert werden, ein klinischer verstorbenen grossen Wissenschaftler und Lehrer für Innere Medizin an der Universität Zürich, Professor Otto Naegeli, geschaffen. Der Preis gilt Effekt im Sinne einer Reduktion des Tumors wurde ­ jedoch selten erreicht. Durch die Weiterentwicklung T-Zellen und Tumorzellen wurden in den letzten Jahren neue Immuntherapien entwickelt. Die T-Zelle erkennt die Antigen-präsentierende Zelle mittels ihres T-Zell-Rezeptors. Daneben interagieren die beiden Zellen mittels verschiedener immun-aktivierender und immun-sup- Preise der Schweiz; er geniesst hohe internationale Anerkennung. Der «Otto Naegeli-Preis» bezweckt die Förderung der medizinischen bzw. biomedizinischen Forschung und wird in der Regel alle zwei Jahre an Forschende in der Schweiz verliehen. Die Preis ­ Verständnis der molekularen Mechanismen zwischen als einer der bedeutendsten wissenschaftlichen summe beträgt zurzeit CHF 200 000. Mit dem Preis sollen auch jüngere Forschende zu weiteren Leistungen angeregt werden. molekularer Methoden und durch ein verbessertes primierender Ligand/Rezeptor-Paare (immune checkgezielt durch monoklonale Antikörper blockiert werden symmetrisch in zwei neue Stammzellen teilen, ande- (immune Checkpoint-Blockade). Die ersten Studien rerseits können sie sich asymmetrisch in eine Stamm- wurden mit CTLA-4-blockierenden Antikörpern bei zelle und eine differenziertere Krebszelle teilen Melanomen durchgeführt. Durch die Blockierung von (Abb. 1). Krebsstammzellen sind aus einer klinischen CTLA-4 werden vermehrt T-Zellen aktiviert. Die Immun- Sichtweise von Interesse, da sie gegen die meisten vor- therapie zeigte gegenüber der Standard-Chemotherapie handenen Therapien wie Chemotherapien, Bestrah- eine deutliche Verlängerung des Gesamtüberlebens. lung oder zielgerichtete Medikamente wie Tyrosin Weiterführende Studien untersuchten die Wirksam- kinase-Inhibitoren resistent sind. Die Tatsache, dass keit einer Blockade der PD-1- (exprimiert auf T-Zellen) Immuntherapien zu Langzeitstabilisierung oder even- und PD-Ligand-1- (exprimiert auf Tumorzellen) Inter- tuell sogar zur Heilung von Patienten mit metastasie- aktion. Anti-PD-1- und Anti-PD-Ligand-1-blockierende renden Melanomen führen können, lässt vermuten, Antikörper zeigen eine gute Wirksamkeit bei verschie- dass das Immunsystem Krebsstammzellen in einem denen Tumorerkrankungen wie dem Melanom, nicht Teil der Patienten eliminieren kann. Das Verständnis kleinzelligen Bronchuskarzinomen, Nierenzellkarzino- der molekularen Interaktionen zwischen Krebsstamm- men und anderen. Typischerweise profitieren Patienten, zellen und zytotoxischen T-Zellen kann deshalb zu bei denen eine Tumorreduktion erreicht wird, langzeitig neuen Therapieansätzen gezielt gegen Krebsstammzel- mit rückfallfreien Verläufen, bei Patienten mit meta len führen. ­ stasierenden Melanomen bis zu zehn Jahren. ­ sich selbst zu erneuern. Einerseits können sie sich ­ points). Signalwege, welche die T-Zelle hemmen, können Die Leukämie gilt als paradigmatisches Beispiel einer Leukämiestammzellen befinden sich wie hämato Krebsstammzellen poetische Stammzellen am Beginn der hierarchischen Differenzierung. Es wird angenommen, dass die gene- renzierung von krankheitsinduzierenden Krebsstamm- tischen Veränderungen, die zur Leukämie führen, in zellen ausgeht, wurde initial für Leukämien dokumen- hämatopoetischen Stammzellen auftreten und diese tiert und ist nun auch für verschiedene solide Tumoren dadurch in eine Leukämiestammzelle transformieren. akzeptiert. Krebsstammzellen haben die Fähigkeit, Leukämiestammzellen befinden sich im Knochenmark SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2016;16(18–19):419– 422 ­ Das Konzept, dass Krebs in einer hierarchischen Diffe- Adrian F. Ochsenbein ­ Krebserkrankung, die von Stammzellen ausgelöst wird. 420 ktuell A ­ Abbildung 1: Symmetrische vs. asymmetrische Zellteilung einer Leukämiestammzelle. Durch die unterschiedliche Ausrichtung des Spindelapparates während der Zellteilung werden Moleküle, die mit der Differenzierung der Zelle assoziiert sind (cell fate determinants), unterschiedlich auf die Tochterzellen verteilt. Durch die Balance der symmetrischen vs. asymmetrischen Zellteilung einer Leukämiestammzelle wird deshalb die Differenzierung der Leukämie sowie deren Aggressivität bestimmt. zellen. ­ phagen leukämische und hämatopoetische Stamm der Leukämiestammzellen wie Quiescence (Ruhezu ­ sympathische Nervensystem, Adipozyten und Makro- der sogenannten Stammzellnische. Viele Funktionen ­ in einer spezialisierten Umgebung (microenvironment), ­ ­ stand), Proliferation oder Differenzierung (asymmetri ­ durch Interaktion mit der Nische reguliert. For Immunzellen als Bestandteil der Nische ­ sche vs. symmetrische Zellteilung, Abb. 1) werden Knochenmark auch ein primäres und sekundäres lym- poetische Stammzellen ähnliche Mechanismen nut- phatisches Organ dar. Entsprechend findet sich im zen, um mit der Nische zu interagieren. Stammzellen Knochenmark eine substanzielle Anzahl differenzierter befinden sich im Knochenmark im trabekulären Teil T- und B-Zellen, Plasmazellen, dendritische Zellen, in enger Nachbarschaft zu Sinusoiden und anderen Neutrophile und Makrophagen. Diese Immunzellen Blutgefässen. Endothelzellen und perivaskuläre Zellen sind somit Bestandteil der Stammzellnische und bilden produzieren Chemokine und Stammzellfaktoren, die eine Art «Immun-Nische». Lymphozyten stellen den verantwortlich sind für die Aufrechterhaltung und Re- grössten Teil der mononukleären Zellen im Knochen- gulation der Stammzellen. Zusätzlich regulieren das mark dar. Sie sind im gesamten Knochenmarkparen- SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM ­ ­­­­ Neben der Funktion als blutbildendes Organ stellt das Jahre dokumentieren, dass leukämische und hämato- ­ schungsergebnisse verschiedener Gruppen der letzten 2016;16(18–19):419– 422 421 hämatopoetische Stammzellen umgeben. Es wird des- phoide Aggregate. Klinische und experimentelle Daten halb davon ausgegangen, dass diese regulatorischen dokumentieren eine wichtige Rolle von CD4-positiven T-Zellen eine immunprivilegierte Nische im Knochen- T-Zellen in der Regulation der Hämatopoese. CD4-T- mark aufbauen, die hämatopoetische Stammzellen vor Zellen produzieren Zytokine, die für die Regulation der einer Zerstörung durch Immunzellen schützen. Diese Hämatopoese wichtig sind, wie Interleukin-3 und GM- Nische kann auch von leukämischen Stammzellen ge- CSF. CD4+CD25+-regulatorische T-Zellen repräsentieren nutzt werden, um sich der Eliminierung durch Zellen ein Drittel aller CD4-positiven T-Zellen im Knochen- des Immunsystems zu entziehen. ­ chym verteilt und bilden zum Teil organisierte lym- ­ ktuell A mark, ein Anteil, der deutlich höher ist als zum Beispiel in anderen lymphatischen Organen wie Lymphknoten regulatorische T-Zellen zur Quiescence der hämato ­ oder Milz. Experimentelle Daten dokumentieren, dass poetischen Stammzelle beitragen und die myeloide Die Regulation von hämatopoetischen Stamm- und Vorläuferzellen während einer Immunaktivierung Differenzierung hemmen. Durch In-vivo-Mikroskopie Das Knochenmark muss nicht nur den kontinuierlichen konnte gezeigt werden, dass regulatorische T-Zellen Ersatz von Blutzellen während der Hämostase sichern, sondern auch auf einen erhöhten Bedarf während ­ einer Stresssituation reagieren, zum Beispiel während einer Infektion oder einer Chemotherapie («NotfallHämatopoese»). Die Steuerung dieses erhöhten Bedarfs an Immunzellen während Infektionen erfolgt durch Erkennung konservierter mikrobialer Produkte mittels Toll-like-Rezeptoren und solubler Faktoren wie Typ I- und Typ-II-Interferone (IFN) oder Tumornekrosefaktor-alpha (TNF-α). Daneben spielen Zell-Zell-Interaktionen zwischen hämatopoetischen Stammzellen ­ (TNFR)-Superfamily-Molekül CD27 ist auf Lympho ­ Notfall-Hämatopoese. Das Tumornekrose-Rezeptor ­ und Immunzellen eine Rolle in der Regulierung der zyten und auf hämatopoetischen Stammzellen exprimiert. CD70, der einzige bekannte Ligand von CD27, wird von aktivierten lymphatischen Zellen exprimiert. Die Interaktion von CD70 und CD27 auf der hämatopoetischen Stammzelle während einer Infektion ­ induziert die vermehrte Differenzierung der Stammzelle, wodurch es zu einer bedarfsadaptierten Produktion von Immunzellen kommt. Verschiedene der Immunmechanismen, die hämatopoetische Stammzellen während einer bedarfsadaptierten Hämatopoese steuern, beeinflussen ebenfalls die leukämische Stammzelle. Obwohl diese Mechanismen evolutionär entstanden sind, um den erhöhten Bedarf an Immunzellen bei einer akuten Infektion ­ sicherzustellen, können dieselben Mechanismen im Falle einer Leukämie zur Progression der Erkrankung SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2016;16(18–19):419– 422 hämatopoetischen Stammzellen und zu deren Pro ­ liferation und Mobilisierung. Der gleiche Effekt wird auf Leukämiestammzellen der chronisch myeloischen Leukämie beobachtet. IFNα wurde während Jahrzehn­ ten vor der Einführung von Tyrosinkinase-Inhibitoren bei der Behandlung der chronisch myeloischen Leuk ­ Abbildung 2: Interaktionen von zytotoxischen T-Zellen mit Leukämiestammzellen. Die zytotoxische T-Zelle kann durch ihren T-Zell-Rezeptor die Antigen-präsentierende Stammzelle erkennen und eliminieren (A). Eine aktivierte zytotoxische T-Zelle sezerniert Interferon-gamma (IFNγ) (B) und Tumornekrosefaktor-alpha (TNF-α) (C). Beide Zytokine führen zur Proliferation der Leukämiestammzelle. IFNγ führt zudem zur erhöhten Expression von PD-L1 auf Leukämiestammzellen und dadurch zur Hemmung der zytotoxischen T-Zelle. Die Interaktion von CD70 mit CD27 auf den Leukämiestammzellen führt ebenfalls zur Proliferation und zusätzlich zu einem erhöhten Anteil an Zellen in symmetrischer Zellteilung (D). ­ führen. IFNα führt zur Aktivierung von ruhenden ämie eingesetzt. Parallele Effekte wurden auch für das T-Zell-Effektor-Zytokin Interferon-gamma (IFNγ) doku- 422 ­ mentiert (Abb. 2). IFNγ kann sowohl in hämatopoe CD70/CD27-Interaktion kann in präklinischen Maus- ­ ktuell A modellen durch monoklonale Antikörper blockiert einer erhöhten Proliferation und im Falle der Leukämie werden. Dies führt zu einer verzögerten Krankheits- zu einer Progression der Erkrankung führen. Zudem entwicklung und verlängertem Überleben. ­ tischen wie auch in leukämischen Stammzellen zu ­ führt IFNγ zu einer Aufregulierung des immun- ­ ämiestammzellen. Dadurch verhindert die Leukämie um hämatopoetische Stammzellen während einer ten Proliferation und Expansion von hämatopoeti- Infektion zu steuern, führen im Falle einer malignen schen und leukämischen Stammzellen, was im Falle Transformation dieser hämatopoetischen Stammzelle einer Leukämie zur Krankheitsprogression führt. zu einer leukämischen Stammzelle, zu deren Expan- Von besonderem therapeutischem Interesse sind Zell- sion und Krankheitsprogression. Verschiedene dieser Zell-Interaktionen zwischen T-Zellen und Leukämie Interaktionen können therapeutisch angegangen wer- ­ ­ den, um die Leukämiestammzelle zu eliminieren. nen. Wir konnten kürzlich dokumentieren, dass die Obwohl die Leukämie als Modellerkrankung für eine Interaktion von CD70 mit CD27 zu einer Vermehrung Stammzell-induzierte Krebsart gilt, ist die Krebsstamm- von leukämischen Stammzellen in der chronischen zellhypothese bei verschiedenen soliden Tumoren nun und akuten myeloischen Leukämie führt. Die Vermeh- ebenfalls akzeptiert. Die Definition der molekularen rung wird induziert durch eine erhöhte Zellteilung Interaktionen zwischen dem Immunsystem und Krebs- und vor allem durch eine erhöhte Rate an symmetri- stammzellen wird deshalb zu neuen Therapiemöglich- scher Zellteilung (Abb. 1). Dadurch entsteht ein höherer keiten führen, die den Ursprung der Krebsentstehung Anteil von undifferenzierten Leukämiezellen mit ge- direkt angehen. chronisch myeloischen Leukämie exprimieren CD27, wird ausgelöst durch Interaktion mit CD70, das auf ­ Adrian Ochsenbein ­ jedoch nicht den Liganden CD70. Der CD27-Signalweg aktivierten T-Zellen exprimiert wird. Interessanterweise Universitätsspital Bern exprimieren die aggressiveren Stammzellen der akuten Universitätsklinik für ­ INSELSPITAL ­ stammzellen, die therapeutisch blockiert werden kön- Prof. Dr. med. Chefarzt ­ Immunmechanismen, die evolutionär entstanden sind, eliminiert wird. TNF-α führt ebenfalls zu einer erhöh- ­­­ stammzelle, dass sie von der zytotoxischen T-Zelle steigerter Aggressivität. Leukämiestammzellen der Korrespondenz: Schlussfolgerungen und Ausblick ­ ­ supprimierenden Moleküls PD-L1 auf den Leuk Verdankung Ich danke dem Schweizerischen Nationalfonds, der Schweizerischen und der Bernischen Krebsliga sowie der Berger Janser Stiftung für die Unterstützung der hier beschriebenen Projekte während vieler Jahre. Zudem danke ich Carsten Riether für die Mitwirkung beim Verfassen dieses Artikels. Disclosure statement myeloischen Leukämie (AML) sowohl CD27 als auch Freiburgstrasse 10 CD70. Dies bedeutet, dass die AML-Stammzellen ihre Der Autor hat keine finanziellen oder persönlichen Verbindungen im Zusammenhang mit diesem Beitrag deklariert. Malignität durch erhöhte Proliferation und symmetri- Porträt CH-3010 Bern adrian.ochsenbein [at]insel.ch sche Zellteilung direkt aufrechterhalten können. Die SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM ­ Medizinische Onkologie 2016;16(18–19):419– 422 © KEYSTONE | Alessandro della Valle