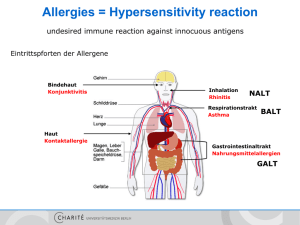
Funktion und pathophysiologische Bedeutung Granzym B
Werbung

Universitätsklinikum Ulm Institut für Transfusionsmedizin und Immungenetik Direktor: Prof. Dr. med. Hubert Schrezenmeier Funktion und pathophysiologische Bedeutung Granzym B-exprimierender regulatorischer B-Zellen Dissertation zur Erlangung des Doktorgrades der Humanbiologie (Dr. biol. hum.) der Medizinischen Fakultät der Universität Ulm vorgelegt von Stefanie Daniela Lindner Kronach 2015 Amtierender Dekan: Prof. Dr. Thomas Wirth 1. Berichterstatter: apl. Prof. Dr. med. Bernd Jahrsdörfer 2. Berichterstatter: Prof. Dr. med. Thomas Barth Tag der Promotion: 12. Juni 2015 Teile dieser Dissertation wurden bereits in folgenden Fachartikeln veröffentlicht: Cancer Research 2013 Lindner S, Dahlke K, Sontheimer K, Hagn M, Kaltenmeier C, Barth TF, Beyer T, Reister F, Fabricius D, Lotfi R, Lunov O, Nienhaus GU, Simmet T, Kreienberg R, Möller P, Schrezenmeier H, Jahrsdorfer B: Interleukin 21-induced granzyme Bexpressing B cells infiltrate tumors and regulate T cells. Cancer Research 2013, 73 (8), 2468-2479. doi: 10.1158/0008-5472.CAN-12-3450. Epub 2013 Feb 5. J Immunol 2015 Kaltenmeier C, Gawanbacht A, Beyer T, Lindner S, van der Merwe D, Härter G, Grüner B, Lotfi R, Kern P, Bommer M, Schrezenmeier H, Kirchhoff F, Jahrsdörfer B: CD4+ T cell-derived IL-21 and deprivation of CD40 signaling favors the in-vivo development of granzyme B-expressing regulatory B cells in HIV patients. J Immunol 2015, 194(8):3768-77. doi: 10.4049/jimmunol.1402568. Epub 2015 Mar 16. Copyright 2015. The American Association of Immunologists, Inc. Inhaltsverzeichnis I I. Inhaltsverzeichnis I. Inhaltsverzeichnis................................................................................................. I II. Abkürzungsverzeichnis ...................................................................................... III 1. Einleitung ............................................................................................................ 1 1.1. Regulatorische Zellen des Immunsystems ................................................ 1 1.2. Regulatorische B-Zellen ............................................................................ 3 1.3. Charakterisierung von regulatorischen B-Zellen ........................................ 5 1.4. Stimulation von regulatorischen B-Zellen .................................................. 7 1.5. IL-21 als Schlüsselzytokin zur Induktion von regulatorischen B-Zellen...... 9 1.6. Granzym B als regulatorische Protease .................................................. 11 1.7. Zielsetzung der Arbeit .............................................................................. 13 2. Material und Methoden ..................................................................................... 15 2.1. Material .................................................................................................... 15 2.1.1. Geräte und Laborbedarf .................................................................... 15 2.1.2. Medien und Reagenzien .................................................................... 16 2.1.3. Software und Programme .................................................................. 17 2.1.4. Puffer und Lösungen ......................................................................... 18 2.1.5. Stimulantien und Inhibitoren .............................................................. 18 2.1.6. Antikörper und Isolations-Kits ............................................................ 19 2.1.7. Zellmaterial ........................................................................................ 21 2.2. Methoden ................................................................................................. 21 2.2.1. Zellisolation ........................................................................................ 21 2.2.1.1. Periphere mononukleäre Zellen (PBMC) ........................................... 21 2.2.1.2. T- und B-Lymphozyten ...................................................................... 22 2.2.1.3. Tumor-infiltrierende Lymphozyten (TILs) ........................................... 22 2.2.2. Durchflusszytometrische Färbungen ................................................. 22 2.2.3. CFSE-Färbung und Proliferationsversuche ....................................... 23 2.2.4. Western Blot ...................................................................................... 23 2.2.4.1. Zellkultur ............................................................................................ 23 2.2.4.2. Zelllyse und Proteinbestimmung ........................................................ 24 2.2.4.3. Diskontinuierliche Polyacrylamid-Gelelektrophorese (SDS-PAGE) ... 24 2.2.4.4. Proteintransfer (Blotting) .................................................................... 25 2.2.4.5. Immunodetektion ............................................................................... 25 2.2.5. Immunohistochemie - Fluoreszenzfärbung ........................................ 26 Inhaltsverzeichnis II 2.2.6. Statistische Auswertung .................................................................... 27 3. Ergebnisse ........................................................................................................ 28 3.1. Regulatorische B-Zellen aus peripherem Blut ......................................... 28 3.1.1. Die Stimulation mit Interleukin 21 induziert einen regulatorischen Phänotyp in B-Zellen ...................................................................................... 28 3.1.2. Immunregulatorischer Effekt Granzym B-sezernierender B-Zellen .... 33 3.2. Regulatorische GrB+ B-Zellen in humanem Gewebematerial .................. 36 3.2.1. Screening von humanen pathologischen Präparaten auf die Anwesenheit von GrB+ Breg ............................................................................ 37 3.2.2. Tumor-infiltrierende Lymphozyten (TILs) aus Patienten mit Hals-KopfTumoren ......................................................................................................... 48 3.2.3. Regulatorische B-Zellen bei HIV-Infektionen ..................................... 50 4. Diskussion ......................................................................................................... 53 5. Zusammenfassung............................................................................................ 61 6. Literaturverzeichnis ........................................................................................... 62 Danksagung ........................................................................................................ ..75 Lebenslauf ............................................................................................................. 77 Abkürzungsverzeichnis II. Abkürzungsverzeichnis AB Acrylamid / Bisacrylamid anti-BCR Antikörper gegen den B-Zell-Rezeptor anti-CD3 Antikörper gegen CD3 (Muromonab) anti-CD3/CD28 Antikörper gegen CD3 und CD28 auf T-Zellen ACK Ammoniumchlorid-Kaliumhydrogencarbonat AIA Antigen-induzierte Arthritis AIM-V Adoptive Immunotherapy Media AK Antikörper AP-1 Activator Protein 1 APC Allophycocyanin APS Ammoniumpersulfat APZ Antigen-präsentierende Zelle B10 B-Zelle, die Interleukin-10 exprimiert BAFF B-Zell aktivierender Faktor BCA Bicinchoninic Acid BCL-6 B Cell Lymphoma 6 protein B-CLL Chronisch lymphatische Leukämie vom B-Zell-Typ BCR B-Zell-Rezeptor BD Becton Dickinson BID BH3-only proapoptotisches Protein Blimp-1 B-lymphocyte-induced maturation protein 1 Breg regulatorische B-Zelle BSA Bovines Serumalbumin BZ B-Zelle cAMP Zyklisches Adenosinmonophosphat CASP Cytohesin-associated scaffolding Protein CCR7 C-C Chemokinrezeptor 7 CD Cluster of Differentiation CD40L CD40-Ligand CFSE Carboxyfluorescein-Succinimidyl-Ester CIA Kollagen-induzierte Arthritis CLB Zelllysepuffer CpG-ODN CpG-Oligodesoxynukleotide III Abkürzungsverzeichnis CTLA-4 Cytotoxic T Lymphocyte Antigen 4 Cy3 Cyanin-3 Fluoreszenzfarbstoff Cy5 Cyanin-5 Fluoreszenzfarbstoff DAPI 4′,6-Diamidin-2-phenylindol DBP DNA-binding Protein DC dendritische Zelle ddH2O doppelt destilliertes Reinstwasser DNA Desoxyribonukleinsäure DNA-PK DNA-abhängige Proteinkinase DTH zellvermittelte Allergie (delayed-type hypersensitivity) DTT Dithiothreitol EAE Experimentelle autoimmune Enzephalomyelitis ECL Enhanced Chemoluminescence EDTA Ethylendiamintetraacetat elF2b eukaryotischer Translations-Initiationsfaktor 2b FACS Fluorescence Activated Cell Sorting FcR Fc-Rezeptor Fc-Teil Konstanter Antikörperteil FGFR1 Fibroblast Growth Factor 1 FITC Fluoresceinisothiocyanat FoxP3 Forkhead-Box-Protein P3 FSC Vorwärtsstreulicht (Forward Scatter) GB Gel-Puffer GIFT15 Fusionsprotein von GM-CSF und IL-15 GITR Glucocorticoid-induced-tumor-necrosis-factor-Rezeptor GluR3 Glutamatrezeptor 3 GM-CSF Granulocyte/Macrophage Colony-Stimulating Factor GrB Granzym B GvHD Graft versus Host disease, Transplantat-Wirt-Reaktion HAART hochaktive antiretrovirale Therapie HEPES 2-(4-(2-Hydroxyethyl)-1-Piperazinyl)-Ethansulfonsäure Her2/neu human epidermal growth factor receptor 2, erb-B2, c-erbB2 HIV Humanes Immundefizienz-Virus HRP Meerrettichperoxidase IV Abkürzungsverzeichnis V HRS-Zellen Hodgkin/- Reed-Sternberg-Zellen HSP70 Heat Shock Protein 70 IDO Indolamin-2,3-Dioxygenase Ig Immunglobulin IL Interleukin IL-21 Interleukin-21 IL-21R Interleukin-21-Rezeptor IFN Interferon ITAM Immunoreceptor Tyrosine-based Activation Motif JAK Janus-Kinase LPS Lipopolysaccharide MACS Magnetic Activated Cell Sorting MDSC Myeloid-derived suppressor cell MFI Mediane Fluoreszenzintensität MHC Major Histocompatibility Complex Nef Negative regulatory factor NF90 Nuclear Factor 90 NF-κB Nuclear Factor kappa-light-chain-enhancer of activated B cells NK Natürliche Killer-Zellen NSCLC nicht-kleinzelliges Lungenkarzinom OKT3 Muromonab (monoklonaler Antikörper gegen CD3) OS overall survival PARP-1 Poly(ADP-Ribose)-Polymerase 1 PBMC Periphere mononukleäre Blutzellen PBS Phosphat-Buffered Saline PE Phycoerythrin Pe-Cy5 Phycoerythrin-Cyanin 5 pDC Plasmazytoide dendritische Zelle PD-L1 programmed cell death ligand 1 (CD274) PFA Paraformaldehyd PI Propidiumiodid pT1 kleiner Primärtumor (postoperative histopathologische TNM Klassifikation) PVDF Polyvinylidenfluorid Abkürzungsverzeichnis RA Rheumatoide Arthritis rpm rounds per minute RPMI „Roswell Park Memorial Institute“ RT Raumtemperatur SDS Sodium Dodecyle Sulfate RFS recurrence-free survival SDS-PAGE SDS-Polyacrylamidgelelektrophorese SLB SDS-Loading Buffer SLE Systemischer Lupus Erythematodes SEM Standardfehler (Standard Error of the Mean) SSC Seitwärtsstreulicht (Side Scatter) STAT Signal Transducer and Activator of Transcription TBS Tris-Buffered Saline TBS-T TBS-Tween TCR T-Zell-Rezeptor TCR-ζ T-Zell-Rezeptor ζ-Kette Teff effektor T-Zelle TEMED Tetramethylethylendiamin TFH follikuläre T-Helferzelle TGF-β Transforming Growth Factor β TH1 bzw. TH2 T-Helferzelle Typ 1 und Typ 2 TH17 T-Helferzelle, produziert IL-17 TILs Tumor-infiltrierende Lymphozyten TIL-B Tumor-infiltrierende B-Zellen TLR-9 Toll-like Rezeptor 9 TNF Tumor-Nekrose-Faktor Tr1 Typ 1 regulatorische T-Zelle (IL-10 Ausschüttung) Treg regulatorische T-Zelle (CD4+-CD25+-FoxP3) TZ T-Zelle WB Western Blot VI Einleitung 1 1. Einleitung 1.1. Regulatorische Zellen des Immunsystems Die Hauptaufgabe der adaptiven Immunabwehr besteht darin, Krankheitserreger zu bekämpfen und dem Körper eine langanhaltende Immunität gegen Infektionen zu gewährleisten. Hieran sind hauptsächlich T- oder BLymphozyten (TZ, BZ) beteiligt, deren Aufgaben, Funktionen und Zusammenspiel in diesem Rahmen sehr gut untersucht sind. Im Laufe der letzten Jahrzehnte sind Subpopulationen diverser Immunzellen identifiziert worden, die neben ihren „klassischen“ Funktionen zur Immunabwehr auch regulatorische und immunsuppressive Aufgaben übernehmen und somit die Funktionalität anderer Zelltypen beeinflussen können. Die bekanntesten dieser Zellen sind regulatorische CD4+CD25+(FoxP3+) T-Zellen (Treg), wobei bei diesem Zelltyp bereits weitere Subtypen mit regulatorischen Potential identifiziert wurden (z.B. IL-10+ regulatorische T-Zellen Typ 1 (Tr1), CD8+CD25+ T-Zellen, etc.) [95, 114, 159]. Treg nutzen verschiedene Mechanismen, um andere Immunzellen zu inhibieren. Hierzu zählen die Ausschüttung inhibitorischer Zytokine wie Interleukin 10 (IL-10), Transforming Growth Factor β (TGF-ß) oder Interleukin 35 (IL-35), was zur Hemmung der Aktivität von Antigen-präsentierenden Zellen (APZ) oder Effektor-TZellen (Teff) führt, Oberflächenrezeptoren sowie Zell-Zell-vermittelte Kontakte Cytotoxic-T-Lymphocyte-Antigen-4 über (CTLA-4), die Gluco- corticoid-induced-tumor-necrosis-factor-Rezeptor (GITR) und CD25 (der α-Kette des Interleukin-2-Rezeptors) [95, 114, 159]. So kann die Expression von CTLA-4 die Aktivität von APZ hemmen und dadurch die Bildung von T eff verhindern. Darüber hinaus kann die Bindung von CTLA-4 an die kostimulatorischen Moleküle CD80 und CD86 auf dendritischen Zellen (DC) das Trp-spaltende Enzym Indolamin-2,3-Dioxygenase (IDO) aktivieren, was zu einem Absinken der lokalen Tryptophan-Konzentration und der Produktion von Kynureninen führt, die als inhibitorische Moleküle die T-Zell-Proliferation hemmen [31, 64]. Durch die Aktivierung von GITR auf murinen CD4+CD25+ Treg wird Zell-ZellKontakt vermittelt die Expression der Serinprotease Granzym B induziert. Diese kann zytotoxisch aktiv werden und Apoptose von T eff induzieren [61]. Auch naive CD4+FoxP3+ Treg in der Umgebung von Tumoren können GrB exprimieren und Perforin-abhängig den Zelltod von NK und CD8+ TZ hervorrufen [28]. Einleitung 2 Treg haben eine hohe CD25-Expressionsrate, die dazu führt, dass diese Zellen stark abhängig von exogenem IL-2 sind und durch Aufbrauchen dieses Moleküls eine inhibitorische Wirkung auf die Aktivierung und Expansion von T eff haben [121, 138]. Neben Treg existieren noch weitere Zellpopulationen, die eine immunregulatorische Wirkung besitzen und in Tabelle 1 zusammengefasst sind [168]. Hierzu zählen regulatorische B-Zellen (Breg) [16, 17, 104, 109, 171], natürliche Killer-Zellen (NK-Zellen) [43, 57], Myeloid-derived suppressor cells (MDSC´s) [58, 113], dendritische Zellen (DCs) [75] und plasmazytoide dendritische Zellen (pDCs) [78]. Interessanterweise sind einige Moleküle mit immunsuppressiver Wirkung, wie IL-10, IDO oder CD25, die bei Treg bekannt sind, auch bei diesen Zelltypen zu finden [4, 17, 21, 57, 75, 96, 152, 173]. Tabelle 1: Regulatorische Zellpopulationen im Immunsystem Bislang bekannte regulatorische Immunzellen, aufgelistet nach dem jeweiligen murinen bzw. humanen Phänotyp. Tabelle ergänzt nach Wood et al., 2012, S. 418 [168], Literatur für NK-Zellen aus Fu et al. 2013 [57]. Abkürzungen: hi: high; T2-MZP: transitionelle T2 marginal zone Vorläufer BZ; trans.: transitionelle BZ. Phänotyp Population Maus Mensch + + Treg CD4 CD25 FoxP3 hi Breg NK-Zellen reg. Makrophagen pDCs + + hi low CD4 CD25 CD127 FoxP3 + CD45RA (ruhend) oder + CD45RO (aktiviert) + + + CD1d CD5 CD19 (B10) + + hi hi hi hi CD19 CD20 CD24 CD27 CD38 IgD IgM + + + CD1d CD19 CD21 CD23 (T2-MZPs) + + + + CD19 CD24 CD38 IgD (trans. BZ) + hi + hi CD19 CD22 IgD IgM (trans. BZ) bright + bright +/CD56 CD27 CD56 CD11b MDSCs MSCs hi Keine spezifischen Marker bislang bekannt low hi low CD11c CD45RA MHC-II + + CD11b Gr1 + + CD11b CD29 CD31 CD34 CD44 + + + CD45 CD73 CD105 CD106 KIT Keine spezifischen Marker bislang bekannt hi - low + + hi Ilow CD4 CD8 CD11c CD45RA MHC-I + low CD11b CD33 CD34 HLA-DR + + + CD34 CD45 CD73 CD90 CD105 HLA-DR , CD11b orCD14 , CD19 or C79a Im weiteren Verlauf dieser Arbeit wird hauptsächlich auf regulatorische B-Zellen eingegangen. Einleitung 3 1.2. Regulatorische B-Zellen Die allgemeine Funktion von B-Lymphozyten im Verlauf der adaptiven Immunantwort ist die Produktion von Antikörpern, aber auch Antigenpräsentation und Zytokinproduktion gehören zu ihren Aufgaben. Als regulatorische Zellen waren sie bislang weniger bekannt. Einen ersten Hinweis auf B-Zellen (BZ) mit immunsupprimierender Wirkung lieferte bereits in den 70-er Jahren ein Maus-Modell mit Zell-vermittelter Allergie (Delayed Type Hypersensitivity (DTH)). BZ-depletierte Milzzellen wurden in Mäuse transferiert was den Ausbruch einer DTH zur Folge hatte. Die Anwesenheit von BZellen schien eine hemmende Wirkung zu zeigen und den Krankheitsverlauf zu verzögern [116]. Weitere Erkenntnisse und Erforschungen dieser Art blieben jedoch längere Zeit aus. Erst in den 1990-er Jahren fand die Erforschung regulatorischer B-Zell-Phänomene weitere Beachtung. In einem experimentellen Autoimmun-Enzephalomyelitis (EAE) - Maus-Modell konnte gezeigt werden, dass B-Zellen nicht für den Ausbruch der Krankheit verantwortlich sind, aber dazu beitragen, den Krankheitsverlauf zu mildern oder gar eine Erholung hervorzurufen [166]. Fillatreau und Kollegen zeigten, dass nur B-Zellen, welche IL-10 sezernieren auch immunregulatorisch aktiv sind, da sie die T H1-Zytokinantwort regulieren. IL-10-defiziente Mäuse dagegen entwickelten eine EAE [109]. Der Begriff „regulatorische B-Zellen“ (Breg) wurde von Mizoguchi und Bhan eingeführt, die in einem Colitis-Maus-Model eine Interleukin-10-produzierende BZell-Population identifizierten, die eine erhöhte CD1d-Expression aufwies und deren Anwesenheit den Krankheitsverlauf verzögerte [108-110]. IL-10+ regulatorische B-Zellen werden häufig auch als B10-Zellen bezeichnet [171]. Ähnliche Beobachtungen sind bei weiteren Autoimmunerkrankungen wie dem Systemischen Lupus Erythematodes (SLE) [7, 16], Rheumatoider Arthritis (RA) oder Collagen-induzierter Arthrits (CIA) gemacht worden [18, 82, 86, 103, 108, 171]. Einen Überblick von Krankheitsmodellen, in denen B-Zellen mit immunregulatorischem Potential eine Rolle spielen, gibt Tabelle 2. Im Mensch sind diese Zellen auch bei gesunden Probanden induzierbar [21, 152] bzw. es treten BZellen mit immunsuppressiven Eigenschaften auch bei malignen Erkrankungen als Tumor-infiltrierende B-Zellen (TIL-B) [115, 143] oder bei HIV auf ([144], [80]). Die Frequenz der auftretenden Breg-Populationen liegt meist zwischen 1-5% [170]. Einleitung 4 Tabelle 2: Erkrankungen, die mit einem regulatorischen Phänotyp von B-Zellen korreliert werden können Übersicht über Erkrankungen, die mit einem regulatorischen B-Zell-Phänotyp korreliert werden. Aufgelistet sind zudem die jeweilige Spezies (murin und human), in der Breg gefunden wurden sowie der Effekt, den diese Zellen in diesem Krankheitsmodel auslösen. Spezies Maus Erkrankung Effekt der B-Zellen DTH Unterdrückung der DTH Immunmodulation Regulation der Autoimmunität durch IL-10 Regulation von CD4+CD25+ Treg Supprimierung von Th1 und Th17 TZ EAE Regulation von CD4+ TZ Unterdrückung der TZ-Antwort Regulation der TZProliferation Regulation von CD4+Foxp3+ TZ Chronische Regulation von Colitits CD4+TCRα-β+ TZ Suppression der TZ-Proliferation Wurminfektion Schutz vor Anaphylaxie Arthritis Inhibition von T(AIA/ CIA) HelferzellDifferenzierung Kontrolle des Krankheitsverlaufs, Suppression der TZSLE Proliferation und Differenzierung zu Th1 Zellen Diabetes Regulation von Teff Typ1 Suppression der CLL Monozyten/Makrophagen-Funktion RA Mensch SLE Verbesserter Krankheitsverlauf Verminderte Suppression der TZProliferation Phänotyp Autoantigenreaktive BZ B7+IL-10+ Literatur [116] [166] [55] [98] TLR-aktivierte IL-10+ BZ IL10+CD1dhi CD5+ IL10+GIFT15+ [87] IL10+ CD1dhiCD5+ IL10+ [175] IL10+ CD1dhi [109, 110] [38] IL10+CD1d+ CD11b-CD5CD27- IgD+ IL10+ IL10+ [100] [128] [130] [97] [104] Transitionale unreife BZ (T2 BZ) [15, 16] Pro-BZ [111] IL10+CD5+ [45] Periphere BZ [160] CD5+ IL-10+ BZ CD19+CD24hi CD38hi IL-10low [2] [16] Einleitung 5 HIV MS Tumore* Chronische Hepatitis B (CHB) Allergien Transplantation/GvHD IL-10+CD154+ GrB+CD5+ SLE BZ GrB+ BZ [44] [70] IL-10+ PD-L1+ [144] IL10+TIM-1+ CD19+ [93] IL10+ [49, 72] CD19+CD25high [42] CD20+ IL10+CD19+ CD24hiCD38high [115] [41] Kontrolle von allergischen Prozessen Reduzierte Zytokinproduktion durch TZ Protolerogene Umgebung durch IL10, Homöostase regulatorische/EffektorBZ IL10+ TGF-β+ [20] IL10+CD5+ [124] CD20+CD24high CD28high (transitionelle) CD20+CD24low CD38low (naïve) [32] Inhibition der CD4+CD25- Teff-Antwort GrB+ [33] IL10+CD5+ CD39+CD73+ [45] [136] CD25+ [152] Suppression der CD4+ TZ-Proliferation Suppression der CD8+ TZ Proliferation Suppression von HIV-1 spezifischer T-ZellAntwort Regulation von Autoimmunität Kontrolle der CD4+ TZProliferation Teils bessere Prognose Suppression der CD8+TZ-Antwort CLL Regulation von aktivierten TZ Apoptose von aktivierten TZ Gesund * hierzu zählen Mamma-, Lungenkarzinom (NSCLC) Ovarialkarzinome, colorektales Karzinom, [80] nicht-kleinzelliges 1.3. Charakterisierung von regulatorischen B-Zellen Breg stellen eine phänotypisch und funktionell uneinheitliche heterogene Zellpopulation mit einem hohen Grad an Diversität dar (s. auch Phänotyp Tab.2). Die meisten Studien untersuchten bisher sogenannte B10-Zellen, die sich über die Oberflächenmoleküle CD19+CD1dhighCD5+ (Maus) oder CD19+CD24+CD38+ (Mensch) und eine IL-10-Freisetzung definieren lassen [15, 16, 53, 104, 109, 110, Einleitung 6 117]). Mittlerweile sind Breg bekannt die neben den oben genannten Markern auch Aktivierungsmarker, kostimulatorische Moleküle, Adhesionsmoleküle, Moleküle der Immunglobulin-Superfamilie oder Enzyme tragen. Hierzu zählen CD10, CD20, CD24, CD25, CD27, CD70, CD86, CD154, IgM und IgD, welche jedoch nicht zwangsläufig alle zusammen exprimiert werden müssen [15, 16, 47, 53, 76, 104, 171]. Die Entwicklung und Reifung von Breg ist bislang ungeklärt. So wurden in Mäusen Milz-BZ (CD5+CD1d+) identifiziert, die nach Lipopolysaccharid (LPS)Stimulation IL-10 produzieren, während Evans und Kollegen nach CD40Stimulation eine IL-10+ Milz-BZ-Population mit transitionellen T2-Phänotyp (CD21highCD23+) generieren konnten [53, 171]. Auch im Menschen sind diverse Phänotypen bekannt. IL-10+ BZ sind sowohl innerhalb der transitionellen BZPopulation (CD19+CD24highCD38high), als auch innerhalb der memory BZPopulation (memoryCD24highCD27+) identifiziert worden [16, 76]. Abbildung 1: Bisher bekannte Effektormechanismen von regulatorischen B-Zellen Graphische Darstellung bekannter Funktionen von Breg auf diverse Zelltypen. Vermittelt wird eine inhibitorische (ⱶ) bzw. aktivierende (→) Wirkung durch die Sekretion von IL-10 oder TGF-β oder Effekte vermittelt über Oberflächenmoleküle. Abbildung nach Mauri 2010, S. 765 [101]. Funktionell besitzen Breg vielfältige Effektormechanismen, die Auswirkungen auf eine Vielzahl anderer Zellen besitzen und die Immunantwort dadurch beeinflussen können [54, 89, 101, 102] (siehe Abbildung 1 [101]). Am weitesten erfasst ist dabei die Sekretion des immunmodulatorischen Moleküls IL-10 [55, 90, 104, 109]. IL-10+ Breg inhibieren die Differenzierung von TH1 und TH17-Zellen und die Aktivierung Einleitung 7 von Makrophagen. Dies kann auch mit Hilfe des anti-inflammatorischen Zytokins TGF-β geschehen. Auch Mechanismen, die unabhängig von einer Zytokin-Sekretion sind, können immunsuppressive Aktivitäten von Breg erklären. Zell-Zell-Kontakt-vermittelte Effekte wie die Antigenerkennung via BCR und die Wechselwirkung von CD80/CD86 und CD28/CTLA-4 auf Teff resultieren in der Induktion von FoxP3+-Treg oder IL-10-produzierenden regulatorischen CD4+ T-Zellen (Tr1). Lipidantigenerkennung via CD1d führt zu einer Aktivierung von invarianten NKTZellen mit möglicherweise ebenfalls regulatorischem Potential [101]. 1.4. Stimulation von regulatorischen B-Zellen Verschiedene Signale scheinen in der Lage zu sein, regulatorische B-ZellSubpopulationen zu generieren. In Tabelle 3 sind bislang bekannte Stimuli mit dem jeweils resultierenden Breg-Phänotyp zusammengefasst. B-Zellen mit regulatorischer Aktivität wurden sowohl bei Autoimmunerkrankungen als auch bei Infektionen gefunden, deshalb ist es wahrscheinlich, dass unterschiedliche Signale zu unterschiedlichen B reg- Populationen bei diversen Krankheitsbildern führen können. Die Heterogenität an Stimuli, die Breg induzieren können, impliziert eine gewisse Redundanz des Systems. TLR-Liganden scheinen für eine IL-10-Induktion ebenso potent wie CD40-Aktivierung. Die Stimulation von TLR2 und TLR4 in der Maus ist verantwortlich für die regulatorische BZ-Funktion bei EAE. Im Mensch dagegen scheint die Kostimulation von TLR9 + anti-BCR am effektivsten zu sein [17, 87]. Die Aktivierung des BCR scheint dabei eine vorrangige Rolle zu spielen, da CD19-/--Mäuse nicht in der Lage sind, eine funktionelle Breg-Populationen auszubilden [171]. Im Menschen ist die Wechselwirkung zwischen CD40 und CD154 verantwortlich für die Differenzierung von BZ zu Plasmazellen. In der Maus hingegen scheint die Stimulation von CD40 auch nötig zu sein, um eine IL-10 Produktion hervorzurufen und IL10+ Breg zu generieren [10, 11, 81]. Mehrere Modelle haben hier gezeigt, dass CD40 für die Induktion von B reg notwendig ist. CD40-Defizienz in Mäusen mit EAE bedingt eine fehlende B reg-Population und einen schwereren Krankheitsverlauf [55]. Zudem bewirken anti-CD40 Antikörper die Bildung von Breg mit suppressiven Charakter in CIA-Modellen [104]. Einleitung 8 Die Induktion von Breg scheint möglicherweise mehrere Aktivierungsschritte zu beinhalten. Zur Induktion werden TLR-abhängige Signale benötigt, die für eine IL-10-Expression verantwortlich sind, während im weiteren Verlauf BCR- und CD40-Interaktion die Expansion und das Überleben von Breg garantieren [86]. Tabelle 3: Stimulation von Breg Bekannte Stimuli, die regulatorische B-Zellen generieren. Angegeben ist neben dem induzierenden Molekül der jeweilige Phänotyp, den die Stimulation hervorruft. Spezies Stimulatoren Toll-like Rezeptor (TLR)Liganden Maus CD40L Diverse Breg CD40L + IFN-β CD40L + CD86 CD40L + Interleukin 21 Lipopolysaccharide (LPS) LPS + anti-IgM IL-10+CD19highFcγIIbhigh IL10+ CD1d+ IL10+ CD1dhighCD5+ TGF-β1+ IL-10+ Literatur [13, 17, 72, 87, 170] [38, 53, 55, 86, 104] [127] [109, 110] [175] [122, 139] IL10+CD21highCD23+CD24high IgMhighIgDhighCD1d+ CD1d+CD5+ [15, 53, 104] [172, 173] IL10+MHCI+MHCII+IgM+IgD+ [128] c-kitlowSca1lowCD127+B220+ CD19+IgM−CD1d+CD43+ IL-35+ IL-10+ [111] CD19highIgD+CD38high CD24highCD5high CD19+CD25+ IL-10- [88] GrB+CD19+CD38+ CD1d+CD147+ GrB+CD38+CD20− CD38+CD27+ IL10+ IL-10+ PD-L1+ [92] IL10+ CD27+CD38+ [17] B-Zell aktivierender Faktor (BAFF) GM-CSF + Interleukin 15 (GIFT15) CpG ODN Interleukin 35 CD40L Mensch Interleukin 2 + Toll-like Rezeptoren Interleukin 21 (und anti-Ig) Interleukin 21 + Interleukin 15 TLR9-Agonisten TLR2-, TLR9-Agonisten, CD40L CpG ODN + anti-Ig B-Zell-Phänotyp Diverse Breg [161] [152] [169] [72] [144] Zudem können bestimmte Signale, die eine Induktion von T reg hervorrufen auch Breg generieren. So kann das Zytokin IL-35 die Entwicklung von IL-10+ Breg fördern, die gleichzeitig auch IL-35 produzieren [161]. Diese IL10+IL35+-Breg- Einleitung 9 Population scheint wiederrum bei experimenteller Autoimmun-Uveitis (EAU) einen immunsuppressiven Effekt zu haben. Seit kurzem ist ein neuer potenter Induktor regulatorischer B-Zellpopulationen sowohl in der Maus als auch im Menschen bekannt, nämlich das Zytokin Interleukin 21 (IL-21), welches im folgenden Kapitel näher beschrieben werden soll [92, 169, 175]. 1.5. IL-21 als Schlüsselzytokin zur Induktion von regulatorischen B-Zellen Das Zytokin IL-21 gehört der IL-2-Familie an und wird hauptsächlich von follikulären T-Helferzellen (TFH), TH17 und NKT-Zellen produziert. Es hat starke immunstimulatorische Wirkung auf andere Immunzellen, da eine Vielzahl von Zellen (T-, B-, NK-Zellen, Fibroblasten, Keratinozyten) den zugehörigen commongamma-chain (γc)-Rezeptor IL-21R exprimieren [5, 35, 123, 146]. Zudem wird IL21 eine antivirale- und antineoplastische Wirkung zugeschrieben, was in mehreren Phase I- und Phase II-Studien evaluiert wird [5, 52, 147]. Viele der günstigen immunstimulatorischen Effekte von IL-21 werden vor allem seinem Einfluss auf die relativ spät einsetzende zelluläre adaptive Immunantwort zugeschrieben. Bei bestimmten Erkrankungen wie Virusinfektionen ist IL-21 eines der ersten Zytokine, das freigesetzt wird [74]. Abhängig von der Zellumgebung und von kostimulatorischen Signalen kann IL21 inhibierend auf die Reifung und Funktion von dendritische Zellen wirken [19], hat aber auch Einfluss auf die Differenzierung von CD4 + T-Zellen (TFH, TH17) [118, 119]. Interessanterweise kann IL-21 in CD8+ T-Zellen zur Induktion von Granzym B führen und damit die zytotoxischen Eigenschaften dieser Zellen verstärken [106]. Die Wirkung von IL-21 auf B-Zellen ist vielseitig und abhängig vom Grad der BZell-Differenzierung und der An- und Abwesenheit weiterer Signale. In Abwesenheit von BCR- und T-Zell-Signalen und zusätzlicher TLR-Stimulation induziert IL-21 Apoptose von unreifen B-Zellen [79, 105]. Durch T-Zell-vermittelte CD40-Ligation wird die Ausschüttung von Zytokinen wie IL-4 vermittelt und bei gleichzeitiger BCR-Aktivierung fördert IL-21 die Proliferation und Differenzierung von B-Zellen zu memory B-Zellen oder Plasmazellen, bedingt durch die Aktivierung des B-lymphocyte-induced maturation protein 1 (Blimp-1) [14, 51, Einleitung 10 120]. Zudem vermittelt IL-21 die Regulation der Immunglobulin-Produktion und induziert den Antikörperklassenwechsel [8, 23]. Auf der anderen Seite konnte in der Maus gezeigt werden, dass IL-21 die Sekretion von IL-10 durch B-Zellen induziert und damit IL-10+ Breg (B10-Zellen) generiert. In einem EAE-Modell etwa konnte der Krankheitsverlauf durch die erhöhte B10-Frequenz verzögert werden, indem diese Zellen direkte Kontrolle auf CD4+ T-Zellen ausüben [175]. Im Menschen konnte nachgewiesen werden, dass maligne B-Zellen von Patienten mit chronischer lymphatischer Leukämie (CLL) nach Aktivierung mit IL21 und immunstimulatorischen CpG-Oligonukleotiden (CpG ODN) in die Lage versetzt werden, die Serinprotease Granzym B (GrB) zu sezernieren und im Sinne eines bystander-Effekts bei unstimulierten CLL-Zellen GrB-abhängig Apoptose induzieren [77]. Im weiteren Verlauf konnte gezeigt werden, dass prinzipiell auch B-Zellen gesunder Spender in der Lage sind, nach Stimulation mit IL-21 GrB zu sezernieren. Xu und Kollegen konnten zeigen, dass aktivierte B-Zellen durch Stimulation mit IL-15 und IL-21 zu GrB-exprimierenden B-Zellen mit plasmazellartiger Morphologie (IgM+IgG+IgA+ CD38+CD20- oder CD38+CD27+) differenzieren und in humanen tonsillären Gewebe nachgewiesen werden können [169]. Ein direkter Nachweis von GrB-Induktion in Plasmazellen durch IL-21 konnte bisher jedoch nicht gezeigt werden, der funktionelle Charakter oben genannter Zellen bleibt daher unklar. Die Aktivierung des JAK-STAT-Signalwegs durch Interleukin-21 führt zur Expression von GrB in B-Zellen, wobei die Phosphorylierung von STAT3 eine entscheidende Rolle hierbei spielt [67, 169]. Dieser IL-21- induzierte GrB+ B-ZellPhänotyp wird bei gleichzeitiger Stimulation des B-Zell-Rezeptors (BCR) verstärkt, während die zusätzliche Ligation von CD40 auf B-Zellen die GrB-Expression hemmt (s. Abb. 2) [67]. IL-21 stellt somit das Schlüsselzytokin bei der Differenzierung von B-Zellen zu Antikörper-produzierenden Plasmazellen dar, die allerdings nur in Anwesenheit von CD40-Ligand (CD40L) stattfindet, wenn voll aktivierte (CD40-Ligand+) CD4+ TZellen am Ort der Entzündung vorliegen. Fehlende CD40-Ligation dagegen bedingt einen GrB+ B-Zell-Phänotyp [9, 51, 67, 169]. Einleitung 11 Abbildung 2: IL-21 als Schlüsselzytokin der Differenzierung von B-Zellen zu Plasmazellen oder Granzym B-sezernierenden B-Zellen. CD40-Ligation reguliert die IL-21-induzierte Differenzierung von BZ in Plasmazellen oder GrBsezernierenden BZ. In der frühen Phase einer Infektion (0-3 Tage) ist ein breites Spektrum niedrig+ affiner und voraktivierter CD4 T-Zellen am Infektionsherd vorhanden, welche IL-21, aber kein CD40L exprimieren. Antigenspezifische B-Zellen werden MHC-unabhängig über virale Antigene + aktiviert und können durch die Wirkung von IL-21 CD40L T-Zellen zu GrB-sezernierenden BZ differenzieren (rechts). In einer späteren Phase der Infektion (>5 Tage), nach Aktivierung durch + professionelle APZ, erreichen voll aktivierte antigenspezifische CD4 T-Zellen aus den lokalen Lymphknoten den Infektionsherd. Diese exprimieren nun IL-21 und CD40L, können damit die GrBExpression durch B-Zellen beenden und stattdessen deren Differenzierung zu Plasmazellen einleiten. (links). Abb. nach Hagn und Jahrsdörfer, 2012, S. 1371 [66]. 1.6. Granzym B als regulatorische Protease Granzym B (GrB) ist eine 32-kDa große Serinprotease aus der Familie der granule enzymes (Granzyme) und ein wichtiger Bestandteil zytotoxischer Granula von NK-Zellen und zytotoxischen T-Zellen (CTL). GrB wird über Exozytose ausgeschüttet, kann durch die Aufnahme in das Zytoplasma von Zielzellen Caspase 3 oder BID aktivieren und hierdurch den programmierten Zelltod auslösen [27]. Klassischerweise wurde GrB deshalb als „killer-Protease“ betrachtet. Für die Aufnahme in Zielzellen wurde lange die Anwesenheit von Perforin als obligatorisch angesehen. GrB kann aber auch Perforin-unabhängig in das Zytoplasma beispielsweise von virusinfizierten Zellen gelangen, etwa durch Einleitung 12 virale Proteine oder über Mannose-6-Phosphatrezeptoren [61, 73, 129, 158]. In den letzten Jahren wurden Substrate von GrB identifiziert, die der Protease auch nicht-zytotoxische Funktionen zuschreiben [6, 94, 133, 151] (s. Tab. 4). Tabelle 4: Substrate von Granzym B Aufgelistet sind bisher bekannte Substrate von GrB. Abkürzungen: BID= BH3-only proapoptotisches Protein; PARP= Poly(ADP-Ribose)-Polymerase 1; DNA-PK= DNA-abhängige Proteinkinase; GluR3= Glutamatrezeptor 3; TCR-ζ= T-Zell-Rezeptor ζ-Kette; FGFR1= Fibroblast Growth Factor 1; NF90= Nuclear Factor 90; HSP70= heat shock Protein 70; CASP= Cytohesinassociated scaffolding Protein; elF2b= eukaryotischer Translations-Initiationsfaktor 2b; elF3= eukaryotischer Translations-Initiationsfaktor 3; DBP= DNA-binding Protein; 100K= 100K- assembly Protein. Effekt auf Apoptotische Proteine DNA-Fragmentierung Proteine der extrazellulären Matrix Oberflächenrezeptoren Autoantigene Virale Proteine Zelluläre Proteine Substrat BID Pro-Caspase-3, 7, 8 PARP DNA-PK Nukleare Laminine Kollagen Typ IV Vitronectin Fibronektin Plasmin TCR-ζ GluR3 FGFR1 U1-70kDa NF90 NF45 DBP ICP4 Von Willebrand Faktor HSP70 HSP90 Notch1 Poly-A-binding Protein IL-1α hnRNP-K Cytohesin-associated scaffolding Protein (CASP) Topoisomerase I B23 Nucleolin Fibrillarin RNA-Polymerase II U1 snRNP 70k La DNA-PK Ku70 Literatur [29, 39] [30] [176] [145] [26] [34] [112] [164] [59] [94] [30] [62] [62] [6] [155] [25] [94] [6] [157] [94] [1] [156] [150] [6] Einleitung 13 eIF2 eIF3β α-/ β-Tubulin Importin α4 Vimentin GrB proteolysiert beispielsweise Proteine der extrazellulären Matrix [34, 112, 176]. Bei Autoimmunerkrankungen wie der rheumatoiden Arthritis (RA) sind erhöhte GrB-Spiegel gefunden worden, was möglicherweise direkt zu einer Schädigung der Synovia führen und damit zur Zerstörung des Gelenks beitragen könnte [149]. Die Prozessierung des Zytokins IL-1α durch GrB erhöht dessen Aktivität um ein Vielfaches. GrB kann daher unter bestimmten Bedingungen auch als direkter Verstärker einer proinflammatorischen Immunantwort wirken [1]. Auch Oberflächenrezeptoren werden von GrB gespalten. Wieckowski und Kollegen konnten zeigen, dass die ζ-Kette des T-Zell-Rezeptors (TCR-ζ) ein Substrat von GrB ist [164]. Die extrazellulären Komponenten des TCR (α- und βKetten) erkennen Antigenen welche in Kontakt mit MHC-Molekülen auf Antigenpräsentierenden Zellen dargeboten werden. Die Weiterleitung der Signale dagegen wird durch die membranständigen CD3-Heterodimere δ:ε und γ:ε sowie einem Homodimer aus zwei ζ-Ketten vermittelt [84, 132, 134]. Wird die ζ-Kette degradiert, kann keine Phosphorylierung der Immunoreceptor-Tyrosine-basedActivation-Motifs (ITAM) stattfinden und die intrazelluläre Signalkaskade zur Aktivierung von T-Zellen wird unterbrochen. Somit kann GrB hier immunsuppressiv auf T-Zellen wirken [84, 132]. Weiterhin ist bekannt, dass neben CTL auch eine Vielzahl von „nichtklassischen“ Zelltypen wie B-Zellen oder plasmazytoide dentritische Zellen (pDC) GrB exprimieren und sezernieren können [67, 78, 169]. Da diese Zellen jedoch weder signifikante Mengen von Granzym A noch von Perforin oder Granulysin exprimieren, wie es für zytotoxische Zellen typisch ist, liegt die Vermutung nahe, dass GrB hier alternative Funktionen ausübt [67, 91]. 1.7. Zielsetzung der Arbeit Da in B-Zellen eine Perforin-unabhängige GrB-Sekretion nach IL-21-Stimulation vermittelt wird [67], liegt die Vermutung nahe, dass GrB hier nicht nur als Einleitung 14 zytotoxische, sondern auch als regulatorische Protease fungieren kann. In der Arbeitsgruppe konnte gezeigt werden, dass GrB+ B-Zellen in direkten Kontakt mit T-Zellen treten und aktives GrB direkt in TZ transferiert wird, dort jedoch keine Apoptose auslöst [92]. Im Rahmen dieser Dissertation wurde zum einen eine exakte phänotypische Charakterisierung von GrB+ B-Zellen durchgeführt und das regulatorische Potential dieser Zellen im Hinblick auf die Wechselwirkung mit T-Zellen untersucht. Des Weiteren wurden mögliche Mechanismen der T-Zell-Hemmung untersucht, wobei das Hauptaugenmerk dabei auf eine GrB-vermittelte Degradierung der ζ–Kette des T-Zell-Rezeptors gelegt wurde, da dieser für die Vermittlung von Wachstumssignalen innerhalb der T-Zellen verantwortlich ist. Da murinen B-Zellen das Vermögen fehlt, Granzym B zu exprimieren [69, 169], wurden weiterführende Untersuchungen zur Rolle und Funktion regulatorischer GrB-sezernierender B-Zellen durch Screening ausgewählter humaner pathologischer Präparate sowie primärer Gewebeproben von Patienten mit Tumorerkrankungen auf die Anwesenheit von GrB+ B-Zellen durchgeführt. Weiterhin wurden B-Zellen von gesunden Spendern im Vergleich zu B-Zellen von HIV-Patienten ex-vivo auf die regulatorische Funktion von GrB+ B-Zellen und deren Wirkung auf die T-Zell-Proliferation untersucht. Material und Methoden 15 2. Material und Methoden 2.1. Material 2.1.1. Geräte und Laborbedarf Axioscope 2-Fluoreszenzmikroskop Carl Zeiss Microscopy GmbH, D Blotting-Papier Thermo Scientific, Braunschweig, D Durchflusszytometer FACScan BD Immunzytometrische Systeme, Heidelberg, D Durchflusszytometer FACSCalibur BD Immunzytometrische Systeme, Heidelberg, D Entwicklermaschine (Agfa Curix 60) Siemens Healthcare, Erlangen, D Einmal-Reaktionsgefäße Eppendorf, Hamburg, D FACS-Röhrchen Sarstedt, Nümbrecht, D Filme (Hyperfilm ECL) GE Healthcare, Freiburg, D Filmkassetten Amersham Bioscience, Freiburg, D Axioskop-Fluoreszenzmikroskop Zeiss, Göttingen, D mit CCD-Kamera Heizblock VWR International GmbH, Darmstadt, D Inkubator Heraeus Sepatech, Osterode, D Lichtmikroskop Nikon GmbH, Düsseldorf, D LS MACS Trennsäulen Miltenyi Biotec, Bergisch Gladbach, D Magnet Miltenyi Biotec, Bergisch Gladbach, D StemCell Technologies, Köln,D Magnetrührer VWR International GmbH, Darmstadt, D Mini-PROTEAN Tetra Cell BioRad Labaratories, Hercules, USA Mini Trans-Blot Module (WB) BioRad Labaratories, Hercules, USA Objektträger Leica Microsystems, Nußloch, D Pap Pen Zytomed Systems, Wertheim, D Pipettenspitzen mit Filter (steril) Biozym Scientific GmbH, Hessisch Oldendorf, D POLARstar Omega Plattenleser BMG Labtech GmbH, Ortenberg, D Polypropylen-FalconTM-Rörchen BD Biosciences, Heidelberg, D PowerPac HC Power Supply BioRad Labaratories, Hercules, USA PVDF Transfermembran (0,45µm) GE Healthcare, Freiburg, D Safety-Multifly®-Kanülen Sarstedt, Nümbrecht, D Material und Methoden 16 Serologische Einmalpipetten VWR International GmbH, Darmstadt, D Sterilbank Heraeus Sepatech, Osterode, D Vacutainer® Na-Heparin-Röhrchen BD Biosciences, Heidelberg, D Vacutainer® multi-sample luer adapter BD Biosciences, Heidelberg, D Zellkulturflaschen (25cm3) Nunc GmbH, Wiesbaden, D Zellkulturplatten (96 well) Nunc GmbH, Wiesbaden, D Zentrifugen: Standzentrifuge Heraeus Sepatech, Osterode, D Tischzentrifuge Eppendorf, Hamburg, Dv 2.1.2. Medien und Reagenzien AIM-V Medium Life technologies, Carlsbad, USA RPMI Medium PAA (The Cell Culture Company), Pasching, A Acrylamid/Bisacryamid Fluka, St. Louis, USA Ammoniumchlorid Merck KGaA, Darmstadt, D Ammoniumpersulfat Sigma-Aldrich, Schnelldorf, D BCA Protein Assay Thermo Scientific, Braunschweig, D Biocoll Biochrom AG, Berlin, D BSA Fraktion V >98% Carl ROTH GmbH & Co KG, Karlsruhe, D Calciumchlorid Sigma-Aldrich, Schnelldorf, D CFSE Sigma-Aldrich, Schnelldorf, D Coomassie Blue G250 Fluka, St. Louis, USA Dulbecco's PBS PAA (The Cell Culture Company), Pasching, A ECL Western Blot Substrat GE Healthcare, Freiburg, D EDTA Fluka, St. Louis, USA Entwicklerlösung (WB) Adefo Chemie GmbH, Dietzenbach, D Fixierlösung (WB) Adefo Chemie GmbH, Dietzenbach, D Glycerin Carl ROTH GmbH & Co KG, Karlsruhe, D Glycin Sigma-Aldrich, Schnelldorf, D HEPES Life technologies, Carlsbad, USA Kaliumhydrogencarbonat Merck KGaA, Darmstadt, D Molekulargewicht-Marker Thermo Scientific, Braunschweig, D (PageRuler Prestained Protein Ladder) Material und Methoden 17 Magnesiumchlorid Sigma-Aldrich, Schnelldorf, D 2-Mercaptoethanol Fluka, St. Louis, USA Methanol Fluka, St. Louis, USA Milchpulver Applichem GmbH, Darmstadt, D Natriumchlorid Applichem GmbH, Darmstadt, D Natronlauge Merck KGaA, Darmstadt, D Paraformaldehyd Merck KGaA, Darmstadt, D PBS Lonza, Basel, CH Salzsäure (4N) VWR International GmbH, Darmstadt, D Saponin Serva Electrophoresis GmbH, Heidelberg, D SDS USB Europe GmbH, Staufen, D Sterofundin B. Braun Melsungen AG, Melsungen, D TEMED Fluka, St. Louis, USA Tricin Carl ROTH GmbH & Co KG, Karlsruhe, D Tris Sigma-Aldrich, Schnelldorf, D Trypanblau Biochrom AG, Berlin, D Tween Sigma-Aldrich, Schnelldorf, D Vectashield (Eindeckelmedium) Vector Laboratories, Burlingame, USA 2.1.3. Software und Programme Cell Quest Pro™ Software BD Immunzytometrische Systeme, Heidelberg, D FlowJo Software (Version 9.3.1) Tree Star, Ashland, Oregon, USA Image J Software (Version 1.48) Wayne Rasband, NIH, Bethesda, MD, USA ISIS Fluoreszenz Imaging System MetaSystems, Altlussheim, Deutschland MS Office Excel 2010 Microsoft, Redmond, WA, USA MS Office PowerPoint 2010 Microsoft, Redmond, WA, USA MS Office Word 2010 Microsoft, Redmond, WA, USA Material und Methoden 18 2.1.4. Puffer und Lösungen Ammoniumchlorid-Kaliumhydrogencarbonat-(ACK)-Lysepuffer: 150mM NH4Cl, 1mM KHCO3, 0,1mM Na2EDTA, pH 7,2 - 7,4RT Annexin V Puffer: 10mM HEPES in Sterofundin, steril filtriert Anoden-Puffer: 100mM Tris/HCl pH 8,9RT Blockier-Puffer: 5% BSA in TBS-T (1x) Blotting-Puffer (1x): 25mM Tris/HCl pH 8,3RT, 192mM Glycin, 20% Methanol, 0,1% SDS Citratpuffer: 10mM, pH 6,0RT Fixations-Puffer: 4% Paraformaldehyd (w/v), 1% 1M NaOH, 1x PBS, pH 7,4 RT Gelpuffer: 3M Tris/HCl pH 8,45 RT, 0,3% (w/v) SDS Kathoden-Puffer: 100mM Tris/HCl, 100mM Tricin, 0,1% (w/v) SDS MACS-Puffer: 0,5% BSA, 2mM EDTA, in PBS, pH 7,2, steril filtriert Permeabilisierungspuffer: 0,25% (v/v) Saponin in PBS, steril filtriert SDS-Loading-Puffer (SLB, 3x): 200mM Tris/HCl pH 6,8RT, 120mM DTT, 36% (v/v) Glycerin, 12% (w/v) SDS, 0,04% (w/v) Coomassie Blue G-250 TBS (10x): 250mM Tris/HCl pH 7,6RT, 1500mM NaCl TBS-T (1x): 25mM Tris/HCl pH 7,6RT, 150mM NaCl, 0,1% Tween 20 Zelllysepuffer (CLB): 10mM HEPES, 10mM NaCl, 1mM KH2PO4, 5mM NaHCO3, 1mM CaCl2, 0,5mM MgCl2, 5mM EDTA 2.1.5. Stimulantien und Inhibitoren Amphotericin Sigma-Aldrich, Schnelldorf, D anti-human BCR [F(ab')2] Jackson Immuno Research Laboratories (Affinity pure F(ab)'2 Fragment Inc., West Grove, PA, USA goat anti-human IgA+IgG+IgM (H+L)) Brefeldin A Sigma-Aldrich, Schnelldorf, D Material und Methoden 19 Collagenase Sigma-Aldrich, Schnelldorf, D Cycloheximid Sigma-Aldrich, Schnelldorf, D anti-CD3/CD28 magnetic beads Invitrogen, Carlsbad, CA, USA Gentamicin Sigma-Aldrich, Schnelldorf, D anti-human Granzym B-Antikörper R&D Systems, Minneapolis, MN, USA polyklonal (IgG) Granzym B-Substratinhibitor American Peptide Company, Sunnyvale, (Ac-IEPD-CHO) CA, USA GrB-Inhibitor (Caspase-3-Inhibitor II) Calbiochem, Darmstadt, D rekombinates anti-human IL-21 Biosource, Camarillo, CA, USA rekombinates anti-human IL-2 PeproTech GmbH, Hamburg, D Penicillin/Streptomycin-Lösung Lonza, Verviers, Belgien Protease Inhibitor Cocktail II Calbiochem, Darmstadt, D 2.1.6. Antikörper und Isolations-Kits Verwendete Antiköper für die Immunodetektion (WB): Maus anti-Aktin monoklonaler AK Thermo Scientific, Braunschweig, D anti-human TCR-ζ Primärantikörper Biolegend, San Diego, CA, USA anti-Maus sekundärer Antikörper Santa Cruz Biotechnology, Santa HRP-konjugiert Cruz, USA Verwendete Antiköper für die Durchflusszytometrie: Annexin V Immunotools, Friesoythe, D Propidiumiodid (PI) Sigma-Aldrich, Schnelldorf, D Antikörper Klon Isotyp Konjugat Hersteller CD1d CD1d42 mIgG1k PE BD Biosciences, Heidelberg, D CD3 UCHT1 mIgG1k PE BD Biosciences, Heidelberg, D CD3 UCHT1 mIgG1k PE-Cy5 BD Biosciences, Heidelberg, D CD4 MEM-241 mIgG1 FITC Immunotools, Friesoythe, D CD5 UCHT2 mIgG1k FITC BD Biosciences, Heidelberg, D CD10 LT10 mIgG1 FITC BD Biosciences, Heidelberg, D CD19 HIB19 mIgG1k PE BD Biosciences, Heidelberg, D CD19 HIB19 mIgG1k PE-Cy5 BD Biosciences, Heidelberg, D Material und Methoden 20 CD20 2H7 mIgG2bk PE-Cy5 BD Biosciences, Heidelberg, D CD24 SN3 mIgG1 PE Exbio, Prag, Tschechien CD25 MEM-181 mIgG1 Alexa Fluor AbD Serotec CD27 M-T271 mIgG1k BD Biosciences, Heidelberg, D CD38 HIT2 mIgG1k PE 488 FITC CD40 5C3 mIgG1k FITC BD Biosciences, Heidelberg, D CD86 2331 mIgG1k PE BD Biosciences, Heidelberg, D CD154 24-31 mIgG1k FITC BioLegend, San Diego, CA, USA GrB CLB-GB12 mIgG1 PE Invitrogen, Carlsbad, CA, USA IDO 700838 mIgG1 Alexa Fluor R&D Systems, Minneapolis, USA IL-10 JES-19F1 rat IgG2ak IL-21 3A3-N2 IgG1k PE 488 PE BioLegend, San Diego, CA, USA USAMN, USA eBioscience IgM G20-127 mIgG1k PE BD Biosciences, Heidelberg, D IgD IA6-2 mIgG2ak FITC BD Biosciences, Heidelberg, D BD Biosciences, Heidelberg, D Verwendete Antikörper für die Immunfluoreszenz: anti-Maus biotinylierter Sekundärantikörper Dako, Glostrup, D anti-Hase biotinylierter Sekundärantikörper Dako, Glostrup, D anti-Maus Cy3 Fluoreszenzantikörper Dianova, Hamburg, D anti-Hase IgG, Peroxidase-konjugiertes Jackson Immuno Research F(ab′)2 Fragment (Esel) Laboratories Inc., West Grove, PA, USA anti-Maus IgG, Peroxidase- konjugiertes Jackson Immuno Research F(ab′)2 Fragment (Schaf) Laboratories Inc., West Grove, PA, USA Dapi Sigma-Aldrich, Schnelldorf, D Maus anti-human Granzym B (Klon GrB-7) Dako, Glostrup, Dänemark Hase anti-human IL-21 (polykonal) Acris antibodies, San Diego, USA Hase anti-human IL-10 (polykonal) Acris antibodies, San Diego, USA Maus anti-human CD19 (Klon LE-CD19) Dako, Glostrup, Dänemark Maus anti-human CD3 (Klon F7.2.38) Dako, Glostrup, Dänemark Strepdavidin Alexa Fluor 488 Konjugat Eugene, Oregon, USA Isolationskits: B-Cell Isolation Kit II Miltenyi Biotech GmbH, Bergisch-Gladbach, D Material und Methoden B-Cell Isolation Kit (B-CLL) 21 Miltenyi Biotech GmbH, Bergisch-Gladbach, D CD4+ TC Isolation Kit II Miltenyi Biotech GmbH, Bergisch-Gladbach, D Fc-Rezeptor Block-Lösung Miltenyi Biotech GmbH, Bergisch-Gladbach, D 2.1.7. Zellmaterial Als Zellmaterial wurden aus dem peripheren Blut gesunder Spender periphere PBMC (peripheral blood mononuclear cells) bzw. daraus isolierte B- oder TLymphozyten verwendet. Die Spende von 40-180ml Blut erfolgte freiwillig, nach ausführlicher Aufklärung über die Entnahme und Verwendung des Blutes. Die Entnahme des Blutes HIV-infizierter Spender erfolgte nach Aufklärung unter ärztlicher Aufsicht in der Abteilung Infektiologie der Klinik für Innere Medizin III des Universitätsklinikums Ulm. Das Kontroll- bzw. Tumorgewebe und Metastasen für die Isolation von Tumor-infiltrierenden Lymphozyten (TILs) wurde von der Klinik für Hals-, Nasen- und Ohrenheilkunde des Universitätsklinikums Ulm bereitgestellt. Paraffin-eingebettetes Gewebematerial wurde aus dem Institut für Pathologie des Universitätsklinikums Ulm erhalten. Die Kultivierung der isolierten Zellen erfolgte in AIM-V- oder RPMI-Medium. Eine Einverständniserklärung der Ethikkommission der Universität Ulm zur Verwendung des jeweiligen Patientenmaterials lag vor. Alle Blut- und Gewebeproben wurden anonymisiert. 2.2. Methoden 2.2.1. Zellisolation 2.2.1.1. Periphere mononukleäre Zellen (PBMC) Nach Entnahme des Blutes wurde dies im Verhältnis 1:2 mit PBS verdünnt und mittels Dichtegradienten-Zentrifugation (Biocoll, Spezifische Dichte 1,077g/ml) die mononukleären Zellen (PBMC) isoliert. Die gewünschte Fraktion an PBMC befand sich nach Zentrifugation der überschichteten Bicoll-Röhrchen bei 1000g für 15min (Ausflauf ohne Bremse!) in der Interphase zwischen Blutplasma und Biocoll und wird distinkt abgenommen. Nach weiteren Waschschritten in PBS (bei 400g, 10min und 200g, 15min) wurden noch eventuell vorhandene Erythrozyten mittels Material und Methoden 22 ACK-Lyserreagenz 6min lysiert und durch Zentrifugation bei 400g, 5min abgetrennt. Die Zellzahl der erhaltenen PBMC wurde gezählt und für weitere Aufreinigungen in die einzelne Zelltypen (s. 2.2.1.2) in MACS-Puffer resuspendiert. Eine Kultivierung der PBMC´s erfolgte in AIM-V- oder RPMIMedium bei einer Zellkonzentration von 1x106 Zellen/ml bei 37°C, 5%CO2. 2.2.1.2. T- und B-Lymphozyten Die Isolation von T- und B-Lymphozyten erfolgte mit Hilfe von Isolationskits (negative Selektion mittels magnetischer Beads) der Miltenyi Biotech GmbH nach Herstellerangaben. Die Zellen wurden während der Isolation in MACS-Puffer gehalten, anschließend gewaschen und in AIM-V- oder RPMI-Medium bei einer Zellkonzentration von 1x106 Zellen/ml bei 37°C, 5%CO2 kultiviert. 2.2.1.3. Tumor-infiltrierende Lymphozyten (TILs) Das erhaltene Gewebematerial (Kontroll-, Tumorgewebe bzw. Metastasen) wurde in RPMI-Medium versetzt, mit 10% FCS, L-Glutamin (2mM), 1% Pen/Strep (100 U/mL bzw. 100 μg/mL), Amphotericin (25 µg/ml) und Gentamicin (10 µg/mL) transportiert um mögliche Verkeimungen zu unterbinden und eine sterile Umgebung zu schaffen. Nach Vortexen des Transportröhrchens wurden das Medium abgesaugt das Gewebestück mit Hilfe einer sterilen Schere oder eines sterilen Spatels in möglichst kleine Stücke geschnitten, anschließend in 15ml serumfreies RPMI-Medium überführt und für 30s gevortext. Das Medium wurde gesammelt und die Prozedur weitere 2-3 mal wiederholt. Das gesammelte Medium sollte die gewünschten Tumor-infiltrierenden Lymphozyten (TILs) enthalten. Nach Zentrifugation bei 400g für 5min wird das Zellpellet mit serumhaltigem RPMI gewaschen. Die Isolation der PBMC bzw. der jeweiligen Lymphozytenpopulation erfolgte wie bereits in 2.2.1.1. und 2.2.1.2. beschrieben. Falls sich das Gewebestück nicht durch vortexen homogenisieren ließ, wurden 50U/ml Collagenase in serumhaltigen RPMI zugesetzt und ÜN bei 37°C, 5%CO 2 inkubiert. 2.2.2. Durchflusszytometrische Färbungen Zur Färbung von Oberflächenmarkern wurden Zellen mit dem jeweiligen Antikörper in FACS-Röhrchen für 15 min bei Raumtemperatur in Dunkelheit Material und Methoden 23 inkubiert, anschließend gewaschen und durchflusszytometrisch analysiert. Zur Färbung intrazellulärer Proteine wie Granzym B wurden die Zellen mit Fixationspuffer (2% Paraformaldehyd (PFA)) 15min in Dunkelheit bei RT fixiert und mit PBS gewaschen (5min, 400g). Zur Permeabilisierung wurden die Zellen für 10min in Dunkelheit bei 4°C mit Permeabilisierungspuffer und Fc-Rezeptor Block-Lösung (um unspezifische Bindungen zu verhindern) versetzt. Anschließend erfolgte die Färbung des intrazellulären Proteins mit dem jeweiligen Antikörper für 15 min in Dunkelheit bei RT. Um unspezifische Antikörperbindungen auszuschließen wurde zusätzlich immer eine lsotypkontrolle durchgeführt. Nach dem Waschen mit PBS war die Analyse am Durchflusszytometer FACScan durchführbar. 2.2.3. CFSE-Färbung und Proliferationsversuche 1x107 CD C4+ T-Zellen/ml wurden mit 10ml PBS/0.1% BSA resuspendiert, mit Carboxyfluorescein-Succinimidyl-Ester (CFSE, End-konzentration 1µM) versetzt und für 10min bei 37°C inkubiert. Die Zellsuspension wurde anschließend mit 40ml eiskaltem RPMI-Medium gestoppt und 5min auf Eis inkubiert. Nach 3 Waschschritten in PBS/0.1% BSA wurden die Zellen für 6 Tage bei einer Ratio von 1:1 mit allogen isolierten B-Zellen in An- und Abwesenheit von anti-CD3/28 magnetic beads, IL-2 (100IU/ml), IL-21 (50ng/ml), anti-BCR (6.5µg/ml) oder GrBInhibitoren (Ac-IEPD-CHO 5µM, GrB AK 10µg/ml) bei 37°C, 5%CO2 kokultiviert. Nach 3 Tagen wurde die Hälfte des Kulturmediums gewechselt. 2.2.4. Western Blot 2.2.4.1. Zellkultur B-Zellen von gesunden Spendern wurden für 24h mit anti-BCR (6.5µg/ml) und IL-21 (50ng/ml) in AIM-V Medium bei 37°C, 5% CO2 stimuliert. Allogene CD4+ TZellen wurden nach Isolation mit anti-CD3/28 magnetic beads ebenfalls für 24h, 37°C, 5% CO2 stimuliert. Nach Entfernung der magnetic beads wurden die TZellen für 30min, 37°C mit Cycloheximid (1µg/ml) versetzt, anschließend in PBS gewaschen und mit den B-Zellen bei einer Ratio von 1:1 für 24h, 37°C kokultiviert. B-Zellen von HIV-positiven Spendern wurden direkt nach Isolation, wie oben beschrieben, mit vorbehandelten allogenen CD4 + T-Zellen bei einer Ratio von 1:5 Material und Methoden 24 in AIM-V Medium bei 37°C, 5% CO2 kokultiviert. CD4+ T-Zellen von HIV-positiven oder gesunden Spendern wurden direkt nach Isolation lysiert (s. 2.2.4.2). 2.2.4.2. Zelllyse und Proteinbestimmung Für die Zelllyse wurden die Zellen in Eppendorf-Reaktionsgefäße geerntet und mit PBS gewaschen. Danach erfolgte die Protein-Extraktion in 60µl CLBLysepuffer für 15min auf Eis und Lagerung des Rohextrakts bei -20°C. Der Lysepuffer wurde mit Protease-Inhibitoren (1:100) versetzt, um Degradation und Dephosphorylierung der Proteine während des Lysevorgangs zu verhindern. Die Bestimmung des Proteingehalts erfolgte mittels quantitativem BCA Protein Assay (Pierce Protein Research Products). Hierfür wurden der Rohextrakt 10min bei 7500rpm, 4°C zentrifugiert und der Überstand in ein neues Eppendorf-Gefäß überführt. 10µl der Proteinlösung wurden für die Bestimmung eingesetzt, mit 90µl ddH20 verdünnt und 1:1 mit dem BCA-Reagenz gemischt. Nach 2h Inkubation bei 37°C war die Reaktion vollständig abgelaufen und der Proteingehalt konnte photometrisch bei 562nm bestimmt werden. Die Auswertung erfolgte mit Hilfe einer Standardkurve. 2.2.4.3. Diskontinuierliche Polyacrylamid-Gelelektrophorese (SDS-PAGE) Um die Trennung der Proteine aus dem Zelllysat mittels Western Blot zu untersuchen, wurde zuerst eine Gelelektrophorese durchgeführt. Das Gel bestand aus einem 4,0 %-igen Sammelgel und einem 18 %-igem Trenngel. Um die Polymerisation zu starten, wurde die Trenngellösung (2,1ml Gelpuffer, 1,12ml 75%-iges Glycerin und 4,8ml 30%-ige Acrylamid-/ Bisacrylamidlösung) mit 50 µl 10 % (w/v) APS und 6,5 µl TEMED versetzt. Die gegossenen Trenngele wurden sofort mit 500 µl ddH2O überschichtet und abgedeckt. Nach Abschluss der Polymerisation (ca. 1 h) wurde das ddH2O abgenommen. Das Sammelgel (2,69ml ddH2O, 1,66ml Gelpuffer, 0,65ml 30%-ige Acrylamid-/ Bisacrylamidlösung) wurde durch Zugabe von 30µl 10 % (w/v) APS und 5µl TEMED gestartet, die Trenngele mit der Sammelgellösung überschichtet und die Kämme eingesetzt. Nach Auspolymerisieren der Sammelgele (ca. 1h) wurden die fertigen Gele mit feuchtem Zellstoff umwickelt und bis zur Verwendung luftdicht bei 4 °C gelagert. Material und Methoden 25 Vor dem Beladen des Gels wurden die Proben mit SDS-Probenpuffer versetzt (eingesetzte Proteinmenge ~2µg) und 5 min bei 95°C vollständig denaturiert. Nach kurzer Zentrifugation (1min, 13 000rpm) wurde alles Protein auf das Gel aufgetragen. Die Gelelektrophorese wurde in einer Mini-PROTEAN® Tetra cellElektrophorese-Apparatur durchgeführt, wobei eine unterschiedliche Stromstärke für Sammel- (12mA) und Trenngel (20mA) angelegt wurde. Die Laufzeit der Elektrophorese betrug 3-4h. Nach dem Abtrennen des Sammelgels wurde das Trenngel für das weitere Vorgehen 30min in 1x Blotting-Puffer äquilibriert. 2.2.4.4. Proteintransfer (Blotting) Der Transfer der Proteine erfolgte auf eine Polyvinylidenfluorid (PVDF)Membran (0,45 µm). Diese wurde 1min in 100% Methanol aktiviert und 15min in 1x Blotting-Puffer äquilibriert Der Western Blot wurde im wet-Verfahren durchgeführt. Hierfür wurde ein „Sandwich“ aus Filterpapier, Membran und Gel zusammengebaut und im Mini-PROTEAN® Trans-Blot Modul (BioRad Laboratories) für 90min bei 180V/Gel geblottet. 2.2.4.5. Immunodetektion Um unspezifische Bindungen zu verhindern, wurde die Membran 1h unter leichtem Schwenken mit TBS-T (1x)/ 5% BSA geblockt. Die Membran wurde anschließend kurz in TBS-T (1x) gewaschen und dann mit dem Primärantikörper (anti-CD3ζ-chain, Verdünnung 1:5.000 in TBS-T (1x)/ 5% BSA) bei 4°C über Nacht auf einem Schüttler inkubiert. Danach wurde die Membran drei mal 10 Minuten mit TBS-T (1x) gewaschen und für 45 Minuten bei Raumtemperatur mit dem Sekundärantikörper (anti-mouse HRP, Verdünnung 1:10.000 in TBS-T (1x)/ 5% BSA) inkubiert. Nach weiteren Waschschritten der Membran in TBS-T (1x) und TBS (1x) erfolgte die Detektion mittels Enhanced Chemolumineszenz (ECL)- Reagenz auf einen geeigneten Hyperfilm (Entwicklungsdauer 30min). Als Ladekontrolle diente β-Aktin (Verdünnung Primärantikörper 1:5.000 in TBS-T (1x)/ 5% BSA, 45min; Sekundärantikörper anti-mouse HRP, Verdünnung 1:10.000 in TBS-T (1x)/ 5% BSA, 45min). Die Auswertung der Western-Blot-Filme erfolgte mittels graphischer Auswertung der Bandenintensitäten durch das Bildverarbeitungsprogramm Image J (http://rsb.info.nih.gov/ij/disclaimer.html) unter Bildung der Ratios TCR-ζ:β-Aktin. Material und Methoden 26 2.2.5. Immunohistochemie - Fluoreszenzfärbung Die Paraffinschnitte (Schichtdicke 1µm) wurden auf sialynisierten Objektträgern fixiert und getrocknet. Die Entparaffinierung erfolgte in Xylol (3x 5min) mit anschließender Rehydrierung durch eine absteigende Alkoholreihe (Isopropanol; 2x Ethanol absolut, 90%, 70%) jeweils 5 Min. Darauf folgte die Antigendemaskierung in Citratpuffer (pH 6,0) im Schnellkochtopf (SKT) für 20min (Heat Induced Epitope Retrieval). Nach einer 20-minütigen Abkühlphase waren die Schnitte für die Färbungen vorbereitet. Zunächst wurden die Schnitte nach Vorbehandlung mit einem Primärantikörper inkubiert (GrB, IL-21, ...), anschließend in PBS (1x) gespült und die Bindung mittels entsprechend Fluoreszenzmarker gekoppelter sekundärer Antikörper sichtbar gemacht. In Tabelle 5 sind die verwendeten Antikörper mit Verdünnungen und Inkubations-Dauer sowie der jeweilige Sekundärantikörper zusammengefasst. Alle Sekundärantikörper wurden 1:200 verdünnt und die Schnitte damit 30 min bei RT inkubiert. Nach jedem Antikörper wurden die Schnitte in PBS (1x) gespült. Tabelle 5: Verwendete Antikörper in der Immunfluoreszenz Aufgelistet sind die jeweiligen Primär- und Sekundärantikörper, die für die Immunfluoreszenz verwendet wurden, sowie die Konzentration, die Dauer der Inkubation und die InkubationsTemperatur InkubationsTemperatur dauer 30 RT 30 RT Antikörper Konzentration anti-CD3 anti-CD19 1:100 1:20 anti-GrB 1:25 30 RT anti-IL-10 anti-IL-21 1:200 1:200 60 30 37°C RT Sekundärantikörper anti-Maus Cy3 anti-Maus Cy3 anti-rabbit biotinylierter 2.AK, Alexa Fluor Streptavidin 488 anti-rabbit DyLight 488 anti-rabbit DyLight 488 Nach kompletter Färbung des 1 Antikörpers wurden die Objektträger für 4 Min. auf eine 90°C heiße Heizplatte gelegt, um die bis dahin noch möglicherweise offenen Bindungsstellen zu denaturieren. Jetzt wurden dieselben Schnitte mit dem zweiten Primärantikörper inkubiert und ein entsprechend anderer Fluoreszenzmarker gekoppelter sekundärer Antikörper angewandt. Die fertigen Schnitte wurden mit dem mounting Medium VectaShield eingedeckelt. Die Visualisierung der Präparate erfolgte mit Hilfe eines Fluoreszenzmikroskops Material und Methoden 27 (Zeiss, Göttingen) und mit der zum Mikroskop gehörenden Software der Firma MetaSystems (Altlussheim, Deutschland). Um sicherzustellen, dass es zu keinen unspezifischen Bindungen der jeweiligen Antikörper kommt, wurden folgende Isotypkontrollen an Tonsillengewebeschnitten durchgeführt: Doppelfärbung GrB und CD19: 1. GrB + IgG2a-FITC -> CD19 + IgG1-RPE (Positivkontrolle) 2. GrB + IgG1-RPE -> CD19 + IgG2a-FITC (Negativkontrolle) 3. IgG2a + IgG1 (Negativkontrolle) Doppelfärbung IL-21 und CD3: 4. CD3 + IgG1-FITC -> IL-21 + IgG-RPE (Positivkontrolle) 5. CD3 + IgG-RPE -> IL-21 + IgG1-FITC (Negativkontrolle) 6. IgG2a + IgG1 (Negativkontrolle) 2.2.6. Statistische Auswertung Alle Daten sind als Mittelwerte ± Standardfehler (SEM) angegeben. Daneben sind Rohdaten einzelner Experimente mit repräsentativem Charakter zur besseren Anschaulichkeit gezeigt. Die statistische Auswertung erfolgte mit dem Student´s TTest. Unterschiede mit p-Werten <0,05 wurden als statistisch signifikant (*p) bzw. <0,01 als hochsignifikant eingestuft (**p). Ergebnisse 28 3. Ergebnisse 3.1. Regulatorische B-Zellen aus peripherem Blut 3.1.1. Die Stimulation mit Interleukin 21 induziert einen regulatorischen Phänotyp in B-Zellen Humane periphere B-Zellen sind in der Lage, nach Stimulation mit IL-21, in Abwesenheit von Perforin, Granzym B (GrB) zu exprimieren. Da von T reg bekannt ist, dass sie ihre regulatorischen Funktionen in einer GrB-abhängigen, jedoch Perforin-unabhängigen Weise ausüben [61], wurde die Hypothese ausgestellt, dass auch GrB-sezernierende B-Zellen eine regulatorische Funktion ausüben. Daher wurden ausgewählte Oberflächenantigene und intrazelluläre Moleküle bei GrB+ B-Zellen untersucht, die auch bei B10-Zellen, Treg oder regulatorischen dendritischen Zellen identifiziert wurden und das regulatorische Potential von GrB + B-Zelen verstärken könnten. Dies betrifft neben B-Zell spezifischen Oberflächenmarkern wie CD19 und CD20 und Immunglobulinen (IgM, IgD) auch diverse kostimulatorische Moleküle (CD1d, CD86, CD154, CD28, CTLA-4), Enzyme (CD10, GrB), Rezeptoren (CD25, CD27) und Adhesionsmoleküle (CD24, CD38, CD58, CD147). Für die phänotypische Charakterisierung von GrB+ B-Zellen wurden PBMC aus peripherem Blut von gesunden Spendern für 4 Tage mit und ohne IL-21 und antiBCR inkubiert und anschließend durchflusszytometrisch auf die Anwesenheit der verschiedenen Marker bei B-Zellen analysiert. In Abbildung 3 sind die Expressionslevel der einzelnen Oberflächenmoleküle im Vergleich der unterschiedlichen Stimuli dargestellt. Es zeigt sich eine signifikante Erhöhung der Expression der Oberflächenproteine CD38, CD1d, IgM, CD86, CD154, CD10 und CD20 bei IL-21/anti-BCR stimulierten GrB+ B-Zellen, während CD24 und IgD in diesen Zellen ein niedrigeres Expressionslevel aufweisen im Vergleich zu unstimulierten Zellen. Die Stimulation mit IL-21 alleine hat keine signifikanten Auswirkungen auf die verschiedenen Oberflächenmarker. Ein wesentliches Merkmal muriner Breg ist die häufige Anwesenheit von IL-10. Deshalb wurden PBMC von gesunden Spendern für 4 Tage in An- und Abwesenheit von anti-BCR, IL-2, IL-21 oder in Kombinationen inkubiert und anschließend mittels FACS die Expression von IL-10 analysiert (Abbildung 4). Ohne Stimulus liegt der prozentuale Anteil von IL-10+ CD19+ B-Zellen unter einem Prozent (Abbildung 4A, B). Die Stimulation mit anti-BCR, IL-2 oder IL-21 alleine Ergebnisse 29 führt zu keinem signifikanten Anstieg an IL-10, während die Kombination von IL-21 und anti-BCR eine ausgeprägte IL-10-Population induziert. Der Anteil an IL-10+ BZellen ist etwa um das 4-fache höher als bei allen anderen Bedingungen. Ein kleiner Teil der IL-21/ anti-BCR stimulierten GrB+ B-Zellen exprimiert also auch den murinen Breg-Marker IL-10. + Abbildung 3: GrB B-Zellen haben einen regulatorischen Phänotyp PBMC von gesunden Spendern wurden für 4 Tage in An- und Abwesenheit von anti-BCR und IL21 inkubiert, gegen CD19 und verschiedene weitere Oberflächenmoleküle, sowie intrazellulär auf die Expression von GrB gefärbt und anschließend mittels FACS analysiert. Im Balkendiagramm sind die MFI´s aus 3 unterschiedlichen Experimenten mit Standardfehler (SEM) gezeigt. Die gestrichelte Linie gibt die durchschnittlichen Werte der Isotypkontrollen an. Die p-Werte zeigen signifikante Unterschiede an; das Signifikanzniveau liegt bei 0,05. Ergebnisse 30 A B Abbildung 4: IL-21 induziert die Expression von IL-10 in B-Zellen PBMC von gesunden Spendern wurden für 4 Tage wie angegeben in An- und Abwesenheit von anti-BCR, IL-2 oder IL-21 inkubiert, auf CD19 gefärbt, sowie intrazellulär auf die Expression von IL10 gefärbt und anschließend mittels FACS analysiert. Dargestellt ist der prozentuale Anteil von IL+ 10 in CD19 BC von einem repräsentativen Experiment. Alle Isotyp-Kontrollen waren negativ. (B) Im Balkendiagramm sind die Mittelwerte aus 3 unterschiedlichen Experimenten mit Standardfehler (SEM) gezeigt. Die jeweiligen signifikanten Unterschiede sind als p-Werte angegeben. Neben typischen Breg-Markern wir CD1d, CD38 oder IL-10 wurden auch Tregspezifische Moleküle, wie CD25, CD147, CD28, FoxP3 und CTLA-4 betrachtet. Hierfür wurden periphere CD19+ B-Zellen und CD4+ T-Zellen von gesunden Spendern separat oder bei einer Ratio von 1:1 in An- und Abwesenheit von antiBCR, IL-2 oder IL-21 für 3 Tage kultiviert und anschließend mittels FACS analysiert. Während CD28, FoxP3 oder CTLA-4 nicht exprimiert werden (Daten nicht gezeigt), wird das Adhäsionsmolekül CD147 durch die Stimulation mit IL-21 Ergebnisse 31 und anti-BCR hochreguliert (Abbildung 3). Auch CD25 wird vermehrt auf GrB+ BZellen exprimiert. In Abbildung 5A ist die Expression von CD25 auf B-Zellen und T-Zellen dargestellt. Separat inkubiert (BZ und TZ alleine) oder in Kokultur werden CD4+ T-Zellen nicht von den Stimulantien beeinflusst, während B-Zellen eine erhöhte CD25-Expressionsrate nach Stimulation mit IL-21 und anti-BCR aufweisen. IL-2 hat keinen Einfluss auf die CD25-Expression, mit IL-21 verdoppelt sich diese im Vergleich zu unstimulierten Zellen und die Kombination IL-21 + antiBCR führt zu einer 8-fachen Erhöhung der CD25-Expression (Abbildung 5B). Damit ist ein weiteres wichtiges immunregulatorisches Molekül auf GrB+ B-Zellen zu finden. A B + Abbildung 5: Das immunoregulatorische Molekül CD25 wird von GrB B-Zellen exprimiert + + (A) Periphere CD19 B-Zellen (Reinheit >98%) und CD4 T-Zellen (Reinheit >95%) von gesunden Spendern wurden separat oder bei einer Ratio von 1:1 in An- und Abwesenheit von anti-BCR, IL-2 oder IL-21 für 3 Tage kultiviert, auf CD19, CD4 und CD25 gefärbt und anschließend mittels FACS analysiert. Dargestellt ist die Expression von CD25 auf den jeweiligen Zellen eines repräsentativen Experiments. (B) Im Balkendiagramm sind die Mittelwerte der CD25 Expression auf B-Zellen nach Kokultur mit CD4+ T-Zellen aus 3 unterschiedlichen Experimenten mit Standardfehler (SEM) gezeigt. Die p-Werte geben signifikante Unterschiede an. Ein intrazellulär wirksames regulatorisches Enzym ist Indolamin-2,3- + Dioxygenase (IDO). Um dessen Expression in GrB Breg nachzuweisen, wurden periphere B-Zellen von gesunden Spendern isoliert und in An- und Abwesenheit Ergebnisse 32 verschiedener Zytokine (IL-2 oder IL-21) für 48h inkubiert. Da die Expressionsrate von GrB durch Kostimulation von IL-21 und anti-BCR erhöht ist, wurde auch dieses Experiment mit und ohne Kostimulation durchgeführt. In Abbildung 6A ist die durchflusszytometrische Analyse eines repräsentativen Experiments dargestellt. A + IL-2 Medium 10 4 10 4 10 3 10 3 10 3 10 2 10 2 1.7 10 1 CD19 PE + IL-21 10 4 10 2 2.3 10 1 10 0 10 0 10 1 10 2 10 3 10 4 10 1 10 0 10 0 10 1 10 2 10 3 10 4 10 0 10 0 10 4 10 4 10 4 10 3 10 3 10 3 10 2 10 2 2.2 10 1 10 1 10 2 10 3 10 4 10 1 10 2 10 2 1.9 10 1 10 0 10 0 Medium 1.7 10 3 10 4 Anti-BCR 5.4 10 1 10 0 10 0 10 1 10 2 10 3 10 4 10 0 10 0 10 1 10 2 10 3 10 4 IDO Alexa-Fluor 488 * p < 0.04 B * p < 0.01 4 + IDO BC [%] 2 0 IL-2 - + - - + - IL-21 - - + - - + - - - + + + Anti-BCR Abbildung 6: IL-21 induziert die Expression von IDO in B-Zellen (A) Isolierte B-Zellen von gesunden Spendern (Reinheit >99%) wurden für 48h wie angegeben in An- und Abwesenheit von anti-BCR, IL-2 oder IL-21 inkubiert, intrazellulär auf die Expression von IDO gefärbt und anschließend mittels FACS analysiert. Dargestellt ist der prozentuale Anteil von + IDO in CD19 BC von einem repräsentativen Experiment. Alle Isotyp-Kontrollen waren negativ. (B) Im Balkendiagramm sind die Mittelwerte aus 3 unterschiedlichen Experimenten mit Standardfehler (SEM) gezeigt. Die p-Werte zeigen signifikante Unterschiede an. Ergebnisse 33 B-Zellen exprimieren basal eine geringe Menge an IDO (~1,7%), die sich durch die alleinige Zugabe von IL-2 oder IL-21 nicht signifikant steigern lässt (Abbildung 6B). Die Zugabe von anti-BCR, sowie die Kostimulation von IL-2 und anti-BCR führen ebenfalls zu keiner erhöhten IDO-Expression, während IL-21 und anti-BCR zusammen den Anteil an IDO annähernd verdoppeln (>4%). Es kann daher davon ausgegangen werden, dass neben GrB auch IDO als regulatorisches Molekül von IL-21 in peripheren B-Zellen induziert wird. Insgesamt ergab die phänotypische Charakterisierung von IL-21-stimulierten BZellen, dass neben GrB auch typische Breg- und Treg-Marker wie IL-10, IDO, CD1d, CD25, CD38 und CD174 exprimiert werden. GrB+ B-Zellen besitzen somit einen ausgeprägten regulatorischen Phänotyp. 3.1.2. Immunregulatorischer Effekt Granzym B-sezernierender B-Zellen Wie durch unsere Arbeitsgruppe bereits gezeigt werden konnte, besitzen GrB+ Breg das Potential, aktives GrB direkt auf T-Zellen zu übertragen, ohne jedoch Apoptose in den Zellen auszulösen. Da viele Breg die Fähigkeit besitzen, die TZell-Proliferation zu hemmen (s. Tab. 2), wurden mit GrB + BZ Proliferationsversuche in Kokultur mit CD4+ T-Zellen durchgeführt. Periphere CD4+ T-Zellen wurden mit Carboxyfluorescein-Succinimidyl-Ester (CFSE) gefärbt und mit allogenen B-Zellen unter Stimulation von IL-21 und antiBCR in An- und Abwesenheit von GrB-Inhibitoren kokultiviert. Die T-ZellProliferation wurde durch Zugabe von anti-CD3/28-Microbeads induziert. Nach 6 Tagen wurden die Zellen durchflusszytometrisch analysiert (Abbildung 7A). Die T-Zell-Proliferation wurde in Anwesenheit von IL-21/anti-BCR-aktivierten BZellen ohne GrB-Inhibitor um 50% (von knapp 40% auf etwa 20%) supprimiert. Die Stimulation von BZ mit anti-BCR alleine zeigt zwar ebenfalls eine geringe Auswirkung auf die TZ-Population, was jedoch mit der langen Inkubationsdauer und dem Medienverbrauch durch die BZ in der Kokultur erklärt werden kann. Die Zugabe eines spezifischen GrB-Substratinhibitors oder eines GrB-Antikörpers bedingte eine Wiederherstellung der T-Zell-Proliferation auf fast 40%. GrB aus Ergebnisse 34 aktivierten GrB+ B-Zellen hat somit signifikante Auswirkungen auf die Proliferation von T-Zellen (Abbildung 7B). A anti-BCR anti-BCR + IL-21 B Abbildung 7: Die Hemmung der T-Zell-Proliferation durch IL-21 aktivierte B-Zellen ist Granzym B abhängig + (A) Periphere CD4 T-Zellen von gesunden Spendern (Reinheit >98%) wurden mit CFSE gefärbt und mit allogenen B-Zellen (Reinheit >99%) bei einer Ratio von 1:1 unter Stimulation von IL-21 und anti-BCR in An- und Abwesenheit von GrB-Inhibitoren kokultiviert. Die T-Zell-Proliferation wurde durch Zugabe von anti-CD3/28-Microbeads induziert. Nach 6 Tagen wurden die Zellen geerntet, mit fluoreszenzmarkierten Antikörpern gegen CD4 und CD19 gefärbt und durchflusszytometrisch analysiert. Dargestellt ist der prozentuale Anteil an proliferierten CD4+ T-Zellen eines repräsentativen Experiments. (B) Im Balkendiagramm sind die Mittelwerte aus 3 unterschiedlichen Experimenten mit Standardfehler (SEM) gezeigt. Die p-Werte zeigen signifikante Unterschiede an. Ergebnisse 35 Bereits vor einiger Zeit konnte gezeigt werden, dass die ζ-Kette des TCR (TCRζ) ein Substrat von GrB ist [164]. Die Inhibition der T-Zell-Proliferation durch GrB+ Breg könnte daher durch eine Degradierung von TCR-ζ erklärt werden, da diese für die intrazelluläre Signalweiterleitung verantwortlich ist. Um diese Hypothese zu testen, wurden CD3/28-aktivierte CD4+ T-Zellen mit IL-21/anti-BCR-präaktivierten B-Zellen für 24h kokultiviert und anschließend TCR-ζ per Western Blot nachgewiesen. Abbildung 8A zeigt einen repräsentativen Immunoblot. A TCR-z (17.9 kDa) b-Aktin (42 kDa) Anti-BCR + + + + IL-21 - + - + Anti-GrB - - + + B ** p < 0.002 Relative Bandenintensität TCR-z : b-Aktin ** p < 0.005 1,0 0,8 0,6 0,4 0,2 0 Anti-BCR IL-21 Anti-GrB + - + + - + + + + + Abbildung 8: Granzym B-sezernierende B-Zellen degradieren die zeta-Kette des T-ZellRezeptors + (A) B-Zellen von gesunden Spendern (Reinheit >99%) wurden mit allogenen CD4 T-Zellen (>98%) für 24h in An- oder Abwesenheit eines GrB-Antikörpers kokultiviert. Nach Lyse der Zellen wurde TCR-ζ mittels Western Blot nachgewiesen. β-Aktin diente als Ladekontrolle. Gezeigt ist ein Experiment von 5 mit vergleichbaren Ergebnissen. (B) Die relative Bandenintensität von TCR-ζ und Ergebnisse 36 b-Aktin wurde mit Image J berechnet. Die Balkendiagramme zeigen die Verhältnisse der Bandenintensitäten aus TCR-ζ:b-Aktin. In Abwesenheit von IL-21 wird kein TCR-ζ abgebaut und eine Bande ist daher deutlich erkennbar. In Anwesenheit von IL-21 dagegen wird die ζ-Kette degradiert (schwache Bande im Vergleich zu anti-BCR alleine). Um nachzuweisen, dass dieser Effekt GrB-abhängig von Breg vermittelt wird, wurde jeweils in An- und Abwesenheit von IL-21 ein Anti-Granzym B Antikörper (Anti-GrB) der Kultur zugegeben. Es zeigt sich, dass die Blockade von GrB den regulatorischen Effekt der Breg aufhebt und TCR-ζ damit nicht abgebaut wird. Kontrollversuche mit gesunden CD4+ T-Zellen alleine ohne B-Zellen zeigten keine Veränderung der TCR-ζ-Intensität in An- oder Abwesenheit von IL-21. Auch die Gegenwart des blockierenden GrB-Antikörpers alleine hatte keinen Einfluss auf TCR-ζ (Daten nicht gezeigt). b-Aktin wurde als Ladekontrolle detektiert und diente gleichzeitig der statistischen Auswertung der relativen Bandenintensitäten TCR-ζ:b-Aktin (Abbildung 8B). Der repräsentative Blot zeigt, dass TCR-ζ durch GrB signifikant abgebaut, durch die Hemmung der Protease jedoch erhalten wird. 3.2. Regulatorische GrB+ B-Zellen in humanem Gewebematerial Wie bereits einleitend erwähnt, steht kein geeignetes in-vivo-Mausmodell für GrB+ B-Zellen zur Verfügung, da sich diese Zellen dort nicht induzieren lassen [69, 169]. Um demnach zeigen zu können, dass GrB+ Breg in-vivo eine Rolle spielen, wurden ausgewählte humane pathologische Präparate auf deren Anwesenheit gescreent. Desweiteren wurden Tumor-infiltrierende Lymphozyten (TIL´s, hauptsächlich Tumor-infiltrierende BZ (TIL-B)) aus primären Gewebeproben von Patienten mit Tumorerkrankungen des Kopf-Hals-Bereichs isoliert und ex-vivo auf die Anwesenheit regulatorischer Marker bei B-Zellen untersucht. Zudem wurden B-Zellen von gesunden Spendern im Vergleich zu B-Zellen von HIV-Patienten exvivo auf die Anwesenheit und Funktion von GrB+ B-Zellen und ihrem Effekt bezüglich der Degradierung von TCR-ζ analysiert. Ergebnisse 3.2.1. Screening 37 von humanen pathologischen Präparaten auf die Anwesenheit von GrB+ Breg Da Tumor-infiltrierende B-Zellen (TIL-B) in einigen Tumorarten identifiziert wurden und möglicherweise eine wichtige Rolle bei der Anti-Tumor-Immunantwort spielen [115], wurde eine Anzahl verschiedener humaner pathologischer Gewebeproben (Paraffinschnitte) auf die Anwesenheit von GrB + B-Zellen untersucht. Zu den betrachteten Tumorarten zählten Mamma-, Ovarial- und Zervixkarzinom, sowie Prostata-, Schilddrüsen- und kolorektales Karzinom. Da bekannt ist, dass auch Zellen des Hodgkin-Lymphoms IL-21 bilden [85], wurde auch Gewebematerial dieses Krankheitsbildes untersucht. Für jede Tumorentität Doppelimmunfluoreszenz wurden untersucht. Die jeweils drei Fälle mittels jeweiligen klinisch-pathologischen Parameter (Diagnose, Alter und Geschlecht der Patienten, Tumorstadium und –grading) der ausgewählten Tumoren sind in Tabelle 5 zusammengefasst. Gefärbt wurden die Paraffinschnitte auf die Anwesenheit von GrB (Alexa Fluor Streptavidin 488, grün) und CD19 bzw. CD3 (Cy3, rot), sowie auf IL-21 (DyLight 488, grün) und CD3 bzw. CD19 (Cy3, rot). Um sicherzustellen, dass es zu keinen unspezifischen Bindungen der jeweiligen Antikörper kam, wurden Isotypkontrollen wie im Methodenteil beschrieben, durchgeführt. Alle Isotypkontrollen waren negativ und unspezifische Kreuzreaktionen konnten ausgeschlossen werden (Daten nicht gezeigt). In den nachfolgenden Abbildungen (Abb. 9A-G) sind Fluoreszenzaufnahmen der Gewebeschnitte gezeigt. Bei fast allen Tumorentitäten konnten GrB + B-Zellen in der unmittelbaren Umgebung von Tumorzellen identifiziert werden, wenn auch in nur geringer Frequenz (Tabelle 5). In muzinösen kolorekatalen Karzinomen und einem invasivem Schilddrüsenkarzinom konnten keine GrB + B-Zellen gefunden werden (Fluoreszenzaufnahmen nicht gezeigt), in Prostata- und Schilddrüsenkarzinomen lag die Frequenz unter 0,5%. Mammakarzinome und Hodgkin-Lymphome besitzen im Schnitt 2% GrB+ B-Zellen. Zervix- und Ovarialkarzinome weisen stärker schwankende Frequenzen auf. Neben GrB + BZellen wurden auch CD3+ GrB+ Zellen identifiziert, deren Frequenz jedoch nicht signifikant höher war (Abb.9A-G, rechte Spalte; Daten nicht gezeigt). Da GrB+ B-Zellen im Tumorgewebe gefunden wurden und IL-21 maßgeblich für deren Differenzierung verantwortlich ist, wurde auch untersucht, ob dieses Zytokin Ergebnisse 38 ebenfalls in den gewählten Gewebeschnitten zu finden und in der Nähe von BZellen exprimiert wird. Hierfür wurden die erhaltenen Paraffinschnitte ebenfalls mittels Doppelimmunfluoreszenz auf IL-21 (grün) und CD3 bzw. CD19 gescreent (rot, Abb. 9A-G, mittlere Spalte). Die Frequenz von IL-21 in den Gewebeschnitten ist ebenfalls in Tabelle 5 zusammengefasst. Es konnten in fast allen Gewebeproben IL-21+ Zellen in der Nähe von CD19+ B-Zellen identifiziert werden, während in Schnitten, die kein GrB aufwiesen (muzinöse kolorekatale Karzinome, invasives Schilddrüsenkarzinom) auch keine IL-21+ Zellen gefunden wurden. Prostatakarzinome wiesen eine geringe Frequenz an GrB + B-Zellen und an IL-21+ Zellen in der unmittelbaren Umgebung auf. Mamma-Karzinom: IL-21 – CD19 GrB – CD19 GrB – CD3 (I) hochgradig differenziert, infiltrierend, invasiv (II) mittelgradig differenziert, duktal invasiv (III) differenziert, infiltrierend, invasiv + + Abbildung 9A: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (Mammakarzinome von drei verschiedenen Patienten (I-III), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne + erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte auf die Anwesenheit von IL-21 + Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) gefärbt (mittlere Spalte). Auch Ergebnisse 39 + Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Ovarial-Karzinom: GrB – CD19 IL-21 – CD19 GrB – CD3 (I) diffuse Peritonealkarzinose (II) muzinöses Adenokarz., mittelgradig differenziert (III) gering differenziert, nekrotisch zerfallend, seriös-papillär + + Abbildung 9B: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (Ovarialkarzinome von drei verschiedenen Patienten (I-III), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne + erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte auf die Anwesenheit von IL-21 + Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) gefärbt (mittlere Spalte). Auch + Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Ergebnisse 40 Zervix-Karzinom: GrB – CD19 IL-21 – CD19 GrB – CD3 (I) gering differenziert, überwiegend nicht verhornend, invasiv (II) gering differenziert, gering verhornend, invasiv (III) mittelgradig differenziert, gering verhornend, invasiv + + Abbildung 9C: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (Zervixkarzinome von drei verschiedenen Patienten (I-III), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne + erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte auf die Anwesenheit von IL-21 + Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) gefärbt (mittlere Spalte). Auch + Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Ergebnisse 41 Prostata-Karzinom: (I) differenziertes, GrB – CD19 IL-21 – CD19 GrB – CD3 tubulär gebautes kribiformes, solides Adenokarzinom (II) Adenokarzinom (III) azinäres Adenokarzinom + + Abbildung 9D: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (Prostatakarzinome von drei verschiedenen Patienten (I-III), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne + erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte auf die Anwesenheit von IL-21 + Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) gefärbt (mittlere Spalte). Auch + Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Ergebnisse 42 Colorektales Karzinom: GrB – CD19 IL-21 – CD19 GrB – CD3 IL-21 – CD19 GrB – CD3 (I) hoch- bis mittelgradig differenziertes, tubuläres Adenokarzinom (II) Adenokarzinom d. Colon ascendens Neuroblastom: GrB – CD19 (I) diffuses Ganglioneuroblastom + + Abbildung 9E: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Ergebnisse 43 Paraffinschnitte humaner pathologischer Gewebe (kolorektale Karzinome von zwei verschiedenen Patienten (I-II), Neuroblastom von einem Patienten (I), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte + + auf die Anwesenheit von IL-21 -Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) + gefärbt (mittlere Spalte). Auch Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Schilddrüsen-Karzinom: GrB – CD19 IL-21 – CD19 GrB – CD3 (I) papilläres Schilddrüsen- IL-21 nicht karzinom mit detektierbar chronischer lymphozytärer Thyroiditis (II) IL-21 nicht follikuläres detektierbar Schilddrüsenkarzinom + + Abbildung 9F: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (Schilddrüsenkarzinome von zwei verschiedenen Patienten (I-II), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne + erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte auf die Anwesenheit von IL-21 + Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) gefärbt (mittlere Spalte). Auch + Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Ergebnisse 44 Hodgkin-Lymphom: GrB – CD19 IL-21 – CD19 GrB – CD3 (I) noduläres, lymphozytenprädominantes HodgkinLymphom (II) follikuläres non-HodgkinLymphom (III) klassischer Morbus Hodgkin + + Abbildung 9G: GrB B-Zellen und IL-21 T-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (Hodgkin-Lymphom von drei verschiedenen Patienten (I-III), Diagnose wie angegeben) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von GrB (grün) und CD19 (rot) gefärbt (linke Spalte). Die Färbung der Zellkerne + erfolgte mit DAPI (blau). Außerdem wurden die Paraffinschnitte auf die Anwesenheit von IL-21 + Zellen in unmittelbarer Umgebung von CD19 B-Zellen (rot) gefärbt (mittlere Spalte). Auch + Aufnahmen von GrB (grün)- exprimierenden CD3 Zellen (rot) sind gezeigt (rechte Spalte). Die Aufnahmen erfolgten bei 60-facher Vergrößerung. Ergebnisse 45 Tabelle 5: Klinisch-pathologische Parameter der gescreenten Tumorentitäten Aufgelistet sind die zu den gewählten Gewebeschnitten erhaltenen klinisch-pathologischen Parameter (Diagnose, Alter und Geschlecht der Patienten, Tumorstadium und -grading) sowie die + + Frequenz der GrB B-Zellen und der IL-21 Zellen. Angegeben sind die Mittelwerte in ‰ mit Standardfehler (SEM), ausgezählt pro Sichtfeld aus 6 verschiedenen Ausschnitten desselben Schnittes bei 60-facher Vergrößerung. Tumorart Diagnose Tumor- Tumor- 0 /00 GrB + + 0 + /00 IL-21 Geschlecht Alter Stadium grad CD19 BC Zellen w 77 pT2, pN1a II 10 ± 1 53 ± 19 w 61 pT1b, pN0 II 19 ± 5 24 ± 4 differenziert, infiltrierend, invasiv w 78 pT2, pN1 II 27 ± 13 32 ± 9 diffuse Peritonealkarzinose w 51 pT3c I 13 ± 3 23 ± 0 w 39 pT1c II 6±1 57 ± 8 w 71 pT3c III 9±2 53 ± 19 w 42 pT2b III 18 ± 7 43 ± 11 hochgradig differenziert, infiltrierend, invasiv MammaKarzinom mittelgradig differenziert, duktal invasiv muzinöses AdenoOvarial- karzinom, mittelgradig Karzinom differenziert gering differenziert, nekrotisch zerfallend, seriös-papillär gering differenziert, überwiegend Karzinom nicht verhornend, Zervix- Ergebnisse 46 invasiv Colorektales gering differenziert, gering verhornend, invasiv w 70 pT2b II 5±1 35 ± 5 mittelgradig differenziert, gering verhornend, invasiv w 41 pT1b1 III 6±2 28 ± 4 hoch- bis mittelgradig differenz., tubuläres Adenokarzinom m 82 pT1p N0pMx I-II 7±2 35 ± 9 muzinöses Adenokarzinom des Colon ascendens w 79 pT3p N0pMx III 0±0 30 ± 12 muzinöses Adenokarzinom w 40 III 0±0 12 ± 5 Adenokarzinom des Colon ascendens, Infiltration ins Fettgewebe m 78 pT3 N0L0V0R0 III 10 ± 6 46 ± 14 differenziertes u. tubulär gebautes kribiformes, solides Adenokarzinom m 73 pT2c 3+4=7* 5±3 7±4 Adenokarzinom m 57 pT3b 4+5=9* 5±2 17 ± 4 Azinäres Adenokarzinom m 64 pT2c 3+3=6* 4±2 23 ± 7 diffuses Ganglioneuroblastom w 2 G1a 28 ± 22 69 ± 44 Karzinom ProstataKarzinom Neuroblastom Ergebnisse 47 Teils Gangliozytom w 2 papillär, chronische lymphozytäre Thyroiditis w 9 m 52 invasiv w 88 nodulär, lymphozytenprädominant m 47 follikuläres non-HodgkinLymphom Lymphom m 79 m 61 Schild- G2 pT2N1aR0 0±0 0±0 13 ± 20 n.d. 4±7 n.d. 0±0 0±0 13 ± 9 21 ± 11 25 ± 9 34 ± 4 18 ± 6 14 ± 8 drüsenKarzinom follikulär pT3V1 LxNxR0 Hodgkin- klassischer Morbus Hodgkin In einem weiteren Ansatz wurden 1-2 die erhaltenen Schnitte mittels Doppelimmunfluoreszenz auf die Anwesenheit von IL-10 (DyLight 488, grün) und CD19 (Cy3, rot) gefärbt. Dieses vor allem für murine B reg charakteristische Zytokin wurde ebenfalls in einigen, jedoch nicht in allen untersuchten Tumorschnitten gefunden und in wesentlich geringerer Frequenz als GrB+ B-Zellen (Abb. 10, hochgradig differenziertes, infiltrierendes, invasives Mammakrazinom (A), mittelgradig differenziertes, gering verhornendes, invasives Zervix-Karzinom (B), noduläres, lymphozyten-prädominantes Hodgkin-Lymphom (C), statistische Daten nicht gezeigt). A B + C Abbildung 10: IL-10 B-Zellen infiltrieren Tumorgewebe Paraffinschnitte humaner pathologischer Gewebe (hochgradig differenziertes, infiltrierendes, invasives Mammakarzinom (A), mittelgradig differenziertes, gering verhornendes, invasives Zervix- Ergebnisse 48 Karzinom (B), noduläres, Lymphozyten-prädominantes Hodgkin-Lymphom (C)) wurden mittels Doppelimmunfluoreszenz auf die Anwesenheit von IL-10 (grün) und CD19 (rot) gefärbt. Die Färbung der Zellkerne erfolgte mit DAPI (blau). Die Aufnahmen wurden bei 60-facher Vergrößerung gemacht. Da für jede Tumorentität nur drei unterschiedliche Fälle betrachtet wurden, wurden keine signifikanten Korrelationen zwischen GrB+ B-Zellen, der Anwesenheit von IL-21 und den klinisch-pathologischen Parametern gefunden. 3.2.2. Tumor-infiltrierende Lymphozyten (TILs) aus Patienten mit Hals-KopfTumoren Da GrB+ B-Zellen in Tumorgewebeschnitten zu finden sind, wurde in einem weiteren Schritt begonnen, TILs direkt nach Sektion aus frischem Tumormaterial zu isolieren und diese Zellen bezüglich ihres regulatorischen Phänotyps zu charakterisieren. Für die Analysen wurden uns Lymphknotenmetastasen und Plattenepithelkarzinome (PEK) des Kopf-Hals-Bereichs von verschiedenen Patienten zur Verfügung gestellt. Als Kontrollgewebe wurden Tonsillen von gesunden Individuen verwendet (n=2). Die Aufarbeitung des Gewebes und die Isolation der Zellen erfolgte wie unter 2.2.1.3. beschrieben. Es wurden Gewebeproben von insgesamt 2 Patienten mit Lymphknotenmetastase (n=2) und einem Patienten mit Plattenepithelkarzinom (n=1) untersucht, weshalb für den Tumor keine Fehlerbalken und Signifikanzen angegeben sind. Die erhaltenen TILs wurden durchflusszytometrisch auf die Anwesenheit verschiedener Breg-Marker analysiert. In Abbildung 11A sind die erhaltenen MFI´s von GrB, IDO, CD25 und IL-10 der Lymphknotenmetastasen und des Plattenepithelkarzinoms im Vergleich zum Kontrollgewebe dargestellt. Sowohl in den Metastasen als auch im PEK konnten TIL-B-Zellen mit stark erhöhter GrB-Expression nachgewiesen werden. Die Metastasen zeigten auch einen leicht erhöhten Level an IDO, während CD25 und IL-10 nicht exprimiert wurden. Im Tumorgewebe fanden sich weniger TIL-B mit IDO-Expression als im Kontrollgewebe, das Level an IL-10 war jedoch erhöht. CD25 schient bei diesen Geweben ebenfalls keine Rolle zu spielen. Andere Marker wie CD10, CD20, CD24, CD27, CD38, CD1d, IgM, IgD, CD86 und CD154 Ergebnisse 49 wurden ebenfalls analysiert, zeigten jedoch keine signifikanten Unterschiede zum Kontrollgewebe (Daten nicht gezeigt). Auch IL-21 wurde in den erhaltenen TILs ex-vivo analysiert (Abb. 11B). Im Tumorgewebe wurde IL-21 ähnlich stark exprimiert wie im Kontrollgewebe. Das Metastasengewebe zeigte jedoch eine um Faktor 1,8 erhöhte IL-21-Expression. Die bislang erhaltenen Ergebnisse deuten auf die Anwesenheit von GrB + Breg in HNO-Tumoren und Metastasen hin, wobei für eine statistisch fundierte Aussage die Aufarbeitung einer höheren Anzahl von Gewebeproben notwendig ist. A 120 Kontrollgewebe (n=2) 100 Metastase (n=2) PEK (n=1) MFI 80 60 40 20 0 GrB B IDO CD25 IL10 80 70 MFI IL-21 60 50 40 30 20 10 0 Kontrollgewebe Metastasen PEK Abbildung 11: Regulatorischer Phänotyp bei TIL-B aus Hopf-Hals-Tumoren PBMC aus Plattenepithelkarzinom PEK (n=1; weiß) und Metastasen (n=2; grau) des Kopf-Hals- Ergebnisse 50 Bereichs und Tonsillen als Kontrollgewebe (n=2; schwarz) wurden isoliert, ex-vivo gegen CD19 und verschiedene Oberflächenmoleküle gefärbt, sowie intrazellulär auf die Expression von GrB, IDO und IL-10 gefärbt und anschließend mittels FACS analysiert. (A). PBMC wurden ebenfalls gegen CD4 und intrazellulär auf IL-21 gefärbt und mittels FACS analysiert. (B). Im Balkendiagramm sind die Mittelwerte der MFI mit Standardfehler (SEM) der jeweiligen Marker gezeigt. Alle Isotyp-Kontrollen waren negativ. 3.2.3. Regulatorische B-Zellen bei HIV-Infektionen Ein weiteres Teil-Projekt neben der Identifikation von GrB+ B-Zellen in Tumorgewebe und der phänotypischen Charakterisierung dieser Zellen bei KopfHals-Metastasen war die Analyse des regulatorische Potentials von GrB+ B-Zellen bei HIV-Patienten. Hierzu wurden GrB+ B-Zellen aus HIV-Patienten isoliert und ihr Effekt auf TCR-ζ von T-Zellen analysiert. Der Nachweis von GrB+ B-Zellen bei HIV-Patienten und deren Charakterisierung wurde im Rahmen eines Parallelprojekts innerhalb unserer Arbeitsgruppe geführt [80]. Da ein verringerter TCR-ζ-Level bei T-Zellen von HIV-Patienten vorliegt, die Gründe hierfür aber noch nicht eindeutig klar sind [60, 153], wurde die Hypothese aufgestellt, dass TCR-ζ als GrB-Substrat durch GrB+ Breg von HIV-infizierten Patienten degradiert werden könnte. Um diese Hypothese zu untermauern, wurden in einer ersten Versuchsreihe CD4+ T-Zellen HIV-positiver Patienten direkt aus ihrem peripheren Blut isoliert und in An- und Abwesenheit eines extrazellulären (anti-GrB) und intrazellulären GrBInhibitors (Caspase-III-Inhibitor) für 24h kultiviert. Anschließend erfolgte die Detektion von TCR-ζ mittels Immunoblot (Abbildung 12A). Als Kontrolle wurden TZellen gesunder Spender kultiviert. Wie erwartet zeigten CD4 + T-Zellen von HIVPatienten eine signifikant schwächere TCR-ζ-Bande als T-Zellen von gesunden Spendern (Abbildung 12A,B). Die Zugabe von GrB-Inhibitoren erwirkte einen deutlichen Anstieg des TCR-ζ-Levels bei T-Zellen aus HIV-Patienten, was darauf hindeutet, dass tatsächlich GrB für die Degradierung der ζ-Kette verantwortlich war. Um eindeutig zu belegen, dass GrB+ Breg für die Degradierung verantwortlich sind, wurden B-Zellen aus infizierten Spendern isoliert und ex-vivo mit CD4+ TZellen gesunder Spender für 24h kokultiviert. Anschließend erfolgte die Detektion von TCR-ζ mittels Immunoblot (Abbildung 13). Ergebnisse 51 Zur Kontrolle wurden B-Zellen gesunder Spender mit allogenen CD4+ T-Zellen kokultiviert, sowie CD4+ T-Zellen alleine. Alle Ansätze erfolgten mit T-Zellen desselben Spenders. Zudem wurde auch die Wirkung eines neutralisierenden GrB-Antikörpers (anti-GrB) getestet. B-Zellen von HIV-Patienten degradierten TCR-ζ, während B-Zellen von gesunden Spendern keine Auswirkungen hatten. Der Einsatz von GrB-Inhibitoren beeinflusste den TCR-ζ-Level von T-Zellen alleine, sowie von T-Zellen in Kokultur mit gesunden B-Zellen nicht. Im Gegensatz hierzu war in T-Zellen, welche mit B-Zellen aus HIV-Patienten kultiviert wurden, durch GrB-Inhibition eine signifikante Verstärkung des ζ-Levels zu verzeichnen. Es konnte damit durch die Experimente gezeigt werden, dass GrB + B-Zellen aus HIVPatienten für die Degradierung der TCR-ζ-Kette verantwortlich sind und somit ein regulatorisches Potential gegenüber T-Zellen besitzen. + A + CD4 TC von CD4 TC von HIV Patienten gesunden Spendern TCR-z (19 kDa) b-Aktin (42 kDa) GrB Inhibition - + + ** p < 0.01 1.2 TCR-zb-Aktin Relative Bandenintensität B - n.s. * p < 0.03 0.8 0.4 0 HIV GrB Inhibition + + - + - - - + + Abbildung 12: CD4 T-Zellen von HIV-positiven Patienten weisen stark reduzierte TCR-ζKetten-Level auf Ergebnisse 52 + (A) Isolierte CD4 T-Zellen (>98%) von gesunden Spendern und HIV-infizierten Spendern wurden direkt für 24h in An- oder Abwesenheit eines GrB-Antikörpers sowie eines intrazellulären GrBInhibitors kultiviert. Nach Lyse der Zellen wurde TCR-ζ mittels Western Blot nachgewiesen. β-Aktin diente als Ladekontrolle. Gezeigt ist ein Experiment von 4 mit vergleichbaren Ergebnissen. (B) Die relative Bandenintensität aus TCR-ζ und b-Aktin wurde mit Image J berechnet. Die Balkendiagramme zeigen die Verhältnisse der Bandenintensitäten aus TCR-ζ:b-Aktin. A HIV BC gesunde BC gesunde TC + gesunde TC + gesunde TC alleine TCR-z (19 kDa) b-Aktin (42 kDa) GrB Inhibition - + B - + - + 1.6 TCR-zb-Aktin Relative Bandenintensität ** p < 0.01 n.s. * p < 0.05 1.2 0.8 0.4 0 HIV + + - - GrB Inhibition - + - + Abbildung 13: Regulatorische B-Zellen von HIV-Patienten degradieren die ζ-Kette des TCR (A) Isolierte B-Zellen (Reinheit >99%) von HIV-Patienten oder gesunden Donoren wurden mit + allogenen CD4 T-Zellen (>98%) von gesunden Spendern für 24h in An- oder Abwesenheit eines GrB-Antikörpers kokultiviert. Nach Lyse der Zellen wurde TCR-ζ mittels Western Blot + nachgewiesen. β-Aktin diente als Ladekontrolle. Kontrollversuche mit gesunden CD4 T-Zellen alleine zeigten keine Veränderung der TCR-ζ-Intensität. Gezeigt ist ein Experiment aus 4 mit vergleichbaren Ergebnissen. (B) Die relative Bandenintensität aus TCR-ζ und b-Aktin wurde mit Image J berechnet. Die Balkendiagramme zeigen die Verhältnisse der Bandenintensitäten aus TCR-ζ:b-Aktin. Diskussion 53 4. Diskussion Phänotypische Charakterisierung Im Verlauf der letzten Jahrzehnte wurde eine Reihe verschiedener Subpopulationen von B-Zellen mit immunregulatorischen Fähigkeiten identifiziert (s. Tab.2) [18, 103, 108]. Breg sind ein essentieller Bestandteil des Immunsystems, die genauen Interaktionen, Stimuli und Wirkungsweisen sind jedoch noch nicht exakt erforscht. Das pleiotrope Zytokin IL-21 scheint in diesem Zusammenhang jedoch ein potenter Induktor zu sein, da sowohl in der Maus als auch im Menschen nach Stimulation mit IL-21 B-Zellen mit immunregulatorischen Fähigkeiten auftreten [92, 169, 175]. Die Arbeitsgruppe von Herrn Prof. Dr. Jahrsdörfer konnte zeigen, dass humane B-Zellen in der Lage sind nach Stimulation mit IL-21, jedoch in Abwesenheit von CD40-Ligation, große Mengen der Serinprotease GrB sezernieren [67, 68]. Da diese Zellen weder signifikante Mengen von Granzym A, Perforin oder Granulysin exprimieren, liegt die Vermutung nahe, dass GrB hier keine zytotoxische, sondern regulatorische Funktion ausübt [67, 91]. Diese Hypothese unterstützt, dass auch GrB-exprimierende Treg immunregulatorisches Potential aufweisen. Gondek und Kollegen konnten zeigen, dass CD4+CD25+ Treg in der Lage sind, GrB zu exprimieren und Perforin-unabhängig auf Teff-Zellen zu übertragen, die dadurch stark in ihrer Proliferation gehemmt werden [61, 65]. Weiterhin konnten Genexpressionsanalysen von isolierten humanen IL-10+ Breg zeigen, dass die Genexpression von GrB in diesen Zellen signifikant erhöht ist im Vergleich zu IL10- B-Zellen [20, 154]. Diese Studie bestätigt ebenfalls unsere Annahme, dass GrB regulatorische Funktionen in B-Zellen übernehmen kann. In der vorliegenden Arbeit wurde deshalb der regulatorische Charakter von GrB+ B-Zellen bzgl. Phänotyp und Funktion untersucht, um festzustellen, inwieweit diese Zellen bereits bekannten Breg-Populationen ähneln, oder ob sie eine eigene Subpopulation innerhalb der Gruppe der Breg bilden. Breg stellen eine heterogene Zellpopulation dar und wurden primär in der Maus als IL-10-produzierende B-Zellen (B10) beschrieben. Im Menschen ist der Phänotyp von Breg uneinheitlicher, was zunächst eine genaue phänotypische Charakterisierung humaner GrB+ B-Zellen nötig machte. In diesem Zusammenhang fanden wir, dass die Stimulation von B-Zellen mit IL-21 und antiBCR neben einer starken GrB-Expression eine signifikante Erhöhung der Diskussion 54 Oberflächenmoleküle CD1d, IgM, CD10, CD20, CD27, CD86, CD154 und CD147 bewirkt. Außerdem werden neben GrB weitere regulatorische Moleküle wie IL-10 und IDO exprimiert, was unsere Hypothese weiter stützt, dass GrB-sezernierende B-Zellen regulatorisches Potential aufweisen. Die Expressionsraten von IDO und IL-10 liegen bei ca. 5%. Dies scheint auf den ersten Blick gering, jedoch könnte ein Zusammenspiel mehrerer Moleküle eine verstärkte regulatorische Wirkung hervorrufen. Blair und Kollegen beschreiben eine CD19+CD24highCD38high Breg-Population in SLE, die zwar IL-10 sezerniert, in ihrem regulatorischen Potential aber vor allem von der Expression des kostimulatorischen Moleküls CD86 abhängig zu sein scheint. Hier wird vermutet, dass neben IL-10 weitere Faktoren an der immunmodulatorischen Fähigkeit von Breg beteiligt sind [16]. Diese Erkenntnis kann auf GrB+ Breg übertragen werden. Auch hier ist neben GrB und IL-10 auch CD86 hochreguliert. Neben den erwähnten „klassischen“ Breg-Markern konnte auch eine erhöhte Expression von CD25, der α-Kette des Interleukin-2-Rezeptors, gezeigt werden. CD25 ist hauptsächlich von Treg bekannt [121, 138]. Mehrere Studien belegen jedoch, dass B-Zellen nach TLR2-, 4- oder 9-Stimulation ebenfalls in der Lage sind, CD25 zu exprimieren und IL-10 zu sezernieren und hierdurch immunmodulatorisches Potential besitzen [4, 21, 152]. Der Effekt einer erhöhten CD25-Expression führt möglicherweise auch dazu, dass diese Zellen exogenes IL2 binden können und dadurch eine inhibitorische Wirkung auf die Aktivierung und Expansion von Teff- und weiteren Zellen, welche IL-2 als autokrinen Faktor benötigen, haben [121, 138]. Der exakte Phänotyp der hier beschriebenen B reg-Population ist GrB++ IL-10+ IDO+ CD1d+ CD19+ CD25++ CD27+ CD38+ CD86+ CD174+. IgD und CD24 sind herunterreguliert. Dieser Phänotyp ähnelt teilweise ausdifferenzierten Plasmazellen [16, 148, 169]. Dies scheint logisch, da sowohl GrB+ Breg als auch Plasmazellen IL-21 als Zytokin für ihre Differenzierung benötigen [9, 14, 51, 67, 120, 169, 175]. Kürzlich zeigten Braza und Kollegen in einem Übersichtsartikel auf, dass der hohe Grad an phänotypischer Diversität von Breg es unmöglich macht, Herkunft, Differenzierung und Funktion exakt zu identifizieren [20, 154]. Es ist sehr wahrscheinlich, dass Breg keinen gemeinsamen Vorläufer haben, sondern durch spezifische Signale, wie im Falle von GrB+ Breg durch IL-21 generiert werden und Diskussion mit 55 unterschiedlichen regulatorischen Mechanismen in den diversen Krankheitsbildern fungieren. Der hier bestimmte Phänotyp von GrB+ B-Zellen stellt daher eine neue, bisher nicht beschriebene B reg-Population dar, die nicht mit bereits bekannten Breg identisch ist (vgl. Tab. 2). Funktionelle Analyse Eine wichtige Aufgabe der vorliegenden Arbeit war die Untersuchung des funktionellen Charakters GrB+ regulatorischer B-Zellen. Hierbei konnte gezeigt werden, dass GrB-sezernierende B-Zellen die Expansion von T-Zellen hemmen, ähnlich der Wirkung regulatorischer T-Zellen. Die inhibierende Wirkung wurde dabei in Anwesenheit GrB-spezifischer, blockierender Antikörper gehemmt. Daraus lässt sich schließen, dass GrB ein wichtiges regulatorisches Effektormolekül dieser Zellpopulation ist. Eine mögliche Auswirkung dieser Hemmung wäre, dass in der frühen Phase akuter Entzündungsreaktionen eine große Zahl peripherer T-Zellen durch IL-21induzierte GrB+ Breg in einem prä-aktivierten Stadium gehalten werden, während die komplette und antigen-spezifische Aktivierung erst in den Lymphknoten stattfindet. Unspezifische oder nicht-vollständig aktivierte T-Zellen in der Peripherie werden durch GrB+ Breg gehemmt, da diese sonst ein hohes Risiko bezüglich der Entwicklung von Autoimmunität bergen würden. Zu dieser Vermutung passt, dass Breg häufig in der frühen Phase akuter Entzündungsreaktionen induziert werden und die Ausbreitung einer Autoimmunerkrankung verlangsamen können [63, 86, 100]. Zudem ist bekannt, dass IL-21 in der frühen Phase von Autoimmunerkrankungen oder viralen Infektionen eines der ersten Zytokine ist, das freigesetzt wird und auch hauptsächlich in dieser frühen Phase immunsuppressive Effekte zeigt [24, 71, 74, 142]. Einige Studien bestätigen, dass B-Zellen für ihre regulatorische Funktionen nicht zwangsläufig CD40-Ligation benötigen [55, 86], wie es auch für GrB+ Breg der Fall ist. Ein Tumorvakzinierungs-Model zeigt, dass CD40-Ligation den regulatorischen Effekt von B-Zellen sogar unterdrücken kann [162]. In späteren Phasen einer Erkrankung oder Infektion, wenn durch kostimulatorische Signale von Antigen-präsentierenden Zellen komplett aktivierte Diskussion 56 Antigen-spezifische T-Zellen, welche sowohl IL-21 als auch CD40L exprimieren, am Entzündungsherd präsent sind, verlieren GrB+ Breg ihre Fähigkeit zur GrBExpression und differenzieren zu Antikörper-sezernierenden Plasmazellen. Die Unterdrückung der Autoimmunität könnte demnach eine wichtige Funktion von GrB+ Breg sein. Wie ich in meiner Arbeit zeigen konnte, liegt ein möglicher Mechanismus der TZell-Hemmung in der GrB-vermittelten Degradierung von TCR-ζ. TCR-ζ wird in vitro durch IL-21-stimulierte GrB+ B-Zellen signifikant abgebaut, bleibt durch die Hemmung der Protease jedoch erhalten. Ebenfalls konnte gezeigt werden, dass GrB für die Proteolyse von TCR-ζ in HIV-Patienten verantwortlich ist, da sich der sehr niedrige TCR-ζ-Level von isolierten CD4+ T-Zellen aus HIV-Patienten in Anwesenheit von GrB-Inhibitoren wieder teilweise erholt. Im Gegenzug sind aus HIV-Patienten isolierte GrB+ B-Zellen in der Lage, TCR-ζ von gesunden allogenen CD4+ T-Zellen zu hemmen, ein Effekt, welcher ebenfalls durch GrB-Inhibition wieder aufgehoben werden kann. Eine reduzierte TCR-ζ-Expression oder gar ein Verlust von TCR-ζ bei CD3+-, CD4+- oder CD8+-T- und NK-Zellen wurde bei mehreren Krebsarten (Brust-, Zervix,- Colon, etc.), HIV-Infektionen und Autoimmunerkrankungen (SLE, RA) gefunden [12, 56, 60, 131, 153]. Dies führt zur funktionellen Beeinträchtigung dieser Zellen und damit zu einer Dysfunktion des Immunsystems [12]. Die Ursachen für den (Teil-) Verlust von TCR-ζ sind meist noch unklar. Allerdings konnte gezeigt werden, dass der mRNA-Level von TCR-ζ unter Infektionsbedingungen nicht betroffen ist, es aber einen post-translationalen Mechanismus geben muss, der gezielt TCR-ζ abbaut [22]. Dieser Befund bestätigt die in dieser Arbeit gezeigten Ergebnisse, dass GrB für die Degradierung von TCR-ζ verantwortlich ist. GrB+ Breg schaffen damit eine immunsuppressive Umgebung, die eine effektive T-Zell-Antwort unterdrückt. Im Hinblick auf eine HIV-Infektion könnte die Suppression der T-ZellProliferation durch einen Abbau von TCR-ζ auch einen positiven Einfluss auf den Krankheitsverlauf nehmen. Untersuchungen unserer Arbeitsgruppe ergaben, dass bis zu 60% der B-Zellen von unbehandelten HIV-Patienten GrB exprimieren. GrB+ B-Zellen sind in der Lage, aktives GrB auf HIV-infizierte CD4+ T-Zellen zu Diskussion 57 transferieren und damit die T-Zell-Proliferation und mit ihr möglicherweise die Virusreplikation zu unterdrücken (unveröffentlichte Daten). Weiterhin konnte gezeigt werden, dass im Laufe einer hochaktiven antiretroviralen Therapie (HAART) nicht nur die Viruslast, sondern auch der GrB-Level sinkt. Eine mögliche Hypothese könnte daher sein, dass vor einer Therapie, wenn eine hohe Viruslast vorliegt, eine hohe Zahl an GrB+ Breg induziert wird, welche die T-Zell-Proliferation hemmen und damit möglicherweise indirekt die Ausbreitung des Virus eindämmen. Im Laufe der Therapie, wenn die Viruslast sinkt, könnte sich dann der TCR-ζ-Level und damit auch die Proliferationsfähigkeit der T-Zellen erholen. Innerhalb dieser Hypothese könnten GrB+ Breg als „Helferzellen“ betrachtet werden, welche die bei HIV-Patienten stark beeinträchtigte CD8+ zytotoxische T-Zell-Zahl ausgleichen könnte, da diese ihrerseits durch eine stark verminderte GrB-Expression nicht in der Lage sind, die Ausbreitung des Virus zu kontrollieren [60, 153, 174]. Somit könnten GrB+ B-Zellen möglicherweise auch dazu beitragen, die Vermehrung des Virus zu verzögern. Pathophysiologische Bedeutung Da sich GrB in murinen B-Zellen nicht durch IL-21 induzieren lässt [69, 169] und damit kein geeignetes in-vivo Modell zur Verfügung steht, wurden ausgewählte humane pathologische Präparate sowie primäre Gewebeproben von Patienten mit Tumorerkrankungen auf die Anwesenheit von GrB+ B-Zellen gescreent. Dabei zeigte sich, dass GrB+ B-Zellen im Microenvironment verschiedener solider Tumore (z.B. Mamma-, Zervix- oder Colon-Karzinom, Kopf-Hals-Tumor) identifiziert werden können, in deren Nähe außerdem auch IL-21-exprimierende Zellen zu finden sind. Auch IL-10+ B-Zellen wurden in Tumoren gefunden, jedoch in wesentlich geringerer Frequenz als GrB+ B-Zellen. Dies spricht dafür, dass das hauptsächliche Effektormolekül dieser B-Zellen GrB ist. Die Ergebnisse über eine Infiltration GrB+ B-Zellen stützt, dass GrB+ CD20+ BZellen bei Leberzellkarzinomen gefunden wurden [143]. Hier wurde in erster Linie an eine zytotoxische Funktion dieser Zellen gedacht, da GrB bislang hauptsächlich über diese Funktion definiert wird. Hagn et al. konnten ebenfalls eine zytotoxische Funktion von GrB + B-Zellen zeigen. Sowohl B-Zelllinien (ARH77) als auch primäre B-Zellen von gesunden Diskussion 58 Spendern sind in der Lage, nach Stimulation mit IL-21 aktives Granzym B Perforin-unabhängig auf Tumorzellen (HeLa, G-361) zu übertragen und diese in die Apoptose leiten [68]. Die Sekretion von GrB durch B-Zellen scheint ein neuer Mechanismus der zytotoxischen Immunantwort zu sein und könnte zu einer Immunüberwachung (immunosurveillance) von soliden Tumoren beitragen, hauptsächlich in der frühen Phase einer Tumorentstehung oder zu Beginn einer viralen Infektion. GrB+ B-Zellen könnten somit ein essentieller Bestandteil bei der frühzeitigen Erkennung und Zerstörung entarteter Zellen sein und zu einer schnellen Immunantwort beitragen. Es wurde in dieser Arbeit damit begonnen, einzelne Fälle verschiedener Tumor-Entitäten zu screenen, um einen Überblick darüber zu erhalten, welche Tumorentitäten GrB+ B-Zellen enthalten. Obwohl aufgrund der kleinen Fallzahlen keine signifikanten Korrelationen der klinisch-pathologischen Parameter mit der Anwesenheit GrB+ BZ gemacht werden konnten, zeigen die Ergebnisse, dass GrB+ Breg in signifikanter Zahl in Tumorgewebe nachzuweisen sind und damit vermutlich eine funktionale Rolle spielen. Solide Tumore sind typischerweise von einer Vielfalt von Immunzellen infiltriert. Neben T-Helferzellen und zytotoxischen CD8+ T-Zellen finden sich auch TIL-Bs [36]. So enthalten etwa 25% aller Brustkrebsgewebe TIL-Bs [37, 99, 115]. Die Präsenz dieser Zellen wird bei Mammakarzinomen überwiegend mit einer positiven Prognose korreliert [140]. Aktivierte B-Zellen werden benötigt, um eine optimale T-Zell-vermittelte anti-Tumor-Immunantwort zu generieren [46, 141]. Andererseits wird die Infiltration von B-Zellen bei Melanomen, Ovarial- oder Prostatakarzinomen eher mit einer schlechten Überlebensrate korreliert [3, 46, 48, 125, 141, 162]. Bei Ovarialkarzinomen konnte zudem gezeigt werden, dass infiltrierende Zellen wie Treg, pDC, Monozyten oder Makrophagen regulatorisch aktiv sind und immunsuppressiven Charakter besitzen [50, 83, 135, 163, 165, 177]. Die Infiltration von Treg beispielsweise kann die Proliferation oder zytotoxische Aktivität von CD4+- und CD8+-T-Zellen hemmen und eine Tumorprogression fördern [107, 126]. Eine hohe Dichte an FoxP3+ Treg wird daher meist mit einer schlechten Prognose korreliert [40, 135, 165, 167]. Auch Breg haben via IL-10 und wie in dieser Arbeit gezeigt über GrB, inhibierende Wirkung auf die Proliferation von T- Diskussion 59 Zellen (s. auch Tab. 2). Sie können daher eine immunologische Toleranz gegenüber Tumorzellen auslösen. Die Induktion und Infiltration von GrB+ Breg in solides Tumorgewebe könnte demnach ein escape-Mechanismus des Tumors sein, der diese Zellen aktiv rekrutiert und somit eine effektive T-Zell-Antwort unterdrückt. GrB+ Breg könnten hierfür zukünftig als prognostischer Marker genutzt werden und Ziel für eine Immuntherapie werden. Diesbezüglich ist es jedoch notwendig, die hier begonnen Untersuchungen an größeren Kohorten (>20 Patienten) zu betrachten und die Infiltration von GrB+ Breg statistisch mit der Gesamtüberlebensrate (overall survival (OS) und recurrence-free survival (RFS)) zu korrelieren. Ein weiterer interessanter Aspekt wäre auch, die Infiltration von Tumoren mit GrB + B-Zellen vor und nach einer Therapie zu vergleichen. Möglicherweise könnten auch unterschiedliche Tumorstadien (pT1 vs. pT4) mit und ohne Metastasierung unterschiedliche prozentuale Anteile infiltrierender GrB+ B-Zellen aufweisen und in Kombination mit klinisch-pathologischen (Östrogen, Parametern Her2/neu, wie Prostaglandin) Alter oder wertvolle Hormonrezeptor-Status Anhaltspunkte für eine Prognosestellung geben. Unsere Befunde bezüglich einer regulatorischen Funktion GrB-sezernierender B-Zellen könnten auch Implikationen für hämatologische Erkrankungen, insbesondere Leukämien und Lymphomen haben. Da bekannt ist, dass Hodgkin/Reed-Sternberg-Zellen (HRS-Zellen) in der Lage sind, IL-21 zu sezernieren [85, 137], liegt die Vermutung nahe, dass Hodgkin-Lymphome GrB+ B-Zellen aufweisen, was bei den in dieser Arbeit betrachteten Hodgkin-Lymphomen tatsächlich der Fall war. Lamprecht und Kollegen fanden heraus, dass HRS-Zellen durch IL-21Sekretion Treg in ihre Umgebung „locken“ können, wodurch eine wirksame Immunabwehr des Körpers gegen die HRS-Zellen unterdrückt wird [85, 137]. Analog dazu könnten regulatorische B-Zellen ein Immunescape-Phänomen zusätzlich verstärken. regulatorischen Lymphomen Andererseits B-Zell-Phänotyps auch therapeutisch könnte durch dazu IL-21 die in genutzt Induktion eines verschiedenen werden, Proliferationsrate maligner, entarteter T-Zellen einzudämmen. die GrB + T-Zellerhöhte Diskussion 60 Weiterhin wäre sehr interessant zu untersuchen, ob GrB+ Breg nicht nur T-ZellProliferation hemmen, sondern auch suppressiven Einfluss auf weitere Immunzellen, wie Granulozyten oder Monozyten haben. DiLillo und Kollegen konnten zeigen, dass IL10+CD5+ Breg die Funktion von Monozyten und Makrophagen in CLL supprimieren [45]. In-vivo-Studien diesbezüglich könnten daher neue Erkenntnisse im Hinblick auf zukünftige diagnostische und therapeutische Anwendungen ermöglichen. Die vorliegende Arbeit zeigt, dass GrB+ B-Zellen einen regulatorischen Phänotyp besitzen und möglicherweise auf vielfältige Art und Weise zu einer schnellen Immunantwort beitragen können. GrB+ Breg scheinen in vivo eine wichtige Rolle zu spielen, da in mehreren soliden Tumoren und auch bei HIVPatienten diese Zellen gefunden wurden. Weiterführende Studien an Hand einzelner, ausgewählter Krankheitsmodelle wie Mamma-Karzinom, HodgkinLymphome oder HIV sind wünschenswert, um das Verständnis der exakten Wirkungsweise und des Zusammenspiels GrB+ Breg mit anderen Immunzellen weiter zu vertiefen. Zusammenfassung 61 5. Zusammenfassung Als Hauptaufgabe humaner B-Zellen im Immunsystem wurde bislang in erster Linie ihre Differenzierung zu Antikörper-sezernierenden Plasmazellen angesehen, als regulatorische Zellen hingegen waren sie nicht bekannt. In den letzten Jahren wurde vermehrt an der Identifikation und Charakterisierung von B-Zellen mit immunregulatorischer Funktion geforscht. Unser Labor erkannte als erstes, dass es möglich ist, humane periphere B-Zellen über Aktivierung ihres B-Zell-Rezeptors durch spezifische Antigene und gleichzeitige Stimulation mit Interleukin 21 zur Sekretion großer Mengen der Serinprotease Granzym B (GrB) anzuregen. Neben einem zytotoxischen Potential GrB+ B-Zellen gegenüber bestimmten Tumorzellen sind solche B-Zellen auch in der Lage, einen anti-proliferativen und damit regulatorischen Effekt auf T-Zellen auszuüben, welcher an die Wirkung regulatorischer T-Zellen erinnert. Dabei kann deren inhibierende Wirkung in Anwesenheit GrB-spezifischer blockierender Antiköpern gehemmt werden. Der mögliche Mechanismus dieser T-Zell-Hemmung liegt in einer direkten GrBvermittelten Degradierung der ζ–Kette des T-Zell-Rezeptors, der für die Vermittlung von Wachstumssignalen innerhalb der T-Zellen mit verantwortlich ist. Ein wichtiger Aspekt der vorliegenden Arbeit war es nachzuweisen, dass GrB + Breg nicht nur in-vitro induzierbar, sondern auch in-vivo nachweisbar sind. Ein Vorhandensein solcher GrB+ Breg konnte sowohl im Microenvironment solider Tumoren, als auch bei HIV-positiven Patienten nachweisen werden, was auf eine mögliche wichtige Rolle dieser Zellen bei der Modulation einer gegen maligne Zellen gerichteten Immunantwort, aber auch einer potentiellen T-Zell-Antwort bei HIV-Infektionen, hindeutet. Die erhaltenen Befunde legen nahe, dass GrB+ Breg durch Treg-ähnliche Mechanismen zur Modulation der zellulären adaptiven Immunantwort beitragen könnten, was im Falle von Tumoren einen möglichen Tumor-Escape und bei HIVInfektionen eine Verstärkung des zellulären Immundefekts begünstigen könnte. Andererseits könnte die Induktion von Breg auch bei entzündlichen Erkrankungen wie Autoimmunerkrankungen oder dem graft-versus-host disease eine wichtige Rolle spielen und in Zukunft Teil neuer zelltherapeutischer Ansätze werden. Literaturverzeichnis 62 6. Literaturverzeichnis 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Afonina IS, Tynan GA, Logue SE, Cullen SP, Bots M, Luthi AU, Reeves EP, McElvaney NG, Medema JP, Lavelle EC, Martin SJ: Granzyme BDependent Proteolysis Acts as a Switch to Enhance the Proinflammatory Activity of IL-1alpha. Mol Cell 2011, 44(2):265-278. Amel Kashipaz MR, Huggins ML, Lanyon P, Robins A, Powell RJ, Todd I: Assessment of Be1 and Be2 cells in systemic lupus erythematosus indicates elevated interleukin-10 producing CD5+ B cells. Lupus 2003, 12(5):356-363. Ammirante M, Luo JL, Grivennikov S, Nedospasov S, Karin M: B-cellderived lymphotoxin promotes castration-resistant prostate cancer. Nature 2010, 464(7286):302-305. Amu S, Brisslert M: Phenotype and function of CD25-expressing B lymphocytes isolated from human umbilical cord blood. Clin Dev Immunol 2011, 2011:481948. Andorsky DJ, Timmerman JM: Interleukin-21: biology and application to cancer therapy. Expert Opin Biol Ther 2008, 8(9):1295-1307. Andrade F: Non-cytotoxic antiviral activities of granzymes in the context of the immune antiviral state. Immunol Rev 2010, 235(1):128146. Anolik JH, Barnard J, Owen T, Zheng B, Kemshetti S, Looney RJ, Sanz I: Delayed memory B cell recovery in peripheral blood and lymphoid tissue in systemic lupus erythematosus after B cell depletion therapy. Arthritis Rheum 2007, 56(9):3044-3056. Avery DT, Bryant VL, Ma CS, de Waal Malefyt R, Tangye SG: IL-21induced isotype switching to IgG and IgA by human naive B cells is differentially regulated by IL-4. J Immunol 2008, 181(3):1767-1779. Avery DT, Ma CS, Bryant VL, Santner-Nanan B, Nanan R, Wong M, Fulcher DA, Cook MC, Tangye SG: STAT3 is required for IL-21-induced secretion of IgE from human naive B cells. Blood 2008, 112(5):17841793. Banchereau J, de Paoli P, Valle A, Garcia E, Rousset F: Long-term human B cell lines dependent on interleukin-4 and antibody to CD40. Science 1991, 251(4989):70-72. Banchereau J, Bazan F, Blanchard D, Brière F, Galizzi JP, al. e: The CD40 antigen and its ligand. Annu Rev Immunol 1994, 12:881-926. Baniyash M: TCR ζ-chain downregulation: curtailing an excessive inflammatory immune response. Nature Rev 2004, 4:675-687. Barr TA, Brown S, Ryan G, Zhao J, Gray D: TLR-mediated stimulation of APC: Distinct cytokine responses of B cells and dendritic cells. European journal of immunology 2007, 37(11):3040-3053. Berglund LJ, Avery DT, Ma CS, Moens L, Deenick EK, Bustamante J, Boisson-Dupuis S, Wong M, Adelstein S, Arkwright PD, Bacchetta R, Bezrodnik L, Dadi H, Roifman CM, Fulcher DA, Ziegler JB, Smart JM, Kobayashi M, Picard C, Durandy A, Cook MC, Casanova JL, Uzel G, Tangye SG: IL-21 signalling via STAT3 primes human naive B cells to respond to IL-2 to enhance their differentiation into plasmablasts. Blood 2013, 122(24):3940-3950. Blair PA, Chavez-Rueda KA, Evans JG, Shlomchik MJ, Eddaoudi A, Isenberg DA, Ehrenstein MR, Mauri C: Selective targeting of B cells with Literaturverzeichnis 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 63 agonistic anti-CD40 is an efficacious strategy for the generation of induced regulatory T2-like B cells and for the suppression of lupus in MRL/lpr mice. J Immunol 2009, 182(6):3492-3502. Blair PA, Norena LY, Flores-Borja F, Rawlings DJ, Isenberg DA, Ehrenstein MR, Mauri C: CD19(+)CD24(hi)CD38(hi) B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients. Immunity 2010, 32(1):129-140. Bouaziz JD, Calbo S, Maho-Vaillant M, Saussine A, Bagot M, Bensussan A, Musette P: IL-10 produced by activated human B cells regulates CD4(+) T-cell activation in vitro. European journal of immunology 2010, 40(10):2686-2691. Bouaziz JD, Yanaba K, Tedder TF: Regulatory B cells as inhibitors of immune responses and inflammation. Immunol Rev 2008, 224:201-214. Brandt K, Bulfone-Paus S, Foster DC, Ruckert R: Interleukin-21 inhibits dendritic cell activation and maturation. Blood 2003, 102(12):4090-4098. Braza F, Chesne J, Castagnet S, Magnan A, Brouard S: Regulatory functions of B cells in allergic diseases. Allergy 2014, 69(11):1454-1463. Brisslert M, Bokarewa M, Larsson P, Wing K, Collins LV, Tarkowski A: Phenotypic and functional characterization of human CD25+ B cells. Immunology 2006, 117(4):548-557. Bronstein-Sitton N, Cohen-Daniel L, Vaknin I, Ezernitchi A, Leshem B, Halabi A, Houri-Hadad Y, Greenbaum E, Zakay-Rones Z, Shapira L, Baniyash M: Sustained exposure to bacterial antigen induces interferon-gamma-dependent T cell receptor zeta down-regulation and impaired T cell function. Nat Immunol 2003, 4(10):957-964. Bryant VL, Ma CS, Avery DT, Li Y, Good KL, Corcoran LM, de Waal Malefyt R, Tangye SG: Cytokine-Mediated Regulation of Human B Cell Differentiation into Ig-Secreting Cells: Predominant Role of IL-21 Produced by CXCR5+ T Follicular Helper Cells. J Immunol 2007, 179(12):8180-8190. Bubier JA, Sproule TJ, Foreman O, Spolski R, Shaffer DJ, Morse HC, 3rd, Leonard WJ, Roopenian DC: A critical role for IL-21 receptor signaling in the pathogenesis of systemic lupus erythematosus in BXSB-Yaa mice. Proceedings of the National Academy of Sciences of the United States of America 2009, 106(5):1518-1523. Buzza MS, Dyson JM, Choi H, Gardiner EE, Andrews RK, Kaiserman D, Mitchell CA, Berndt MC, Dong JF, Bird PI: Antihemostatic activity of human granzyme B mediated by cleavage of von Willebrand factor. J Biol Chem 2008, 283(33):22498-22504. Buzza MS, Zamurs L, Sun J, Bird CH, Smith AI, Trapani JA, al. e: Extracellular matrix remodeling by human granzyme B via cleavage of vitronectin, fibronectin and laminin. J Biol Chem 2005, 280:2354923558. Buzza MS, Bird PI: Extracellular granzymes: current perspectives. Biol Chem 2006, 387(7):827-837. Cao X, Cai SF, Fehniger TA, Song J, Collins LI, Piwnica-Worms DR, Ley TJ: Granzyme B and perforin are important for regulatory T cellmediated suppression of tumor clearance. Immunity 2007, 27(4):635646. Casciola-Rosen L, Garcia-Calvo M, Bull HG, Becker JW, Hines T, Thornberry NA, Rosen A: Mouse and human granzyme B have distinct Literaturverzeichnis 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 64 tetrapeptide specificities and abilities to recruit the bid pathway. J Biol Chem 2007, 282(7):4545-4552. Casciola-Rosen L, Andrade F, Ulanet D, Wong WB, Rosen A: Cleavage by granzyme B is strongly predictive of autoantigen status: implications for initiation of autoimmunity. The Journal of experimental medicine 1999, 190(6):815-826. Chen W, Liang X, Peterson AJ, Munn DH, Blazar BR: The indoleamine 2,3-dioxygenase pathway is essential for human plasmacytoid dendritic cell-induced adaptive T regulatory cell generation. J Immunol 2008, 181(8):5396-5404. Chesneau M, Pallier A, Braza F, Lacombe G, Le Gallou S, Baron D, Giral M, Danger R, Guerif P, Aubert-Wastiaux H, Neel A, Michel L, Laplaud DA, Degauque N, Soulillou JP, Tarte K, Brouard S: Unique B cell differentiation profile in tolerant kidney transplant patients. Am J Transplant 2014, 14(1):144-155. Chesneau M, Michel L, Dugast E, Chenouard A, Baron D, Pallier A, Durand J, Braza F, Guerif P, Laplaud DA, Soulillou JP, Giral M, Degauque N, Chiffoleau E, Brouard S: Tolerant kidney transplant patients produce B cells with regulatory properties. J Am Soc Nephrol 2015, Epub ahead of print. Choy JC, Hung VH, Hunter AL, Cheung PK, Motyka B, Goping IS, Sawchuk T, Bleackley RC, Podor TJ, McManus BM, Granville DJ: Granzyme B induces smooth muscle cell apoptosis in the absence of perforin: involvement of extracellular matrix degradation. Arterioscler Thromb Vasc Biol 2004, 24(12):2245-2250. Coquet JM, Kyparissoudis K, Pellicci DG, Besra G, Berzins SP, Smyth MJ, Godfrey DI: IL-21 is produced by NKT cells and modulates NKT cell activation and cytokine production. J Immunol 2007, 178(5):2827-2834. Coronella JA, Spier C, Welch M, Trevor KT, Stopeck AT, Villar H, Hersh EM: Antigen-driven oligoclonal expansion of tumor-infiltrating B cells in infiltrating ductal carcinoma of the breast. J Immunol 2002, 169(4):1829-1836. Coronella-Wood JA, Hersh EM: Naturally occurring B-cell responses to breast cancer. Cancer Immunol Immunother 2003, 52(12):715-738. Correale J, Farez M, Razzitte G: Helminth infections associated with multiple sclerosis induce regulatory B cells. Ann Neurol 2008, 64(2):187-199. Cullen SP, Adrain C, Luthi AU, Duriez PJ, Martin SJ: Human and murine granzyme B exhibit divergent substrate preferences. J Cell Biol 2007, 176(4):435-444. Curiel TJ, Coukos G, Zou L, Alvarez X, Cheng P, Mottram P, EvdemonHogan M, Conejo-Garcia JR, Zhang L, Burow M, Zhu Y, Wei S, Kryczek I, Daniel B, Gordon A, Myers L, Lackner A, Disis ML, Knutson KL, Chen L, Zou W: Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med 2004, 10(9):942-949. Das A, Ellis G, Pallant C, Lopes AR, Khanna P, Peppa D, Chen A, Blair P, Dusheiko G, Gill U, Kennedy PT, Brunetto M, Lampertico P, Mauri C, Maini MK: IL-10-producing regulatory B cells in the pathogenesis of chronic hepatitis B virus infection. J Immunol 2012, 189(8):3925-3935. Literaturverzeichnis 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 65 de Andrés C, Tejera-Alhambra M, Alonso B, Valor L, Teijeiro R, RamosMedina R, Mateos D, Faure F, Sanchez-Ramon S: New regulatory CD19CD25 B-cell subset in clinically isolated syndrome and multiple sclerosis relapse. Changes after glucocorticoids. J Neuroimmunol 2014, 270:37-44. Deniz G, Erten G, Kücüksezer UC, Kocacik D, Karagiannidis C, Aktas E, Akdis CA, Akdis M: Regulatory NK cells suppress antigen-specific T cell responses. J Immunol 2008, 180:850-857. Diaz-Alderete A, Crispin JC, Vargas-Rojas MI, Alcocer-Varela J: IL-10 production in B cells is confined to CD154+ cells in patients with systemic lupus erythematosus. J Autoimmun 2004, 23(4):379-383. DiLillo DJ, Weinberg JB, Yoshizaki A, Horikawa M, Bryant JM, Iwata Y, Matsushita T, Matta KM, Chen Y, Venturi GM, Russo G, Gockerman JP, Moore JO, Diehl LF, Volkheimer AD, Friedman DR, Lanasa MC, Hall RP, Tedder TF: Chronic lymphocytic leukemia and regulatory B cells share IL-10 competence and immunosuppressive function. Leukemia 2013, 27(1):170-182. DiLillo DJ, Yanaba K, Tedder TF: B cells are required for optimal CD4+ and CD8+ T cell tumor immunity: therapeutic B cell depletion enhances B16 melanoma growth in mice. J Immunol 2010, 184(7):40064016. DiLillo DJ, Matsushita T, Tedder TF: B10 cells and regulatory B cells balance immune responses during inflammation, autoimmunity, and cancer. Ann N Y Acad Sci 2010, 1183:38-57. Dong HP, Elstrand MB, Holth A, Silins I, Berner A, Trope CG, Davidson B, Risberg B: NK- and B-cell infiltration correlates with worse outcome in metastatic ovarian carcinoma. Am J Clin Pathol 2006, 125(3):451-458. Duddy M, Niino M, Adatia F, Hebert S, Freedman M, Atkins H, Kim HJ, BarOr A: Distinct effector cytokine profiles of memory and naive human B cell subsets and implication in multiple sclerosis. J Immunol 2007, 178(10):6092-6099. Duluc D, Delneste Y, Tan F, Moles MP, Grimaud L, Lenoir J, Preisser L, Anegon I, Catala L, Ifrah N, Descamps P, Gamelin E, Gascan H, Hebbar M, Jeannin P: Tumor-associated leukemia inhibitory factor and IL-6 skew monocyte differentiation into tumor-associated macrophage-like cells. Blood 2007, 110(13):4319-4330. Ettinger R, Sims GP, Fairhurst AM, Robbins R, da Silva YS, Spolski R, Leonard WJ, Lipsky PE: IL-21 induces differentiation of human naive and memory B cells into antibody-secreting plasma cells. J Immunol 2005, 175(12):7867-7879. Ettinger R, Kuchen S, Lipsky PE: Interleukin 21 as a target of intervention in autoimmune disease. Ann Rheum Dis 2008, 67 Suppl 3:iii83-86. Evans JG, Chavez-Rueda KA, Eddaoudi A, Meyer-Bahlburg A, Rawlings DJ, Ehrenstein MR, Mauri C: Novel suppressive function of transitional 2 B cells in experimental arthritis. J Immunol 2007, 178(12):7868-7878. Fillatreau S, Gray D, Anderton SM: Not always the bad guys: B cells as regulators of autoimmune pathology. Nat Rev Immunol 2008, 8(5):391397. Literaturverzeichnis 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 66 Fillatreau S, Sweenie CH, McGeachy MJ, Gray D, Anderton SM: B cells regulate autoimmunity by provision of IL-10. Nat Immunol 2002, 3(10):944-950. Finke J, Zea A, Stanley J, Longo D, Mizoguchi H, Tubbs R, Wiltrout R, o'Shea J, Kudoh S, Klein E, Bukowski RM, Ochoa AC: Loss of T-cell receptor zeta chain and p56lck in T-cells infiltrating human renal cell carcinoma. Cancer Res 1993:5613-5616. Fu B, Tian Z, Wei H: Subsets of human natural killer cells and their regulatory effects. Immunology 2013, 141(483-489). Gabrilovich DI, Nagaraj S: Myeloid-derived suppressor cells as regulators of the immune system. Nat Rev Immunol 2009, 9(3):162-174. Ganor Y, Teichberg VI, Levite M: TCR activation eliminates glutamate receptor GluR3 from the cell surface of normal human T cells, via an autocrine/paracrine granzyme B-mediated proteolytic cleavage. J Immunol 2007, 178(2):683-692. Geertsma MF, van Wengen-Stevenhagen A, van Dam EM, Risberg K, Kroon FP, Groeneveld PH, Nibbering PH: Decreased expression of zeta molecules by T lymphocytes is correlated with disease progression in human immunodeficiency virus-infected persons. J Infect Dis 1999, 180(3):649-658. Gondek DC, Lu LF, Quezada SA, Sakaguchi S, Noelle RJ: Cutting edge: contact-mediated suppression by CD4+CD25+ regulatory cells involves a granzyme B-dependent, perforin-independent mechanism. J Immunol 2005, 174(4):1783-1786. Graham KL, Thibault DL, Steinman JB, Okeke L, Kao PN, Utz PJ: Granzyme B is dispensable for immunologic tolerance to self in a murine model of systemic lupus erythematosus. Arthritis Rheum 2005, 52(6):1684-1693. Gray D, Gray M: What are regulatory B cells? European journal of immunology 2010, 40(10):2677-2679. Grohmann U OC, Fallarino F, Vacca C, Calcinaro F, Falorni A, Candeloro P, Belladonna ML, Bianchi R, Fioretti MC, Puccetti P: CTLA-4-Ig regulates tryptophan catabolism in vivo. Nat Immunol 2002, 3(11):1097-1101. Grossman WJ, Verbsky JW, Tollefsen BL, Kemper C, Atkinson JP, Ley TJ: Differential expression of granzymes A and B in human cytotoxic lymphocyte subsets and T regulatory cells. Blood 2004, 104(9):28402848. Hagn M, Jahrsdorfer B: Why do human B cells secrete granzyme B? Insights into a novel B-cell differentiation pathway. Oncoimmunology 2012, 1(8):1368-1375. Hagn M, Schwesinger E, Ebel V, Sontheimer K, Maier J, Beyer T, Syrovets T, Laumonnier Y, Fabricius D, Simmet T, Jahrsdorfer B: Human B cells secrete granzyme B when recognizing viral antigens in the context of the acute phase cytokine IL-21. J Immunol 2009, 183(3):1838-1845. Hagn M, Sontheimer K, Dahlke K, Brueggemann S, Kaltenmeier C, Beyer T, Hofmann S, Lunov O, Barth TF, Fabricius D, Tron K, Nienhaus GU, Simmet T, Schrezenmeier H, Jahrsdorfer B: Human B cells differentiate into granzyme B-secreting cytotoxic B lymphocytes upon incomplete T-cell help. Immunol Cell Biol 2012, 90(4):457-467. Literaturverzeichnis 69. 70. 71. 72. 73. 74. 75. 76. 77. 78. 79. 80. 81. 67 Hagn M, Belz GT, Kallies A, Sutton VR, Thia KY, Tarlinton DM, Hawkins ED, Trapani JA: Activated Mouse B Cells Lack Expression of Granzyme B. J Immunol 2012, 188(8):3886-3892. Hagn M, Ebel V, Sontheimer K, Schwesinger E, Lunov O, Beyer T, Fabricius D, Barth TF, Viardot A, Stilgenbauer S, Hepp J, ScharffetterKochanek K, Simmet T, Jahrsdorfer B: CD5+ B cells from individuals with systemic lupus erythematosus express granzyme B. European journal of immunology 2010, 40(7):2060-2069. Herber D, Brown TP, Liang S, Young DA, Collins M, Dunussi-Joannopoulos K: IL-21 has a pathogenic role in a lupus-prone mouse model and its blockade with IL-21R.Fc reduces disease progression. J Immunol 2007, 178(6):3822-3830. Hirotani M, Niino M, Fukazawa T, Kikuchi S, Yabe I, Hamada S, Tajima Y, Sasaki H: Decreased IL-10 production mediated by Toll-like receptor 9 in B cells in multiple sclerosis. J Neuroimmunol 2010, 221(1-2):95-100. Hirst CE, Buzza MS, Sutton VR, Trapani JA, Loveland KL, Bird PI: Perforin-independent expression of granzyme B and proteinase inhibitor 9 in human testis and placenta suggests a role for granzyme B-mediated proteolysis in reproduction. Mol Hum Reprod 2001, 7(12):1133-1142. Holm C, Nyvold CG, Paludan SR, Thomsen AR, Hokland M: Interleukin-21 mRNA expression during virus infections. Cytokine 2006, 33(1):41-45. Hwu P, Du MX, Lapointe R, Do M, Taylor MW, Young HA: Indoleamine 2,3-dioxygenase production by human dendritic cells results in the inhibition of T cell proliferation. J Immunol 2000, 164(7):3596-3599. Iwata Y, Matsushita T, Horikawa M, DiLillo DJ, Yanaba K, Venturi GM, Szablocs PM, Bernstein SH, Margro CM, Williams AD, Hall RP, St Clair EW, Tedder TF: Characterization of a rare IL-10–competent B-cell subset in humans that parallels mouse regulatory B10 cells. Blood 2011, 117(2):530-541. Jahrsdörfer B, Blackwell SE, Wooldridge JE, Huang J, Andreski MW, Jacobus LS, Taylor CM, Weiner GJ: B-chronic lymphocytic leukemia cells and other B cells can produce granzyme B and gain cytotoxic potential after interleukin-21-based activation. Blood 2006, 108(8):27122719. Jahrsdörfer B, Vollmer A, Blackwell SE, Maier J, Sontheimer K, Beyer T, Mandel B, Lunov O, Tron K, Nienhaus GU, Simmet T, Debatin KM, Weiner GJ, Fabricius D: Granzyme B produced by human plasmacytoid dendritic cells suppresses T-cell expansion. Blood 2010, 115(6):11561165. Jin H, Carrio R, Yu A, Malek TR: Distinct activation signals determine whether IL-21 induces B cell costimulation, growth arrest, or Bimdependent apoptosis. J Immunol 2004, 173(1):657-665. Kaltenmeier C, Gawanbacht A, Beyer T, Lindner S, van der Merwe D, Haerter G, Gruener B, Lotfi R, Kern P, Bommer M, Schrezenmeier H, Kirchhoff F, Jahrsdoerfer B: CD4+ T cell-derived IL-21 and deprivation of CD40 signaling favors the in-vivo development of granzyme Bexpressing regulatory B cells in HIV patients. J Immunol 2015, submitted. Kehry MR: CD40-mediated signaling in B cells. Balancing cell survival, growth, and death. J Immunol 1996, 156:2345-2348. Literaturverzeichnis 82. 83. 84. 85. 86. 87. 88. 89. 90. 91. 92. 93. 94. 95. 96. 68 Klinker MW, Lundy SK: Multiple mechanisms of immune suppression by B lymphocytes. Mol Med 2012, 18(1):123-137. Kryczek I, Zou L, Rodriguez P, Zhu G, Wei S, Mottram P, Brumlik M, Cheng P, Curiel T, Myers L, Lackner A, Alvarez X, Ochoa A, Chen L, Zou W: B7H4 expression identifies a novel suppressive macrophage population in human ovarian carcinoma. The Journal of experimental medicine 2006, 203(4):871-881. Kuhns MS, Davis MM, Garcia KC: Deconstructing the form and function of the TCR/CD3 complex. Immunity 2006, 24:133-139. Lamprecht B, Kreher S, Anagnostopoulos I, Johrens K, Monteleone G, Jundt F, Stein H, Janz M, Dorken B, Mathas S: Aberrant expression of the Th2 cytokine IL-21 in Hodgkin lymphoma cells regulates STAT3 signaling and attracts Treg cells via regulation of MIP-3alpha. Blood 2008, 112(8):3339-3347. Lampropoulou V, Calderon-Gomez E, Roch T, Neves P, Shen P, Stervbo U, Boudinot P, Anderton SM, Fillatreau S: Suppressive functions of activated B cells in autoimmune diseases reveal the dual roles of Tolllike receptors in immunity. Immunol Rev 2010, 233(1):146-161. Lampropoulou V, Hoehlig K, Roch T, Neves P, Calderon Gomez E, Sweenie CH, Hao Y, Freitas AA, Steinhoff U, Anderton SM, Fillatreau S: TLR-activated B cells suppress T cell-mediated autoimmunity. J Immunol 2008, 180(7):4763-4773. Lemoine S, Morva A, Youinou P, Jamin C: Human T cells induce their own regulation through activation of B cells. J Autoimmun 2011, 36(34):228-238. Lemoine S, Morva A, Youinou P, Jamin C: Regulatory B cells in autoimmune diseases: how do they work? Ann N Y Acad Sci 2009, 1173:260-267. Lenert P, Brummel R, Field EH, Ashman RF: TLR-9 activation of marginal zone B cells in lupus mice regulates immunity through increased IL-10 production. J Clin Immunol 2005, 25(1):29-40. Lieberman J: The ABCs of granule-mediated cytotoxicity: new weapons in the arsenal. Nat Rev Immunol 2003, 3(5):361-370. Lindner S, Dahlke K, Sontheimer K, Hagn M, Kaltenmeier C, Barth TF, Beyer T, Reister F, Fabricius D, Lotfi R, Lunov O, Nienhaus GU, Simmet T, Kreienberg R, Moller P, Schrezenmeier H, Jahrsdorfer B: Interleukin 21Induced Granzyme B-Expressing B Cells Infiltrate Tumors and Regulate T Cells. Cancer Res 2013, 73(8):2468-2479. Liu J, Zhan W, Kim CJ, Clayton K, Zhao H, Lee E, Cao JC, Ziegler B, Gregor A, Yue FY, Huibner S, Macparland S, Schwartz J, Song HH, Benko E, Gyenes G, Kovacs C, Kaul R, Ostrowski M: IL-10-Producing B Cells Are Induced Early in HIV-1 Infection and Suppress HIV-1-Specific T Cell Responses. PLoS One 2014, 9(2):e89236. Loeb CR, Harris JL, Craik CS: Granzyme B proteolyzes receptors important to proliferation and survival, tipping the balance toward apoptosis. J Biol Chem 2006, 281(38):28326-28335. Maggi E, Cosmi L, Liotta F, Romagnani P, Romagnani S, Annuziato F: Thymic regulatory T cells. Autoimmun Rev 2005, 4:579-586. Manches O, Munn D, Fallahi A, Lifson J, Chaperot L, Plumas J, Bhardwaj N: HIV-activated human plasmacytoid DCs induce Tregs through an Literaturverzeichnis 97. 98. 99. 100. 101. 102. 103. 104. 105. 106. 107. 108. 109. 110. 111. 112. 69 indoleamine 2,3-dioxygenase-dependent mechanism. J Clin Invest 2008, 118(10):3431-3439. Mangan NE, Fallon RE, Smith P, van Rooijen N, McKenzie AN, Fallon PG: Helminth infection protects mice from anaphylaxis via IL-10-producing B cells. J Immunol 2004, 173(10):6346-6356. Mann MK, Maresz K, Shriver LP, Tan Y, Dittel BN: B cell regulation of CD4+CD25+ T regulatory cells and IL-10 via B7 is essential for recovery from experimental autoimmune encephalomyelitis. J Immunol 2007, 178(6):3447-3456. Marsigliante S, Biscozzo L, Marra A, Nicolardi G, Leo G, Lobreglio GB, Storelli C: Computerised counting of tumour infiltrating lymphocytes in 90 breast cancer specimens. Cancer Lett 1999, 139(1):33-41. Matsushita T, Yanaba K, Bouaziz JD, Fujimoto M, Tedder TF: Regulatory B cells inhibit EAE initiation in mice while other B cells promote disease progression. J Clin Invest 2008, 118(10):3420-3430. Mauri C: Regulation of immunity and autoimmunity by B cells. Curr Opin Immunol 2010, 22(6):761-767. Mauri C, Bosma A: Immune regulatory function of B cells. Annu Rev Immunol 2012, 30:221-241. Mauri C, Ehrenstein MR: The 'short' history of regulatory B cells. Trends Immunol 2008, 29(1):34-40. Mauri C, Gray D, Mushtaq N, Londei M: Prevention of arthritis by interleukin 10-producing B cells. The Journal of experimental medicine 2003, 197(4):489-501. Mehta DS, Wurster AL, Whitters MJ, Young DA, Collins M, Grusby MJ: IL21 induces the apoptosis of resting and activated primary B cells. J Immunol 2003, 170(8):4111-4118. Mittal A, Murugaiyan G, Beynon V, Hu D, Weiner HL: IL-27 induction of IL21 from human CD8+ T cells induces granzyme B in an autocrine manner. Immunol Cell Biol 2012, 90(8):831-835. Miyara M, Sakaguchi S: Natural regulatory T cells: mechanisms of suppression. Trends Mol Med 2007, 13(3):108-116. Mizoguchi A, Bhan AK: A case for regulatory B cells. J Immunol 2006, 176(2):705-710. Mizoguchi A, Mizoguchi E, Takedatsu H, Blumberg RS, Bhan AK: Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation. Immunity 2002, 16(2):219-230. Mizoguchi E, Mizoguchi A, Preffer FI, Bhan AK: Regulatory role of mature B cells in a murine model of inflammatory bowel disease. Int Immunol 2000, 12(5):597-605. Montandon R, Korniotis S, Layseca-Espinosa E, Gras C, Megret J, Ezine S, Dy M, Zavala F: Innate pro-B-cell progenitors protect against type 1 diabetes by regulating autoimmune effector T cells. Proceedings of the National Academy of Sciences of the United States of America 2013. Mulligan-Kehoe MJ, Drinane MC, Mollmark J, Casciola-Rosen L, Hummers LK, Hall A, Rosen A, Wigley FM, Simons M: Antiangiogenic plasma activity in patients with systemic sclerosis. Arthritis Rheum 2007, 56(10):3448-3458. Literaturverzeichnis 113. 114. 115. 116. 117. 118. 119. 120. 121. 122. 123. 124. 70 Nagaraj S, Collazo M, Corzo CA, Youn JI, Ortiz M, Quiceno D, Gabrilovich DI: Regulatory myeloid suppressor cells in health and disease. Cancer Res 2009, 69(19):7503-7506. Nagler-Anderson C, Bhan AK, Podolsky DK, Terhorst C: Control freaks: immune regulatory cells. Nature Immunology 2004, 5(2):119-122. Nelson BH: CD20+ B cells: the other tumor-infiltrating lymphocytes. J Immunol 2010, 185(9):4977-4982. Neta R, Salvin SB: Specific suppression of delayed hypersensitivity: the possible presence of a suppressor B cell in the regulation of delayed hypersensitivity. J Immunol 1974, 113(6):1716-1725. Newell KA, Asare A, Kirk AD, Gisler TD, Bourcier K, Suthanthiran M, Burlingham WJ, Marks WH, Sanz I, Lechler RI, Hernandez-Fuentes MP, Turka LA, Seyfert-Margolis VL: Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest 2010, 120(6):1836-1847. Nurieva R, Yang XO, Martinez G, Zhang Y, Panopoulos AD, Ma L, Schluns K, Tian Q, Watowich SS, Jetten AM, Dong C: Essential autocrine regulation by IL-21 in the generation of inflammatory T cells. Nature 2007, 448(7152):480-483. Nurieva RI, Chung Y, Hwang D, Yang XO, Kang HS, Ma L, Wang YH, Watowich SS, Jetten AM, Tian Q, Dong C: Generation of T follicular helper cells is mediated by interleukin-21 but independent of T helper 1, 2, or 17 cell lineages. Immunity 2008, 29(1):138-149. Ozaki K, Spolski R, Ettinger R, Kim HP, Wang G, Qi CF, Hwu P, Shaffer DJ, Akilesh S, Roopenian DC, Morse HC, 3rd, Lipsky PE, Leonard WJ: Regulation of B cell differentiation and plasma cell generation by IL21, a novel inducer of Blimp-1 and Bcl-6. J Immunol 2004, 173(9):53615371. Pandiyan P, Zheng L, Ishihara S, Reed J, Lenardo MJ: CD4+CD25+Foxp3+ regulatory T cells induce cytokine deprivationmediated apoptosis of effector CD4+ T cells. Nat Immunol 2007, 8(12):1353-1362. Parekh VV, Prasad DV, Banerjee PP, Joshi BN, Kumar A, Mishra GC: B cells activated by lipopolysaccharide, but not by anti-Ig and anti-CD40 antibody, induce anergy in CD8+ T cells: role of TGF-beta 1. J Immunol 2003, 170(12):5897-5911. Parrish-Novak J, Dillon SR, Nelson A, Hammond A, Sprecher C, Gross JA, Johnston J, Madden K, Xu W, West J, Schrader S, Burkhead S, Heipel M, Brandt C, Kuijper JL, Kramer J, Conklin D, Presnell SR, Berry J, Shiota F, Bort S, Hambly K, Mudri S, Clegg C, Moore M, Grant FJ, Lofton-Day C, Gilbert T, Rayond F, Ching A, Yao L, Smith D, Webster P, Whitmore T, Maurer M, Kaushansky K, Holly RD, Foster D: Interleukin 21 and its receptor are involved in NK cell expansion and regulation of lymphocyte function. Nature 2000, 408(6808):57-63. Peng Y, Chen X, Liu Q, Zhang X, Huang K, Liu L, Li H, Zhou M, Huang F, Fan Z, Sun J, Ke M, Li X, Zhang Q, Xiang AP: Mesenchymal stromal cells infusions improve refractory chronic graft versus host disease through an increase of CD5+ regulatory B cells producing interleukin 10. Leukemia 2014, Epub ahead of print. Literaturverzeichnis 125. 126. 127. 128. 129. 130. 131. 132. 133. 134. 135. 136. 137. 138. 139. 71 Perricone MA, Smith KA, Claussen KA, Plog MS, Hempel DM, Roberts BL, St George JA, Kaplan JM: Enhanced efficacy of melanoma vaccines in the absence of B lymphocytes. J Immunother 2004, 27(4):273-281. Piccirillo CA: Regulatory T cells in health and disease. Cytokine 2008, 43(3):395-401. Qian L, Qian C, Chen Y, Bai Y, Bao Y, Lu L, Cao X: Regulatory dendritic cells program B cells to differentiate into CD19hiFcgammaIIbhi regulatory B cells through IFN-beta and CD40L. Blood 2012, 120(3):581591. Rafei M, Hsieh J, Zehntner S, Li M, Forner K, Birman E, Boivin MN, Young YK, Perreault C, Galipeau J: A granulocyte-macrophage colonystimulating factor and interleukin-15 fusokine induces a regulatory B cell population with immune suppressive properties. Nat Med 2009, 15(9):1038-1045. Ramakrishnan R, Assudani D, Nagaraj S, Hunter T, Cho HI, Antonia S, Altiok S, Celis E, Gabrilovich DI: Chemotherapy enhances tumor cell susceptibility to CTL-mediated killing during cancer immunotherapy in mice. J Clin Invest 2010, 120(4):1111-1124. Ray A, Basu S, Williams CB, Salzman NH, Dittel BN: A novel IL-10independent regulatory role for B cells in suppressing autoimmunity by maintenance of regulatory T cells via GITR ligand. J Immunol 2012, 188(7):3188-3198. Reichert TE, Day R, Wagner EM, Whiteside TL: Absent or low expression of the zeta chain in T cells at the tumor site correlates with poor survival in patients with oral carcinoma. Cancer Res 1998(58):53445347. Reth M: Antigen receptor tail clue. Nature 1989, 338:383-384. Romero V, Andrade F: Non-apoptotic functions of granzymes. Tissue Antigens 2008, 71(5):409-416. Samelson LE, Harford JB, Klausner RD: Identification of the components of the murine T cell antigen receptor complex. Cell 1985, 43:223-231. Sato E, Olson SH, Ahn J, Bundy B, Nishikawa H, Qian F, Jungbluth AA, Frosina D, Gnjatic S, Ambrosone C, Kepner J, Odunsi T, Ritter G, Lele S, Chen YT, Ohtani H, Old LJ, Odunsi K: Intraepithelial CD8+ tumorinfiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proceedings of the National Academy of Sciences of the United States of America 2005, 102(51):18538-18543. Saze Z, Schuler PJ, Hong C-S, Cheng D, Jackson EK, Whiteside TL: Adenosine production by human B cells and B cell-mediated suppression of activated T cells. Blood 2013, 122(1):9-18. Scheeren FA, Diehl SA, Smit LA, Beaumont T, Naspetti M, Bende RJ, Blom B, Karube K, Ohshima K, van Noesel CJ, Spits H: IL-21 is expressed in Hodgkin lymphoma and activates STAT5: evidence that activated STAT5 is required for Hodgkin lymphomagenesis. Blood 2008, 111(9):4706-4715. Scheffold A, Murphy KM, Hofer T: Competition for cytokines: T(reg) cells take all. Nat Immunol 2007, 8(12):1285-1287. Schioppa T, Moore R, Thompson RG, Rosser EC, Kulbe H, Nedospasov S, Mauri C, Coussens LM, Balkwill FR: B regulatory cells and the tumorpromoting actions of TNF-alpha during squamous carcinogenesis. Literaturverzeichnis 140. 141. 142. 143. 144. 145. 146. 147. 148. 149. 150. 151. 152. 72 Proceedings of the National Academy of Sciences of the United States of America 2011, 108(26):10662-10667. Schmidt M, Böhm D, von Törne C, Steiner E, Puhl A, Pilch HL, HA., Hengstler J, Kölbl H, Gehrmann M: The humoral immune system has a key prognostic impact in node-negative breast cancer. Cancer Res 2008, 68:5405-5413. Schultz K, Klarnet J, Gieni R, Hayglass K, Greenberg P: The role of Bcells for in vivo T-cell response to a frined virus-induced leukemia. Science 1990, 249(4971):921-923. Shen P, Roch T, Lampropoulou V, RA. OC, Stervbo U, Hilgenberg E, Ries S, Dang VD, Jaimes Y, Daridon C, Jouneau L, Boudinot P, Wilantri S, Sakwa I, Miyazaki Y, Leech M, McPherson R, Wirtz S, Neurath M, Hoelig K, Meinl E, Grutzkau A, Grun J, Horn K, Kuhl A, Dorner T, Bar-Or A, Kaufmann SH, Anderton S, Fillatreau S: IL-35-producing B cells are critical regulators of immunity during autoimmune and infectious diseases. Nature 2014, 507:366-370. Shi JY, Gao Q, Wang ZC, Zhou J, Wang X, Min ZH, Shi YH, Shi GM, Ding ZB, Ke AW, Dai Z, Qiu SJ, Song K, Fan J: Margin Infiltrating CD20+ B Cells Display an Atypical Memory Phenotype and Correlate with Favorable Prognosis in Hepatocellular Carcinoma. Clin Cancer Res 2013. Siewe B, Stapleton JT, Martinson J, Keshavarzian A, Kazmi N, Demarais PM, French AL, Landay A: Regulatory B cell frequency correlates with markers of HIV disease progression and attenuates anti-HIV CD8+ T cell function in vitro. J Leukoc Biol 2013. Simon MM, Kramer MD, Prester M, Gay S: Mouse T-cell associated serine proteinase 1 degrades collagen type IV: a structural basis for the migration of lymphocytes through vascular basement membranes. Immunology 1991, 73:117-119. Spolski R, Leonard WJ: Interleukin-21: basic biology and implications for cancer and autoimmunity. Annu Rev Immunol 2008, 26:57-79. Spolski R, Leonard WJ: Interleukin-21: a double-edged sword with therapeutic potential. Nat Rev Drug Discov 2014, 13(5):379-395. Sumimoto K, Uchida K, Kusuda T, Mitsuyama T, Sakaguchi Y, Fukui T, Matsushita M, Takaoka M, Nishio A, Okazaki K: The role of CD19(+)CD24(high)CD38(high) and CD19(+)CD24(high)CD27(+) regulatory B cells in patients with type 1 autoimmune pancreatitis. Pancreatology 2014, 14(3):193-200. Tak PP, Spaeny-Dekking L, Kraan MC, Breedveld FC, Froelich CJ, Hack CE: The levels of soluble granzyme A and B are elevated in plasma and synovial fluid of patients with rheumatoid arthritis (RA). Clin Exp Immunol 1999, 116(2):366-370. Tompkins N, MacNeil A, Pohajdak B: Cytohesin-associated scaffolding protein (CASP) is a substrate for granzyme B and ubiquitination. Biochem Biophys Res Commun 2014, 452(3):473-478. Trapani JA, Sutton VR: Granzyme B: pro-apoptotic, antiviral and antitumor functions. Curr Opin Immunol 2003, 15(5):533-543. Tretter T, Venigalla RK, Eckstein V, Saffrich R, Sertel S, Ho AD, Lorenz HM: Induction of CD4+ T-cell anergy and apoptosis by activated human B cells. Blood 2008, 112(12):4555-4564. Literaturverzeichnis 153. 154. 155. 156. 157. 158. 159. 160. 161. 162. 163. 164. 165. 166. 167. 73 Trimble LA, Lieberman J: Circulating CD8 T lymphocytes in human immunodeficiency virus-infected individuals have impaired function and downmodulate CD3 zeta, the signaling chain of the T-cell receptor complex. Blood 1998, 91(2):585-594. van de Veen W, Stanic B, Yaman G, Wawrzyniak M, Sollner S, Akdis DG, Ruckert B, Akdis CA, Akdis M: IgG4 production is confined to human IL10-producing regulatory B cells that suppress antigen-specific immune responses. J Allergy Clin Immunol 2013, 131(4):1204-1212. van Domselaar R, Bovenschen N: Cell death-independent functions of granzymes: hit viruses where it hurts. Rev Med Virol 2011, 21(5):301314. van Domselaar R, Quadir R, van der Made AM, Broekhuizen R, Bovenschen N: All human granzymes target hnRNP K that is essential for tumor cell viability. J Biol Chem 2012, 287(27):22854-22864. van Tetering G, Bovenschen N, Meeldijk J, J. vDP, Vooijs M: Cleavage of Notch1 by granzyme B disables its transcriptional activity. Biochemical Journal 2011, 437:313-322. Veugelers K, Motyka B, Goping IS, Shostak I, Sawchuk T, Bleackley RC: Granule-mediated killing by granzyme B and perforin requires a mannose 6-phosphate receptor and is augmented by cell surface heparan sulfate. Mol Biol Cell 2006, 17(2):623-633. Vignali DA, Collison LW, Workman CJ: How regulatory T cells work. Nat Rev Immunol 2008, 8(7):523-532. Wagner U, Kaltenhauser S, Pierer M, Wilke B, Arnold S, Hantzschel H: B lymphocytopenia in rheumatoid arthritis is associated with the DRB1 shared epitope and increased acute phase response. Arthritis Res 2002, 4(4):R1. Wang RX, Yu CR, Dambuza IM, Mahdi RM, Dolinska M, Sergeey YV, Wingfield PT, Kim SH, Egwuagu CE: Interleukin-35 induces regulatory B cells that suppress autoimmune disease. Nat Med 2014. Watt V, Ronchese F, Ritchie D: Resting B cells suppress tumor immunity via an MHC class-II dependent mechanism. J Immunother 2007, 30(3):323-332. Wei S, Kryczek I, Zou L, Daniel B, Cheng P, Mottram P, Curiel T, Lange A, Zou W: Plasmacytoid dendritic cells induce CD8+ regulatory T cells in human ovarian carcinoma. Cancer Res 2005, 65(12):5020-5026. Wieckowski E, Wang GQ, Gastman BR, Goldstein LA, Rabinowich H: Granzyme B-mediated degradation of T-cell receptor zeta chain. Cancer Res 2002, 62(17):4884-4889. Wolf D, Wolf AM, Rumpold H, Fiegl H, Zeimet AG, Muller-Holzner E, Deibl M, Gastl G, Gunsilius E, Marth C: The expression of the regulatory T cell-specific forkhead box transcription factor FoxP3 is associated with poor prognosis in ovarian cancer. Clin Cancer Res 2005, 11(23):8326-8331. Wolf SD, Dittel BN, Hardardottir F, Janeway CA, Jr.: Experimental autoimmune encephalomyelitis induction in genetically B celldeficient mice. The Journal of experimental medicine 1996, 184(6):22712278. Woo EY, Chu CS, Goletz TJ, Schlienger K, Yeh H, Coukos G, Rubin SC, Kaiser LR, June CH: Regulatory CD4(+)CD25(+) T cells in tumors from Literaturverzeichnis 168. 169. 170. 171. 172. 173. 174. 175. 176. 177. 74 patients with early-stage non-small cell lung cancer and late-stage ovarian cancer. Cancer Res 2001, 61(12):4766-4772. Wood KJ, Bushell A, Hester J: Regulatory immune cells in transplantation. Nature Rev 2012, 12:417-430. Xu W, Narayanan P, Kang N, Clayton S, Ohne Y, Shi P, Herve MC, Balderas R, Picard C, Casanova JL, Gorvel JP, Oh S, Pascual V, Banchereau J: Human plasma cells express granzyme B. European journal of immunology 2014, 44(1):275-284. Yanaba K, Bouaziz JD, Matsushita T, Tsubata T, Tedder TF: The development and function of regulatory B cells expressing IL-10 (B10 cells) requires antigen receptor diversity and TLR signals. J Immunol 2009, 182(12):7459-7472. Yanaba K, Bouaziz JD, Haas KM, Poe JC, Fujimoto M, Tedder TF: A regulatory B cell subset with a unique CD1dhiCD5+ phenotype controls T cell-dependent inflammatory responses. Immunity 2008, 28(5):639-650. Yang M, Sun L, Wang S, Ko KH, Xu H, Zheng BJ, Cao X, Lu L: Novel function of B cell-activating factor in the induction of IL-10-producing regulatory B cells. J Immunol 2010, 184(7):3321-3325. Yang M, Deng J, Liu Y, Ko KH, Wang X, Jiao Z, Wang S, Hua Z, Sun L, Srivastava G, Lau CS, Cao X, Lu L: IL-10-producing regulatory B10 cells ameliorate collagen-induced arthritis via suppressing Th17 cell generation. Am J Pathol 2012, 180(6):2375-2385. Yang O, Lin H, Dagorag M, Ng H, Effros R, Uittenbogaart C: Decreased perforin and GrB expression in senescent HIV-1-specific cytotoxic T lymphocytes. Virology 2005, 332(1):16-19. Yoshizaki A, Miyagaki T, DiLillo DJ, Matsushita T, Horikawa M, Kountikov EI, Spolski R, Poe JC, Leonard WJ, Tedder TF: Regulatory B cells control T-cell autoimmunity through IL-21-dependent cognate interactions. Nature 2012, 491(7423):264-268. Zhang D, Beresford PJ, Greenberg AH, Lieberman J: Granzymes A and B directly cleave lamins and disrupt the nuclear lamina during granulemediated cytolysis. Proceedings of the National Academy of Sciences of the United States of America 2001, 98(10):5746-5751. Zou W, Machelon V, Coulomb-L'Hermin A, Borvak J, Nome F, Isaeva T, Wei S, Krzysiek R, Durand-Gasselin I, Gordon A, Pustilnik T, Curiel DT, Galanaud P, Capron F, Emilie D, Curiel TJ: Stromal-derived factor-1 in human tumors recruits and alters the function of plasmacytoid precursor dendritic cells. Nat Med 2001, 7(12):1339-1346. Danksagung Inhalte dieser Seiten wurden aus Gründen des Datenschutzes entfernt. 75 Danksagung 76 Lebenslauf 77 Lebenslauf Der Lebenslauf ist in der Online-Version aus Gründen des Datenschutzes nicht enthalten Publikationen 78 Publikationen 2015: Kaltenmeier C, Gawanbacht A, Beyer T, Lindner S, van der Merwe D, Härter G, Grüner B, Lotfi R, Kern P, Bommer M, Schrezenmeier H, Kirchhoff F, Jahrsdörfer B: CD4+ T cell-derived IL-21 and deprivation of CD40 signaling favors the in-vivo development of granzyme B-expressing regulatory B cells in HIV patients. J Immunol 2015, 194(8):3768-77. 2014: Jahrsdörfer B., Lindner S., Hagn M., Schrezenmeier H.: CD27+IgD- B cells in the peripheral blood of colorectal cancer patients: on anti-tumor or tumor-protective mission? Letter to the Editor, Oncoscience 2014, 1(9):558-559. Hagn M, Blackwell SE, Beyer T, Ebel V, Fabricius D, Lindner S, Stilgenbauer S, Simmet T, Tam C, Neeson P, Trapani JA, Schrezenmeier H, Weiner GJ, Jahrsdörfer B: B-CLL cells acquire APC- and CTL-like phenotypic characteristics after stimulation with CpG ODN and IL-21. Int Immunol. 2014, 26(7):383-95. 2013: Lindner S, Dahlke K, Sontheimer K, Hagn M, Kaltenmeier C, Barth TF, Beyer T, Reister F, Fabricius D, Lotfi R, Lunov O, Nienhaus GU, Simmet T, Kreienberg R, Möller P, Schrezenmeier H, Jahrsdorfer B: Interleukin 21-induced granzyme Bexpressing B cells infiltrate tumors and regulate T cells. Cancer Research 2013, 73 (8), 2468-2479 2012: Hagn M, Sontheimer K, Dahlke K, Brueggemann S, Kaltenmeier C, Beyer T, Hofmann S, Lunov O, Barth TF, Fabricius D, Tron K, Nienhaus GU, Simmet T, Schrezenmeier H, Jahrsdörfer B: Human B cells differentiate into granzyme Bsecreting cytotoxic B lymphocytes upon incomplete T-cell help. Immunol Cell Biol. 2012 Apr;90(4):457-67. 2010: Jakob RP, Zierer BK, Weininger U, Hofmann SD, Lorenz SH, Balbach J, Dobbek H, Schmid FX: Elimination of a cis-proline-containing loop and turn optimization stabilizes a protein and accelerates its folding. J Mol Biol. 2010 Jun 4;399(2):33146. Abstracts Lindner et al.: Interleukin-21 induces regulatory B cells in humans. Posterpräsentation, 46. Jahreskongress der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie (DGTI), 2013, Münster, Deutschland. Publikationen 79 Lindner et al.: Interleukin-21-induced granzyme B-expressing B lymphocytes regulate T cells and infiltrate tumors. Posterpräsentation, Annual Meeting of the The American Association of Immunologists (AAI), Honolulu, USA Lindner et al.: Interleukin-21-induced granzyme B-expressing B lymphocytes infiltrate tumors and regulate T cells. Posterpräsentation, 54th Annual Meeting of the American Society of Hematology (ASH), 2012, Atlanta, USA Hofmann et al.: Interleukin-21-induced granzyme B-expressing B lymphocytes regulate T-cells and infiltrate human solid tumors. Posterpräsentation, 45. Jahreskongress der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie (DGTI), 2012, Graz, Österreich. Hofmann et al.: Tumor-infiltrating lymphocytes in breast cancer tissue comprise granzyme B-expressing B cells with cytotoxic potential. Posterpräsentation, 100th Annual Meeting of the The American Association of Immunologists (AAI), Boston, USA, J Immunol 2012 188:127.23 Preise Posterpreis „Bestes Poster” für Lindner et al.: Interleukin-21 induces regulatory B cells in humans. 46. Jahreskongress der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie (DGTI), 2013, Münster, Deutschland. Posterpreis “Bestes Poster“ für Hofmann et al.: Interleukin-21-induced granzyme B-expressing B lymphocytes regulate T-cells and infiltrate human solid tumors. 45. Jahreskongress der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie (DGTI), 2012, Graz, Österreich.