Herstellung von dendritischen Zellen für die Verwendung als
Werbung

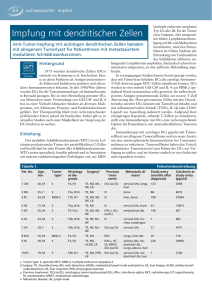
Themenfeld: Translationale Forschung Institut für Molekulare Immunologie Herstellung von dendritischen Zellen für die Verwendung als Antitumor-Vakzine Die Tumorimmunologie hat sich zur Aufgabe gemacht, die körpereigenen Abwehrmechanismen zu erforschen und neue Wege zu finden, die Zellen des Immunsystems oder Tumorzellen gezielt therapeutisch zu beeinflussen, um Krebserkrankungen zu bekämpfen. E ine vielversprechende Immuntherapie-Strategie basiert auf professionellen Antigen- präsentierenden dendritischen Zellen (DCs), welche nach dem derzeitigen Wissensstand die besten Aktivatoren der Immunabwehr sind. Für die Entwicklung einer DC-basierten Vakzine müssen insbesonders drei interaktive Signale berücksichtigt werden, um eine optimale Aktivierung von angeborener und adaptiver Antitumor-Immunität zu erreichen (siehe Abbildung): Präsentation von MHC-Tumorpeptid-Komplexen auf der Oberfläche von DCs für die Selektion von MHC-restringierten T-Zellen sowie die Expression von aktivierenden Liganden für die Stimulation von Effektorzellen des angeborenen Immunsystems (Signal 1), dominante Expression von positiven kostimulatorischen Molekülen (Signal 2) und Produktion von für das Immunsystem förderlichen Botenstoffen (Signal 3). Für unreife DCs und nicht vollständig ausgereifte DCs, die in der Vergangenheit vermehrt für klinische Studien eingesetzt wurden, ist mittlerweile die Induktion von regulatorischen T-Zellen und / oder Toleranz nachgewiesen. Unser Ziel ist es deshalb, eine neue Generation von „vollständig ausgereiften“ DCs für eine effiziente Aktivierung von Effektorzellen zu entwickeln. Besonders hinsichtlich Signal 1 werden am Institut für Molekulare Immunologie Verfahren erarbeitet, um Tumorantigene besonders effizient in DCs einzubringen, mit dem Bestreben, hochaffine T-Helfer-Zellen, zytotoxische T-Zellen oder auch Zellen des angeborenen Immunsystems, wie z.B. Natürliche Killer (NK)-Zellen, zu generieren, die Tumorzellen effektiv erkennen und zerstören können. Es zeigte sich, dass die Transfektion mit Tumorantigen-kodierenden RNS-Molekülen in reife dendritische Zellen dazu in besonderem Maße geeignet ist. Der Vorteil dieses Vorgehens besteht darin, dass der Vakzine-Ansatz nicht auf bekannte Tumor-Peptide beschränkt ist, weil das gesamte Protein für die Prozessierung und Präsentation durch die DCs zur Verfügung steht. Am Institut für Molekulare Immunologie wurde die Beladung von DCs mit in-vitrotranskribierten Einzelspezies-cRNS-Molekülen zur Aktivierung von T-Zellen selektierter Spezifität im Melanomsystem sowie im Rahmen einer Vakzine-Entwicklung zur Behandlung von Patienten mit metastasierendem Nierenzellkarzinom bereits erfolgreich etabliert. Hierbei zeigte sich, dass idealerweise nicht mehr als drei verschiedene Tumorantigen-kodierende RNS-Spezies gleichzeitig in die Empfänger DCs transfiziert werden sollten, um keine Inhibition der Antigen-Präsentation zu erreichen. 48 Wissenschaftliche Highlights Dr. Bernhard Frankenberger Institut für Molekulare Immunologie Telefon 0 89 / 70 99 344 [email protected] Literatur: Zobywalski, A., Javorovic, M., Frankenberger, B., Pohla, H., Kremmer, E., Bigalke, I., Schendel, D.J.: Generation of clinical grade dendritic cells with capacity to produce biologically active IL-12p70. J Transl Med Apr 12; 5:18 (2007) Themenfeld: Translationale Forschung Außerdem wurden am Institut Bedingungen etabliert, um DCs mit optimaler Vitalität, Lebensdauer, Phänotyp, Wanderungspotential und Funktion zu generieren. Ein Schwerpunkt bezüglich der Optimierung von DC-basierten Vakzinen konzentrierte sich deshalb auch auf Analysen mit unterschiedlichen DC-Ausreifungs-Methoden, welche v.a. auf die für eine Aktivierung von Effektorzellen sehr wichtigen Signale 2 und 3 einen grossen Einfluß zeigten. Insbesondere die Fähigkeit von reifen DCs, dem angeborenen und adaptiven Immunsystem ein geeignetes Signal-3-Milieu in Form von sezerniertem IL-12 bereitzustellen, lässt eine wesentliche Verbesserung der Vakzine-Effizienz erwarten. Weiterhin werden Protokolle zur standardisierten Herstellung der dendritischen Zellen (SOPs) für die therapeutische Anwendung am Patienten ausgearbeitet. Für die Herstellung größerer Mengen an RNS-beladenen DCs nach SOP-Bedingungen für einen klinischen Phase-I/II-Einsatz sind sowohl eine fundierte Qualitätskontrolle der DC-basierten Vakzine unter pre-GMP-Bedingungen sowie eine GMP-Einrichtung erforderlich. Herstellung von DCs für eine Antitumor-Vakzine Bei der Herstellung einer DC-basierten Tumorzell-Vakzine ist die Optimierung von drei Signalen an die Effektorzellen besonders wichtig: die von den DCs exprimierten Tumor-assoziierten Antigene sollen möglichst die Heterogenität des Tumors bezüglich der exprimierten Zielantigene abdecken (Signal 1), Entwicklung von DCs mit einer dominanten positiven Kostimulation (Signal 2) und Design von DC-Reifungs-Cocktails, die es den DCs erlaubt, biologisch aktives IL-12 mit Th1-polarisierendem Potenzial zu produzieren, um die AntitumorAntwort zu verbessern (Signal 3). Si gn al 3 Th1 / CTL Optimale dendritische Zellen müssen 3 Signale für die Aktivierung von Effektorzellen bereitstellen 1 Mono GM-CSF IL-4 2 NK IL-12 hoch IL-10 niedrig ReifungsCocktail iDC mDC 4 5 Anti-Tumor Immunität 3 3 RNS-kodierende Tumorantigene 1 nal g i S positive Kostimulation hoch negative Kostimulation niedrig Signal 2 Wissenschaftliche Highlights 49