Forschungsbericht - Medizinische Hochschule Hannover
Werbung

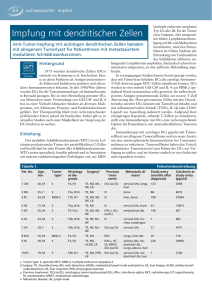
TWINCORE Infektionsimmunologie Direktor: Prof. Dr. Tim Sparwasser Tel.: 0511/ 220027200 • E-Mail: [email protected] • http://www.twincore.de/ infektionsimmunologie.html Forschungsprofil Vakzinierungen können als größter Erfolg der Immunologie angesehen werden und gelten als kosteneffektivste Maßnahmen der Medizin. Dennoch sterben jährlich Millionen an respiratorischen Infektionen, Durchfallerkrankungen, Tuberkulose, Malaria und AIDS. Somit existieren trotz des besserem Verständnis des Immunsystems seit den Pionierarbeiten von Edward Jenner für viele Erreger keine geeigneten Impfstrategien, die sowohl eine gute zelluläre wie humorale Immunantwort induzieren. Dies gilt insbesondere für sog. „split“ Vakzine, wo anstelle von attenuierten Erregern aufgereinigte Peptidantigene benutzt werden. Selbst in Bereichen, in denen durch moderne Antibiotikatherapie große Fortschritte erzielt wurden, entstehen als Folge der Intensivmedizin multiple Resistenzen, die drohen, uns in die Ära der prä-antibiotischen Medizin zurückzuversetzen. Charles Janeway formulierte 1989 das „schmutzige Geheimnis des Immunologen“, das besagte, dass mit den Fortschritten der modernen Proteinbiochemie Immunisierungen mit aufgereinigten Proteinen immer ineffizienter wurden. Er postulierte, dass kontaminierende Faktoren von Pathogenen („pathogen associated molecular patterns“: PAMPs), die über sog. Mustererkennungsmoleküle („pattern recogniction receptors“ PRRs) erkannt werden, essentiell sind für die Unterscheidung des Immunsystems zwischen „Selbst“ und „Nicht-Selbst“ und damit letztlich für den Impferfolg. Prof. Dr. Tim Sparwasser, Facharzt für Medizinische Mikrobiologie, leitet das das Institut für Infektionsimmunologie am Zentrum für Experimentelle und Klinische Infektionsforschung, Twincore, seit dem 15.09.2008. Sein Forschungsschwerpunkt liegt in der Untersuchung der Bedeutung von Mustererkennungsmolekülen z.B. aus der Familie der Toll-like Rezeptoren (TLRs) und der C-Typ Lektine (CLRs) für die Aktivierung der wichtigsten positiven Regulatoren des Immunsystems und Initiatoren adaptiver Immunantworten, der dendritischen Zellen (DCs). Ein weiterer Fokus sind Regulatorische T Zellen (Tregs), die man als Hauptgegenspieler von DCs bezeichnen könnte: Tregs verhindern über noch nicht komplett verstandene Mechanismen eine überschießende Immunantwort und limitieren T Effektorzell-Proliferation. Optimale Vakzinierungsstrategien gegen Pathogene könnten die Aktivierung bestimmter DC-Subpopulationen unter Vermeidung der Treg Expansion bzw. Induktion beinhalten. Vakzinierungsstudien, die im murinen Modellsystem auf Tregs und DCs abzielen, besitzen allerdings mehrere Limitationen: Tregs und DC Subpopulationen haben gemeinsam, dass diese in vivo einer detaillierten Untersuchung schlecht zugänglich sind. So existieren z.B. Subpopulationen von DCs in extrem geringer Anzahl in verschiedenen lymphatischen Organen, die teilweise sehr spezialisierte Aufgaben bis hin zur Induktion von Toleranz besitzen sollen. Da diese „regulatorischen Immunzellen“ z.T. sehr empfindlich auf ex vivo Isolation reagieren und in vivo bislang nur sehr unzureichend manipulierbar waren, ist der Wissenstand über Funktion und Forschungsbericht 2008 803 TWINCORE Bedeutung von Tregs und DC Subpopulationen für die adaptive Immunität noch unvollständig. Ein weiterer komplizierender Faktor ist die Expression unterschiedlicher Mustererkennungsmoleküle oder unterschiedliche Expressionsprofile von PRRs auf DC Subpopulationen zwischen Maus und Mensch. Eine wichtige Zielsetzung des Instituts für Infektionsimmunologie ist es daher, molekulare Werkzeuge zu entwickeln, die eine genetische Manipulation von DCs und Tregs und damit letztlich physiologischere Modelle ermöglichen. Wir wollen anhand dieser Modelle die Funktion von Tregs und Subpopulationen von DCs in Infektion, Allergie und Toleranz untersuchen. In „humanisierten“ Modellen wird die Rolle von PRRs wie humanem TLR9 und DC-SIGN analysiert und Impfstrategien, die auf diese Moleküle abzielen, in vivo getestet. Forschungsprojekte Molekulare Mechanismen der DC-SIGN-vermittelten Immunevasion: Entwicklung eines murinen Krankheitsmodells zur Pathogenese der Tuberkulose Weltweit ist nach Angaben der WHO ca. ein Drittel der Weltbevölkerung mit Mycobacterium tuberculosis infiziert. Mykobakterien werden überwiegend über die Atemwege übertragen und sind verantwortlich für fast 2 Millionen Todesfälle pro Jahr. Die akute aktive Tuberkulose macht nur ca. 10% aller Infektionen aus, meist sind die betroffenen Individuen asymptomatisch und nicht kontagiös. Die mykobakterielle Infektion wird zum Teil lebenslang durch das Immunsystem kontrolliert, und eine aktive Tuberkulose bricht erst dann aus, wenn diese Balance zwischen Erreger und Wirt gestört wird. Es ist unklar, warum die zelluläre Immunität vom T Helfer-1 (Th1)-Typ nicht ausreicht, um eine einmal erfolgte Infektion völlig auszuheilen bzw. sicher vor Re-infektion der Lunge zu schützen. Makrophagen gelten als Hauptzielzellen und zugleich wichtigste Effektorzellen der frühen mykobakteriellen Infektion, danach sind vor allem CD4+ und CD8+ T Zellen der adaptiven Immunantwort für die Kontrolle der Infektion verantwortlich. Die Rolle von dendritischen Zellen (DCs) in der Tuberkulose wurde erst in jüngster Zeit Abb. 1: Expression des humanen Transgens: DC-SIGN positive Zellen (braun) wurden immunhistochemisch in Lymphknoten, Milz und Lunge detektiert. Mittels FACS- Analyse lassen sich DC-SIGN-positive Zellen als CD11c-positive dendritische Zellen darstellen. intensiver untersucht: Ähnlich wie Makrophagen besitzen DCs Oberflächenrezeptoren für Mykobakterien, wie z.B. den Fc-Rezeptor, Komplementrezeptoren (CD11b, CD11c) und den Mannoserezeptor (MR), und gelten außerdem als Hauptproduzenten von Interleukin 12 (IL-12), das eine essentielle Bedeutung in der Induktion von Th1 Antworten und damit in der Kontrolle der mykobakteriellen Infektion besitzt. 804 Forschungsbericht 2008 TWINCORE DC-SIGN („Dendritic Cell-Specific ICAM-3 Grabbing Non-integrin” = CD209), ein Rezeptor für mannosylierte Oberflächenantigene von verschiedenen Pathogenen, bindet ebenfalls an Mykobakterien und ist im Menschen spezifisch auf myeloiden DCs exprimiert. In vitro Experimente haben gezeigt, dass DCSIGN nicht nur den wichtigsten Liganden für mannosyliertes Lipoarabinomannan (Man-LAM), Zellwandbestandteile langsam wachsender Mykobakterien, auf DCs darstellt, sondern auch, dass humane DCs nach DC-SIGN Bindung und LPS Stimulation vermehrt Interleukin 10 (IL-10) produzieren. Diese Beobachtung führte zu der Hypothese, dass DC-SIGN über Inhibition von aktivierenden Toll-like Rezeptor (TLR) Signaling zur Immunevasion (Th2 Bias) beiträgt. Die Rolle von DC-SIGN in vivo war bislang ungeklärt. Ziel unserer Studie war es, ein transgenes (tg) Modell zur Pathogenese der Tuberkulose zu etablieren, um die Bedeutung von DCs und humanem DC-SIGN in vivo für die Immunevasion von Mykobakterien zu verstehen (Schäfer et al. Journal of Immunology 2008). In der Maus gibt es verschiedene Homologe des humanen DC-SIGN-Moleküls, keines ist nach derzeitigem Wissenstand jedoch wie im Menschen auf myeloiden DCs exprimiert. Unter der Kontrolle des murinen CD11c Promoters wurde daher die cDNA des humanen CD209 Moleküls transgen in allen konventionellen DCs exprimiert (Abb. 1). [Abbildung1] Nach der Etablierung transgener Linien („hSIGN Linie“) haben wir Kontroll-DCs (= „Wildtyp“: wt) und hSIGN DCs zunächst in vitro mit Mykobakterien infiziert. Interessanterweise waren im Gegensatz zu den publizierten humanen Daten keine signifikanten Unterschiede bezüglich der IL10 Sekretion detektierbar: In vitro wurden DCs aus tg Mäusen und nicht-transgenen mit lebenden Mycobacterium Bovis (BCG), Zellwandbestandteilen von M. tuberculosis (Mtb) (Kollaboration mit J. Belisle, University of Colorado), sowie lebenden Mtb (Kollaboration S. Ehlers, Borstel) stimuliert und die Zytokinspiegel verglichen. Im Kulturüberstand stimulierter DC-SIGN+-Zellen war 50-75% weniger IL-12-p40 und IL-12-p70 messbar als in Kontroll-DCs. Keine signifikanten Unterschiede zwischen tg und Kontroll- (wt) Zellen konnten gezeigt werden, wenn ausschließlich Toll-like-Rezeptor (TLR) Liganden wie z.B. CpG benutzt wurden. Die Unterschiede im Zytokinprofil konnten nur bei DCs (die das Transgen exprimieren) beobachtet werden, die Makrophagen von DC-SIGN tg und Kontroll-Mäusen zeigten ähnliche Zytokinspiegel nach Infektion mit Mykobakterien. Die verminderten IL12 Spiegel ließen sich funktionell als reduziertes Th1 priming sowohl in CD4 wie auch in CD8 T Zellen reproduzieren. Wegen der unterschiedlichen intrazytoplasmatischen Domäne der murinen Formen von DC-SIGN, die nicht das im Primaten hochkonservierte Motiv aus sauren Aminosäuren (EEE) in Kombination mit einem Di-Leucin Motiv (LL) exprimieren, waren 10 verschiedene DC-SIGN Mutanten mittels PCR hergestellt und subkloniert worden (inklusive Delta 20, bzw. Delta 35 und human-murinen chimären Mutanten), von denen ursprünglich Erkenntnisse über den DC-SIGN-vermittelten Pathomechanismus erwartet worden waren. Allerdings konnten wir schon mit DCs aus wt und tg Tieren keine veränderte Kompartimentierung des Antigens durch DC-SIGN beobachten, wie ursprünglich für andere DC-SIGN Liganden (HIV) beschrieben. Auch biochemisch über Fraktionierung der lysosomalen und endosomalen Kompartimente (Percoll-Gradient, Fraktionierung über Bestimmung der ß-Hexoseaminidase-Aktivität) waren keine auffälligen Unterschiede zwischen wt und tg Zellen bezüglich der Prozessierung von Mykobakterien sichtbar. Die Struktur-Funktionsanalyse der intrazellulären Domäne von DC-SIGN könnte noch für den Aspekt der Beeinflussung von TLR Signalwegen attraktiv werden: Humanes DC-SIGN enthält ein tyrosin-basiertes Motiv, das ebenfalls nicht in der Maus anzutreffen ist, und das an ITAM oder ITIM Motive erinnert. Daher ist ein Teil der 10 Konstrukte, Forschungsbericht 2008 805 TWINCORE in denen die putativen Internalisierungsmotive bzw. das Tyrosinmotiv durch neutrale Aminosäuren (Alanin, Phenylalanin) ersetzt wurden, für zukünftige Studien interessant. Die Zytokindaten legten einen Einfluss von DC-SIGN auf TLR-vermittelte Signalwege nahe, wie bereits für humane DCs postuliert. Wir haben daher Western-Blot Analysen sowie EMSAs für NFkappaB durchgeführt, konnten jedoch trotz der deutlichen Unterschiede in den IL12 Spiegeln keinen Einfluss des Transgens auf p38/Erk oder JNK Aktivierung feststellen. Ebenfalls kein Einfluss konnte detektiert werden für die frühe NFkappaB Aktivierung (5-30 Minuten). Von der Gruppe um Y. van Kooyk (Univ. Amsterdam) wurden mittlerweile humane Daten publiziert, die einen DC-SIGN Einfluss auf die späte NFkappaB-Aktivierung suggerieren. Eine Raf-Kinase scheint in humanen DCs involviert zu sein. Erste Daten in unseren tg DCs legen ähnliche Effekte nahe, die in Zukunft in unseren Systemen im Detail weiterverfolgt werden. Erste Studien zu Lectin-vermittelten Signalkaskaden wurden bereits in Kollaboration mit der Arbeitsgruppe um J. Ruland (TUM) publiziert (Gross et al. Nature 2006). Der Vorteil im murinen System ist der Verfügbarkeit der entsprechenden Gen-defizienten Mäuse, wir haben bereits DCs aus DC-SIGNtg*Myd88-defizienten und DC-SIGNtg*CARD9-defizienten DCs hergestellt, um unsere Hypothesen weiterzuverfolgen. In den folgenden Studien haben wir uns daher zunächst auf die in vivo Bedeutung von DC-SIGN in der mykobakteriellen Infektion fokussiert. Hierfür wurden Gruppen von transgenen und Kontroll-Mäusen intravenös mit BCG infiziert. Entgegen der Erwartung und Ausgangshypothese (verminderte IL12 Spiegel = verminderte Th1 Antwort = verminderte Pathogenclearance) zeigte der Vergleich der Keimzahlen (Koloniebildende Einheiten / CFU) in Leber und Milz keinen Unterschied zwischen DC-SIGN tg und wt Tieren. Im physiologischeren Infektionsmodell mit krankheitsrelevanten Erregern (humanpathogenen Mtb, Kollaboration S. Ehlers, Borstel) wurden die Keimzahlen in der Lunge nach Aeorsolinfektion verglichen. Auch hier waren keine Unterschiede zwischen den beiden Mausstämmen zu beobachten. Wichtigste Zielgröße war allerdings das Überleben der „humanisierten“ Mtb-infizierten Mäuse im Vergleich mit Kontrollmäusen. Interessanterweise war das Überleben der tg Tiere entgegen unserer Ausgangshypothese sowohl nach Inhalation von 100 KBE/Lunge (Niedrigdosis-Experiment), bzw. 2000 KBE/Lunge (Hochdosis-Experiment) signifikant verbessert. Obwohl wir im Serum werden während der Infektion bezüglich der Zytokinwerte für (IL-10, IL-12 und TNF-alpha) keine deutlichen Unterschiede fanden, zeigten aufgereinigte CD8+ T Zellen aus infizierten tg Mäusen nach in vitro Re-Stimulierung (Ko-Kultur mit Mtb Spiegel als��Peptid-beladenen DCs) reduzierte Interferon-gamma Indikator einer reduzierten Th1 Immunantwort. Auffälligster Unterschied und bisher einzige Erklärung für das verbesserte Überleben der transgenen Tiere waren histologische Befunde: hSIGN Mäuse zeigten reduzierte Gewebepathologie v.a. zu späten Zeitpunkten (Tag 150) der Infektion mit Mtb. Wir haben daher unsere Ausgangshypothese dahingehend korrigiert, dass DC-SIGN als im Primaten hochkonserviertes Molekül möglicherweise nicht primär dem Pathogen nützt (im Sinne der Immunevasion), sondern dass (über zukünftig zu definierende Signalmechanismen) das Überleben des Wirtes mit einer chronischen Infektion bei verringerter Entzündung und Gewebe(immun)pathologie verbessert ist. Eine detaillierte Untersuchung der Effektor-T-Zellantworten in hSIGN und wt Mäusen soll in Zukunft erfolgen. Eine interessante alternative Hypothese, die ebenfalls weiterverfolgt werden soll, ist die DC-SIGN-abhängige Induktion von regulatorischen T Zellen. Für andere CLRs, z.B. DEC-205, wurde nach Antigenaufnahme über dieses Lektin eine Expansion von Tregs beobachtet, die Effektor-T-Zellantworten und damit Immunpathologie unterdrücken können. 806 Forschungsbericht 2008 TWINCORE Gerade bei chronischen Infektionen wie der Tuberkulose könnten induzierte Tregs einen wichtigen Mechanismus der Pathogenpersistenz darstellen. Aufgrund des von uns generierten Mausmodells haben wir möglicherweise einen Paradigmenwechsel eingeleitet, und tatsächlich existieren mittlerweile auch humane Studien zu Polymorphismen, die zeigen, dass erhöhte DC-SIGN Expression mit verbesserter Prognose in der mykobakteriellen Infektion einhergeht. Dieser erste Beweis für die protektive Bedeutung von DC-SIGN in der Verhinderung von Immunpathologie einer der wichtigsten Infektionskrankheiten der Menschheit hat damit möglicherweise wichtige therapeutische Konsequenzen. Experimentelle, auf DCSIGN abzielende Therapieformen (z.B. Blockierung mittels spezifischer Antikörper) müssten gegebenenfalls auch in Abhängigkeit von Ergebnissen aus weiteren zukünftigen Studien hinterfragt werden. Aus unseren Arbeiten ergab sich eine erfolgreiche Antragstellung für ein internationales Konsortium (EUREKA Projekt), im Rahmen dessen Vakzinierungen über DC-SIGN Targeting optimiert werden sollen. Weitere Informationen s. Schaefer, et al. J Immunol 180:6836-6845. Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: DFG Weitere Forschungsprojekte Entwicklung BAC („Bacterial Artificial Chromosome“) transgener Mausmodelle zur Analyse der Rolle von Dendritischen Zellen in der Pathogenese des allergischen Asthmas Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: DFG In vivo Analyse der Rolle von regulatorischen T Zellen (Tregs) in der Tumorgenese: Immunregulation durch spezifische Manipulation von Tregs und Optimierung von Vakzinierungsstrategien Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: DFG A glycomics approach for the treatment of cancer: Role of human DC-SIGN in humanized mouse models. Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: EUREKA TLR „humanisierte“ BAC transgene Mausmodelle: Testung von TLR-Liganden als Adjuvantien Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: Wirtschaft / NIAID Subcontract Rolle von TLRs für Parapocken-Erkennung Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: Wirtschaft Rolle „lymphoider“ DC Subpopulationen in Infektionen Projektleitung: Sparwasser, Tim (Prof. Dr. med.); Förderung: DC-Thera Forschungsbericht 2008 807 TWINCORE Originalpublikationen Edele F, Molenaar R, Gütle D, Dudda JC, Jakob T, Homey B, Mebius R, Hornef M, Martin SF. Cutting edge: instructive role of peripheral tissue cells in the imprinting of T cell homing receptor patterns. J.Immunol. 2008;181(6):3745-3749 Heit A, Gebhardt F, Lahl K, Neuenhahn M, Schmitz F, Anderl F, Wagner H, Sparwasser T, Busch DH, Kastenmüller K. Circumvention of regulatory CD4(+) T cell activity during cross-priming strongly enhances T cell-mediated immunity. Eur. J.Immunol. 2008;38(6):1585-1597 Lembo A, Pelletier M, Iyer R, Timko M, Dudda JC, West TE, Wilson CB, Hajjar AM, Skerrett SJ. Administration of a synthetic TLR4 agonist protects mice from pneumonic tularemia. J.Immunol. 2008;180(11):7574-7581 Martin SF, Dudda JC, Bachtanian E, Lembo A, Liller S, Durr C, Heimesaat MM, Bereswill S, Fejer G, Vassileva R, Jakob T, Freudenberg N, Termeer CC, Johner C, Galanos C, Freudenberg MA. Tolllike receptor and IL-12 signaling control susceptibility to contact hypersensitivity. J.Exp.Med. 2008;205(9):2151-2162 Osorio F, Leibundgut-Landmann S, Lochner M, Lahl K, Sparwasser T, Eberl G, Reis E Sousa C. DC activated via dectin-1 convert Treg into IL-17 producers. Eur.J.Immunol. 2008;38(12):3274-3281 Abstracts 2008 wurden 9 Abstracts publiziert. Master Mayer, Christian: Targeting of regulatory T cells for augmentation of anti-tumour immunity and mechanisms for the generation of induced regulatory T cells. Stipendien Mayer, Christian: Studienstifung des deutschen Volkes: Targeting of regulatory T cells. Schrauf, Catharina: Boehringer Ingelheim PhD Fellowship: Analysis of dendritic cell function in vivo. Weitere Tätigkeiten in der Forschung Sparwasser, Tim (Prof. Dr. med.): Vorstandsmitglied SFB/TR22; Projektkoordinator der Studienstiftung des deutschen Volkes, Lebenswissenschaftliches Kolleg, Fachbereich Immunologie; Gutachter der DFG, Telethon (Italien), Israel Science Foundation, Studienstiftung des deutschen Volkes; Gutachtertätigkeit für die Zeitschriften J. Immunology, Trends in Immunology, Immunology, Immunobiology, Immunology Letters, Human Immunology, Journal of Investigative Dermatology, International Archives of Allergy and Immunology, BioTechniques, Life Sciences, Expert Review of Vaccines, FEMS Immunology & Medical Microbiology. Schaefer M, Reiling N, Fessler C, Stephani J, Taniuchi I, Hatam F, Yildirim AO, Fehrenbach H, Walter K, Ruland J, Wagner H, Ehlers S, Sparwasser T. Decreased pathology and prolonged survival of human DC-SIGN transgenic mice during mycobacterial infection. J.Immunol. 2008;180(10):6836-6845 808 Forschungsbericht 2008