Verbesserung der Tumordiagnostik durch immunhistologische
Werbung

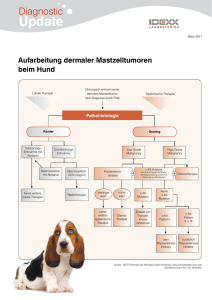
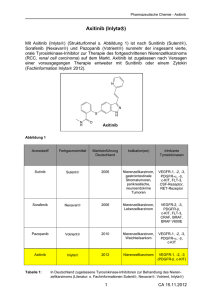
BILDUNG & WISSEN Verbesserung der Tumordiagnostik durch immunhistologische Verfahren Heike Aupperle, Corinna Hohloch, Gerhard Loesenbeck In Kürze Die konventionelle histopathologische Untersuchung kann bei schlecht differenzierten Neoplasien den histogenetischen Ursprung oft nicht sicher identifizieren. Da dieser vor dem Hintergrund der anspruchsvolleren onkologischen Therapien aber zunehmend an Bedeutung gewinnt, werden auch in der Veterinär-Pathologie immer häufiger immunhistologische Methoden zur Tumordifferenzierung eingesetzt. Auch die nähere immunhistologische Charakterisierung einer bereits histopathologisch diagnostizierten Neoplasie (z. B. Mastzelltumor, Lymphom, Karzinom) kann von prognostischer und therapeutischer Bedeutung sein. Ziel dieses Beitrags ist es daher, einen kurzen Überblick über einige häufig verwendete immunhistologische Methoden und Marker in der Veterinär-Pathologie zu geben und Möglichkeiten der Tumorcharakterisierung vorzustellen. Immunhistologie – was ist das? Die Immunhistologie stellt eine Technik dar, bei der mittels spezifischer Antikörper das gesuchte Tumorantigen (z. B. Zytokeratin in Epithelzellen, c-Kit in Mastzellen) im Gewebe detektiert und farblich markiert werden kann. Hierzu werden Antikörper verwendet, die meist für die Humanmedizin entwickelt wurden, bei denen aber eine Kreuzreaktivität mit den Geweben von Hund und Katze vorliegt. Da dies nicht bei jedem humanpathologisch verwendeten Antikörper gegeben ist, stehen für die Veterinär-Pathologie deutlich weniger Marker zur Verfügung, als in der humanmedizinischen Diagnostik (Bahrami et al., 2008) eingesetzt werden. Dies gilt insbesondere für die subtypisierende Differenzierung von Lymphomen/Leukämien und von Karzinomen unterschiedlichen Ursprungs. Nach der üblichen histologischen Untersuchung kann die immunhistologische Untersuchung zielgerichtet direkt an den bereits eingesandten formalinfixierten, paraffin-eingebetteten Gewebeproben erfolgen. Das Verfahren nimmt meist zwei Tage in Anspruch. Bei der Auswertung ist das positive Signal in der spezifischen Lokalisation (in den Tumorzellen und im normalen Gewebe) kritisch zu analysieren. Tumordiagnostik mit Hilfe der Immunhistologie Um eine Aussage hinsichtlich der Prognose und Therapie bei undifferenzierten, anaplastischen Tumoren treffen zu können, ist es hilfreich, den histogenetischen Ursprung (epithelial, mesenchymal, melanozytär, hämatopoetisch) zu ermitteln. Dies kann mit immunhistologischen Methoden gelingen. Beispiele für einige immunhistologische Reaktionsmuster von Tumoren finden Sie in Tabelle 1. Die folgenden Marker werden routinemäßig zur immunhistologischen Tumor- Einleitung Die Therapie von Tumoren in der Kleintiermedizin gewinnt zunehmend an Bedeutung. Für die Planung eines optimalen Behandlungskonzeptes wird eine möglichst detaillierte Tumordiagnostik somit immer wichtiger. Insbesondere bei schlecht differenzierten Tumoren ist der histogenetische Ursprung mittels konventioneller Lichtmikroskopie häufig nicht sicher zu identifizieren. Es können dann immunhistologische Spezialverfahren zur präziseren Differenzierung sog. „Spindelzelltumoren“ oder „Rundzelltumoren“ beitragen, so dass diese sicher z. B. als Neurofibrosarkom, Hämangiosarkom bzw. B-/T-Zell Lymphom, Melanom, Karzinom o. a. diagnostiziert werden können (Bahrami et al., 2008; Dennis et al., 2011). 296 KLEINTIERMEDIZIN 3-2011 Abb. 1: Mammakarzinom einer 10-jährigen Labradorhündin: Mittels immunhistologischem Nachweis von Zytokeratin sind nicht nur die epithelialen Zellen des Mammakarzinoms (Ca), sondern auch das infiltrative ), die intravaskulären Tumorzellemboli (↑) und die Metastasen (M) darstellbar. Wachstum ( ¬ Tab. 1: Typische immunhistologische Expressionsmuster verschiedener Tumoren Zytokeratin Vimentin a-Aktin Desmin Faktor VIII, CD31 Gfap S100 Melan A c-Kit CD3 CD79 Karzinom +++ (+) - - - - (+) - +/- - - Hämangiom/ -sarkom - ++ - - +++ - - - - - - Fibrom/-sarkom - +++ +/- - - - - - - - - Rhabdomyom/ -sarkom - + - ++ - - - - - - - Leiomyom/ -sarkom - + +++ ++ - - -/+ - - - - Neurofibrom/ -sarkom - + - - - ++ -/+ - - - - GIST (Darm) - + -/+ - - - -/+ - +++ - - Melanom - + - - - - + ++ + - - Mastzelltumor - + - - - - - - +++ - - T-Zell Lymphom - + - - - - - - - +++ - B-Zell Lymphom - + - - - - - - - - +++ differenzierung in der Veterinär-Pathologie herangezogen: Der Nachweis von Zytokeratinen ermöglicht die Differenzierung von epithelialen Tumoren (z. B. skirrhöse oder anaplastische Karzinome) sowie die Identifikation auch kleinerer Karzinommetastasen oder Tumorzellemboli in Gefäßen und Lymphknoten (Lee, 2007; Sorenmo et al., 2011) (Abb. 1). Desmin ist ein Intermediärfilament in glatten sowie quergestreiften Muskelzellen und wird zur Abgrenzung von Leiomyosarkomen und Rhabdomyosarkomen zu anderen Spindelzelltumoren genutzt (Dennis et al., 2011). Der Nachweis von a-Aktin, einem Mikrofilament in glatten Muskelzellen, kann Leiomyome/sarkome von Rhabdomyomen/sarkomen unterscheiden (Bahrami et al., 2008; Dennis et al., 2011). Vimentin ist ein Intermediärfilament der mesenchymalen Zellen. Es ist nur in Kombination mit anderen Markern sinnvoll einzusetzen, da auch anaplastische Karzinome positiv reagieren können (Bahrami et al., 2008; Sorenmo et al., 2011). Der Nachweis von S-100 Protein hat ebenfalls eine relativ niedrige Spezifität. Beispiele für S-100 positive Tumore sind maligne Melanome (Ramos-Vara und Miller, 2011) und Schwannome (Bahrami et al., 2008). Gfap (Glial fibrillary acidic protein) ist ein Intermediärfilament, welches im Zellskelett von Astrozyten, Gliazellen und Schwannzellen vorkommt und daher der Identifikation der entsprechenden Tumore dient. Insbesondere können Neurofibrome/sarkome (Abb. 2) von Fibromen/sarkomen oder Hämangiosarkomen unterschieden werden (Bahrami et al., 2008; Dennis et al., 2011). Abb. 2: Immunhistologischer Nachweis der Expression von Gfap in einem Neurofibrom eines Hundes mit wirbeligem Wachstum der Tumorzellen (T), die kollagenen Bindegewebssepten (K) dazwischen sind negativ. KLEINTIERMEDIZIN 3-2011 297 BILDUNG & WISSEN Abb. 3: Gastrointestinaler stromaler Tumor (GIST) am Zäkum eines 12-jährigen Mischlingsrüden: A: HE-Färbung: Spindelzelliger Tumor (T) in der Muskelschicht (M) des Darmes bei normaler Schleimhaut (S); B: Immunhistologischer Nachweis der c-Kit Expression in den Tumorzellen (T), die Muskulatur (M) und die Schleimhaut (S) sind negativ; C: Immunhistologischer Nachweis des Muskelmarkers Desmin in der Lamina muscularis submucosa (m) der Schleimhaut (S) und der Tunica muscularis (M). Von Willebrand Faktor (Faktor VIII) kommt in Gefäßendothelien vor. Sein Nachweis dient der Identifikation von Hämangiosarkomen und ihrer Unterscheidung zu Lymphangiosarkomen und anderen Sarkomen. Auch CD31, ein Marker für Endothelzellen, kann zu dem gleichen Zweck angewendet werden (Folpe und Cooper, 2007). Melan A wird von Melanozyten und steroidproduzierende Zellen exprimiert. Sein Nachweis hilft bei der Diagnose amelanotischer Melanome (Ramos-Vara und Miller, 2011), Hoden- und Ovar- (Bahrami et al., 2008) sowie Nebennierenrindentumoren (Zhang et al., 2003). c-Kit ist ein Tyrosinkinase Rezeptor Typ III, auch CD117 genannt. Er kommt phy- siologischerweise in verschiedenen Geweben (hämatopoetische Stammzellen, epitheliale Gewebe, Melanozyten, Hoden, Ovarien, Teile des ZNS) vor (Morini et al., 2004). Eine c-Kit-Expression wird dementsprechend auch bei den Tumoren, die aus diesen Geweben hervorgehen, nachgewiesen. Der immunhistologische Nachweis von c-Kit wird daher z. B. bei der Identifikation der gastrointestinalen stromalen Tumoren (GIST), die von den neurogenen Cajalzellen ausgehen, eingesetzt, um diese von Leiomyomen/sarkomen zu unterscheiden (Maas et al., 2007; Gillespie et al., 2011) (Abb. 3). Auch bei der Mastzelltumordiagnostik ist c-Kit von Bedeutung (s. unten). Abb. 4: Mammakarzinom einer 8-jährigen Dobermannhündin: Deutliche intrazytoplasmatische Expression von Cox-2 in den Epithelzellen (E) des hochgradig infiltrativ wachsenden Karzinoms 298 KLEINTIERMEDIZIN 3-2011 Prognostischer und therapeutischer Nutzen der immunhistologischen Tumordifferenzierung – Beispiele Bei bestimmten Neoplasien können die immunhistologischen Verfahren zur weiteren Charakterisierung der Tumordifferenzierung beitragen. Die Differenzierung lymphoproliferativer Prozesse in T- bzw. B-Zell-Lymphome ist mittels des Nachweises von CD3 (T-Lymphozyten) und CD79a (B-Lymphozyten) möglich. Dies ist von prognostischer Relevanz (Valli et al., 2011). Die Cyclooxygenase (Cox)-Enzyme sind bei der Prostaglandinbiosynthese von Bedeutung. Während Cox-1 in normalen Geweben vorkommt, wird Cox-2 aus bislang unbekannten Gründen in Entzündungen oder Neoplasien exprimiert (Dore, 2011). Die pro-neoplastische Wirkung von Cox-2 besteht im Wesentlichen in einer Anregung der Tumorzellproliferation, einer Hemmung der Apoptose, einer Induktion der Angiogenese und einer erhöhten Invasivität der Tumorzellen in Verbindung mit einer Hemmung des Immunsystems (Dore, 2011). In Human- und Tiermedizin wurde eine Cox-2 Expression in ca. 50 - 100 % der Mammakarzinome (Abb. 4), Prostatakarzinome, Plattenepithelkarzinome und Übergangsepithelkarzinome der Harnblase/Niere gefunden (Dore, 2011). Nichtsteroidale Antiphlogistika (NSAIDs) blockieren dieses Enzym. Bei einigen Cox2 positiven Tumoren scheint mit diesen Präparaten daher ein antineoplastischer Effekt erzielt zu werden (Wiedemann, 2011). Abb. 5: Immunhistologische Expressionsmuster des c-Kit Rezeptors in kaninen Mastzelltumoren: A: normales, perimembranöses c-Kit Muster 1; B: atypisches, „stippchenartiges“ c-Kit Muster 2; C: atypisches, diffuses c-Kit Muster 3 Die Proliferationsaktivität innerhalb eines Tumors kann durch das Zählen der Mitosen je Gesichtsfeld oder durch den immunhistologischen Nachweis von Ki-67 Antigen bestimmt werden. Ki-67 Antigen ist ein nukleäres Protein, das sehr eng mit den Mitosephasen assoziiert ist. Es wird ausschließlich während der Zellteilung, nicht aber im Rahmen von Reparaturvorgängen exprimiert (Madewell, 2001). Die Bestimmung der Proliferationsaktivität ist z. B. bei der prognostischen Beurteilung von Spindel- (Dennis et al., 2011) und Mastzelltumoren bedeutsam. So konnte gezeigt werden, dass die mediane Überlebenszeit bei Mastzelltumoren mit mehr als 23 Ki-67 Antigen positiven Zellen/1 cm2 unter 24 Monaten liegt (Webster et al., 2007). Eine Besonderheit bei den Mastzelltumoren ist, dass unterschiedliche c-Kit Expressionsmuster mittels Immunhistologie dargestellt werden können (da Costa et al., 2007). Immunhistologisch ist die c-Kit Expression in normalen Mastzellen als perimembranöses Muster 1 erkennbar. In einem Teil der Mastzelltumore kann man zwei vom Normalbild abweichende pathologische Expressionsmuster beobachten (Abb. 5): c-Kit Muster 2 ist gekennzeichnet durch eine stippchenartige Akkumulation im perinukleären Bereich, der vermutlich dem Golgi-Apparat entspricht. Als c-Kit Muster 3 wird ein Bild bezeichnet, bei dem eine diffuse Anfärbung des Zytoplasmas der Mastzellen auftritt (da Costa et al., 2007). Aus der Literatur ist bekannt, dass es eine Korrelation des histologischen Grades mit dem c-Kit Expressionsmuster gibt (Preziosi et al., 2004). Es wurde gezeigt, dass der Nachweis eines atypischen c-Kit Expressionsmusters mit einer schlechteren Prognose einhergeht: c-Kit 1 Mortalität 14,3 %, c-Kit 2 Mortalität 39,5 %, c-Kit 3 Mortalität 38,5 % (Thompson et al., 2011). Daher wird die immunhistologische Charakterisierung des c-Kit Rezeptors und der Ki-67 Antigen Expression zur präzisierenden Einschätzung der Prognose von Mastzelltumoren eingesetzt, die histologisch als low-grade Mastzelltumoren nach Kiupel et al. (2011) eingestuft werden (früher Grad I und Grad II nach Patnaik et al., 1984). Grenzen der immunhistologischen Tumordiagnostik Die Immunhistologie ist eine hochspezifische Technik, um bestimmte Strukturen im Gewebeschnitt zu detektieren. Trotzdem gibt es Einschränkungen bezüglich der Nachweisbarkeit der Antigene und der Auswertbarkeit des Reaktionsmusters: Einige Antigene zerfallen im unfixierten Gewebe, so dass es zu falsch negativen Ergebnissen kommen kann, wenn der Tumor nach der Exzision zu lange unfixiert bleibt oder unzureichend fixiert (große Probe) wurde. Aber auch zu lange Fixationszeiten in Formalin (länger als 10 Tage) können zu einem Verlust der immunhistologischen Reaktionsfähigkeit des Gewebes führen. In anaplastischen Tumoren wird in Einzelfällen eine atypische oder fehlende Expression festgestellt, da auf Grund der schlechten Differenzierung auch die gewebetypischen Charakteristika bzw. Expressionsmuster möglicherweise verloren gehen. In diesen Fällen kann die Diagnose trotz der immunhistologischen Untersuchungen unklar bleiben (Bahrami et al., 2008). Schlussfolgerungen Der Einsatz immunhistologischer Verfahren in der Tumorpathologie ermöglicht die präzisere Diagnose und Charakterisierung von Neoplasien bei den Haustieren und kann einen Beitrag zur prognostischen Einschätzung und dem therapeutischen Vorgehen leisten. Unter Berücksichtigung der großen Fortschritte in der VeterinärOnkologie wird die Bedeutung dieser Techniken in den nächsten Jahren wahrscheinlich weiter zunehmen und zusätzliche Marker für den spezifischen Einsatz beim Tier etabliert werden. Literaturhinweise 1. Bahrami, A., L. D. Truong, J. Y. Ro (2008): Undifferentiated Tumor. True identity by immunohistochemistry. Arch Pathol Lab Med 132, 326-348. 2. Da Costa, R. M., E. Matos, A. Rema, C. Lopes, M. A. Pires, F. Gärtner (2011): CD117 immunoexpression in canine mast cell tumours: correlations with pathological variables and proliferation markers. BMC Vet Res 3, 19-26. 3. Dennis, M. M., K. D. McSporran, N. J. Bacon, F. Y. Schulman, R. A. Foster, B. E. Powers (2011): Prognostic factors for cutaneous and subcutaneous soft tissue sarcomas in dogs. Vet Pathol 48, 73-84. 4. Dore, M. (2011): Cyclooxygenase-2 Expression in animal cancer. Vet Pathol 48, 254-265. 5. Folpe, A. L., K. Cooper (2007): Best practices in diagnostic immunohistochemistry. Pleomorphic cutaneous spindle cell tumors. Arch Pathol Lab Med 131, 15171524. 6. Gillespie, V., K. Baer, J. Farrelly, D. Craft, R. Luong (2011): Canine gastrointestinal stromal tumors: Immunohistochemical expression of cd34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. Vet Pathol 48, 283-291. 7. Kiupel, M., J. D. Webster, K. L. Bailey, S. Best, J. Delay, C. J. Detrisac, S. D. Fitzgerald, D. Gamble, P. E. Ginn, M. H. Goldschmidt, M. J. Hendrick, E. W. Howerth, E. B. Janowitz, I. Langohr, S. D. Lenz, T. P. Lipsomb, M. A. Miller, W. Misdorp, S. Moroff, T. P. Mullaney, I. Neyens, D. O’Toole, J. Ramos-Vara, T. J. Scase, F. Y. Schulman, D. Sledge, R. C. Smedley, K. Smith, P. W. Snyder, E. Southorn, N. L. Stedman, B. A. Steficek, P. KLEINTIERMEDIZIN 3-2011 299 BILDUNG & WISSEN C. Stromberg, V. E. Valli, S. E. Weisbrode, J. Yager, J. Heller, R. Miller (2011): Proposal of a 2-Tier histologic grading system for canine cutaneous mast cell tumours for more accurate ly predict biological behaviour. Vet Pathol 48, 147-155. 8. Lee, A. H. S. (2007): The histological diagnosis of metastases to the breast from extramammary malignancies. J. Clin Pathol 60, 1333-1341. 9. Maas, C. P., H. J. G. Ter Haar, I. van der Gaag, J. Kirpenstein (2007): Reclassification of small intestinal and caecal smooth muscle tumours in 72 dogs: Clinical, histologic, and immunohistochemical evaluation. Vet Surg 36, 302-313. 10. Madewell, B. R. (2001): Cellular proliferation in tumours: a review of methods, interpretation, and clinical applications. J Vet Intern Med 15, 334-340. 11. Morini, M., G. Bettini, R. Preziosi, L. Mandrioli (2004): c-Kit gebe product (CD117) immunoreactivity in canine and feline paraffin sections. J Histochem Cytochem 52, 705-708. 12. Patnaik, A. K., W. J. Ehler, E. G. MacEwen (1984): Canine cutaneous mast cell tumor: Morphologic grading and survival time in 83 dogs. Vet Pathol 21, 469-474. 13. Preziosi, R., M. Morini, G. Sarli (2004): Expression of the KIT protein (CD117) in primary cutaneous mast 299 /a KLEINTIERMEDIZIN 3-2011 cell tumours of the dog. J Vet Diagn Invest 16, 554-561. 14. Ramos-Vara, J. A., M. A. Miller (2011): Immunohistochemical idenfication of canine melanocytic neoplasms with antibodies to melanocytic neoplasms with antibodies to melanocytic PNL2 and tyrosinase: comparison with melan A. Vet Pathol 48, 443-450. 15. Sorenmo, K. U., R. Rasotto, V. Zappulli, M. H. Goldschmidt (2011): Developement, anatomy, histology, lymphatic drainage, clinical features, and cell differentiation markers of canine mammary gland neoplasms. Vet Pathol 48, 85-97. 16. Thompson, J. J., J. A. Yager, S. J. Best, D. L. Pearl, B. L. Coomber, R. N. Torres, M. Kiupel, R. A. Foster (2011): Canine subcutaneous mast cell tumours: cellular proliferation and KIT expression as prognostic indices. Vet Pathol 48, 169-181. 17. Webster, J. D., V. Yuzbasiyan-Gurkan, R. A. Miller, J. B. Kaneene, M. Kiupel (2007): Cellular proliferation in canine cutaneous mast cell tumours: Associations with c-Kit and ist role in prognostication. Vet Pathol 44, 298-308. 18. Valli, V. E., M. San Myint, A. Barthel, D. Bienzle, J. Caswell, F. Colbatzky, A. Durham, E. J. Ehrhart, Y. Johnson, C. Jones, M. Kiupel, P. Labelle, S. Lester, M. Miller, P. Moore, S. Moroff, P. Roccabianca, J. Ramos- Vara, A. Ross, T. Scase, H., Tvedten and W. Vernau (2011): Classification of Canine Malignant Lymphomas According to the World Health Organization Criteria. Vet Pathol 48, 198-211. 19. Wiedemann, C. (2011): Nichtsteroidale Antipholgistika in der Krebstherapie beim Hund – eine Literaturübersicht. Kleintierkonkret 14, 3-6. 20. Zhang, P. J., E. M. Genega, J. E. Tomaszewski, T. L. Pasha, A. A. LiVolsi (2003): The role of calretinin, inhibin, mealn A, bcl-2, and c-Kit in differentiating adrenal cortical and medullary tumours: an immunohistochemical study. Mod Pathol 16, 591-597. Korrespondenzadressen PD Dr. Heike Aupperle, Corinna Hohloch, Dr. Gerhard Lösenbeck, Laboklin GmbH & Co KG, Steubenstr. 4, 97688 Bad Kissingen, [email protected]