Axitinib (Inlyta®)
Werbung
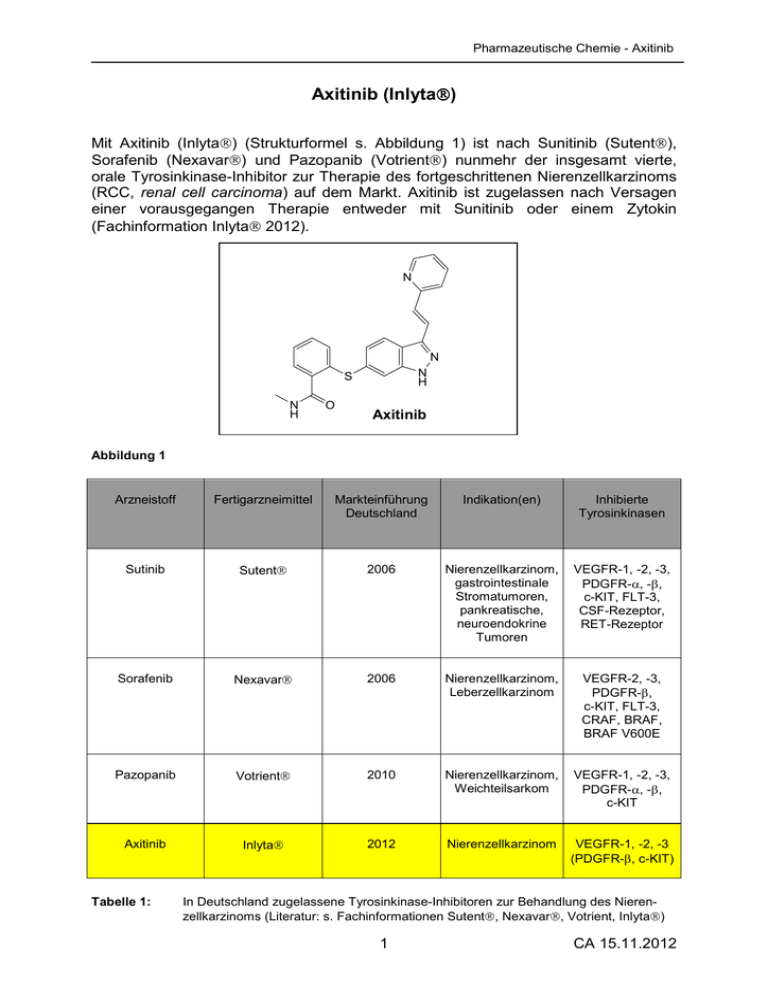
Pharmazeutische Chemie - Axitinib Axitinib (Inlyta ) Mit Axitinib (Inlyta) (Strukturformel s. Abbildung 1) ist nach Sunitinib (Sutent), Sorafenib (Nexavar) und Pazopanib (Votrient) nunmehr der insgesamt vierte, orale Tyrosinkinase-Inhibitor zur Therapie des fortgeschrittenen Nierenzellkarzinoms (RCC, renal cell carcinoma) auf dem Markt. Axitinib ist zugelassen nach Versagen einer vorausgegangen Therapie entweder mit Sunitinib oder einem Zytokin (Fachinformation Inlyta 2012). N N N H S N H O Axitinib Abbildung 1 Arzneistoff Fertigarzneimittel Markteinführung Deutschland Indikation(en) Inhibierte Tyrosinkinasen Sutinib Sutent 2006 Nierenzellkarzinom, gastrointestinale Stromatumoren, pankreatische, neuroendokrine Tumoren VEGFR-1, -2, -3, PDGFR-α, -β, c-KIT, FLT-3, CSF-Rezeptor, RET-Rezeptor Sorafenib Nexavar 2006 Nierenzellkarzinom, Leberzellkarzinom VEGFR-2, -3, PDGFR-β, c-KIT, FLT-3, CRAF, BRAF, BRAF V600E Pazopanib Votrient 2010 Nierenzellkarzinom, Weichteilsarkom VEGFR-1, -2, -3, PDGFR-α, -β, c-KIT Axitinib Inlyta 2012 Nierenzellkarzinom VEGFR-1, -2, -3 (PDGFR-β, c-KIT) Tabelle 1: In Deutschland zugelassene Tyrosinkinase-Inhibitoren zur Behandlung des Nierenzellkarzinoms (Literatur: s. Fachinformationen Sutent, Nexavar, Votrient, Inlyta) 1 CA 15.11.2012 Pharmazeutische Chemie - Axitinib Das wachsende Verständnis der zugrundeliegenden molekularen Biologie beim Nierenzellkarzinom und die Erfahrungen mit den bisher zugelassenen TyrosinkinaseInhibitoren, haben die vaskulären endothelialen Wachstumsfaktor-Rezeptoren (VEGF-Rezeptoren) als wirkungsvolles Target bei dieser Erkrankung etabliert, und die VEGF-Signalkaskade scheint für die Tumor-Angiogenese insbesondere auch beim RCC von primärer Bedeutung zu sein (Rini 2009, Heng et al. 2010, Cho und Chung 2012). Die VEGF-Familie besteht aus fünf miteinander verwandten Proteinen (VEGF-A, VEGF-B, VEGF-C, VEGF-D und PLGF (placental growth factor). Die Signalweiterleitung erfolgt durch die Bindung dieser fünf Wachstumsfaktoren an drei verschiedenen Rezeptor-Tyrosinkinasen (VEGF-1-, VEGF-2-, VEGF-3-Rezeptor). Die Hemmung der VEGF-Signalkaskade muss dabei nicht unbedingt intrazellulär mittels Tyrosinkinase-Inhibitoren erfolgen. Mit Bevacizumab (Avastin) ist beispielsweise ein monoklonaler Antikörper in der Therapie des RCC etabliert, der an VEGF-A bindet („Anti-VEGF-A-Antikörper“) und damit die Bindung an die VEGFRezeptoren unterbindet. Daneben sind auch Antikörper entwickelt worden, die an die extrazelluläre Domäne der VEGF-Rezeptoren binden und so die Signalweiterleitung verhindern (z.B. IMC-1C11) (Bhargava und Robinson 2011). Sutinib, Sorafenib und Pazopanib sind sogenannte Multityrosinkinase-Hemmer, die neben den VEGF-Rezeptoren auch noch weitere Kinasen hemmen (Tabelle 1). Insbesondere hinsichtlich des Nebenwirkungsprofils kann ein selektiver VEGFInhibitor sicherlich Verbesserungen mit sich bringen. Axitinib ist ein solcher (relativ) selektiver, potenter Inhibitor von VEGF-1-, VEGF-2und VEGF-3-Rezeptoren im niedrig-nanomolaren Bereich und demzufolge sicherlich eine Innovation. Gegenüber dem PDGF-Rezeptor β und c-KIT weist Axitinb eine ca. 8-fach niedrigere inhibitorische Aktivität auf, gegenüber anderen Kinasen (z.B. EGF, RET) zeigt es kaum Aktivitäten (Hu-Lowe et al. 2008, Kania 2009). Ausgangspunkt für die Entwicklung des Axitinibs war ein strukturbasiertes Wirkstoffdesign (siehe Kania 2009: Structure-based design and characetrization of axitinib) (Abbildung 2). Als erste Leitstruktur wurde ein Pyrazol mit zwei identischen Styryl-Substituenten ausgewählt. Der Pyrazol-Ring bindet dabei in der Adeninbindenden Region der Kinase. Die langen Styryl-Substituenten mit den sp2hybridisierten C-Atomen erlauben verschiedene Konformationen. Um ein rigideres Molekül zu erhalten, wurden anhand möglicher Konformere des Pyrazols, die sich aus der Rotation um die Bindung direkt am Heterozyklus ergeben, 6-substituierte bzw. 7-substituierte 1H-Indazol-Derivate entwickelt. Damit war das Grundgerüst des Axitinibs zur Verankerung in der Adenin-bindenden Region sowie der GelenkDomäne gegeben. Die an Position 7 substituierten Indazole zeigten sich als wenig potent, während sich die 6-substituierten Indazole als aussichtsreiche Kandidaten für eine weitergehende Strukturoptimierung erwiesen. Gleichzeitig wurde eine Serie von 3-substituierten Indazolen untersucht, wobei wieder Styryl-Substituenten ausprobiert wurden. Unter Einbeziehung aller Ergebnisse wurde anschließend erstmals eine Serie von 3,6-disubstituierten Indazolen entwickelt. Axitinib ist ein solches 3,6disubstituiertes Indazol. An Position 3 befindet sich ein 2-Pyridylvinyl-Substituent. Substituenten am aromatischen Ring wie etwa beim Ausgangs-Pyrazol (1) mit einer Hydroxyl-und einer Methoxy-Gruppe sind nicht nötig, was im Hinblick auf eine mögliche, metabolische Instabilität insbesondere einer Hydroxyl-Gruppe von Vorteil ist. Der Austausch des Styryls durch ein 2-Pyridyl-vinyl ermöglicht bessere 2 CA 15.11.2012 Pharmazeutische Chemie - Axitinib Wechselwirkungen mit dem Solvent Wasser. An Position 6 des Axitinibs verbindet nun ein Thioether den Indazol-Heterozyklus mit einem N-Methylbenzamid. O OH O OH N N N H N H O O HO HO Pyrazol 3 3 N2 N2 O 6 1N 6 7 7 H 1N H O HO HO 6-substituierte Indazole 7-substituierte Indazole Styryl-Substituent 3 R N2 O 6 7 1N H HO 3,6-disubstituierte Indazole N 2-Pyridylvinyl-Substituent Benzamid E 3 S N H 6 N H N Axitinib O Thioether Abbildung 2: Entwicklung des Axitinibs nach Kania 2009 3 CA 15.11.2012 Pharmazeutische Chemie - Axitinib Literatur: Bhargava, P. und Robinson, M.O. Curr Oncol Rep 2011, 13, 103 Cho, I.C. und Chung, J. Korean J Urol 2012, 53, 217 Fachinformation Inlyta 2012 Pfizer Limited Fachinformation Nexavar 2012 Bayer Pharma AG Fachinformation Sutent 2012 Pfizer Llimited Fachinformation Votrient 2012 Glaxo Group Limited Heng, D.Y. et al. Ther Adv Med Oncol 2010, 2, 39 Hu-Lowe, D.D. et al. Clin Cancer Res 2008, 14, 7272 Kania, R.S. in Kinase Inhibitor Drugs 2009 Eds. Li und Stafford, John Wiley & Sons, Inc., Hoboken, NJ, USA, pp 167 Rini, B.I. Cancer 2009, 115(10 Suppl), 2306 4 CA 15.11.2012











