PAPAGEMO
Werbung

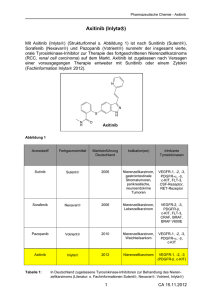
PAPAGEMO TITEL DER STUDIE A phase II clinical trial of pazopanib alone and pazopanib plus gemcitabine in relapsed or metastatic soft tissue sarcoma. “Eine Phase II Studie zur Prüfung der Wirksamkeit von pazopanib gegenüber Pazopanib plus Gemcitabine bei Patienten mit Rezidiv oder metastsiertem Weichteilsearkom. STUDIENZIELE Primäres Studienziel: • Progressionsfreies Überleben (PFS) nach 12 Wochen. Sekundäre Studienziele: • Gesamtüberleben (OS) • Ansprechrate (SD, PR, CR) • Zeit bis zur Progression (TTP) • Toxizität (CTCAE, version 4.0) • Lebensqualität (QoL) THERAPIESCHEMA Dies ist eine 1:1 randomisierte, prospektive Phase II Studie zur Prüfung der Wirksamkeit von Pazopanib allein gegenüber einer Therapie mit Pazopanib plus Gemcitabine bei Patienten mit rezidiviertem oder metastasiertem Sarkom. Arm A: Pazopanib 800mg/d p.o. plus Gemcitabine 1000mg/m (d1,8) i.v., q3w Arm B: Pazopanib 800mg/d p.o. WESENTLICHE EINUND AUSSCHLUSSKRITERIEN Wesentliche Einschlusskriterien: • > 18 Jahre • histologisch oder zytologisch gesicherte Diagnose eines Weichteilsarkoms • mindestens 1 vorangegangene Antrazyklin- oder Ifosfamid-haltige Chemotherapie eine Therapie mit beiden Substanzen. • ECOG 0-2 • Lebenserwartung > 3 Monate • Mindestens 1 messbare Läsion nach RECIST (v1.1) • Adäquate Organfunktion • Wesentliche Ausschlusskriterien: • Folgende Subtypen: • Chondrosarkom • Ewing Sarkom oder PNET • Osteosarkom • Dermatofibrosarcoma protuberans • GIST • Inflammatorisches myofibroblastisches Sarkom • Malignes Mesotheliom • Gemischter mesodermaler Tumor des Uterus