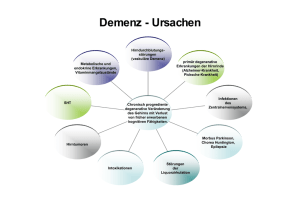
AnnaLinsDissertation
Werbung

Aus der Psychiatrischen und Psychotherapeutischen Klinik des Universitätsklinikums Erlangen Friedrich-Alexander-Universität Erlangen-Nürnberg Leiter: Prof. Dr. med. Johannes Kornhuber Diagnostischer Wert der Verteilung der regionalen Hirnperfusion im SPECT bei verschiedenen Demenzformen mittels reduktionistischer Analyse prinzipieller Komponenten Inaugural-Dissertation zur Erlangung der Doktorwürde der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg vorgelegt von Anna Lins aus Erlangen II Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Prof. Dr. med. Dr. h.c. Jürgen Schüttler Referent: Prof. Dr. med. Johannes Kornhuber Koreferent: Prof. Dr. med. Markus Weih Tag der mündlichen Prüfung: 03.09.2013 III Für meine Eltern IV Inhaltsverzeichnis 1 Zusammenfassung _________________________________ 1 1.1 Hintergrund und Ziele......................................................................................... 1 1.2 Material und Methoden ...................................................................................... 1 1.3 Ergebnisse ......................................................................................................... 1 1.4 Schlussfolgerung ............................................................................................... 2 2 Abstract __________________________________________ 3 2.1 Background and Goals....................................................................................... 3 2.2 Material and Methods......................................................................................... 3 2.3 Results .............................................................................................................. 3 2.4 Conclusion ......................................................................................................... 3 3 Hintergrund und Ziele ______________________________ 5 3.1 Zielsetzung ........................................................................................................ 7 3.2 Demenzen ......................................................................................................... 9 3.3 3.2.1 Mild Cognitive Impairment (MCI) ...........................................................12 3.2.2 Alzheimerdemenz .................................................................................15 3.2.3 Nicht-Alzheimerdemenzen ....................................................................18 3.2.4 Memory-Kliniken ...................................................................................21 3.2.5 Diagnostik der Demenz.........................................................................24 3.2.6 Therapie ...............................................................................................28 Erläuterung zu den verwendeten Computing-Verfahren.....................................31 4 Material und Methoden ____________________________ 33 4.1 Datenerhebung .................................................................................................33 4.2 Preprocessing ...................................................................................................33 4.3 Zusammenstellung des Trainingsdatensatzes ...................................................35 4.4 Definition von Regions of Interest (ROIs) ...........................................................38 4.5 Hauptkomponentenanalyse – PCA....................................................................39 V 4.6 4.7 Multiple Discriminant Analysis ...........................................................................39 4.6.1 Gaussian Mixture Model .......................................................................40 4.6.2 Robustheitsanalyse ..............................................................................40 Zusammenstellung der Testgruppe ...................................................................40 5 Ergebnisse ______________________________________ 42 5.1 5.2 Training ............................................................................................................42 5.1.1 Epidemiologie .......................................................................................42 5.1.2 Diskriminant-Ebene ..............................................................................45 Testdatensätze .................................................................................................50 5.2.1 Epidemiologie .......................................................................................50 5.2.2 Diskriminant-Ebene ..............................................................................52 6 Diskussion ______________________________________ 55 7 Schlussfolgerung _________________________________ 60 8 Literatur _________________________________________ VI 9 Danksagung _____________________________________ IX 10 Eidesstattliche Erklärung __________________________ X 1 1 Zusammenfassung 1.1 Hintergrund und Ziele Dementielle Syndrome stellen sowohl in Industrienationen als auch in Schwellenländern eine wachsende Herausforderung für Gesellschaft und Gesundheitssysteme dar. Aufgrund der zunehmenden Prävalenz verschiedener Formen von Altersdemenz, bedingt durch die stetig steigende Lebenserwartung, wächst der Bedarf an kurativen ebenso wie an diagnostischen Verfahren. Diese Arbeit befasst sich mit einem Computing-Verfahren, welches langfristig dabei helfen soll, verschiedene Formen von Demenz anhand von Perfusions-SPECT-Aufnahmen des Gehirns zuverlässig voneinander zu differenzieren. 1.2 Material und Methoden Für das Training und zur Testung des Programms wurden die SPECT-Aufnahmen von Patienten der Gedächtnissprechstunde der Psychiatrischen und Psychotherapeutischen Klinik des Universitätsklinikums Erlangen verwendet, die sich zwischen 2000 und 2010 dort in Behandlung befanden. Alle Aufnahmen wurden zunächst in eine Form gebracht, die den Vergleich untereinander erlaubte. Mit Hilfe der Hauptkomponentenanalyse und durch die Definition sogenannter Regions of Interest (ROIs) wurde dann der immense Datensatz soweit reduziert, dass eine Analyse möglich wurde. Die eigentliche Zuordnung zu den diagnostischen Untergruppen Alzheimerdemenz, frontotemporale Demenz und Kontrollen erfolgte mittels Multiple Discriminant Analysis. In einem ersten Schritt wurde das Programm an ausgewählten, besonders typischen Fällen für die entsprechenden Pathologien trainiert, um in einem zweiten Schritt an einer größeren Gruppe getestet zu werden. 1.3 Ergebnisse In der Klassifizierung der Testfälle wurden eine Sensitivität von 73,1% und eine Spezifität von 77,2% erreicht. In den meisten Fällen wurden damit die Datensätze wie erwartet klassifiziert. Dies entspricht den in vergleichbaren Studien erreichten Ergebnissen. 2 1.4 Schlussfolgerung Das in dieser Arbeit vorgestellte Verfahren zeigte eine verhältnismäßig hohe diagnostische Sicherheit in der Zuordnung bestimmter charakteristischer Pathologien in der SPECT-Bildgebung zum jeweils korrespondierenden klinischen Syndrom. Derzeit sind überlagernde Krankheitsbilder und altersbedingte, unspezifische Veränderungen der Hirnperfusion noch ein wesentliches Hindernis bei der korrekten Auswertung der Aufnahmen durch das Programm. Durch Verbesserungen in der Mustererkennung und im Trainingsprozess des Programms könnte hier aller Wahrscheinlichkeit nach Abhilfe geschaffen werden. Ein praktischer Einsatz im klinischen Alltag zur Unterstützung des diagnostischen Prozesses ist damit unter bestimmten Voraussetzungen vorstellbar. 3 2 Abstract 2.1 Background and Goals Dementia has become an increasing challenge for societies and healthcare systems in industrialised nations as well as in developing countries. Due to the increasing prevalence of different forms of senile dementia, brought about by a constantly rising life expectancy, the need for curative as well as for diagnostic tools is growing. This thesis studies a computational method which in the long run is supposed to help to differentiate various forms of dementia on the basis of perfusion-SPECT images of the brain. 2.2 Material and Methods The training and the testing of the method was conducted on SPECT images of patients of the memory-clinic of the Psychiatric and Psychotherapeutic Department of the University Hospital of Erlangen, who were in treatment between the years of 2000 and 2010. All images were first preprocessed to allow the comparison among each other. By means of principal component analysis and the definition of so called regions of interest (ROIs) the enormous dataset was reduced to a manageable form. The actual classification into the diagnostic groups of Alzheimer’s dementia, frontotemporal dementia and controls was accomplished using multiple discriminant analysis. First the method was trained on a group of preselected, particularly characteristic cases of the respective pathology and then tested on a larger set of cases. 2.3 Results The classification of the test cases yielded a sensitivity of 73.1% and a specificity of 77.2%. Most cases were thus classified as expected. This is consistent with the data obtained in similar studies. 2.4 Conclusion The method presented in this work shows a relatively high diagnostic certitude in the classification of certain characteristic pathologies in SPECT-imaging to the respective clinical syndrome. Presently, overlapping diseases and unspecific alterations in the brain perfusion caused by age are still substantial obstacles to the correct analysis 4 by the programme. Improvements in pattern recognition and in the training process of the method could probably help overcome these obstacles. Thus, under certain conditions a use in clinical routine practice is imaginable. 5 3 Hintergrund und Ziele Demenzen gehören heute weltweit zu den häufigsten neurodegenerativen Erkrankungen im Alter. Die gesamtgesellschaftliche Bedeutung dementieller Erkrankungen nimmt in Industrienationen wie in Schwellenländern zu, da aufgrund der steigenden Lebenserwartung allgemein auch die Prävalenz altersbedingter Erkrankungen zunimmt. Nach epidemiologischen Studien lebten im Jahr 2001 weltweit 24,3 Millionen Menschen mit Demenz. Für das Jahr 2020 wird nach aktueller Studienlage eine Zahl von 42,3 Millionen Betroffenen prognostiziert, was etwa einer Verdopplung innerhalb von 20 Jahren entspricht. Untersuchungen zufolge ist davon auszugehen, dass der Trend anhält. Das hieße, dass die Zahl sich bis zum Jahr 2040 erneut annähernd verdoppeln wird auf geschätzte 81,1 Millionen Demenzpatienten (Ferri 2005). Insbesondere Länder, die heute als Schwellen- und Entwicklungsländer gelten, wie ein Großteil der afrikanischen Staaten, Indien, Brasilien und China, müssen mit einer massiven Zunahme der Zahl der Demenzkranken rechnen. Es ist davon auszugehen, dass 2040 in China und den Staaten des Westpazifikraumes dreimal so viele Menschen mit einer Form von Demenz leben werden wie in Westeuropa (Ferri 2005). Abb 1 Zahl der Menschen mit Demenz in Industrienationen (unterer Balkenabschnitt) und Entwicklungsländern (oberer Balkenabschnitt) [Ferri 2005] 6 Verschiedene Faktoren, die großen Einfluss auf die errechneten Quoten haben, können nicht verlässlich vorausgesagt werden und bilden damit potentielle Fehlerquellen. So gehen die Prognosen beispielsweise von einer über die Jahre gleich bleibenden Inzidenz dementieller Erkrankungen in den einzelnen Weltregionen aus. Therapeutische Entwicklungen der Gegenwart oder kommender Jahrzehnte, die eine Reduzierung von Schweregrad, Inzidenz oder Prävalenz bewirken könnten, lassen sich jedoch noch nicht abschätzen. Die Aussagen der zitierten Untersuchung sind damit nur unter Vorbehalt gültig, stellen aber auf Basis derzeitiger Erkenntnisse die bestmögliche Voraussage in Bezug auf die epidemiologische Entwicklung der Demenzen dar. Dennoch kommt bereits heute einer möglichst akkuraten, schnellen und präzisen Diagnostik und Differentialdiagnose der Demenzen eine wichtige Rolle zu, um die Patienten rasch einer Therapie zuzuführen. 7 3.1 Zielsetzung Obwohl es für die häufigsten Formen der Altersdemenz, vor allem der Alzheimerdemenz, bis heute keine ursächlichen Therapieansätze gibt, ist eine frühe und genaue Diagnose der zugrunde liegenden Ursachen bei einem dementiellen Syndrom wichtig für die symptomatische Behandlung. Fortschritte bei Bildgebungsverfahren und im Bereich biologischer Marker in Blut und Liquor erlauben heute in vielen Fällen eine bessere Einordnung des jeweils vorliegenden klinischen Syndroms. Mit der Weiterentwicklung funktioneller Bildgebungsverfahren wie der Perfusions-SPECT (Single Photon Emission Computed Tomography) und FDG-PET (Positronen EmissionsTomographie mit Fluordesoxyglucose) oder neuerdings dem Amyloid-PET hat die Demenz-Forschung in den letzten Jahren einen wesentlichen Schritt in Richtung einer in-vivo Diagnostik insbesondere von Alzheimerdemenz vollzogen (Weih 2010). Die vorliegende Arbeit beschäftigt sich mit der Demenzdiagnostik im SPECT mit Hilfe automatisierter Computerverfahren. Das verwendete Programm soll langfristig in der Lage sein, durch die automatische Analyse von SPECT-Aufnahmen der Patienten verschiedene Formen von Demenz frühzeitig zu erkennen und zu diagnostizieren. Computergestützte Verfahren haben in den letzten Jahren in der Medizin allgemein stark an Bedeutung gewonnen. Insbesondere aus dem Bereich der radiologischen Diagnostik sind solche Technologien nicht mehr wegzudenken. Alltägliche Untersuchungsmethoden wie CT, MRT, Szintigraphie oder Sonographie sind ohne die rechnergestützte Rekonstruktion der Bilddaten nicht vorstellbar. Auch das SPECTVerfahren verwendet entsprechende Algorithmen. Die daraus resultierende dreidimensionale Darstellung ermöglicht es dem erfahrenen Kliniker, charakteristische Abweichungen des Durchblutungsmusters von der Norm zu erkennen und auf dieser Basis eine Diagnose zu stellen. Die dreidimensionale Darstellung der Hirnperfusion bietet damit beispielsweise eine wertvolle Informationsquelle in der Diagnostik und Differentialdiagnose neuropsychiatrischer Syndrome. Entzündliche und degenerative Prozesse lassen sich dadurch ebenso voneinander abgrenzen wie verschiedene Formen der Altersdemenz und vaskuläre Ausfallsmuster. In diesem Zusammenhang liegt der Gedanke nahe, dass der Rechner nicht nur in der Rekonstruktion der Bilder sondern auch zu deren Analyse einen wertvollen Beitrag leisten könnte. 8 Das ideale Programm würde also nicht nur die Bilddaten in eine für den Arzt interpretierbare Form bringen sondern selbständig als Expertensystem eine Diagnose vorschlagen. Wäre das Programm in der Lage, bereits kleinste pathologische Veränderungen zu erkennen, wäre der Nutzen insbesondere bei der Früherkennung von Krankheiten enorm und brächte auch logistisch-organisatorische Vorteile mit sich. Die Entwicklung eines solchen Computerverfahrens steht im Mittelpunkt der vorliegenden Arbeit. Durch Anwendung der Hauptkomponentenanalyse ist es dem besprochenen Programm möglich, die komplexen Strukturen des menschlichen Gehirns auf einfache Parameter zu reduzieren, die den Vergleich verschiedener Gehirne untereinander bzw. mit einem Standardgehirn erlauben. Mit Hilfe eines Pools ausgewählter, besonders charakteristischer pathologischer Befunde wurde das Verfahren zunächst trainiert, um die Identifikation der typischen Muster der verschiedenen Demenzformen durch das Programm zu ermöglichen. Das auf diese Weise kalibrierte Verfahren wurde anschließend mit einer größeren Gruppe gemischter Bilddatensätze getestet, um die Zuverlässigkeit der durch das Programm vorgeschlagenen diagnostischen Einordnungen zu überprüfen. 9 3.2 Demenzen Die aktuelle internationale Klassifikation der Krankheiten und verwandter Gesundheitsprobleme (ICD-10) der WHO definiert den Begriff Demenz unter der Codierung F00 bis F03 wie folgt: Demenz (F00-F03) ist ein Syndrom als Folge einer meist chronischen oder fortschreitenden Krankheit des Gehirns mit Störung vieler höherer kortikaler Funktionen, einschließlich Gedächtnis, Denken, Orientierung, Auffassung, Rechnen, Lernfähigkeit, Sprache und Urteilsvermögen. Das Bewusstsein ist nicht getrübt. Die kognitiven Beeinträchtigungen werden gewöhnlich von Veränderungen der emotionalen Kontrolle, des Sozialverhaltens oder der Motivation begleitet, gelegentlich treten diese auch eher auf. Dieses Syndrom kommt bei Alzheimer-Krankheit, bei zerebrovaskulären Störungen und bei anderen Zustandsbildern vor, die primär oder sekundär das Gehirn betreffen. (DIMDI) Im Gegensatz zu vielen anderen organischen Erkrankungen des Gehirns, insbesondere viraler oder bakterieller Genese, bleiben bei der Demenz das Bewusstsein und die Funktion der Sinne definitionsgemäß von der Krankheit unbeeinflusst. Um die Diagnose einer Demenz nach ICD-10 stellen zu können, müssen die beschriebenen Symptome zudem über einen Zeitraum von mindestens sechs Monaten bestehen, was die Demenz von Delirien und weiteren vorübergehenden Beeinträchtigungen von Mnestik und kognitiven Fähigkeiten im Rahmen akuter Erkrankungen trennt. Es gibt jedoch auch Demenzen mit einem kürzeren Verlauf, wie zum Beispiel die Creutzfeldt-Jakob-Krankheit, die jedoch im Folgenden nicht berücksichtigt werden. Der schleichende Verlust grundlegender Fähigkeiten ist prägend für den Krankheitsverlauf. Häufig manifestiert sich ein dementielles Syndrom zunächst in einer Beeinträchtigung des Kurzzeitgedächtnisses bevor es sich sukzessive auch auf andere wichtige kognitive Fähigkeiten auswirkt. Das Gefühl, langsam „vergesslich“ zu werden, kann für die Betroffenen sehr belastend und schambesetzt sein. Häufig versuchen Betroffene, die zunehmende Einschränkung ihrer geistigen Leistungsfähigkeit vor ihrem Umfeld geheim zu halten. Viele Patienten meiden Situationen, in denen ihre Defizite auffallen könnten und ziehen sich zurück. Der soziale Rückzug führt zu einem weiteren Verlust an Stimuli, was wiederum eine raschere Progression des geistigen Abbaus zur Folge haben kann. Mit dem Fortschreiten der dementiellen Entwicklung fällt es den Betroffenen immer schwerer, sich im Alltag zurechtzufin- 10 den. Besonders in späteren Stadien der Demenz kann die Bewältigung auch einfacher Aufgaben die Betroffenen so überfordern, dass sie auf die Hilfe anderer angewiesen sind. Hinzu kommen Persönlichkeitsveränderungen, die eine Demenz häufig begleiten. Besonders die frontotemporalen Demenzen sind von einem veränderten Interaktionsverhalten charakterisiert, das vor allem für den Betroffenen nahestehende Personen belastend sein kann. Dabei ist zu berücksichtigen, dass Bildungshintergrund und prämorbides Intelligenzniveau eine große Rolle bei der Manifestation eines dementiellen Syndroms spielen. So ist es einem Menschen mit überdurchschnittlicher Intelligenz länger möglich, kognitive Einbußen zu kompensieren, so dass das wahre Ausmaß der bereits vorliegenden Einschränkungen dem Umfeld unter Umständen lange verborgen bleibt. Diese Leistung wird erklärt durch das Konzept der Reservekapazität des Gehirns. Unter Reservekapazität versteht man die Fähigkeit des Gehirns, durch Krankheiten oder Alter bedingte Ausfälle so zu kompensieren, dass sich klinisch lange keine oder nur geringe Auswirkungen zeigen, die dem wahren Ausmaß der pathologischen Prozesse nicht entsprechen (Forstmeier 2009). Je größer die Reservekapazität einer Person ist, desto größer müssen die Schäden an den neuronalen Netzwerken des Großhirns sein, bevor sich ein klinischer Befund manifestiert. Erst wenn die Verluste eine bestimmte, individuell unterschiedliche Demenzschwelle überschreiten, wird der Betroffene ein Demenzsyndrom entwickeln. (Beyreuther 2002, S. 10) Zwei Faktoren sind entscheidend für diese Ausgleichsleistung. Einerseits die individuellen prämorbiden strukturellen Gegebenheiten des Gehirns wie die Anzahl der Neurone und die Funktionalität der neuronalen Netze, andererseits der Trainingszustand des Gehirns. Je besser die intellektuellen Fähigkeiten geübt und je regelmäßiger sie abgerufen werden, desto stabiler sind die zugrundeliegenden neuronalen Netzwerke. Hier liegt der Vergleich mit einem Computer nahe, bei dem die Kombination aus zuverlässiger Hardware und leistungsstarker Software entscheidend für die Rechenleistung ist. Ein Mensch, der einen hohen Bildungsabschluss erreicht hat und einer anspruchsvollen beruflichen Tätigkeit nachgeht, entwickelt dadurch stabilere neuronale Netze als ein Gleichaltriger mit einem niedrigen Bildungsniveau und einem monotonen, intellektuell nicht stimulierenden Arbeitsumfeld. 11 Im Umkehrschluss hat ein Mensch mit hoher Ausgangsintelligenz, der in den gängigen Demenztests auffällig abschneidet, bereits ausgeprägte Verluste erlitten, selbst wenn der Test nicht deutlich pathologisch ausfällt. Standardisierte Demenztests wie der Mini Mental Status-Test bilden meist nur den unteren Bereich des Leistungsspektrums ab, da sie sich auf sehr simple Fragen beschränken, die für eine Person mit einer beginnenden kognitiven Störung und verhältnismäßig hohem Intelligenzniveau noch gut zu bewältigen sind. (Beyreuther 2002, S. 11) Hier ist die Beurteilung der Progredienz von entscheidender Bedeutung. Verlaufstests und die Fremdanamnese bei Ehepartnern und Angehörigen können Aufschluss darüber geben, wie individuelle Leistungseinbußen zu bewerten sind. Dasselbe gilt bei Patienten mit durchschnittlichem oder niedrigem kognitiven Ausgangsniveau: ein unterdurchschnittliches Abschneiden in einem kognitiven Leistungstest muss hier nicht zwangsläufig auf eine beginnende Demenz hindeuten sondern kann die Folge physiologischer Alterungsprozesse sein. In jedem Fall müssen intellektuelles Ausgangsniveau und Progredienz der Symptome berücksichtigt werden. Bei der Definition des Demenz-Begriffs steht der fortschreitende Verlust kognitiver Funktionen im Vordergrund. Ein Abbau geistiger Leistungsfähigkeit ist jedoch bis zu einem gewissen Grad auch ein Bestandteil des normalen physiologischen Alterungsprozesses. Inwieweit eine dementielle Entwicklung die zwangsläufige Endstrecke des normalen Alterungsvorgangs des zentralen Nervensystems ist, ist noch Gegenstand von Diskussion und Forschung. Demnach ist die Progressionsgeschwindigkeit des Abbaus geistiger Leistungsfähigkeit von Person zu Person unterschiedlich, je nachdem in welcher Umgebung sie sich befindet. Einige Menschen würden also bereits in einem verhältnismäßig jungen Lebensalter erkranken, während andere den Zeitpunkt nicht mehr erleben, an dem sie an einer Demenz erkrankt wären. Diese Hypothese setzt voraus, dass große interindividuelle Unterschiede in Bezug auf die Aktivität der Alterungsprozesse im Zentralnervensystem bestehen. Darüber hinaus ist, wie schon beschrieben, das intellektuelle Ausgangniveau von Mensch zu Mensch verschieden. Eine Person mit einer durchschnittlichen Intelligenz erreicht schon bei geringeren kognitiven Verlusten die Schwelle zur Entwicklung einer Demenz als ein Mensch mit einem hohen kognitiven Ausgangsniveau. (Beyreuther 2002, S. 9–10) Spezielle pathologische Befunde, wie zum Beispiel das charakteristische Muster krankhafter Amyloid- oder Neurofibrillenablagerungen bei Alzheimerdemenz, spre- 12 chen jedoch eher für die Einstufung dementieller Syndrome als Ergebnis einer spezifischen zugrundeliegenden Pathologie (genauere Pathophysiologie im Abschnitt 3.2.2). Demnach muss auch bei vorliegenden Risikofaktoren, wie zum Beispiel einem vorgealterten Organismus, immer auch ein auslösendes Moment hinzutreten, welches die Ausprägung einer Demenz bewirkt. Das können einerseits klassische Demenzkrankheiten wie die Alzheimerdemenz sein, aber auch Schädel-HirnTraumata oder Infektionen. Das hohe Lebensalter bei der Erstmanifestation einer Demenz ließe sich dadurch erklären, dass die zugrundeliegenden pathologischen Prozesse Jahrzehnte andauern, bevor sie sich im Organismus manifestieren und als dementielles Syndrom nach außen sichtbar werden. So haben beispielsweise Menschen mit einer besonderen Vulnerabilität, wie es heute für Träger des Apolipoprotein-E4-Allels als erwiesen gilt (Drzezga 2009), ein erhöhtes Risiko, an der sporadischen, alters-assoziierten Alzheimerdemenz zu erkranken. Die Zeit bleibt jedoch auch in diesen Fällen ein entscheidender Faktor, da die auf ApoE4 basierende Pathologie Jahrzehnte braucht, um sichtbare Effekte im Organismus zu bewirken. Demnach wäre ein frühes präventives Eingreifen zur Unterbrechung der pathologischen Abläufe bereits im jüngeren Lebensalter sinnvoll. Inwiefern Frühprävention, insbesondere bei Trägern des ApoE4-Allels, die Wahrscheinlichkeit des Auftretens von Demenzen im späteren Lebensalter beeinflusst, ist derzeit Gegenstand der Forschung. 3.2.1 Mild Cognitive Impairment (MCI) Der Begriff der leichten kognitiven Störung oder mild cognitive impairment (MCI), hat in den letzten Jahren in der Demenzforschung zunehmend an Bedeutung gewonnen. Das zugrundeliegende Konzept geht davon aus, dass es im Spektrum der geistigen Alterungsprozesse einen Übergangsbereich zwischen normaler mentaler Alterung und manifester Alzheimerdemenz gibt. Die ICD-10-Klassifikation definiert im Abschnitt F06.7 die leichte kognitive Störung als 13 Eine Störung, die charakterisiert ist durch Gedächtnisstörungen, Lernschwierigkeiten und die verminderte Fähigkeit, sich längere Zeit auf eine Aufgabe zu konzentrieren. Oft besteht ein Gefühl geistiger Ermüdung bei dem Versuch, Aufgaben zu lösen. Objektiv erfolgreiches Lernen wird subjektiv als schwierig empfunden. Keines dieser Symptome ist so schwerwiegend, dass die Diagnose einer Demenz (F00-F03) oder eines Delirs (F05.-) gestellt werden kann. […] (DIMDI) Im Falle einer leichten kognitiven Störung besteht also ausdrücklich noch keine manifeste Demenz bei meist erhaltener Alltagsfähigkeit. Zunehmend wird von „prodromaler“ Alzheimerdemenz gesprochen. Der Fokus der Definition nach ICD-10 liegt vielmehr auf den subjektiv empfundenen Einschränkungen der geistigen Leistungsfähigkeit, die der Betroffene erlebt. Insbesondere das Lernen und Behalten neuer Inhalte wird für den Betroffenen zum Problem. Die Abnahme der Gedächtnisleistung ist verglichen mit dem Altersdurchschnitt größer, allerdings wiederum nicht so gravierend, dass sie zu relevanten Einschränkungen in der Bewältigung der Alltagsaufgaben führen würden (Gauthier 2006). Dennoch ist die MCI dem Verständnis nach eine pathologische Variante des Alterns, gehört also bereits nicht mehr zum normalen Verlauf der altersbedingten Veränderungen in Wahrnehmung und Kognition (Petersen 2004). In der praktischen Anwendung des Begriffs ergeben sich jedoch einige Probleme. Da die milde kognitive Störung wie bereits angedeutet den Übergangsbereich zwischen altersentsprechender Entwicklung und beginnender Demenz beschreibt, stellt sich die Frage nach der genauen Abgrenzung der einzelnen Entitäten. Lange stand in Zweifel, ob es sich überhaupt um ein eigenständiges Störungsbild handelt, heute ist das Konzept einer geringgradigen Störung der kognitiven Fähigkeiten als Vorstufe einer Demenz in der Fachwelt jedoch weitgehend akzeptiert (Petersen 2004). Die International Working Group on MCI hat drei allgemeine Konsensus-Kriterien erarbeitet, die für die Diagnose einer leichten kognitiven Störung erfüllt sein sollten: Der Patient ist erstens weder normal noch dement im Sinne eines dementiellen Syndroms nach ICD-10 oder DSM-IV. Zweitens gibt es Hinweise für einen Abbau geistiger Leistungsfähigkeit, der entweder mittels objektiver Testung nachgewiesen oder durch Dritte bestätigt werden kann. Drittens bleiben die Fähigkeiten zur Bewältigung des Alltags und komplexe instrumentelle Fertigkeiten intakt oder sind nur minimal 14 eingeschränkt (Winblad 2004). Unschärfe in der Abgrenzung zwischen normalen Alterungsprozessen, MCI und beginnender Demenz besteht damit nach wie vor, ein erster Schritt zur Vereinheitlichung der Diagnosekriterien ist jedoch erreicht. Der Stellenwert von MCI als Prodromalstadium einer Alzheimerdemenz ist derzeit Gegenstand intensiver Forschung. Es gilt dabei als sicher, dass Patienten, bei denen die Diagnose einer Alzheimerdemenz gestellt wird, schon Jahre vorher Einschränkungen in ihrer geistigen Leistungsfähigkeit zeigen. Diese betreffen verschiedene kognitive Bereiche wie das episodische Gedächtnis, exekutive Funktionen, Aufmerksamkeit, Auffassungsvermögen und Raumwahrnehmung (Bäckman 2004). Die aktuelle Studienlage deutet darauf hin, dass im Umkehrschluss das Risiko an einer Alzheimerdemenz zu erkranken steigt, wenn bereits eine leichte kognitive Störung vorliegt (Petersen 2004). Dabei haben sich neben dem episodischen Gedächtnis vor allem die Domänen Auffassung und exekutive Funktionen als bedeutend für das Herausfiltern gefährdeter Patienten aus dem Testkollektiv erwiesen. Die Tatsache, dass eben diese drei Domänen auch im normalen Alterungsprozess mit am stärksten betroffen sind, unterstützt die These, dass der Übergang von normaler Alterung über MCI bis zu einer manifesten Demenz ein Kontinuum darstellt (Bäckman 2004). Die Forschung der letzten Jahre hat gezeigt, dass nicht jede Form von MCI zwangsläufig in eine Demenz vom Alzheimertyp übergeht. Um die weitere Entwicklung des jeweils betrachteten Prozesses besser vorhersagen zu können, wurde das Konzept um mehrere Subkategorien erweitert. Zunächst wird zwischen MCI mit und ohne Gedächtnisstörungen unterschieden. Basierend auf dem oben beschriebenen DomänenPrinzip wird danach weiter differenziert, ob eine einzelne oder mehrere Domänen betroffen sind. Damit ergeben sich insgesamt vier Untergruppen der leichten kognitiven Störung: MCI mit reiner Gedächtnisstörung, MCI mit Gedächtnisstörung und Beeinträchtigung mindestens einer weiteren Domäne, MCI ohne Gedächtnisstörung mit einer einzelnen betroffenen Domäne und MCI ohne Gedächtnisstörung mit mehreren betroffenen Domänen (Petersen 2008). Die Studienlage zu Epidemiologie und Progress leichter kognitiver Störungen bietet zum Teil sehr unterschiedliche Ergebnisse, was hauptsächlich auf die zwischen den einzelnen Studien stark voneinander abweichenden Einschluss- und Diagnosekriterien zurückzuführen ist. Nach aktuellem Stand der Forschung ist von einer Konversi- 15 onsrate von MCI zu Alzheimerdemenz von 10-15% jährlich auszugehen (Petersen 2008). Einer Studie zufolge liegt die Prävalenz des MCI unter Krankenhauspatienten im Alter von über 65 Jahren bei bis zu 36% (Bickel 2006). Diese Zahlen veranschaulichen den enormen Stellenwert, den eine sichere Diagnose von MCI in der Zukunft haben könnte, denn die Stellung der leichten kognitiven Störung als derzeit frühestes klinisch erfassbares Stadium der Alzheimerdemenz definiert sie als möglichen Angriffspunkt für eine frühe antidementive Therapie. 3.2.2 Alzheimerdemenz Im Jahr 1906 beschrieb der deutsche Neurologe und Psychiater Alois Alzheimer als erster das Syndrom, das später seinen Namen tragen sollte. Bei der fünfzigjährigen Patientin Auguste Deter hatte Alzheimer die Symptome beobachtet, die heute noch als wegweisend für die klinische Diagnose einer Alzheimerdemenz gelten: Auguste Deter litt unter einem rasch fortschreitenden Verlust ihrer kognitiven Fähigkeiten, zunehmender Verwirrtheit und entwickelte zudem wahnhafte Eifersuchtsideen (Eckert 2002). Nach dem Tode der Patientin fünf Jahre später untersuchte Alzheimer ihr Gehirn in München und entdeckte in den neuropathologischen Befunden charakteristische Veränderungen, die heute noch Gültigkeit haben. Bereits in seiner ersten Veröffentlichung im Jahr 1906 beschrieb er neben vaskulären Veränderungen die Bildung von extrazellulären senilen „Drusen“ bzw. Amyloidplaques und intrazellulären Neurofibrillen im Gehirngewebe sowie eine generalisierte Atrophie des Großhirns („Walnussgehirn“). Damit hatte Alzheimer schon damals alle wesentlichen zu der Krankheit gehörigen Symptome und Befunde erfasst (Alzheimer 1906). Da es sich bei Auguste Deter um eine verhältnismäßig junge Patientin handelte, ging man zunächst davon aus, dass es sich bei ihrer Krankheit um eine präsenile Form der Demenz handelte. Erst nach weiteren Fallberichten und ausführlicheren Untersuchungen stellte man fest, dass die von Alzheimer beschriebene Neuropathologie auch und vor allem bei älteren Patienten mit Demenz auftrat. Heute unterscheidet man eine präsenile Form der Alzheimerdemenz mit einem Krankheitsbeginn vor dem 65. Lebensjahr (F00.0) von einer senilen Form mit Krankheitsbeginn nach dem 65. Lebensjahr (F00.1), wobei die senile Form die weitaus häufigere ist. Die Fälle von präseniler Alzheimerdemenz machen einen Anteil an allen Alzheimer-Fällen von unter fünf Prozent aus und treten meist familiär gehäuft auf (Wallesch 2005). Neuro- 16 pathologisch und klinisch werden Unterschiede zwischen den beiden Formen heute verneint. Heute gilt der Morbus Alzheimer als die weltweit häufigste Form der Altersdemenz. In Europa sind derzeit sechzig bis siebzig Prozent der dementiellen Syndrome auf die Alzheimer-Krankheit zurückzuführen. Die zweithäufigste Ursache, die Gruppe der vaskulären Demenzen, macht dagegen nur fünfzehn bis zwanzig Prozent der Demenzfälle aus (van der Flier 2005). Die übrigen Fälle verteilen sich auf andere Demenzformen wie die Lewy-Body-Demenz und die frontotemporale Demenz und andere, seltenere Demenzformen. Die überwältigende Mehrheit der Demenzpatienten leidet demnach an Alzheimerdemenz. Das klinische Verlaufsbild der Alzheimerdemenz ist in den über einhundert Jahren seit der Veröffentlichung von Alzheimers Originalarbeit von vielen weiteren Autoren beschrieben worden. Die für die Krankheit als typisch betrachteten neuropsychiatrischen Symptome entsprechen den von Alois Alzheimer ursprünglich beschriebenen Beobachtungen und sind üblicherweise langsam beginnend und fortschreitend. Die Klinik der Alzheimer-Krankheit wird von Verlusten in verschiedenen Bereichen bestimmt. Bereits im Anfangsstadium führt die Erkrankung zu subjektiven, später objektiv überprüfbaren kognitiven Einbußen zunächst milder Ausprägung (milde kognitive Störung/mild cognitive impairment, MCI, vgl. Abschnitt 3.2.1). Diese betreffen unter anderem das Gedächtnis, das Denkvermögen, die Sprache und das räumliche Vorstellungsvermögen (Beyreuther K. 2002). Ebenfalls in früheren Stadien der Erkrankung kommt es zu Veränderungen im Bereich von Psyche und Verhalten. Hierzu zählen beispielsweise Depressionen, Wesensveränderungen und Angstzustände. Auch psychoseähnliche Bilder im Sinne von Wahnideen und Halluzinationen sind möglich. Zum Dritten kommt es bei weiter fortgeschrittenen Verläufen zu Einschränkungen in den Verrichtungen des täglichen Lebens (Activities of Daily Living, ADL). Zunächst können insbesondere komplexere Aufgaben wie der Umgang mit Geld, Hobbies oder die Zubereitung einer Mahlzeit nicht mehr selbständig bewältigt werden, in späteren Stadien werden auch einfache Tätigkeiten wie sich anziehen oder selbständig essen unmöglich (Burns 2002). Auch in der Darstellung der Neuropathologie konnte Alzheimer bereits die für die Krankheit wesentlichen Befunde nachweisen. Die von ihm beschriebenen Ablage- 17 rungen im Gehirn der Erkrankten gelten bis heute als zentraler Bestandteil der pathologischen Zusammenhänge der Alzheimerdemenz. Heute weiß man, dass die vorgefundenen Plaques hauptsächlich aus extrazellulären Ablagerungen krankhaft veränderter β-Amyloid-Proteine bestehen. Dieses Protein ist ein Spaltprodukt eines größeren Vorläuferproteins, des Alzheimer-AmyloidPräkursor-Proteins (APP). Dieses Vorläuferprotein und seine Abbauprodukte kommen auch bei Gesunden vor, hier jedoch überwiegend in der Variante des 40 Aminosäuren langen Aβ40 (Parihar 2004). In den Amyloid-Plaques aus den Gehirnen von Alzheimer-Patienten lässt sich jedoch hauptsächlich das um zwei Aminosäuren längere Aβ42 nachweisen. Dieses in der molekularen Struktur nur leicht veränderte Protein hat gegenüber dem physiologischen Aβ40 dramatisch veränderte Eigenschaften. Die beiden überzähligen Aminosäuren bewirken eine erhöhte Aggregationsneigung und eine größere Resistenz gegen proteolytische Spaltung (Beyreuther K. 2002, S. 99). Diese beiden veränderten Eigenschaften sind es, die die Ablagerung des pathologischen Proteins in senilen Plaques bewirken. Die lichtmikroskopisch nachweisbaren neurofibrillären Bündel oder Tangles liegen im Gegensatz zu den Amyloid-Plaques intrazellulär. Auf molekularer Ebene findet sich als Hauptbestandteil der Tangles das sogenannte Tau-Protein. Tau steht dabei für Tubulin-assoziierte Untereinheit. Dieses mit dem Mikrotubuliapparat der Nervenzelle assoziierte Strukturprotein (auch Mikrotubuli-assoziiertes Protein Tau, MAPT, genannt) trägt unter physiologischen Bedingungen zur Stabilität des Axons und zu physiologischen axonalen Transportprozessen bei (Parihar 2004). Bei Patienten mit Alzheimerdemenz liegt das Tau-Protein in einer hyperphosphorylierten Form vor. Durch die Bindung zusätzlicher Phosphatgruppen oder verminderte Dephosphorylierung verändern sich die Eigenschaften des Strukturproteins. Es verliert die Verbindung zum Axonapparat und wird in das Zellsoma verlagert, wo es zellkernnah zu Tangles aggregiert. Die dadurch bedingte Destabilisierung des Axons führt zunächst zu einer Störung des axonalen Transports und damit schließlich zum Zelluntergang. Diesen durch die Akkumulation der pathologischen Produkte ausgelösten Verlust von Nervenzellen und Synapsen bezeichnet man als neurofibrilläre Degeneration (Beyreuther K. 2002, S. 114). Dieser Prozess führt langfristig zu einer mittels bildgebender Verfahren nachweisbaren gleichmäßigen Schrumpfung des Neocortex, die ebenfalls als typisch für die Alzheimerdemenz gilt. 18 Die neurotoxischen Effekte der pathologischen Proteinablagerungen betreffen in besonderer Weise die cholinergen Bahnen des Vorderhirns, die als essentiell für Lernprozesse, Aufmerksamkeitsfokussierung und Gedächtnis gelten. Besonders der im basalen Vorderhirn liegende Nucleus basalis Meynert (NBM) ist besonders anfällig für die der Alzheimerdemenz zugrundeliegenden Vorgänge (Terry 2003). Das dadurch verursachte cholinerge Defizit im Gehirn von Alzheimer-Patienten ist seit den Siebzigerjahren bekannt und gilt heute, analog zum dopaminergen Defizit beim M. Parkinson, als weitgehend akzeptiertes Erklärungsmodell für einen Teil der mit der Krankheit einhergehenden kognitiven Einschränkungen, insbesondere in späteren Krankheitsstadien (Frölich 2002). Ein Ausgleich des cholinergen Defizits über eine zentrale Hemmung der Acetylcholinesterase ist das Ziel der bisher zugelassenen symptomatischen antidementiven Pharmaka (Terry 2003) (vgl. Abschnitt 3.2.6). 3.2.3 Nicht-Alzheimerdemenzen Die Alzheimer-Erkrankung gilt heute als die bei weitem häufigste Form der Altersdemenz. Mit sechzig bis siebzig Prozent macht sie den größten Anteil aller diagnostizierten Demenzsyndrome aus (vgl. Abschnitt 3.2.2). Obwohl die anderen Demenzformen damit nur einen vergleichsweise kleinen Anteil an der Gesamtheit der Demenzen haben und deshalb im öffentlichen Bewusstsein nicht so präsent sind wie die Alzheimer-Erkrankung, darf man sie in der Betrachtung der globalen Demenzproblematik nicht außer Acht lassen. Als die wichtigste Demenz-Ursache nach der Alzheimer-Erkrankung gelten heute die vaskulären Demenzformen. In dieser heterogenen Gruppe sind alle dementiellen Syndrome zusammengefasst, deren Auslöser Defekte in der zerebralen Blutversorgung sind. Zusammen machen diese Syndrome einen Anteil an allen Demenzen von fünfzehn bis zwanzig Prozent aus (van der Flier 2005). Ein typisches Merkmal, das allen Demenzen mit vaskulärer Genese gemeinsam ist, ist der plötzliche Beginn oder die schubweise Verschlechterung der Symptomatik bei einem Patienten mit typischen kardiovaskulären Risikofaktoren wie Hypertonus, Diabetes, Nikotinabusus und koronarer Herzkrankheit. Im Rahmen von vaskulären Demenzen kann es zwischenzeitlich auch zu Remissionen kommen. Im Gegensatz zum schleichenden, sich progredient verschlechternden Verlauf der Alzheimerdemenz ist diese Entwicklung kennzeichnend für eine vaskuläre Genese und damit differentialdiagnostisch bedeut- 19 sam. Ein weiteres Charakteristikum, das häufig hinzutritt, sind dezente fokalneurologische Ausfälle (Aggarwal 2007). Eine häufige Form der vaskulären Demenz ist die Multiinfarktdemenz. Hierbei kommt es zu multiplen territorialen Infarkten im Bereich des Kortex und/oder Subkortex. Ursachen dafür sind meist Mikroembolien, beispielsweise aufgrund kardialer oder arterio-arterieller Embolien oder seltener vorbestehender Gerinnungsstörungen (Förstl 2009, S. 69). Ein ähnlicher Mechanismus kann zum Verschluss kleinerer Arteriolen im Endstromgebiet führen und sogenannte lakunäre Infarkte auslösen. Als Lakunen werden dabei kleine Infarktzonen bezeichnet, die bevorzugt im Bereich der Stammganglien auftreten. Im Vordergrund stehen hier typischerweise zunächst rein motorische oder rein sensible Ausfälle (pure motor stroke beziehungsweise pure sensory stroke). Zu dementiellen Symptomen kommt es häufig erst dann, wenn mehrere Lakunen konfluieren (status lacunaris) (Aggarwal 2007). In diesem Zusammenhang ist auch das Krankheitsbild des Morbus Binswanger zu nennen, dessen Pathomechanismus ebenfalls auf einer Mikroangiopathie beruht. Die Einordnung des Morbus Binswanger als eigenständiges Krankheitsbild ist zum Teil umstritten, da die Abgrenzung zwischen M. Binswanger und Demenz aufgrund multipler lakunärer Infarkte noch diskutiert wird (Förstl 2009, S. 73). Häufig ist heute die Rede von der subkortikalen arteriosklerotischen Enzephalopathie (SAE). Eine Sonderstellung unter den vaskulären Demenzen nimmt das Krankheitsbild der zerebralen autosomal-dominanten Arteriopathie mit subkortikalen Infarkten und Leukenzephalopathie (CADASIL) ein. Hierbei handelt es sich um eine bevorzugt im jüngeren Lebensalter beginnende Form der Multiinfarktdemenz, der ein autosomaldominant vererbter Gendefekt zugrunde liegt. Mit nur etwa 100 dokumentierten Fällen deutschlandweit gehört CADASIL zu den seltenen Demenzursachen. (Förstl 2009, S. 73). Zu den bedeutendsten Vertretern der Demenzen mit frühem Beginn gehört des Weiteren die frontotemporale Demenz (FTD). Wie der Name schon andeutet, liegt der Hauptfokus der frontotemporalen Demenz im Bereich der Stirn- und Schläfenlappen. Sie gehört damit als Unterkategorie zu den unter dem Begriff frontotemporale Lobärdegeneration (FTLD) zusammengefassten Krankheitsbildern, denen eine umschriebene Neurodegeneration in Frontal- und Temporallappen gemeinsam ist. Das 20 Haupterkrankungsalter liegt zwischen 45 und 65 Jahren, also unter dem der Alzheimerdemenz (Neary 2005). Die FTD wurde früher Morbus Pick genannt. Klinisch imponiert die FTD weniger durch Gedächtnisstörungen als durch Persönlichkeitsveränderungen. Charakteristisch ist dabei ein schleichender Beginn von Veränderungen im Verhalten der Betroffenen. Dies ist oft das erste sichtbare Anzeichen für den Beginn einer FTD. Häufige Phänomene sind Unzuverlässigkeit, verändertes Kontaktverhalten und Abweichung von gesellschaftlichen und gesetzlichen Normen bis hin zu kriminellen Delikten (Snowden 2002). Das deviante Verhalten der Betroffenen bei meist völlig fehlender Krankheitseinsicht macht die Erkrankung besonders für Angehörige und dem Betroffenen Nahestehende zu einer großen Belastung. Eine Demenzform, deren Pathogenese als weitgehend aufgeklärt gilt, ist die Demenz mit Lewy-Bodies (DLB). Bei den namensgebenden Lewy-Bodies oder LewyKörperchen handelt es sich um kleine intrazelluläre Einschlüsse mit hyalinem Kern, die sich an verschiedenen Orten im Gehirn ablagern können. Bei einer vorwiegenden Ablagerung im Bereich der Substantia nigra des Hirnstamms kommt es zu einem Parkinson-Syndrom. Lagern sich die Lewy-Körperchen hingegen im Kortex ab, ist eine dementielle Entwicklung die Folge. Eine Kombination beider Muster kommt ebenfalls vor und führt dann zur sogenannten Parkinson-Demenz. Auch treten im Rahmen der DLB häufig Symptome aus dem Parkinson-Spektrum auf, wie Rigor, kleinschrittiges Gangbild und Hypomimie. Diese Tatsache dokumentiert die enge pathogenetische Verwandtschaft der beiden Krankheitsbilder (Beyreuther. 2002, S. 274–277). Klinische Kennzeichen einer DLB sind neben fortschreitenden kognitiven Defiziten und den bereits erwähnten Parkinson-ähnlichen motorischen Symptomen insbesondere starke Schwankungen in Aufmerksamkeit und Konzentration. Diese Fluktuationen sind tageszeitunabhängig und erfolgen zum Teil schlagartig. Ein weiteres Charakteristikum, das die Demenz mit Lewy-Bodies von anderen Demenzformen unterscheidet, ist das Vorhandensein rezidivierender visueller Halluzinationen. Die beschriebenen Symptome sind differentialdiagnostisch von großer Bedeutung (Beyreuther 2002, S. 278). Der Erkrankung liegt eine pathologische Anreicherung des neuronalen Proteins Alpha-Synnuklein zugrunde. 21 Die Differentialdiagnose der dementiellen Syndrome ist häufig problematisch und wird zusätzlich durch die Tatsache erschwert, dass es neben den klassischen Demenzen auch Mischformen gibt, insbesondere beim älteren Menschen. So ist eine Kombination von Alzheimerdemenz mit vaskulären Demenzformen nicht ungewöhnlich. Ein großes Feld eröffnet sich außerdem bei der Betrachtung der potentiell reversiblen Demenzursachen wie beispielsweise Infektionen, Vitaminmangelzustände oder dem Normaldruckhydrocephalus (NPH). Erkrankungen wie Meningitis, Neurosyphilis, Creutzfeldt-Jakob-Krankheit und andere Infektionskrankheiten sollten im Rahmen der Demenzdiagnostik bedacht und abgeklärt werden. Ebenso ist eine dementielle Entwicklung aufgrund chronischen Alkoholmissbrauchs, z.B. in Form eines Korsakoff-Syndroms oder einer hepatischen Enzephalopathie, in Betracht zu ziehen. Hirnschäden aufgrund von Traumata lassen sich über bildgebende Verfahren nachweisen beziehungsweise ausschließen. Auch eine Pseudodemenz bei einer zugrundeliegenden depressiven Erkrankung sollte als mögliche Ursache nicht außer Acht gelassen werden. Eine umfassende Abklärung mittels CT oder MRT, neuropsychologischer Testung sowie Blut- und Liquor-Analyse ist für die genaue Demenzdiagnostik unabdingbar. Seit 2009 stehen hierfür erstmals Leitlinien auf hohem Niveau zur Verfügung (DGPPN 2009). 3.2.4 Memory-Kliniken Der in Abschnitt 1 bereits beschriebene demographische Wandel und die dadurch bedingte Zunahme von altersbedingten Erkrankungen stellt das medizinische Versorgungssystem vor besondere Herausforderungen. Alle Bereiche der modernen Medizin müssen sich auf eine ältere Patientenklientel einstellen. Dies gilt auch und besonders für den Bereich der Psychiatrie, der mit der Versorgung einer wachsenden Zahl von Patienten mit Demenz und anderen neuropsychiatrischen Syndromen konfrontiert ist (Bickel 2001). Der wachsende Bedarf führte zur Entwicklung spezialisierter psychiatrischer Zentren, die auf die Bedürfnisse älterer Patienten eingerichtet sind. In diesen sogenannten Memory-Kliniken oder Gedächtnissprechstunden liegt der Fokus auf Diagnose und Therapie der psychiatrischen Erkrankungen des älteren Menschen, insbesondere dementieller Syndrome. Das erste spezialisierte Zentrum dieser Art wurde 1983 in London eröffnet, 1985 wurde ein erstes entsprechendes Pilotprojekt in Deutschland 22 an der TU München gegründet. Derzeit gibt es in Deutschland etwa 160 MemoryKliniken (Förstl 2009, S. 312). Das primäre Ziel dieser Einrichtungen ist die Diagnose von dementiellen Syndromen und die Einleitung der weiteren Behandlung des Betroffenen. Zu diesem Zweck verfügen die meisten Memory-Kliniken über ein multiprofessionelles Team aus Psychiatern, Psychologen, Neurologen, Sozialpädagogen und speziell geschultem Pflegepersonal. Memory-Kliniken sind überwiegend in Form von Ambulanzen organisiert; einigen ist ein teilstationärer Bereich angegliedert (Diehl 2003). Der erste Schritt besteht in einer ausführlichen Anamneseerhebung, die meist mit Hilfe eines standardisierten Fragebogens erfolgt. Neben Items wie der medizinischen Vorgeschichte, der bisherigen Medikation, Schulbildung und weiteren biographischen Daten werden die subjektiven Beschwerden des Patienten abgefragt. Zusätzlich wird eine Fremdanamnese bei einer Bezugsperson des Betroffenen erhoben, um die Angaben zu verifizieren und zusätzliche wichtige Fakten in Erfahrung zu bringen. Außerdem erfolgt eine ausführliche neuropsychologische Testung, meist mit Tests aus der CERAD-Batterie (Consortium to Establish a Registry for Alzheimer’s Disease) (Förstl 2009). Zusätzlich werden eine internistische und neurologische Statuserhebung durchgeführt sowie eine Blutentnahme zur Überprüfung von Blutbild, Entzündungsmarkern, Serumchemie, Vitamin-Spiegeln, Infektions-Serologie und Schilddrüsen-Parametern, um potentiell reversible Ursachen für die vermutete dementielle Entwicklung auszuschließen (Diehl 2003). Es folgen weitere Untersuchungen zur Abklärung organischer Ursachen. Eine strukturelle Bildgebung mittels MRT oder CT erfolgt gewöhnlich routinemäßig, eine funktionelle Bildgebung in Form von SPECT oder FDG-PET steht nicht in jeder Memory-Klinik zur Verfügung. Eine Liquoranalyse ist ebenfalls nicht Bestandteil der ersten Routineabklärung, da sie nur unter stationären Bedingungen erfolgen kann. Diese Zusatzuntersuchung steht zur Diskussion, wenn die ersten Befunde Zweifel an der Diagnose offen lassen oder die genaue Differentialdiagnose nicht zu ermitteln ist (Diehl 2003). Die in den Memory-Kliniken am häufigsten gestellte Diagnose ist aufgrund der o.g. Epidemiologie die Alzheimerdemenz, gefolgt von der der leichten kognitiven Stö- 23 rung (MCI) (Förstl 2009, S. 314). Nach der Diagnosestellung folgt ein ausführliches Aufklärungsgespräch, das sich nach dem individuellen Wissensstand und Informationsbedarf des Patienten richtet. Wenn der Patient zustimmt, werden auch die Angehörigen oder nahe Bezugspersonen über das festgestellte Krankheitsbild informiert (Diehl 2003). Je nach Aufbau der jeweiligen Klinik und nach Wunsch des Patienten kann die weitere Behandlung in der Memory-Klinik erfolgen oder durch einen niedergelassenen Facharzt. In jedem Fall unterbreitet die Klinik Therapievorschläge und hält bei Bedarf Adressen zur weiteren Anbindung des Patienten bereit. Das Ausmaß, in dem die einzelnen Kliniken weiterführende Therapien anbieten, ist sehr unterschiedlich. Es hängt zum großen Teil davon ab, welcher Institution die betreffende Memory-Klinik angegliedert ist. Es bestehen deutliche Unterschiede in personeller und apparativer Ausstattung, aber auch in Bezug auf die Ziele, die die verschiedenen Träger mit der Einrichtung einer Gedächtnissprechstunde verfolgen (Aguirreche 2003). So steht in Universitätskliniken die Forschung und damit in erster Linie die Diagnostik von dementiellen Syndromen im Vordergrund. Eine weitere Schwierigkeit für die Patienten stellen die zum Teil monatelangen Wartezeiten dar, die sich durch die große Nachfrage erklären lassen. Der Bedarf an kompetenter diagnostischer Abklärung von Gedächtnisstörungen ist groß und wächst weiter. Die heterogene Struktur der Memory-Kliniken erschwert die Umsetzung einheitlicher Normen. Derzeit gibt es keine verbindlichen Qualitätsstandards für Gedächtnissprechstunden (Aguirreche 2003). Das Kompetenznetzwerk Demenzen (KND), ein eingetragener Verein, in dem sich insgesamt dreizehn spezialisierte Zentren zusammengeschlossen haben, hat es sich zum Ziel gesetzt, bundesweit einheitliche Richtlinien für die Diagnostik von Demenzen zu erarbeiten (Maier 2008). Dennoch lässt sich konstatieren, dass unabhängig davon die Versorgung der Patienten in den Memory-Kliniken im Allgemeinen auf fachlich hohem Niveau erfolgt. Eine Studie von 2005, in der dreißig Kliniken verglichen wurden, kommt zu dem Schluss, dass in den deutschen Gedächtnis-Ambulanzen Diagnostik und Therapie nach aktuellem Stand der Wissenschaft durchgeführt werden (Rainer 2005). 24 Die ausführliche Darstellung von Memory-Kliniken ist im Zusammenhang mit der in der vorliegenden Arbeit behandelten Fragestellung wichtig, da die untersuchte Population die diagnostische Wertigkeit der Untersuchungsverfahren beeinflusst. 3.2.5 Diagnostik der Demenz Eine sorgfältige, umfassende Diagnostik eines dementiellen Syndroms ist für eine sinnvolle Therapieentscheidung zwingend erforderlich. Klinische Erfahrung und die Fortschritte in Molekularbiologie und bildgebenden Verfahren ermöglichen heute die genaue Diagnose schon in frühen Stadien einer Demenz. Die Beobachtung und Evaluation der klinischen Symptome steht nach wie vor an erster Stelle in der Differentialdiagnose einer Demenz. Mit Hilfe standardisierter neuropsychologischer Testungen wie DemTect, Uhrentest und MMST lässt sich orientierend der Schweregrad des Syndroms einschätzen (Eschweiler 2010). Eine ausführliche Eigen- und Fremdanamnese ist ebenfalls unabdingbar für eine bessere Einstufung des Krankheitsbildes. Verlauf und Progredienz der Störung können wichtige Hinweise auf die Ätiologie geben. So spricht beispielsweise ein langsamer, sich graduell verschlechternder Verlauf eher für eine Alzheimerdemenz, wohingegen eine schubweise Verschlechterung mit zwischenzeitlicher Erholung an eine vaskuläre Genese denken lässt (Aggarwal 2007). Begleitende psychiatrische Symptome wie Wesensveränderungen oder persistierende optische Halluzinationen können wegweisend für die Diagnose einer frontotemporalen beziehungsweise einer Demenz mit Lewy-Bodies sein (Snowden 2002), (Beyreuther K. 2002). In vielen Fällen lässt sich auf diese Weise eine recht zuverlässige Verdachtsdiagnose stellen. Zur Verifizierung der Differentialdiagnose und in Fällen, die weniger charakteristische Merkmale zeigen, werden jedoch weitere diagnostische Instrumente benötigt. Ein wichtiger Baustein ist die Liquoranalyse. Neben dem Ausschluss entzündlicher oder neoplastischer Ursachen einer Demenz (vgl. Abschnitt 3.2.3) stehen heute verlässliche Biomarker zur Verfügung, die eine wichtige Rolle bei der Differentialdiagnose der Alzheimerdemenz spielen. Aufgrund der charakteristischen Pathologie mit krankhaften Ablagerungen von Aβ42 und Tau-Protein (vgl. Abschnitt 3.2.2) finden sich auch im Liquor auffällige Protein-Werte. Die anderen wichtigen Demenzformen wie vaskuläre Demenzen, FTD und DLB bieten wegen ihrer anders gearteten Patho- 25 logie keine vergleichbaren Veränderungen der neurochemischen Parameter im Liquor. Bei Patienten mit Alzheimerdemenz lassen sich erhöhte Konzentrationen von TauProtein im Liquor nachweisen. Dabei nimmt sowohl die Gesamtmenge an TauProtein zu als auch der Anteil an hyperphosphoryliertem Tau (Sjögren 2001). Diese gegenüber der normalen Form mit weiteren Phosphat-Resten ausgestattete Form des Proteins gilt als in besonderem Maße an der Pathogenese der Alzheimer-Erkrankung beteiligt (siehe Abschnitt 3.2.2). Die Konzentration des Aβ42-Proteins hingegen liegt bei Patienten mit Alzheimerdemenz signifikant niedriger als bei gesunden Kontrollen (Motter 1995). Dieser Effekt wurde von Motter erstmals 1995 nachgewiesen und wird nach der Bestätigung durch viele weitere voneinander unabhängige Arbeitsgruppen als erwiesen angesehen. Dass die Konzentration des auslösenden Agens bei betroffenen Individuen gegenüber der Norm erniedrigt sein soll, scheint zunächst überraschend. Als Grund dafür wird heute die verstärkte Aggregationsneigung des hydrophoben pathologischen Proteins gesehen, dass dadurch verstärkt ausfällt und nicht mehr als lösliche Form im Liquor nachweisbar ist (Beyreuther K. 2002, S. 99). Zu den wichtigsten diagnostischen Werkzeugen gehören außerdem die strukturellen bildgebenden Verfahren der Computer-Tomographie (CT) und der MagnetresonanzTomographie (MRT). Die Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde (DGPPN) empfiehlt in ihren aktuellen S3-Leitlinien zur Demenzdiagnostik die routinemäßige Durchführung einer craniellen CT oder MRT zum Ausschluss behandelbarer Ursachen und zur diagnostischen Zuordnung einer Demenz. Dabei ist wegen der höheren Sensitivität und der fehlenden Strahlenbelastung die MRT zu bevorzugen (DGPPN 2009). Die strukturelle Bildgebung liefert Informationen über eventuelle vaskuläre Läsionen, generalisierte oder lokale Atrophien oder Neoplasien als mögliche Ursachen einer Demenz. Alle Befunde sind stets gemeinsam mit den klinisch erhobenen Informationen zu bewerten und können so zu einer Sicherung der Differentialdiagnose beitragen. Neben der strukturellen gewinnt auch die funktionelle Bildgebung zunehmend an Bedeutung. Die Verfahren mit dem höchsten Stellenwert sind hier die PositronenEmissions-Tomographie (PET) und die Single Photon Emission Tomography 26 (SPECT). Beide Verfahren dienen einer Darstellung der Perfusion des Gehirns mit Hilfe radioaktiver Tracer. Im Folgenden wird die Durchführung und Funktionsweise der SPECT-Untersuchung der Hirnperfusion näher erläutert. Bei der SPECT-Untersuchung des Gehirns handelt es sich um eine technisch aufwendige Methode, die nur an wenigen spezialisierten Zentren angeboten werden kann. Das Prinzip der Untersuchung besteht in der Messung der von einem Radiopharmakon emittierten Gammastrahlung und beruht damit auf demselben Mechanismus wie die Szintigraphie. Vor Beginn der eigentlichen Untersuchung wird der Patient in einem dunklen, geräuscharmen Umfeld abgeschirmt. Dabei sollte er nach Möglichkeit die Augen geöffnet halten und nicht sprechen (vgl. Leitlinien der Deutschen Gesellschaft für Nuklearmedizin Menzel 1999). Dadurch soll eine Stimulation der visuellen und auditorischen Kortexareale vermieden werden und damit eine Steigerung der Perfusion in den entsprechenden Gebieten. Nach etwa einer Viertelstunde wird dem Patienten über eine Venenverweilkanüle das Radiopharmakon injiziert. Zur Anwendung kommen hier mit dem metastabilen Technetium-Isotop 99mTc gekoppelte Pharmaka, beispielsweise 99mTc-HMPAO (Hexamethylpropylenaminooxim) oder 99mTc-ECD (Ethylcysteinat-Dimer). Diese beiden Tracer sind sehr lipophil und werden daher schnell ins Hirngewebe aufgenommen. Da sie intrazellulär in eine hydrophile Form umgewandelt werden, reichern sie sich in den Zellen an, so dass ihre Konzentration im Gewebe über einen längeren Zeitraum stabil bleibt. Die Aufnahme des Tracers in das Gehirn ist in weniger als fünf Minuten abgeschlossen; bis zu einer halben Stunde nach der Injektion finden jedoch noch Umverteilungsvorgänge statt. Danach bleibt die Tracer-Verteilung im Gehirn für etwa vier Stunden stabil (Kuwert 2008, S. 235). Für die eigentliche Messung wird der Patient in bequemer Rückenlage auf einer Untersuchungsliege positioniert. Der Kopf wird leicht fixiert, um Bewegungsartefakte zu minimieren. Während der Untersuchung rotiert die Gamma-Kamera in vorgegebenen Winkelschritten von 3° um den Kopf des Patienten und misst die beim Zerfall der Tc-Isotope freiwerdende Gamma-Strahlung. Um die bestmögliche Auflösung bei geringstmöglicher Strahlenbelastung zu erreichen, sind modernere Scanner mit mehreren Kameraköpfen ausgestattet. Zusätzlich werden hochauflösende fokussierte Kollimatoren eingesetzt, die im Gegensatz zu konventionellen Parallellochkollimatoren eine höhere Auflösung bei höherer Zählrate ermöglichen (Menzel 1999). Aus den 27 so akquirierten zweidimensionalen Einzelbildern wird im Computer die dreidimensionale Verteilung des Nuklids im Gewebe rekonstruiert (Schicha 2007, S. 73). Eine gängige Darstellungsform ist die dreidimensionale statistische Kartierung nach Minoshima (Kuwert 2008, S. 240). Die mit Hilfe der Gamma-Kamera ermittelte und mittels Computerverfahren dreidimensional dargestellte Tracer-Aufnahme in das Gewebe lässt Rückschlüsse auf die Durchblutung verschiedener Hirnareale zu. Die Anreicherung des Radiopharmakons hängt einerseits von der Extraktionsrate, anderseits von der Durchblutung des betrachteten Areals ab. Da die Extraktionsrate jedoch ihrerseits von der Durchblutung beeinflusst wird, lässt sich der regionale Cerebrale Blutfluss (rCBF) nicht einfach per Dreisatz berechnen sondern kann nur als relative Größe angegeben werden. Charakteristische Veränderungen im rCBF machen die SPECT zu einem wertvollen Instrument in der Differentialdiagnostik dementieller Erkrankungen. So ist beispielsweise eine temporo-parietal betonte Abschwächung des rCBF typisch für das Bild einer Alzheimerdemenz. Dieses Muster korrespondiert mit der für den Morbus Alzheimer typischen Neurodegeneration in den vom Nucleus basalis Meynert ausgehenden Assoziationsfasern. Das Bild der frontotemporalen Demenz in der SPECT zeigt analog dazu eine deutliche Verminderung der Durchblutung frontal und temporal, die die Atrophie der entsprechenden Areale widerspiegelt (Kuwert 2008, S. 248). Die Frage, inwieweit das aufwendige SPECT-Verfahren zu Diagnose und Differentialdiagnose von dementiellen Syndromen beitragen kann, war und ist Gegenstand intensiver Forschung. In einer großangelegten Metastudie von Dougall und Mitarbeitern aus dem Jahr 2004 über insgesamt 48 Einzelstudien zur klinischen Anwendung von SPECT zur Demenzdiagnostik betrug die Sensitivität bzw. Spezifität der SPECT bei der Unterscheidung von Alzheimer-Fällen von gesunden Kontrollen 77,1% bzw. 89,0%. In der Differenzierung zwischen Alzheimerdemenz und anderen Demenzformen wurden entsprechende Werte von 65,7% bzw. 75,9% erreicht (Dougall 2005). 28 3.2.6 Therapie Für keine der häufigsten Demenzursachen -Alzheimerdemenz, frontotemporale Demenz und vaskuläre Demenz- steht heute eine ursächliche Therapie zur Verfügung. Trotz enormer Bemühungen von Forschungsgruppen weltweit, insbesondere zur Behandlung der Alzheimerdemenz, sind die Therapie-Optionen weiterhin begrenzt. In Deutschland sind derzeit nur vier Medikamente zur Behandlung der Alzheimerdemenz zugelassen. Donepezil, Rivastigmin und Galantamin gehören zur Gruppe der Acetylcholinesterase-Hemmer. Sie greifen das Enzym Acetylcholinesterase im synaptischen Spalt an und verzögern so den Abbau des Neurotransmitters Acetylcholin (ACh). Die dadurch erreichte erhöhte ACh-Konzentration im synaptischen Spalt verbessert die neuronale Übertragung und kann zu einem gewissen Grad das durch die Krankheit verursachte cholinerge Defizit im Vorderhirn ausgleichen (siehe Abschnitt 3.2.2). Darauf beruht die Wirkung dieser Antidementiva. Die Behandlung ist jedoch rein symptomatisch; das grundsätzliche Prinzip der neurotoxischen Proteinablagerungen und der dadurch verursachten Neurodegeneration bleibt unbeeinflusst. Die Acetylcholinesterasehemmer sind zur Therapie der leichten bis mittelschweren Alzheimerdemenz zugelassen (DGPPN 2009). Memantine, das vierte in der Alzheimer-Therapie zugelassene Medikament, wirkt über einen Antagonismus am Glutamat-Rezeptor vom NMDA-Typ. Der Wirkmechanismus besteht in einer Hemmung des Effekts der bei neurodegenerativer Demenz pathologisch erhöhten Glutamat-Konzentration (Karow 2007, S. 930). Memantine findet Anwendung bei moderater bis schwerer Alzheimerdemenz und ist zudem für die Parkinsontherapie zugelassen (DGPPN 2009). Da die Ursache der Krankheit unbehandelt bleibt, können alle heute bekannten Antidementiva nur für einen begrenzten Zeitraum das Fortschreiten der Krankheit aufhalten. Aktuellen Studien zufolge verlangsamt die Antidementiva-Therapie den Krankheitsverlauf um etwa ein halbes Jahr (Omerovic 2008). Die Medikation kann jedoch die kognitiven Fähigkeiten der Patienten stabilisieren und damit helfen, deren Alltagsfähigkeiten zu erhalten und die Lebensqualität zu verbessern. Nach einer Meta-Analyse der zum Thema vorliegenden Studien sprach sich die DGPPN in den S3Leitlinien zur Demenz für eine Verwendung der genannten Medikamente aus (DGPPN 2009). Andere Medikamente wie zum Beispiel nicht-steroidale Antiphlo- 29 gistika, Ginkgo-Präparate und Vitamin E, werden von der DGPPN ausdrücklich nicht empfohlen. Dennoch erhalten Schätzungen zufolge in Deutschland nur ca. 25% der AlzheimerKranken entsprechende Medikamente (Weih 2011, S. 202). Diese Tatsache ist vermutlich unter anderem darauf zurückzuführen, dass diese Arzneimittel nur einen moderaten Effekt bei vergleichsweise hohen Kosten zeigen. Das Fehlen wirksamer Arzneimittel gegen dementielle Erkrankungen erhöht den Stellenwert nicht-medikamentöser Therapiekonzepte. Verschiedene Ansätze wie kognitives Training, Ergotherapie oder Kunst- und Musiktherapien werden in vielen auf die Versorgung Demenzkranker spezialisierten Zentren angeboten. Großangelegte Metastudien des IQWiG (Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen) und Reviews der Cochrane Collaboration konnten jedoch allenfalls moderate Effekte der verschiedenen Interventionsverfahren feststellen, so dass die DGPPN in ihren aktuellen S3 Leitlinien die meisten nichtmedikamentösen Verfahren auf den niedrigsten Empfehlungsgrad C einstuft (DGPPN 2009). Zu einigen Verfahren, wie der Tanz- und der Kunsttherapie, konnten aufgrund fehlender aussagekräftiger Studien keine Empfehlungen abgegeben werden. Ursache der allgemein schlechten Studienlage ist meist die schlechte Messbarkeit der Zielgrößen und die Schwierigkeit der Durchführung randomisierter, placebokontrollierter Studien zu den Interventionsverfahren. Ein nicht sicher nachgewiesener Nutzen entspricht in diesem Fall also nicht automatisch einem fehlenden Nutzen. In der praktischen Anwendung in Alten- und Pflegeheimen spielen Verfahren eine besondere Rolle, die auf einer starken Strukturierung des Alltags beruhen. Diese unter dem Begriff Milieu-Therapie zusammengefassten Ansätze verfolgen das Ziel, den Patienten ein stabiles Umfeld zu bieten, in dem sie möglichst wenig mit neuen und überraschenden Eindrücken konfrontiert werden, um Überforderungssituationen zu vermeiden (Staack 2004). Eine verbreitete Methode ist das Realitäts-Orientierungs-Training (ROT). Hintergrund dieses Verfahrens ist der Gedanke, den dementen Patienten so viele Anhaltspunkte und Orientierungshilfen wie möglich an die Hand zu geben, um ihnen die Orientierung im Alltag zu erleichtern. Eine wichtige Rolle spielen dabei Hilfsmittel wie Uhren, Kalender oder Beschriftungen an Türen und Gegenständen (Noll 1992). 30 Diese Hinweise sollen es den Patienten ermöglichen, sich weitgehend ohne Hilfe in ihrem Umfeld zurechtzufinden und so Frustrationserlebnisse und Überforderung zu vermeiden. Ein Review aus dem Jahr 2000 konnte positive Effekte auf kognitive Leistungen der Patienten sowie auf deren Verhalten nachweisen. So ging aggressives Verhalten unter der Therapie signifikant zurück (Spector 2000). Zusätzlich zu allen genannten Therapieansätzen ist es außerdem wichtig, weitere Erkrankungen der älteren, häufig multimorbiden Patienten zu behandeln. Die Behandlung vaskulärer Risikofaktoren wie Hypertonie oder Hypercholesterinämie hat zwar keinen unmittelbaren Effekt auf die kognitive Leistungsfähigkeit, ist aber ein wichtiger Ansatzpunkt zur Prävention weiterer Verschlechterung. Andere Faktoren können die kognitiven Leistungen auch direkt beeinflussen. So kann beispielsweise eine Exsikkose zu Verwirrtheitszuständen und Apathie bei den Patienten führen, bis hin zur potentiell lebensbedrohlichen Extremform des Delirs. Ebenso können Medikamente mit anticholinerger Wirkung (beispielsweise Neuroleptika) einen negativen Effekt auf das ohnehin beeinträchtigte cholinerge System im Frontalhirn haben. Insgesamt bleibt festzuhalten, dass Respekt, Wertschätzung und Anerkennung die Basis jeder erfolgreichen Demenztherapie bilden müssen. Nur wenn der Patient mit seinen Stärken und Schwächen als Individuum anerkannt und behandelt wird, kann die Demenztherapie zur Steigerung der Lebensqualität beitragen. 31 3.3 Erläuterung zu den verwendeten Computing-Verfahren In der medizinischen Forschung und im Rahmen von Neurostudien gewinnen Methoden zur schnellen Verarbeitung großer Datenmengen zunehmend an Bedeutung. Insbesondere bei modernen bildgebenden Verfahren ist das generierte Datenvolumen so immens, dass eine Vereinfachung der Daten für eine sinnvolle Analyse unumgänglich ist. In dieser Arbeit soll auf die Anwendung solcher Methoden bei der Analyse von Gehirnperfusions-SPECT-Bildern eingegangen werden. Hier wird der Stellenwert der Dimensionsreduktion besonders deutlich. Die SPECT-Aufnahme eines einzelnen Gehirns umfasst 226.985 Variablen, das heißt Voxel, in der GanzhirnRegion (Stühler 2011). Der Einsatz multivariater Methoden ermöglicht trotz der enormen Größe eines einzelnen Datensatzes den voxelbasierten Vergleich verschiedener Einzeldatensätze, indem sie statistische Beziehungen zwischen allen Voxeln simultan einbezieht (Merhof 2011). Ein erster Schritt zur Reduktion der betrachteten Daten ist die Konzentration auf die für die Fragestellung relevanten Abschnitte des SPECT-Bildes, sprich des Gehirns. Durch die Definition solcher Regions of Interest (ROI) lassen sich verzerrende und redundante Informationen von vorneherein aus der Analyse ausschließen (vgl. Abschnitt 4.4). Zur weiteren Reduktion des berechneten Datenvolumens werden multivariate Verfahren angewandt. Unter dem Begriff multivariate Verfahren werden in der Statistik verschiedene Analyseverfahren zusammengefasst, die eine simultane Untersuchung aller Variablen ermöglichen. Das Ziel ist eine Vereinfachung des untersuchten Datensatzes. Dazu wird ähnlich einer Kartierung die Zahl der zu analysierenden Variablen reduziert, ohne dass dabei wesentliche Informationen verloren gehen. Diese Einschränkung der Datenmenge wird durch die Redundanz des Datensatzes möglich. Das bedeutet, dass viele der untersuchten Variablen miteinander in Beziehung stehen und sich deshalb eine durch die andere ausdrücken lässt. Will man beispielsweise einen Quader beschreiben, eignen sich dazu die Variablen Länge, Breite und Höhe. Um verschiedene Quader miteinander zu vergleichen, können die drei genannten Größen zum Merkmal Volumen zusammengefasst werden. Diese Vereinfachung bedeutet keinen wesentlichen Informationsverlust, reduziert jedoch die Menge der betrachteten Variablen und erleichtert so den Vergleich. 32 Die Anwendung multivariater Verfahren setzt voraus, dass die untersuchten Variablen miteinander in Beziehung stehen und eine Zusammenhangsstruktur aufweisen. Bei der Aufdeckung der Struktur unterscheidet man zwischen induktiven und explorativen Methoden. Induktive Methoden basieren darauf, dass man eine Zusammenhangsstruktur vorgibt und untersucht, ob die vorliegenden Daten mit der vorgegebenen Struktur zusammenpassen. Im Rahmen eines explorativen Ansatzes wird versucht, die Struktur aus den vorliegenden Daten zu ermitteln. Durch die verschiedenen Verfahren zur Dimensionsreduktion erhält man einen besser handhabbaren Datensatz. Auf dessen Grundlage lassen sich nun die eigentlichen Analysen besser und mit geringerer Verzerrung durchführen. 33 4 Material und Methoden 4.1 Datenerhebung In die Untersuchung wurden Patienten einbezogen, die sich zwischen 2000 und 2010 erstmals in der Gedächtnissprechstunde der Psychiatrischen und Psychotherapeutischen Klinik des Universitätsklinikums Erlangen vorgestellt hatten oder bei denen im Rahmen eines stationären Aufenthalts in dem genannten Zeitraum die Diagnose einer Demenz gestellt worden war. Die diagnostischen Maßnahmen umfassten eine ausführliche neuropsychologische Testung, eine Liquorpunktion und eine SPECTAufnahme des Gehirns. Die Untersuchung der geistigen Leistungsfähigkeit erfolgte jeweils durch erfahrene Psychiater mit Hilfe standardisierter Screening-Tests (MMST und Clock-DrawingTest). Bei unklaren Ergebnissen erfolgte eine weitere neuropsychologische Testung mit Tests aus der CERAD-Batterie. Zusätzlich wurde eine ausführliche Anamnese erhoben. Die dabei aufgenommenen Parameter umfassten die Familienanamnese bezüglich dementieller Erkrankungen, die subjektive Krankheitsdauer vor Erstvorstellung bei einem Arzt, Vorerkrankungen, kardiovaskuläre Risikofaktoren wie Nikotin-Abusus und Hypertonie, Anzahl und Art der regelmäßig eingenommenen Medikamente sowie die Gesamtdauer von Schul- und Berufsausbildung. Die SPECT-Untersuchungen wurden in der neuroradiologischen Abteilung des Universitätsklinikums Erlangen durchgeführt. Für die Untersuchung wurde mit 99mTc markiertes ECD (Ethylcysteinat-Dimer) mit einer Aktivität von 740 MBq injiziert. Nach einer mindestens fünfzehnminütigen Ruhephase erfolgte die Aufnahme mit Hilfe eines Siemens MultiSPECT3 Scanners. Das Sichtfeld der Kamera erfasste dabei das gesamte Groß- und Kleinhirn. Zur genauen Durchführung der SPECT-Untersuchung siehe Abschnitt 3.2.5. 4.2 Preprocessing Die voxelbasierte Analyse verschiedener Bilddatensätze mit Hilfe multivariater Methoden stellt hohe Anforderungen an die Qualität des Gesamtdatensatzes beziehungsweise der einzelnen Bilddatensätze. Um die Analyse der Bilddaten zu ermöglichen, ist es notwendig, die Bilddatensätze in eine möglichst vergleichbare Form zu 34 bringen. Das heißt, alle interindividuellen Unterschiede zwischen den Bilddatensätzen, die nicht in Zusammenhang mit der untersuchten Pathologie stehen und damit keine Relevanz für die Analyse haben, sollen möglichst ausgeglichen werden. Die Gesamtheit der zu diesem Zweck eingesetzten Verfahren wird als Preprocessing bezeichnet. Die Ergebnisse einer multivariaten Analyse hängen stark von der Qualität des zuvor durchgeführten Preprocessing ab. Insbesondere dann, wenn kleinste Veränderungen zwischen den Datensätzen betrachtet werden sollen, ist ein sorgfältiges Preprocessing der Daten unumgänglich (Merhof 2011). Die betrachteten Bilddatensätze variieren in verschiedenen Aspekten, die zum Teil in interindividuellen Unterschieden der untersuchten Probanden, zum Teil in der Aufnahme selbst begründet sind. Für den Ausgleich dieser nicht relevanten Unterschiede stehen mehrere Methoden zur Verfügung, die sich jeweils mit verschiedenen Aspekten der aufgenommenen Bilddaten befassen. Um die Bilddatensätze überhaupt voxelbasiert vergleichen zu können, ist die Abbildung in ein gemeinsames Koordinatensystem notwendig. Damit wird erreicht, dass die Voxel der einzelnen Scans einander genau entsprechen. Das in dieser Arbeit verwendete Referenz-Koordinatensystem basiert auf dem Montreal Neurological Institute single subject brain. Mit Hilfe verschiedener Registrierungs-Methoden wird eine Aufnahme Schritt für Schritt an diese Referenz angepasst. Eine genauere Anpassung erfolgte mittels Affine Registration. Unterschiede in Größe und Form der untersuchten Gehirne können so ausgeglichen werden. Eine weitere notwendige Maßnahme ist die Reduktion des Hintergrundrauschens, das beispielsweise durch Bewegungsartefakte oder anatomische Unterschiede zwischen den Probanden verursacht wird. Hierfür wurde ein Gauß-Filter mit einer Halbwertsbreite von 12 mm eingesetzt. Im letzten Schritt müssen die Intensitätswerte der Datensätze normalisiert werden. Das ist notwendig, weil auch hier deutliche Unterschiede zwischen den Bilddatensätzen bestehen, die, wenn sie nicht korrigiert werden, einen sinnvollen Vergleich unmöglich machen. Gründe für diese Abweichungen sind unter anderem Unterschiede in der injizierten Tracer-Dosis oder verschiedene Geschwindigkeiten im metabolischen Abbau des Tracers. Hierzu wird für jeden Bilddatensatz eine Region innerhalb des Gehirns als Referenzbereich gewählt. Diese Referenzregion soll die Stoffwech- 35 selaktivität in gesundem Gehirngewebe des Probanden abbilden. Damit eignen sich vor allem Bereiche des Gehirns, die in der Regel nicht von dem untersuchten Krankheitsprozess betroffen sind. Alternativ kann zur Normalisierung auch der Mittelwert über das gesamte Gehirn verwendet werden, was bewirken soll, dass das Signal in den gesunden Bereichen das in den pathologisch veränderten ausgleicht. In dieser Arbeit erfolgte die Normalisierung der Intensitätswerte anhand der 25% hellsten Voxel innerhalb der Ganzhirn-Region (Groß- und Kleinhirn). 4.3 Zusammenstellung des Trainingsdatensatzes Um die korrekte Klassifikation unbekannter Einzeldatensätze zu ermöglichen, ist es zunächst nötig, das Verfahren zu trainieren. Das bedeutet, dass eine belastbare Datenmatrix generiert werden muss, auf deren Basis dann die Evaluation weiterer Datensätze erfolgen kann. Bildlich gesprochen kann das Programm, ähnlich wie ein Mensch, nur dann bestimmte Pathologien richtig einordnen, wenn es vorher entsprechend geschult worden ist. In dieser Trainingsphase kommt es weniger darauf an, komplexe Einzelfälle richtig einzuordnen, sondern ein für die jeweilige Erkrankung möglichst spezifisches Grundmuster herauszuarbeiten. Zunächst wurden aus dem beschriebenen Kollektiv geeignete Datensätze für das Training des Verfahrens ausgewählt. Um sicherzustellen, dass nur besonders charakteristische Befunde für die Trainingsphase verwendet wurden, wurden Früh- und Spätstadien der Erkrankungen ausgeschlossen, da in diesen Fällen noch keine ausgeprägten morphologischen Veränderungen zu sehen sind beziehungsweise sich Mischbefunde und unspezifische Veränderungen häufen. Die Eingrenzung erfolgte zunächst über das Ergebnis des Mini-Mental Status-Tests (MMST) der Patienten. Probanden mit einem MMST-Wert von über 26 oder unter 11 Punkten wurden aus dem Trainingsdatensatz ausgeschlossen. 36 Die vorliegenden SPECT-Ergebnisse und Untersuchungsbefunde wurden durch einen erfahrenen Facharzt (M.W.) ausgewertet. Mit Hilfe der ICD-10-Kriterien wurde eine endgültige Diagnose gestellt. Das Patientenkollektiv wurde in folgende Gruppen eingeteilt: 1. nicht-demente Kontrollpatienten 2. Patienten mit milder kognitiver Störung (MCI) mit Verdacht auf beginnende Alzheimerdemenz 3. Patienten mit Alzheimerdemenz 4. Nicht-Alzheimerdemenzen Gruppe 1 wurde dabei aus Patienten zusammengestellt, bei denen aufgrund der Ergebnisse der SPECT- und Labordiagnostik kein Anhalt für einen degenerativen Prozess im Sinne einer Demenz bestand. Hierzu gehörten Patienten mit Pseudodemenz im Rahmen einer Depression und Patienten, die sich wegen subjektiver Gedächtniseinschränkungen in der Gedächtnis-Sprechstunde vorgestellt hatten, bei denen die neuropsychologische Testung und die apparative Diagnostik jedoch keine Hinweise für eine dementielle Entwicklung ergaben. Gruppe 2 wurde für das Training nicht berücksichtigt, da die hier auftretenden Veränderungen in der Bildgebung häufig noch wenig ausgeprägt waren. Daher waren die entsprechenden Datensätze für das Training nicht einsetzbar. In Gruppe 3 wurden Patienten aufgenommen, bei denen sowohl klinisch als auch in der Bildgebung die Diagnose einer manifesten Alzheimerdemenz gestellt worden war. In Gruppe 4 wurden zunächst alle Probanden zusammengefasst, bei denen aufgrund der SPECT-Befunde und klinischen Parameter eine Demenz diagnostiziert worden war, die nicht zum Alzheimer-Spektrum gehörte. Diese Gruppe umfasste damit Demenzen mit Lewy-Bodies, vaskuläre Demenzen und frontotemporale Demenz. Aufgrund der Heterogenität dieser Gruppe ergaben sich sehr gemischte Befunde in der Bildgebung, so dass sich diese Einteilung als nicht praktikabel für die Verwendung im Trainingsdatensatz erwies. Um die betrachteten Fälle von Nicht- Alzheimerdemenz untereinander vergleichbarer zu machen, wurde die Analyse auf 37 Patienten mit frontotemporaler Demenz beschränkt. Individuen mit anderen Demenzformen wurden aus der Untersuchung ausgeschlossen. Somit ergaben sich folgende Gruppen für das Training: 1. Nicht-demente Kontrollpatienten (CTR) 2. Alzheimerdemenz (AD) 3. Frontotemporale Demenz (FTD) Um die Zahl der für das Training verwendbaren Datensätze insbesondere in den Gruppen 2 und 3 zu steigern, erfolgte eine erneute Evaluation der vorliegenden SPECT-Aufnahmen der bisher aufgrund der MMST-Ergebnisse ausgeschlossenen Fälle durch einen erfahrenen Nuklearmediziner (G.P.). Auf diese Weise konnten beide Gruppen um zusätzliche typische Fälle erweitert werden. Alle für die Kontrollgruppe verwendeten SPECT-Bilder wurden ebenfalls nochmals begutachtet. Soweit vorhanden wurde auch die strukturelle Bildgebung ausgewertet um andere zugrundeliegende Pathologien auszuschließen. Die Kontrollgruppe wurde zu den übrigen Gruppen alterskorreliert. Aus der AD- und FTD-Gruppe wurden Patienten unter 55 Jahren ausgeschlossen, um der typischen Altersverteilung bei Alzheimerdemenz gerecht zu werden. In die FTD-Gruppe wurden auch Patienten unter 55 Jahren einbezogen, um der Tatsache Rechnung zu tragen, dass der Erkrankungsgipfel für frontotemporale Demenz in jüngerem Alter liegt. In einem iterativen Prozess wurde der Trainingsdatensatz weiter angepasst. Nach ersten Probeläufen des Trainings wurden die Bilddaten erneut evaluiert. Insbesondere diejenigen Fälle, die sich in den Analysen auffällig verhielten bzw. nicht wie erwartet klassifiziert wurden, wurden ebenfalls G.P. zur Beurteilung vorgelegt. Ohne Kenntnis der vermuteten Diagnose wurden die Bilder erneut unvoreingenommen befundet. Aufnahmen mit schlechter Bildqualität, Bewegungsartefakten und fehlerhaftem Preprocessing konnten auf diese Weise ebenso aus dem Trainingsdatensatz ausgeschlossen werden wie Fälle mit zusätzlichen überlagernden Pathologien und komplexen Mischbefunden. Die aussortierten Fälle wurden jeweils ersetzt, um die Gruppen gleich groß zu erhalten. Dieses Vorgehen wurde solange wiederholt, bis alle 38 aufgrund unspezifischer Veränderungen und mangelnder Bildqualität fehlklassifizierten Probanden ausgeschlossen waren. 4.4 Definition von Regions of Interest (ROIs) Eine Reduktion der verwendeten Daten lässt sich erreichen, indem man sich bei der Analyse auf die Hirnregionen beschränkt, die zur Unterscheidung der betrachteten Pathologien voneinander entscheidend sind. Diese sogenannten Regions of interest (ROIs) sind diejenigen Regionen, in denen besonders krankheitsspezifische Veränderungen auftreten. Die Konzentration auf die ROIs ermöglicht neben einer weiteren Vereinfachung des Datensatzes eine Elimination verzerrender Variablen, die für die eigentliche Klassifikationsanalyse nicht relevant sind. Dies sind zum Beispiel Varianzen im Bereich des Okzipitallappens, die durch eine individuell unterschiedliche Aktivierung visueller Kortexareale der Probanden während der Untersuchung bedingt sind. Auch in anderen Bereichen des Hirnstamms und der Großhirnrinde finden sich interindividuelle Unterschiede, die auf unterschiedlichen Durchblutungsmustern, der Stoffwechsellage des Probanden und anderen Störvariablen beruhen, die für die Klassifikation nicht relevant sind. Zur Definition der ROIs wurde das AAL-Verfahren (Automated Anatomical Labeling) angewandt, ein digitaler Atlas des menschlichen Gehirns, der auf dem Montreal Neurological Institute Single Subject Brain beruht (Tzourio-Mazoyer 2002). Für die mittels AAL definierten Regionen wurden die eigentlichen Analysen durchgeführt und deren Effizienz verglichen. Anhand dieses Kriteriums konnten so die Regionen bewertet werden, inwiefern sie für die Unterscheidung der Klassen relevante Informationen enthalten. ROIs, deren Effizienz als unterdurchschnittlich eingeschätzt wurde, wurden aus der eigentlichen Analyse ausgeschlossen, um so den Einfluss verzerrender Variablen zu minimieren. In das Verfahren einbezogen wurden Gebiete im Bereich des Gyrus cinguli, des Temporal-, Parietal- und Frontallappens (im Einzelnen: Cingulum-Mid/Ant, Temporal-Mid-R, Angular-R, Parietal-Sup und Frontal-Inf-TriL). 39 4.5 Hauptkomponentenanalyse – PCA Zur weiteren Vereinfachung des Datensatzes wurde mit der Hauptkomponentenanalyse ein multivariates Verfahren eingesetzt (vgl. Abschnitt 3.3). Die Hauptkomponentenanalyse oder Principal Component Analysis (PCA) gehört zu den explorativen statistischen Verfahren. Wie oben beschrieben nutzt sie als multivariate Methode die Zusammenhangsstruktur innerhalb eines Datensatzes, um die vorhandenen Bilddaten durch eine Linearkombination von n Hauptkomponenten (Principal Components – PCs) auszudrücken. Dadurch wird eine Dimensionsreduktion des Variablenraumes erreicht. Die erste PC beschreibt dabei den größtmöglichen Anteil an der Varianz des Datensatzes, ausgedrückt in einer einzelnen Komponente. Die folgenden PCs enthalten jeweils einen möglichst großen Anteil an der restlichen Varianz. Die durch die folgenden PCs ausgedrückte Varianz korreliert dabei nicht mehr mit der durch die vorangegangen PCs beschriebenen Varianz. Auf diese Weise sind alle PCs unabhängig voneinander und der reduzierte Variablenraum enthält keine redundante Information mehr. Ist die zugrundeliegende Matrix stabil, reichen meist wenige PCs aus, um mindestens 60% der Gesamtvarianz zu beschreiben. So erhält man eine vereinfachte Definition des Datensatzes, ohne dass es zu einem bedeutenden Informationsverlust kommt. Nach Durchführung des F-Tests wurden in diesem Fall die ersten drei PCs als ausreichend zur Repräsentation der Gesamtvarianz betrachtet. 4.6 Multiple Discriminant Analysis Nach der Aufbereitung der Datensätze im Preprocessing und der Vereinfachung des Gesamtdatensatzes durch die PCA folgte die eigentliche Analyse der Daten. Dieser Schritt erfolgt mittels der Multiple Discriminant Analysis oder MDA. Die MDA ist eine Verallgemeinerung der Fisher Diskriminanten-Analyse (FDA). Im Gegensatz zur FDA ermöglicht sie die Unterscheidung von mehr als zwei Klassen. Im Rahmen der MDA werden die Daten in einen Unterraum mit k Dimensionen projiziert, wobei k der Anzahl der Klassen minus eins entspricht. Die im Fall von drei betrachteten Klassen dabei entstehende Diskriminant-Ebene wird so gewählt, dass der Abstand der Klassen voneinander so groß und der Abstand der Elemente der jeweiligen Klassen untereinander so klein wie möglich ist. Diese als between-class scatter und within-class scatter bezeichneten Größen sind damit ein Maß für die 40 Exaktheit der Trennung der untersuchten Klassen. Im Idealfall werden die Elemente einer Klasse als zusammengehörig identifiziert, also möglichst eng beieinander auf die Ebene projiziert, während die nicht zur Klasse gehörenden Elemente weit von der Gruppe entfernt eingeordnet werden. Der Unterraum, der diese Voraussetzung am besten erfüllt, dient als Grundlage für die weitere Analyse. 4.6.1 Gaussian Mixture Model Um die Einzeldatensätze jeweils einer der drei Diagnosegruppen zuzuweisen, wurde mit dem Gaussian Mixture Model (GMM) ein probabilistisches Klassifikationsmodell verwendet. Im Gegensatz zu anderen Klassifikationssystemen erlaubt diese Art der Klassifikation nicht nur eine Zuweisung des Einzeldatensatzes zu einer Gruppe, sondern gibt gleichzeitig die prozentuale Wahrscheinlichkeit an, mit der der betrachtete Datensatz zu der entsprechenden Gruppe gehört. Damit erlaubt das Gaussian Mixture Model eine Aussage über die Sicherheit der Zuordnung, so dass sich Grenzfälle unmittelbar aus der statistischen Auswertung ablesen lassen und nicht erst in der Betrachtung der Diskriminant-Ebene auffallen. 4.6.2 Robustheitsanalyse Die Analyse der Robustheit des Verfahrens erfolgte durch absichtliches Mislabeling jeweils eines Falles pro Iteration. So wurde beispielsweise ein als Alzheimerdemenz diagnostizierter Fall als Kontrolle beschriftet, um zu sehen, wie zuverlässig die Klassifikation durch GMM erfolgt, wenn die Diagnose nicht in allen untersuchten Fällen korrekt gestellt ist. Wird der Fall weiterhin in die Klasse eingeordnet, die der eigentlichen Diagnose entspricht, so kann man davon ausgehen, dass das Verfahren robust ist und auch im Fall von Störungen stabil arbeitet. 4.7 Zusammenstellung der Testgruppe Nachdem das Verfahren mit Hilfe der ausgewählten Trainings-Fälle programmiert worden war, die jeweils typischen Demenzmuster zu unterscheiden, wurden in einem zweiten Schritt Testfälle durch das Programm klassifiziert. Das Preprocessing und die Datenanalyse erfolgten analog zu den Trainings-Datensätzen. Zur Überprüfung der Klassifikationsgenauigkeit wurden als Testfälle Einzeldatensätze verwendet, bei denen eine beginnende frontotemporale Demenz oder Demenz vom Alzheimertyp diagnostiziert worden war oder bei denen der Verdacht auf eine 41 frontotemporale Demenz oder Demenz vom Alzheimertyp bestand. Hierzu wurden Datensätze herangezogen, die zuvor aus der Trainingsgruppe ausgeschlossen worden waren. Die Testgruppe (nur Krankheitsfälle) gliederte sich damit in folgende Untergruppen: 1. Beginnende Alzheimerdemenz (bAD) 2. Beginnende frontotemporale Demenz (bFTD) 3. Verdacht auf Alzheimerdemenz (sAD) 4. Verdacht auf frontotemporale Demenz (sFTD) Aufgrund schlechterer Bildqualität oder nicht eindeutiger Befunde war allein anhand der Bildgebung häufig keine sichere Diagnose möglich. Daher wurde in diesen Fällen die Diagnose auf der Basis zusätzlicher Parameter bestimmt. In die Diagnose flossen sowohl klinische Beobachtungen als auch laborchemische Untersuchungen ein (ApoE-Genotyp und Tau-Protein im Liquor). Die in diesen Fällen als richtig betrachtete Klassifizierung entstand jeweils aus der Zusammenschau aller verfügbaren Untersuchungen. 42 5 Ergebnisse 5.1 Training Für das Training des Verfahrens wurden drei Gruppen zusammengestellt: 1. Nicht-demente Kontrollpatienten (CTR) 2. Alzheimerdemenz (AD) 3. Frontotemporale Demenz (FTD) Das Verfahren wurde mit Hilfe der Daten von insgesamt 73 Individuen trainiert, davon 47 weiblich und 26 männlich (35,6% m). 5.1.1 Epidemiologie Gruppe 1 umfasste insgesamt 26 Probanden, davon 5 Männer und 21 Frauen (19,2% m). Das Durchschnittsalter betrug 64,2 Jahre (SD=5,1). Der durchschnittliche MMST-Wert lag bei 25,2 Punkten (SD=3,5; fehlende Angaben in 20 Fällen). Die durchschnittliche Gesamtausbildungsdauer betrug 10,5 Jahre (SD=5,4; fehlende Angaben in 20 Fällen). Im Durchschnitt nahmen die Patienten 2,6 Medikamente regelmäßig ein (SD=1,5; fehlende Angaben bei 23 Probanden). Bei 11,5% der Patienten war die Familienanamnese positiv in Bezug auf dementielle Erkrankungen; in 7,7% war sie sicher negativ. In den übrigen Fällen konnten keine Angaben gemacht werden. Gruppe 2 beinhaltete 26 Individuen mit Alzheimerdemenz, 13 weiblich und 13 männlich (50% m). Das Durchschnittsalter errechnete sich zu 67,0 Jahren (SD=7,1). Der durchschnittliche MMST-Wert betrug 18,1 Punkte (SD=7,6; fehlende Angaben bei 6 Probanden). Im Mittel hatten die Probanden eine Gesamtausbildungsdauer von 11,5 Jahren (SD 2,9; fehlende Angaben bei 10 Patienten). Die Probanden nahmen 3,8 Medikamente regelmäßig ein (SD=2,4; fehlende Angaben bei 13 Fällen). Bei 15,4% war die Familienanamnese positiv in Bezug auf dementielle Syndrome, in 42,3% war sie sicher negativ. In den übrigen Fällen konnten keine Angaben gemacht werden. In Gruppe 3 wurden 21 Probanden mit frontotemporaler Demenz eingeschlossen, davon 13 weiblich und 8 männlich (38,1% m). Das durchschnittliche Alter betrug 65,9 Jahre (SD=8,3). Der MMST-Punktwert lag in dieser Gruppe bei durchschnitt- 43 lich 25,1 Punkten (SD=6,5), wobei zu 9 Probanden keine Daten vorlagen. Die gesamte Ausbildungsdauer betrug durchschnittlich 11,8 Jahre (SD=2,9, fehlende Daten bei 15 Probanden). Die Zahl der regelmäßig eingenommenen Medikamente betrug 3,8 Stück (SD=3,4, fehlende Daten bei 14 Probanden). Bei 19,0% der Patienten war die Familienanamnese positiv bezüglich dementieller Syndrome, bei 28,6% war sie sicher negativ; in den übrigen Fällen wurden keine Angaben gemacht. 44 Tabelle 1: Übersicht der epidemiologischen Daten des Trainingsdatensatzes Anzahl Patienten männlich (%) Alter MMST Ausbildung Anzahl Familienanamnese (Jahre) (Punkte) (Jahre) Medikamente positiv (%) CTR 26 19,2 64,2 25,2 10,5 2,6 11,5 AD 26 50,0 67,0 18,1 11,5 3,8 15,4 FTD 21 38,1 65,9 25,1 11,8 3,8 19,0 Alter MMST Ausbildung Anzahl Familienanamnese (Jahre) (Punkte) (Jahre) Medikamente positiv (%) Tabelle 2: Übersicht der epidemiologischen Daten des Testdatensatzes Anzahl Patienten männlich (%) bAD 9 44,4 63,2 25,8 11,8 3,0 44,4 bFTD 2 100 61,5 26,0 17,5 15,0 0,0 sAD 8 100 65,6 25,8 13,0 3,0 12,5 sFTD 7 42,8 61,6 19,8 11,8 2,5 0,0 45 5.1.2 Diskriminant-Ebene Nach Preprocessing und Hauptkomponentenanalyse wurde die Multiple Discriminant Analysis durchgeführt. Dazu wurde der Datensatz stratifiziert. Aus jeder der Gruppen wurden jeweils 20 Fälle zufällig ausgewählt. Aus der Projektion der Daten in einen zweidimensionalen Unterraum zur Betrachtung der drei diagnostischen Gruppen ergab sich eine Diskriminant-Ebene, dargestellt in Abb 2. Abb 2 Diskriminant-Ebene aus der Projektion des Trainingsdatensatzes Die untersuchten Fälle werden auf der Ebene jeweils durch einen farbigen Punkt repräsentiert. Die Farbe eines Punktes entspricht dabei der als gesichert geltenden klinischen Diagnose, die aufgrund der Zusammenschau der verschiedenen Untersuchungsergebnisse gestellt wurde (vgl. 4.3) Die vom Programm vorgeschlagene Gruppenzugehörigkeit lässt sich aus der Position eines Punktes auf der Ebene ablesen. Je näher der Punkt an dem jeweiligen Klassenzentrum liegt (dargestellt durch einen Stern), desto sicherer ist die Diagnose. Durch die Anwendung der Fisher Diskriminanten-Analyse (FDA) auf jeweils zwei Klassen wurden zunächst starre Klassengrenzen (Linear Boundaries) ermittelt. Diese Grenzen sind zur besseren Veranschaulichung als schwarze Linien auf der Ebene dargestellt. 46 Die Klassenzuordnung wurde zusätzlich mit dem Gaussian Mixture Model ermittelt. Mit Hilfe dieses Modells lässt sich zu jedem Einzeldatensatz die prozentuale Wahrscheinlichkeit angeben, mit der er zur angenommenen Klasse gehört. Die Wahrscheinlichkeiten zu jedem Einzeldatensatz sind in Tabelle 3 bis Tabelle 5 zusammengefasst. In jeder Iteration des Trainings wurden aus jeder Gruppe 20 Fälle zufällig ausgewählt und durch die MDA auf die Diskriminant-Ebene abgebildet. Zur besseren Veranschaulichung ist auf der Abbildung der gesamte Trainingsdatensatz von 73 Fällen auf einer Ebene dargestellt. Die Fälle, die tatsächlich in dieser Iteration zum Training verwendet wurden, sind mit einer schwarzen Umrandung hervorgehoben. Die Fälle, deren Punkte nicht mit einem schwarzen Rand gekennzeichnet sind, wurden in diesem Durchlauf nicht verwendet. Die in Tabelle 3 bis Tabelle 5 angegebenen Prozentwerte stammen aus der nachträglichen Projektion dieser Daten auf die Ebene und sind grau hinterlegt. Die Kontrollgruppe bietet auf der Ebene ein sehr kompaktes Bild um das Klassenzentrum. Diese normalen Kontrollfälle werden von dem Programm gut identifiziert und automatisch der richtigen Klasse zugeordnet. Keiner der Kontrollfälle wurde als pathologisch fehlklassifiziert. Auch die FTD-Gruppe wird durch die Linear Boundaries gut eingegrenzt. Mit Wahrscheinlichkeitswerten von durchgehend über 80% nach GMM werden die FTD-Fälle gut identifiziert und der erwarteten Klasse zugeordnet. Eine Fehlklassifikation eines Falles in eine andere Klasse erfolgte nicht. In der Gruppe der Alzheimer-Fälle ist die Standardabweichung der Werte deutlich größer, was durch die weitere Verteilung der Fälle um das Klassenzentrum anschaulich wird. Gemessen an den linearen Grenzen kommt es zu zwei Fehlklassifikationen. Fall 21 wird als Kontrolle klassifiziert, wohingegen Fall 26 vom Programm als frontotemporale Demenz eingeordnet wird. Die entsprechenden Wahrscheinlichkeitswerte aus dem GMM liegen für Fall 21 bei 70,3% und für Fall 26 bei 55,8%. Die übrigen Fälle werden mit sehr großer Sicherheit wie erwartet in die AD-Gruppe klassifiziert. Die Robustheitsanalyse durch absichtliche Fehldiagnose jeweils eines Falles pro Iteration (vgl. Abschnitt 4.6.2) zeigte eine robuste Einordnung durch das GMM, welches auch bei Fehldiagnosen einzelner Fälle noch gute Ergebnisse für den gesamten Datensatz liefert. 47 Tabelle 3: Trainingsdatensatz Kontrollen Fall Nr. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 61 62 63 64 65 66 Gruppe CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR CTR Wahrscheinlichkeit nach GMM (%) CTR AD FTD 96,3 1,2 2,5 98,5 1,1 0,4 98,3 0,8 0,9 97,2 1,3 1,5 96,0 3,7 0,3 79,7 5,6 14,8 97,2 1,0 1,9 98,4 1,2 0,4 98,1 1,5 0,4 93,8 5,5 0,7 97,3 0,9 1,8 94,1 1,5 4,5 95,5 4,1 0,4 97,1 2,3 0,6 86,7 1,9 11,5 90,4 8,3 1,4 73,6 3,6 22,8 91,7 6,5 1,8 96,4 3,3 0,3 93,2 1,6 5,2 88,7 2,1 9,2 53,4 8,2 38,4 85,5 11,6 3,0 94,4 5,1 0,5 95,7 4,0 0,3 98,3 0,8 0,9 Die grau hinterlegten Fälle wurden in der in Abb 2 dargestellten Iteration des Verfahrens nicht verwendet und nachträglich auf die Diskriminant-Ebene projiziert. 48 Tabelle 4: Trainingsdatensatz Alzheimerdemenz Fall Nr. 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 67 68 69 70 71 72 Gruppe AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD AD Wahrscheinlichkeit nach GMM (%) CTR AD FTD 29,6 70,3 0,1 0,0 100,0 0,0 0,1 99,9 0,0 0,0 96,7 3,3 0,0 99,0 1,0 0,2 55,8 44,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 99,9 0,1 0,0 100,0 0,0 0,0 100,0 0,0 4,1 94,5 1,4 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 1,5 85,1 13,4 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 100,0 0,0 0,0 99,2 0,8 0,0 100,0 0,0 Die grau hinterlegten Fälle wurden in der in Abb 2 dargestellten Iteration des Verfahrens nicht verwendet und nachträglich auf die Diskriminant-Ebene projiziert. 49 Tabelle 5: Trainingsdatensatz frontotemporale Demenz Fall Nr. 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 73 Gruppe FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD FTD Wahrscheinlichkeit nach GMM (%) CTR AD FTD 5,0 5,9 89,0 0,0 12,8 87,2 0,0 2,1 97,9 3,5 3,8 92,7 0,0 2,9 97,1 0,0 1,8 98,2 0,0 2,4 97,6 11,5 7,5 81,0 0,0 1,1 98,9 0,0 2,0 98,0 0,0 1,8 98,2 0,0 1,6 98,4 0,0 30,1 70,0 0,0 1,7 98,3 0,0 3,4 96,6 0,0 4,4 95,6 0,0 2,2 97,8 0,0 1,0 99,0 0,0 1,2 98,8 0,0 3,4 96,6 0,6 10,9 88,5 Die grau hinterlegten Fälle wurden in der in Abb 2 dargestellten Iteration des Verfahrens nicht verwendet und nachträglich auf die Diskriminant-Ebene projiziert. 50 5.2 Testdatensätze Das mit Hilfe des Trainingsdatensatzes trainierte Verfahren wurde an insgesamt 26 Fällen mit beginnender oder vermuteter Erkrankung getestet. 17 der Probanden waren Männer, 9 Frauen. Die Testfälle wurden in folgende Gruppen eingeteilt: 1. Beginnende Alzheimerdemenz (bAD) 2. Beginnende frontotemporale Demenz (bFTD) 3. Verdacht auf Alzheimerdemenz (sAD) 4. Verdacht auf frontotemporale Demenz (sFTD) 5.2.1 Epidemiologie In Gruppe 1 wurden 9 Individuen mit beginnender Alzheimerdemenz zusammengefasst, davon 4 Männer und 5 Frauen (44,4% m). Das Durchschnittsalter lag bei 63,2 Jahren (SD=12,2). Das durchschnittliche Abschneiden beim MMST ergab 25,8 Punkte (SD=2,2; fehlende Angaben in 4 Fällen). Die Gesamtausbildungsdauer betrug im Durchschnitt 11,8 Jahre (SD=4,3; fehlende Angaben bei 5 Probanden). Im Durchschnitt wurden 3,0 Medikamente regelmäßig eingenommen (SD=2,2; fehlende Angaben in 5 Fällen). Bei 44,4% der Probanden war die Familienanamnese positiv auf dementielle Erkrankungen, bei 0,11% war sie sicher negativ. In den übrigen Fällen waren keine Angaben verfügbar. Gruppe 2 umfasste 2 Probanden mit beginnender frontotemporaler Demenz, davon 2 Männer und keine Frauen (100% m). Das Durchschnittsalter betrug 61,5 Jahre (SD=12,0). Der durchschnittliche MMST-Wert betrug 26,0 Punkte (SD=5,7). Die Gesamtausbildungsdauer ergab sich im Durchschnitt zu 17,5 Jahren (SD=0,7), durchschnittlich wurden 15,0 Medikamente pro Tag regelmäßig eingenommen (SD=14,1). In beiden untersuchten Fällen war die Familienanamese sicher negativ bezüglich dementieller Symptome. Gruppe 3 setzte sich aus insgesamt 8 Probanden mit Verdacht auf Alzheimerdemenz zusammen, davon keine Frauen und 8 Männer (100% m). Im Durchschnitt waren diese Probanden 65,6 Jahre alt (SD=8,3). Im MMST wurden durchschnittlich 25,8 Punkte erreicht (SD=3,4; fehlende Angaben in 4 Fällen). Die Gesamtausbil- 51 dungsdauer lag im Durchschnitt bei 13,0 Jahren (SD=3,5; fehlende Angaben in 5 Fällen), die Probanden nahmen 3,0 Medikamente täglich regelmäßig ein (SD=1,4; fehlende Angaben in 6 Fällen). In 12,5% der Fälle war die Familienanamnese positiv in Bezug auf dementielle Erkrankungen, in 37,5% war sie sicher negativ. In den verbleibenden Fällen wurden keine Angaben gemacht. Gruppe 4 bestand aus 7 Individuen mit Verdacht auf frontotemporale Demenz, davon 4 Frauen und 3 Männer (42,8% m). Das Durchschnittsalter lag bei 61,6 Jahren (SD=15,7), der durchschnittliche MMST-Wert ergab 19,8 Punkte (SD=10,2; fehlende Angaben in einem Fall). Die gesamte Ausbildungsdauer betrug 11,8 Jahre (SD=1,7; fehlende Angaben in 3 Fällen). Im Durchschnitt nahmen die Probanden 2,5 Medikamente pro Tag regelmäßig ein (SD=2,1; fehlende Angaben in 5 Fällen). Bei keinem der Probanden bestand eine positive Familienanamnese bezüglich dementieller Symptome, in weiteren 57,1% war sie sicher negativ. Die übrigen Probanden hatten keine diesbezüglichen Angaben gemacht. 52 5.2.2 Diskriminant-Ebene Die optimale Diskriminant-Ebene wurde durch das Training des Verfahrens mit ausgewählten Fällen mit besonders typischer Darstellung in der SPECT festgelegt (vgl. Abschnitt 5.1). Im nächsten Schritt wurden 26 Fälle mit beginnender oder nur vermuteter Erkrankung auf diese Ebene projiziert. Die Projektion der Testfälle ist in Abb 3 dargestellt. Abb 3 Diskriminant-Ebene aus der Projektion des Testdatensatzes Wie zu erwarten, ist im Fall der wenig fortgeschrittenen Erkrankungsfälle keine kompakte Anordnung der Punkte um die Klassenzentren zu erkennen. Wie schon im Training ist die Gruppe der AD-Fälle auch bei den weniger ausgeprägten Verläufen weiter verteilt als die Vergleichsgruppen. Von den 9 Fällen beginnender AD werden nach GMM 5 Fälle der AD-Gruppe zugeordnet, dies entspricht einer Sensitivität von 66,6%. Die Fälle 1 und 2 werden mit einer Wahrscheinlichkeit von 66,8% bzw. 83,4% der FTD-Klasse zugewiesen. Fall Nr. 6 wird mit relativ hoher Wahrscheinlichkeit (62,1%) als Kontrollfall klassifiziert. Für Fall Nr. 8 erfolgt keine eindeutige Einordnung; die Wahrscheinlichkeiten für die Kontroll- und die Alzheimer-Klassifikation werden hier als etwa gleich hoch angegeben. 53 In der Gruppe der vermuteten Alzheimerdemenz werden bis auf eine Ausnahme alle Fälle wie erwartet klassifiziert, wodurch für diese Untergruppe eine Sensitivität von 87,5% erreicht wird. Fall Nr. 15 wird mit hoher Wahrscheinlichkeit als FTDFall identifiziert. Beide Fälle beginnender frontotemporaler Demenz werden wie erwartet in die FTD-Sektion der Ebene projiziert; im Gaussian Mixture Model ergibt sich für die Zuordnung jeweils eine Wahrscheinlichkeit von über 80%. Die Verdachtsfälle bewegen sich bis auf eine Ausnahme ebenfalls im Rahmen der Gruppenbegrenzungen, dies entspricht einer korrekten Klassifizierung in 85,7% der Fälle. Fall 25 wird vom Programm mit sehr hoher Wahrscheinlichkeit (93,6% nach GMM) der Gruppe der Alzheimerdemenzen zugeordnet. Auch Fall 24 findet sich nach der Klassenzuordnung durch das GMM mit 63,4% Wahrscheinlichkeit auf der Seite der Alzheimerdemenz. Insgesamt wurden von den 26 beginnenden und vermuteten Fällen 19 wie erwartet klassifiziert. Das entspricht einer Sensitivität von 73,1%. In der Gruppe der frontotemporalen Demenzen (vermutete und beginnende FTD) wurde eine Sensitivität von 77,8% erreicht bei einer Spezifität von 76,5%. In der Gruppe der Alzheimerdemenz lag die Sensitivität dementsprechend bei 76,5%, die Spezifität bei 77,8%. 54 Tabelle 6: Testdatensatz Fall Nr. 1 2 3 4 5 6 7 8 9 Gruppe bAD bAD bAD bAD bAD bAD bAD bAD bAD Wahrscheinlichkeit nach GMM CTR AD FTD 28,7 4,6 66,8 12,4 4,2 83,4 0,0 100,0 0,0 9,0 86,3 4,7 24,1 46,9 29,0 62,1 23,3 14,6 5,5 91,8 2,7 52,5 47,2 0,3 0,0 100,0 0,0 10 11 12 13 14 15 16 17 18 19 sAD sAD sAD sAD sAD sAD sAD sAD bFTD bFTD 1,2 1,2 0,0 10,2 17,9 14,7 0,0 0,0 0,0 11,4 98,8 96,0 100,0 89,8 80,8 15,1 99,8 100,0 1,2 7,6 0,1 2,8 0,0 0,0 1,2 70,2 0,2 0,0 98,8 81,1 20 21 22 23 24 25 26 sFTD sFTD sFTD sFTD sFTD sFTD sFTD 0,0 0,7 0,0 0,9 0,0 0,0 0,0 2,3 6,6 1,8 3,1 63,4 93,6 3,0 97,7 92,8 98,3 96,0 36,6 6,4 97,0 55 6 Diskussion Das in dieser Arbeit vorgestellte Verfahren ermöglicht eine computergestützte Klassifikation pathologischer Veränderungen der Hirnperfusion als diagnostisches Mittel. Die Dimensionsreduktion des Variablenraumes mit Hilfe der Hauptkomponentenanalyse und die Übertragung der Bilddaten in ein Referenz- Koordinatensystem erleichtern dabei den Vergleich einzelner Befunde. Die Projektion auf die Diskriminantebene mittels der Multiple Discriminant Analysis und die Anwendung des Gaussian Mixture Model erlauben schließlich neben einer weiteren Dimensionsreduktion die Zuordnung der einzelnen Datensätze zu den verschiedenen Klassen. Somit lassen sich automatisiert diagnostisch aussagekräftige Angaben über Perfusionsstörungen im Gehirn machen. Bereits in früheren Publikationen wurde gezeigt, dass die Anwendung dieser mathematischen Verfahren zur Analyse von Perfusions-SPECT-Daten prinzipiell möglich ist (Stühler 2011). Für die vorliegende Arbeit wurde das Verfahren an einer größeren Stichprobe getestet. Dazu wurden die Daten von insgesamt 99 Probanden ausgewertet. 73 Datensätze wurden zum Training des Verfahrens eingesetzt, die verbleibenden 26 dienten der Testung der Zuverlässigkeit der Klassifikation. Dabei zeigte sich, dass sich das Verfahren auch zur Anwendung auf größere Populationen eignet. Auch die früheren bzw. vermuteten Demenz-Stadien wurden zufriedenstellend klassifiziert. Die betrachtete Gruppe von Probanden zeichnete sich dabei nicht nur durch ihre Größe aus, auch die verhältnismäßig hohe Zahl an Probanden mit frontotemporaler Demenz stellt eine Besonderheit dar, da es aufgrund der relativen Seltenheit dieses Krankheitsbildes meist nicht möglich ist, eine ausreichende Zahl an Probanden zu rekrutieren. Es handelte sich zudem um eine umfassend charakterisierte Stichprobe, deren Daten kontinuierlich über mehrere Jahre erfasst wurden. So lagen neben den SPECT-Bildern und –Befunden jeweils auch die Ergebnisse einer Liquor-Punktion und neuropsychologischer Testungen, in der Regel des MMST, vor. Die konventionelle Diagnose beruhte damit nicht nur auf der Auswertung der SPECT-Bilder durch einen erfahrenen Facharzt, sondern stützte sich neben der Klinik auf weitere valide Befunde. Dadurch wurde eine genauere Überprüfung der durch das Programm getroffenen Klassifikation möglich. 56 Bei der Perfusions-SPECT handelt es sich um ein etabliertes, in der Praxis verbreitetes Verfahren, dessen Aussagekraft und Reliabilität für die in dieser Arbeit untersuchten Krankheitsbilder als bewiesen gelten (Holman 1992; Pickut 1997). Ebenso sind die statistischen und mathematischen Methoden, die zur Anwendung kamen, gut etabliert und valide. Ihre Anwendbarkeit in der Analyse struktureller wie funktioneller bildgebender Verfahren konnte in mehreren Studien gezeigt werden (Johnson 1998). Bei der Zusammensetzung der untersuchten Patientengruppe ist jedoch zu berücksichtigen, dass die Stichprobe in einer Universitätsklinik erhoben wurde, was von vorneherein einen gewissen Selektions-Bias bedeutet. Ein Beispiel dafür ist das verhältnismäßig niedrige Durchschnittsalter der Probanden. Darüber hinaus wurden in die Untersuchung nur diejenigen Patienten eingeschlossen, bei denen eine Liquorpunktion durchgeführt worden war. Probanden, bei denen dies nicht möglich war, wurden nicht in die Untersuchung einbezogen. Aufgrund dieser Einschränkungen ist die unmittelbare Übertragbarkeit der Ergebnisse auf die allgemeine Bevölkerung begrenzt. Bei der Definition der Diskriminant-Ebene (vgl. Abb 2) mit Hilfe der MDA auf Grundlage des Trainingsdatensatzes wurde eine hohe Genauigkeit bei der Klassifikation der Fälle erreicht. Weder in der Gruppe der Kontrollen noch in der FTDGruppe kam es zu Fehlklassifizierungen. In der AD-Gruppe wurden gemessen an den Linear Boundaries (nach FDA, vgl. Abschnitt 5.1.2) zwei Fälle fehlklassifiziert. Fall 21 wird nach diesem Klassifikationsmodell in die Gruppe der Kontrollen eingeordnet. Betrachtet man jedoch die Klassifikation nach GMM, wird Fall 21 dort mit hoher Wahrscheinlichkeit als AD identifiziert. Da die GMM für diese Fragestellung das verlässlichere Klassifikationssystem darstellt, kann der Fall als korrekt klassifiziert gewertet werden. Fall 26 wird anhand der FDA in die FTD-Gruppe eingeordnet. Das GMM zeigt hier keine genaue Festlegung auf eine Gruppe, AD und FTD werden als annähernd gleich wahrscheinlich angegeben. Der Fall ist somit als Grenzfall zu betrachten, die über fünfzigprozentige Festlegung auf AD lässt sich jedoch noch als korrekte Einordnung werten. Insgesamt wurde damit nach Anwendung des GMM kein Fall aus dem Trainingsset fehlklassifiziert. In anderen Studien wurden für den Trainings-Durchgang des Ver- 57 fahrens bei ähnlich großen Kollektiven vergleichbar hohe Werte erreicht (Charpentier 2000). Auch die Performance des Verfahrens bei der Klassifikation des Testdatensatzes war zufriedenstellend. Die nicht wie erwartet klassifizierten Fälle aus der FTDGruppe (Fall 24 und 25) wurden mit hoher Wahrscheinlichkeit in die AD-Gruppe eingeordnet. Die Liquorbefunde in Fall 24 ergaben keine Hinweise auf das Vorliegen einer Alzheimerdemenz. Die SPECT-Aufnahme zeigte in der Evaluation durch einen Nuklearmediziner eine linksbetonte perisylvische Atrophie sowie eine frontale und linkstemporale Hypoperfusion. Insgesamt präsentierte sich ein sicher pathologisches Bild, das sich jedoch nicht mit Sicherheit als frontotemporale Demenz einordnen ließ. Aus der Fallgeschichte geht hervor, dass die unter der Nummer 24 anonymisierte Patientin zudem an einem Parkinson-Syndrom litt. Es handelt sich hierbei also um ein sehr komplexes Bild, das sich weder mit Hilfe konventioneller Diagnostik noch durch das hier präsentierte Computing-Verfahren eindeutig bestimmen ließ. Fall 25 wurde durch das GMM ebenfalls als AD klassifiziert. Aufgrund im SPECT festgestellter Bereiche frontaler Hyperperfusion wurde dieser Fall durch den Experten als FTD eingeordnet. Erhöhte Gesamt- und Phospho-Tau-Werte im Liquor erlauben jedoch die Vermutung, dass es sich um eine Alzheimerdemenz handelt. In diesem Fall wäre damit die Einordnung durch das Computer-Verfahren als korrekt zu betrachten. In der Gruppe der Alzheimerdemenz waren die Ergebnisse zufriedenstellend. Die Fälle 6 und 8 werden als Kontrollen an der Grenze zur AD-Gruppe klassifiziert, was für eine beginnende Pathologie nicht ungewöhnlich ist. Insbesondere in Fall 8 liegen die Klassifikations-Wahrscheinlichkeiten für CTR und AD sehr nah beieinander, was eine beginnende Erkrankung in der Übergangsphase in ein fortgeschritteneres Stadium nahelegt. Mit den Fällen 1, 2 und 15 werden insgesamt drei ADFälle als FTD klassifiziert. In Fall 1 wurde in den SPECT-Aufnahmen eine diskrete Hypoperfusion frontal diagnostiziert. Aufgrund der klinischen Präsentation und der Zusammenschau der übrigen Befunde (insbesondere erhöhte Gesamt- und PhosphoTau-Werte sowie erniedrigte Aβ42-Konzentration im Liquor) war der Fall jedoch 58 als AD diagnostiziert worden. Das Programm hat mit der frontalen Hypoperfusion dennoch das FTD-typische Muster erkannt und auf dieser Grundlage eine hohe Wahrscheinlichkeit für die Klassifikation als FTD berechnet. Auch Fall 15 wies zusätzlich zu AD-typischen parietalen Atrophie-Mustern eine linksbetonte frontale Minderperfusion auf, die wiederum für die Klassifikation durch das Programm ausschlaggebend gewesen sein dürfte. Fall 2 hatte sich in der SPECT-Bildgebung als relativ unauffällig dargestellt. Die Diagnose beginnende Alzheimerdemenz wurde bei klinisch vorliegenden Merkfähigkeitsstörungen in erster Linie auf der Grundlage eines leicht erhöhten Phospho-Tau-Wertes im Liquor und der positiven Familienanamnese beider Eltern gestellt. Die Analyse der SPECT-Bilder durch den Experten ergibt keinen Hinweis darauf, weshalb der Fall durch das Programm mit so hoher Sicherheit als FTD eingeordnet wurde. Fall 2 muss damit als fehlklassifiziert gelten. Da das Verfahren sonst jedoch recht zuverlässige oder zumindest nachvollziehbare Ergebnisse liefert, muss in diesem Fall auch an eine früh im Anonymisierungsprozess aufgetretene Verwechslung der Datensätze gedacht werden. Für den gesamten Testdatensatz wurde eine Sensitivität von 77,0% erreicht. Horn et al erreichten in ihrer Studie von 2009 höhere Werte von bis zu 88% (Horn 2009). Das vergleichsweise schlechtere Abschneiden des hier besprochenen Verfahrens lässt sich unter anderem damit erklären, dass Horn und Mitarbeiter in ihren Testlauf auch Patienten mit fortgeschrittenem Krankheitsverlauf einbezogen. Anders als im hier präsentierten Test wurden also nicht nur beginnende oder vermutete Erkrankungsfälle klassifiziert. Die deutlicheren Veränderungen an Gehirnen länger erkrankter Patienten erlauben eine bessere Identifikation und damit Klassifikation durch das Computerprogramm. Die hier erzielten Werte wurden allein durch die Analyse beginnender und zum Teil wenig ausgeprägter Pathologien erreicht und können somit immer noch als verhältnismäßig gut betrachtet werden. Habert und Mitarbeiter beschäftigen sich in ihrer Publikation von 2011 ebenfalls mit beginnenden Krankheitsfällen, konzentrieren sich jedoch ausschließlich auf Fälle beginnender Alzheimerdemenz (Habert 2011). Die in dieser Studie erreichten Werte für Sensitivität und Spezifität lagen bei 82% bzw. 90%. 59 Insgesamt muss man sich bei der Betrachtung der Ergebnisse bewusst machen, dass auch die als korrekt angenommene Diagnose letztlich auf Verfahren beruht, die ihrerseits störanfällig sind. Die klinische Diagnose ist zwar häufig aussagekräftig, jedoch auch bis zu einem gewissen Grad untersucherabhängig. Zudem können sich AD und FTD in frühen Stadien unter Umständen klinisch ähnlich präsentieren (Litvan 1997). Die Laboruntersuchungen auf Veränderungen der Liquorzusammensetzung bieten eine Basis für die Diagnose von Alzheimerdemenzen, können aber noch nicht zum Ausschluss anderer Erkrankungen wie der FTD herangezogen werden. Eine sichere Diagnose im Sinne eines „Goldstandards“ könnte nur durch eine histopathologische Untersuchung des Hirngewebes post mortem erreicht werden. Da diese Möglichkeit meist nicht zur Verfügung steht, wird die bestmögliche Einordnung durch eine gemeinsame Betrachtung der SPECT- mit den übrigen Befunden erreicht (McNeill 2006). Zusammenfassend lässt sich die Performance des Verfahrens als durchaus gut beurteilen. Sensitivität und Spezifität sind mit den in ähnlichen Arbeiten erreichten Werten unter Berücksichtigung der Unterschiede in der Methodik vergleichbar. Auch diejenigen Fälle, die als nicht detektiert in die Statistik eingehen, müssen nicht als völlig fehlklassifiziert gelten. Bei näherer Betrachtung sind sie, allein auf Basis der SPECT beurteilt, häufig korrekt klassifiziert, da Übergangsstadien oder Mischbilder vorlagen. Die Klassifikation funktionierte also noch besser, als die Sensitivitäts-Werte nahelegen. Man muss sich in jedem Fall bewusst sein, dass das Verfahren immer nur so gut ist wie der Trainingsdatensatz, an dem es geschult wurde. Wie bei jeder Form der Mustererkennung kann das Programm jeweils nur diejenigen Pathologien wiedererkennen, auf die es trainiert ist. Das funktioniert wiederum nur in Fällen, in denen eine Erkrankung ein charakteristisches Muster von Veränderungen hervorruft. Dadurch wird die Bewertung seltener oder komplexer Erkrankungen deutlich erschwert. Insbesondere überlagernde Pathologien und unspezifische Veränderungen, die ja gerade in Gehirnen älterer Probanden häufig sind, können die Identifikation der ursprünglich zugrundeliegenden Erkrankung schwierig bis unmöglich machen. So sind Speicherungsdefekte und regionale Hypoperfusionen bis zu einem gewissen Grad Bestandteil des normalen Alterungsprozesses (Goto 1998). 60 Im derzeitigen Stadium der Entwicklung ist eine Analyse von Mischpathologien noch nicht zuverlässig möglich. Beginnende Stadien der untersuchten Erkrankungen werden von dem Programm bereits jetzt weitgehend zufriedenstellend erkannt und bewertet. Dies ist ein wichtiges Kriterium für einen langfristig angestrebten Einsatz in der klinischen Praxis, da das Programm helfen könnte, die Frühdiagnostik von Demenzen entscheidend zu verbessern. Die Unterscheidung unspezifischer und signifikanter Veränderungen in der Konfiguration des Hirngewebes wird auch in den kommenden Entwicklungsstufen ein zentrales Thema in der computergestützten Bildanalyse bleiben. Ein größerer Pool an Trainingsdaten, an dem das Verfahren lernen kann, könnte hier ein erster Weg zur Abhilfe sein. Je besser das Verfahren trainiert ist, desto besser können einzelne Pathologien identifiziert und zugeordnet werden. Problematisch bleibt hier der Mangel an geeigneten Probanden, besonders bei der Untersuchung verhältnismäßig seltener Erkrankungen. Die Darstellung einer komplexen bildgebenden Methode in Form einer Diskriminantanalyse kann dem Kliniker auf einen Blick Information geben über die diagnostische Sicherheit (bzw. positive likelihood-Ratio, LR+), die dem Abstand der Messpunkte vom Ausgangspunkt der Diskriminantgeraden entspricht, oder auch einer diagnostischen Unsicherheit (Messpunkte nahe dem Ausgangspunkt oder auf einer Geraden). 7 Schlussfolgerung Das in dieser Arbeit dargestellte Verfahren ist ein wichtiger Schritt auf dem Weg zu einer computergestützten Demenz-Diagnostik. In der jetzigen Form ist es noch nicht geeignet, die manuelle Bildauswertung durch einen Fachmann zu ersetzen oder in bedeutender Weise zu unterstützen, die erzielten Ergebnisse lassen jedoch ein großes Entwicklungspotential erkennen. Dieses Ergebnis erlangt seine eigentliche Bedeutung vor dem Hintergrund, dass auch im Bereich der Demenz-Therapie auf weitere Fortschritte zu hoffen ist. Dadurch wird eine möglichst frühe und genaue Diagnose dementieller Syndrome zunehmend an Wichtigkeit gewinnen. Ein interessanter Aspekt ist dabei die Überlegung, dass ein Computerprogramm dem Menschen beim Erkennen von Mustern deutlich überlegen ist. Einem sehr gut trainierten Verfahren wäre es demnach möglich, auch in einer komplexen Mischpathologie, die sich für den menschlichen Gutachter nicht einordnen lässt, das ent- 61 sprechende krankheitsspezifische Muster zu erkennen und so eine Klassifizierung zu ermöglichen. Die weiter fortschreitende Entwicklung im Bereich der computergestützten Bildanalyse ist nicht isoliert zu betrachten. Auch in anderen Bereichen der Demenzdiagnostik werden ständig Fortschritte erzielt. Die dritte wichtige Säule der Demenzdiagnostik ist, neben der klinischen Evaluation und der Bildgebung, die Analyse von Biomarkern in Blut und Liquor. Im Fall der Alzheimerdemenz sind die entsprechenden Tests bereits etabliert und stellen ein wichtiges diagnostisches Instrument dar (vgl. Abschnitt 3.2.2). Bereits heute beruht eine aussagekräftige Alzheimer-Diagnose auf einem Zusammenspiel der drei Methoden. Im Falle der frontotemporalen Demenz und der Demenz mit Lewy-Bodies sind vergleichbare Tests im Augenblick noch nicht verfügbar, doch die Entwicklung entsprechender Analysemethoden ist weltweit Gegenstand intensiver Forschungsbemühungen. Die Entwicklung eines zuverlässigen Tests für entsprechende Biomarker ist langfristig zu erwarten. Die Zusammenführung beider Teilaspekte der apparativen Diagnostik ist eine Möglichkeit der Weiterentwicklung der computerbasierten Analyse. Die in Blut und Liquor bestimmten Werte könnten dabei als zusätzliche Variablen in die Berechnung einfließen und den Klassifizierungsvorgang erleichtern und präzisieren. VI 8 Literatur 1. Aggarwal, N; Decarli, C (2007): Vascular dementia: emerging trends. In: Seminars in Neurology, S. 66–77. 2. Aguirreche, E; Zeppenfeld, G; Kolb, G (2003): Gedächtnissprechstunden: "Memory-Kliniken" im deutschsprachigen Raum. In: Zeitschrift für Gerontologie und Geriatrie, S. 183–188. 3. Alzheimer, A (1906): Über einen eigenartigen schweren Erkrankungsprozeß der Hirnrinde. In: Neurologisches Centralblatt, S. 1129–1136. 4. Bäckman, L; Jones, S; Berger, A-K; Laukka, E; Small, B (2004): Multiple cognitive deficits during the transition to Alzheimer's disease. In: Journal of internal medicine, S. 195–204. 5. Beyreuther K., E: Demenzen - Grundlagen und Klinik. Thieme. Stuttgart (2002): 6. Bickel, H (2001): Demenzen im höheren Lebensalter: Schätzungen des Vorkommens und der Versorgungskosten. In: Zeitschrift für Gerontologie und Geriatrie, S. 108–115. 7. Bickel, H; Mosch, E; Seigerschmidt, E; Siemen, M; Forstl, H (2006): Prevalence and persistence of mild cognitive impairment among elderly patients in general hospitals. In: Dementia and geriatric cognitive disorders, S. 242–250. 8. Burns, A; Byrne, E; Maurer, K (2002): Alzheimer's disease. In: Lancet, S. 163– 165. 9. Charpentier, P; Lavenu, I; Defebvre, L; Duhamel, A; Lecouffe, P; Pasquier, F; Steinling, M (2000): Alzheimer's disease and frontotemporal dementia are differentiated by discriminant analysis applied to 99mTc HmPAO SPECT data. In: Journal of Neurology, Neurosurgery & Psychiatry, S. 661–663. 10. DGPPN (2009): S3-Leitlinie Demenzen. 11. Diehl, J; Staehelin, H; Wiltfang, J; Hampel, H; Calabrese, P; Monsch, A et al. (2003): Erkennung und Behandlung der Demenz in den deutschsprachigen Memory-Kliniken: Empfehlungen für die Praxis. In: Zeitschrift für Gerontologie und Geriatrie, S. 189–196. 12. DIMDIICD-10 Klassifikation 2011. 13. Dougall, N; Bruggink, S; Ebmeier, K (2005): Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia. In: The American journal of geriatric psychiatry, S. 554–570. 14. Drzezga, A; Grimmer, T; Henriksen, G; Mühlau, M; Perneczky, R; Miederer, I et al. (2009): Effect of APOE genotype on amyloid plaque load and gray matter volume in Alzheimer disease. In: Neurology, S. 1487–1494. 15. Eckert, A (2002): Aus der Frankfurter Anstalt für Irre und Epileptische. Alois Alzheimer und die Alzheimer Krankheit. In: Pharmazie in unserer Zeit, S. 356– 360. 16. Eschweiler, G; Leyhe, T; Klöppel, S; Hüll, M (2010): New developments in the diagnosis of dementia. In: Deutsches Ärzteblatt international, S. 677–683. 17. Ferri, C; Prince, M; Brayne, C; Brodaty, H; Fratiglioni, L; Ganguli, M et al. (2005): Global prevalence of dementia: a Delphi consensus study. In: Lancet, S. 2112–2117. 18. Förstl, H: Demenzen in Theorie und Praxis. Springer Berlin Heidelberg. Berlin, Heidelberg (2009). 19. Forstmeier, S; Maercker, A (2009): Die Reservekapazität des Gehirns beeinflusst die kognitive Funktion im Alter: Motivationale, kognitive und körperliche Facetten. In: Zeitschrift für Neuropsychologie, S. 1–12. 20. Frölich, L (2002): The cholinergic pathology in Alzheimer's disease-discrepancies between clinical experience and pathophysiological findings. In: J Neural Transm, S. 1003–1013. VII 21. Gauthier, S; Reisberg, B; Zaudig, M; Petersen, R; Ritchie, K; Broich, K et al. (2006): Mild cognitive impairment. In: The Lancet, S. 1262–1270. 22. Goto, R; Kawashima, R; Ito, H; Koyama, M; Sato, K; Ono, S et al. (1998): A comparison of Tc-99m HMPAO brain SPECT images of young and aged normal individuals. In: Ann Nucl Med, S. 333–339. 23. Habert, M-O; Horn, J-F; Sarazin, M; Lotterie, J-A; Puel, M; Onen, F et al. (2011): Brain perfusion SPECT with an automated quantitative tool can identify prodromal Alzheimer's disease among patients with mild cognitive impairment. In: Neurobiol. Aging, S. 15–23. 24. Holman, B; Johnson, K; Gerada, B; Carvalho, P; Satlin, A (1992): The scintigraphic appearance of Alzheimer's disease: a prospective study using technetium-99m-HMPAO SPECT. In: J. Nucl. Med, S. 181–185. 25. Horn, J-F; Habert, M-O; Kas, A; Malek, Z; Maksud, P; Lacomblez, L et al. (2009): Differential automatic diagnosis between Alzheimer's disease and frontotemporal dementia based on perfusion SPECT images. In: Artificial Intelligence in Medicine, S. 147–158. 26. Johnson, K; Jones, K; Holman, B; Becker, J; Spiers, P; Satlin, A; Albert, M S. (1998): Preclinical prediction of Alzheimer's disease using SPECT. In: Neurology, S. 1563–1571. 27. Karow, T; Lang-Roth, R: Allgemeine und spezielle Pharmakologie und Toxikologie. im Selbstverlag. Pulheim (2007): 28. Kuwert, T; Grünwald, F; Haberkorn, U; Krause, T: Nuklearmedizin. Thieme. Stuttgart (2008). 29. Litvan, I; Agid, Y; Sastrj, N; Jankovic, J; Wenning, G; Goetz, C G. et al. (1997): What are the obstacles for an accurate clinical diagnosis of Pick's disease? A clinicopathologic study. In: Neurology, S. 62–69. 30. Maier, W. Kompetenznetz-Demenzen (2008): Zentrale Ziele des Kompetenznetz Demenzen. Online verfügbar unter http://www.kompetenznetzdemenzen.de/ueber-das-netz/ueber-uns/#c19. 31. McNeill, R; Sare, G; Manoharan, M; Testa, H; Mann, D; Neary, D et al. (2006): Accuracy of single-photon emission computed tomography in differentiating frontotemporal dementia from Alzheimer's disease. In: Journal of Neurology, Neurosurgery & Psychiatry, S. 350–355. 32. Menzel, C; Bartenstein, P; Brust, P; Coenen, H; Krause, B; Kuwert, T et al. Deutsche Gesellschaft für Nuklearmedizin (1999): Leitlinie für die Hirnperfusions-SPECT mit Technetium-99m-Radiopharmaka. Online verfügbar unter http://www.nuklearmedizin.de/leistungen/leitlinien/html/spect.php?navId=53. 33. Merhof, D; Markiewicz, P; Platsch, G; Declerck, J; Weih, M; Kornhuber, J et al. (2011): Optimized data preprocessing for multivariate analysis applied to 99mTc-ECD SPECT data sets of Alzheimer's patients and asymptomatic controls. In: J. Cereb. Blood Flow Metab, S. 371–383. 34. Motter, R; Vigo-Pelfrey, C; Kholodenko, D; Barbour, R; Johnson-Wood, K; Galasko, D et al. (1995): Reduction of beta-amyloid peptide42 in the cerebrospinal fluid of patients with Alzheimer's disease. In: Ann. Neurol, S. 643–648. 35. Neary, D; Snowden, J; Mann, D (2005): Frontotemporal dementia. In: The Lancet Neurology, S. 771–780. 36. Noll, P; Haag, G (1992): Das Realitätsorientierungstraining – eine spezifische Intervention bei Verwirrtheit. In: Verhaltenstherapie, S. 222–230. 37. Omerovic, M; Hampel, H; Teipel, S; Buerger, K (2008): Pharmacological treatment of Alzheimer's dementia: State of the art and current dilemmas. In: World J Biol Psychiatry, S. 69–75. 38. Parihar, M; Hemnani, T (2004): Alzheimer's disease pathogenesis and therapeutic interventions. In: J Clin Neurosci, S. 456–467. VIII 39. Petersen, R (2004): Mild cognitive impairment as a diagnostic entity. In: J. Intern. Med, S. 183–194. 40. Petersen, R; Negash, S (2008): Mild cognitive impairment: an overview. In: CNS Spectr, S. 45–53. 41. Pickut, B; Saerens, J; Mariën, P; Borggreve, F; Goeman, J; Vandevivere, J et al. (1997): Discriminative use of SPECT in frontal lobe-type dementia versus (senile) dementia of the Alzheimer's type. In: J. Nucl. Med., S. 929–934. 42. Rainer, M; Mucke, H; Masching, A; Haushofer, M; Karger, M; Kasper, S; Kurz, A (2005): Zeitgemäßes Management von nicht kognitiven Symptomen bei Demenz. In: Psychiatr Prax, S. 31–38. 43. Schicha, H; Schober, O; Dietlein, M: Nuklearmedizin. Schattauer. Stuttgart (2007). 44. Sjögren, M; Davidsson, P; Tullberg, M; Minthon, L; Wallin, A; Wikkelso, C et al. (2001): Both total and phosphorylated tau are increased in Alzheimer's disease. In: J. Neurol. Neurosurg. Psychiatr, S. 624–630. 45. Snowden, J; Neary, D; Mann, D (2002): Frontotemporal dementia. In: Br J Psychiatry, S. 140–143. 46. Spector, A; Davies, S; Woods, B; Orrell, M (2000): Reality orientation for dementia: a systematic review of the evidence of effectiveness from randomized controlled trials. In: Gerontologist, S. 206–212. 47. Staack, S: Milieutherapie. Vincentz. Hannover (2004): 48. Stühler, E; Platsch, G; Weih, M; Kornhuber, J; Kuwert, T; Merhof, D (2011): Multiple discriminant analysis of SPECT data for alzheimer's disease, frontotemporal dementia and asymptomatic controls. In: Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC), 2011 IEEE. 49. Terry, A; Buccafusco, J (2003): The cholinergic hypothesis of age and Alzheimer's disease-related cognitive deficits: recent challenges and their implications for novel drug development. In: J. Pharmacol. Exp. Ther, S. 821–827. 50. Tzourio-Mazoyer, N; Landeau, B; Papathanassiou, D; Crivello, F; Etard, O; Delcroix, N et al. (2002): Automated Anatomical Labeling of Activations in SPM Using a Macroscopic Anatomical Parcellation of the MNI MRI Single-Subject Brain. In: Neuroimage, S. 273–289. 51. van der Flier, W; Scheltens, P (2005): Epidemiology and risk factors of dementia. In: J. Neurol. Neurosurg. Psychiatr, S. v2-7. 52. Wallesch, C: Demenzen. Thieme (2005). 53. Weih, M: Wie war das noch mal? Verlag Hans Huber. Bern (2011). 54. Weih, M; Degirmenci, U; Kreil, S; Lewczuk, P; Schmidt, D; Kornhuber, J; Kuwert, T (2010): Perfusion Imaging with SPECT in the Era of PathophysiologyBased Biomarkers for Alzheimer's Disease. In: Int J Alzheimers Dis, S. 109618. 55. Winblad, B; Palmer, K; Kivipelto, M; Jelic, V; Fratiglioni, L; Wahlund, L-O et al. (2004): Mild cognitive impairment--beyond controversies, towards a consensus: report of the International Working Group on Mild Cognitive Impairment. In: J. Intern. Med, S. 240–246. IX 9 Danksagung Diese Arbeit wäre nicht möglich gewesen ohne die tatkräftige Unterstützung vieler Menschen. Ich möchte mich zuerst bei meinem Doktorvater und Betreuer Prof. Dr. Markus Weih bedanken, der mir jederzeit mit gutem Rat und wichtigen Impulsen zur Seite stand. Ebenso möchte ich mich bei Herrn Professor Kornhuber bedanken, in dessen Klinik die verwendeten Patientendaten erhoben wurden. Ein besonderer Dank geht auch an Dipl. math. Elisabeth Stühler und Prof. Dr. Dorit Merhof von der Universität Konstanz, ohne die dieses Projekt überhaupt nicht zustande gekommen wäre. Vielen Dank für die gute Zusammenarbeit, die Unterstützung und die geduldigen Erklärungen zu den Statistik- und Computer-Verfahren! Bei Herrn Professor Kuwert und Frau Dr. Schmidt aus der Nuklearmedizinischen Klinik der Universität Erlangen möchte ich mich für die Hilfe bei der Sammlung der Datensätze und die freundliche Beratung bei der Auswahl der Patienten bedanken. Ein ganz persönlicher Dank gebührt meinen Eltern und meiner Familie, ohne deren Unterstützung weder mein Medizinstudium noch diese Arbeit möglich gewesen wären. Danke, dass ihr jederzeit hinter mir gestanden und immer an mich geglaubt habt. X 10 Eidesstattliche Erklärung Hiermit erkläre ich, dass ich die vorliegende Arbeit selbständig verfasst und keine anderen als die angegebenen Hilfsmittel benutzt habe. Die Stellen der Doktorarbeit, die anderen Quellen im Wortlaut oder dem Sinn nach entnommen wurden, sind durch Angaben der Herkunft kenntlich gemacht. Dies gilt auch für Zeichnungen, Skizzen, bildliche Darstellungen sowie für Quellen aus dem Internet. Erlangen, den 10.10.2012 Anna Lins