Helicobacter pylori – ein Keim der Magenschmerzen macht
Werbung

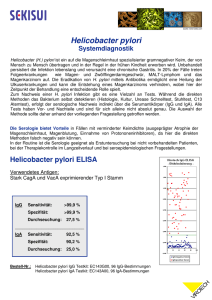
Helicobacter pylori – ein Keim der Magenschmerzen macht Freie Universität Berlin Institut für klinische Physiologie Pathophysiologisches Seminar Wintersemester 2002/2003 Referent: Philip Groth Betreuer: Hanno Tröger _________________________________________________________________________________________ Helicobacter pylori ist ein microaerophiles Bakterium aus der Familie der Helicobacteraceae, Mitglied der Unterklasse der Proteobacteria. Es ist ein spiralförmiges Bakterium mit Geißeln, das hauptsächlich im Magen vorkommt. Erst sehr spät wurde festgestellt, daß es für ein Bakterium tatsächlich möglich ist, unter den unwirtlichen sauren Bedingungen des Magens zu überleben. Dies war die Stunde der Entdeckung von Helicobacter pylori durch Barry Marshall und Robin Warren (Perth, Australien) im Jahre 1983. Es wird für viele schwere Krankheiten wie Verdauungsstörungen, Magen- und Darmgeschwüre, sowie Magenkrebs verantwortlich gemacht. Es ist von der IARC, einer Organisation der WHO, 1994 als Klasse 1 Karzinogen (Karzinogen für Menschen) eingestuft worden. Eine Helicobacter pylori Infektion kommt weltweit vor und hat eine bis zu 80% Prävalenz bei Erwachsenen mittleren Alters in Entwicklungsländern. Bei derselben Zielgruppe in Industrieländern liegt dieser Wert bei 20-50%. Bei solchen Angaben sollte bewußt zwischen ethnischen, altersbedingten und sozioökonomischen Gruppen unterschieden werden. So ist die Prävalenz bei älteren Menschen deutlich höher als bei jungen. Dies liegt am Kohorteneffekt, da die älteren Menschen in ihrer Kindheit („Vulnerabilitätsphase“) schlechteren hygienischen Bedingungen ausgesetzt waren, als dies heutzutage der Fall ist. Es findet also keine langsame Zunahme der Infektionsrate mit der Zeit statt, wie man zunächst glaubte. Bei Menschen mit niedrigem sozioökonomischen Status ist die Prävalenz ebenfalls deutlich höher. Die Infektion erfolgt durch orale Aufnahme des Bakteriums und wird meist innerhalb der Familie in der frühen Kindheit übertragen. Wahrscheinlich erfolgt dies über Erbrochenes, Speichel oder Fäzes, wobei in Entwicklungsländern offenbar auch kontaminiertes Wasser eine Rolle spielt. -1- Das Epithelgewebe des Magens ist durch eine dicke gelartige Schleimschicht (pH=4) vom sauren Magensaft (pH=2) geschützt. Helicobacter pylori dringt mit Hilfe seiner Geißeln in diese Schicht ein und bildet feste Bindungen mit den Epithelzellen mittels Adhesinen (z.B. BabA) aus. In dieser Position beginnt die Hydrolyse von Harnstoff in Kohlenstoffdioxid und Ammoniak + C=O(NH2) + H2O => CO2 + NH4 unter Einwirkung des vom Bakterium mitgebrachten Enzyms Urease. Die Bildung von Ammoniak führt zu Umweltbedingungen (pH=7) unter denen der Keim überleben und sich vermehren kann. Spezielle pH-regulierte Harnstoffkanäle (UreI) in der Zellwand sorgen dafür, daß ein neutraler pH-Wert erhalten bleibt. Nachdem die Lebensbedingungen auf diese Weise gesichert sind, sezernieren die meisten Stämme ein Exotoxin, genannt VacA, welches in die Wand der Epithelzellen eindringt und dort einen hexameren Anionenkanal bildet. Vermutlich dient dieser der Nährstoffversorgung der Bakterien. Es gibt zwar auch Stämme, die ohne VacA auskommen, diese werden aber meist mit einem milderen Krankheitsverlauf in Verbindung gebracht und durch die anderen Stämme leicht kompetitiv verdrängt. Nach dem Einnisten von Helicobacter pylori kommt es schnell zu einer Mageninfektion in praktisch allen Patienten. Die Infektion ruft eine heftige Immunantwort hervor, die anfangs durch Bildung von B- und T-Lymphozyten, später auch durch Plasmazellen und Makrophagen geprägt ist Dies führt zu einer Erhöhung von Zytokinen, vor allem Interleukin-8, aber auch Interleukin1β, Interleukin-2, Interleukin-6 und TNFα. Bei der spezifischen Immunantwort können T-Helferzellen grundsätzlich in zwei funktionelle Gruppen differenzieren: Th1-Zellen, die vor allem Interleukin-2 und Interferon-γ sezernieren, sowie Th2-Zellen mit der Sekretion von Interleukin-4, Interleukin-5 und Interleukin-10. Th1-Zellen differenzieren vermehrt im Rahmen der Abwehr von intrazellulären Erregern, wohingegen Th2-Zellen B-Zellen stimulieren, bei der Immunantwort gegen extrazellulärer Pathogene. Da Helicobacter pylori nicht invasiv ist, sondern sich nur an die äußere Epithelschicht anlagert, wäre eine Th2-Immunantwort zu erwarten, was aber nicht der Fall ist. Vermutlich aufgrund der erhöhten Interleukin-1β Werte in der Umgebung werden statt dessen Th1-Zellen ausgebildet, deren Zytokine eine Gastritis (Magenschleimhautentzündung) hervorrufen, während Th2-Zellen eher schützende und heilende Wirkung bei Magenentzündungen hätten. Es wird angenommen, daß diese fehlgesteuerte Immunantwort in Kombination mit einer vermehrten Apoptose der Helicobacter pylori - spezifischen T-Zellklone zur Persistenz der Infektion beiträgt. -2- Eine Entzündung mit Helicobacter pylori wird häufig zur chronischen Erkrankung bzw. chronischen Infektion, mit wenig Aussicht auf spontane Heilung. Es gilt als gesichert, daß Helicobacter pylori auslösender Faktor für Krankheiten wie chronische Gastritis, Verdauungsstörungen und Atrophie der Magenschleimhaut ist. Zudem gibt es verstärkt Hinweise auf eine Assoziation von Magenkrebs und einer Helicobacter pylori Infektion. In einer kürzlich veröffentlichten prospektiven Studie an 1526 Personen, zeigte sich eine Inzidenz von 2.9 % innerhalb eines Zeitraumes von 7,8 Jahren bei 1246 Patienten, wohingegen es bei den 280 nicht infizierten Kontrollen zu keinem einzigen Fall von Magenkrebs kam.1 Dabei konnte gezeigt werden, daß Helicobacter pylori als Beschleuniger von Zellproliferation eher eine Rolle als Promotor von Karzinogenen besitzt, als ein Karzinogen selbst ist.2 Das Risiko der Entwicklung von Magenlymphomen wird durch eine HPInfektion signifikant erhöht. Erstaunlicherweise gibt es in den Frühstadien dieser Erkrankung hohe Remissionsraten allein durch eine Eradikation des Keimes durch Antibiotika, wobei hierzu noch wenig Langzeiterfahrungen vorliegen und dies deshalb nur innerhalb von Studienprotokollen durchgeführt werden sollte. Aufgrund der hohen Prävalenz von Helicobacter pylori in der Weltbevölkerung ist eine umfassende Eradikation des Bakteriums noch nicht so bald in Sicht, und schon allein aus Kostengründen eher utopisch. So wird auch aufgrund der Kosten angeraten, einen Test auf Helicobacter pylori nur bei dyspeptischen Beschwerden durchzuführen. Die Strategie dabei sieht vor, dass man Patienten unter 45 Jahrenm, ohne Alarmsymptome, ohne Einnahme von magenschädlichen Medikamenten und ohne familiäre Belastung für maligne Erkrankungen im oberen GI-Trakt nichtinvasiv auf Helicobacter pylori testet und im positivem Fall umgehend einer Behandlung zuführt. Ansonsten würde man den Patienten eine endoskopische Untersuchung empfehlen, die auch eine H.P.-Testung beinhaltet aber vor allem in der Lage ist Neoplasien zu diagnostizieren. Übliche Tests sind der Harnstoff-Atemtest, wobei mit dem stabilen Isotop C13 versetzter Harnstoff zugeführt und unter Nutzung der Urease-Aktivität von Helicobacter innerhalb von kurzer Zeit ausgeatmetes C13 gemessen werden kann und somit als Nachweis von Helicobacter pylori Infektionen dient. Weitere Tests sind Blut- oder Stuhltests (Antikörper- bzw. Antigen-Nachweis) oder die Endoskopie mit Biopsie und ebenfalls Nachweis der spezifischen Ureaseaktivität sowie einer immunhistologischen Färbung. Der Atemtest ist schnell, präzise und kostet ca. € 200,- was die Krankenkassen bei Verordnung erstatten. Alle diese Tests haben eine Sensitivität von 89-99% und eine Spezifität von über 90%. 1 2 Uemura et al 2001 New England Journal of Medicine 345:784 Han et al 2002 Journal of Gastroenterology and Hepatology Volume 17 Issue 3 253:261 -3- Medikamente und Behandlungen: Die Eradikation basiert auf dem Prinzip der Säuresekretion in Verbindung mit einer Antibiotikatherapie und muss für mindestens sieben Tage konsequent durchgeführt werden. Die zwei gängigsten Therapieschemata sind (jeweils in Kombination mit 2 x Standarddosis eines Protonenpumpeninhibitors): Italienische Clarithromycin Amoxicillin 7d Tripletherapie 2 x 500mg p.o. 2 x 1g p.o. Französische Clarithromycin Metronidazol 7d Tripletherapie 2 x 250mg p.o. 3 x 400mg p.o . Nach einer vollständigen Eradikation ist die Rückfallrate etwa 6-20% innerhalb der folgenden 6-24 Monate, wobei hier auch Re-Infektionen mögliche Faktoren sind, was die hohen Abweichungen der Literaturwerte erklären kann. Alternativ zu oralen Medikamenten ist es möglich, Wirkstoffe direkt auf die Infektionsherde zu sprühen. Dies wurde bisher nur in kleinen Maßstäben erprobt.3 Eine erneute Therapie bei Versagen der Ersttherapie ist möglich, aber sehr viel langwieriger und kostspieliger als eine erfolgreiche Ersttherapie, auch sind die Nebenwirkungen beträchtlich höher. Die Entdeckung von Helicobacter pylori ist eine der großen Erfolgsgeschichten in der Medizin. Über Jahre hinweg blieb bei schweren Magengeschwüren den Ärzten meist nichts anderes übrig, als den Magen (teilweise) herauszuoperieren. Die Idee, daß es tatsächlich einem Bakterium gelingt, sich unter den unwirtlichen Bedingungen des Magens zu behaupten und die damit einhergehende Entdeckung von Helicobacter pylori läutete in diesem Sinne ein neues Zeitalter ein. Die Behandlungsmethoden heutzutage sind unkompliziert und effizient, auch wenn in verschiedenen Ländern mit unterschiedlichen Wirkstoffen behandelt wird. Allgemein wird in den nächsten Jahren ein weltweit deutlicher Rückgang der Verbreitung des Bakteriums erwartet, aber bis zur weltweiten Eradikation ist es noch ein weiter Weg. Weitere Quellen: • The New England Journal of Medicine, Vol. 347, No.15 • Journal of Gastroenterology and Hepatology, Vol. 14, Issue 11 Vol. 15, Issue 12 Vol. 16, Issues 3,6,8 Vol. 17, Issues 1-6,9 • The Helicobacter Foundation: http://www.helico.com 3 http://www.helico.com/info/treatment/treatment-jichi.htm -4-