Mode der Bewegung, Freiheitsgrade
Werbung

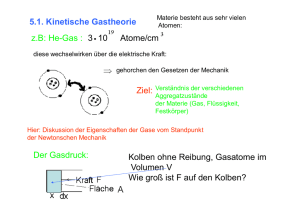
Mode der Bewegung, Freiheitsgrade Bewegungsmoden (normal modes of motion) : Jede UNABHÄNGIGE Bewegungsmöglichkeit der Atome (unabhängig: im quantenmechanischen Sinne durch orthogonale Wellenfunktionen gekennzeichnet Ψn*ΨmdV = δnm ) ∫ Moleküle (siehe Atkins, Physical Chemistry, S. 522): bei N Atomen 3N Koordinaten = Bewegungsmoden zur Verfügung • 3 nötig für Festlegung des Schwerpunktes (Translation des SP) • 3 Winkelgrößen nötig für Festlegung der Orientierung im Raum (bei linearen Molekülen 2 Winkel) entsprechend Rotation des Moleküls • lässt 3N-6 Koordinaten für interne Bewegungen (3N-5 bei linearen Molekülen), die Vibrationen und Rotationen von Subgruppen des Moleküls betreffend. Freiheitsgrad: Faktor, der angibt, wieviel Wärmeenergie die Bewegungsmoden tragen. Bei Translation und Rotation entspricht jeder thermisch aktivierten Bewegungsmode ein Freiheitsgrad, bei Vibrationen sind jeder aktivierten Bewegungsmode zwei Freiheitsgrade zuzuordnen (einer für kinetische, der andere für potentielle Energie). Freiheitsgrade, Gleichverteilungssatz Gleichverteilungssatz: Auf jeden aktivierten Freiheitsgrad entfällt im thermischen Gleichgewicht die gleiche mittlere Energie von ½ kBT. Tests: Ar-Atom. N=3 ⇒ 3 Koordinaten, 3 für SP-Translation, 0 Rotationsmoden, 0 Vibrationsmoden ⇒ 3 Freiheitsgrade, mittlere thermische Energie je Molekül: U = 3·½ kBT. N2-Molekül: N=2 ⇒ 6 Koordinaten, 3 für SP-Translation, 2 aktivierte Rotationsmoden, 3N-5=1 Vibrationsmoden ⇒ 7 Freiheitsgrade, mittlere thermische Energie je Molekül: U = 7·½ kBT. C02-Molekül: N=3 ⇒ 9 Koordinaten, 3 für SP-Translation, 2 aktivierte Rotationsmoden, 3N-6= 3 Vibrationsmoden ⇒ 11 Freiheitsgrade, mittlere thermische Energie je Molekül: U = 11·½ kBT. Anmerkung: Ob Vibrationsmoden bei gegebener Temperatur aktiviert sind, hängt von der Größe des Energiequantums, das zur Anregung der Schwingung aufzubringen ist, ab. Freiheitsgrade beim Festkörper Kristalline Festkörper: Es existieren keine Rotationsmoden. Zahl der Schwingungsmoden: 3N-6≈3N, da N sehr groß ist. Also Zahl der Freiheitsgrade: f=2·3N, da Vibrationen doppelt zu zählen sind. Innere Energie des Kristalls, wenn alle Moden aktiviert sind: U = f·½ kBT= 3NkBT (bekannt als Regel von Dulong-Petit) Freiheitsgrade und die Zustandsgleichung des idealen Gases Geht die Zahl f der Freiheitsgrade in die Zustandsgleichung des idealen Gases ein? Antwort: NEIN Die Gleichung lautet immer: pV = NkBT, mit N: Zahl der Atome/Moleküle Begründung: Die kinetische Gastheorie betrachtet elastische Stöße der Moleküle mit der Wand. Berechnet man die Summe aller Impulsüberträge auf die Wand, so stellt sich heraus, dass man mit der Schwerpunktsbewegung alleine rechnen kann. Die inneren Bewegungen tragen nicht bei. Intensive Größen, extensive Größen Man unterscheidet intensive und extensive Größen: Vorgehen: Man denke sich ein thermodynamisches System in zwei Teile geteilt: Untersystem 1 Untersystem 2 Extensive Größen (Quantitätsgrößen) sind solche, die sich additiv aus den Zahlenwerten der Untersysteme zusammensetzen. Dazu gehören: Volumen V, Gesamtmasse M, elektrische Ladung Q, elektrisches Gesamtdipolmoment Σed, Gesamtenergie, Entropie Intensive Größen (Intensitätsgrößen) sind solche, deren Werte in den Untersystemen und im Gesamtsystem gleich groß sind. Dazu gehören: Druck p, Temperatur T, elektr. Potential Φ, elektrisches Feld E, magnet. Feld H, Masse m und elektrische Ladung q des einzelnen Teilchens, elektr. Dipolmoment jedes einzelnen Atoms ed, Teilchendichte Zustandsgrößen ZUSTANDSGRÖSSEN: Physikalische Größen, deren Wert eindeutig bestimmt ist, wenn man einen thermodynamischen Gleichgewichtszustand betrachtet. Z.B.: Gesamtenergie U (innere Energie N·f·(1/2)kBT) p T V nicht: W (Arbeitsleistung des Gases bei Zustandsänderung) ZUSTANDSÄNDERUNG: Änderung der Zustandsgrößen: dp, dT, dV, ... Der Wert von dp, dT, dV, ... ist eindeutig festgelegt, wenn man den Anfangs- und den Endzustand kennt, und ist unabhängig vom Weg, auf dem man vom Anfangs- in den Endzustand kommt (Analogie: pot. Energie) Bei Größen, die nicht Zustandsgrößen sind, hängt die Änderung von der Prozessführung ab. Man kennzeichnet dies durch die Schreibweise: δW