Special - BIOspektrum
Werbung
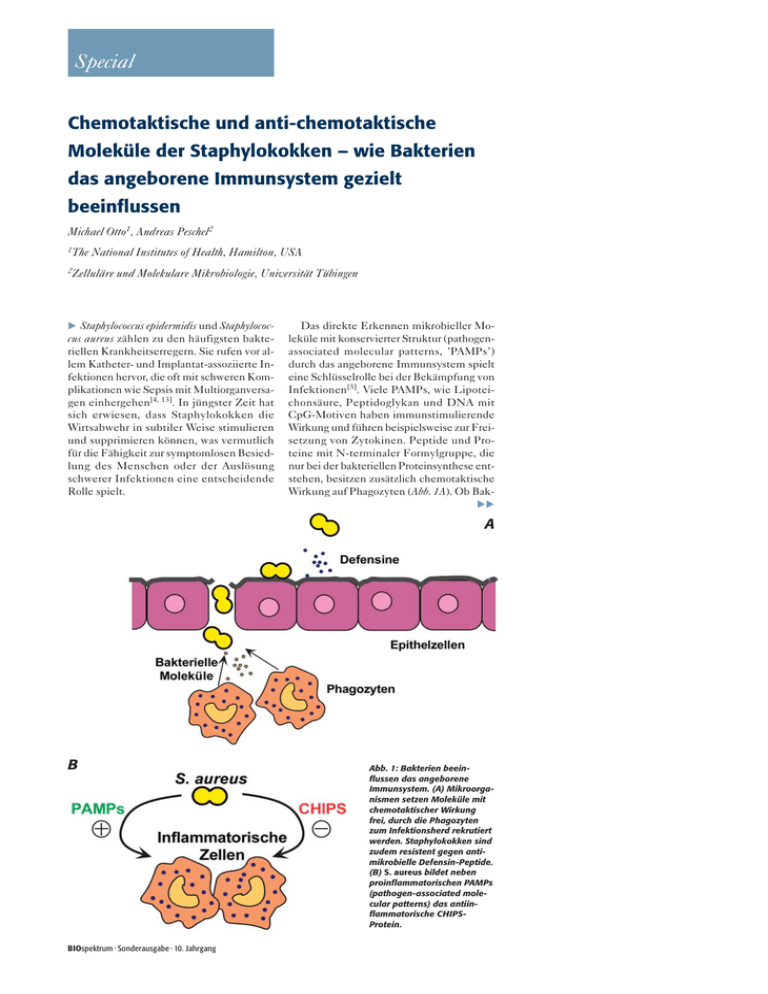
Special Chemotaktische und anti-chemotaktische Moleküle der Staphylokokken – wie Bakterien das angeborene Immunsystem gezielt beeinflussen Michael Otto1, Andreas Peschel2 1The National Institutes of Health, Hamilton, USA 2Zelluläre und Molekulare Mikrobiologie, Universität Tübingen Staphylococcus epidermidis und Staphylococcus aureus zählen zu den häufigsten bakteriellen Krankheitserregern. Sie rufen vor allem Katheter- und Implantat-assoziierte Infektionen hervor, die oft mit schweren Komplikationen wie Sepsis mit Multiorganversagen einhergehen[4, 13]. In jüngster Zeit hat sich erwiesen, dass Staphylokokken die Wirtsabwehr in subtiler Weise stimulieren und supprimieren können, was vermutlich für die Fähigkeit zur symptomlosen Besiedlung des Menschen oder der Auslösung schwerer Infektionen eine entscheidende Rolle spielt. Das direkte Erkennen mikrobieller Moleküle mit konservierter Struktur (pathogenassociated molecular patterns, ’PAMPs’) durch das angeborene Immunsystem spielt eine Schlüsselrolle bei der Bekämpfung von Infektionen[5]. Viele PAMPs, wie Lipoteichonsäure, Peptidoglykan und DNA mit CpG-Motiven haben immunstimulierende Wirkung und führen beispielsweise zur Freisetzung von Zytokinen. Peptide und Proteine mit N-terminaler Formylgruppe, die nur bei der bakteriellen Proteinsynthese entstehen, besitzen zusätzlich chemotaktische Wirkung auf Phagozyten (Abb. 1A). Ob Bak A B BIOspektrum · Sonderausgabe · 10. Jahrgang Abb. 1: Bakterien beeinflussen das angeborene Immunsystem. (A) Mikroorganismen setzen Moleküle mit chemotaktischer Wirkung frei, durch die Phagozyten zum Infektionsherd rekrutiert werden. Staphylokokken sind zudem resistent gegen antimikrobielle Defensin-Peptide. (B) S. aureus bildet neben proinflammatorischen PAMPs (pathogen-associated molecular patterns) das antiinflammatorische CHIPSProtein. Special 526 terien PAMPs auch aktiv und in regulierter Weise freisetzen und ob auch Moleküle mit antiinflammatorischer Aktivität gebildet werden, war bis vor kurzem ungeklärt. Das δ-Toxin S. aureus und S. epidermidis produzieren das hämolytische, porenbildende δ-Toxin[7]. Die Sequenzen der aus 25 Aminosäuren bestehenden Peptide der beiden Arten sind fast identisch. Bakterien sind auf Grund ihrer andersartigen Zellhülle vor der lytischen Wirkung des δ-Toxins geschützt. δ-Toxin besitzt aktivierende und chemotaktische Wirkung auf Granulozyten[10, 11]. Neuere Ergebnisse zeigen, dass δ-Toxin physiko-chemische Ähnlichkeiten zu einer Gruppe von sekretierten, N-terminal formylierten Peptiden aufweist, die als „phenol-soluble modulins“ (PSMs) bezeichnet wurden[6] und deren Rolle in der Pathogenese von Staphylokokken-Infektionen Gegenstand aktueller Forschung ist. PSM-Peptide PSMs wurden ursprünglich bei S. epidermidis als Komplex aus drei unterschiedlichen Peptiden (PSMα, β, und γ) beschrieben. PSMγ ist identisch mit δ-Toxin[6]. Die proinflammatorischen PSM-Peptide führen beispielsweise zur Produktion von Zytokinen durch Aktivierung des PAMP-Rezeptors TLR2[2, 8]. Im Gegensatz zu den meisten anderen sekretierten bakteriellen Proteinen bleibt bei PSM-Peptiden die N-terminale Formylgruppe erhalten, da sie keine Signalpeptide besitzen und auf ungeklärte Weise ausgeschleust werden. Vermutlich beruht darauf ihre chemotaktische Wirkung auf Leukozyten[3, 11]. Die Produktion der PSM-Peptide ist abhängig vom Quorum-Sensing-System agr[12]. S. epidermidis-agr-Mutanten besitzen deshalb eine deutlich herabgesetzte proinflammatorische und chemotaktische Wirkung. Alle PSM-Peptide haben zudem einen negativen Einfluss auf die Biofilmbildung[14], was zur Ablösung von Zellklustern und zur Verbreitung der Infektion führt (Abb. 2). Die PSMPeptide scheinen auf Grund ihrer Doppelfunktion als Kontrolleure von Entzündungen und Biofilmbildung eine entscheidende Rolle unter den wenigen bekannten Virulenzfaktoren von S. epidermidis, wahrscheinlich aber auch bei S. aureus und weiteren Staphylokokken-Spezies, zu spielen. Das CHIPS-Protein S. aureus sekretiert einen neu entdeckten Faktor, der die durch formylierte Peptide Abb. 2: Modell zur Rolle der PSM-Peptide im Verlauf einer Biofilm-assoziierten Infektion. Biofilm-assoziierte Infektionen durchlaufen eine Kolonisierungs-, Biofilm-, und Disseminationsphase. Der Wechsel zwischen planktonischem und Biofilm-Status bringt multiple Veränderungen in Metabolismus und Produktion von Virulenzfaktoren mit sich. Den PSM-Peptiden kommt dabei eine Schlüsselrolle zu. Expression der PSM-Peptide führt vermutlich zu Zellablösung, Verbreitung der Infektion und Anlockung und Aktivierung von Immunzellen. Die Suppression der PSM-Produktion, kontrolliert durch niedrige Aktivität des globalen Regulators agr im Biofilmkörper (Otto et al., unveröffentlicht), ermöglicht hingegen die Ausbildung eines reifen Biofilms, der die typische Resistenz gegen das Immunsystem besitzt. und das Komplement-Spaltprodukt C5a vermittelte Chemotaxis und Aktivierung menschlicher Leukozyten blockieren kann. Das ’CHIPS’ genannte Protein (chemotaxis inhibitory protein of S. aureus) kann die Rekrutierung von neutrophilen Granulozyten zum Infektionsherd blockieren[1], und es scheint die Wirkung von δ-Toxin und PSMPeptiden in gegensätzlicher Weise zu beeinflussen (Abb. 1B). Bislang ist ungeklärt, wie CHIPS genau auf Leukozyten wirkt, wie es reguliert wird und unter welchen Bedingungen es Einfluss auf eine Staphylokokkeninfektion nimmt. Die Tatsache, dass CHIPS auf einer neu entdeckten Pathogenitätsinsel kodiert ist und von 60 Prozent der S. aureus-Stämme gebildet wird, spricht für eine bedeutende Rolle bei Infektionen[1]. Pro- und antiinflammatorische bakterielle Moleküle-Perspektiven Bislang wurde davon ausgegangen, dass es sich bei PAMPs stets um essenzielle bakterielle Moleküle handelt und dass deren Erkennung durch das angeborene Immunsystem nachteilig für Bakterien ist. Die Tatsache, dass Staphylokokken auch nicht-essenzielle PAMPs, wie δ-Toxin und PSM-Peptide, in großen Mengen freisetzen, lässt den Schluss zu, dass Bakterien aus bestimmten Entzündungsreaktionen Nutzen ziehen können. Möglicherweise werden Leukozyten durch Leukozidine effizient inaktiviert und lysiert, während die frei werdenden Nährstoffe den Bakterien zum Wachstum dienen. Die ausgeprägte Resistenz der Staphylokokken gegen die meisten antimikrobiellen Moleküle des Menschen ist hierbei offensichtlich von essenzieller Bedeutung[9, 15, 16]. Unter bestimmten Bedingungen, vor allem in der Frühphase einer Infektion und in Biofilmen, mag es für Bakterien eher von Vorteil sein, unerkannt zu bleiben. Das CHIPS-Protein und die Quorum-SensingKontrolle der PSM-Expression scheinen diesem Zweck zu dienen. Wir beginnen gerade erst zu verstehen, wie PAMPs und ’antiPAMPs’ wie das CHIPS-Protein zusammen spielen. Ob auch andere Pathogene ähnliche Mechanismen nutzen, ist bislang ungeklärt. Es ist jedoch anzunehmen, dass Mikroorganismen ihre eigene inflammatorische Aktivität wesentlich gezielter nutzen und kontrollieren können als bislang angenommen. Wie wir diese Erkenntnis und die neu entdeckten pro- und antiinflammatorischen Moleküle für neue Therapieverfahren nutzen können, wird sich im Rahmen laufender Forschungsprojekte erweisen. BIOspektrum · Sonderausgabe · 10. Jahrgang Special Literatur [1] de Haas, C., Veldkamp, K. E., Peschel, A., Weerkamp, F., van Wamel, W. J., Heezius, E. C., Poppelier, M. J., Van Kessel, K. P., Van Strijp, J. A. (2004): Chemotaxis inhibitory protein of Staphylococ- [11] Somerville, G. A., Cockayne, A., Dürr, M., Peschel, A., Otto, M., Musser, J. M. (2003): Synthesis and deformylation of Staphylococcus aureus deltatoxin are linked to tricarboxylic acid cycle activity. J.Bacteriol. 185:6686–6694. [2] Hajjar, A. M., O’Mahony, D. S., Ozinsky, A., Underhill, D. M., Aderem, A., Klebanoff, S. J., Wilson, C. B. (2001): Cutting edge: functional interac- [12] Vuong, C., Dürr, M., Carmody, A. B., Peschel, A., Klebanoff, S. J., Otto, M. (2004): Regulation of pathogen-associated molecular pattern expression in Staphylococcus epidermidis: quorum sensing determines inflammatory activity and production of phenol-soluble modulins. Cell.Microbiol. 6 (8): 753–759. tions between toll-like receptor (TLR) 2 and TLR1 or TLR6 in response to phenol-soluble modulin. J.Immunol. 166:15–19. [13] Vuong, C., Otto, M. (2002): Staphylococcus epidermidis infections. Microbes.Infect. 4:481–489. [3] Liles, W. C., Thomsen, A. R., O’Mahony, D. S., Klebanoff, S. J. (2001): Stimulation of human neutrophils and monocytes by staphylococcal phenol-soluble modulin. J.Leukoc.Biol. 70:96–102. [14] Vuong, C., H. L. Saenz, F. Götz, M. Otto (2000): Impact of the agr quorum-sensing system on adherence to polystyrene in Staphylococcus aureus. J.Infect.Dis. 182:1688–1693. cus aureus, a bacterial anti-inflammatory agent. J.Exp.Med. 199:687–695. [4] Lowy, F. D. (1998): Staphylococcus aureus infections. N.Engl.J.Med. 339:520–532. [5] Medzhitov, R., Janeway, C. (2000): Innate immunity. N.Engl.J.Med. 343:338–344. [6] Mehlin, C., Headley, C. M., Klebanoff, S. J. (1999): An inflammatory polypeptide complex from Staphylococcus epidermidis: isolation and characterization. J.Exp.Med. 189:907–918. [7] Otto, M., Götz, F. (2000): Analysis of quorum sensing activity in staphylococci by RP-HPLC of staphylococcal delta-toxin. Biotechniques 28:1088, 1090, 1092, 1096. [8] Otto, M., O’Mahony, D. S., Guina, T., Klebanoff, S. J. (2004): Activity of Staphylococcus epidermidis phenol-soluble modulin (PSM) peptides expressed in Staphylococcus carnosus. J.Infect.Dis. 190 (4): 748–755. [9] Peschel, A., Jack, R. W., Otto, M., Collins, L. V., Staubitz, P., Nicholson, G., Kalbacher, H., Nieuwenhuizen, W. F., Jung, G., Tarkowski, A., van Kessel, K. P. M., van Strijp, J. A. G. (2001): Staphylococcus aureus resistance to human defensins and evasion of neutrophil killing via the novel virulence factor MprF is based on modification of membrane lipids with L-lysine. J.Exp.Med. 193:1067–1076. [10] Schmitz, F. J., Veldkamp, K. E., Van Kessel, K. P., Verhoef, J., Van Strijp, J. A. (1997): Delta-toxin from Staphylococcus aureus as a costimulator of human neutrophil oxidative burst. J.Infect.Dis. 176:1531–1537. BIOspektrum · Sonderausgabe · 10. Jahrgang [15] Vuong, C., Voyich, J. M., Fischer, E. R., Braughton, K. R., Whitney, A. R., DeLeo, F. R., Otto, M. (2004): Polysaccharide intercellular adhesin (PIA) protects Staphylococcus epidermidis against major components of the human innate immune system. Cell.Microbiol. 6 (3): 269–275. [16] Weidenmaier, C., Kokai-Kun, J. F., Kristian, S. A., Chanturyia, T., Kalbacher, H., Gross, M., Nicholson, G., Neumeister, B., Mond, J. J., Peschel, A. (2004): Role of teichoic acids in Staphylo- coccus aureus nasal colonization, a major risk factor in nosokomial infections. Nat.Med. 10:243–245. Korrespondenzadressen: Michael Otto Laboratory of Human Bacterial Pathogenesis Rocky Mountain Laboratories The National Institutes of Health 903 S 4th Street Hamilton, MT 59840, USA [email protected] Andreas Peschel Zelluläre und Molekulare Mikrobiologie Medizinische Mikrobiologie und Hygiene Universität Tübingen Elfriede-Aulhorn-Str. 6 D-72076 Tübingen [email protected]