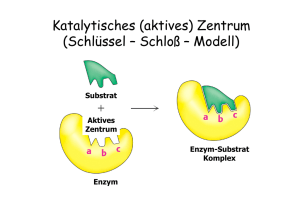
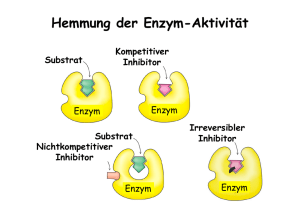
Enzym-Kinetik (Abb. 1) Das Thema der heutigen Vorlesung ist die
Werbung

1 Enzym-Kinetik (Abb. 1) Das Thema der heutigen Vorlesung ist die Kinetik isolierter und gereinigter Enzyme zum Verständnis ihrer Reaktionsmechanismen. Wie ich schon erwähnte, ist die Geschwindigkeit (V) einer monomolekularen, unkatalysierten chemischen Reaktion proportional zu der Konzentration des Ausgangstoffes (einklammerter S), und der Geschwindigkeitskonstante (k). Weil die gleichzeitige Bestimmung der im Laufe der Reaktion fortlaufend sinkenden Reaktionsgeschwindigkeit und der Konzentration des reagierenden Stoffes keine einfache Aufgabe ist, beschäftigt sich die Reaktionskinetik im Allgemeinen mit der Abhängigkeit der Anfangsgeschwindigkeit der Reaktion (V0) von der anfänglichen Konzentration des reagierenden Stoffes (einklammerter S), die man kennt, und in einer Versuchsserie nach Belieben variieren kann. In einem Koordinatensystem bei dem die Abszissenachse die anfängliche Konzentration des Ausgangstoffes, und die Ordinatenachse die Anfangsgeschwindigkeit der Reaktion repräsentieren, erscheint die betreffende Gleichung als eine, aus dem Origo ausgehende Gerade, deren Steigung mit dem Wert der Geschwindigkeitskonstante der Reaktion übereinstimmt. Es stellte sich aber heraus, dass bei enzymatischen Reaktionen dies nicht der Fall ist. Zwar wird die Anfangsgeschwindigkeit (V0) immer größer und größer während man die anfängliche Substratkonzentration erhöht, aber nicht nach einer Gerade, sondern nach einer als Sättigungskurve bezeichnete Hyperbole. Je größer die Anfangskonzentration des Substrats ist desto weniger kann ihre weitere Erhöhung die Anfangsgeschwindigkeit weiter erhöhen. Schließlich wird eine maximale Anfangsgeschwindigkeit (Vmax) erreicht. Später werden sie sehen, dass die maximale Anfangsgeschwindigkeit bei enzymkinetischer Analyse des Mechanismus von enzymatischen Reaktionen ein wichtiger Faktor ist. 2 Aus der Analyse solcher Kurven wurde festgestellt, dass die Anfangsgeschwindigkeit der mit blauer Farbe dargestellten dreiphasigen monomolekularen enzymatischen Reaktion nicht zu der Substratkonzentration proportional ist, sondern zu der Konzentration des Enzym-Produkt-Komplexes [EP], und die partiale Geschwindigkeitskonstante seiner Spaltung (k3) stimmt mit der Geschwindigkeitskonstante der Gesamtreaktion überein. Im Allgemeinen kann man die folgenden feststellen: Erstens, die Gesamtgeschwindigkeit einer enzymatischen Reaktion ist immer zu der Konzentration desjenigen Zwischenprodukts proportional, dessen Weiteränderung am langsamsten ist. In der allgemeinen Reaktionsgeschwindigkeit-Gleichung ist die Konzentration des geschwindigkeitsbestimmenden Zwischenprodukts mit [Zg] symbolisiert. Zweitens, die Geschwindigkeitskonstante der langsamsten Weiteränderung stimmt mit der Geschwindigkeitskonstante der Gesamtreaktion überein. Diese ist in der rotfarbigen Gleichung der allgemeinen Reaktionsgeschwindigkeit mit kkat symbolisiert. Weiterhin stellte es sich heraus, dass diese Feststellungen für eine relativ lange Zeit gelten, abgesehen von einer unmessbar kurzen Anfangsperiode, in der das Enzym mit dem Substrat gesättigt wird. Nach der Anfangsperiode stellt nämlich für eine relativ lange Zeit ein dynamisches Gleichgewicht zwischen der Entstehung und der Weiteränderung des Geschwindigkeit-bestimmenden Zwischenprodukts ein, das auf Deutsch als Fliessgleichgewicht, auf Englisch als "steady state" bezeichnet ist. Während der Fliessgleichgewicht-Periode bleibt die Konzentration aller Zwischenprodukte konstant, auch die Konzentration des Geschwindigkeit-bestimmenden Zwischenprodukts. Daher bleibt die Geschwindigkeit der Gesamtreaktion während der Fliessgleichgewicht-Periode konstant, und gleich der Anfangsgeschwindigkeit. 3 (Abb. 2) Die experimentelle Bestimmung der Konzentration des Geschwindigkeit-bestimmenden Zwischenprodukts ist im Algemeinen eine schwierige Aufgabe, manchmal kann es gar nicht verwirklicht werden. Deshalb leiteten Michaelis und Menten eine Gleichung ein, die nur bekannte oder einfach messbare Faktoren wie die Anfangsgeschwindigkeit, V0, die maximale Anfangsgeschwindigkeit, Vmax, die anfängliche Substratkonzentration eingeklammerter [S], und die so genannte Michaelis-Konstante Km enthält. Diese Konstante ist eine Kombination der partialen Geschwindigkeitskonstanten der einzelnen Phasen der enzymatischen Reaktionen. Bei der dargestellten monomolekularen, zweiphasigen, enzymatischen Reaktion ist die MichaelisKonstante gleich k2 plus k-1 per k1. Der Wert der Michaelis-Konstante variiert sich erheblich von Enzym zu Enzym wie in der projizierten Tabelle zu sehen ist. Wenn man den Ausdruck, V0 gleich Vmax/2, in die Michaelis-MentenGleichung einsetzt, bekommt man nach Vereinfachung und Umänderung, dass die Michaelis-Konstante, Km, gleich derjenigen Substrat-Konzentration ist, bei der die Anfangsgeschwindigkeit (V0) genau die Hälfte der maximalen Anfangsgeschwindigkeit (Vmax) ist. Bei sehr niedrigen Substratkonzentrationen, wobei die Michaelis-Konstante viel größer als sie ist, kann sie in dem Nenner der MichaelisMenten-Gleichung vernachlässigt werden. So ergibt sich anstatt der hyperbolischen Sättigungskurve eine lineare Abhängigkeit der Anfangsgeschwindigkeit von der Substratkonzentration mit einer Steigung von Vmax/Km. Bei sehr hohen Substrat-Konzentrationen, wobei die Michaelis-Konstante viel kleiner als sie ist, kann die Michaelis-Konstante in der Michaelis-MentenGleichung vernachlässigt werden. So ergibt sich nach Vereinfachung, dass die Anfangsgeschwindigkeit, unabhängig von der Veränderung der Substratkonzentration, immer gleich Vmax ist. Mit der Ausnahme der 4 regulatorischen Enzyme, die später diskutiert werden, gehorchen alle Enzyme der Michaelis-Menten-Kinetik, unabhängig von ihren Mechanismen. (Abb. 3) Damit die Michaelis-Menten-Gleichung für die Praxis einfacher verwendet werden kann, wird sie verschiedenartig transformiert. Die am häufigsten verwendete Transformation besteht in der Inversion ihrer beiden Seiten. Nach Umformung und Vereinfachung erhält man die so genannte Lineweaver-BurkGleichung. Wenn man diese Gleichung in einem Koordinatensystem darstellt, dessen Abszissenachse den Kehrwert der anfänglichen Substratkonzentration und die Ordinatenachse den Kehrwert der Anfangsgeschwindigkeit repräsentieren, bekommt man eine Gerade. Die Steigung dieser Gerade ist Km /Vmax, sie schneidet die Ordinatenachse bei 1/Vmax und die Abszissenachse bei -1/Km. Die Lineweaver-Burk-Gerade einer beliebigen enzymatischen Reaktion kann experimentell folgenderweise aufgenommen werden. Man bestimmt die Anfangsgeschwindigkeit der fraglichen enzymatischen Reaktion bei zwei, voneinander weit liegenden Substratkonzentrationen. Danach zeichnet man die Kehrwerte der gemessenen Anfangsgeschwindigkeiten gegen die Kehrwerten der entsprechenden Substratkonzentrationen in das Lineweaver-BurkKoordinatensystem ein, und zieht eine Gerade durch diese zwei Punkte. Die Kehrwerte der Michaelis-Konstante und der maximalen Anfangsgeschwindigkeit können Sie von dem bekommenen Diagramm ablesen. (Abb. 4) Erinnern Sie sich daran, dass die Anfangsgeschwindigkeit irgendeiner enzymatischen Reaktion zu der Konzentration des Geschwindigkeitbestimmendes Zwischenprodukts [eingeklammerter Zg] und der allgemeinen Geschwindigkeit-Konstante (kkat) proportional ist. Es wurde auch diskutiert, dass im Falle von großem Substratüberschuss die Anfangsgeschwindigkeit mit der maximalen Anfangsgeschwindigkeit, Vmax, übereinstimmt. Darüber hinaus ist bei großem Substratüberschuss das Enzym mit dem Geschwindigkeit-bestimmenden 5 Zwischenprodukt gesättigt, daher ist Konzentration des Enzyms eingeklammerter [Et] mit der Konzentration dieses Zwischenprodukts gleich. Mit Berücksichtigung der so bekommenen schwarzen Gleichungen umwandelt sich die allgemeine Reaktionsgeschwindigkeit-Gleichung zu Vmax gleich mit kkat multiplizierter Enzymkonzentration ist. Setzt man dies in die Michaelis-Menten-Gleichung ein, bekommt man die blaue Gleichung und nach Umformung die braune Gleichung. Mit Hilfe dieser Gleichung kann man den Wert der Geschwindigkeitskonstante der allgemeinen Reaktionsgeschwindigkeit-Gleichung ausrechnen, wenn man die Anfangsgeschwindigkeit bei einer bekannten, großen Substratkonzentration bestimmt, und die Enzymkonzentration und den Wert der Michaelis-Konstante kennt. Diese Geschwindigkeitskonstante wird als Wechselzahl, auf English "turnover number" bezeichnet. Sie ist gleich derjenigen Zahl der der Substratmoleküle, die in einer Sekunde von einem einzigen Enzymmolekül zu Produktmolekülen überführt werden können, wenn das Enzym mit dem Substrat gesättigt ist. Die Wechselzahl variiert von einem Enzym zu dem anderen erheblich. Ein einziges Katalase-Molekül kann zum Beispiel 40 Millionen Wasserstoffperoxyd-Moleküle in einer Sekunde zu Sauerstoff-Molekülen und Wassermolekülen zersetzen. Dies ist eine unglaublich große Zahl. Dagegen hydrolysiert ein Molekül eine Art ATP-ase nur 0.4 ATP-Moleküle in einer Sekunde. Der beste Parameter für den Vergleich der katalytischen Wirksamkeit von unterschiedlichen Enzymen ist das Verhältnis ihrer kkat und Km Werte. Dieses Verhältnis kann für eine beliebige enzymatische Reaktion mit einem Experiment bestimmt werden, in dem man die Anfangsgeschwindigkeit bei einer bekannten, sehr niedrigen Substratkonzentration bestimmt. In diesem Fall kann nämlich die Substratkonzentration im Nenner der blaufarbigen Gleichung vernachlässigt 6 werden. Dadurch umändert sich diese Gleichung zu der grünfarbigen Gleichung, in der sowohl die Anfangsgeschwindigkeit, als auch die Konzentrationen vom Substrat und Enzym bekannt sind. Für den Vergleich-Parameter kkat/Km existiert ein oberer Grenzwert zwischen 108 und 109, der von derjenigen Geschwindigkeit bestimmt wird, mit der die Substratmoleküle in wässriger Lösung durch Diffusion die Enzymmoleküle erreichen. Enzyme, deren kkat/Km Werte in der Nähe dieses Grenzwertes liegen, umändern die durch Diffusion zu ihnen gelieferten Substratmoleküle sofort zu Produktmolekülen. Solche Enzyme nennen wir katalytisch perfekt. Wie Sie an der projizierten Tabelle ablesen können, erreichen Enzyme mit sehr unterschiedlichen kkat und Km Werten beinahe diesen Grenzwert. (Abb. 5) In bimolekularen enzymatischen Reaktionen bindet jedes Enzymmolekül zwei Substratmoleküle, wie Hexokinase ein ATP-Molekül und ein D-Glucose-Molekül bei der bereits erwähnten Bildung von D-Glucose-6-Phosphat. Je nach der Reihenfolge der Substratsbindung können bimolekulare enzymatische Reaktionen auf unterschiedlichen Wegen fortschreiten. Auf dem Weg mit zufälliger Reihenfolge werden beide Substrate, S1 und S2, von dem Enzym mit ähnlicher Wahrscheinlichkeit reversibel gebunden. Dann kann die reversible Bindung des anderen Substrats erfolgen, unter Bildung eines ternären EnzymSubstrat-1-Substrat-2-Komplexes, ES1S2. Schließlich zerfällt dieser Komplex zu dem Enzym und den beiden Produkten. Auf dem Weg mit geordneter Reihenfolge kann das Enzym nur Substrat-1 binden, Substrat-2 aber nicht. Der Enzym-Substrat-1-Komplex kann danach Substrat-2 binden, der entstehende ternäre Enzym-Substrat-1-Substrat-2-Komplex spaltet sich schließlich zu dem Enzym und den Produkten. Bei der geordneten Reihenfolge gibt es einen Reaktionsweg ohne die Bildung eines ternären Enzym-Substrat-1-Substrat-2-Komplexes. Bei einer solchen 7 bimolekularen Reaktion umändert sich der Enzym-Substrat-1-Komplex zu einem Enzym-Produkt-1-Komplex, in dem das Enzym eine persistente Veränderung erträgt. Dieser Komplex zerfällt dann zu Produkt-1 und dem veränderten Enzym, das nur Substrat-2 binden kann, Substrat-1 aber nicht mehr. Schließlich zerfällt der Enzym-Produkt-2-Komplex zu Produkt-2 und dem originalen Enzym. Es kann vorkommen, dass die persistente Veränderung des Enzyms darin besteht, dass ihm Substrat-1 bei seiner Umwandlung zu Produkt-1 eine funktionelle Gruppe überträgt. Das so veränderte Enzym seinerseits überträgt diese funktionelle Gruppe an Produkt-2 bei dem Zerfall des Enzym-Substrat-2-Komplexes. Man bezeichnet einen solchen Reaktionsverlauf als Ping-Pong-Mechanismus. Ob bei einer bimolekularen enzymatischen Reaktion ein ternärer EnzymSubstrat-1-Substrat-2-Komplex entsteht, kann man mit der folgenden Versuchsserie ermitteln. Bei Konstanthalten der Enzymkonzentration und der Konzentration von Substrat-2, verändert man die Konzentration von Substrat-1, und bestimmt die dadurch erzeugte Veränderung der Anfangsgeschwindigkeit. Dieser Vorgang wird danach bei drei anderen Konzentrationen von Substrat-2 wiederholt. Bei der doppeltreziproken Darstellung der bekommenen Ergebnisse erhält man 4 Geraden. Wenn sie sich in einem gemeinsamen Punkt schneiden, so handelt es sich um die Entstehung eines ternären Enzym-Substrat-Komplexes. Parallele Geraden weisen auf einen Ping-Pong-Mechanismus hin. (Abb. 6) Weitere Informationen zur Aufklärung des Mechanismus enzymatischer Reaktionen kann man durch Analyse des Einflusses von EnzymInhibitoren auf ihre Kinetik bekommen. Enzymatische Inhibition, die häufig als enzymatische Hemmung bezeichnet ist, hat zwei Klassen: reversible und irreversible. Reversible Inhibition ihrerseits kann kompetitiv, unkompetitiv oder gemischt sein. 8 Der chemische Aufbau und die räumliche Anordnung eines reversiblen, kompetitiven Inhibitors ist denen des Substrats ähnlich. Deshalb konkurriert der Inhibitor mit dem Substrat um das aktive Zentrum des Enzyms. Eine Anzahl der Enzym-Moleküle bilden mit Inhibitor-Molekülen im Rahmen eines dynamischen Gleichgewichts Enzym-Inhibitor-Komplexe. Während ihrer Lebenszeit kann ihr Enzym-Teil mit dem Substrat nicht reagieren. Dadurch wird die Konzentration des funktionsfähigen Enzyms gesenkt und die enzymatische Reaktion verlangsamt. Es wurde theoretisch abgeleitet, und experimentell bewiesen, dass die Michaelis-Menten-Gleichung für die reversible, kompetitive Inhibition die blaufarbige Gestalt annimmt, in der im Vergleich mit der originalen Gleichung die Michaelis-Konstante der nicht-inhibierten Reaktion mit einem Faktor (α) multipliziert wird. Wie man von der für diesen Fall geltenden Lineweaver-BurkGleichung ablesen kann, ist der Kehrwert von Vmax unabhängig von dem Faktor α; das Km/Vmax Verhältnis, das heisst die Steigung der Lineweaver-Burk-Gerade ist aber mit α multipliziert. Die mit α multiplizierte Michaelis-Konstante ist als scheinbare MichaelisKonstante bezeichnet. Bei großem Substratüberschuss ist die Substratkonzentration viel größer als die scheinbare Michaelis-Konstante, die daher in dem Nenner der umgestalteten Michaelis-Menten-Gleichung vernachlässigt werden kann. So ergibt sich nach Vereinfachung, dass die Anfangsgeschwindigkeit bei großer Substratkonzentration gleich der maximalen Anfangsgeschwindigkeit (Vmax) ist. Ob eine Enzym-Inhibition reversibel und kompetitiv ist, kann man mit dem folgenden Experiment ermitteln. Man nimmt das Lineweaver-Burk-Diagramm einerseits ohne den Inhibitor, andererseits mit zwei unterschiedlichen InhibitorKonzentrationen auf, unter Konstanthaltung der Enzymkonzentration. Bei kompetitiver, reversibler Enzym-Inhibition besitzen die drei bekommenen Geraden unterschiedliche Steigungen, und schneiden sich im gleichen Punkt, der an der 9 Ordinatenachse liegt. Man kann den Wert von α bei einer reversibel und kompetitiv inhibierten, enzymatischen Reaktion dadurch ausrechnen, dass man die Steigung ihrer Lineweaver-Burk-Gerade mit der Steigung der Lineweaver-Burk-Gerade der nicht-inhibierten Reaktion dividiert. (Abb. 7) Der chemische Aufbau eines reversiblen und unkompetitiven Inhibitors ähnelt dem chemischen Aufbau des Substrats nicht. Daher kann er sich an das aktive Zentrum des Enzyms nicht binden, besitzt aber eine eigene Bindungsstelle an dem Enzym. Trotzdem kann er sich an das substratfreie Enzym nicht binden, sondern nur an einem Enzym-Substrat-Komplex. Der entstehende Enzym-Substrat-Inhibitor-Komplex verhindert für seine Lebenszeit die Umwandlung des Substrats zu Produkt, und dadurch verlangsamt die Reaktion. Es wurde theoretisch abgeleitet und experimentell bewiesen, dass die Michaelis-Menten-Gleichung für die reversible, unkompetitive Inhibition die blaufarbige Gestalt annimmt, in der die Konzentration des Substrats in dem Nenner der Gleichung mit einem Faktor, markiertem α', multipliziert ist. Wie man an der für diesen Fall geltenden Lineweaver-Burk-Gleichung ablesen kann, ist das Km/Vmax Verhältnis, das heisst die Steigung der Lineweaver-Burk-Gerade unabhängig von markiertem α', der Kehrwert von Vmax ist aber mit ihm multipliziert. Die mit markiertem α' multiplizierte Substratkonzentration ist als scheinbare Substratkonzentration bezeichnet. Bei großem Substratüberschuss ist die scheinbare Substratkonzentration viel größer als die Michaelis-Konstante; sie kann daher in dem Nenner der umgestalteten Michaelis-Menten-Gleichung vernachlässigt werden. So ergibt sich nach Vereinfachung, dass die Anfangsgeschwindigkeit bei großem Substrat-Überschuss gleich der maximalen Anfangsgeschwindigkeit per markiertem α' ist. 10 Ob eine Enzym-Inhibition reversibel und unkompetitiv ist, kann mit dem folgenden Experiment ermittelt werden. Man nimmt das Lineweaver-BurkDiagramm einerseits ohne den Inhibitor, andererseits mit zwei unterschiedlichen Inhibitor-Konzentrationen, unter Konstanthaltung der Enzymkonzentration auf. Wenn man drei Geraden mit gleicher Steigung bekommt, die sowohl die Ordinatenachse als auch die Abszissenachse in unterschiedlichen Punkten schneiden, handelt es sich um eine unkompetitive, reversible Inhibition. Erinnern Sie sich daran, dass bei der kompetitiven, reversiblen Inhibition die entsprechenden Geraden unterschiedliche Steigungen haben. Man kann den Wert von markiertem α' einer reversibel und unkompetitiv inhibierten Reaktion dadurch ausrechnen, dass man den Ordinatenwert des Punktes wo ihre Lineweaver-Burk-Gerade die Ordinatenachse schneidet mit dem Ordinatenwert desjenigen Punktes dividiert, wo die Lineweaver-Burk-Gerade der nicht-inhibierten Reaktion die Ordinatenachse schneidet. (Abb. 8) In Ähnlichkeit mit einem reversiblen unkompetitiven Inhibitor besitzt ein reversibler, gemischter Inhibitor eine eigene Bindungsstelle an das Enzym. In Gegenteil zu einem reversiblen, unkompetitiven Inhibitor kann sich ein reversibel, gemischter Inhibitor sowohl an den Enzym-Substrat-Komplex unter Bildung eines ternären Enzym-Substrat-Inhibitor-Komplexes, als auch an das substratfreies Enzym unter Bildung eines Enzym-Inhibitor-Komplexes binden. Dieser Komplex kann dann entweder zu Enzym und Inhibitor zerfallen, oder durch Anbindung eines Substratmoleküls zu dem Enzym-Substrat-Inhibitor-Komplex umändern. So entsteht ein Enzym-Substrat-Inhibitor-Kreislauf, mit einem Ausgang in Richtung der Produktbildung. Die für diesen Fall umgestaltete Michaelis-Menten-Gleichung enthält in ihrem Nenner zwei Faktoren: Einer davon multipliziert die Michaelis-Konstante der nicht-inhibierten Reaktion, der andere die Substratkonzentration. Wenn man 11 das Lineweaver-Burk-Diagramm einerseits ohne den Inhibitor, andererseits mit zwei unterschiedlichen Inhibitor-Konzentrationen beim Konstanthalten der Enzymkonzentration aufnimmt, bekommt man drei Geraden mit unterschiedlichen Steigungen, die im Gegensatz zu der reversiblen und kompetitiven Inhibition unterschiedliche Steigungen haben, und im Gegensatz zu der kompetitiven Inhibition, sich nicht an der Ordinatenachse des Koordinatensystems schneiden. Die Werte von α beziehungsweise α' können ebenso ausgerechnet werden, wie bei der kompetitiven beziehungsweise unkompetitiven Inhibition. (Abb. 9) Ein irreversibler Inhibitor bildet eine sehr stabile kovalente Bindung mit einer der funktionellen Gruppen in dem aktiven Zentrum des Enzyms, oder zerstört dort eine der essenziellen funktionellen Gruppen. Ein kovalent bindender Inhibitor kann nützliche Information bezüglich des enzymatischen Reaktionsmechanismus liefern. Mit seiner Hilfe können nämlich Aminosäurereste mit Schlüsselposition in dem aktiven Zentrum des Enzyms dadurch ermittelt werden, dass man nach Inhibition das Enzym hydrolysiert, und diejenige Aminosäure identifiziert, mit der der Inhibitor kovalent verknüpft ist. Zum Beispiel wurde die Schlüsselposition von Serin in Chymotrypsin mittels Diisopropylfluorophosphat ermittelt, das eine kovalente Bindung nur mit Serin herstellen kann. Eine besondere Klasse der irreversiblen Inhibition ist die so genannte Selbstmord-Inhibition. Ein Selbsmord-Inhibitor ist ein modifiziertes Substrat das zuerst reversibel und kompetitiv in dem aktiven Zentrum des Enzyms gebunden wird. Der entstehende Enzym-Inhibitor-Komplex wird danach durch den normalen enzymatischen Mechanismus in das normale Produkt und eine sehr reaktionsfähige Verbindung überführt, die sich irreversibel an eine essentielle funktionelle Gruppe in dem aktiven Zentrum des Enzyms bindet, oder sie zerstört. Die Wirkungsweise einiger neuer Arzneimittel beruht auf der Selbstmord-Inhibition. Solche Arzneimittel wurden in der Kenntnis der betreffenden Reaktionsmechanismen 12 erarbeitet. Ein gutes Selbstmord-Inhibitor-Arzneimittel ist nur für ein einziges Enzym spezifisch, und verursacht wenige Nebenwirkungen. (Abb. 10) Was die Abhängigkeit der Enzymaktivität von dem pH-Wert betrifft, besitzt jedes Enzym einen optimalen pH-Wert. Ist der pH-Wert seiner Umgebung höher oder niedriger, nimmt seine Aktivität ab. Das pH-Optimum von den meisten Enzymen liegt in dem beinahe neutralen pH-Bereich, wie das der Glucose-6-Phosphatase. Einige Enzyme haben aber ihr pH-Optimum bei extremen pH-Werten, wie das Verdauungsenzym Pepsin, bei etwa pH 1,5. Der Grund für die pH-Abhängigkeit der Enzyme ist, dass Seitenketten einiger Aminosäureresten in ihren aktiven Zentren schwache Säuren oder Basen mit unterschiedlichem pHOptimum sind. Diese Seitenketten dissoziieren bei unterschiedlichen pH-Werten in unter-schiedlichen Massen. Dies beeinflusst die räumliche Anordnung der funktionellen Gruppen in dem aktiven Zentrum des Enzyms, und dadurch seine Aktivität.