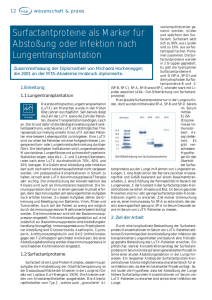
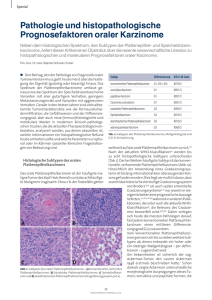
Nicht-bronchioloalveoläre Adenokarzinome und großzellige
Werbung

Aus dem Institut für Pathologie der Ruhr-Universität Bochum Prof. Dr. med. A. Tannapfel Nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge Prognostische Faktoren für das 5-Jahres-Überleben unter Berücksichtigung der SP-A Expression der Tumoren Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Tina Bellgardt aus Herne 2008 Dekan: Prof. Dr. med. Gert Muhr Referent: Prof. Dr. med. Josune Guzman y Rotaeche Korreferent: PD Dr. med. A. M. Müller Tag der mündlichen Prüfung: 21.10.2008 II Abstract Hintergrund: In dieser Arbeit soll die Surfactant Protein A Expression bei nicht-bronchioloalveolären Adenokarzinome und großzelligen Karzinome adenoider Herkunft der Lunge hinsichtlich ihrer prognostischen Bedeutung untersucht werden. Weiterhin sollen bei diesen Karzinomen die Parameter Histologie, Tumorstadium, Operationsausmaß, Alter, Geschlecht und Nikotinkonsum hinsichtlich ihrer prognostischen Bedeutung untersucht werden. Methode: Die untersuchten Karzinome der Lunge stammten aus dem Einsendegut der Ruhrlandklinik Essen an die Abteilung für Pathologie der Ruhr-Universität Bochum aus dem Zeitraum von 1992 bis 1997. Die erneute Klassifikation der untersuchten Bronchialkarzinome erfolgte in Anlehnung an die pathomorphologische Klassifikation der malignen epithelialen Lungentumoren der WHO von 1999. Daraufhin wurde bei allen Adenokarzinomen, die keine bronchioloalveolären Elemente enthielten, und bei allen großzelligen Karzinomen adenoider Herkunft die SP-A Expression der Tumorzellen immunhistochemisch bestimmt. Über die Patienten wurden via Akteneinsicht folgende Daten ermittelt: Geschlecht, Alter des Patienten zum Zeitpunkt der Operation, pTNM Stadium, Tumorstadium, Lokalisation des Tumors, Art der Operation, Nikotinabusus mit Angabe der Anzahl der Packyears, Angabe einer präoperativ durchgeführten Chemo- oder Strahlentherapie, Vorhandensein eines Zweittumors. Die 5-Jahres-Überlebenskurven wurden mit Kaplan-Meier-Methodik dargestellt. Die Unterschiede zwischen den Gruppen wurden mit dem Lok-Rang-Test geschätzt. Eine multivariate Analyse wurde mit der Regressionsanalyse nach Cox durchgeführt. Ergebnisse: Es wurden insgesamt 178 primären Karzinomen der Lunge ausgewertet. Dabei handelte es sich um 108 nicht-bronchioloalveoläre Adenokarzinome (darunter 50 azinäre (46,3%), 21 solide (19,4%), 19 vom gemischten Zelltyp (17,6%), 14 papilläre (13,0%), 4 schleimbildende (3,7%)) und 70 großzellige Karzinome adenoider Herkunft (darunter 4 Karzinome (5,7%), die der klarzelligen Variante des großzelligen Karzinoms zuzurechnen waren). Unter den Adenokarzinomen zeigten 41 (38,0%) eine positive SP-A Reaktion, unter den großzelligen Karzinomen zeigten 19 (27,1%) Fälle eine Expression von SP-A. In der Regressionsanalyse nach Cox zeigten sich für das Tumorstadium, das Operationsausmaß, das Alter und die Rauchgewohnheiten jeweils signifikante Werte. So haben Patienten mit Pneumektomie ein signifikant schlechteres 5-Jahres-Überleben im Vergleich zu Patienten, bei denen kleinere Eingriffen durchgeführt wurden. Patienten, die bei der Durchführung der Tumoroperation älter als 69 Jahre waren zeigen ein signifikant besseres 5-Jahres-Überleben als jüngere Patienten. Patienten, die rauchten, zeigten ebenfalls ein signifikant besseres 5-JahresÜberleben. Hingegen zeigten die Kovarianten Histologie und Geschlecht keine signifikante Bedeutung. Die Patienten mit SP-A positiven Karzinomen haben in dieser Arbeit ein tendenziell (pWert nicht signifikant) schlechteres 5-Jahres-Überleben. Schlussfolgerungen: In der vorliegenden Arbeit konnten wir zeigen, dass primäre Adenokarzinome der Lunge, die kein bronchioloalveoläres Wachstumsmuster zeigen, SP-A exprimieren können. Wir konnten ebenfalls zeigen, dass ein Teil der primären großzelligen Karzinome der Lunge adenoider Herkunft SP-A exprimieren können. Die Patienten mit SP-A positiven Karzinomen haben in dieser Arbeit ein tendenziell schlechteres 5-Jahres-Überleben. Die Faktoren Histologie der Tumoren und Geschlecht der Patienten erwiesen sich in dieser Arbeit nicht als prognostisch relevante Faktoren. Rauchen und ein höheres Lebensalter waren positive Einflussfaktoren. Die Faktoren Operationsausmaß, Tumorstadium, Alter und Nikotinkonsum zeigten in dieser Arbeit eine unabhängige prognostische Bedeutung für das 5-Jahres-Überleben von Patienten mit primären nichtbronchioloalveolären Adenokarzinomen der Lunge und primären großzelligen Karzinomen adenoider Herkunft der Lunge. III Meiner Familie IV Inhaltsverzeichnis Seite Abstract Widmung Inhaltsverzeichnis V Verzeichnis der Abkürzungen X Verzeichnis der Abbildungen und Tabellen XI 1. Einleitung 1 1.1. Wissenschaftlich-theoretischer Hintergrund 1 1.1.1. Das Bronchialkarzinom 1 1.1.1.1. 1.1.1.1.1 1.1.1.1.2 1.1.1.1.3 1.1.1.1.3.1 1.1.1.1.3.2 1.1.1.1.3.3 3 4 4 4 4 4 4 1.1.1.1.4 1.1.1.1.5 1.1.1.1.6 1.1.1.2. 1.1.1.2.1 Adenokarzinome Azinär Papillär Bronchioloalveoläres Karzinom Nicht-schleimbildendes Schleimbildendes Gemischt schleimbildendes und nicht-schleimbildendes oder Zwischentypen Solides Adenokarzinom mit Schleim Adenokarzinome mit gemischten Subtypen Varianten Großzellige Karzinome Varianten 1.1.2. 1.1.3. 1.1.4. TNM Klassifikation Tumordifferenzierungsgrade Stadieneinteilung 6 7 7 1.1.5. 1.1.5.1 Prognose Die Bedeutung des Tumorstadiums und der TNMKlassifikation für die Prognose von Patienten mit Bronchialkarzinomen Die Bedeutung der Histologie für die Prognose von Patienten mit Bronchialkarzinomen Die Bedeutung des Geschlechtes für die Prognose von Patienten mit Bronchialkarzinomen Die Bedeutung des Alters für die Prognose von Patienten mit Bronchialkarzinomen 8 8 1.1.5.2. 1.1.5.3 1.1.5.4 V 5 5 5 5 5 9 10 10 Seite 1.1.5.5. Die Bedeutung des Rauchens für die Prognose von Patienten mit Bronchialkarzinomen Die Bedeutung biologischer Marker für die Prognose von Patienten mit Bronchialkarzinomen Die Bedeutung von Surfactant Protein A für die Prognose von Patienten mit Bronchialkarzinomen 10 1.2. Ziele dieser Arbeit 19 2. Material und Methoden 20 2.1. Material 20 2.1.1. Untersuchungskollektiv 20 2.2. Methoden 21 2.2.1. Re-Klassifikation der Adenokarzinome und großzelligen Karzinome nach der WHO Klassifikation 21 2.2.2. 2.2.3. HE- und PAS-Färbungen, SP-A-Immunreaktion Auswertung der immunhistochemischen Reaktion 21 24 2.2.4. Externe Positivkontrolle 26 2.2.5. Interne Positivkontrolle 26 2.2.6. Datenerhebung 27 2.2.7. Ausschlusskriterien 28 2.2.8. 2.2.8.1. 2.2.8.2. 2.2.8.3. Statistik Kaplan-Meier Methode Log-Rank-Test Regressionsanalyse nach Cox 28 29 29 29 1.1.5.6. 1.1.5.7. VI 11 15 Seite 30 3. Ergebnisse 3.1. Histologische Diagnose nach WHO-Kriterien der untersuchten Bronchialkarzinome Histologische Subklassen der nicht-bronchioloalveolären Adenokarzinome Histologische Subklassifikation der großzelligen Karzinome 30 33 33 3.2.2. SP-A Expresion der untersuchten Karzinome SP-A Expression der nicht-bronchioloalveolären Adenokarzinome SP-A Expression der großzelligen Karzinome 3.3. Statistische Auswertung 35 3.3.1. 3.3.1.1. 3.3.1.2. 3.3.1.3. 3.3.1.3.1. 3.3.1.3.2. 3.3.1.3.3. Beschreibung des Patientenkollektivs Verteilung der Tumorstadien Operationsausmaß Demographische Daten Geschlechtsverteilung Alter der Patienten Nikotinabusus 35 35 36 37 37 38 39 3.1.1. 3.1.2. 3.2. 3.2.1. VII 30 32 34 Seite 41 3.3.2. Vergleich der Überlebensfunktionen 3.3.2.1. Vergleich nach Histologie 41 3.3.2.2. Vergleich der Überlebenskurven nach SP-A Expression 42 3.3.2.2.1 3.3.2.2.2. 3.3.2.2.3. Vergleich nach SP-A Expression am Gesamtkollektiv Vergleich der SP-A Expression der Adenokarzinome Vergleich der SP-A Expression der großzelligen Karzinome 42 43 44 3.3.2.3. 3.3.2.3.1. 3.3.2.3.2. 3.3.2.3.3. Vergleich der Überlebensfunktionen nach Tumorstadium Vergleich nach Tumorstadium beim Gesamtkollektiv Vergleich nach Tumorstadium der Adenokarzinome Vergleich nach Tumorstadium der großzelligen Karzinome 45 45 47 49 3.3.2.4. 3.3.2.4.1 3.3.2.4.2. 3.3.2.4.3. Vergleich der Überlebenskurven nach Operationsausmaß Vergleich nach Operationsausmaß am Gesamtkollektiv Vergleich nach Operationsausmaß der Adenokarzinome Vergleich nach Operationsausmaß der großzelligen Karzinome 51 51 52 53 3.3.2.5. Vergleich der Überlebensfunktion nach Geschlecht der Patienten Vergleich nach Geschlecht beim Gesamtkollektiv Vergleich nach Geschlecht der Patienten mit Adenokarzinomen Vergleich nach Geschlecht der Patienten der mit großzelligen Karzinomen 54 3.3.2.6. 3.3.2.6.1. 3.3.2.6.2 3.3.2.6.3 Vergleich der Überlebensfunktion nach Alter der Patienten Vergleich nach Alter der Patienten im Gesamtkollektiv Vergleich nach Alter der Patienten mit Adenokarzinomen Vergleich nach Alter der Patienten mit großzelligen Karzinomen 57 57 58 59 3.3.2.7. 60 3.3.2.7.1. 3.3.2.7.2. 3.3.2.7.3. Vergleich der Überlebenskurven nach Rauchern und Nichtrauchern Vergleich nach Rauchern am Gesamtkollektiv Vergleich nach Rauchern bei Adenokarzinomen Vergleich nach Rauchern bei großzelligen Karzinomen 3.3.3. Regressionsanalyse nach Cox 63 3.3.2.5.1. 3.3.2.5.2. 3.3.2.5.3. VIII 54 55 56 60 61 62 Seite 64 4. Diskussion 4.1. Überblick 64 4.2. 4.2.1. 4.2.2. 4.2.3. 4.2.3.1. 4.2.3.2. 4.2.3.3. 4.2.3.4. 4.2.3.5. 4.2.3.6. 4.2.3.7. 4.2.3.8. Diskussion der Ergebnisse Histologische Re-Klassifikation SP-A Expression der untersuchten Karzinome Prognostische Bedeutung der untersuchten Parameter Histologie der Tumoren SP-A Expression der Tumoren Tumorstadium bei der Operation Operationsausmaß Geschlecht Alter der Patienten bei der Tumoroperation Rauchgewohnheiten Regressionsanalyse nach Cox 65 65 66 68 68 70 71 73 74 75 76 78 5. Schlussfolgerung 80 6. Literatur 81 Anhang 88 Danksagung 93 Lebenslauf 94 IX Verzeichnis der Abkürzungen WHO World Health Organization SP-A Surfactant protein A NSCLC Non small cell lung cancer UICC Unio internationalis contra cancrum CEA carcinoembryonic antigen EGFR epiermal growth factor receptor hnRNP A2/B1 heterogeneouse ribonucleoprotein A2/B1 FDG Fluoro-2-deoxyglucose COX-2 Cyclooxygenase-2 HE Hämatoxylin-Eosin PAS-Reaktion Periodsäure-Schiff-Reakion EMA Epitheliales-Membran-Antigen PAP Peroxidase Anti Peroxidase TTF-1 Thyroid transcriptions faktor 1 X Verzeichnis der Abbildungen und Tabellen Abbildungen: Abbildung 2.1: Großzelliges Karzinom der Lunge. HE Färbung. Abbildung 2.2: Azinäres Adenokarzinom der Lunge. HE-Färbung. Abbildung 2.3: Solides Adenokarzinom der Lunge. HE-Färbung. Abbildung 2.4: Papilläres Adenokarzinom der Lunge: HE-Färbung. Abbildung 2.5: SP-A positive Tumorzellen eines großzelligen Karzinoms der Lunge. Immunhistochemischen SP-A Reaktion. Abbildung 2.6: SP-A positive Tumorzellen eines azinären Adenokarzinoms der Lunge. Immunhistochemischen SP-A Reaktion. Abbildung 2.7: SP-A positive Tumorzellen eines papillären Adenokarzinoms der Lunge. Immunhistochemischen SP-A Reaktion. Abbildung 3.1: Histologische Subklassifikation der 108 untersuchten Adenokarzinome Abbildung 3.2: Histologische Subklassifikation der 70 untersuchten großzelligen Karzinome Abbildung 3.3: Anzahl der SP-A positiven und SP-A negativen Fälle innerhalb der einzelnen histologischen Subtypen der 108 untersuchten Adenokarzinome Abbildung 3.4: Anzahl der SP-A positiven und SP-A negativen Fälle innerhalb der histologischen Gruppe der 70 untersuchten großzelligen Karzinome Abbildung 3.5: Anzahl der Fälle verteilt auf die unterschiedlichen Tumorstadien Abbildung 3.6: Anzahl der Fälle mit unterschiedlichem Operationsausmaß Abbildung 3.7: Verteilung der weiblichen und männlichen Patienten in der Gruppe der Adenokarzinome und der Gruppe der großzelligen Karzinome Abbildung 3.8: Anzahl der Raucher und der Nichtraucher im untersuchten Kollektiv Abbildung 3.9: Anzahl der Adenokarzinome und der großzelligen Karzinome innerhalb der Gruppe der Raucher und Nichtraucher Abbildung 3.10: Anzahl der männlichen und weiblichen Patienten innerhalb der Gruppe der Raucher und Nichtraucher Abbildung 3.11: Überlebensfunktion nach Kaplan-Meier für Adenokarzinome und großzellige Karzinome Abbildung 3.12: Überlebensfunktion nach Kaplan-Meier für SP-A positive und SP-A negative Karzinome Abbildung 3.13: Überlebensfunktion nach Kaplan-Meier für SP-A positive und SP-A negative Adenokarzinome Abbildung 3.14: Überlebensfunktion nach Kaplan-Meier für SP-A positive und SP-A negative großzellige Karzinome Abbildung 3.15: Überlebensfunktion nach Kaplan-Meier für Tumorstadium I und höhere Tumorstadien Abbildung 3.16: Überlebensfunktion nach Kaplan-Meier für Tumorstadium IIb und IIIa XI Seite 22 22 23 23 24 25 25 31 32 33 34 35 36 37 39 40 40 41 42 43 44 45 46 Abbildung 3.17: Überlebensfunktion nach Kaplan-Meier für Tumorstadium I und höhere Tumorstadien bei den Adenokarzinomen Abbildung 3.18: Überlebensfunktion nach Kaplan-Meier für Tumorstadium IIb und IIIa bei Adenokarzinomen Abbildung 3.19: Überlebensfunktion nach Kaplan-Meier für Tumorstadium I und höhere Tumorstadien bei großzelligen Karzinomen Abbildung 3.20: Überlebensfunktion nach Kaplan-Meier für Tumorstadium IIb und IIIa bei großzelligen Karzinomen Abbildung 3.21: Überlebensfunktion nach Kaplan-Meier für Patienten mit Pneumoektomie und kleineren Eingriffen Abbildung 3.22: Überlebensfunktion nach Kaplan-Meier für Patienten, bei denen ein Adenokarzinom vorlag, verglichen nach Operationsausmaß Abbildung 3.23: Überlebensfunktion nach Kaplan-Meier für Patienten, bei denen ein großzelliges Karzinom vorlag, verglichen nach Operationsausmaß Abbildung 3.24: Überlebensfunktion nach Kaplan-Meier für männliche und weibliche Patienten Abbildung 3.25: Überlebensfunktion nach Kaplan-Meier für männliche und weibliche Patienten mit Adenokarzinomen Abbildung 3.26: Überlebensfunktion nach Kaplan-Meier für männliche und weibliche Patienten mit großzelligen Karzinomen Abbildung 3.27: Überlebensfunktion nach Kaplan-Meier für die unterschiedlichen Altersgruppen Abbildung 3.28: Überlebensfunktion nach Kaplan-Meier für die unterschiedlichen Altersgruppen innerhalb der Adenokarzinome Abbildung 3.29: Überlebensfunktion nach Kaplan-Meier nach Altersgruppen innerhalb der großzelligen Karzinome Abbildung 3.30: Überlebensfunktion nach Kaplan-Meier für Raucher und Nichtraucher Abbildung 3.31: Überlebensfunktion nach Kaplan-Meier für Raucher und Nichtraucher innerhalb der Adenokarzinome Abbildung 3.32: Überlebensfunktion nach Kaplan-Meier für Raucher und Nichtraucher innerhalb der großzelligen Karzinome 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 Tabellen: Tabelle 3.1: Übersicht über Minimal-, Maximal- und Mittelwerte sowie Standardabweichung des Alters der Patienten bei Diagnosestellung in Jahren Tabelle 3.2: Ergebnisse der Regressionsanalyse nach Cox XII Seite 38 63 1. Einleitung 1.1. Wissenschaftlich-theoretischer Hintergrund 1.1.1. Das Bronchialkarzinom Das Bronchialkarzinom ist der häufigste bösartige Tumor des Mannes. Im Jahr 1988 starben in Deutschland (alte Bundesländer) 22180 Männer und 5260 Frauen an bösartigen Tumoren der Lunge, die damit 26,2% bzw. 6,2% aller Krebstodesfälle verursachten [57]. Das Bronchialkarzinom wird beim Mann häufiger beobachtet als bei der Frau, aber die Häufigkeit bei den Frauen steigt deutlich an. So betrug das Verhältnis Mann zu Frau im Jahre 1950 noch 10:1 [13]. Etwa 90% aller Patienten mit Bronchialkarzinom sind Raucher. Die sogenannte British Doctors Study belegte schon in den 1950er Jahren den Zusammenhang zwischen Lungenkrebs und Rauchen. Auch „passivrauchende“ Nichtraucher sind einem erhöhten Gesundheitsrisiko ausgesetzt [32]. Der überwiegende Anteil der Bronchialkarzinome lässt sich den 4 Hauptgruppen, dem Adenokarzinom, dem großzelligen Bronchialkarzinom, dem Plattenepithelkarzinom und dem kleinzelligen Bronchialkarzinom, zuordnen. Das Adenokarzinom, das Plattenepithelkarzinom und das großzellige Bronchialkarzinom werden auch als nicht-kleinzellige Bronchialkarzinome (Non small cell lung cancer (NSCLC)) zusammengefasst. Bei Rauchern sind das Plattenepithelkarzinom und das kleinzellige Bronchialkarzinom am häufigsten, bei Nichtrauchern findet sich eine relative Häufung des Adenokarzinoms. 25 bis 40 Prozent der Lungenkarzinome sind Adenokarzinome. Sie entstehen aus schleimproduzierenden Zellen und entwickeln sich bevorzugt in Narbengeweben (z.B. in Tuberkulosenarben). Dieser Tumor liegt meist in der peripheren Lunge. Eine 1 frühe Metastasierung ist typisch, die sowohl über die Lymphbahnen als auch über die Blutbahn erfolgt (bevorzugt in das Gehirn, die Leber und die Nebennierenrinde). Histologisch sieht man vor allem Drüsenformationen. Eine besondere Rolle spielt das vergleichsweise seltene bronchioloalveoläre Karzinom. Diese Sonderform, die 1-9% der untersuchten Bronchialkarzinome ausmacht, wächst langsam und innerhalb der anatomischen Strukturen. Radiologisch wird es daher häufig mit einer Pneumonie verwechselt. Im Gegensatz zu anderen Bronchialkarzinomen besteht kein Prozent der Zusammenhang zu inhalativen Noxen. Die großzelligen Bronchialkarzinome machen 10 bis 15 Bronchialkarzinome aus. Auch sie metastasieren hämatogen in Leber, Gehirn und Knochen. Die großzelligen Bronchialkarzinome sind entdifferenzierte Adeno- und Plattenepithelkarzinome, die lichtmikroskopisch nicht mehr als solche erkannt werden können. Sie zeigen histologisch große Zellen mit großen Kernen, wenig Zytoplasma und reichlich Nukleoli. Immunhistochemisch und elektronenmikroskopisch zeigen sie aber noch minimale Differenzierungszeichen von Drüsen- oder Plattenepithel. Eine histologische Variante leitet sich wie das kleinzellige Bronchialkarzinom aus den neuroendokrinen Zellen ab und zeigt rosetten-, trabekel- oder nestförmiges Wachstum. Die Gruppe der nicht-kleinzelligen Bronchialkarzinome ist meist durch ein langsameres Tumorwachstum mit Verdopplungszeiten von im Mittel 100 Tagen beim Plattenepithelkarzinom und 183 beim Adenokarzinom gekennzeichnet. Innerhalb der Gruppen bestehen erhebliche Unterschiede, so dass im Einzellfall sowohl eine extrem lange als auch eine sehr kurze Verdopplungszeit vorkommen können [60]. 2 1.1.1.1. Adenokarzinome Adenokarzinome kommen besonders häufig in der Lungenperipherie vor. Grundsätzlich können sie aber überall von den Bronchien bis in die Alveolen entstehen. Makroskopisch sind die Tumoren rundlich, weißgelblich mit zentraler Nekrose und je nach gebildeter Schleimmenge auch glasig. Tubuläre, azinäre oder papilläre Wuchsform, sowie Schleimbildung der Tumorzellen treten bei Adenokarzinomen in den Vordergrund. Häufig treten diese Wuchsformen auch in einem Tumor gemischt auf. Bei mäßiggradiger Differenzierung weisen die Zellen runde Kerne auf, grobes Chromatin und große prominente Nucleoli. Sie enthalten mäßig Zytoplasma und z.T. feine oder schleimähnliche Vakuolen. In geringer differenzierten Tumoren zeigen die Zellen eher ein pleomorphes Erscheinungsbild und sind schwer von großzelligen Karzinomen zu unterscheiden. Der bronchioloalveoläre Typ weist eine tapetenförmige Auskleidung der Alveolarräume unter Benutzung der vorbestehenden Lungenstruktur auf. Dieses Karzinom wird auch als Alveolarzellkarzinom bezeichnet. Es kompliziert gehäuft fibrosierende Lungenerkrankungen und entsteht multifokal. Dadurch infiltriert das Karzinom diffus ins Lungengewebe und ahmt eine Lobärpneumonie oder karnifiziernede Pneumonie nach. Da der Tumor große Schleimmengen produzieren kann und kaum Kernanaplasieen aufweist, wurde er früher auch als Lungenadenomatose bezeichnet. Die Zahl der Fälle von Adenokarzinomen ist zunehmend und in manchen Ländern sind nahezu 50% der Fälle von Lungenkrebs Adenokarzinome. Adenokarzinome sind assoziiert mit Zigarettenrauchen, allerdings nicht so streng wie andere histologische Typen. Adenokarzinome werden nach der WHO-Klassifikation wie folgt eingeteilt: 3 1.1.1.1.1 Azinär Ein Adenokarzinom mit Azini und Tubuli häufig bestehend aus Schleim produzierenden Zellen, die bronchialen Drüsen oder den die Bronchien auskleidenden Epithelzellen ähneln. 1.1.1.1.2 Papillär Ein Adenokarzinom mit vorwiegend papillärer Struktur, die zugrundeliegende alveoläre Architektur ersetzend. 1.1.1.1.3 Bronchioloalveoläres Karzinom Ein Adenokarzinom mit rein bronchioloalveolärem Wachstum ohne Zeichen einer Stroma-, Gefäß- oder Pleurainvasion. 1.1.1.1.3.1 Nicht-schleimbildendes Ein nicht schleimbildendes Adenokarzinom mit Clarazellen und/oder Typ II Pneumozyten an den Alveolarwänden wachsend ohne Stromainvasion. 1.1.1.1.3.2 Schleimbildendes Ein schleimbildendes Adenokarzinom bestehend aus schmalen säulenartigen Zellen mit einer variierenden Menge von zytoplasmatischem Schleim. Dieser Schleim verdrängt in typischer Weise den Nukleus an den Rand der Zelle, ohne Stromainvasion an den Alveolarwänden. 1.1.1.1.3.3 Gemischt schleimbildendes und nicht-schleimbildendes oder Zwischentypen Ein Adenokarzinom mit gemischten schleimbildenden und nicht-schleimbildenden Zellen oder eines, in dem man nicht zwischen beiden Zelltypen unterscheiden kann. Der Tumor wächst entlang der Alveolarwände ohne Stromainvasion. 4 1.1.1.1.4 Solides Adenokarzinom mit Schleim Ein Adenokarzinom, dem Tubuli, Azini oder papilläre Strukturen fehlen, in dem aber häufig schleim-enthaltende Tumorzellen vorkommen (fünf oder mehr Schleimpositive Zellen in mindestens zwei high-power-fields). 1.1.1.1.5 Adenokarzinome mit gemischten Subtypen 1.1.1.1.6 Varianten Gut differenzierte fetale Adenokarzinome, Schleimbildende („colloide“) Adenokarzinome, schleimbildende Kystadenokarzinome, Siegelringzelladenokarzinome, klarzellige Adenokarzinome 1.1.1.2. Großzellige Karzinome Großzellige Karzinome der Lunge sind undifferenzierte bösartige epitheliale Tumoren, die keine zytologischen Zeichen von kleinzelligen Karzinomen drüsiger oder plattenepithelialer Differenzierung aufweisen. Die Zellen sind groß und zytoplasmareich (Extrem: klarzellige Variante). In den Tumorzellen kann man plumpe Nukleolen erkennen. Die Zellgrenzen sind deutlich erkennbar. Die meisten dieser Tumoren sind zytokohäsiv. Die recht scharf begrenzten, rundlichen Tumoren mit grauweißlicher Schnittfläche bevorzugen die Lungenperipherie. 1.1.1.2.1 Varianten Großzelliges neuroendokrines Karzinom, basaloides Karzinom, Lymphoepitheliom ähnliches Karzinom, klarzelliges Karzinom, großzelliges Karzinom mit rhabdoidem Phenotyp 5 1.1.2. TNM Klassifikation TX: Primärtumor kann nicht bewertet werden, oder Tumor ist bewiesen durch das Vorhandensein von malignen Zellen im Sputum oder BAL, aber nicht sichtbar in bildgebenden Verfahren. T0: kein Anhalt für einen Primärtumor Tis: Carcinoma in situ T1: Tumor 3 cm oder kleiner im Durchmesser, auf Lunge begrenzt, Hauptbronchus frei T2: Tumor größer als 3 cm, Befall von Hauptbronchus, viszeraler Pleura, subtotale Atelektase, Obstruktionspneumonie T3: Tumor jeglicher Größe mit Infiltration in Brustwand, Zwerchfell, mediastinale Pleura und parietales Perikard; totale Atelektase oder Obstruktionspneumonie T4: Tumoren jeglicher Größe mit Infiltration in Mediastinum, Herz, große Gefäße, Trachea, Ösophagus, Wirbelkörper oder Pleuritis carcinomatosa NX: regionale Lymphknoten können nicht bewertet werden N0: keine regionalen Lymphknotenmetastasen N1: Ipsilaterale peribronchiale und/oder hiläre Lymphknotenmetastasen N2: ipsilaterale mediastinale und/oder subkraniale Lymphknotenmetastasen N3: wie N1,N2 aber kontralateral MX: Fernmetastasen können nicht beurteilt werden M0: keine Fernmetastasen M1: Fernmetastasen vorhanden 6 1.1.3. Tumordifferenzierungsgrade GX: Grad der Differenzierung kann nicht bestimmt werden G1: hochdifferenzierter Tumor G2: mäßiggradigdifferenzierter Tumor G3: wenig differenzierter Tumor G4: undifferenzierter, anaplastischer Tumor 1.1.4. Stadieneinteilung Occultes Karzinom: TX N0 M0 Stadium 0 : Tis N0 M0 Stadium IA : T1 N0 M0 Stadium IB : T2 N0 M0 Stadium IIA : T1 N1 M0 Stadium IIB : T2 N1 M0; T3 N0 M0 Stadium IIIA : T1 N2 M0; T2 N2 M0; T3, N1,N2 M0 Stadium IIIB : jedes T N3 M0; T4 jedes N M0 Stadium IV : jedes T jedes N M1 7 1.1.5. Prognose Hinsichtlich der Prognose von Bronchialkarzinomen wurden bereits mehr als 150 verschiedenen Faktoren, die das Überleben von Patienten mit Lungenkarzinomen beeinflussen, gefunden und untersucht [33]. 1.1.5.1. Die Bedeutung des Tumorstadiums und der TNMKlassifikation für die Prognose von Patienten mit Bronchialkarzinomen Die Stadieneinteilung, die auf der Grundlage des TNM Systems nach einem Vorschlag der UICC erfolgt, hat eine erhebliche prognostische Bedeutung [78]. Zur Bedeutung des TNM Systems und des Tumorstadiums gibt es eine große Anzahl von Studien [7, 12, 33, 45, 49, 50, 65, 75, 80]. Das Fünfjahres-Überleben im Stadium I liegt bei 43% (klinisches Staging) bzw. bei 57% (chirurgisches Staging); im Stadium II bei 31% (klinisches Staging) bzw. 41% (chirurgisches Staging); im Stadium IIIa bei 18% (klinisches Staging) bzw. 25% (chirurgisches Staging); im Stadium IIIb bei 7% (klinisches Staging) bzw. 20% (chirurgisches Staging) und im Stadium IV bei 2% (klinisches Staging) [2]. Große Studien haben demonstriert, dass das TNM System der konsistenteste Prognosefaktor ist [33]. Das T Stadium sollte nach Meinung der Arbeitsgruppe um Christian jedoch überdacht werden. Die Definition des T Faktors im Stagingsystem der NSCLC sollte nach Meinung dieser Arbeitsgruppe zwei Einteilungsgrenzen gemäß der Tumorgröße erwägen. In dieser Studie wurden Schwellendurchmesser von zwei und fünf cm definiert. Diese Subgruppen unterschieden sich in ihrer Prognose signifikant [12]. Der Schwellendurchmesser von 5 cm wurde auch von Cangir und Mitarbeitern beschrieben [9]. In der Untersuchung von Caldarella und Mitarbeitern wird angeregt, auch das Stadium N I in weitere Untergruppen zu gliedern, da verschiedene Subgruppen Unterschiede in Bezug auf das Überleben aufweisen. So hat das Vorhandensein von hilären Lymphknotenmetastasen eine prognostische Bedeutung [7]. Das 5-Jahres8 Überleben der Patienten mit pulmonalen Metastasen betrug 41,2%, das der Patienten mit hilären Lymphknotenmetastasen 21,8%. 1.1.5.2. Die Bedeutung der Histologie für die Prognose von Patienten mit Bronchialkarzinomen Die Histologie hat in Multivarianzanalysen eine unabhängige prognostische Bedeutung für das Langzeitüberleben gezeigt [16, 37, 49, 50]. So wurde das Überleben von Patienten nach Pneumektomie und kleineren Eingriffen in bezug auf den histologischen Zelltyp des Karzinoms untersucht [37]. Adenokarzinome hatten in dieser Untersuchung eine schlechtere Prognose als Plattenepithelkarzinome. Allerdings war der Anteil der Patienten mit N0 – 1 Stadien in der Gruppe der Patienten mit Adenokarzinomen signifikant geringer als in der Gruppe der Patienten mit Plattenepithelkarzinomen. Eine weitere Studie beschäftigte sich mit dem Überleben von Patienten mit NSCLC in Schweden. Hier konnten die Erfahrungen, dass Adenokarzinome im Vergleich zu Plattenepithelkarzinomen eine schlechtere Prognose aufweisen, nicht bestätigt werden [6]. In einer Studie von Wilde et al [76] wiesen die Patienten mit bronchioloalveolären Karzinomen die beste Überlebensrate und somit die günstigste Prognose auf. Dies fand sich auch in der Untersuchung von Sakao und Mitarbeitern, in der kleine Adenokarzinome in zwei Gruppen aufgeteilt wurden. Solche mit minimaler oder fehlender bronchioloalveolären Komponenten zeigten ein aggressives biologisches Verhalten. Gemischte Adenokarzinome mit bronchioloalveoläre Anteilen waren weniger aggressiv und hatten eine günstigere 5-Jahres-Überlebensrate [54]. Clayton et al. [14] verwiesen auf die Tumorzellausbreitung, sowie ebenfalls auf den Zelltyp der Ursprungszelle als wichtigen Prognosefaktor. Die Tumoren mit alveolärer Ausbreitung hatten die günstigste Prognose. 9 1.1.5.3. Die Bedeutung des Geschlechtes für die Prognose von Patienten mit Bronchialkarzinomen Ebenso ist das Geschlecht des Patienten ein Prognosefaktor [1, 5, 40]. In vielen Studien zeigte sich das weibliche Geschlecht als ein positiver prognostischer Faktor [3, 10, 16, 49, 50, 51, 77]. In einer Studie wurde die Vermutung geäußert, dass das Vorhandensein von Östrogenrezeptoren in den Lungenkarzinomzellen für das bessere Überleben verantwortlich sein könnte [16]. 1.1.5.4. Die Bedeutung des Alters für die Prognose von Patienten mit Bronchialkarzinomen Auch die Frage, ob ältere Patienten ein schlechteres Überleben aufweisen wurde untersucht. Patienten über 70 Jahre, bei denen ein NSCLC im Stadium I resiziert wurden, haben ein vergleichbares Überleben wie Patienten, die jünger sind [79]. 1.1.5.5. Die Bedeutung des Rauchens für die Prognose von Patienten mit Bronchialkarzinomen Nach einer Studie von Luke und Mitarbeitern sind Nichtraucher mit Adenokarzinomen hauptsächlich weiblich, bei Diagnosestellung älter und zeigen ein besseres Überleben als Patienten, die rauchen. In der Multivarianzanalyse zeigte sich das Nichtrauchen als unabhängiger günstiger Prognosefaktor [42]. 10 1.1.5.6. Die Bedeutung von biologischen Markern für die Prognose von Patienten mit Bronchialkarzinomen Hsu et al. untersuchten präoperativ die carcinoembryonic antigen (CEA) Tumormarkerspiegel als einen prognostischen Faktor bei Frauen mit frühem NSCLC. Sie fanden, dass der CEA Spiegel und die Tumorgröße unabhängige prognostische Faktoren bei weiblichen Patienten mit NSCLC im Stadium I sind, wobei ein ungewöhnlich hoher präoperativer CEA Spiegel und eine Tumorgröße von mehr als 3 cm eine schlechtere Prognose nach sich ziehen [29]. Patienten mit initial normalem CEA haben ein besseres Überleben [52]. Ebenso ist der Tumormarker CA125 ein Vorhersagefaktor für das Ansprechen von Patienten auf die Chemotherapie und ein prognostischer Faktor für das Überleben [68]. So hatten Patienten mit einem CA125 Wert über 35 KU/l ein schlechteres Überleben. Als weitere biologische Marker wurden auch [(18)F]Fluoro-2-deoxyglucose (FDG) Aufnahme, glucose transporter type 1 (Glut-1) und Ki-67 Expression in NSCLC untersucht. Die FDG Aufnahme zeigte in einer Multivarianzanalyse eine Beeinflussung des tumorfreien Überlebens. Patienten mit hohen Werten für die FDG Aufnahme hatten eine niedrigere 1-Jahr-tumorfreie-Überlebensrate [41]. Die FDG Aufnahme in der Positronen Emissions Tomographie wird zur Diagnose und zum Staging von Lungenkarzinomen genutzt. Die FDG Aufnahme lässt sich zur Vorhersage von tumorfreiem Überleben bei Patienten mit Adenokarzinomen der Lunge im Stadium I nutzen [46]. Offersen und Mitarbeiter untersuchten die Beziehung zwischen Prognose und Angiogenese bei Patienten mit NSCLC in Bezug auf Urokinase plasminogen activator und plasminogen inhibitor type 1. Jedoch konnte keiner der beiden Faktoren sich als prognostischer Marker für das Überleben der Patienten identifizieren lassen [43]. 11 Die Expression von phosphorylierten Tyrosine-enthaltenden Proteinen von Tumorzellen nicht-kleinzelliger Lungenkarzinome wurde von Gong und Kollegen mit einem kürzeren tumorfreien Überleben in Verbindung gebracht [23]. Die totale EGFR (epidermal growth factor receptor) Expression in der Immunhistochemie hat eine prognostische Bedeutung gezeigt [15]. Daher wurde von der Arbeitsgruppe untersucht, ob auch der Aktivierungs- (Phosphorylierung-) Status von EGFR und die Aktivierung des entsprechenden Gegenregulationsmechanismus p-STAT-3 einen prognostischen Nutzen bei NSCLC haben. Dies ist jedoch nicht der Fall [15]. Von Sonobe et al. wurde der Einfluss von EGFR Genmutation auf die Expression von EGFR, phosphoryl-Akt und phosphoryl-MAPK sowie die Prognose von Patienten mit NSCLC untersucht. Sie kamen zu dem Ergebnis, dass in frühen Stadien von NCSLC eine EGFR Genmutation gut für die Prognose der Patienten ist [56]. Die MUC4 Expression ist ein weiterer untersuchter biologischer Marker bei NSCLC. Tsutasumida et al. fanden eine Korrelation zwischen einer hohen Expression dieses Markers und einem kurzen tumorfreien Intervall und einer schlechten Überlebensrate bei Patienten mit einem Adenokarzinomen der Lunge im Stadium Ia [70]. Eine erhöhte Expression von intrazellulärem Laminin, Her2/neu Überexpression und Unterbrechungen während der postoperativen Chemotherapie wirken sich nach einer Untersuchung von Szelachowska et al. [62] nachteilig auf das Überleben von Patienten mit NSCLC aus. Die prognostische Bedeutung von p16(INK4a), einem Tumorsupressorgen, das durch Hypermethylisierung inaktiviert wird, wurde von Ota und Mitarbeitern untersucht. Ein hoher p16(INK4a) Methylisierungsgrad zeigte sich als prognostisch ungünstig [47]. Insulin receptor substrate-I down-regulation scheint eher ein frühes Ereignis in der Entwicklung von NSCLC zu sein, als ein prognostischer Faktor und tritt häufiger bei Plattenepithelkarzinomen und Rauchern auf [25]. 12 Desmoglein 3 ist ein desmosomales Protein der Katherinfamilie. Negativität in der Immunhistologie war mit einem kürzeren Überleben assoziiert und zwar bei allen Lungenkarzinompatienten unabhängig vom histologischen Subtyp des Tumors [20]. Auch eine erhöhte Expression von S100 A2 und heterogeneouse ribonucleoprotein A2/B1 (hnRNP A2/B1) sind prognostisch ungünstige Faktoren [84]. Eine Mutation des TP53 Gens hat keinen Einfluss auf das Überleben [63]. Trophinin kann die Invasion von Zellen erhöhen. Patienten mit Adenokarzinomen der Lunge im Stadium I haben ein besseres Überleben und ein kürzeres tumorfreies Überleben, wenn sie kein Trophinin expremierten [11]. Cyclooxygenase-2 (COX-2) wird in Lungenkarzinomen besonders in Adenokarzinomen überexpremiert. Ein schwacher nachteiliger Effekt für das Überleben der betroffenen Patienten ist mit der Expression von COX-2 assoziiert [36]. Auch zur Unterscheidung der verschiedenen histologischen Typen von Karzinomen der Lunge wurden verschiedene biologische Marker untersucht. So zeigten sich SPA, p63, CK5/CK6 und CK7 nützlich bei der Trennung zwischen Adenokarzinomen von Plattenepithelkarzinomen [8]. Napsin A ist geeignet um primäre Adenokarzinome der Lunge von Adenokarzinomen anderen Ursprungs zu unterscheiden [61]. Dazu ist Napsin A in dieser Studie besser geeignet als SP-A. Auch die Gruppe um Zamecnik nutzt SP-A zur Unterscheidung von Karzinomen der Lunge und von solchen anderen Ursprungs [83]. In dieser Studie wird auch Thyroid transcripitions faktor 1 (TTF-1) genutzt. Sogar der Einfluss von Jahreszeiten und verschiedener geographischer Regionen auf die Prognose wurde untersucht. Junge männliche Patienten, bei denen die 13 Diagnose im Herbst gestellt wurde, hatten einen Überlebensvorteil im Vergleich zu denen, bei denen die Diagnose im Winter gestellt wurde. Das Wohnen in einer Region mit hohen UV Werten bedeutet einen Überlebensvorteil. Dieser Vorteil wird durch einen hohen Wert von sonneninduzierten 25-Hydroxyvitamin D erklärt und zeigt sich auch bei anderen Karzinomarten [51]. Es wurde auch versucht, durch die Kombination verschiedener biologischer Marker, die allein keine prognostisch signifikante Bedeutung haben, eine Aussage zum Überleben der Patienten zu erhalten: Eine solche Kombination von biologischen Markern fand die Gruppe um Hilbe. Die Proteinexpressionen C-erbB3, p53 und microvessel density wurden kombiniert, und Patienten, bei denen die Expression von allen drei oder zwei der genannten Marker erhöht ist, haben ein schlechteres Überleben als Patienten, bei denen nur die Expression eines oder von keinem Marker erhöht sind [27]. Da so viele unterschiedliche Prognosefaktoren existieren, hat die Gruppe um Blanchon einen Prognoseindex aus persönlichen Daten, Tumordaten und funktionellen Informationen gebildet, der bei Patientenmanagement, Einsatz von Ressourcen und Studienplanungen helfen soll [4]. 14 1.1.5.7. Die Bedeutung von Surfactant Protein A für die Prognose von Patienten mit Bronchialkarzinomen Das Surfactant der Lunge ist eine oberflächenaktive Substanz an der LuftFlüssigkeitsgrenze der Alveolen, die durch Reduktion der alveolären Oberflächenspannung der Aufrechterhaltung der alveolären Stabilität dient [24, 39]. Somit werden ein beschränkter Kollaps der Alveolen bei niedrigem transpulmonalem Druck während der Exspiration und die Expansion der Alveolen während der Inspiration gewährleistet [18, 19, 24, 39]. Dieser Anti-Atelektase-Faktor ist daher die Voraussetzung für die adäquate Ventilation der peripheren Lunge. Weiterhin dient Surfactant dem mechanischen Schutz der Epithelzellen gegen infektiöse Agenzien und ist an wichtigen pulmonalen Abwehrmechanismen und an der lokalen Immunmodulation beteiligt. Der Begriff „Surfactant“ ist aus der Bezeichnung „surface active agent“ entstanden. Chemisch gesehen ist Surfactant eine Emulsion aus Lipiden, Proteinen und Kohlenhydraten. Bestandteile des Surfactants sind zu 90% Lipide und zu 10% vier durchalphabetisierte Surfactantproteine A bis D, von denen Surfactant Protein A (SPA) das mengenmäßig häufigste darstellt. Die Proteine stellen mit 10% die zweitgrößte Fraktion dar. Sie setzen sich zu 80 % aus Serumproteinen und zu 20% aus Surfactant spezifischen Proteinen zusammen. Der Kohlenhydratanteil ist sehr gering [18, 19, 24, 39]. Das SP-A bildet aufgrund seines relativen Vorkommens und seiner Größe von 26000 bis 36000 Dalton den Hauptanteil der Surfactant spezifischen Proteinen. Von King und Mitarbeitern wurde SP-A bereits 1973 als erstes Surfactant spezifisches Protein identifiziert, isoliert und im Detail untersucht und beschrieben [34]. SP-A konnte in Pneumozyten Typ II nachgewiesen werden. Diese Epithelzellen bedecken zusammen mit den Pneumozyten Typ I die alveoläre Oberfläche. Die Pneumozyten kleiden hierbei 93-97% und die Pneumozyten Typ II nur 3-7% aus. Die Pneumozyten Typ II sind als Syntheseort des Surfactant bekannt. Neben der de Novo Synthese des Surfactant wird eine Wiederaufnahme und ein Recycling des 15 Surfactant durch die Pneumozyten Typ II beschrieben. An der Clearance sind vermutlich auch andere pulmonale Zellen, wie beispielsweise in größerem Umfang Clarazellen, sowie die Zilienzellen der distalen Bronchiolen beteiligt. Bei den Clarazellen handelt es sich um flimmerlose Zellen der Bronchioli terminalis, deren lumenseitiger Abschnitt in unterschiedlichem Ausmaß über das allgemeine Niveau des bronchiolären Lumens vorgebuchtet erscheint. Sie kleiden als vorherrschender Zelltyp die Bronchioli aus. Sie wurden sowohl in den Bronchioli terminalis, bronchioli respiratorii, als auch in den Bronchien nachgewiesen. Viele dieser Zellen tragen kuppenartige Vorwölbungen, die charakteristisch für diesen Zelltyp sind. Die Entstehung des Bronchialkarzinoms ist sehr komplex und nicht ganz entschlüsselt. Hier eine Vereinfachung der gängigsten Entstehungsmodelle: Die Reservezellen des Bronchialsystems sind pluripotent, das heißt sie sind fähig, sich zu verschiedenen Zellen der Bronchialschleimhaut auszudifferenzieren, zum Beispiel zu Plattenepithelien, Becherzellen, Clarazellen und zu neuroendokrinen Zellen. Nach chronisch-entzündlicher Reizung und Einwirkung von kanzerogenen Noxen kann das Epithel mit einer Plattenepithelmetaplasie, einer Becherzellhyperplasie oder einer Entartung neuroendokriner Zellen reagieren, die die verschiedenen Subtypen von Bronchialkarzinomen bilden. Es konnte gezeigt werden, dass die Clarazellen neben den Basalzellen als Vorläuferzellen für das bronchioläre Epithel fungieren [44, 48, 53]. Eine Rolle als Ursprungszellen bei der bronchialen Karzinogenese wird diskutiert [30], da diese Zellen eine nur gering ausgeprägte DNA-Reparaturkapazität und eine hohe Proliferationsfähigkeit aufweisen [48]. In Clarazellen und zum kleinen Teil auch in Pneumozyten Typ II konnte das Cytochrom P 450-Monooxigenasesesystem nachgewiesen werden [48]. Dieses System ermöglicht überwiegend eine Metabolisierung, aber auch eine Aktivierung potentieller Toxine und Kanzerogene. Hierdurch kann es zu einer direkten Zellschädigung (Nekrose) oder über die Bildung von Prokarzinogenen zu einer verzögerten Schädigung mit anschließender neoplastischer Zelltransformation kommen. Aufgrund der nur geringen Kapazität zur DNA-Reparatur sind die Clarazellen besonders sensitiv für Karzinogene. 16 In diesem Zusammenhang wird vermutet, dass die Adenokarzinome der Lunge, besonders die Untergruppe der bronchioloalveolären Adenokarzinomen jedoch auch andere Subtypen, aus den Pneumozyten II oder den Clarazellen ihren Ursprung nehmen [17, 21, 28, 38, 44, 48, 64, 72, 74]. SP-A lässt sich auch in einem Teil der großzelligen Karzinomen der Lunge nachweisen, so dass vermutet wird, dass auch ein Teil der großzelligen Karzinome ihren Ursprung in SP-A produzierenden Zellen nehmen [73]. Im Gegensatz dazu ist die Arbeitsgruppe um Mizutani der Ansicht, dass SP-A produzierende Zellen lediglich bronchioloalveoläre und papilläre Karzinome generieren [38]. Mit der Entwicklung eines Antikörpers gegen das Surfactant Protein A ergibt sich die Möglichkeit, Lungenkarzinome auf die Expression von SP-A immunhistochemisch zu untersuchen. Falls hierbei eine positive Reaktion erzielt wird, gibt diese einen Hinweis auf die Herkunft der Tumorzellen aus Pneumozyten Typ II oder Clarazellen. Eine negative SP-A Reaktion schließt eine solche Abstammung jedoch nicht aus. In einer Studie von Wilde et al. [76] wiesen bronchioloalveoläre Karzinome die beste Überlebensrate und somit die günstigste Prognose auf. Clayton und Kollegen [14] verwiesen auf die Tumorzellausbreitung, sowie ebenfalls auf den Zelltyp der Ursprungszelle als wichtigen Prognosefaktor hin. Die Tumoren mit alveolärer Ausbreitung hatten die günstigste Prognose. Auch die Gruppe um Goldmann zeigt, dass SP-A bei der Diagnose von Karzinomen ungeklärten Ursprungs hilfreich sein kann [22]. Daher scheint es möglich, dass Tumoren, die noch die Fähigkeit zur SP-A Produktion besitzen, eine günstigere Prognose aufweisen, als solche, die diese Fähigkeit verloren haben. 17 Auch Delitionen des SP-A Gens bei Patienten mit NSCLC gehen mit einer schlechteren Prognose der betroffenen Patienten einher [31]. Unterschiedliche Allele des SP-A gehen mit erhöhtem Risiko für Karzinome der Lunge einher [55]. Adenokarzinome zeigen eine erhöhte SP-A1 und SP-A2 Transkriptionsaktivität und die SP-AmRNA Variabilität wächst mit zunehmendem Tumorgrading [59]. 18 1.2. Ziele dieser Arbeit 1) In dieser Arbeit soll die Surfactant Protein A Expression des Bronchialkarzinoms unter besonderer Berücksichtigung des nicht-bronchioloalveolären Adenokarzinoms und großzelligen Karzinomen adenoider Herkunft hinsichtlich ihrer prognostischen Bedeutung untersucht werden: - Gibt es einen Unterschied im 5-Jahres-Überleben von Patienten mit SP-A positiven und SP-A negativen Karzinomen der Lunge? 2) Weiterhin sollen bei diesen Karzinomen die Parameter Histologie, Tumorstadium, Operationsausmaß, Alter, Geschlecht, Nikotinkonsum hinsichtlich ihrer prognostischen Bedeutung untersucht werden: - Hat die Histologie einen Einfluss auf das 5-Jahres-Überleben? - Hat das Alter einen Einfluss auf das 5-Jahres-Überleben? - Hat das Geschlecht der Patienten einen Einfluss auf das 5-Jahres-Überleben? - Hat das Tumorstadium einen Einfluss auf das 5-Jahres-Überleben? - Hat der Nikotinkonsum der Patienten einen Einfluss auf das 5-Jahres-Überleben? - Hat das Operationsausmaß einen Einfluss auf das 5-Jahres-Überleben? 19 2. Material und Methoden 2.1. Material 2.1.1. Untersuchungskollektiv Die untersuchten Karzinome der Lunge stammten aus dem Einsendegut der Ruhrlandklinik Essen an die Abteilung für Pathologie der Ruhr-Universität Bochum aus dem Zeitraum von 1992 bis 1997. Alle aus diesem Zeitraum stammenden Lungenpräparate der Ruhrlandklinik, die in den Unterlagen des Pathologischen Institutes als Adenokarzinome oder großzellige Karzinome der Lunge klassifiziert wurden, sind erneut histologisch an Hand der vorhandenen HE und PAS Färbungen nach der WHO-Klassifikation eingeteilt worden. Die pTNM Stadien der untersuchten Adenokarzinome und der großzelligen Karzinome der Lunge wurden aus den vorhandenen Daten des Pathologischen Institutes der Ruhr-Universität Bochum übernommen. Daraufhin wurde bei allen Adenokarzinomen, die keine bronchioloalveolären Elemente enthielten, und bei allen großzelligen Karzinomen adenoider Herkunft an Hand von vorhandenen SP-A Färbungen die SP-A Expression der Tumorzellen beurteilt. 20 2.2. Methoden 2.2.1. Re-Klassifikation der Adenokarzinome und großzelligen Karzinome nach WHO Klassifikation Die erneute Klassifikation der untersuchten Bronchialkarzinome erfolgte in Anlehnung an die pathomorphologische Klassifikation der malignen epithelialen Lungentumoren der WHO von 1999 [69]. 2.2.2. HE- und PAS-Färbungen, SP-A-Immunreaktion Es wurden von jedem Präparat HE-Färbung und eine PAS-Färbung zur Tumorklassifikation herangezogen. Die Auswertung der SP-A Expression erfolgte an Paraffinschnitten mittels der indirekten Peroxidase Anti Peroxidase (PAP)-Methode nach Sternberger [58]. Der verwendete Primärantikörper gegen Surfactant Protein A ist ein polyklonaler Antikörper, der im Fraunhofer Institut in Hannover von Prof. Dr. W. Bartsch hergestellt wurde. Die Qualität dieses Antikörpers gegen SP-A ist mit der von kommerziell erhältlichen vergleichbar. 21 Abbildung 2.1: Großzelliges Karzinom der Lunge. HE-Färbung. Originalvergrößerung x 200 Abbildung 2.2: Azinäres Adenokarzionm der Lunge. HE-Färbung. Originalvergrößerung x 200 22 Abbildung 2.3: Solides Adenokarzinom der Lunge. HE-Färbung. Originalvergrößerung x 200 Abbildung 2.4: Papilläres Adenokarzinom der Lunge. HE-Färbung. Originalvergrößerung x 200 23 2.2.3. Auswertung der immunhistochemischen Reaktion Als „positiv“ wurden die Karzinome bezeichnet, die eine diffuse oder fokale Positivität der immunhistochemischen Reaktion im Zytoplasma der Tumorzellen zeigten (siehe Abb. 2.5, Abb. 2.6, Abb. 2.7). Abbildung 2.5: SP-A positive Tumorzellen eines großzelligen Karzinoms der Lunge. Immunhistochemischen SP-A Reaktion. Originalvergrößerung x 200 24 Abbildung 2.6: SP-A positive Tumorzellen eines azinären Adenokarzinoms der Lunge. Immunhistochemischen SP-A Reaktion. Originalvergrößerung x 200 Abbildung 2.7: SP-A positive Tumorzellen eines papillären Adenokarzinoms der Lunge. Immunhistochemischen SP-A Reaktion. Originalvergrößerung x 200 25 2.2.4. Externe Positivkontrolle Die externe Positivkontrolle, die den Erfolg der immunhistochemischen Reaktion nachweisen sollte und mit EMA-Primärantikörpern durchgeführt wurde, sollte in allen Fällen eine eindeutig positive Immunreaktion zeigen. 2.2.5. Interne Positivkontrolle Normale bzw. hyperplastische Typ II Pneumozyten im Randbereich des Tumors oder im angrenzenden Lungengewebe dienten als interne SP-A positive Kontrolle. 26 2.2.6. Datenerhebung Zu jedem Patienten wurden via Akteneinsicht folgende Daten ermittelt: • Eingangsnummer des Präparates • Eingangsdatum des Präparates • Geschlecht • Alter des Patienten zum Zeitpunkt der Operation • pTNM Stadium • Tumorstadium • Lokalisation des Tumors • Art der Operation • Nikotinabusus mit Angabe der Anzahl der Packyears • Angabe einer präoperativ durchgeführten Chemo- oder Strahlentherapie • Vorhandensein eines Zweittumors Als Beginn der Verlaufsbeobachtung wurde das Eingangsdatum des Präparates festgelegt. Der Beobachtungszeitraum betrug 60 Monate. Die Mortalität der Studienpatienten wurde durch Durchsicht der Krankenakten ermittelt. Dabei wurden Entlassungsdatum, Ambulanztermine sowie spätere stationäre Aufenthalte berücksichtigt. Für Patienten, bei denen aufgrund der Krankenhausdaten allein das 5-Jahres-Überleben nicht sicher ermittelt werden konnte, wurden Hausärzte schriftlich befragt. Am Ende der Beobachtungszeit wurde erhoben, ob die Patienten noch lebten oder bereits verstorben waren. Bei den verstorbenen Patienten wurde aufgezeichnet, ob sie am Tumor oder an einer anderen Ursache verstorben waren. Als Zielereignis wurde der Tod des Patienten in Folge des Tumorleidens definiert. Alle Patienten, die aus einer anderen Ursache verstorben waren, wurden ab dem Zeitpunkt ihres Todes in der weiteren Auswertung und Darstellung als zensiert betrachtet. 27 2.2.7. Ausschlusskriterien Alle Fälle, in denen die Patienten eine präoperative Chemo - oder Strahlentherapie erhalten hatten oder ein synchroner Zweittumor bestand, wurden von der Beobachtung ausgeschlossen. Ebenfalls wurden alle Fälle ausgeschlossen, bei denen keine Krankenakteneinsicht bestand, oder die Patienten, die direkt nach der Operation ihren Wohnsitz unbekannt verlegt haben und somit nicht weiter verfolgt werden können. 2.2.8. Statistik Zu Beginn der Studie ließen wir uns durch Mitarbeiter der Abteilung für Med. Informatik, Biometrie und Epidemiologie der Ruhr-Universität Bochum beraten. Zunächst wurde mit Microsoft Access eine Datenbank für alle gesammelten Daten angelegt. Demographische Daten wie Alter, Geschlecht und Nikotinabusus wurden deskriptiv unter der Angabe von Häufigkeit, Minimal– und Maximalwert, Mittelwert und Standardabweichung dargestellt. Die Analysen der erhobenen Daten erfolgten mit dem Statistikprogramm „Statistical Package for the Social Sciences“ (SPSS) Version 14.0 für Windows. Die Überlebenskurven wurden mit Kaplan-Meier-Methodik dargestellt. Die Unterschiede zwischen den Gruppen wurden mit dem Lok-Rang-Test geschätzt. Eine multivariate Analyse wurde mit der Regressionsanalyse nach Cox durchgeführt. Die Signifikanz wurde bei allen Tests bei einem p-Wert von kleiner 0,05 angenommen. 28 2.2.8.1. Kaplan-Meier-Methode Bei dieser Methode zerlegt man die Beobachtungszeit in möglichst kleine Zeitintervalle. Dann berechnet man für jedes Zeitintervall i die relative Häufigkeit, mit der die Probanden, die bis zum Beginn des i-ten Intervalls nicht an ihren Tumor verstorben waren, auch dieses Intervall überlebten. In die Berechnung gehen also auch alle zensierten Verläufe ein, die im i-ten Intervall unter Beobachtung standen. Die Rate derer, die nach T Zeitintervallen noch ereignisfrei sind, wird dann nach der Kaplan-Meier-Methode (product-limit method) über alle T Intervalle geschätzt. Über den Standartfehler kann man das 95%-Konfidenzintervall berechnen [26, 67]. 2.2.8.2. Log-Rank-Test Der Log-Rank-Test macht Aussagen darüber, ob die beobachteten Unterschiede in den Überlebenszeitkurven statistisch signifikant sind. Der Test gründet sich auf Unterschiede zwischen beobachteten und erwarteten Ereignisverläufen zu den einzelnen Zeitpunkten [26, 67]. 2.2.8.3. Regressionsanalyse nach Cox Mit diesem Verfahren kann man untersuchen, wie bestimmte Variablen, die auch Kovarianten genannt werden, die Überlebenswahrscheinlichkeit beeinflussen. Es handelt sich dabei um eine der multiplen Regressionsanalyse bzw. der logistischen Regression verwandte Methode, die auch die Einbeziehung zensierter Fälle gestattet. Der Effekt einer einzelnen prognostischen Variablen innerhalb dieser Variablenkonstellation ist an dem zugehörigen Regressionskoeffizienten β ablesbar. Wobei ein positiver Wert eine Erhöhung des Risikos anzeigt und ein negativer Wert ein verringertes Risiko [26, 67]. 29 3. Ergebnisse 3.1. Histologische Diagnose nach WHO-Kriterien der untersuchten Bronchialkarzinome Aus den primären Karzinomen der Lunge aus dem Einsendegut der Ruhrlandklinik Essen an die Abteilung für Pathologie der Ruhr-Universität Bochum aus dem Zeitraum von 1992 – 1997 konnten wir 252 primäre nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft herausfiltern. Bei 39 Patienten handelte es sich dabei um einen Zweittumor bzw. um eine fragliche Metastase eines Adenokarzinoms anderen Ursprungs, 22 Patienten hatten bereits eine präoperative Strahlen und/oder Chemotherapie erhalten, in 7 Fällen waren die Patienten direkt nach der OP verzogen, bei 6 Fällen konnten die zugehörigen Akten nicht gefunden werden. Es wurde an den verbliebenen insgesamt 178 primären Karzinomen der Lunge eine Auswertung durchgeführt. Dabei handelte es sich um 108 nicht-bronchioloalveoläre Adenokarzinome und 70 großzellige Karzinome adenoider Herkunft der Lunge. 30 3.1.1. Histologische Subklassen der nicht- bronchioloalveolären Adenokarzinome 108 der untersuchten Karzinome waren nicht-bronchioloalveoläre Adenokarzinome. Diese 108 Adenokarzinome untergliederten sich im Einzelnen in folgende Subtypen (siehe Abb. 3.1): 50 azinäre (46,3%), 21 solide (19,4%), 19 vom gemischten Zelltyp (17,6%), 14 papilläre (13,0%), 4 schleimbildende (3,7%). 60 Anzahl der Fälle 50 40 30 50 20 21 10 19 14 4 0 azinär Abbildung 3.1: solide gemischter Zelltyp Histologische Subklassifikation Adenokarzinome 31 papillär der 108 schleimbildend untersuchten 3.1.2. Histologische Subklassifikation der großzelligen Karzinome Bei 70 der untersuchten Tumoren handelte es sich um großzellige Karzinome adenoider Herkunft der Lunge. Darunter befanden sich 4 Karzinome (5,7%), die der klarzelligen Variante des großzelligen Karzinoms zuzurechnen waren (siehe Abb. 3.2). 70 60 Anzahl der Fälle 50 40 66 30 20 10 4 0 großzellige Karzinome klarzellige Variante Abbildung 3.2: Histologische Subklassifikation der 70 untersuchten großzelligen Karzinome 32 3.2. SP-A Expression der untersuchten Karzinome 3.2.1. SP-A Expression der nicht-bronchioloalveolären Adenokarzinome Von 108 untersuchten nicht-bronchioloalveolären Adenokarzinomen zeigten insgesamt 41 (38,0%) eine positive SP-A Reaktion, 67 (62,0%) dagegen zeigten eine negative SP-A Expression. Im Einzelnen fiel die SP-A Expression der verschiedenen Subtypen folgendermaßen aus (siehe Abb. 3.3): Von den 50 azinären Adenokarzinomen waren 20 (40,0%) SP-A positiv und 30 (60,0%) SP-A negativ. Unter den 21 soliden Karzinomen zeigte nur ein Tumor (4,8%) eine SP-A positive Reaktion. Die übrigen 20 (95,2%) Karzinome waren SP-A negativ. Bei den 19 Adenokarzinomen mit gemischtem Zelltyp fand sich bei 14 (73,7%) Tumoren eine positive SP-A Reaktion und bei 5 (26,3%) Tumoren fiel die SP-A Reaktion negativ aus. Von den 14 Adenokarzinomen, die histologisch dem papillären Subtyp zuzuordnen waren, waren 6 (42,9%) SP-A positiv und 8 (57,1%) SP-A negativ. Die 4 schleimbildenden Adenokarzinome schließlich zeigten alle eine negative SP-A Reaktion. 60 50 Anzahl der Fälle SP-A negativ 40 SP-A positv 30 30 20 5 10 20 20 8 14 1 0 azinär solide gemischter Zelltyp 6 4 papillär schleimbildend Abbildung 3.3: Anzahl der SP-A positiven und SP-A negativen Fälle innerhalb der einzelnen histologischen Subtypen der 108 untersuchten Adenokarzinome 33 3.2.2. SP-A Expression der großzellige Karzinome Von den 70 untersuchten großzelligen Karzinome adenoider Herkunft waren 19 (27,1%) Fälle SP-A positiv, die übrigen 51 (72,9%) Karzinome zeigten eine negative SP-A Expression (siehe Abb. 3.4). Unter diese 51 SP-A negativen großzelligen Karzinomen befanden sich auch die 4 Fälle, in denen es sich histologisch um die klarzellige Variante des großzelligen Karzinoms handelte. Anzahl der Fälle 70 60 SP-A negativ 50 SP-A positiv 40 47 30 20 10 19 4 0 großzellige Karzinome klarzellige Variante Abbildung 3.4: Anzahl der SP-A positiven und SP-A negativen Fälle in den einzelnen histologischen Subtypen der 70 untersuchten großzelligen Karzinome 34 3.3. Statistische Auswertung 3.3.1. Beschreibung des Patientenkollektivs 3.3.1.1. Verteilung der Tumorstadien 16 Patienten hatten ein Tumorstadium Ia, bei 56 Patienten lag das Tumorstadium Ib vor, 4 der Patienten wiesen ein Tumorstadium IIa auf, 29 Patienten waren im Tumorstadium IIb, 44 im Tumorstadium IIIa, 2 im Tumorstadium IIIb und bei 27 Patienten lag das Tumorstadium IV vor (siehe Abb. 3.5). 60 Anzahl der Fälle 50 40 30 56 44 20 29 10 27 16 2 4 0 Ia Ib IIa IIb IIIa IIIb Abbildung 3.5: Anzahl der Fälle verteilt auf die unterschiedlichen Tumorstadien 35 IV 3.3.1.2. Operationsausmaß Bei 30 Patienten wurde eine Pneumektomie durchgeführt, 148 Patienten erhielten einen kleineren Eingriff. Dies waren im Einzelnen 2 Keilexzissionen, 137 Lobektomien und 9 Bilobektomien (siehe Abb. 3.6). 160 140 Anzahl der Fälle 120 100 80 137 60 40 20 30 0 Pneumektomie Lobektomie 9 2 Bilobektomie Keilexzission Abbildung 3.6: Anzahl der Fälle mit unterschiedlichem Operationsausmaß 36 3.3.1.3. Demographische Daten 3.3.1.3.1 Geschlechtsverteilung Von den insgesamt 178 untersuchten Fällen waren 56 (31,5%) Patienten weiblich, 122 (68,5%) Patienten waren männlich. Unter den insgesamt 108 Fällen von nicht-bronchioloalveolären Adenokarzinomen waren 39 (36,1%) weibliche und 69 (63,9%) männliche Patienten. Und unter den insgesamt 70 großzelligen Karzinomen adenoider Herkunft befanden sich 17 (24,3%) weibliche und 53 (75,7%) männliche Patienten (siehe Abb. 3.7). 120 weiblich Anzahl der Fälle 100 männlich 80 69 60 53 40 20 39 17 0 Adenokarzinome großzellige Karzinome Abbildung 3.7: Verteilung der weiblichen und männlichen Patienten in der Gruppe der Adenokarzinome und der Gruppe der großzelligen Karzinome 37 3.3.1.3.2 Alter der Patienten Die Patienten waren bei Diagnosestellung zwischen 37 und 83 Jahren alt. Der Mittelwert lag bei 62 Jahren. Bei den nicht- bronchioloalveolären Adenokarzinomen lag das Alter zwischen einem Minimalwert von 37 Jahren und einem Maximalwert von 80 Jahren. Der Mittelwert betrug 61 Jahre, bei den SP-A positiven nicht-bronchioloalveolären Adenokarzinomen 61 Jahre, bei den SP-A negativen 61 Jahre. Bei den großzelligen Karzinomen adenoider Herkunft lag der Minimalwert bei 39 Jahren, der Maximalwert bei 83 Jahren. Der Mittelwert betrug hier 63 Jahre, bei den SP-A positiven 62 Jahre, bei den SP-A negativen 63 Jahre (siehe Tabelle 3.1). Tabelle 3.1: Übersicht über Minimal-, Maximal- und Mittelwert sowie die Standardabweichung des Alters der Patienten bei Diagnosestellung in Jahren Minimum Maximum Mittelwert Standardabweichung Gesamtkollektiv n=178 SP-A positive Fälle n=60 SP-A negative n=118 37 37 37 83 83 81 62 61 62 10 11 9 Adenokarzinome n=108 SP-A positive Fälle n=41 SP-A negative Fälle n=67 37 37 37 80 74 80 61 61 61 10 11 9 Großzellige Karzinome n=70 SP-A positive Fälle n=19 SP-A negative Fälle n=51 39 39 41 83 83 81 63 62 63 9 10 9 38 3.3.1.3.3 Nikotinabusus 23 Patienten waren sicher Nichtraucher, zu 44 Patienten fanden sich hierzu keine sicheren Angaben und 111 Patienten waren sicher Raucher (siehe Abb. 3.8). Von den 111 Rauchern hatten 68 (61,26%) Patienten ein nicht-bronchioloalveoläres Adenokarzinom und 43 (38,74%) Patienten ein großzelliges Karzinom adenoidr Herkunft. Von den 23 Nichtrauchern hatten 15 (65,22%) Patienten ein nichtbronchioloalveoläres Adenokarzinom und 8 (34,78) Patienten ein großzelliges Karzinom adenoider Herkunft (siehe Abb. 3.9). 78 der Patienten, die rauchten, waren männlich (70,27%) und 33 weiblich (29,73%). 13 der Nichtraucher waren männlich (56,52%) und 10 weiblich (43,48%). 120 Anzahl der Fälle 100 80 60 111 40 44 20 23 0 Nichtraucher Raucher keine Angaben Abbildung 3.8: Anzahl der Raucher und der Nichtraucher im untersuchten Kollektiv 39 120 Anzahl der Fälle 100 43 80 großzellige Karzinome Adenokarzinome 60 40 68 20 8 15 0 Raucher Nichtraucher Abbildung 3.9: Anzahl der Adenokarzinome und der großzelligen Karzinome innerhalb der Gruppe der Raucher und Nichtraucher 120 Anzahl der Fälle 100 33 weiblich 80 m ännlich 60 40 78 20 10 13 0 Raucher Nichtraucher Abbildung 3.10: Anzahl der männlichen und weiblichen Patienten innerhalb der Gruppe der Raucher und Nichtraucher 40 3.3.2. Vergleich der Überlebensfunktionen 3.3.2.1. Vergleich nach Histologie Das Überleben wurde getrennt nach dem Faktor Histologie für alle 178 Fälle mit der Kaplan-Meier-Methode analysiert. Der Unterschied im Überleben von Patienten mit einem nicht-bronchioloalveolären Adenokarzinom und solchen mit einem großzelligen Karzinom adenoider Herkunft ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,057, siehe Abb. 3.11). 1,0 Adenokarzinome Kum. Überleben 0,8 0,6 großzellige Karzinome 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.11: Überlebensfunktion nach Kaplan-Meier für Adenokarzinome und großzellige Karzinome, Log-Rank-Test nicht signifikant, p=0,057. 41 3.3.2.2. Vergleich der Überlebenskurven nach SP-A Expression 3.3.2.2.1 Vergleich nach SP-A Expression am Gesamtkollektiv Das Überleben wurde getrennt nach dem Faktor SP-A Expression für alle 178 Fälle mit der Kaplan-Meier-Methode analysiert. Der Unterschied im Überleben von SP-A positiven Fällen und SP-A negativen Fällen ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,367, siehe Abb. 3.12). 1,0 0,8 Kum. Überleben SP-A negative Fälle 0,6 SP-A positive Fälle 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.12: Überlebensfunktion nach Kaplan-Meier für SP-A positive und SP-A negative Karzinome, Log-Rank-Test nicht signifikant, p=0,367. 42 3.3.2.2.2 Vergleich der SP-A Expression der Adenokarzinome Das Überleben wurde getrennt nach dem Faktor SP-A Expression für alle 108 Fälle, in denen ein nicht-bronchioloalveoläres Adenokarzinom vorlag, mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben von SP-A positiven und negativen Fällen ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,303, siehe Abb. 3.13). 1,0 Kum. Überleben 0,8 SP-A negative Fälle 0,6 SP-A positive Fälle 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.13: Überlebensfunktion nach Kaplan-Meier für SP-A positive und SP-A negative Adenokarzinome, Log-Rank-Test nicht signifikant, p=0,303. 43 3.3.2.2.3 Vergleich der SP-A Expression der großzelligen Karzinome Das Überleben wurde getrennt nach dem Faktor SP-A Expression für alle 70 Fälle, in denen ein großzelliges Karzinom adenoider Herkunft vorlag, mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben von SP-A positiven und negativen Fällen ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p = 0,544, siehe Abb. 3.14). 1,0 0,8 Kum. Überleben SP-A negative Fälle 0,6 SP-A positive Fälle 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.14: Überlebensfunktion nach Kaplan-Meier für SP-A positive und SP-A negative großzellige Karzinome, Log-Rank-Test nicht signifikant, p = 0,544. 44 3.3.2.3. Vergleich der Überlebensfunktionen nach Tumorstadium 3.3.2.3.1 Vergleich nach Tumorstadium beim Gesamtkollektiv Das Überleben wurde getrennt nach dem Faktor Tumorstadium für alle 178 Fälle mit der Kaplan-Meier-Methode analysiert. Hierzu wurden die Tumorstadien Ia und Ib mit höheren Tumorstadien verglichen. Der Unterschied im Überleben von Patienten mit den Tumorstadien Ia und Ib und Patienten mit höheren Tumorstadien ist im untersuchten Kollektiv signifikant besser für Patienten mit einem Tumorstadium I (Logrank-Test signifikant, p<0,001, siehe Abb. 3.15). 1,0 Tumorstadium 1a und 1b Kum. Überleben 0,8 0,6 höhere Tumorstadien 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.15: Überlebensfunktion nach Kaplan-Meier für Tumorstadium I und höhere Tumorstadien, Log-Rank-Test signifikant, p<0,001. 45 Das Überleben wurden zusätzlich nach dem Faktor Tumorstadium IIb und IIIa für alle 178 Fälle nach der Kaplan-Meier-Methode analysiert. Der Unterschied ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p= 0,407; siehe Abb. 3.16). 1,0 0,8 Kum. Überleben Stadium 2b 0,6 Stadium 3a 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.16: Überlebensfunktion nach Kaplan-Meier für Tumorstadium IIb und IIIa, Log-Rank-Test nicht signifikant, p=0,407. 46 3.3.2.3.2 Vergleich nach Tumorstadium der Adenokarzinome Das Überleben wurde getrennt nach dem Faktor Tumorstadium für alle 108 Fälle, in denen ein nicht-bronchioloalveoläres Adenokarzinom vorlag, mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben ist im untersuchten Kollektiv signifikant besser für Patienten mit einem Tumor im Stadium I (Logrank-Test signifikant, p=0,001; siehe Abb. 3.17). 1,0 Tumorstadium 1a und 1b Kum. Überleben 0,8 0,6 höheres Tumorstadium 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.17: Überlebensfunktion nach Kaplan-Meier für Tumorstadium I und höhere Tumorstadien bei den Adenokarzinomen, Log-Rank-Test signifikant, p<0,001 47 Das Überleben wurden zusätzlich nach dem Faktor Tumorstadium IIb und IIIa für alle 108 Fälle, in denen ein nicht-bronchioloalveoläres Adenokarzinom vorlag, nach der Kaplan-Meier-Methode analysiert. Der Unterschied ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p= 0,311; siehe Abb. 3.18). 1,0 Stadium2b Kum. Überleben 0,8 0,6 Stadium 3a 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.18: Überlebensfunktion nach Kaplan-Meier für Tumorstadium IIb und IIIa bei Adenokarzinomen, Log-Rank-Test nicht signifikant, p=0,311. 48 3.3.2.3.3 Vergleich nach Tumorstadium der großzelligen Karzinome Das Überleben wurde getrennt nach dem Faktor Tumorstadium für alle 70 Fälle in denen ein großzelliges Karzinom adenoider Herkunft vorlag mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben ist im untersuchten Kollektiv signifikant besser für Patienten mit einem Tumor im Stadium I(Logrank-Test signifikant, p<0,0001; siehe Abb. 3.19). 1,0 Tumorstadium 1a und 1b Kum. Überleben 0,8 höheres Tumorstadium 0,6 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.19: Überlebensfunktion nach Kaplan-Meier für Tumorstadium I und höhere Tumorstadien bei großzelligen Karzinomen, Log-Rank-Test signifikant, p<0,001. 49 Das Überleben wurden zusätzlich nach dem Faktor Tumorstadium IIb und IIIa für alle 70 Fälle, in denen ein großzelliges Karzinom adenoider Herkunft vorlag, nach der Kaplan-Meier-Methode analysiert. Der Unterschied ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p= 0,635; siehe Abb. 3.20). 1,0 Kum. Überleben 0,8 Stadium 2b 0,6 Stadium 3a 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.20: Überlebensfunktion nach Kaplan-Meier für Tumorstadium IIb und IIIa bei großzelligen Karzinomen, Log-Rank-Test nicht signifikant, p=0,635. 50 3.3.2.4. Vergleich der Überlebenskurven nach Operationsausmaß 3.3.2.4.1 Vergleich nach Operationsausmaß am Gesamtkollektiv Das Überleben wurde getrennt nach dem Faktor Operationsausmaß für alle 178 Fälle mit der Kaplan-Meier-Methode analysiert. Es wurden die Fälle, in denen eine Pneumonektomie durchgeführt wurde, mit den Fällen, in denen ein kleinerer Eingriff wie eine Keil- oder Lappenresektion durchgeführt wurde, verglichen. Das Überleben von Patienten, bei denen eine Pneumonektomie erfolgte, ist im untersuchten Kollektiv signifikant schlechter als das der Patienten, bei denen kleinere Eingriffe durchgeführt wurden (Log-Rank-Test signifikant, p<0,0001, siehe Abb. 3.21). 1,0 kleinere Eingriffe Kum. Überleben 0,8 0,6 Pneumonektomie 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.21: Überlebensfunktion nach Kaplan-Meier für Patienten mit Pneumonektomie und kleineren Eingriffen, Log-Rank-Test signifikant, p<0,0001 51 3.3.2.4.2 Vergleich nach Operationsausmaß der Adenokarzinome Das Überleben wurde getrennt nach dem Faktor Ausmaß der Operation für alle 108 Fälle in denen ein nicht-bronchioloalveoläres Adenokarzinom vorlag, mit der KaplanMeier-Methode analysiert. Der Unterschied im Überleben von Patienten mit Pneumonektomie und solchen, bei denen ein kleinerer Eingriff durchgeführt wurde, ist im untersuchten Kollektiv signifikant (Log-Rank-Test signifikant, p<0,001, siehe Abb. 3.22). 1,0 kleinere Eingriffe Kum. Überleben 0,8 0,6 Pneumonektomie 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.22: Überlebensfunktion nach Kaplan-Meier für Patienten, bei denen ein Adenokarzinomen vorlag, verglichen nach Operationsausmaß, Log-Rank-Test signifikant, p<0,001 52 3.3.2.4.3 Vergleich nach Operationsausmaß der großzelligen Karzinome Das Überleben wurde getrennt nach dem Faktor Operationsausmaß für alle 70 Fälle, in denen ein großzelliges Karzinom adenoider Herkunft vorlag, mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben von Patienten mit Pneumonektomie und solchen, bei denen ein kleinerer Eingriff durchgeführt wurde, ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,106; siehe Abb. 3.23). 1,0 0,8 Kum. Überleben kleinere Eingriffe 0,6 0,4 Pneumonektomie 0,2 0,0 0 10 20 30 40 50 60 Überlebensfunktion in Monaten Abbildung 3.23: Überlebensfunktion nach Kaplan-Meier für Patienten, bei denen ein großzelliges Karzinom vorlag, verglichen nach Operationsausmaß, Log-Rank-Test nicht signifikant, p=0,106 53 3.3.2.5. Vergleich der Überlebensfunktion nach Geschlecht der Patienten 3.3.2.5.1 Vergleich nach Geschlecht beim Gesamtkollektiv Das Überleben wurde getrennt nach dem Faktor Geschlecht für alle 178 Fälle mit der Kaplan-Meier-Methode analysiert. Der Unterschied im Überleben von männlichen und weiblichen Patienten ist im untersuchten Kollektiv nicht signifikant (Log-RankTest nicht signifikant, p=0,447; siehe Abb. 3.24). 1,0 0,8 Kum. Überleben weibliche Patienten 0,6 männliche Patienten 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.24: Überlebensfunktion nach Kaplan-Meier für männliche und weibliche Patienten, Lok-Rank-Test nicht signifikant, p=0,447 54 3.3.2.5.2 Vergleich nach Geschlecht der Patienten mit Adenokarzinomen Das Überleben wurde getrennt nach dem Faktor Geschlecht für alle 108 Fälle, in denen ein nicht-bronchioloalveoläres Adenokarzinom vorlag, mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben von männlichen und weiblichen Patienten ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,867; siehe Abb. 3.25). 1,0 weibliche Patienten 0,8 Kum. Überleben männliche Patienten 0,6 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.25: Überlebensfunktion nach Kaplan-Meier für männliche und weibliche Patienten mit Adenokarzinomen, Log-Rank-Test nicht signifikant, p=0,867 55 3.3.2.5.3 Vergleich nach Geschlecht der Patienten mit großzelligen Karzinomen Das Überleben wurde getrennt nach dem Faktor Geschlecht für alle 70 Fälle, in denen ein großzelliges Karzinom adenoider Herkunft vorlag, mit der Kaplan-MeierMethode analysiert. Der Unterschied im Überleben von männlichen und weiblichen Patienten ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,588; siehe Abb. 3.26). 1,0 Kum. Überleben 0,8 weibliche Patienten 0,6 männliche Patienten 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.26: Überlebensfunktion nach Kaplan-Meier für männliche und weibliche Patienten mit großzelligen Karzinomen, Log-Rank-Test nicht signifikant, p=0,588 56 3.3.2.6. Vergleich der Überlebensfunktionen nach Alter der Patienten 3.3.2.6.1 Vergleich nach Alter der Patienten im Gesamtkollekitv Das Überleben wurde getrennt nach dem Faktor Alter für alle 178 Fälle mit der Kaplan-Meier-Methode analysiert. Der Unterschied im Überleben der Patienten ist im untersuchten Kollektiv signifikant besser für die älteren Patienten (Log-Rank-Test signifikant, p=0,031; siehe Abb. 3.27). 1,0 über 69-jährige Kum. Überleben 0,8 0,6 unter 70-jährige 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.27: Überlebensfunktion nach Kaplan-Meier für die unterschiedlichen Altersgruppen, Log-Rank-Test signifikant, p=0,031. 57 3.3.2.6.2 Vergleich nach Alter der Patienten mit Adenokarzinomen Das Überleben wurde getrennt nach dem Faktor Alter für alle 108 Fälle, in denen ein nicht-bronchioloalveoläres Adenokarzinom vorlag, mit der Kaplan-Meier-Methode analysiert. Der Unterschied im Überleben der Patienten ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,206, siehe Abb. 3.28). 1,0 über 69-jährige Kum. Überleben 0,8 0,6 unter 70-jährige 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.28: Überlebensfunktion nach Kaplan-Meier für die unterschiedlichen Altergruppen innerhalb der Adenokarzinomen: Log-Rank-Test nicht signifikant, p=0,206 58 3.3.2.6.3 Vergleich nach Alter der Patienten mit großzelligen Karzinomen Das Überleben wurde getrennt nach dem Faktor Alter für alle 70 Fälle, in denen ein großzelliges Karzinom adenoider Herkunft vorlag, mit der Kaplan-Meier-Methode analysiert. Der Unterschied im Überleben ist im untersuchten Kollektiv nicht signifikant (Log-Rank-Test nicht signifikant, p=0,084, siehe Abb. 3.29). 1,0 über 69-jährige Kum. Überleben 0,8 0,6 unter 70-jährige 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.29: Überlebensfunktion nach Kaplan-Meier für die unterschiedlichen Altersgruppen innerhalb der großzelligen Karzinome, Log-Rank-Test nicht signifikant, p= 0,084 59 3.3.2.7. Vergleich der Überlebenskurven nach Rauchern und Nichtrauchern 3.3.2.7.1 Vergleich nach Rauchern am Gesamtkollektiv Das Überleben wurde getrennt nach dem Faktor Raucher bzw. Nichtraucher für die 134 Fälle, zu denen dazu Daten vorlagen, mit der Kaplan-Meier-Methode analysiert. Das Überleben der 111 Patienten, die Raucher waren, war besser als das der 23 Nichtraucher. Dieser Unterschied war signifikant (Log-Rank-Test signifikant, p=0,018, siehe Abb. 3.30.). 1,0 Raucher Kum. Überleben 0,8 0,6 Nichtraucher 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.30: Überlebensfunktion nach Kaplan-Meier für Raucher und Nichtraucher, Log-Rank-Test signifikant, p=0,185. 60 3.3.2.7.2 Vergleich nach Rauchern bei Adenokarzinomen Das Überleben wurde getrennt nach dem Faktor Raucher bzw. Nichtraucher für die 83 Fälle von nicht-bronchioloalveolären Adenokarzinomen, zu denen dazu Daten vorlagen, mit der Kaplan-Meier-Methode analysiert. Das Überleben der 68 Patienten, die Raucher waren war besser als das der 15 Nichtraucher. Dieser Unterschied war nicht signifikant (Log-Rank-Test nicht signifikant, p=0,185, siehe Abb. 3.31). 1,0 Raucher Kum. Überleben 0,8 0,6 Nichtraucher 0,4 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.31: Überlebensfunktion nach Kaplan-Meier für Raucher und Nichtraucher innerhalb der Adenokarzinome, Log-Rank-Test nicht signifikant, p=0,185. 61 3.3.2.7.3 Vergleich nach Rauchern bei Großzellern Das Überleben wurde getrennt nach dem Faktor Raucher bzw. Nichtraucher für die 51 Fälle von großzelligen Karzinomen adenoider Herkunft, zu denen dazu Daten vorlagen, mit der Kaplan-Meier-Methode analysiert. Das Überleben der 43 Patienten, die Raucher waren war besser als das der 8 Nichtraucher. Dieser Unterschied war signifikant (Log-Rank-Test signifikant, p=0,009, siehe Abb. 3.32). 1,0 Kum. Überleben 0,8 Raucher 0,6 0,4 Nichtraucher 0,2 0,0 0 10 20 30 40 50 60 Überlebenszeit in Monaten Abbildung 3.32: Überlebensfunktion nach Kaplan-Meier für Raucher und Nichtraucher innerhalb der großzelligen Karzinome, Log-Rank-Test signifikant, p=0,009. 62 3.3.3. Regressionsanalyse nach Cox Der Einfluss von Histologie, SP-A Expression, Tumorstadium, Operationsausmaß, Geschlecht, Alter und Rauchgewohnheiten auf die Überlebenskurve wurde mit der Regressionsanalyse nach Cox ausgewertet (siehe Tabelle 3.2). Dabei zeigten sich für das Tumorstadium, das Operationsausmaß, das Alter und die Rauchgewohnheiten jeweils signifikante Werte. Bei den Kovarianten Histologie, SP-A Expression und Geschlecht lag der p-Wert im nicht signifikanten Bereich. Tabelle 3.2: Ergebnisse der Regressionsanalyse nach Cox Kovarianten p-Wert Signifikanz Histologie 0,125 n.s. SP-A Expression 0,136 n.s. Operationsausmaß 0,032 s. <0,001 s. Geschlecht 0,614 n.s. Alter 0,029 s. Raucher 0,047 s. Tumorstadium 63 4. Diskussion 4.1. Überblick In dieser Arbeit wurden 108 primäre nicht-bronchioloalveoläre Adenokarzinome der Lunge sowie 70 großzellige Karzinome der Lunge adenoider Herkunft untersucht. Es erfolgte eine Re-Klassifikation der Adenokarzinome und der großzelligen Karzinome adenoider Herkunft anhand der WHO-Kriterien [69], da in dieser Studie nur primäre nicht-bronchioloalveoläre Adenokarzinome der Lunge und großzellige Karzinome adenoider Herkunft der Lunge untersucht werden sollten. Diese Unterscheidung war anhand der vorhandenen Aufzeichnungen in den Patientenakten nicht sicher möglich. Zudem war die histologische Untersuchung, die in den Patientenakten vorlag, von verschiedenen Untersuchern durchgeführt worden. Um eine einheitliche Bewertung zu erhalten, erfolgte daher eine erneute Klassifikation. Die Parameter Alter der Patienten bei Diagnosestellung, Geschlecht, Tumorstadium, Nikotinkonsum, Operationsausmaß, die aus den Akten der Ruhrlandklinik erhoben werden konnten, wurden hinsichtlich ihrer prognostischen Bedeutung in Bezug auf das 5-Jahres-Überleben ausgewertet. Weiterhin wurde die Expression von Surfactant Protein A in den Tumorzellen und die prognostische Bedeutung dieser Expression untersucht. 64 4.2. Diskussion der Ergebnisse 4.2.1. Histologische Re-Klassifikation Es wurde an insgesamt 178 primären Karzinomen der Lunge eine histologische ReKlassifikation durchgeführt (siehe Seite 31-32). Es fanden sich 108 Adenokarzinome, die sich im Einzelnen in folgende Subtypen untergliederten: 50 azinäre (46,3%), 21 solide (19,4%), 19 vom gemischten Zelltyp (17,6%), 14 papilläre (13,0%), 4 schleimbildende (3,7%). Bei 70 der untersuchten Tumoren handelte es sich um großzellige Karzinome adenoider Herkunft. Darunter befanden sich 4 Karzinome (5,7%), die der klarzelligen Variante des großzelligen Karzinoms zuzurechnen waren. Diese Re-Klassifikation nahmen wir vor, da in dieser Studie ausschließlich nicht bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft betrachtet werden sollten. Wir gehen von einem Konzept aus, wonach die chemische Karzinogenese im Bronchialepithel von Erwachsenen zu Typ II Pneumozyten-Karzinomen mit verschiedenen glandulären Wachstumsmustern führen, also sowohl azinäre als auch adenoidzystische oder bronchioloalveoläre Karzinome daraus entstehen. Dieses Konzept konnten Ten Heve-Opbroek et al. [64] und Hirata et al. [28] mit ihren Daten ebenfalls unterstützen. 65 4.2.2. SP-A Expression der untersuchten Karzinome In der vorliegenden Arbeit konnten wir zeigen, dass auch primäre Adenokarzinome der Lunge, die kein bronchioloalveoläres Wachstumsmuster zeigen, SP-A expremieren. Diese Beobachtung wurde auch von Ueno et al. [72] gemacht. In der genannten Untersuchung wurden die Adenokarzinome jedoch nicht in die verschiedenen Subtypen untergliedert, wie wir es in dieser Arbeit differenziert haben. Bei der vorliegenden Untersuchung handelt es sich um das größte Kollektiv von azinären und soliden Adenokarzinomen mit Schleimproduktion, das bisher analysiert wurde. Wir fanden heraus, dass 40% der azinären und 4,8% der soliden Adenokarzinomen der Lunge intrazytoplasmatische Expression von SP-A zeigen. Bei den papillären Adenokarzinomen zeigten 42,9% eine Expression von SP-A und bei den Adenokarzinomen mit gemischtem Zelltyp waren es 73,7%. Die schleimbildenden Adenokarzinome zeigten in keinem Fall eine Expression von SP-A (siehe Seite 33). In einer Studie von Mizutani et al. [38] wurde geschlossen, dass ausschließlich Tumoren mit Typ II Pneumozyten oder Clarzellen, also bronchioloalveoläre und papilläre Adenokarzinome, SP-A positiv sind. Ten Heve-Opbroek et al. [64] hingegen konnten mit ihren Daten das Konzept unterstützen, wonach die chemische Karzinogenese im Bronchialepithel von Erwachsenen zu Typ II Pneumozyten-Karzinomen mit verschiedene glandulären Wachstumsmustern führen, also sowohl azinäre als auch adenoidzystische oder bronchioloalveoläre Karzinome daraus entstehen. Im Gegensatz zu Mizutani et al. [38] unterstützen unsere Daten die Theorie [28, 64], dass SP-A produzierende Zellen nicht nur bronchioloalveoläre und papilläre Karzinome generieren, sondern auch andere Subtypen von Adenokarzinomen der Lunge, wie etwa azinäre und solide Adenokarzinome mit Schleimproduktion. In zwei vorangegangenen Arbeiten konnte unsere Arbeitsgruppe ebenfalls zeigen [73, 74], dass SP-A produzierende Zellen nicht nur bronchioloalveoläre und papilläre 66 Karzinome generieren, sondern auch andere Subtypen von Adenokarzinomen der Lunge, wie etwa azinäre und solide Adenokarzinome mit Schleimproduktion. In unserer Studie konnten wir auch zeigen, dass ein kleiner Teil der großzelligen Karzinome SP-A positiv sind. Es fand sich bei 27,1% der großzelligen Karzinome eine SP-A Expression (siehe Seite 34). Kitinya et al. [35] untersuchten unter anderem 43 primäre großzellige Karzinome der Lunge und berichten ebenfalls von zumindest einem SP-A positiven primären großzelligen Karzinom der Lunge. Mizutani et al. [38] hingegen fanden SP-A positive Zellen nur in Adenokarzinomen, nicht jedoch in anderen histologischen Typen primärer Karzinome der Lunge. 67 4.2.3. Prognostische Bedeutung der untersuchten Parameter 4.2.3.1. Histologie der Tumoren Die vorliegende Arbeit ist die erste in der Literatur, in der die Gruppe von nichtbronchioloalveolären Adenokarzinomen der Lunge und großzelligen Karzinomen adenoider Herkunft der Lunge in ihrer prognostischen Bedeutung über 5 Jahre klinisch verfolgt wurden. In dieser Studie zeigen Patienten mit nicht-bronchioloalveolären Adenokarzinomen tendenziell ein besseres Überleben als Patienten mit großzelligen Karzinomen adenoider Herkunft (siehe Abb. 3.9). Dieser Unterschied ist jedoch im Log-Rank-Test gerade nicht signifikant (p = 0,057). Da der p-Wert aber sehr nah an der Grenze zur Signifikanz liegt, erfolgte die Auswertung der übrigen Faktoren nicht nur am Gesamtkollektiv, sondern zusätzlich unterteilt nach Adenokarzinomen und großzelligen Karzinomen. Die Histologie hat in multivariaten Analysen eine unabhängige prognostische Bedeutung für das Langzeitüberleben gezeigt [16, 37, 49, 50]. In einer Studie von Mizushima et al. [37] wurde das Überleben von Patienten nach Pneumektomie und kleineren Eingriffen in bezug auf den histologischen Zelltyp des Karzinoms untersucht [37]. Allerdings wurden in dieser Studie Adenokarzinome und Plattenepithelkarzinome verglichen. Adenokarzinome hatten in dieser Untersuchung eine schlechtere Prognose als Plattenepithelkarzinome. Eine weitere Studie beschäftigte sich mit dem Überleben von Patienten mit NSCLC in Schweden. Hier konnten die Erfahrungen, dass Adenokarzinome im Vergleich zu Plattenepithelkarzinomen eine schlechtere Prognose aufweisen, nicht bestätigt werden [6]. In einer Studie von Wilde et al. [76] wiesen die Patienten mit bronchioloalveolären Karzinomen die beste Überlebensrate und somit die günstigste Prognose auf. 68 Dies fand sich auch in der Untersuchung von Sakao und Mitarbeitern, in der kleine Adenokarzinome in zwei Gruppen aufgeteilt wurden. Solche mit minimaler oder fehlender bronchioloalveolären Komponenten zeigten ein aggressives biologisches Verhalten. Gemischte Adenokarzinome mit bronchioloalveoläre Anteilen waren weniger aggressiv und hatten eine günstigere 5-Jahres-Überlebensrate [54]. Clayton et al. [14] verwiesen auf die Tumorzellausbreitung, sowie ebenfalls auf den Zelltyp der Ursprungszelle als wichtigen Prognosefaktor. Die Tumoren mit alveolärer Ausbreitung hatten die günstigste Prognose. 69 4.2.3.2. SP-A Expression der Tumoren Die Expression von SP-A im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) zeigt im Log-Rank-Test keine signifikante prognostische Bedeutung. Allerdings haben Patienten mit Karzinomen, die SP-A Expression zeigen, tendenziell ein schlechteres Überleben (siehe Abb. 3.12). Die Expression von SP-A bei nicht-bronchioloalveolären Adenokarzinomen zeigt in der vorliegenden Untersuchung im Log-Rank-Test ebenfalls keine signifikante prognostische Bedeutung (siehe Abb. 3.13). Das Überleben der Patienten mit SP-A positiven Adenokarzinomen war aber auch hier tendenziell schlechter als das der Patienten mit SP-A negativen nicht-bronchioloalveolären Adenokarzinomen. Da die Überlebenskurven der Patienten mit SP-A positiven und SP-A negativen nicht-bronchioloalveolären Adenokarzinomen mit der Zeit jedoch immer stärker auseinanderweichen, stellt sich die Frage, ob der Unterschied für das 10-JahresÜberleben signifikant wird. Diese Frage wird jetzt in einer weitern Studie untersucht. Auch die Expression von SP-A bei großzelligen Lungenkarzinomen adenoider Herkunft zeigte in dieser Untersuchung im Log-Rank-Test keinen signifikanten Unterschied hinsichtlich der prognostischen Bedeutung (siehe Abb. 3.14). Auch in dieser Gruppe wiesen die Patienten mit SP-A positiven Tumoren ein - wenn auch nicht signifikant - schlechteres Überleben im Vergleich zu den Patienten mit SP-A negativen Tumoren auf. Diese Beobachtung korrelieren mit den Ergebnissen von Tsutsumida et al. [71], die die Relation von MUC1 zur SP-A Expression von 185 nicht-bronchioloalveolären Adenokarzinomen untersucht haben und dabei eine Assoziation zwischen einer hohen MUC1/SP-A Relation und einem schlechten Outcome für die Patienten fanden. 70 4.2.3.3. Tumorstadium bei der Operation Im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) sowie in den beiden Untergruppen (nichtbronchioloalveoläre Adenokarzinome und großzellige Karzinome getrennt voneinander betrachtet) hatte das Tumorstadium I im Vergleich zu höheren Tumorstadien im Log-Rank-Test eine signifikante Bedeutung hinsichtlich der Prognose des Überlebens der Patienten (siehe Abb. 15, Abb. 3.17, Abb. 3.19). Dieses Ergebnis stimmt mit den in der Literatur beschriebenen Ergebnissen vieler Studien überein [7, 12, 33, 45, 49, 50, 65, 75, 80]. Allerdings wird dort häufig auch das TNM Stadium zum Vergleich herangezogen. Hingegen zeigte sich zwischen dem Tumorstadium IIb und dem Tumorstadium IIIa in unserem Kollektiv sowohl im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) als auch in den beiden Untergruppen (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome getrennt voneinander betrachtet) kein signifikanter Unterschied im 5-Jahres-Überleben (siehe Abb. 3.16, Abb. 3.18, Abb. 3.20). So konnten Yildizeli et al. [80] zeigen, dass insbesondere ein N2 Stadium und das Tumorstadium III die Prognose signifikant verschlechtern. Auch Pfannschmidt et al. [49] fanden ein signifikant schlechteres Überleben von Patienten mit dem Tumorstadium IIIa im Vergleich zu Patienten mit dem Tumorstadium IIb. Dies zeigt sich tendenziell auch in unserem Kollektiv, allerdings sind die Werte nicht signifikant. Und in einer weiteren Studie von Pfannschmidt et al. [50] fand sich auch ein signifikant schlechteres Überleben von Patienten mit dem Tumorstaium IIIb im Vergleich mit Patienten im Tumorstadium IV. Dieser Vergleich war an unserem Kollektiv leider nicht möglich, da es lediglich einen nicht zensierten Fall im Tumorstadium IIIb gab. 71 Ohashi et al. [45] untersuchten prognostische Faktoren für Patienten mit inoperablem NSCLC. Auch hier fand sich ein frühes N Stadium als signifikanter Faktor für ein besseres Überleben. Togashi et al. [65] untersuchten Patienten, deren NSCLC komplett reseziert werden konnte. Hier zeigte sich mit zunehmendem Tumorstadium sowohl ein schlechteres Überleben als auch eine höhere Rückfallrate. Caldarella et al. [7] untersuchten Patienten mit N1-Stadium. In dieser Untersuchung wird angeregt, auch das Stadium N1 in weitere Untergruppen zu gliedern, da verschiedene Subgruppen Unterschiede in Bezug auf das Überleben aufweisen. So hat das Vorhandensein von hilären Lymphknotenmetastasen eine prognostische Bedeutung. Das 5-Jahres-Überleben der Patienten mit pulmonalen Metastasen betrug 41,2%, das der Patienten mit hilären Lymphknotenmetastasen 21,8%. 72 4.2.3.4. Operationsausmaß Im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) zeigten Patienten, bei denen eine Pneumektomie durchgeführt wurde, im Log-Rank-Test ein signifikant schlechteres Überleben als solche, bei denen ein kleiner Eingriff erfolgte (p<0,001) (siehe Abb. 3.21). Dies zeigte sich auch bei der Untergruppe der Patienten mit nicht- bronchioloalveolären Adenokarzinomen (p<0,001) (siehe Abb. 3.22). Da das Operationsausmaß eng mit einem weiter fortgeschrittenen Tumorleiden verbunden ist, zeigt sich dieses Ergebnis auch in einer anderen Studie [50]. Für die Untergruppe der Patienten mit großzelligen Karzinomen adenoider Herkunft zeigt sich jedoch im Log-Rank-Test kein signifikanter Unterschied (p=0,106) (siehe Abb. 3.23). Allerdings wurde eine Pneumektomie in dieser Untergruppe nur bei 15 Patienten durchgeführt. Es handelt sich als hierbei um eine sehr kleine Fallzahl, so dass dieses Ergebnis an einer größeren Gruppe überprüft werden sollte. Pfannschmidt et al. [50] untersuchte in einer retrospektiven Studie 2376 Patienten mit NSCLC, die zwischen den Jahren 1996 und 2005 behandelt wurden. Diese Arbeitsgruppe benutzten ebenfalls das Cox Model zur Regressionsanalyse. Diese Arbeitsgruppe zeigte mit ihren Daten in Übereinstimmung mit unseren Ergebnissen, dass das Tumorstadium, das Operationsausmaß und das Alter das Überleben signifikant beeinflussen. Im Gegensatz zu unseren Ergebnissen waren dort auch das Geschlecht und die Histologie unabhängige Prognosefaktoren. Die Rauchgewohnheiten und die Expression von SP-A wurden von Pfannschmidt et al. [50] nicht untersucht. 73 4.2.3.5. Geschlecht Im Gegensatz zu anderen Studien, bei denen sich ein besseres Überleben für weibliche Patienten zeigt, hatte in dem von uns untersuchten Kollektiv das Geschlecht im Log-Rank-Test weder im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) noch bei den beiden Untergruppen, den nicht-bronchioloalveolären Adenokarzinomen und den großzelligen Karzinomen adenoider Herkunft, eine prognostisch signifikante Bedeutung (siehe Abb. 3.24 bis Abb. 3.26) [3, 10, 16, 45, 49, 50, 51, 77]. Pfannschmidt et al. [50] führten eine Regressionsanalyse durch, bei der sich, im Gegensatz zu unseren Ergebnissen, das Geschlecht als unabhängige Prognosefaktoren herausstellte. Auch in einer weiteren Studie von Pfannschmidt et al. [49], zeigten sich in einer multivariaten Analyse unter anderem das Geschlecht als prognostisch signifikanter Faktor. Ohashi et al. [45] untersuchten in einer retrospektiven Analyse 121 Patienten mit inoperablem NSCLC. Sie zeigten in einer multivariaten Analyse unter anderem, dass das weibliches Geschlecht mit einem besseren Überleben assoziiert sind. Rauchgewohnheiten, Alter und die Expression von SP-A wurden nicht betrachtet. Im Gegensatz dazu hatte in unserer Arbeit das Geschlecht keine prognostische Bedeutung gezeigt. Allerdings haben wir auch eine andere Gruppe von Patienten untersucht. Die Patienten in unserer Studie hatten operable Tumoren, wohingegen Ohashi et al. Patienten mit inoperablen Tumoren untersuchten. In einer Studie von Coscio et al. [16] wurde die Vermutung geäußert, dass das Vorhandensein von Östrogenrezeptoren in den Lungenkarzinomzellen für das bessere Überleben von Frauen im Vergleich zu Männern verantwortlich sein könnte. 74 4.2.3.6. Alter der Patienten bei der Tumoroperation Im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) zeigt sich im Log-Rank-Test ein signifikant besseres Überleben der Patienten, die 70 Jahre und älter waren (siehe Abb. 3.27). Der p-Wert lag bei 0,031. In den Untergruppen (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome getrennt voneinander betrachtet) war dieser Unterschied zwar nicht signifikant, die älteren Patienten hatten aber auch hier tendenziell ein besseres Überleben (siehe Abb. 3.28 und Abb. 3.29). In einer Studie von Yamamoto et al. [79] hatten ältere Patienten ein zu den jüngeren Patienten vergleichbares Überleben, der Unterschied war dort nicht signifikant [79]. Das bessere Überleben der älteren Patienten entsprach nicht unseren Erwartungen. Zunächst vermuteten wir eine Überlagerung durch einen anderen prognostisch relevanten Faktor, der in der Gruppe der älteren Patienten häufiger vertreten seien könnte. Aber auch in der Regressionsanalyse nach Cox zeigt sich ein signifikant besseres 5-Jahres-Überleben der älteren Patienten. Möglicherweise liegt der Grund für das längere Überleben von den über 69-jährigen Patienten in einem langsameren Tumorwachstum bei diesen Patienten. 75 4.2.3.7. Rauchgewohnheiten Im Gesamtkollektiv (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome adenoider Herkunft der Lunge) zeigt sich im Log-Rank-Test kein signifikanter Unterschied für den Faktor Rauchen (siehe Abb. 3.30). In den beiden Untergruppen (nicht-bronchioloalveoläre Adenokarzinome und großzellige Karzinome getrennt voneinander betrachtet) zeigten Patienten, die rauchten, ein signifikant bessere Überleben. Der p-Wert von Patienten mit Adenokarzinomen lag bei 0,185 und der p-Wert bei den Patienten mit großzelligen Karzinomen bei 0,009 (siehe Abb. 3.31 und Abb. 3.32). Yoshino et al. [82] untersuchten Karzinome der Lunge im Stadium I. Sie fanden, dass in der Untergruppe der Patienten mit Adenokarzinomen das Rauchverhalten ein unabhängiger prognostischer Faktor ist. In dieser Studie wurde auch zwischen bronchioloalveolären und nicht-bronchioloalveoläre Adenokarzinomen unterschieden. In beiden Subgruppen zeigten Raucher ein schlechtere Überleben. In einer vorangegangenen Studie [81], bei der nicht nach histologischen Subtyp unterschieden wurde, fand diese Arbeitsgruppe keinen signifikanten Unterschied im Überleben von Rauchern und Nichtrauchern mit NSCLC. In einer Studie von Toh et al. [66] wurde kein signifikanter Unterschied im Outcome zwischen Rauchern und Nichtrauchern gefunden. Bei den untersuchten Fällen wurde in dieser Studie nicht nach dem histologischen Typ getrennt betrachtet. Es handelt sich zu 54% um Patienten mit Adenokarzinomen und zu 22% Patienten mit Plattenepithelkarzinomen. Die Nichtraucher waren zu 73,9% weiblich. In einer Studie von Nordquist et al., in der Patienten mit Adenokarzinomen untersucht wurden, fand sich ein signifikant besseres Überleben der Nichtraucher [42]. In dieser Studie waren die Patienten, die Nichtraucher waren, hauptsächlich weiblich. Bei unserem Patientenkollektiv war die Mehrzahl der nichtrauchenden Patienten hingegen männlich (13 von 23; 56,52%). 76 Und auch in der Studie von Yildizeli et al. [80] zeigten die Raucher eine höhere Komplikationsrate im Anschluss an die Tumoroperation. In dieser Studie wurden allerdings die histologischen Typen nicht, wie in unser Studie, getrennt von einander betrachtet. Es handelte Plattenepithelkarzinome, sich nur darüber 21% der Adenokarzinome. 77 hinaus hauptsächlich untersuchten (75%) Karzinome um waren 4.2.3.8. Regressionsanalyse nach Cox In der Regressionsanalyse nach Cox zeigten sich für das Tumorstadium, das Operationsausmaß, das Alter und die Rauchgewohnheiten jeweils signifikante Werte. So haben Patienten mit Pneumektomie ein signifikant schlechteres 5-JahresÜberleben im Vergleich zu Patienten, bei denen kleinere Eingriffe durchgeführt wurden. Patienten, die bei der Durchführung der Tumoroperation älter als 69 Jahre waren, zeigen ein besseres 5-Jahres-Überleben als jüngere Patienten. Patienten, die rauchten, zeigten ebenfalls ein besseres 5-Jahres-Überleben. Bei den Kovarianten Histologie, SP-A Expression und Geschlecht lag der p-Wert im nicht signifikanten Bereich (siehe Seite 63). In der bereits genannten Studie von Pfannschmidt et al. [50], in der ebenfalls das Cox Model zur Regressionsanalyse benutzt wurde, zeigten die Daten in Übereinstimmung mit unseren Ergebnissen, dass das Tumorstadium, das Operationsausmaß und das Alter das Überleben signifikant beeinflussen. Im Gegensatz zu unseren Ergebnissen waren dort auch das Geschlecht und die Histologie unabhängige Prognosefaktoren. Die Rauchgewohnheiten und die Expression von SP-A wurden von Pfannschmidt et al. [50] in dieser Studie nicht untersucht. Auch in einer weiteren bereits erwähnten Studie von Pfannschmidt et al. [49], zeigten sich in einer multivariaten Analyse Geschlecht und Histologie als prognostisch signifikante Faktoren. Ohashi et al. [45] untersuchten in einer retrospektiven Analyse 121 Patienten mit inoperablem NSCLC. Sie zeigten in einer multivariaten Analyse, dass ein frühes N Stadium, weibliches Geschlecht, und Chemo- bzw. Radiotherapie – dieses haben wir nicht betrachtet - mit einem besseren Überleben assoziiert sind. Rauchgewohnheiten, Alter und die Expression von SP-A wurden von Ohashi et al. nicht betrachtet. Im Gegensatz zur oben genannten Arbeit hatte in unserer Arbeit das Geschlecht keine prognostische Bedeutung gezeigt. Allerdings haben wir eine andere Gruppe 78 von Patienten untersucht. Die Patienten in unserer Studie hatten operable Tumoren, wohingegen Ohashi et al. Patienten mit inoperablen Tumoren untersuchten. Yildizeli et al. [80] untersuchten in einer retrospektiven Analyse 218 Patienten die sich in den Jahren 1981 – 2005 einer Manschettenresektion wegen eines NSCLC unterzogen und fanden in ihrer multivariaten Analyse das N stadium und das Tumorstadium als signifikante prognostische Faktoren. Caldarella et al. [7] untersuchten ebenfalls mit Hilfe der Regessionsanalyse nach Cox 112 Patienten mit einem N1 Lymphknoten Stadium und fanden heraus, dass das Vorhandensein hilärer Lymphknotenmetastasen prognostisch relevant ist. Warum in anderen Studien das Geschlecht ein unabhängiger prognostisch signifikanter Faktor ist und dies sich bei uns nicht zeigt kann nicht abschließend geklärt werden. Auch das bessere 5-Jahres-Überleben der Raucher, das sich bereits im Log-RankTest zeigt, erweist sich in diesem Kollektiv entgegen unseren Erwartungen und im Wiederspruch zur gefundenen Literatur in der Regressionsanalyse nach Cox als unabhängiger Prognosefaktor. Warum die Raucher in diesem Kollektiv das bessere Überlegen zeigen, bleibt letztlich gleichfalls ungeklärt. 79 5. Schlussfolgerung In der vorliegenden Arbeit konnten wir zeigen, dass auch primäre Adenokarzinome der Lunge, die kein bronchioloalveoläres Wachstumsmuster zeigen, SP-A exprimieren können. Wir konnten ebenfalls zeigen, dass ein Teil der primären großzelligen Karzinome der Lunge adenoider Herkunft SP-A exprimieren können. Die Patienten mit SP-A positiven Karzinomen haben in dieser Arbeit ein tendenziell schlechteres 5-Jahres-Überleben. Ob die Untergruppe der Patienten mit Adenokarzinomen mit SP-A Expression ein signifikant schlechteres 10-JahresÜberleben aufweist, muss noch in einer weiteren Arbeit untersucht werden. Die Faktoren Histologie der Tumoren und Geschlecht der Patienten erwiesen sich in dieser Arbeit nicht als prognostisch relevante Faktoren. Dagegen zeigten sich Rauchen und ein höheres Lebensalter als positive Einflussfaktoren. Die Faktoren Operationsausmaß, Tumorstadium, Alter und Nikotinkonsum zeigten in dieser Arbeit eine unabhängige prognostische Bedeutung für das 5-JahresÜberleben von Patienten mit primären nicht-bronchioloalveolären Adenokarzinomen der Lunge und primären großzelligen Karzinomen adenoider Herkunft der Lunge. 80 6. Literatur [1] Alexiou, C., Onyeaka, C. V., Beggs, D., Akar, R., Beggs, L., Salama, F. D., Duffy, J. P., and Morgan, W. E. (2002). Do women live longer following lung resection for carcinoma? Eur.J.Cardiothorac.Surg. 21, 319-325 [2] AWMF (2004). Interdisziplinäre Leitlinie der Deutschen Krebsgesellschaft. AWMF-Leitlinien-Register Nr. 032/007, [3] Belani, C. P., Marts, S., Schiller, J., and Socinski, M. A. (2007). Women and lung cancer: Epidemiology, tumor biology, and emerging trends in clinical research. Lung Cancer 55, 15-23 [4] Blanchon, F., Grivaux, M., Asselain, B., Labeas, F. X., Orlando, J. P., Piquet, J., and Zureik, M. (2006). 4-year mortality in patients with non-small-cell lung cancer: develompment and validation of a prognostic index. Lancet.Oncol. 7, 829-836 [5] Bouchardy, C., Fioretta, G., De Perrot, M., Obradovic, M., and Spiliopoulos, A. (1999). Determinants of long term survival after surgery for cancer of the lung: A population-based study. Cancer 86, 2229-2237 [6] Brooks, D. R., Klint, A., Dickman, P. W., Stahle, E., and Lambe, M. (2007). Temporal trends in non-small cell lung cancer survival in Sweden. Br.J.Cancer 96, 519-522 [7] Caldarella, A., Crocetti, E., Comin, C. E., Janni, A., Pegna, A. L., and Paci, E. (2006). Prognostic variability among nonsmall cell lung cancer patients with pathologic N1 lymph node involvement. Epidemiological figures with strong clinical implications. Cancer 107, 793-798 [8] Camilo, R., Capelozzi, V. L., Siqueria, S. A., and Del Carlo Bernardi, F. (2006). Expression of p63, keratin 5/6, keratin 7, and surfacatnt-A in non-small cell lung carcinoma. Hum.Pathol. 37, 542-546 [9] Cangir, A. K., Kutlay, H., Akal, M., Gungor, A., Ozdemir, N., and Akay, H. (2004). Prognostic value of tumor size in non-small cell lung cancer larger than five centimeters in diameter. Lung Cancer 46, 325-331 [10] Chatkin, J. M., Abreu, C. M., Fritscher, C. C., Wagner, M. B., and Pinto, J. A. (2004). Is there a gender difference in non-small cell lung cancer survival? Gend Med. 1, 41-47 [11] Chen, K. Y., Lee, Y. C., Lai, J. M., Chang, Y. L., Yu, C. J., Huang, C. Y., and Yang, P. C. (2007). Identification of trophinin as an enhancer for cell invasion and a prognostic factor for early stage lung cancer. Eur J Cancer 43, 782-790 [12] Christian, C., Erica, S., and Morandi, U. (2006). The prognostic impact of tumor size in resected stage I non-small cell lung cancer: evidence for a two thresholds tumor diameters classification. Lung Cancer 54, 185-191 81 [13] Classen, M., Diehl, V., and Kochsiek, K. (1993). Innere Medizin. Urban und Schwarzenberg, München, 1137 [14] Clayton, F. (1986). Bronchioloalveolar carcinomas. Cell types, patterns of growth, and prognostic correlates. Cancer 57, 1555-1564 [15] Cortas, T., Eisenberg, R., Fu, P., Kern, J., Patrick, L., and Dowlati, A. (2007). Activation state egfr and STAT-3 as prognostic markers in resected non-small cell lung cancer. Lung Cancer 55, 349-355 [16] Coscio, A. M. and Garst, J. (2006). Lung cancer in women. Curr.Oncol.Rep. 8, 248-251 [17] Dairaku, M., Sueishi, K., Tanaka, K., and Horie, A. (1983). Immunohistological analysis of surfactant-apoprotein in the bronchiolo-alveolar carcinoma. Virchows Arch.A Pathol.Anat.Histopathol. 400, 223-234 [18] Dobbs, L. G. (1989). Pulmonary Surfactant. Ann.Rev.Med. 40, 431-446 [19] Floros, J. (1990). Sixty years of surfactant research. Am.J.Physiol. 2, 238-240 [20] Fukuoka, J., Dracheva, T., Shih, J. H., Hewitt, S. M., Fujii, T., Kishor, A., Mann, F., Shilo, K., Franks, T. J., Travis, W. D., and Jen, J. (2007). Desmoglein 3 as a prognostic factor in lung cancer. Hum.Pathol. 38, 276-283 [21] Gazdar, A. F., Linnoila, R. I., Kurita, Y., Oie, H. K., Mulshine, J. L., Clark, J. C., and Whitsett, J. A. (1990). Peripheral airway cell differentiation in human lung cancer cell lines. Cancer Res. 50, 5481-5487 [22] Goldmann, T., Galle, J., Wiedorn, K. H., Deutschbein, M. E., Neuhaus, M., Branscheid, D., and Vollmer, E. (2001). Diagnostic value of immunhistochemically detected surfactant-aporotein-A in malignant tumors located in the lungs: report of two cases. Ann Diagn Pathol. 5, 84-90 [23] Gong, Y., Hirano, T., Kato, Y., Yoshida, K., Shou, Y., Ohira, T., Ikeda, N., Ebihara, Y., and Kato, H. (2002). Phosphorylated tyrosine-containing proteins in primary lung cancer correlates with proliferation and prognosis. Br.J.Cancer 86, 1893-1898 [24] Hamm, H., Bartsch, W., and Fabel, H. (1992). The surfactant system of the adult lung: physiology and clinical perspectives. Clin.Investig. 70, 637-657 [25] Han, C. H., Cho, J. Y., Moon, J. T., Kim, S. K., Kim, H. J., Shin, D. H., Chang, J., Ahn, C. M., and Chang, Y. S. (2006). Clinical significance of insulin receptor substrate-I down-regulation in non-small cell lung cancer. Oncol.Rep. 16, 1205-1210 [26] Harms, V. (1998). Biomathematik, Statistik und Dokumentation. Harms Verlag 7.ed, 216-221 82 [27] Hilbe, W., Dirnhofer, S., Oberwasserlechner, F., Eisterer, W., Ammann, K., Schmid, T., Hilbe, G., Thaler, J., and Wolle, E. (2003). Immunohistochemical typing of non-small cell lung cancer on cryostat sections: correlation with clinical parameters and prognisis. J.Clin.Pathol. 56, 736-741 [28] Hirata, H., Noguchi, M., Shimosato, Y., Uei, Y., and Goya, T. (1990). Clinicopathologic and immunhistochemical characteristics of bronchial gland type adenocarcinoma of the lung. Am.J.Clin.Pathol. 93, 20-25 [29] Hsu, W. H., Huang, C. S., Hsu, H. S., Lee, H. C., Huang, B. S., and Huang, M. H. (2007). Preoperativ serum carcinoembryonic antigen level is a prognostic factor in women with early non-small-cell lung cancer. Ann.Thorac.Surg 83, 419-424 [30] Jacques, J. and Currie, W. (1977). Bronchiolo-alveolar carcinoma: a Clara cell tumor? Cancer 40, 2171-2180 [31] Jiang, F., Caraway, N. P., Nebiyou Bekele, B., Zhang, H. Z., Khanna, A., Wang, H., Li, R., Fernandez, R. L., Zaidi, T. M., Johnston, D. A., and Katz, R. L. (2005). Surfactant protein A gene delition and prognostics of patients with stage I non-small cell lung cancer. Clin.Cancer.Res. 11, 5417-5424 [32] Junge, B. (1997). Passivrauchen: Wie gefährlich ist es wirklich? Pharm Ztg. 142, 1791-1800 [33] Kawamukai, K., Cesario, A., Margaritora, S., Meacci, E., Piraino, A., Vita, M. L., Tessitore, A., Cusumano, G., and Granone, P. (2004). Tnm independent prognostic factors in lung cancer. Rays. 29, 373-376 [34] King, R. J., Klass, D. J., Gikas, E. G., and Clements, J. A. (1973). Isolation of apoproteins from canine surface active material. Am.J.Physiol. 224, 788-795 [35] Kitinya, J. N., Sueishi, K., Tanaka, K., and Katsuda, Y. (1986). Immunoreactivity of surfactant-apoprotein in adeocarcinomas, large cell and small cell carcinomas of the lung. Acta Patholo Jpn 36, 1271-1278 [36] Mascaux, C., Martin, B., Paesmans, M., Berghmans, T., Dusart, M., Haller, A., Lothaire, P., Meert, A. P., Lafitte, J. J., and Sculier, J. P. (2006). Has Cox-2 a prognostic role in non-small-cell lung cancer? A systematic review of the literature with meta-analysis of the survival results. Br.J.Cancer 95, 139-145 [37] Mizushima, Y., Sugiyaama, S., Noto, H., Kusajima, Y., Yamashita, R., Sassa, K., and Kobayashi, M. (1998). Prognosis for patients with pneumonectomy or lesser resections for non-small cell lung cancer based on histologic cell type. Oncology Reports 5, 689-692 [38] Mizutani, Y., Nakajima, T., Morinaga, S., Gotoh, M., Shimosato, Y., Akino, T., and Suzuki, A. (1988). Immunohistochemical localization of pulmonary surfactant apoproteins in various lung tumors. Special reference to nonmucus producing lung adenocarcinomas. Cancer 61, 532-537 83 [39] Morgenroth, K. (1986). Das Surfactantsystem der Lunge. de Gruyter 1-46 [40] Naruke, T., Goya, T., Tsuchiya, R., and Suemasu, K. (1988). Prognosis and survival in resected lung carcinoma based on the new international staging system. J.Thorac.Cardiovasc.Surg. 96, 440-447 [41] Nguyen, X. c., Lee, W. W., Chung, J. H., Park, S. Y., Sung, S. W., Kim, Y. K., So, Y., Lee, D. S., Chung, J. K., Lee, M. C., and Kim, S. E. (2007). FDG uptake, glucose transporter type 1, and Ki-67 expressions in non-small-cell lung cancer: Correlation and prognostic values. Eur.J.Radiol. 62, 214-219 [42] Nordquist, L. T., Simon, G. R., Cantor, A., Alberts, W. M., and Bepler, G. (2004). Improved Survival in Never-Smokers vs Current Smokers with primary Adenokarcinoma of the lung. Chest. 126, 347-351 [43] Offersen, B. V., Pfeiffer, P., Andreasen, P., and Overgaard, J. (2007). Urokinase plasminogen activator and plasminogen activator inhibitor type-1 in nonsmall-cell lung cancer: Relation to prognosis and angiogenesis. Lung Cancer 56, 43-50 [44] Ogata, T. and Endo, K. (1984). Clara cell granules of peripheral lung cancers. Cancer 54, 1635-1644 [45] Ohashi, R., Takahashi, K., Ishiwata, T., Sakuraba, S., and Fukuchi, Y. (2006). Prognostic factors in patients with inoperable non-small cell lung cancer - an analysis of long-term survival patients. Gan.To.Kagaku.Ryoho. 33, 1595-1602 [46] Ohtsuka, T., Nomori, H., Watanabe, K., Kaji, M., Naruke, T., Suemasu, K., and Uno, K. (2006). Prognostic significance of [(18)F]fluorodeoxyglucose uptake on positron emission tomography in patients with pathologic stage I lung adenocarcimoma. Cancer 107, 2468-2473 [47] Ota, N., Kawakami, K., Okuda, T., Takehara, A., Hiranuma, C., Oyama, K., Ota, Y., Oda, M., and Watanabe, G. (2006). Prognostic significance of p16(INK4a) hypermethylation in non-small cell lung cancer is evident by quantitative DNA methylation analysis. Anticancer.Res. 26, 3729-3732 [48] Pankow, W., Bittinger, A., and Wichert, P. (1989). [The Clara cell]. Pneumologie 43, 277-283 [49] Pfannschmidt, J., Muley, T., Bulzebruck, H., Hoffmann, H., and Dienemann, H. (2007). Prognostic assessment after surgical resection for non-small cell lung cancer: Experiences in 2083 patients. Lung Cancer 55, 371-377 [50] Pfannschmidt, J., Muley, T., Hoffmann, H., Bulzebruck, H., and Dienemann, H. (2006). Prognosis after complete surgical resection for non-small cell lung cancer based on the staging classifikation. Dtsch.Med.Wochenschr. 131, 2643-2648 [51] Porojnicu, A. C., Robsahm, T. E., Dahlback, A., Berg, J. P., Christiani, D., Brulan, O. S., and Moan, J. (2007). Seasonal and geographical variations in lung cancer prognosis in Norway. Does Vitamin D from the sun play a role? Lung Cancer 55, 263-270 84 [52] Rego, A., Oliveira, A., Barroso, A., Conde, S., Lira, A., Miranda, J., Leal, F., and Parente, B. (2005). Surgical treatment of lung cancer and prognostic value of tumor markers. Rev Port Pneumol. 11, 35-36 [53] Rehm, S., Lijinsky, W., Singh, G., and Katyal, S. L. (1991). Mouse bronchiolar cell carcinogenesis. Histologic characterization and expression of Clara cell antigen in lesions induced by N-nitrosobis-(2-chloroethyl) ureas. Am.J.Pathol. 139, 413-422 [54] Sakao, Y., Miyamoto, H., Sakuraba, M., Oh, T., Shiomi, K., Sonobe, S., and Izumi, H. (2007). Prognostic significance of a histologic subtype in small adenocarcinoma of the lung: the impact of nonbronchioloalveolar carcinoma componentes. Ann Thorac Surg 83, 209-214 [55] Seifert, C., Lin, H. M., Seifert, U., Plagens, A., DiAngelo, S., von Wichert, P., and Floros, J. (2005). Rare SP-A alleles and the SP-A1-6A849 allele associate with risk for lung carcinoma. Clin.Genet. 68, 128-136 [56] Sonobe, M., Nakagawa, M., Takenaka, K., Katakura, H., Adachi, M., Yanagihara, K., Otake, Y., Wada, H., and Tanaka, F. (2007). Influence of epidermal growth factor (EGFR) gene mutations on the expression of EGFR, phosphoryl-AKT, and phosphoryl-MAPK, and on the prognosis of patients with non-small cell lung cancer. J.Surg.Oncol. 95, 63-69 [57] Statistisches Bundesamt (1990). Todesursachen 1988. Kohlhammer, Stuttgard [58] Sternberger, L. A. (1979). Immunocytochemistry. John Wiley and Sons, New York [59] Stoffers, M., Goldmann, T., Branscheid, D., Galle, J., and Vollmer, E. (2004). Trnscriptional activity of surfactant-apoproteins A1 and A2 in non-small cell lung carcinomas and tumor-free lung tissues. Pneumologie 58, 395-399 [60] Strauss, M. J. (1983). Lung Cancer. Clinical Diagnosis and Treatment. Grune and Stratton, New York, 63-84 [61] Suzuki, A., Shijubo, N., Yamada, G., Ichimiya, S., Satoh, M., Abe, S., and Sato, N. (2005). Napsin A is useful to distinguish primary lung adenocarcinoma from adenocarcinoma of other organs. Pathol.Res.Pract. 201, 579-586 [62] Szelachowska, J., Jelen, M., and Kornafel, J. (2006). Prognostic significance of intracellular laminin and Her2/neu overexpression in non-small cell lung cancer. Anticancer.Res. 26, 3871-3876 [63] Szymanowska, A., Jassem, E., Dziadziuszko, R., Skrzypski, M., KobierskaGulida, G., Holm, K., Borg, A., Rzyman, W., Limon, J., and Jassem, J. (2005). Analysis of prognostic value of TP53 gene mutation in non-small cell lung cancer. Pneumonol.Alergol.Pol. 73, 264-269 85 [64] Ten Heve-Opbroek, A. A., Hammond, W. G., Benfield, J. R., Teplitz, R. L., and Dijkman, J. H. (1993). Expression of alveolar typ II cell markers in acinar adenocarcinomas and adenoid cystic carcinomas arising from segmental bronchi. A study in a heterotopic bronchogenic carcinoma model in dogs. Am.J.Pathol. 142, 1251-1264 [65] Togashi, K., Saito, M., Asami, F., Niyoshi, S., and Tanba, H. (2006). Longterm results after recurrence of completely resected primary lung cancer. Kyobu.Geka 59, 1137-1140 [66] Toh, C., Wong, E., Lim, W., Leong, S., and Tan, E. (2004). The Impact of Smoking Status on the Behavior and Survival Outcome of Patients with Advanced Non-small Cell Lung Cancer. Chest 126, 1750-1756 [67] Trampisch, H. J. and Windeler, J. (1997). Medizinische Statistik. Springer 2.ed, 333-346 [68] Trape, J., Buxo, J., Perez deOlaguer, J., and Vidal, C. (2003). Tumor markers as prognostic factors in treated non-small cell lung cancer. Anticancer Res. 23, 4277-4281 [69] Travis, W. D., Colby, T. V., Corrin, B., Shimosato, Y., and Brambilla, E. (1999). Histological Typing of Lung and Pleural Tumours. Springer 3.ed, 1-70 [70] Tsutsumida, H., Goto, M., Kitajima, S., Kubota, I., Hirotsu, Y., Wakimoto, J., Batra, S. K., Imai, K., and Yonezawa, S. (2007). MUC4 expression correlates with poor prognosis in small-sized lung adenocarcinoma. Lung Cancer 55, 195-203 [71] Tsutsumida, H., Goto, M., Kitajima, S., Kubota, I., Hirotsu, Y., and Yonezawa, S. (2004). Combined status of MUC1 mucin and surfactant apoprotein A expression can predict the outcome of patients with small-size lung adenocarcinoma. Histopathology 44, 147-155 [72] Ueno, T., Linder, S., and Elmberger, G. (2003). Aspartic proteinase napsin is a useful marker for diagnosis of primary lung adenocarcinoma. Br.J.Cancer 88, 1229-1233 [73] Uzaslan, E., Ebsen, M., Stuempel, T., Freudenberg, N., Nakamura, S., Costabel, U., and Guzman, J. (2006). Surfactant protein A detection in large cell carcinoma of the lung. Appl.Immunohistochem.Mol.Morphol. 14, 88-90 [74] Uzaslan, E., Stuempel, T., Ebsen, M., Freudenberg, N., Nakamura, S., Costabel, U., and Guzman, J. (2005). Surfactant protein A detection in primary pulmonary adenocarcinoma without bronchioloalveolar pattern. Respiration 72, 249-253 [75] Volpino, P., Cavallaro, A., Cangemi, R., Chiarotti, F., De Cesare, A., Fiori, E., Bononi, M., Vigliarolo, R., and Cangemi, V. (2003). Comparative analysis of clinical features and prognostic factors in resected bronchioloalveolar carcinoma and adenocarcinoma of the lung. Anticancer Res. 23, 4959-4965 86 [76] Wilde, J., Haenselt, V., Luft, D., Luft, P., and Welker, L. (1990). [The relationship of histological type and tumor location to prognosis in 1000 patients with lung resection with special reference to adenocarcinoma]. Pneumologie 44, 1287-1293 [77] Williams, D. E., Pairolero, P. C., Davis, C. S., Bernatz, P. E., Payne, W. S., Taylor, W. F., Uhlenhopp, M. A., and Fontana, R. S. (1981). Survival of patients surgically treated for stage I lung cancer. J.Thorac.Cardiovasc.Surg. 82, 70-76 [78] Wittekind, C. and Wagner, G. (1997). UICC TNM-Klassifikation maligner Tumoren. Springer, Berlin Heidelberg New York [79] Yamamoto, K., Padilla Alarcon, J., Calvo Mediana, V., Garcia-Zaraza, A., Pastor Guillen, J., Blasco Armengod, E., and Paris Romeu, F. (2003). Surgical results of stage I non-small cell lung cancer: comparison between elderly and younger patients. Eur.J.Cardiothorac.Surg. 23, 21-25 [80] Yildizeli, B., Fadel, E., Mussot, S., Fabre, D., Chataigner, O., and Dartevelle, P. G. (2007). Morbidity, mortality, and long-term survival after sleeve lobectomy for non-small cell lung cancer. Eur.J.Cardiothorac.Surg. 31, 95-102 [81] Yoshino, I., Baba, H., and Fukuyama, F. (2002). A time trend of profile and surgical results in 1123 patients with non-small cell lung cancer. Surgery 131, 226-231 [82] Yoshino, I., Kawano, D., Oba, T., and Maehara, Y. (2006). Smoking Status as a Prognostic Factor in PAtients with Stage I Pulmonary Adenocarcinoma. Ann Thorac Surg 81, 1189-1193 [83] Zamecnik, J. and Kodet, R. (2002). Value of thyroid transcription factor-1 and surfactant apoprotein A in the differential diagnosis of pulmonary carcinomas. a study of 109 cases. Virchows Arch. 440, 353-361 [84] Zech, V. F., Dlaska, M., Tzankov, A., and Hilbe, W. (2006). Prognostic and diagnostic relevance of hnRNP A2/B1 and S100 A2 in non-small cell lung cancer. Cancer.Detect.Prev. 30, 395-402 87 8 GZ 12 AD 13 AD 15 AD 17 GZ 19 AD 21 AD 25 AD 30 AD 31 GZ 35 GZ 45 AD 47 AD 48 AD 67 AD 70 AD 79 AD 88 GZ 97 AD 101 GZ 113 AD 115 AD 116 GZ 118 AD 120 GZ 129 AD 130 AD 136 AD 145 AD 151 GZ 161 AD 165 AD 172 GZ 173 AD 175 AD 7 GZ ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja nein 63 m 41 w 74 m 72 w 83 w 49 w 60 w 70 w 58 m 60 m 65 m 74 m 50 m 56 m 73 w 63 m 65 m 72 m 71 w 64 m 45 m 37 m 44 w 60 w 72 m 72 m 59 m 68 m 55 m 57 m 72 m 66 m 70 m 66 w 70 m 57 w nein nein nein nein nein nein nein ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. nein 2b 1a 3a 2b 1a 2a 1b 1b 1b 1b 1b 1a 1b 2b 1b 1b 1b 4 3a 1b 1a 4 1b 1a 1b 3a 1b 2b 2b 1a 3a 1b 4 1a 1b 1b Pneumonektomie UL-Res. OL-Res. OL-Res. UL-Res. UL-Res. OL-Res. UL-Res. OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. Pneumonektomie UL-Res. OL-Res. OL-Res. UL-Res. OL-Res. Pneumonektomie OL-Res. Pneumonektomie OL-Res. OL-Res. OL-Res. Bilobektomie OL-Res. OL-Res. OL-Res. UL-Res. OL-Res. OL-Res. UL-Res. OL-Res. OL-Res. OL-Res. 88 22 25 >60 >60 33 >60 >60 >60 >60 >60 >60 >60 17 21 >60 11 23 6 28 >60 >60 30 11 >60 1 1 >60 1 24 16 18 29 18 >60 16 >60 am Tumor gestorben Überlebenszeit in Monaten Operationsausmaß T N M 2 10 1 00 2 20 2 10 1 00 1 10 2 00 2 00 2 00 2 00 2 00 1 00 2 00 2 10 2 00 2 00 2 00 2 01 1 20 2 00 1 00 3 11 2 00 1 00 2 00 2 20 2 00 2 10 3 00 1 00 2 20 2 00 2 11 1 00 2 00 2 00 Tumorstadium Raucher Geschlecht des Patienten Alter des Patienten bei Diagnosestellung SP-A Reaktion Histologie Fallnummer Anhang Nein Nein Nein Nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja 2b 4 3a 4 1b 1b 1a 1b 1b 2b 1b 2b 3a 3a 2b 1b 1b 1b 1a 1b 1a 1b 3a 3a 1b 1a 1a 3a 3a 3a 1b 2b 3a 4 1b 3a 1b 1b 2b 1b 1b 1b 1b 1b Bilobektomie OL-Res Pneumonektomie UL-Res. UL-Res. Pneumonektomie OL-Res. Pneumonektomie UL-Res. Bilobektomie OL-Res. Bilobektomie OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. UL-Res. OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. Pneumonektomie UL-Res. UL-Res. OL-Res. OL-Res. OL-Res OL-Res. OL-Res. Bilobektomie Bilobektomie OL-Res. OL-Manschettenres. Pneumonektomie OL-Res. UL-Res. OL-Res. UL-Res. OL-Res. UL-Res. ML-Res. OL-Res. 89 38 16 20 25 >60 >60 70 21 >60 31 66 >60 >60 >60 >60 >60 59 >60 52 >60 >60 >60 34 14 >60 >60 82 33 >60 0 >60 >60 >60 >60 59 6 >60 >60 22 >60 >60 >60 >60 66 am Tumor gestorben Überlebenszeit in Monaten T N M 2 10 2 01 2 20 4 21 2 00 2 00 1 00 2 00 2 00 2 10 2 00 2 10 2 20 2 20 2 10 2 00 2 00 2 00 1 00 2 00 1 00 2 00 1 20 3 10 2 00 1 00 1 00 2 20 2 20 3 10 2 00 2 10 2 20 1 01 2 00 2 20 2 00 2 00 2 10 2 00 2 00 2 00 2 00 2 00 Operationsausmaß 58 w 63 m 55 w 68 m 62 m 72 m 63 m 68 m 67 m 73 m 74 m 63 m 64 m 68 m 74 m 52 w 73 m 72 w 71 m 54 m 57 m 68 m 58 w 62 m 58 w 65 m 74 m 71 m 72 m 69 m 80 m 67 w 44 w 53 w 54 m 61 w 52 m 67 w 55 m 70 w 60 m 68 m 69 w 66 m Tumorstadium Alter des Patienten bei Diagnosestellung Geschlecht des Patienten nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein Raucher SP-A Reaktion Histologie Fallnummer 9 AD 14 AD 22 AD 27 AD 28 GZ 29 GZ 32 AD 36 AD 37 GZ 38 GZ 42 AD 43 AD 46 AD 50 GZ 51 GZ 52 GZ 54 GZ 55 AD 56 AD 58 AD 59 AD 60 GZ 61 AD 63 GZ 64 AD 71 AD 72 AD 73 AD 74 GZ 76 AD 77 AD 78 AD 83 AD 84 AD 85 AD 87 AD 90 GZ 93 GZ 94 GZ 95 AD 98 AD 99 GZ 102 AD 107 GZ nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein 76 m ja 111 GZ 112 AD 114 GZ 122 AD 123 GZ 125 GZ 126 GZ 128 AD 131 AD 134 AD 138 AD 139 AD 140 GZ 143 AD 144 AD 148 AD 152 AD 155 GZ 156 AD 157 AD 159 AD 162 GZ 164 AD 168 AD 169 AD 171 AD 176 AD 11 GZ 16 AD 20 AD 39 AD 40 AD 41 GZ 49 AD 62 AD 65 AD 69 GZ 82 AD 91 AD 92 GZ nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein ja ja ja ja ja ja ja ja ja ja ja ja ja 65 m 56 m 80 w 69 m 74 w 72 w 56 w 61 w 59 w 65 w 57 m 55 m 60 m 55 m 48 m 57 m 63 m 67 m 71 w 62 m 69 m 66 w 47 m 40 w 72 m 73 m 71 m 52 m 47 w 58 m 42 w 72 m 60 m 69 w 57 m 60 w 60 m 62 m 67 m 56 m ja ja ja ja ja ja ja ja ja ja k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. nein nein nein ja ja ja ja ja ja ja ja ja ja 3 2 2 2 2 1 1 2 2 2 1 2 4 2 3 1 2 2 2 2 2 2 4 2 1 3 3 3 2 2 1 3 2 3 2 2 2 2 2 2 00 00 20 00 10 10 00 00 00 10 10 00 00 00 20 00 00 00 20 20 01 00 01 00 10 11 20 11 00 31 20 10 10 20 20 00 00 00 10 20 2b 1b 3a 1b 2b 2a 1a 1b 1b 2b 2a 1b 3b 1b 3a 1a 1b 1b 3a 3a 4 1b 4 1b 2a 4 3a 4 1b 4 3a 3a 2b 3a 3a 1b 1b 1b 2b 3a Pneumonektomie OLRes.+Brustwandres. OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. UL-Res. OL-Res. Pneumonektomie OL-Res. Bilobektomie OL-Res. Pneumonektomie OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. UL-Res. UL-Res. OL-Res. OL-Res. UL-Res. OL-Res. OL-Res. Pneumonektomie UL-Res. UL-Res. UL-Res. OL-Res. OL-Res. OL-Res. Pneumonektomie OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. 90 am Tumor gestorben T N M 3 20 3a Überlebenszeit in Monaten Operationsausmaß Tumorstadium Raucher Geschlecht des Patienten Alter des Patienten bei Diagnosestellung SP-A Reaktion Histologie Fallnummer 110 GZ 16 nein 56 >60 8 >60 57 70 65 >60 >60 23 >60 >60 >60 62 0 >60 >60 >60 >60 61 >60 >60 11 >60 9 11 62 13 40 9 21 48 15 4 4 29 60 23 41 35 nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein nein 39 w 71 w 41 w 42 w 63 m 63 w 70 m 72 m 55 w 73 m 64 m 59 m 55 w 81 m 55 m 65 m 66 m 51 w 55 m 70 m 59 m 72 m 53 m 63 w 49 m 69 w 54 m 38 m 55 m 52 m 46 m 65 m 68 m 41 w 52 w 65 m 63 m 64 m 37 w 52 w 54 m 52 m ja ja ja ja ja ja ja k.A. k.A. k.A. k.A. k.A. nein nein nein nein nein nein nein nein nein ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja 4 3a 3a 3a 3a 4 3a 2b 4 2b 3a 3a 2b 2b 2b 1a 4 1b 3a 3a 1b 2b 4 3a 4 1b 3a 3a 3a 4 1a 4 3a 3a 1b 4 4 4 3a 1b 4 2b OL-Res. OL-Res. Bilobektomie ML-Res. OL-Res. OL-Res. UL-Res. OL-Res. UL-Res. OL-Res. OL-Res. OL-Res. Pneumonektomie UL-Res. UL-Res. OL-Res. Pneumonektomie OL-Res. Pneumonektomie OL-Res. UL-Res. OL-Res. OL-Res. OL-Res. Pneumonektomie OL-Res. Pneumonektomie Pneumonektomie Pneumonektomie Pneumonektomie OL-Res. OL-Res. OL-Res. OL-Res. OL-Res. UL-Res. Pneumonektomie Pneumonektomie OL-Res. Bilobektomie OL-Res. OL-Res. 91 13 58 10 53 7 11 18 55 17 29 11 7 19 4 11 3 34 29 40 3 39 18 17 17 15 4 16 1 11 8 51 7 4 19 9 51 14 10 18 38 23 60 am Tumor gestorben Überlebenszeit in Monaten Operationsausmaß T N M 4 01 3 10 2 20 1 20 2 20 3 01 2 20 2 10 2 11 2 10 2 20 2 20 2 10 2 10 3 00 1 00 2 11 2 00 2 20 3 20 2 00 2 10 2 01 3 10 2 21 2 00 3 10 2 20 3 10 3 11 1 00 2 01 3 20 2 20 2 00 3 01 2 21 2 01 1 20 2 00 3 01 2 10 Tumorstadium Raucher Geschlecht des Patienten Alter des Patienten bei Diagnosestellung SP-A Reaktion Histologie Fallnummer 96 GZ 100 AD 103 AD 117 AD 119 GZ 121 AD 133 AD 141 GZ 146 AD 147 AD 149 GZ 158 GZ 1 GZ 2 GZ 3 GZ 4 GZ 5 GZ 6 AD 10 GZ 18 AD 23 AD 24 GZ 26 AD 33 AD 34 AD 44 AD 53 AD 57 AD 66 GZ 68 GZ 75 GZ 80 AD 81 AD 86 GZ 89 GZ 104 GZ 105 GZ 106 AD 108 AD 109 AD 124 GZ 127 AD ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja ja nein nein 69 m 59 w ja k.A. 137 GZ 142 AD 150 GZ 153 AD 154 AD 160 AD 163 GZ 166 GZ 167 GZ 170 AD 174 GZ 177 GZ 178 GZ nein nein nein nein nein nein nein nein nein nein nein nein nein 58 w 58 m 56 m 65 m 63 m 70 m 64 m 65 w 60 m 61 m 74 m 52 m 59 m k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. k.A. 2 2 3 2 2 1 2 3 2 3 2 3 1 01 10 10 11 00 20 10 00 10 00 20 30 11 4 2b 3a 4 1b 3a 2b 2b 2b 2b 3a 3b 4 Pneumonektomie UL-Res. extrapleuraleTUAuslösung+OL-Res. OL-Res. OL-Res. Pneumonektomie Pneumonektomie Pneumonektomie OL-Res. OL-Res. OL-Res. OL-Res. Pneumonektomie Pneumonektomie ML-Res. 92 am Tumor gestorben T N M 3 00 2b 3 21 4 Überlebenszeit in Monaten Operationsausmaß Tumorstadium Raucher Geschlecht des Patienten Alter des Patienten bei Diagnosestellung SP-A Reaktion Histologie Fallnummer 132 GZ 135 GZ 45 10 ja ja 3 34 5 12 23 7 8 41 37 3 58 2 12 ja ja ja ja ja ja ja ja ja ja ja ja ja Danksagung Mein Dank gilt folgenden Personen: Prof. Dr. med. J. Guzman y Rotaeche, Abteilung für Pathologie der Ruhr-Universität Bochum für die Überlassung des Themas und die gute Betreuung der Arbeit. Den Mitarbeitern des Institutes für Pathologie der Ruhr-Universität Bochum für die gute Zusammenarbeit bei der Durchführung der Studie. Herrn Prof. Dr. med. U. Costabel und den Mitarbeitern der Abteilung für Pneumologie uns Allergologie der Ruhrlandklinik Essen für die freundliche Unterstützung. Herrn Dipl. Stat. Herrn Holland-Letz aus der Abteilung für Med. Informatik, Biometrie und Epidemiologie der Ruhr-Universität Bochum für Beratung bei statistischen Fragen. 93 Lebenslauf Name: Tina Bellgardt geb. Stümpel Geburtsdatum: 22. August 1976 Geburtsort: Herne Eltern: Jürgen Stümpel, Dipl. Ing. Annette Stümpel, geb. Mertens, Lehrerin Schulbildung: 1983 – 1987 Grundschule an der Düngelstr., Herne 1987 – 1996 Haranni-Gymnasium, Herne 1996 Allgemeine Hochschulreife Ausbildung: 1996 – 1999 Ausbildung zur Krankenschwester 1999 Staatliche Prüfung in der Krankenpflege und Erlaubnis zur Führung der Berufsbezeichnung „Krankenschwester“ Studium: 1999 – 2005 Studium der Humanmedizin, Ruhr-Universität Bochum Ärztliche Vorprüfung: August /September 2001 1.Staatsexamen: August 2002 2. Staatsexamen 2004 3. Staatsexamen 2005 Berufliche Tätigkeit als Ärztin Seit 12/2005 Assistenzärztin in der Abteilung für Innere Medizin des Katholischen Krankenhauses Dortmund West Veröffentlichungen E. Uzaslan, T. Stuempel, M. Ebsen, N. Freudenberg, S. Nakamura, U. Costabel, J. Guzman Surfactant Protein A Detection in Primary Pulmonary Adenocarcinoma without Bronchioloalveolar Pattern Respiration 2005 May-Jun; 72(3):249-53. E. Uzaslan, T. Stuempel, N. Freudenberg, S. Nakamura, U. Costabel, J. Guzman Surfactant Protein A (SP-A) Detection in Large Cell Carcinoma of the Lung Appl Immunhistochem Mol Morphol. 2006 Mar; 14(1):88-90. 94 Wissenschaftliche Vorträge Posterpräsentation IAP Asia Pacific Meeting 2003 T.Stuempel, U.Costabel, W.Bartsch, I.Binkhoff, J.Guzman Surfactant Protein-A (SP-A) Detection in non-ciliated Epithelium of Chondrohamartoma of the Lung Posterpräsentation USCAP 2003 T.Stuempel, U.Costabel, W.Bartsch, J.Guzman Surfactant Protein-A (SP-A) Detection in Large Cell Carcinoma of the Lung Posterpräsentation ATS 2003 T.Stuempel, U.Costabel, W.Bartsch, J.Guzman Surfactant Protein-A (SP-A) Detection in Primary Pulmonary Adenocarcinoma withoutbronchioloalveoläre Pattern 95