Mikrobio 2
Werbung

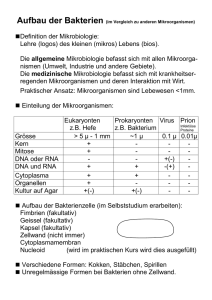
Periplasmaraum Mikrokapillarer Spalt zwischen Membran und Zellwand Æ Enzyme zum Nahrungsaufschluss Æ ß-Lactamasen Æ Bindeproteine für Zucker, Aminosäuren, anorganische Ionen Æ Nukleasen Die äußere Hülle der Bakterienzelle Schrittweise Entfernung der Zellwand (E. coli / Phenol) Murein enthält: Muraminsäure, D-Aminosäuren Zellwand - Mureinsacculus Querschnitte von Bakterienzellwänden Gramnegativ Grampositiv Gramfärbung Gram-negative Zelle (dünne Zellwand) Gegenfärbung mit Safranin oder Fuchsin Gram-positive Zelle (dicke Zellwand) Zytoplasmamembran Zytoplasma Periplasmatischer Spaltraum Zellwand KristallviolettJod-Komplex im Periplasmaraum Gramnegativ Simonsiella Grampositiv Listeria Murein Wandreste Lysozym, Penicilline Sphäroplast Instabile L-Form Stabile L-Form nackter Protoplast Entstehung der wandlosen Formen Mycoplasmen Zellwandlose Bakterien Kolonien auf Agar von Mycoplasma + Ureaplasma Strukturen außerhalb der Bakterienzellwand Lipoteichonsäuren bei Gram-positiven Bakterien Besonderheiten bei Gram-negativen: Äußere Membran mit Porinen (Transportkanäle) Lipopolysaccharid (LPS, Pyrogen) bei Gram-negativen Bakterien Lipoid A Kernregion O-Antigen Kapseln und Schleime Kapseln von Pneumokokken Sporenbildung bei Gram-positiven Bakterien der Gattungen Bacillus und Clostridium Eigenschaften die mit der Sporenbildung einhergehen: Thermoresistenz Abtöten gelingt erst bei Anwendung von • Überspanntem Wasserdampf 120°C/ 20 Minuten • Trockener Hitze 180°C/30 Minuten • Formaldehyd 1%/30 Minuten Clostridium Sporen (Trommelschlegelform) und Kapseln (Tuscheausstrich) Fragmentationssporen Fimbrien Geißeln und Fimbrien Stoffwechsel-Physiologie Einteilung der Organismen nach der Kohlenstoffquelle für Biosynthesen und Energiegewinnung Chemoorganotroph < CH2O>n + nO2 nH2O ATP, Energie + nCO2 Einteilung der Organismen nach der Kohlenstoffquelle für Biosynthesen und Energiegewinnung Photolithotroph nH2O + nCO2 hν <CH2O>n + nO2 Einteilung der Organismen nach der Kohlenstoffquelle für Biosynthesen und Energiegewinnung Photoorganotroph nH2A + nCO2 hν <CH2O>n + nAO Einteilung der Organismen nach der Kohlenstoffquelle für Biosynthesen und Energiegewinnung Chemolithotroph ½ O2 + H2 H2O + “Biologische Knallgasreaktion” Energie Einteilung der Organismen nach der Kohlenstoffquelle für Biosynthesen und Energiegewinnung C-Assimilation Energiegewinnung Prokaryonten Eukaryonten Heterotroph Chemo-organotroph Bakterien Photo-organotroph Bakterien Pilze, Tiere - Autotroph Chemo-lithotroph Photo-lithotroph Grüne Pflanzen Bakterien Cyanobakterien Die Züchtung von Bakterien in künstlichen Kulturmedien Louis Pasteur Bio-Elemente • Makro-Elemente C, O, H, N, S, P, K, Ca, Mg, Fe • Spurenelemente Mn, Mo, Zn, Cu, Co, Ni, Va, B, Si, Se, u.a. Wachstumsfaktoren (Suppline) Biotin Nicotinsäure Thiamin p-Aminobenzoesäure Pantothensäure Pyridoxamin Cyanocobalmin Kultivierung chemo-organotropher Mikroorganismen Grundvoraussetzung: > 20% Wassergehalt Kultivierung chemo-organotropher Mikroorganismen • Energie- und Kohlestoffquelle Komplexe Substrate Malzextrakt Pepton Milch Serum Fruchtsäfte u.a.m. Kultivierung chemo-organotropher Mikroorganismen • Mineralien einschließlich Spurenelemente Bio-Elemente • Makro-Elemente S, P, K, Ca, Mg, Fe • Spurenelemente Mn, Mo, Zn, Cu, Co, Ni, Va, B, Si, Se, u.a. Kultivierung chemo-organotropher Mikroorganismen • N-Quelle Ammonium-Ion Nitrat Nitrit N2 Bei parasitierenden Mikroorganismen oft Bedürfnis für organisch gebundenen N: Aminosäuren Kultivierung chemo-organotropher Mikroorganismen • N-Quelle Wildtypisch Verwertung von Anorganischem N Æ Mutation zur Bedürftigkeit von organisch gebundenem N: N-Prototrophie Umgekehrt: N-Auxotrophie Kultivierung chemo-organotropher Mikroorganismen • Osmolarität Hohe Osmolarität, geringe Wasseraktivität Î Normalerweise keine Vermehrung • Osmophilie • Xerophilie • Halophilie Ö Konservierungsverfahren Fruchtgelees durch Rohrzucker Einsalzen von Fleisch/Fisch Kultivierung chemo-organotropher Mikroorganismen • Osmolarität Extrem halophile Formen im Meerwasser: Halobacterium 30% NaCl-Bedarf Mäßig halophile Meeresbakterien ca. 1%-3% Kultivierung chemo-organotropher Mikroorganismen • Wasserstoffionenkonzentration (pH-Wert) In Frage kommen pH 1 - 14 Mikroorganismen in Extrembereichen: Acidophile Bakterien Alkalophile Bakterien Meistens: ca. pH 7 Optimum Kultivierung chemo-organotropher Mikroorganismen • Temperatur Psychrophil < 1°C bis -10°C Mesophil 15°C bis 45°C Thermophil > 45°C Kultivierung chemo-organotropher Mikroorganismen • Kultur-Atmosphäre Pasteur: * Leben mit und ohne O2 möglich * Dogma der Urzeugung falsch Aerob Anaerob Mikroaerophil – Reduzierte O2-Spannung Capnophil – Erhöhter CO2-Gehalt Kultivierung chemo-organotropher Mikroorganismen • Wachstumsfaktoren Vitamine/Suppline * Biotin, Nicotinsäure, Cyancobalamin, Vitamin K * Hämatin, NAD, Cholesterin, Aminosäuren, Oligopeptide etc. Kultivierung chemo-organotropher Mikroorganismen • Inhibitoren Insbesondere bei anspruchsvollen Mikroorganismen: Beseitigung organischer + anorganischer Hemmstoffe z.B. Peroxide, langkettige Fettsäuren Kultivierung chemo-organotropher Mikroorganismen • (Hydrostatischer Druck) Tiefsee-Mikroflora: Barophilie Æ 500-1000 Atmosphären Druck Kultivierung chemo-organotropher Mikroorganismen • Mineralien einschließlich Spurenelemente • N-Quelle • Energie- und Kohlestoffquelle • Osmolarität • pH • Temperatur • Atmosphäre • Wachstumsfaktoren • Inhibitoren • (hydrostatischer Druck)